La mutación V600E de BRAF (protooncogén B-Raf) asocia mayor riesgo de persistencia y recidiva en el carcinoma papilar de tiroides, y puede modificar la cirugía o el seguimiento. Las tecnologías de biología molecular empleadas en su detección son caras y técnicamente demandantes. Recientemente se ha propuesto la evaluación inmunohistoquímica (IHQ), más sencilla y asequible, que permitiría universalizar su evaluación.
ObjetivoComparar los resultados y el coste económico del estudio IHQ frente a la PCR en tiempo real (RT_PCR) para la detección de BRAF V600E en los carcinomas papilares de tiroides. Se incluyó el análisis de las diferencias clínico-patológicas según el resultado por RT_PCR.
MétodosEstudio prospectivo sobre 82 muestras consecutivas, 54 de ellas biopsias con aguja gruesa. El estudio IHQ se realizó con el anticuerpo monoclonal murino VE-1, y fue categorizado como positivo o negativo. La detección mediante RT_PCR se realizó con la prueba diagnóstica Cobas® 4800 (Roche) sobre ADN extraído del tejido fijado por microdisección manual.
ResultadosAmbas técnicas fueron concordantes en 81 casos (98,8%), con un resultado discordante, positivo en la IHQ y negativo en la RT_PCR, atribuido a heterogeneidad histológica. Solo en gasto de material diagnóstico, la IHQ logra un ahorro superior al 50% frente a la técnica molecular.
ConclusionesLa detección IHQ de la mutación BRAF V600E presenta una elevada fiabilidad, sin falsos negativos, en muestras adecuadamente procesadas. Su empleo permite abaratar costes y generalizar su empleo, especialmente en centros sin acceso rutinario a técnicas de biología molecular.
The BRAF V600E mutation is the most common genetic change in papillary thyroid carcinoma and is associated with a poorer clinical course. Usual methods for its study (DNA sequencing or molecular test based on PCR) are expensive and time-consuming. Recently, immunohistochemistry (IHC) for BRAF mutation has been introduced.
ObjectiveTo compare the results of IHC and real time PCR (RT-PCR) in the detection of BRAF V600E mutation in papillary thyroid carcinoma. Analysis of clinical and pathological differences depending on RT-PCR results is included.
MethodsA prospective study was performed in 82 consecutive samples, 54 of them taken through a core needle biopsy. IHC was performed on tissue fixed for 24hours with 10% neutral formalin using the anti-BRAF V600E (VE-1) mouse monoclonal primary antibody and was rated as positive or negative. DNA was extracted from formalin-fixed, paraffin-embedded tissues by manual microdissection, and BRAF mutation was detected by RT-PCR using the Cobas® 4800 BRAF V600 mutation test (Roche).
ResultsBoth techniques were concordant in 81 cases, and BRAF was positive in 49. Discordance appeared in a follicular variant showing positive IHC and negative RT-PCR, attributed to histological heterogeneity. Cost of materials for IHC was less than half of the cost for RT-PCR.
ConclusionsIHC appears to be a reliable, economical and easily available alternative to molecular biology techniques for routine detection of the BRAF V600E mutation in papillary thyroid carcinoma patients, provided optimal fixation conditions are used. It may be a useful technique in hospitals with no access to molecular biology techniques.
La mutación V600E de BRAF (protooncogén B-Raf) es la alteración genética presente con mayor frecuencia en el carcinoma papilar de tiroides (CPT), alcanzando una prevalencia del 29 al 83% según las diferentes poblaciones1. Numerosos estudios han demostrado su asociación con características clínico-patológicas agresivas2, así como con una mayor recurrencia de la enfermedad3. Debido a esta asociación, su presencia ha sido considerada como un potencial marcador pronóstico en el CPT, y se ha incluido como un indicador de riesgo adicional en determinados subtipos de neoplasias en las recientes guías de la American Thyroid Association4. Su detección preoperatoria también ha sido empleada para establecer el diagnóstico de carcinoma papilar en muestras citológicas indeterminadas5.
Para identificar la mutación se han desarrollado varios métodos moleculares. Los dos más empleados son los que siguen. El primero consiste en la secuenciación directa del ADN amplificado por reacción en cadena de la polimerasa (PCR) por el método Sanger, que aprovecha el análisis de los diferentes fragmentos de ADN complementario generados por la incorporación de dideoxinucleótidos que detienen la replicación de la cadena. Una variante comúnmente empleada es la pirosecuenciación, basada en la detección de la liberación del pirofosfato tras la incorporación de nucleótidos.
El segundo de los métodos es el que se basa en la PCR específica de alelos. La más utilizada para la identificación de biomarcadores moleculares en tumores es la PCR en tiempo real (RT_PCR)6,7. Esta técnica destaca por su alta sensibilidad, (detecta la mutación con menos de un 10% de células tumorales en la muestra), reproducibilidad y capacidad de automatización. Existen 2 tipos de sondas para la determinación de mutaciones en BRAF, denominadas TaqMan® y Scorpions®. La prueba diagnóstica cobas®4800 (Roche), diseñada para determinar la mutación V600E, utiliza la sonda TaqMan® y está aprobada por la Food and Drug Administration como prueba diagnóstica in vitro. La sonda Scorpions® se utiliza con la prueba BRAF gen rotor Q de Qiagen®. La RT_PCR tiene un elevado coste económico y, al desarrollarse en varios pasos sucesivos, requiere mucho trabajo y un elevado consumo de tiempo. Por esta razón, su disponibilidad es limitada.
Recientemente, se ha desarrollado un anticuerpo específico para la mutación que permite la visualización inmunohistoquímica (IHQ) de la proteína mutada con elevada sensibilidad y especificidad (clon VE-1). El VE-1 es un anticuerpo monoclonal de ratón, que ha demostrado fiabilidad en varios tejidos tumorales, incluyendo el cáncer de tiroides8 y el melanoma9. Su precisión diagnóstica se ha evaluado en varios trabajos, frecuentemente sobre muestras tisulares almacenadas, y hay discrepancia sobre la lectura de la intensidad de la tinción10. Esta técnica resulta más barata y rápida, por lo que se postula como un método preciso y asequible de primera línea, aunque algunos autores defienden que en caso de negatividad de IHC se debiera realizar el estudio molecular11.
El objetivo de este trabajo fue evaluar los resultados de la detección de la presencia de la mutación BRAF V600E mediante IHQ frente a la PCR en tiempo real con la prueba cobas®4800 en una serie de pacientes con diagnóstico histológico de CPT. Trabajos previos realizados apuntan a una elevada tasa de concordancia entre ambas técnicas12, y su validación confirmaría la IHQ, más asequible y menos laboriosa, como prueba de despistaje para la presencia de la mutación V600E en el CPT, en analogía con el empleo de la IHQ en la selección del tejido para estudio molecular en los tumores cromafines13. Como objetivo secundario, se analizaron las diferencias en las características clínicas y patológicas entre los tumores portadores de la mutación y los que no la portaban, relevante por la escasez de publicaciones al respecto en nuestro entorno. Para este análisis se considera el resultado de la evaluación por RT_PCR, al ser esta la prueba de referencia para la detección de la mutación.
Material y métodosSe realizó un estudio prospectivo en 79 pacientes diagnosticados de carcinoma papilar de tiroides en el periodo de noviembre de 2014 a mayo de 2016. Las muestras de tejido tumoral analizadas procedían inicialmente del material obtenido en la intervención quirúrgica, y a partir de marzo de 2015, los estudios se realizaron sobre muestras obtenidas por biopsia con aguja gruesa, salvo en los casos de carcinomas incidentales sin diagnóstico prequirúrgico. Todos los pacientes dieron su consentimiento para el estudio, y este fue autorizado por el comité ético de nuestro centro.
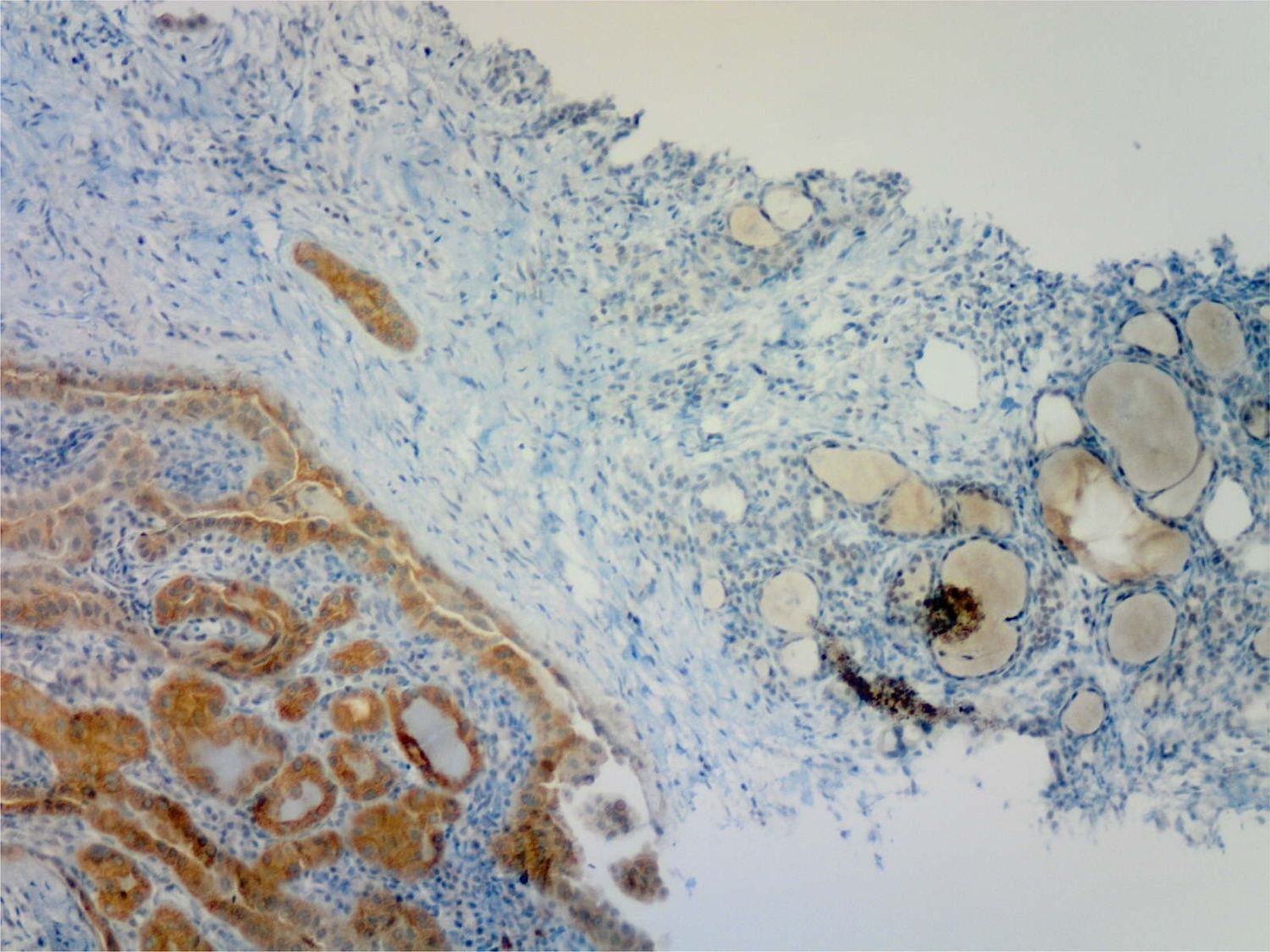
El estudio inmunohistoquímico se realizó sobre tejido fijado durante 24 h con formalina neutra al 10%, y empleando el anticuerpo monoclonal murino anti-BRAF V600E (VE-1), generado a partir del sobrenadante de un cultivo celular purificado, con una concentración de anticuerpo de 12μg/ml. La IHQ se realizaba sobre la plataforma Benchmark XT (Ventana Medical Systems), y la visualización específica de la proteína BRAF con el kit de detección Optiview DAB IHC (Ventana Medical Systems). Se emplearon especímenes validados de CPT portadores de la mutación y no mutados como controles positivos y negativos respectivamente. El proceso completo, incluido el desenmascaramiento del antígeno (cell conditioning), la incubación con el anticuerpo primario a 37°C, y la contratinción con hematoxilina-eosina previos a la valoración de la preparación por el patólogo suponen menos de seis h (5 h y 46 minutos), lo que permite emitir un informe conjunto con el de la anatomía patológica. La imagen de IHQ era interpretada como positiva o negativa por el patólogo antes de conocer el informe del biólogo molecular. Se consideraba positiva la muestra en presencia de inmunotinción citoplasmática difusa, con tres grados posibles: leve, moderada o franca, y cualquiera de ellos era informado como IHQ positiva.
Previa selección por el patólogo del área de interés, orientado por la zona de tumor con mayor intensidad del marcaje inmunohistoquímico, se tomaba un fragmento del bloque de parafina con ayuda de una jeringa («punch»). El proceso continuaba con el desparafinado de la muestra (34 minutos), y la posterior digestión enzimática durante una noche. Al día siguiente, la muestra se incubaba a 90°C durante una hora para inactivar los enzimas y extraer el ADN, cuya posterior purificación requería otros 85 minutos. Tras realizar su cuantificación por espectrofotometría, se analizaba una muestra diluida de ADN (5ng/μl) mediante RT_PCR (real time PCR) con el sistema cobas 4800BRAF/V600, específico para dicha mutación, en un proceso que ocupaba 90 minutos adicionales, en los que se realizaban todos los ciclos de reacción e hibridación y permitía obtener el informe automatizado. Esta técnica se basa en la transferencia de energía de resonancia fluorescente tras un protocolo de varios ciclos de amplificación y templado a diversas temperaturas y duraciones del exón 15 del BRAF (7), que contiene el codón 600, con la sonda TaqMan®. La sonda contiene un oligonucleótido específico de la mutación V600E y otro en su forma no mutada (salvaje) que hibridan con el ADN complementario generado en los ciclos de PCR. El sistema realiza un análisis automatizado de la curva de desnaturalización, ya que los productos de PCR de diferente longitud y secuencia, dependiendo del oligonucleótido hibridado, se desnaturalizan a temperaturas diferentes dando picos característicos de cada secuencia. El software cobas®4800BRAF/V600 (Roche) analiza estos picos y conforma un informe estandarizado sobre la presencia de la mutación (positivo/negativo) acorde a las instrucciones de manual del producto que es validado por el biólogo molecular. Todo este proceso supone casi dos jornadas laborales completas para el resultado.
Para el cálculo del coste económico de cada una de las técnicas se empleó el valor de adquisición de los reactivos y material imprescindibles para ambas pruebas, sin incluir el tiempo, el material fungible, ni el personal requerido para ambas, al considerarlas prácticas de diagnóstico rutinarias. Para el estudio de la mutación mediante RT-PCR, el coste de 24 pruebas diagnósticas cobas®4800BRAF/V600 (Roche), con la sonda TaqMan® era de 1.973,27 € (82,2 € cada una). El coste de 50 anticuerpos monoclonales anti-BRAF V600E para IHQ era de 1.389 €, (27,28€ cada uno), y 250 kits de detección tenían un coste total de 2.785 € (11,03€ cada uno), resultando un total de 38,81 € por cada estudio IHQ completo.
Se evaluaron las diferencias clínicas y patológicas entre los pacientes y tumores portadores de la mutación BRAF V600E y los que no la tenían (WT) por RT_PCR, considerada la prueba de referencia. Utilizamos la comparación de medias mediante t de Student en las tres variables cuantitativas analizadas, ya que todas presentaban una distribución normal (edad, tamaño tumoral enmm y concentración de TSH preoperatoria). Las variables cualitativas analizadas incluyeron: distribución por sexos, presencia de extensión extratiroidea, hallazgo incidental del tumor, presencia de multifocalidad (más de un foco tumoral en el tiroides resecado), presencia de afectación ganglionar clínica o patológica (en el caso de incluir disección ganglionar) y variante del CPT, dividida en clásica, folicular o mixta de ambas. Para la comparación de estas variables utilizamos Chi-cuadrado o el estadístico exacto de Fisher cuando uno de los parámetros incluía menos de 5 casos. La sensibilidad, especificidad, valor predictivo positivo, y valor predictivo negativo de la técnica de IHQ se calcularon considerando como verdaderos positivos los tumores portadores de la mutación por IHQ y RT-PCR, verdaderos negativos los tumores WT con ambas técnicas, falsos positivos los considerados mutados con IHQ y WT con RT-PCR, y falsos negativos los que no mostraban positividad con IHQ y eran portadores de la mutación en el análisis por la técnica molecular. Se calculó el índice kappa para valorar la concordancia de ambas técnicas en la detección de la mutación. Para los cálculos estadísticos se empleó software SPSS V.20 (SPSS, Chicago, EE. UU.).
ResultadosInicialmente, se incluyeron en el estudio 84 muestras, pero 2 fueron descartadas, una por la escasez de tejido disponible para obtener ADN, y otra por la mala calidad de la preparación histológica que limitaba la interpretación de la IHQ. En total se analizaron 82 muestras procedentes de 79 pacientes con CPT, de 12 a 82 años de edad (media: 51), 17 de ellos varones. Dos muestras procedían del mismo paciente, con sendos focos tumorales bien diferenciados, uno en cada lóbulo, y otras 2 de adenopatías laterocervicales del nivel IV, procedentes de dos pacientes con muestra tumoral del tiroides también. El tamaño medio del foco tumoral tiroideo fue de 14,7mm (rango: 4-55mm), con una mediana de 12mm. De las 79 glándulas evaluadas, 46 contenían tumores con un único foco, y las restantes 33 (42%) contenían entre 2 y 8 focos tumorales (multifocales), afectando a ambos lóbulos en 23 de los casos. Dieciocho de los CPT presentaban extensión extratiroidea, microscópica en todos los casos, y el resto (61) estaban limitados al tiroides.
Cincuenta y cuatro de los estudios se realizaron sobre muestras de tiroides obtenidas mediante biopsias automatizadas con aguja gruesa de calibre 18G, así como las de ambas adenopatías. Trece CPT, de 4 a 10mm, habían sido encontrados de forma incidental en el estudio patológico de tiroidectomías llevadas a cabo por tamaño (7), hipertiroidismo (3), voluntad del paciente (2), o biopsia de neoplasia folicular en un nódulo adyacente con resultado benigno tras la cirugía (1). Los 13 CPT incidentales fueron intratiroideos, uno con dos focos en el mismo lóbulo y otro con 4 focos repartidos en ambos lóbulos.
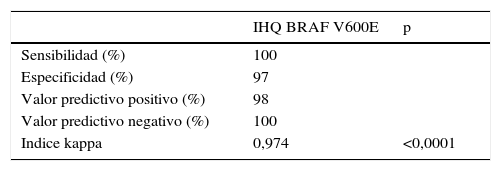
En global, una muestra de las 82 mostró discordancia entre las dos técnicas de detección, con un valor predictivo negativo de la IHQ del 100% en nuestro caso. La concordancia de ambas pruebas alcanzó el 98,8%, con una tasa de discordancia del 1,2%. En la tabla 1 se muestran los valores estadísticos de valoración de la técnica IHQ frente a la técnica de referencia (RT_PCR).
Comparación de los resultados del estudio mediante inmunoistoquímica (IHQ) respecto a la prueba de referencia (RT_PCR) en las 82 muestras estudiadas
| IHQ BRAF V600E | p | |
|---|---|---|
| Sensibilidad (%) | 100 | |
| Especificidad (%) | 97 | |
| Valor predictivo positivo (%) | 98 | |
| Valor predictivo negativo (%) | 100 | |
| Indice kappa | 0,974 | <0,0001 |
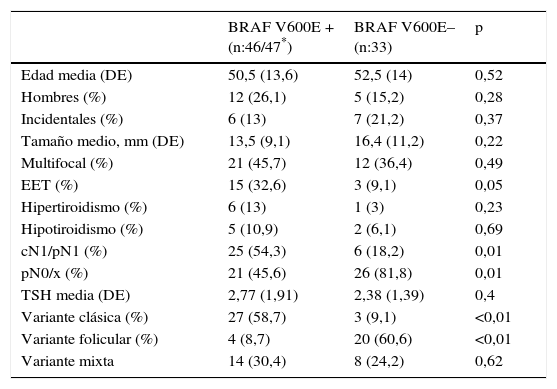
De las 80 muestras tomadas en tejido tiroideo, 47 resultaron positivas por RT_PCR y 33 negativas. Las características de los pacientes, divididos por el resultado obtenido mediante RT_PCR, se muestran en la tabla 2. La afectación ganglionar, clínica o patológica, y la incidencia de la variante clásica del CPT se asociaron de forma significativa con la presencia de la mutación BRAF V600E mediante RT_PCR.
Características de los 79 pacientes del estudio divididos por la presencia de la mutación por RT_PCR
| BRAF V600E + (n:46/47*) | BRAF V600E– (n:33) | p | |
|---|---|---|---|
| Edad media (DE) | 50,5 (13,6) | 52,5 (14) | 0,52 |
| Hombres (%) | 12 (26,1) | 5 (15,2) | 0,28 |
| Incidentales (%) | 6 (13) | 7 (21,2) | 0,37 |
| Tamaño medio, mm (DE) | 13,5 (9,1) | 16,4 (11,2) | 0,22 |
| Multifocal (%) | 21 (45,7) | 12 (36,4) | 0,49 |
| EET (%) | 15 (32,6) | 3 (9,1) | 0,05 |
| Hipertiroidismo (%) | 6 (13) | 1 (3) | 0,23 |
| Hipotiroidismo (%) | 5 (10,9) | 2 (6,1) | 0,69 |
| cN1/pN1 (%) | 25 (54,3) | 6 (18,2) | 0,01 |
| pN0/x (%) | 21 (45,6) | 26 (81,8) | 0,01 |
| TSH media (DE) | 2,77 (1,91) | 2,38 (1,39) | 0,4 |
| Variante clásica (%) | 27 (58,7) | 3 (9,1) | <0,01 |
| Variante folicular (%) | 4 (8,7) | 20 (60,6) | <0,01 |
| Variante mixta | 14 (30,4) | 8 (24,2) | 0,62 |
cN/pN: afectación ganglionar clínica (ecográfica o intraquirúrgica)/patológica (en examen microscópico); DE: desviación estándar; EET: extensión extratiroidea; N0: ausencia de afectación; N1: afectación positiva; pNx: ganglios no analizados.
Las 47 muestras positivas por RT_PCR habían sido informadas por el patólogo previamente como positivas mediante IHQ en todos los casos (fig. 1). De las 33 muestras tiroideas sin mutación V600E en BRAF por RT_PCR, una fue informada como positiva (moderada) en la IHQ, un carcinoma papilar incidental de 5mm con predominio de variante folicular no encapsulada y áreas puntuales de patrón clásico, unifocal e intratiroideo, adyacente a un adenoma folicular en una mujer de 38 años. Esta inmunotinción positiva se confirmó tras la revisión de la muestra por el patólogo, que también confirmó que la muestra para estudio genético había sido correctamente tomada del área de tejido neoplásico maligno con más densidad de señal en la IHQ.
Los dos ganglios metastásicos analizados fueron positivos por RT_PCR e IHQ. Paradójicamente, en uno de los pacientes el tumor primario tiroideo resultó negativo mediante ambas técnicas, IHQ y RT-PCR. En el paciente con dos focos de CPT independientes analizados, uno en cada lóbulo, ambos fueron positivos por ambas técnicas.
El gasto económico, limitado al coste del material específico para la prueba, de los 82 estudios de RT_PCR en los 18 meses del estudio alcanzó los 6.740€, frente a los 3.182€ de los materiales para la evaluación IHQ. Los resultados de la IHQ fueron recibidos simultáneamente con el informe patológico, mientras que el análisis molecular mediante RT_PCR se recibió al cabo de uno o varios días del informe patológico.
DiscusiónLa mutación V600E de BRAF no se presenta en lesiones tiroideas benignas, y por este motivo ha sido propuesta para la mejor filiación de muestras citológicas indeterminadas obtenidas por punción-aspiración con aguja fina14. Su presencia condiciona una activación constitutiva de la vía señalizada con quinasas MAP (mitogen-activated protein), lo que provoca un aumento de la proliferación celular y resistencia a la apoptosis. Está demostrada su asociación a predictores de agresividad tumoral en los CPT, fundamentalmente extensión extratiroidea y afectación ganglionar, y un riesgo incrementado de recurrencia, aunque no de mortalidad3. Asimismo, la mutación reduce la sensibilidad tumoral al radioyodo a través de la translocación del NIS (Na/I symporter) desde la membrana al citoplasma, impidiendo la entrada del isótopo en la célula maligna15. La mutación también se ha demostrado como una potencial diana terapéutica para los fármacos inhibidores de BRAF16, a semejanza de los tratamientos con vemurafenib en el melanoma maligno. Esta relevancia diagnóstica y terapéutica hacen que su detección, idealmente preoperatoria, tenga un gran interés, pero la complejidad y el coste económico de las técnicas moleculares, además de la necesaria disponibilidad de un laboratorio de biología molecular, son factores limitantes para muchos centros donde se trata esta patología.
La frecuencia de la mutación en nuestro entorno ha sido reflejada en escasas publicaciones5,15, y se sitúa en torno al 50%. En esta muestra de 79 pacientes, 46 (58,2%) fueron portadores de la mutación cuando se analizaron por RT_PCR, una frecuencia discretamente superior. El análisis de las características de estos pacientes confirma también en nuestro entorno una asociación significativa con la presencia de metástasis ganglionares y la variante clásica del carcinoma papilar. Además, y en consonancia con lo publicado en otros países, se evidencia una tendencia a detectarse en tumores de menor tamaño y con mayor frecuencia de extensión extratiroidea, lo que apoya su mayor agresividad biológica.
La técnica de IHQ ha validado su utilidad como marcador de la presencia de mutaciones en el gen de la enzima succinatodeshidrogenasa (SDH) en tumores cromafines, de modo que la evaluación molecular para mutaciones germinales en cualquiera de los diversos genes SDH solo está indicada en pacientes con tumores negativos al marcaje IHQ con SHDB. Inversamente, su expresión y positividad IHQ ahorra la necesidad de evaluar estos genes, al ser incompatible con mutaciones17. Además, una tinción negativa para SDHA permite dirigir el estudio específicamente a este gen.
El desarrollo de un anticuerpo monoclonal (VE-1) de origen murino ha permitido la evaluación IHQ para la mutación BRAF V600E en los CPT, y otros tumores con este alelo mutado, principalmente melanomas y carcinomas colorrectales18. Varias publicaciones recientes encuentran una buena correlación de la IHQ con el resultado del análisis del ADN por diversas técnicas moleculares12,18–20. La técnica IHQ tiene limitaciones derivadas del preanalítico, ya que, como ocurrió en uno de nuestros casos, la calidad de la muestra en ocasiones no permite un veredicto definitivo. Para limitar este aspecto, se recomienda la fijación en dos horas tras la obtención de la muestra y su cuidadoso procesamiento18. Otra limitación deriva de la subjetividad de la interpretación, y muchas publicaciones distinguen diferentes grados de positividad. En este trabajo, al realizar el estudio de manera prospectiva y previa al análisis del DNA, se estableció solo una categoría dicotómica positiva/negativa en la IHQ, a criterio del patólogo. Merece reseñarse la posibilidad de hacer el estudio en muestras obtenidas mediante biopsia con aguja gruesa, ya publicada previamente por otros grupos21.22. Esta técnica permite disponer de un material de calidad y cantidad superior al de los aspirados citológicos, donde también se ha empleado el marcaje inmunocitoquímico para BRAFV600E23.
Al analizar los estudios publicados desde hace 3 años con diversas técnicas de análisis molecular10,11,19 destaca un metanálisis24 de 11 estudios, con muestras citológicas en 2, que incluía 1.141 pacientes y diversas técnicas de análisis del ADN. En este metanálisis se obtenía una alta tasa de concordancia entre la evaluación IHQ y del ADN, especialmente cuando la IHQ era positiva (92,1%). Se encontraba una mayor discordancia en muestras con IHQ negativa (falsos negativos de la IHQ) y la justificaban por el empleo de muestras histológicas antiguas de baja calidad, previamente congeladas o descalcificadas. En el presente estudio no se produjeron falsos negativos de la IHQ, ya que la única muestra de dudosa calidad fue descartada y todo el tejido estudiado había sido fijado unas horas antes. Otras posibles causas de falsos negativos de la IHQ son la pérdida de la expresión del antígeno mutado, descrito en áreas tumorales con necrosis25, y la presencia de mutaciones adicionales que impidan la traslación del ARN mensajero mutado en una proteína funcional.
El resultado obtenido en este estudio coincide con el de Zhu et al. con secuenciación Sanger26 al encontrar una sensibilidad para la IHQ del 100%, aunque con menor especificidad (82,2%) en su publicación. Esta menor especificidad posiblemente se deba a que se trata de un estudio sobre muestras fijadas años atrás y por el empleo de la secuenciación Sanger, menos sensible a porcentajes bajos (<10%) de población tumoral portadora de la mutación. Los falsos positivos en la IHQ, el otro potencial origen de discordancia entre esta y las técnicas moleculares, se han descrito por la contaminación de la muestra con tejidos diferentes (mucosa sinusal o bronquiolos) con inmunorreactividad positiva27, descartada en este trabajo, o por un falso negativo de la RT_PCR. Esta posibilidad es menor que con la secuenciación Sanger, ya que detecta porcentajes de células mutadas inferiores al 5%, pero la presencia de la mutación en una proporción pequeña de células tumorales debida a la heterogeneidad génetica del tumor parece la explicación más plausible. El tumor discordante era un CPT con predominio de variante folicular, usualmente sin mutación BRAF, lo que sugiere la existencia dentro del tumor de un clon celular portador de la mutación no incluido en la toma del estudio molecular y responsable de la positividad en la IHQ. La heterogeneidad celular y génica del CPT se refleja en el paciente con dos focos tumorales discordantes en el análisis mutacional, un CPT variante folicular unifocal intratiroideo BRAF negativo con ambas técnicas, y una metástasis ganglionar de este tumor en el nivel ganglionar cervical IV, con la mutación evidente por ambas técnicas. Esta combinación apunta a la diseminación precoz de un clon celular portador de la mutación V600E, un evento precoz en la carcinogénesis del CPT28, no identificado en el tumor primario con ninguna de las dos técnicas, presumiblemente por su baja densidad celular. En estos casos, la aplicación de técnicas moleculares aún más sensibles, como el clamp cuantitativo de ácidos nucleicos (PNA-clamp qPCR), puede mejorar la sensibilidad para detectar la población mutada11.
La ausencia de falsos negativos de la IHQ cuando la muestra tisular tiene buena calidad, como en esta serie, reafirma la posibilidad de emplearla como técnica de despistaje, con un notable ahorro económico. Asimismo, el tiempo necesario para llevar a cabo la técnica es notablemente inferior al preciso para el estudio de biología molecular. Los recursos humanos para el estudio IHQ también son menores, al realizarse todo el estudio en el mismo departamento y sobre la muestra ya procesada para el estudio histológico convencional, mientras que la secuenciación requiere la participación del departamento de patología para obtener la muestra tumoral adecuada y del biólogo molecular para el estudio genético.
Una limitación evidente de este trabajo es el número de muestras estudiado, solo 82, todas ellas de óptima calidad, pero insuficiente para poder extraer conclusiones definitivas. La evaluación mediante un estudio más amplio, e idealmente multicéntrico, podría validar los resultados obtenidos en este estudio.
En conclusión, la IHQ para BRAF V600E se muestra como una técnica precisa al compararla con la RT_PCR para la identificación de la mutación BRAF V600E en los CPT, con un considerable ahorro de coste económico y laboral.
Conflicto de interesesTodos los autores declaran explícitamente no tener conflicto alguno de intereses con el contenido de este artículo o las técnicas empleadas en él.
A los técnicos de Anatomía Patológica por su colaboración en la preparación de las muestras.