El tratamiento de la diabetes tipo 2 (DM2) es complejo y su propósito es reducir la morbimortalidad, por lo que su manejo tiene que incluir: un control glucémico individualizado precoz (mediante una adecuada educación diabetológica, modificaciones del estilo de vida y tratamiento farmacológico), el control de los factores de riesgo cardiovascular (CV), la detección y tratamiento precoz de las complicaciones y la evaluación de las comorbilidades asociadas. El objetivo fue elaborar un documento para unificar los aspectos necesarios para el abordaje integral de las personas con DM2.
ParticipantesMiembros del Grupo de trabajo de Diabetes Mellitus de la Sociedad Española de Endocrinología y Nutrición.
MétodosSe realizó una revisión de la evidencia disponible relativa a cada aspecto del manejo de la diabetes: objetivos de control glucémico, dieta y ejercicio, tratamiento farmacológico, tratamiento y control de factores de riesgo, detección de complicaciones y manejo del paciente frágil con DM2. Las recomendaciones se formularon según los grados de evidencia recogidos en los Standards of Medical Care in Diabetes 2018. Tras la formulación de las recomendaciones el documento fue consensuado por los miembros del Grupo de trabajo de Diabetes Mellitus de la Sociedad Española de Endocrinología y Nutrición.
ConclusionesEl objetivo de este documento es proporcionar, desde el punto de vista del endocrinólogo clínico, unas recomendaciones prácticas basadas en la evidencia acerca de todos los aspectos necesarios para el abordaje integral de la DM2.
Treatment of type 2 diabetes mellitus (T2DM) is complex and is intended to decrease morbidity and mortality. Management should therefore include adequate diabetes education, lifestyle changes, drug treatment to achieve early blood glucose control and reduction of cardiovascular (CV) risk factors, early detection and treatment of complications, and assessment of associated comorbidities.
The objective was to prepare a document including all aspects required for a comprehensive approach to T2DM.
ParticipantsMembers of the Diabetes Mellitus Working Group of the Spanish Society of Endocrinology.
MethodsThe available evidence regarding each aspect of diabetes management (blood glucose control goals, diet and exercise, drug treatment, risk factor management and control, detection of complications, and management of frail patients) was reviewed. Recommendations were formulated based on the grades of evidence stated in the 2018 Standards of Medical Care in Diabetes. Recommendations were discussed and agreed by the working group members.
ConclusionsThis document is intended to provide evidence-based practical recommendations for comprehensive management of T2DM by clinical endocrinologists.
El manejo de la diabetes tipo 2 (DM2) es complejo y su propósito es reducir la morbimortalidad. Es preciso realizar un control glucémico individualizado, de forma precoz y sin hipoglucemias, mediante una adecuada educación diabetológica, modificaciones del estilo de vida y tratamiento farmacológico. Además, es necesario realizar un control global de los factores de riesgo cardiovascular (CV), y una correcta detección y tratamiento de las complicaciones asociadas a esta enfermedad, tanto las complicaciones clásicas microvasculares (retinopatía, nefropatía) como otras también importantes como el hígado graso no alcohólico (HGNA), la insuficiencia cardiaca o el síndrome de apnea hipopnea del sueño. En la elaboración de este documento nos planteamos realizar una aproximación distinta a la de las guías previas, intentando elaborar un documento práctico centrado en aspectos algo más novedosos, y en ocasiones controvertidos, del manejo y tratamiento de la diabetes tipo 2. Además, la disponibilidad de nuevas terapias para la diabetes permite una mejor individualización del tratamiento, en función de las características clínicas de cada paciente. En este contexto el Grupo de Trabajo de Diabetes Mellitus de la Sociedad Española de Endocrinología y Nutrición (SEEN) se propuso elaborar este documento para unificar los aspectos necesarios para el abordaje integral de la DM2, dirigido a todos los profesionales implicados en el tratamiento de la DM2.
El objetivo de este documento es proporcionar, desde el punto de vista del endocrinólogo clínico, unas recomendaciones prácticas basadas en la evidencia acerca de todos los aspectos necesarios para el abordaje integral de la DM2.
Material y métodosSe realizó una revisión de la evidencia disponible relativa a cada aspecto del manejo de la diabetes. Las recomendaciones se formularon de acuerdo a los grados de evidencia recogidos en los Standards of Medical Care in Diabetes 20181 (tabla 1). Tras la formulación de las recomendaciones el documento fue consensuado por los componentes del Grupo de Trabajo de Diabetes Mellitus de la SEEN. Las recomendaciones se colgaron en la Web de la SEEN (www.seen.es) el 5 de mayo de 2018 y están disponibles con acceso libre.
Grados de evidencia de las recomendaciones
| Nivel de evidencia | Descripción |
|---|---|
| A | Evidencia clara procedente de ensayos clínicos aleatorizados con potencia adecuada, incluyendo:Ensayos clínicos multicéntricosEnsayos clínicos realizados en una o más institucionesMetaanálisis que incorporen grados de calidad |
| B | Evidencia sustentada en estudios observacionales de calidad:Estudios prospectivos de cohortes o registrosMeta-análisis de estudios de cohortesEvidencia sustentada en estudios de casos y controles |
| C | Evidencia procedente de ensayos clínicos aleatorizados de baja calidad o no controlados:Ensayos clínicos aleatorizados con uno o más defectos metodológicos mayores, o 3 o más defectos metodológicos menores, que podrían invalidar los resultadosEstudios observacionales con alto riesgo de sesgos (como series de casos con comparación con controles históricos)Series de casosEvidencia contradictoria con el peso de la evidencia que respalda la recomendación |
| E | Consenso de expertos o experiencia clínica |
Fuente: adaptado de Standards of Medical Care in Diabetes-20181.
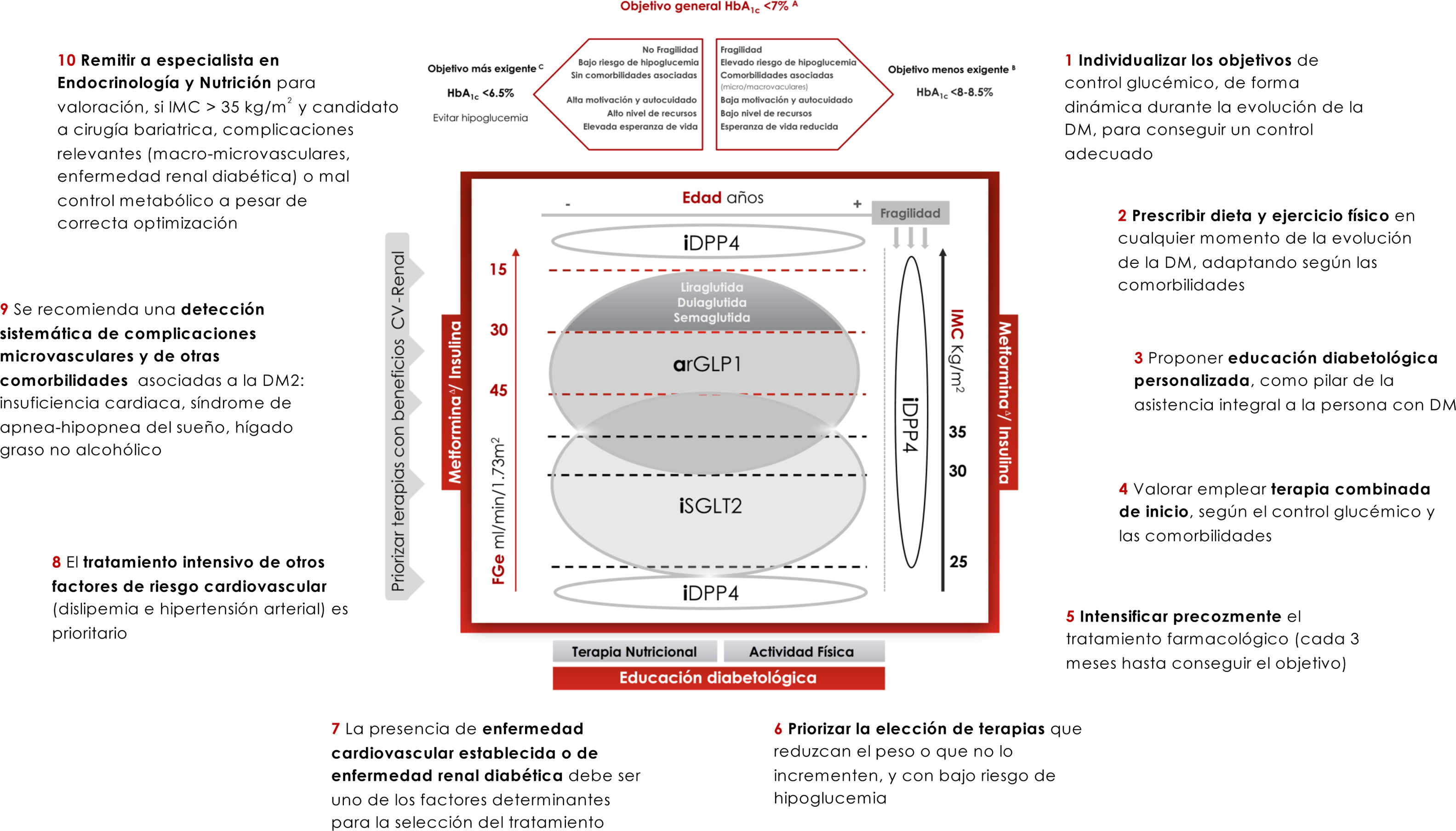
La DM2 es una enfermedad asociada a una alta tasa de muertes prematuras e invalidez. El control glucémico precoz ha demostrado reducir las complicaciones asociadas, la mortalidad y los costes asociados a la enfermedad, así como aumentar la calidad de vida2. El parámetro más utilizado para valorar el control glucémico en la DM2 es la hemoglobina glucosilada (HbA1c). El objetivo de HbA1c en la DM2ha ido evolucionando en los últimos años. En los estudios ACCORD3, ADVANCE4 y VADT5 se evaluó si el tratamiento glucémico intensivo, en comparación con el tratamiento convencional, producía beneficios a nivel CV en sujetos con DM2 de larga evolución y con un alto porcentaje de complicaciones cardiovasculares. Estos estudios indicaron que el control glucémico intensivo no ofrecía beneficio alguno en cuanto al desarrollo de eventos cardiovasculares y que podía aumentar la mortalidad2. Por el contrario, y aunque en el estudio original no se observaron efectos significativos del control glucémico sobre las complicaciones cardiovasculares, el análisis postintervención del estudio UKPDS6 sí demostró que, en pacientes con DM2 de reciente diagnóstico y sin complicaciones asociadas, el control glucémico intensivo reducía los eventos cardiovasculares y las complicaciones microvasculares. Estas evidencias, en su conjunto, remarcan la importancia del estricto control glucémico desde las fases más tempranas de la DM2 para disminuir las complicaciones microvasculares y la morbimortalidad de origen CV. Sin embargo, sugieren ser menos agresivos con el control glucémico en fases más evolucionadas de la DM22,7.
La individualización de los objetivos de control en la DM2 es fundamental, adaptándolos a la situación personal y a las características y preferencias de cada paciente (fig. 1). El objetivo de la HbA1c ha de ser dinámico y debe adaptarse al entorno clínico cambiante del paciente. La valoración de los niveles de HbA1c tiene que estimarse junto con los niveles de glucemia basal y posprandial, y con la presencia de hipoglucemias. Asimismo, debemos ser conscientes de que el objetivo de HbA1c es susceptible de modificarse con el tiempo, debiendo adaptarse a la situación de cada paciente. Si bien se considera que, en general, el objetivo de control en la DM2 debería ser conseguir unos niveles de HbA1c<7% (evidencia A), un objetivo más estricto (HbA1c<6,5%) puede ser adecuado en aquellas personas de menor edad, con una DM2 menos evolucionada, sin complicaciones asociadas, con una mayor capacidad de autocuidados y con apoyo familiar, siempre y cuando lograr dichos niveles de HbA1c no conlleve la aparición de hipoglucemias y se evite el aumento de peso (evidencia C). Por el contrario, serían recomendables niveles de HbA1c menos estrictos (<8-8,5%) en personas de edad avanzada frágiles y/o con esperanza de vida limitada, con poca capacidad de autocuidados y con escaso apoyo familiar (evidencia B)2,7. En personas con diabetes y enfermedad CV establecida el objetivo de HbA1c debería situarse entre 7-7,5%2,7. Finalmente, otros objetivos de control, de manera adicional a la HbA1c, serían valores de glucemia capilar basales en torno a 80-130mg/dl y niveles de glucemia<180mg/dl a las 2horas del inicio de la ingesta.
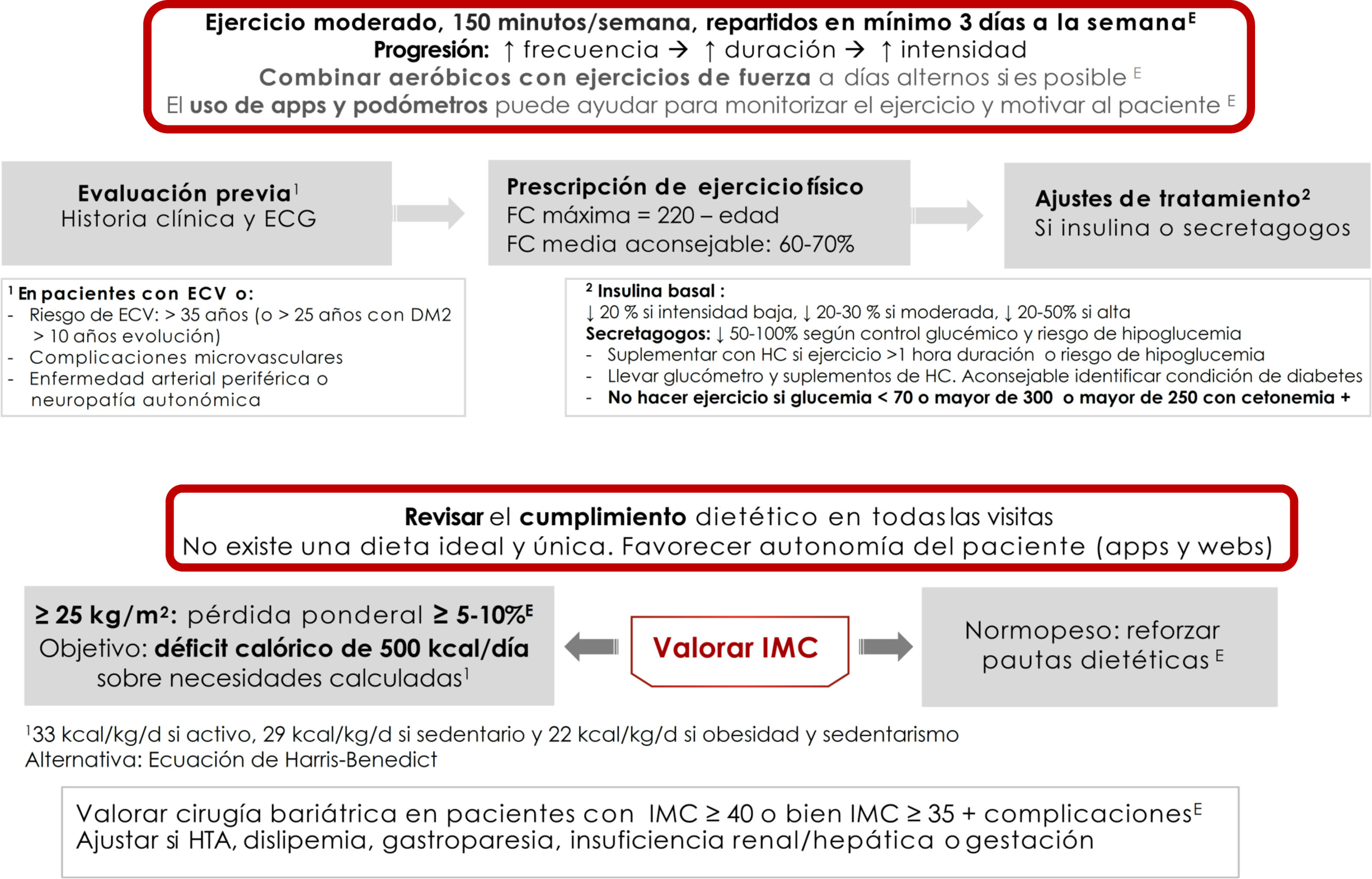
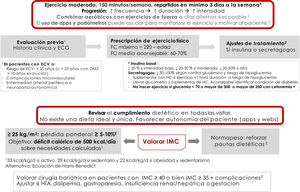
Recomendaciones y prescripción de ejercicio físicoEl ejercicio físico mejora el control glucémico, disminuye la resistencia a la insulina, reduce el riesgo CV, ayuda a la pérdida ponderal y mejora la sensación de bienestar y la calidad de vida. Los efectos difieren según el tipo de ejercicio. El ejercicio aeróbico fundamentalmente mejora la sensibilidad a la insulina, además de otros parámetros del sistema CV y la capacidad pulmonar8. Los ejercicios de resistencia son beneficiosos para aumentar la masa muscular, la fuerza, la densidad mineral ósea, la sensibilidad a la insulina, la presión arterial y el perfil lipídico. Los ejercicios de flexibilidad y equilibrio ayudan a reducir las caídas, mejoran la movilidad y pueden ser realizados incluso si existe neuropatía. Aparte de recomendar ejercicio físico, es decir, actividad física planificada, se debe aconsejar aumentar la actividad física en las actividades cotidianas9 (evidencia E para todas las recomendaciones de este apartado) (fig. 2).
Antes de la prescripción de ejercicio debe realizarse una historia clínica completa, focalizada en los síntomas sugestivos de complicaciones cardiovasculares, y un ECG. Además, si se va a practicar ejercicio físico de intensidad moderada-alta, si existe enfermedad CV (o sospecha de ella) o complicaciones microvasculares se recomienda realizar adicionalmente una prueba de esfuerzo. Se consideran pacientes con riesgo de enfermedad CV aquellos mayores de 35 años, o mayores de 25 años con diabetes de más de 10 años de evolución, con otros factores de riesgo de CV, complicaciones microvasculares, enfermedad vascular periférica o neuropatía autonómica (evidencia E)9,10.
Como recomendación general las personas con DM2 deben realizar al menos 150minutos semanales de actividad aeróbica moderada-vigorosa, repartida al menos en 3 días, sin dejar más de 2 días consecutivos sin realizar actividad física. En personas más jóvenes o con mejor forma física, los entrenamientos de alta intensidad de al menos 75minutos semanales pueden ser suficientes. Es aconsejable incluir 2-3 sesiones a la semana de ejercicio de resistencia en días no consecutivos7,9,11. Además, debe animarse a los pacientes a disminuir el sedentarismo, porque interrumpir una actividad sedentaria cada 30minutos ha demostrado mejorar el control glucémico. En pacientes ancianos se aconsejan los ejercicios de flexibilidad y equilibrio 2-3 días por semana. Se debe ir optimizando el ejercicio físico en este orden, aumentando la frecuencia, la duración y la intensidad de forma progresiva, y se aconseja llegar a un 60-70% de la frecuencia cardíaca máxima (siendo esta 220-edad) (fig. 2). Los dispositivos de monitorización de actividad física (wearables) pueden ayudar a la monitorización del ejercicio, así como a la automotivación (evidencia E)7,12.
En pacientes tratados con insulina o secretagogos (sulfonilureas y repaglinida), si el ejercicio supera la hora de duración se aconseja tomar un suplemento con hidratos de carbono. No se aconseja realizar ejercicio en las siguientes situaciones: glucemia inferior a 70mg/dl, mayor de 300mg/dl, o más de 250mg/dl con cuerpos cetónicos positivos. En estas situaciones, tras la resolución correcta de la hipoglucemia, puede realizarse la actividad física. Si el paciente recibe insulina basal se aconseja un ajuste de la dosis en función de la intensidad del ejercicio, siempre y cuando este se realice de forma regular, con una reducción del 20%, entre el 20-30% y del 20-50% en función de la intensidad del ejercicio (baja, moderada y alta respectivamente). Para aquellos pacientes que reciben secretagogos es aconsejable también ajustar la dosis en caso de realizar ejercicio regular: reducir dosis un 50-100% si tienen alto riesgo de hipoglucemia o HbA1c baja, un 25-50% si el control es adecuado y no modificar la dosis si el control está fuera de objetivo (evidencia E)8.
En pacientes con complicaciones crónicas asociadas a la diabetes se aconseja personalizar la actividad física, tal y como se indica en la tabla del algoritmo disponible en la web de la SEEN8,12
Terapia nutricionalLa intervención nutricional en la DM2 puede reducir entre 0,5-2% la HbA1c. En pacientes con normopeso el objetivo es mantener un peso adecuado7,12. En pacientes con índice de masa corporal (IMC)≥25kg/m2 el objetivo es la pérdida ponderal de al menos un 5-10% del peso corporal (fig. 2). Para ello debe conseguirse un déficit calórico de 500kcal diarias sobre las necesidades diarias calculadas: 33kcal/kg/día en sujetos activos, 29kcal/kg/día en sujetos sedentarios y 22kcal/kg/día en obesidad y sedentarismo, o calculando con ecuaciones predictivas como Harris-Benedict.
No existe una recomendación única e ideal en cuanto a la distribución porcentual de macronutrientes. Deben priorizarse los alimentos frescos y de temporada. El soporte especializado de dietista-nutricionista o enfermera educadora con formación en nutrición ha demostrado ser coste-efectivo. Además, es necesario favorecer la autonomía del paciente, y los recursos digitales como apps o webs pueden ser útiles para el consejo y seguimiento dietético. A continuación se indican algunas recomendaciones específicas (evidencia E)7,12:
Hidratos de carbono: se debe favorecer el consumo de los de bajo índice glucémico como vegetales, frutas, cereales integrales y legumbres y evitar alimentos de alto índice glucémico y alimentos procesados ricos en azúcares.
Grasas: entre las grasas aconsejadas están el aceite de oliva virgen extra, el aguacate y el pescado azul. Se deben limitar las grasas saturadas a <7%, grasas trans a <1% y el colesterol a <300mg/día. El pescado azul (rico en EPA y DHA), las nueces y las semillas se aconsejan en la prevención y tratamiento de la enfermedad CV. No existe evidencia sobre el beneficio CV de los suplementos farmacológicos de omega-313.
Proteínas: se recomienda favorecer el consumo de proteína vegetal (legumbres, soja, quinoa...). La proteína animal de preferencia debe ser procedente de pescado, marisco, huevos y lácteos desnatados. El consumo de un huevo diario en diabetes ha demostrado ser seguro, y hasta 12 huevos semanales no modifican el perfil lipídico ni el control glucémico14. Debe priorizarse el consumo de carnes magras. El consumo de carne roja y de procesados de carne debe ser ocasional. Solo se debe reducir el consumo de proteínas de la dieta en casos de insuficiencia renal moderada o grave, y no se debe reducir su consumo en terapia renal sustitutiva.
El consumo alto de fibra mejora el control glucémico y el perfil lipídico, para ello se aconseja un consumo diario de 5 porciones de frutas enteras y verduras. Se deben evitar los zumos, especialmente los industriales.
Las personas con diabetes no tienen incrementadas sus necesidades en micronutrientes y no se debe suplementar de forma rutinaria, salvo que exista un déficit comprobado. No se debe aconsejar el consumo de alcohol, por el aumento del riesgo de hipoglucemia y por el incremento del aporte calórico de la dieta. En caso de consumirse debe limitarse a menos de 15g en mujeres (una unidad de bebida estándar) y menos de 30g en varones (2unidades de bebida estándar).
Se debe reducir el consumo de sal (menos de 2.300mg de sodio al día, equivalente a 3g de sal al día), y en caso de hipertensión arterial debe reducirse aún más. El uso de edulcorantes acalóricos en vez de azúcar puede ayudar a reducir el contenido calórico total de la dieta. En general han demostrado ser seguros y no existe ninguno que haya demostrado ser superior en la diabetes.
Debería valorarse la cirugía metabólica en pacientes con DM2 e IMC≥40kg/m2, o IMC≥35kg/m2 con complicaciones asociadas. La cirugía metabólica consiste en la aplicación de los procedimientos quirúrgicos encaminados al tratamiento de la DM2 y de los factores de riesgo cardiometabólicos susceptibles de mejoría. Su principal indicación sería en pacientes con obesidad (IMC≥35kg/m2), especialmente si la DM2 o sus comorbilidades son difíciles de controlar con cambios en el estilo de vida y tratamiento farmacológico15.
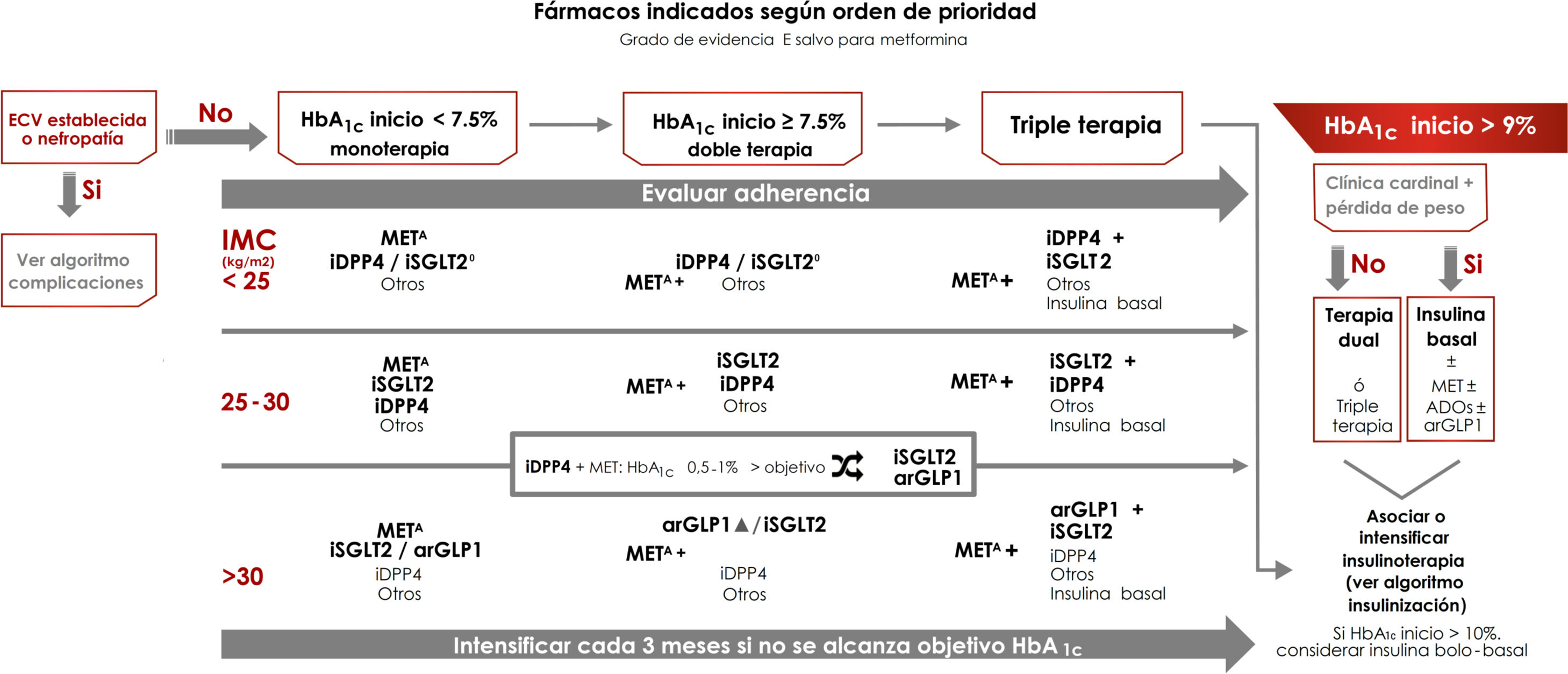
Tratamiento de la diabetes tipo 2 centrado en el control glucémicoLas recomendaciones de tratamiento en este caso se realizan según el grado de control glucémico inicial: monoterapia si HbA1c inicial<7,5%, terapia doble si HbA1c inicial entre 7,5% y 9%, y triple terapia si la HbA1c inicial es>9%7. En esta última situación, si existe clínica cardinal se recomienda insulina basal, asociada a otras terapias antidiabéticas, y si la HbA1c de partida es>10% puede considerarse el uso de insulina en pauta bolo-basal como terapia inicial, aunque posteriormente debe reevaluarse y valorar el cambio a un tratamiento más sencillo (evidencia E) (fig. 3). Al igual que lo que ocurre en otras guías, el objetivo de control glucémico que marca el límite para seleccionar terapias dobles o triples se ha fijado de forma arbitraria, y debe individualizarse.
Algoritmo de tratamiento centrado en el control glucémico.
Otros fármacos: SU, GLIN, PIO. Evitar si hay riesgo de hipoglucemias (SU, repaglinida) o de insuficiencia cardiaca o fracturas (PIO).
ECV: enfermedad cardiovascular; GLIN: repaglinida; MET: metformina; PIO: pioglitazona; SU: sulfonilureas.
ΔA favor arGLP1: dificultad de control de la ingesta, IMC>35kg/m2, distancia a objetivo de HbA1c>1%, riesgo ↑ fracturas, infecciones genitales de repetición.
°Si hipertensión arterial o necesidad de evitar ganancia ponderal. iSGLT2: dapaglifozina, empaglifozina, canaglifozina, ertuglifozina (aprobado por la European Medicines Agency).
El peso es un importante determinante de la selección del tratamiento. El control ponderal mejora la microangiopatía (enfermedad renal, polineuropatía) y la macroangiopatía (la adiposidad abdominal es un FRCV independiente), y ayuda al control de otros FRCV y comorbilidades7. Si el IMC es≥25kg/m2 se recomiendan como terapias preferentes de segunda línea tras la metformina aquellas que reducen el peso corporal: inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) y los agonistas del receptor de GLP1 (arGLP1), aunque hay que considerar que los arGLP1 solo están financiados en nuestro país con un IMC≥30kg/m2. En sujetos con IMC<25kg/m2, en segunda línea tras la metformina, se recomiendan al mismo nivel los inhibidores de DPP4 (iDPP4) y los iSGLT2, priorizando los iSGLT2 si existe hipertensión arterial o necesidad de evitar ganancia ponderal (evidencia E).
Tras la instauración o la modificación de la pauta de tratamiento debe evaluarse el control glucémico a los 3 meses, intensificando de nuevo el tratamiento si no se ha alcanzado el objetivo de control glucémico. Durante todo el tratamiento, y antes de realizar una nueva intensificación, debe evaluarse de forma periódica la adherencia al tratamiento (evidencia E) (fig. 3). En un paciente tratado con metformina+iDPP4, que tiene HbA1c 0,5-1% por encima de objetivo, se recomienda añadir iSGLT2 o sustituir iDPP4 por arGLP1.
Las distintas terapias antidiabéticas se indican según orden de prioridad, destacando aquellas terapias con bajo riesgo de hipoglucemia (metformina [evidencia A], iDPP4, iSGLT2 y arGLP1 [evidencia E]) y con efecto positivo sobre el peso y sobre los valores de presión arterial (iSGLT2 y arGLP1). Otras terapias que aumentan el riesgo de hipoglucemia (sulfonilureas o repaglinida), o que tienen un perfil de efectos adversos menos favorable, como la pioglitazona (retención hídrica, insuficiencia cardiaca o fracturas) se recomiendan como opciones de segunda línea, aunque pueden utilizarse en caso de intolerancia o contraindicación a las terapias de primera línea7,16 (fig. 3).
La hipoglucemia se asocia con una considerable morbimortalidad. Es un posible factor de riesgo de deterioro neurocognitivo, de caídas y de lesiones relacionadas, y deteriora la calidad de vida. La hipoglucemia es un factor limitante principal para optimizar el control glucémico y para la adherencia terapéutica. Evitar hipoglucemias es coste-efectivo, y el uso de fármacos con bajo riesgo de hipoglucemia es de gran relevancia17.
La presencia de insuficiencia renal determina o limita el uso de la mayoría de las terapias antidiabéticas, salvo la insulina. El algoritmo de tratamiento recoge las limitaciones de cada grupo terapéutico según el filtrado glomerular (fig. 4).
Ajuste de terapias antidiabéticas según la función renal.
La línea roja marca el filtrado glomerular límite para el uso de un determinado fármaco.
FGe: Filtrado glomerular estimado.
*Ajuste de dosis en enfermedad renal crónica (ERC) salvo linagliptina.
**Dapaglifozina FGe>60.
#No requiere ajuste de dosis en ERC. En enfermedad renal avanzada, vigilar dosis de repaglinida por riesgo de hipoglucemia.
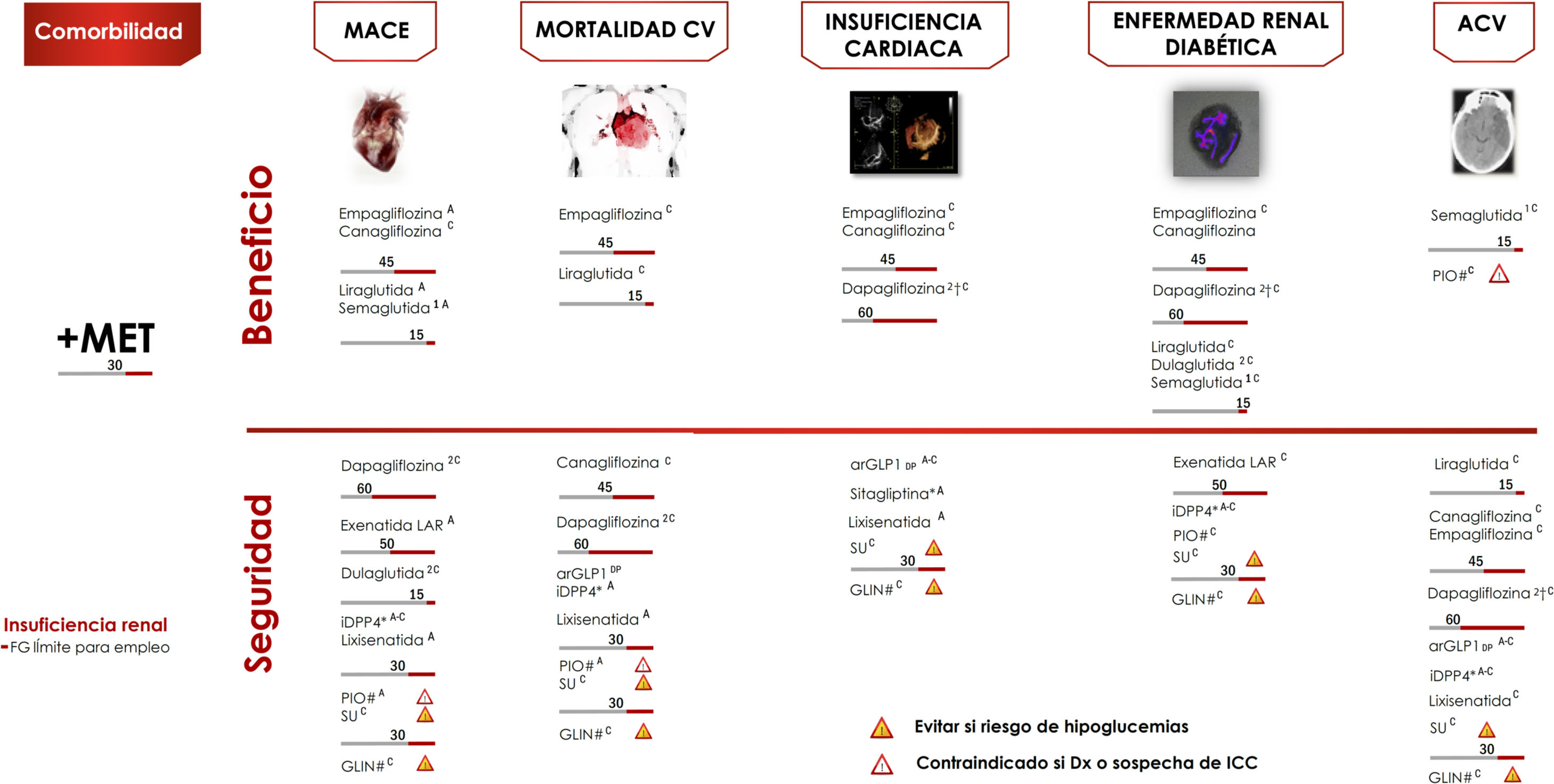
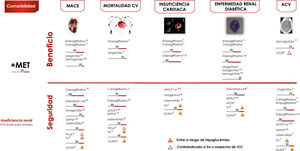
La enfermedad CV aterosclerótica (ECV), definida como enfermedad coronaria, enfermedad cerebrovascular o arteriopatía periférica, es la causa principal de morbimortalidad en personas con diabetes, y es el principal contribuyente a los costes directos e indirectos de la diabetes16. Para los pacientes con DM2 y ECV o enfermedad renal diabética se recomienda incorporar un agente con evidencia de reducción de los eventos CV o de la progresión de la enfermedad renal diabética, teniendo en consideración las características individuales del paciente (evidencia A).
Ensayos clínicos de seguridad cardiovascularDisponemos de 4 grandes ensayos controlados aleatorizados que han demostrado reducciones estadísticamente significativas y clínicamente relevantes en los eventos CV, en pacientes con ECV establecida o con alto riesgo CV: EMPAREG-OUTCOME18, con empagliflozina (evidencia A) y CANVAS19, con canagliflozina (evidencia C), LEADER20, con liraglutida (evidencia A) y SUSTAIN-621, con semaglutida (evidencia A). En todos los estudios mencionados la terapia evaluada demostró la no inferioridad en lo relativo a la reducción de MACE, y además la superioridad, salvo en el estudio SUSTAIN-6, que solo estaba diseñado para evaluar la no inferioridad.
Los ensayos de empagliflozina y liraglutida demostraron reducciones significativas en la muerte CV (evidencia A) (fig. 5). Por el contrario, otros arGLP1 no han mostrado reducciones similares en los eventos CV22,23. En esos estudios se examinaron los fármacos en combinación con metformina, lo que la sitúa como fármaco de elección en combinación.
Algoritmo de tratamiento centrado en comorbilidades.
Intensificación. Si no se alcanza objetivo individualizado en 3 meses asociar triple terapia con fármaco con mecanismo de acción complementario y beneficio/seguridad CV. Valorar empleo de insulinoterapia basal (ver algoritmo).
ACV; accidente cerebrovascular; CV: cardiovascular; DP: duración prolongada; FG: filtrado glomerular; GLIN: repaglinida; MACE: eventos CV mayores; PIO: pioglitazona; SU: sulfonilurea.
*Ajuste de dosis en IR salvo linagliptina.
# No requiere ajuste de dosis en ERC.
† Evidencia basada en estudios observacionales.
(1) Aprobado por la European Medicines Agency.
(2) Dulaglutida, dapagliflozina y linagliptina no han finalizado ensayo de seguridad CV. Vildagliptina no tiene ensayo de seguridad CV.
Otras aportaciones a la evidencia de estos ensayos se han derivado de objetivos secundarios o análisis post-hoc (evidencia C)24–27. En estos análisis empagliflozina y canagliflozina han demostrado reducir la tasa de hospitalización por insuficiencia cardiaca, y empagliflozina, canaglifozina, liraglutida y semaglutida mejoran los objetivos renales, definidos como progresión de la albuminuria, progresión a enfermedad renal terminal y/o duplicación de las concentraciones séricas de creatinina. En otros ensayos clínicos de seguridad CV diferentes terapias antidiabéticas como sitagliptina28, alogliptina29, saxagliptina30, lixisenatida23 y exenatida-LAR22 han demostrado un efecto neutro sobre los eventos CV, lo que respalda el uso de estos fármacos cuando es necesario para mejorar el control glucémico, con el objetivo de limitar las complicaciones microvasculares sin aumentar el riesgo CV. Sin embargo, se observaron diferencias entre los distintos iDPP-4 en lo relativo al riesgo de insuficiencia cardiaca, con un incremento de riesgo en el estudio SAVOR, con saxagliptina30, y también con alogliptina en un análisis post-hoc del estudio EXAMINE29. Por el contrario, sitagliptina no aumentó el riesgo de insuficiencia cardiaca en el estudio TECOS28.
Respecto a las insulinas, en sujetos con prediabetes y DM2 glargina ha demostrado también su seguridad CV31. En sujetos con ECV establecida y/o alto riesgo CV, la insulina degludec ha confirmado su seguridad cardiovascular en comparación con la insulina glargina32.
Vildagliptina no ha realizado ensayo de seguridad CV, mientras que los ensayos clínicos CV de dulaglutida (REWIND), dapagliflozina (DECLARE), ertugliflozina (VERTIS) y linagliptina (CARMELINA, CAROLINA) aún están en marcha.
Estudios de vida realAdemás de los ensayos de seguridad CV, el análisis de datos del «mundo real» es un campo emergente en la diabetes, como medio de complementar los datos obtenidos en los ensayos de seguridad CV. Disponemos de varios estudios observacionales que confirman los efectos positivos de los iSGLT2 en vida real (CVD-real, EASEL)33–35, que apuntan en la misma dirección de los resultados en reducción de morbimortalidad CV de los ensayos de seguridad CV, si bien la mayoría de los pacientes de estos estudios no tenían ECV establecida.
En la figura 5 se indican las recomendaciones adicionales sobre la terapia en adultos con DM2 y comorbilidad CV o renal.
Algoritmo de insulinizaciónEn la DM2 la producción de insulina disminuye progresivamente, por tanto, si la evolución de la enfermedad es lo suficientemente prolongada se necesitará insulina como terapia de reemplazo. Por otra parte, si el paciente presenta hiperglucemia sintomática o estado hipercatabólico, incluso en el momento del diagnóstico, el tratamiento con insulina será necesario, transitoriamente en caso de descompensaciones reversibles o de forma permanente7. El conjunto de evidencias muestra que la opción más razonable es iniciar el reemplazo con insulina basal, valorando de forma individualizada si se mantiene el tratamiento antidiabético previo, total o parcialmente16, según lo explicado sobre terapias no insulínicas en los apartados previos. Actualmente disponemos de 5 tipos de insulina con la que realizar este primer paso, las diferencias fundamentales entre estas son la duración de acción, de la que depende el número de administraciones diarias, y la variabilidad en su efecto, ambas determinantes tanto del número de administraciones diarias necesarias como del riesgo de hipoglucemia de cada opción (evidencia E). Así, la insulina NPH presenta una vida media inferior a la necesaria para mantener niveles adecuados durante las siguientes 24horas, más una elevada variabilidad en su efecto que determina un mayor riesgo de hipoglucemia36. Habitualmente se requerirá más de una administración diaria de insulina NPH para conseguir el grado de control metabólico necesario. En este documento clasificaremos el resto de las opciones, los análogos de insulina basal, en análogos de primera generación (AB1, insulina glargina U100 e insulina detemir) y análogos de segunda generación (AB2, insulina glargina U300 e insulina degludec). Frente a la insulina NPH los AB1 demostraron mayor duración de acción, menor variabilidad y menor riesgo de hipoglucemia, posteriormente los estudios realizados mostraron que los AB2 eran superiores en estos 3 parámetros a los AB137–43. La insulina degludec demostró, frente a glargina U100, descenso del riesgo de hipoglucemia en un ensayo clínico diseñado con hipoglucemias como objetivo principal44 e hipoglucemias graves en otro ensayo clínico realizado en pacientes de elevado riesgo CV32. Estas y otras características diferenciales de cada insulina basal se muestran en la figura 6. Hasta el momento solo se ha publicado un ensayo clínico que ha comparado los AB245. En el estudio BRIGHT45 el objetivo primario fue evaluar la no inferioridad en los cambios de HbA1c después del tratamiento con insulina basal (glargina U300 vs. degludec) en pacientes con DM2, durante 24 semanas. De forma similar a estudios previos realizados con otras insulinas basales, no se observaron diferencias en HbA1c al final del periodo de estudio. Tampoco se observaron diferencias en la tasa de hipoglucemias, aunque las hipoglucemias no se evaluaron como objetivo primario ni secundario, sino que se recogieron como efectos adversos.
Algoritmo de insulinización.
Si no se alcanza objetivo de HbA1c en 3 meses tras evaluar adherencia y ajustes de dosis.
GCA: glucemia capilar en ayunas.
1: Se considera una insulina intermedia por la frecuente necesidad de administrar más de una dosis diaria; 2: a mayor duración será necesario un mayor periodo para conseguir el efecto esperado; 3: se precisará mayor dosis si se administra más de una vez por día; 4: reembolso de prescripción limitado a condiciones de visado; 5: individualizar el método de ajuste de la insulina basal (por ejemplo media o menor valor de las 3 GCA previas).
La dosis de inicio recomendada de insulina basal es 10unidades/día o 0,2-0,3unidades/kg/día (evidencia A). Posteriormente, será necesario titular esta dosis de inicio hasta la requerida por cada sujeto, según la glucemia capilar en ayunas (GCA) hasta alcanzar la GCA objetivo establecida para cada paciente (evidencia E)7,16. Se han realizado estudios que validaron el ajuste de la dosis según la media o el menor valor de las 3GCA previas o, preferentemente con AB2, un valor de GCA semanal46,47. Si tras un plazo mínimo de 3 meses de terapia con insulina basal, en los que se consiga la dosis necesaria para alcanzar la GCA objetivo, en los que la HbA1c permaneciera por encima del objetivo establecido para el paciente, valoraremos el siguiente paso en la intensificación terapéutica, de igual forma que si se hubiera conseguido pero presentara nueva descompensación hiperglucémica en posteriores controles analíticos7,16.
Antes de iniciar una pauta avanzada que incluya insulina rápida podría intensificarse la pauta de tratamiento con opciones no insulínicas, si no estaban prescritas previamente ni concurriera intolerancia y/o contraindicación, priorizando las terapias que faciliten la adherencia (por ejemplo combinadas), con bajo riesgo de hipoglucemia, que favorezcan el control ponderal u otros factores de riesgo CV (tabla 2)7,16. Si aun con estas medidas terapéuticas el sujeto presentara control glucémico inadecuado, se valoraría si añadir insulina rápida o cambiar la pauta previa a mezclas bifásicas, en función de las características del paciente (evidencia E).
Algoritmo de insulinización, intensificación con múltiples dosis de insulina
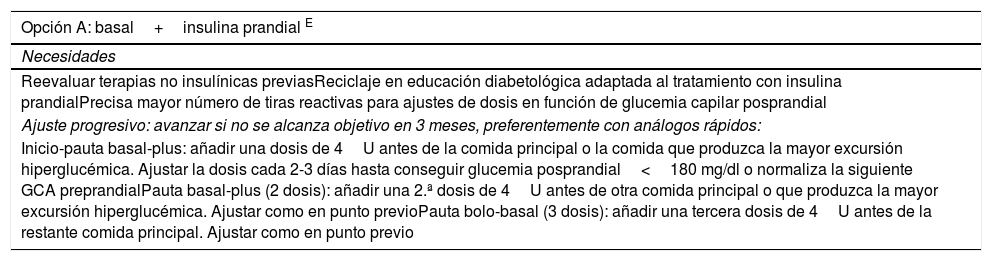
| Opción A: basal+insulina prandial E |
|---|
| Necesidades |
| Reevaluar terapias no insulínicas previasReciclaje en educación diabetológica adaptada al tratamiento con insulina prandialPrecisa mayor número de tiras reactivas para ajustes de dosis en función de glucemia capilar posprandial |
| Ajuste progresivo: avanzar si no se alcanza objetivo en 3 meses, preferentemente con análogos rápidos: |
| Inicio-pauta basal-plus: añadir una dosis de 4U antes de la comida principal o la comida que produzca la mayor excursión hiperglucémica. Ajustar la dosis cada 2-3 días hasta conseguir glucemia posprandial<180 mg/dl o normaliza la siguiente GCA preprandialPauta basal-plus (2 dosis): añadir una 2.ª dosis de 4U antes de otra comida principal o que produzca la mayor excursión hiperglucémica. Ajustar como en punto previoPauta bolo-basal (3 dosis): añadir una tercera dosis de 4U antes de la restante comida principal. Ajustar como en punto previo |
| Opción B: cambio a mezcla bifásica E |
|---|
| Indicación |
| En pacientes con bajo riesgo de hipoglucemia, medidas de estilo de vida más horarios relativamente estables y con capacidad limitada para aplicar los ajustes necesarios de las pautas de insulina (basal y/o bolos) |
| Ajuste progresivo: ajustar la dosis cada 2-3 días hasta conseguir glucemia posprandia<180 mg/dl o normaliza la siguiente GCA preprandial |
| El riesgo de hipoglucemia es superior con estas pautas Evidencia ADosis inicial: 0,2-0,3U/kg/d repartidos en 2 (2/3 en desayuno más 1/3 en cena) o 3 dosis (1/2 en desayuno, 1/4en comida, 1/4en cena) |
El texto en superíndice indica el grado de evidencia.
GCA: glucemia capilar en ayunas (mg/dl); U: unidades.
Se distinguen distintos objetivos de control según el nivel de riesgo7:
- 1.
Alto riesgo CV (la mayoría de las personas con DM2, excluyendo por su menor riesgo a <40 años sin otros FRCV ni lesiones en órganos diana, y por su mayor riesgo a los incluidos en los puntos 2 y 3): mantener LDLc<100mg/dl, no-HDLc<130mg/dl, triglicéridos<150mg/dl y ApoB<90mg/dl (evidencia A).
- 2.
Muy alto riesgo CV (DM2 con otros FRCV mayores como tabaquismo o HTA, lesiones en órganos diana o enfermedad renal crónica estadio 4-5): mantener LDLc<70mg/dl, no HDLc<100mg/dl, triglicéridos<150mg/dl y ApoB<80mg/dl (evidencia A).
- 3.
Riesgo CV extremo (DM2 con enfermedad arteriosclerótica CV, cerebrovascular o periférica establecida): mantener LDLc<55mg/dl, no HDLc<80mg/dl, triglicéridos<150mg/dl y ApoB<70mg/dl (evidencia A).
En el tratamiento son fundamentales las medidas higiénico-diéticas: reducir la ingesta de grasas saturadas, trans y colesterol, y aumentar los ácidos grasos omega 3 y la fibra alimentaria; valorar el consumo de esteroles vegetales; conseguir descenso ponderal si existe sobrepeso u obesidad; aumentar la actividad física (evidencia A).
Se planteará añadir tratamiento farmacológico a los pacientes que no alcanzan los objetivos de control después de 3 meses de instauración de medidas higiénico-dietéticas. Cuando no se alcancen los objetivos de LDLc se añadirá escalonadamente (evidencia A)48:
- -
Estatinas (tabla 3) de baja, moderada o alta potencia, según las necesidades de reducción de niveles de LDLc sean menores del 30%, entre 30-50% o mayores del 50%.
Tabla 3.Estatinas clasificadas según su potencia (dosis diaria)
Baja potencia Moderada potencia Alta potencia Simvastatina 10mgPravastatina 10-20mgLovastatina 20mgFluvastatina 20-40mgPitavastatina 1mg Atorvastatina 10-20mgRosuvastatina 5-10mgSimvastatina 20-40mgPravastatina 40-80mgLovastatina 40mgFluvastatina de liberación prolongada 80mgFluvastatina 40mgPitavastatina 2-4mg Atorvastatina 40-80mgRosuvastatina 20-40mg Utilizar según las necesidades de reducción de niveles de LDLc sean menores del 30%, entre 30-50% o mayores del 50%.
- -
Ezetimibe 10mg/día.
- -
Inhibidores de PCSK9: alirocumab (75mg/15 días, los pacientes que requieran una reducción del LDLc>60% pueden empezar con 150mg una vez cada 2 semanas o 300mg una vez cada 4 semanas, administrados vía subcutánea), evolocumab (140mg/15 días o 420mg/mes).
En pacientes con triglicéridos>150mg/dl y HDLc<40mg/dl (hombres) o<45mg/dl (mujeres) se debe mejorar el control glucémico e insistir en la abstinencia de alcohol y en los hábitos de vida saludables. En aquellos con triglicéridos>500mg/dl se añadirá tratamiento farmacológico en monoterapia o de forma combinada. En aquellos sujetos con niveles de triglicéridos entre 200 y 500mg/dl y HDLc bajo, una vez alcanzado el objetivo de LDLc se puede valorar añadir tratamiento farmacológico con (evidencia A)49:
- 1.
Fibratos (de elección): fenofibrato (145-250mg/día), gemfibrozilo (900-1.200mg/día) o bezafibrato (200-400mg/día). En combinación con estatinas utilizar preferentemente fenofibrato.
- 2.
Ácidos grasos omega 3 (2-4g/día).
El objetivo de control general es una presión arterial sistólica (PAS)<140mmHg y una PA diastólica (PAD)<90mmHg (evidencia A). El objetivo de control para pacientes de alto riesgo CV, jóvenes, o con albuminuria es PA<130/80mmHg, siempre que se alcance sin efectos secundarios (evidencia C)50.
Las medidas higiénico-dietéticas incluyen reducir el consumo de sodio (<2,3g/día) y de alcohol, aumentar el consumo de frutas y verduras, descenso ponderal si existe sobrepeso u obesidad y aumentar la actividad física (evidencia B)50.
- –
En aquellos pacientes con PAS entre 140 y 159mmHg y/o PAD entre 90 y 99mmHg se recomienda iniciar tratamiento farmacológico con un fármaco, que podrá ser IECA, ARA-2, calcio antagonista dihidropiridínico o diurético tiazídico. Si el paciente tiene albuminuria (cociente albúmina/creatinina ≥30mg/g) se considerará un IECA o un ARA-2 como la primera elección (evidencia A)48,50.
- –
En aquellos con PA≥160/100mmHg se recomienda iniciar tratamiento combinado con 2 fármacos, que habrá de incluir un IECA o ARA-2 si el paciente tiene albuminuria (evidencia A)50.
- –
Si no se alcanza el objetivo se podrá añadir un segundo o tercer fármaco, evitando combinar IECA y ARA-2 (evidencia A).
- –
Los bloqueadores beta podrían usarse en pacientes con cardiopatía isquémica o insuficiencia cardiaca (evidencia A).
- –
Es imprescindible indicar la abstención del tabaco, para lo que puede incluirse al paciente en programas estructurados, apoyándose en fármacos cuando sea necesario (evidencia A). En cuanto a la antiagregación se recomienda el ácido acetil salicílico (75-150mg/día) o clopidogrel (75mg/día) en pacientes con intolerancia o alergia al primero48:
- •
En prevención secundaria (evento isquémico previo), siempre que sea posible (evidencia A).
- •
En prevención primaria si el paciente es de alto riesgo CV (hombres y mujeres >50 años con otro/s FRCV: historia familiar de enfermedad CV precoz, HTA, tabaquismo, dislipidemia o albuminuria), siempre que el riesgo de hemorragia sea bajo (evidencia C).
La individualización del tratamiento en pacientes con DM2 es un factor clave en el éxito de la terapia elegida. El perfil de efectos adversos y el análisis de coste-efectividad ayudan en la toma de decisiones terapéuticas. En este sentido las terapias antidiabéticas no insulínicas que no incrementan el riesgo de hipoglucemias (iDPP4, arGLP1, iSGLT2), en combinación con metformina y/o pioglitazona, deberían ser una opción preferente con respecto a los secretagogos y la insulina. A su vez, el efecto beneficioso de los arGLP1 y los iSGLT2 sobre el peso sitúa a ambos grupos como fármacos de elección en pacientes con sobrepeso u obesidad con respecto a terapias con efecto neutro (iDPP4) o perjudicial (secretagogos, insulina, pioglitazona) sobre el peso. Tanto la metformina como los arGLP1 se asocian a efectos adversos gastrointestinales (dispepsia, náuseas, vómitos), por lo que es importante el inicio progresivo de la dosis y la suspensión en caso de intolerancia. Aunque los datos no son concluyentes y el riesgo parece bajo, la presencia previa de pancreatitis (arGLP1, iDPP4) y enfermedad biliar (arGLP1) limita el uso de terapias incretínicas. Con los iSGLT2 el efecto adverso más importante es la aparición de infecciones genitales (entre un 5% y un 10%), que suelen ser leves, se resuelven habitualmente con un único ciclo de tratamiento antifúngico y no requieren de la suspensión del tratamiento con iSGLT2. Canagliflozina se ha asociado a un aumento del riesgo de amputaciones de los miembros inferiores, así como a un incremento de fracturas, por lo que su uso debe limitarse en pacientes con riesgo elevado de estas entidades19. Así mismo, en individuos, particularmente mujeres, con riesgo elevado de fractura, debe limitarse el uso de pioglitazona y en menor grado el uso de sulfonilureas e insulina, por el aumento del riesgo de fractura51. La pioglitazona está también contraindicada en pacientes con antecedentes de cáncer de vejiga o hematuria macroscópica no filiada. Aunque de manera infrecuente, el tratamiento con metformina se asocia a acidosis láctica (durante procesos intercurrentes se recomienda evitar su uso en estas situaciones) y déficit de vitamina B12, se recomienda la monitorización de los niveles al menos de forma anual, especialmente en situaciones de riesgo: ancianos, uso de inhibidores de la bomba de protones. Por último, tanto liraglutida52 como pioglitazona53 han mostrado un beneficio en la evolución del HGNA.
Ante el incremento progresivo del gasto sanitario, tanto el Ministerio de Sanidad, como las principales asociaciones internacionales, entre las que destacan la NICE, recomiendan aplicar análisis de coste-efectividad para la priorización de los recursos sanitarios. En este sentido, y en el contexto del Sistema Nacional de Salud, varios estudios han puesto de manifiesto que las nuevas terapias antidiabéticas no insulínicas (arGLP1, iSGLT2) representan una opción dominante (más efectiva y menos costosa) o coste-efectiva (≤30.000 euros por año de vida ganado ajustado a calidad) con respecto a otras opciones de tratamiento54–57. A su vez, el uso de insulina degludec con respecto a glargina U100 también ha demostrado ser una opción coste-efectiva58.
Detección de comorbilidadesHígado graso no alcohólicoEl HGNA es la enfermedad hepática crónica más frecuente en el mundo (prevalencia del 25-30% en la población general y 70% en DM2). Incluye la esteatosis simple, la esteatohepatitis no alcohólica (EHNA) y la fibrosis, en ausencia de otras causas de enfermedad hepática y de consumo de alcohol (<20g/día en varones y <10g/día en mujeres). Puede evolucionar a cirrosis y carcinoma hepatocelular. Los pacientes con DM2 son particularmente susceptibles de presentar formas más graves de HGNA y tienen un mayor riesgo de carcinoma hepatocelular. Además, la coexistencia de DM y EHNA suele implicar peor perfil metabólico y mayor riesgo CV59.
La ecografía es la técnica inicial de elección para el diagnóstico, aunque la sensibilidad es baja cuando la esteatosis es menor del 33% (por ejemplo pacientes con fibrosis) o en presencia de obesidad abdominal60. Las enzimas hepáticas no son un marcador sensible de HGNA, ya que las formas más graves de hepatopatía suelen cursar con valores normales. El uso de escalas de riesgo, como el índice de hígado graso (https://www.medicalalgorithms.com/fatty-liver-index) ha demostrado ser de utilidad para el diagnóstico59,60.
Si existe esteatosis o enzimas hepáticas alteradas se aplicarán las escalas de riesgo de fibrosis, que utilizan variables clínicas y marcadores subrogados de inflamación o fibrosis hepática (NAFLD fibrosis score [http://nafldscore.com] edad, IMC, intolerancia a glucosa/diabetes, GOT/GPT, plaquetas, albúmina; FIB-4 [http://www.mdcalc.com/fibrosis-4-fib-4-index-liver-fibrosis]: edad, GOT, GPT, plaquetas)60. Los pacientes con riesgo moderado y alto de fibrosis según estas escalas deben remitirse al especialista en digestivo para descartar otras hepatopatías y para valorar la realización de elastografía y/o biopsia. En el resto de casos se hará seguimiento periódico con enzimas hepáticas y ecografía, en pacientes sin esteatosis, y con enzimas hepáticas y escalas de riesgo de fibrosis en pacientes con esteatosis y riesgo bajo de fibrosis. En los pacientes sin esteatosis y con enzimas hepáticas normales se repetirá la valoración de forma periódica (cada 3-5 años).
En la actualidad no existe ningún tratamiento farmacológico aprobado para el HGNA. La modificación del estilo de vida encaminada a la reducción del 7-10% del peso es el pilar del tratamiento (se debe valorar cirugía metabólica si el IMC es≥35kg/m2)59,60. Algunos tratamientos antidiabéticos han demostrado efectos positivos en la EHNA (pioglitazona 45mg/día53 y liraglutida52) y la fibrosis (pioglitazona 45mg/día) en ensayos clínicos aleatorizados.
Insuficiencia cardiacaLa insuficiencia cardiaca es actualmente la complicación CV más frecuente en la DM2, con una incidencia mayor al infarto de miocardio o el ictus61. Ante la sospecha de insuficiencia cardiaca (enfermedad coronaria previa, HTA, ortopnea o disnea paroxística nocturna) y la presencia de síntomas y signos clínicos (disnea, edemas y fatiga; presión venosa yugular elevada, crepitantes pulmonares), acompañadas o no de alteraciones electrocardiográficas, debe valorarse la derivación a cardiología para la realización de ecocardiografía. Si existen datos clínicos de sospecha es útil la determinación, si está disponible en el centro, del péptido natriurético de tipo B (BNP>35pg/ml) y la fracción N terminal del propéptido natriurético cerebral (NT-ProBNP>125 pg/ml) para identificar los pacientes que requieran ecocardiografía61.
Síndrome de apnea-hipopnea del sueñoSe caracteriza por somnolencia excesiva, trastornos cognitivo-conductuales, respiratorios, cardiacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior durante el sueño. La prevalencia en pacientes con DM2 es mayor que en la población general y se estima en torno al 50%62. La coexistencia de síndrome de apnea-hipopnea del sueño (SAHS) podría agravar la evolución de la DM2. Además, existe asociación entre las complicaciones macrovasculares de la diabetes y el SAHS, y es un predictor independiente de retinopatía proliferativa62.
El despistaje mediante cuestionarios validados (el Stop-Bang es el considerado más eficaz por sensibilidad 93-100%, especificidad 43%) permitiría el diagnóstico precoz y el abordaje por parte del especialista en neumología. El tratamiento se centra en la reducción ponderal. El CPAP está considerado el mejor tratamiento para el SAHS moderado o grave, que mejora la sensibilidad a la insulina en pacientes con SAHS severo (índice apnea-hipopnea>30) frente a aquellos con SAHS menos severo62.
Tratamiento de la diabetes tipo 2 en paciente frágilLa presencia de fragilidad es un importante determinante de la selección de la terapia para la diabetes63. En sujetos con DM2 mayores de 70 años se recomienda valorar la presencia de fragilidad con los criterios de Fried64.
- -
Pérdida involuntaria de peso (>4,5kg o 5% en un año).
- -
Baja energía o resistencia: respuesta afirmativa (más de 5-7 días/semana) a alguna de estas preguntas:
- •
En la última semana, ¿cuántos días ha sentido que todo lo que hacía era un esfuerzo? o ¿cuántos días no ha tenido ganas de hacer nada?
- -
Velocidad de la marcha: tiempo para caminar 4,6m>7segundos (varón<175cm o mujer<159cm) o >6segundos (varón>175cm o mujer>159cm).
- -
Bajo nivel de actividad física (en el varón pasear≤2horas y 30minutos/semana, en la mujer≤2horas/semana).
- -
Debilidad muscular medida por dinamometría manual.
Si el paciente cumple criterios de fragilidad (3 o más criterios) deben adaptarse los objetivos de tratamiento (evidencia E): si ECV establecida HbA1c entre 7,5% y 8%, en sujetos frágiles HbA1c entre 8% y 8,5%. Es fundamental evitar las hipoglucemias, que en los sujetos de edad avanzada son más frecuentes si el control glucémico es muy estricto y/o existe un mayor número de comorbilidades. En sujetos frágiles debe valorarse la retirada de tratamientos si la HbA1c está por debajo del objetivo63.
Como tratamiento farmacológico de primera línea se recomienda la metformina (evidencia A), ajustando según la función renal, y vigilando la aparición de efectos secundarios, que pueden tener gran relevancia en sujetos frágiles: intolerancia digestiva, disgeusia, hiporexia y déficit de vitamina B1216. Es necesario monitorizar la función renal, al menos de forma anual. Como terapia de segunda línea, o como primera opción si existen efectos adversos asociados a la metformina, se recomiendan los iDPP4 (evidencia E)63. Si con estas terapias no se consigue un adecuado control glucémico se valorará la insulina basal (priorizando los análogos basales con un menor riesgo de hipoglucemia) (evidencia E). En el paciente frágil se recomienda evitar el uso de otras terapias: pioglitazona si hay riesgo de insuficiencia cardiaca, riesgo de fracturas y/o caídas: secretagogos (sulfonilureas y repaglinida), por el riesgo de hipoglucemia; iSGLT2 y arGLP1 por el descenso ponderal, que puede no ser adecuado en el paciente frágil.
Abordaje integral de la diabetes mellitus tipo 2En conclusión, este documento propone un manejo integral de la DM2, individualizado según las características del paciente y priorizando la selección de terapias para la diabetes con bajo riesgo de hipoglucemia y con efectos positivos sobre los factores de riesgo CV, incluido el peso. Además, la presencia de enfermedad CV o de enfermedad renal son 2 determinantes prioritarios en la selección del tratamiento (fig. 1). Por último, la prescripción adecuada de dieta y ejercicio son fundamentales desde el diagnóstico y durante toda la evolución de la enfermedad. Las recomendaciones clave se recogen en el decálogo de la figura 1.
El documento se ha actualizado en 2019 en base a las nuevas evidencias publicadas, y está disponible en http://www.seen.es/docs/apartados/791/abordaje%20integral%20dm2019.pdf
AutoríaRebeca Reyes-García y Óscar Moreno-Pérez han contribuido por igual al desarrollo y elaboración del manuscrito.
Conflicto de interesesR. Reyes: ponente/consultor de Almirall, Ascensia, Astra-Zeneca, Boehringer-Ingelheim, Esteve, Ferrer, Faes Farma, Glaxo Smith Kline, Janssen-Cilag, Lilly, MSD, Novartis, NovoNordisk, Sanofi-Aventis. Investigador clínico de Astra-Zeneca, Glaxo Smith Kline, Lilly, NovoNordisk, Roche.
O. Moreno: ponente/consultor de NovoNordisk, Lilly, MSD, Novartis, Boehringer-Ingelheim, Astra-Zeneca.
C. Tejera: ponente/consultor de Sanofi-Aventis, NovoNordisk, Astra-Zeneca, R, Lilly, Boehringer-Ingelheim, MSD. Investigador clínico de NovoNordisk, Sanofi-Aventis, Astra-Zeneca.
V. Bellido: ponente/consultor de Astra-Zeneca, Boehringer-Ingelheim, Esteve, Lilly, MSD, NovoNordisk, Roche, Sanofi-Aventis. Investigador clínico de Sanofi-Aventis.
M. López de la Torre: ponente/consultor de NovoNordisk, Lilly, Novartis, Sanofi-Aventis, MSD, Boehringer-Ingelheim, Astra-Zeneca, Bristol-Myers Squibb, Esteve, Faes Farma, Almirall, Glaxo Smith Kline, Janssen-Cilag, Abbot y Ferrer. Investigador clínico de NovoNordisk, Lilly, Intarcia, Bristol-Myers Squibb, Boehringer-Ingelheim, Sanofi-Aventis, Glaxo Smith Kline, Astra-Zeneca, Amgen, Novartis.
P. Rozas: ponente/consultor de Astra-Zeneca, Boehringer-Ingelheim, Esteve, Ferrer, Faes Farma, Janssen-Cilag, Lilly, MSD, Novartis, NovoNordisk, Sanofi-Aventis.
JC Fernández: ponente/consultor: Astra-Zeneca, Boehringer-Ingelheim, Esteve, Lilly, NovoNordisk, Sanofi-Aventis. Becas de investigación: M, NovoNordisk.
A. Marco: ponente/consultor de Almirall, Astra-Zeneca, Boehringer-Ingelheim, Esteve, Faes Farma, Lilly, MSD, NovoNordisk, Sanofi-Aventis. Investigador clínico: Sanofi-Aventis.
J. Escalada: ponente/consultor de Astra-Zeneca, Boehringer-Ingelheim, Lilly, MSD, NovoNordisk, Sanofi-Aventis.
M. Gargallo: ponente/consultor de Astra-Zeneca, Boehringer-Ingelheim, Janssen-Cilag, Lilly, Sanofi-Aventis/Lilly, Sanofi-Aventis. Investigador clínico: Sanofi-Aventis.
M. Botana: ponente/consultor de Astra-Zeneca, Boehringer-Ingelheim, Esteve, Ferrer, Faes Farma, Janssen-Cilag, Lilly, Novartis, NovoNordisk, Sanofi-Aventis.
J. López y J.M. Gómez: ponente/consultor de Astra-Zeneca, Boehringer-Ingelheim, Esteve, Janssen-Cilag, MSD, NovoNordisk, Sanofi-Aventis. Investigador clínico: Janssen-Cilag.
E. Jódar: ponente/consultor de Almirall, Astra-Zeneca, Boehringer-Ingelheim, Ferrer, Faes Farma, Janssen-Cilag, Lilly, MSD, Novartis, NovoNordisk; investigador clínico: Astra-Zeneca, Boehringer-Ingelheim, Glaxo Smith Kline, Janssen-Cilag, Lilly, MSD, NovoNordisk, R, Sanofi-Aventis.
P. Mezquita: ponente/consultor de Lilly, Almirall, Novartis, NovoNordisk, Astra-Zeneca, Bristol-Myers Squibb, Esteve, MSD, Sanofi-Aventis, Faes Farma. Investigador clínico: Lilly, Roche, Sanofi-Aventis, NovoNordisk, MSD, Boehringer-Ingelheim, Theracos, Glaxo Smith Kline.
El documento completo puede consultarse en: http://www.seen.es/docs/apartados/355/2018%2005%2005%20Abordaje%20Integral%20DM2_SEEN_2018_GTDMSEEN%201.pdf.