El hiperaldosteronismo primario (HAP) es la causa más frecuente de hipertensión endocrina, con una prevalencia del 6-12% en pacientes hipertensos. El cociente aldosterona/renina es el método de cribado de elección. Dada la variabilidad de sus puntos de corte, se sugiere contar con valores de referencia propios.
Objetivos1) Optimizar los puntos de corte del cociente aldosterona/renina para el cribado de hiperaldosteronismo con la metodología actual; 2)evaluar la correlación y la sensibilidad diagnóstica de los cocientes aldosterona/actividad de renina plasmática (RAA) y aldosterona/concentración de renina (RAC) para el cribado de hiperaldosteronismo, y 3)determinar la prevalencia de hiperaldosteronismo en nuestra población.
Materiales y métodosSe determinaron los niveles de aldosterona (RIA competitivo en fase sólida RIAZENco Zentech), actividad de renina plasmática (RIA en fase sólida DiaSorin) y concentración de renina (quimioluminiscencia Liaison DiaSorin) en 345 sujetos (136 controles y 209 hipertensos). Se calcularon los cocientes RAA y RAC.
ResultadosLa prevalencia de HAP, tras confirmación diagnóstica, fue del 5,9% de los hipertensos. El valor de corte para sospecha de HAP determinado por curvas ROC fue 48,9(ng/dl)/(ng/ml/h) para RAA (sensibilidad 100% y especificidad 93,6%) y 2,3(ng/dl)/(μUI/ml) para RAC (sensibilidad 100% y especificidad 90,9%). Se observó buena correlación entre RAA y RAC (ρ=0,83; p<0,0001), con una concordancia diagnóstica presuntiva del 96,6%.
ConclusionesHemos determinado en nuestra población nuevos valores de corte de RAA y RAC para el cribado de HAP, con buena sensibilidad y concordancia como métodos de cribado. Es importante contar con rangos de normalidad propios para evitar errores diagnósticos.
Primary aldosteronism (PA) is the most common cause of endocrine hypertension, with a prevalence rate of 6-12% in hypertensive patients. Aldosterone/renin ratio (ARR) is the screening test of choice for PA. Because of the variable cut-off points of ARR, reference values related to the populations and methods considered are recommended.
Objectives(i)To optimize the ARR cut-off points for PA screening with current methods; (ii)to assess the correlation and diagnostic sensitivity of the plasma aldosterone concentration/plasma renin activity (ARR) ratio and the aldosterone concentration/renin concentration (ARC) ratios for PA screening, and (iii)to determine the prevalence of PA in our population.
Materials and methodsPlasma aldosterone concentration and plasma renin activity levels were measured using radioimmunoassays (RIAZENco Zentech and RIA DiaSorin respectively), while a chemiluminescence assay (Liaison Diasorin) was used to test renin concentration. ARR and ARC ratios were calculated in 345 subjects (136 healthy subjects and 209 hypertensive patients).
ResultsPrevalence of PA was 5.9% after diagnostic confirmation. ROC curve analysis suggested an ARR threshold of 48.9(ng/dL)/(ng/mL/h) (100% sensitivity, 93.6% specificity) and an ARC threshold of 2.3(ng/dL)/(μIU/mL) (100% sensitivity, 90.9% specificity). Good correlation was seen between ARR and ARC (ρ=.83, P<.0001), with a presumptive diagnostic concordance of 96.6%.
ConclusionsNew cut-off values of ARR and ARC for screening of PA, with high sensitivity and good diagnostic concordance, were determined in the study population. It is important to have valid normal ranges to avoid diagnostic errors.
El hiperaldosteronismo primario (HAP) es la causa más frecuente de hipertensión secundaria de origen endocrino; afecta al 6-12% de los pacientes hipertensos, con mayor prevalencia en los casos de hipertensión resistente al tratamiento (20%). Con iguales cifras de presión arterial, estos pacientes presentan mayor frecuencia de eventos cardiovasculares que aquellos con hipertensión esencial1.
El método de cribado de elección para el diagnóstico de HAP es el cociente aldosterona plasmática (A)/ renina (R). Esta última puede ser medida como actividad de renina plasmática (ARP), que es la capacidad para transformar angiotensinógeno en angiotensina o como concentración de renina (CR) plasmática inmunorreactiva dando lugar a los cocientes aldosterona/actividad de renina plasmática (RAA) y aldosterona/concentración de renina (RAC)2. La medición de la ARP se realiza a través de un radioinmunoensayo (RIA), método manual laborioso, complejo y dependiente del operador que dificulta la comparación de los resultados entre distintos laboratorios. En la actualidad contamos con métodos automatizados que cuantifican la masa de renina (CR), fáciles de implementar en el laboratorio clínico, con mejor reproducibilidad y menor demanda en el tiempo de procesamiento, pero con menor sensibilidad en valores bajos, según se ha referido3.
La falta de uniformidad en los protocolos de diagnóstico y métodos de laboratorio utilizados en la determinación de A y R implican una variabilidad sustancial en los valores de corte de RAA y RAC. Tanto las diferentes condiciones preanalíticas como la selección de pacientes, las variaciones en la R y A, la ubicación geográfica y el origen étnico determinan la marcada variedad de valores de corte del cociente RAA, que oscila entre 7,2 y 100,1(ng/dl)/(ng/ml/h)4, si bien la mayoría de los autores informan valores entre 20 y 40(ng/dl)/(ng/ml/h)2. Un estudio multicéntrico realizado por la Sociedad Argentina de Endocrinología (SAEM)5 determinó el valor de corte de RAA en 36(ng/dl)/(ng/ml/h) y de RAC en 2,39(ng/dl)/(μUI/ml), utilizando como metodologías para medición de A: RIA DPC (Diagnostic Product Corporation, CA, EE.UU.) y de CR: IRMA DSL (Diagnostic Systems Laboratories Inc., Tx, EE.UU.). Actualmente la metodología en nuestro servicio y en otros centros de referencia difiere de la referida en el estudio de SAEM, por lo cual es preciso contar con nuevos valores de referencia.
Los objetivos de este trabajo son:
- •
Optimizar los puntos de corte de RAA y RAC para el cribado de HAP, con la metodología actualmente en uso en nuestro hospital.
- •
Evaluar la correlación y la sensibilidad diagnóstica de RAA y RAC para el cribado de HAP.
- •
Determinar la prevalencia de HAP en nuestra población de hipertensos utilizando como valor de detección el referido en el trabajo de SAEM5.
Se realizó un estudio prospectivo de corte transversal en un hospital de la Ciudad Autónoma de Buenos Aires en el periodo 2015-2017 en el que fueron evaluados 345 sujetos de ambos sexos. Se incluyeron 136 controles sanos y 209 pacientes con diagnóstico de hipertensión arterial. Los criterios de exclusión fueron los siguientes: 1)menores de 18años; 2)embarazadas; 3)pacientes con endocrinopatías (disfunción tiroidea sin tratamiento adecuado, diabetes mellitus, hiperparatiroidismo, insuficiencia suprarrenal, feocromocitoma, síndrome de Cushing); 4)contraindicación cardiológica para modificar la medicación antihipertensiva que interfiera con las determinaciones bioquímicas (betabloqueantes, inhibidores de la enzima convertidora de angiotensina [IECA], antagonistas del receptor de angiotensina [ARAII], diuréticos) o de recibir dieta normosódica, y 5)insuficiencia renal, cardíaca o hepática.
Los sujetos incluidos fueron evaluados clínicamente con determinación de medidas antropométricas (peso, talla, índice de masa corporal [IMC] y presión arterial). La medición de la presión arterial se realizó con tensiómetros oscilométricos Omrom HEM-7200. Se registró la presión arterial según las normas de las Guías de la Sociedad Europea de Hipertensión Arterial6, con tres tomas en cada brazo promediadas: basal, a los 3 y a los 5min.
Se solicitaron determinaciones bioquímicas para la evaluación del sistema de renina-angiotensina-aldosterona (SRAA). Los pacientes con antecedentes de hipertensión arterial (HTA) bajo tratamiento antihipertensivo fueron evaluados por el servicio de HTA para determinar la factibilidad de modificar dicha medicación a fármacos que no interfieran con las mediciones de A y R. Se suspendieron los betabloqueantes, los IECA y los ARAII durante 2semanas, y los diuréticos durante 4-6semanas, y se cambiaron a calcioantagonistas (amlodipino) cuando no existió contraindicación desde el punto de vista cardiológico. Se suplementó con potasio en los casos necesarios. Se indicó cumplir dieta normosódica durante las 2semanas previas al estudio y se solicitó ionograma antes de la extracción de sangre. Las determinaciones se realizaron en condiciones de normokalemia.
Todos los sujetos incluidos dieron su consentimiento informado para participar en el estudio.
Métodos de laboratorioLa toma de muestra se hizo por la mañana, entre las 8:00 y las 9:00h, en condiciones de 2h posdeambulación, en un tubo con EDTA-K2. Tras la centrifugación, las muestras de plasma fueron alicuotadas y almacenadas inmediatamente a −20°C hasta su procesamiento. Cada alícuota fue descongelada una única vez. Se determinóA mediante un RIA competitivo en fase sólida (RIAZENco, Zentech SA, Bélgica), ARP usando un RIA en fase sólida (DiaSorin Inc, Estados Unidos) y CR mediante un método quimioluminiscente que utiliza una plataforma automatizada (LIAISON, DiaSorin, Saluggia, Italia). Se consideraron los siguientes rangos de referencia según las especificaciones del fabricante: A 3,8-30ng/dl, ARP 1,3-3,9ng/ml/h y CR 4,4-46,4μUI/ml.
Diseño del estudioPara el cribado de hiperaldosteronismo se calcularon: RAA mediante el cociente A (ng/dl)/ARP (ng/ml/h) y RAC mediante el cociente A (ng/dl)/CR (μUI/ml). La sospecha de HAP se basó en valores de RAA superiores a 36 (ng/dl)/(ng/ml/h) asociados con mediciones de aldosterona superiores o iguales a 15ng/ml (puntos de corte fijados en un estudio previo nacional)5, coincidente con lo referido en guías2 y bibliografía internacional7.
En los casos de RAA patológica, el diagnóstico de HAP fue confirmado mediante la realización de las pruebas de captopril y/o sobrecarga salina a fin de demostrar la falta de supresión en la producción de aldosterona2. La literatura actual no identifica ninguna prueba confirmatoria como estándar de oro. En nuestro servicio utilizamos de elección la prueba de captopril por mayor seguridad para el paciente, pero en algunos casos en que el captopril no está disponible en nuestro país y según el cuadro clínico del paciente, realizamos la prueba de sobrecarga salina.
En la prueba de sobrecarga salina8 se administran 2l de solución fisiológica (0,9%) por vía intravenosa en infusión de 4h. Las muestras de sangre para las determinaciones de ARP y A se obtuvieron al inicio de la prueba y a las 4h, con control estricto de la presión arterial. La prueba se considera positiva si los valores de A persisten por encima de 10ng/ml.
En la prueba de captopril9 se miden las concentraciones de A y ARP en condiciones basales y 1h después de administrar 50mg de captopril por vía oral. En condiciones normales la acción de este fármaco (IECA) provoca un descenso de las concentraciones de A y aumento de los valores de ARP. La prueba se considera positiva si los valores de A descienden menos del 30% respecto del valor basal y la ARP persiste suprimida. Cuatro pacientes efectuaron ambas pruebas.
En todos los pacientes con diagnóstico de HAP por prueba de confirmación patológica se realizó TAC de abdomen y cateterismo selectivo de venas adrenales cuando estaba indicado y fue posible realizarlo (33,3% de los pacientes).
Análisis estadísticoSe utilizó el software IBM SPSS versión 21. Se analizaron las diferencias entre los grupos de distribución no paramétrica utilizando los test de Mann-Whitney y de Kruskal-Wallis, el método de correlación de Spearman, y se calcularon las curvas ROC para definir los valores de corte de RAA y RAC.
Se evaluó la correlación entre RAA y RAC utilizando como parámetro la concordancia diagnóstica presuntiva (CDP)3. Esta se calculó como el porcentaje de muestras que, en función de sus datos de laboratorio, son igualmente clasificadas como menores o mayores al punto de corte establecido por la bibliografía5.
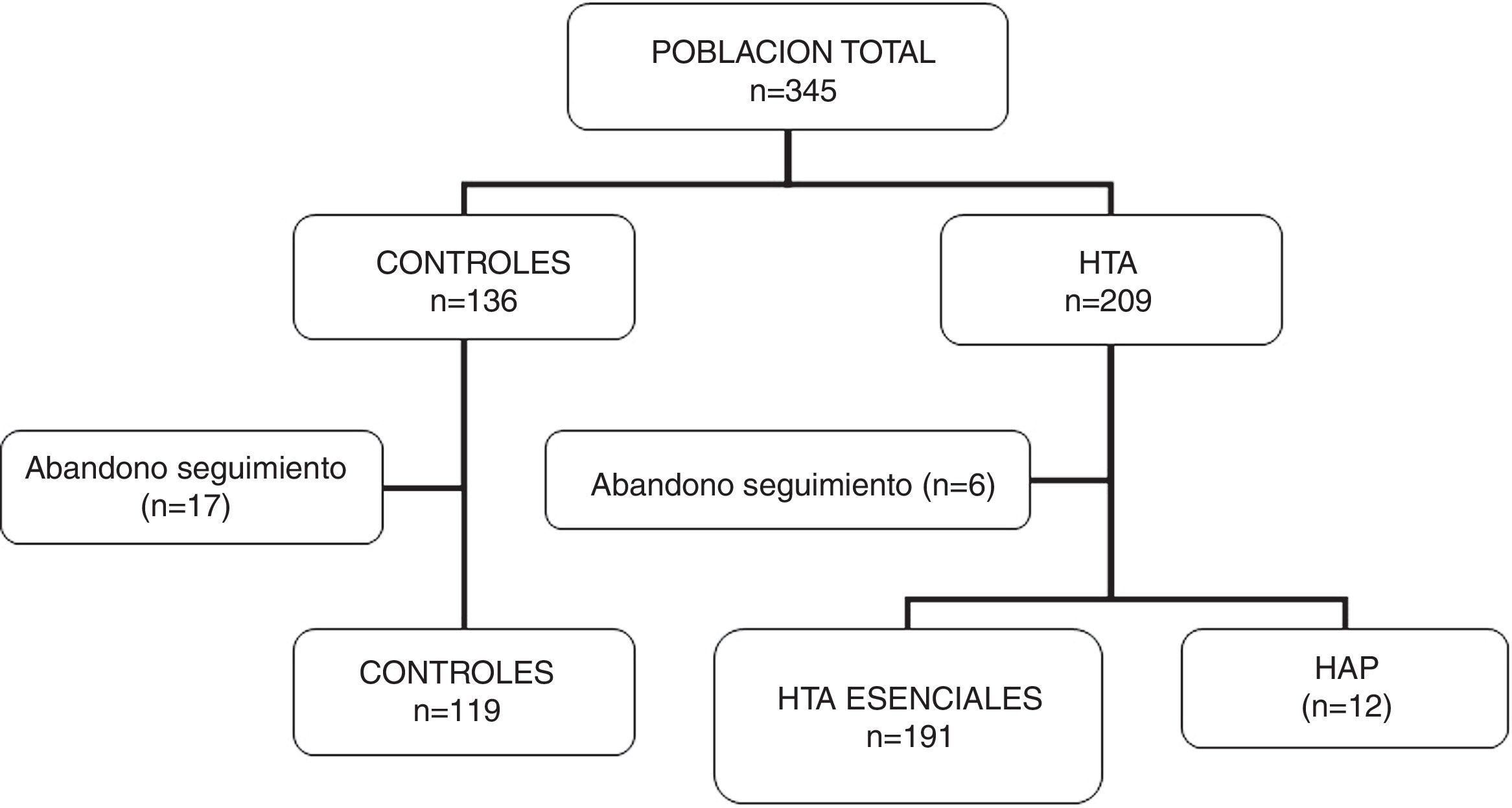
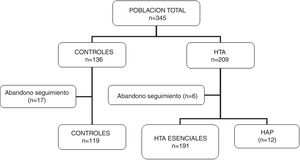
ResultadosParticiparon del estudio 345 sujetos (136 controles y 209 pacientes hipertensos), de los cuales 23 individuos fueron excluidos por abandono de seguimiento sin haber completado los estudios solicitados. Se incluyeron 322 para el análisis final (119 controles y 203 hipertensos). En este grupo de hipertensos se diagnosticaron 12 casos de HAP (5,9% de los hipertensos). En la figura 1 se muestran las características de la población en estudio.
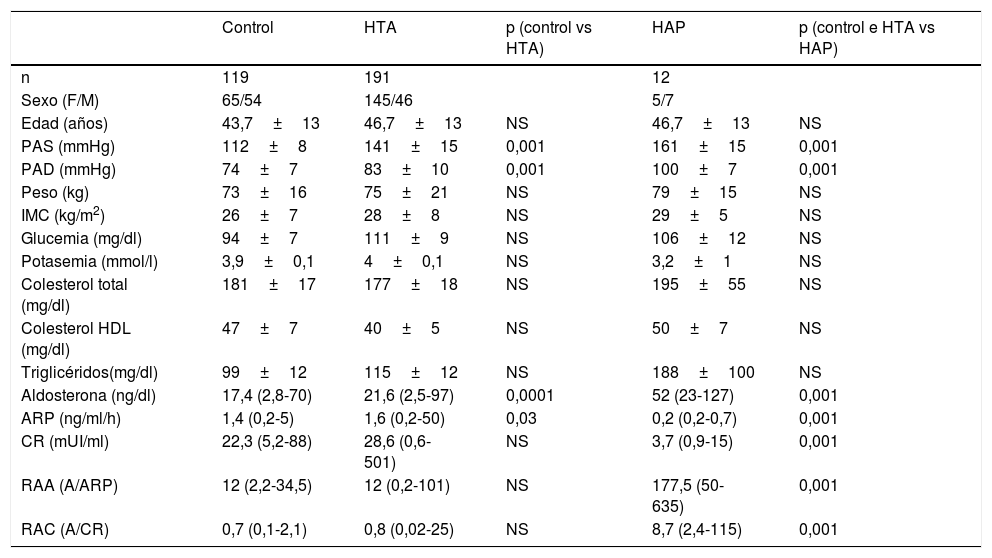
No hubo diferencias significativas en la edad ni en las características clínicas (peso, IMC) entre los grupos. Los registros de presión arterial fueron más altos en los pacientes hipertensos que en los controles y superiores en los HAP respecto a los controles e hipertensos esenciales. Los valores de glucemia, ionograma y lipidograma fueron similares en los tres grupos. En los pacientes con HAP las concentraciones séricas de potasio fueron más bajas que en los otros dos grupos, sin llegar a alcanzar significación estadística (p=0,06) (tabla 1).
Características de los sujetos incluidos en el estudio
| Control | HTA | p (control vs HTA) | HAP | p (control e HTA vs HAP) | |
|---|---|---|---|---|---|
| n | 119 | 191 | 12 | ||
| Sexo (F/M) | 65/54 | 145/46 | 5/7 | ||
| Edad (años) | 43,7±13 | 46,7±13 | NS | 46,7±13 | NS |
| PAS (mmHg) | 112±8 | 141±15 | 0,001 | 161±15 | 0,001 |
| PAD (mmHg) | 74±7 | 83±10 | 0,001 | 100±7 | 0,001 |
| Peso (kg) | 73±16 | 75±21 | NS | 79±15 | NS |
| IMC (kg/m2) | 26±7 | 28±8 | NS | 29±5 | NS |
| Glucemia (mg/dl) | 94±7 | 111±9 | NS | 106±12 | NS |
| Potasemia (mmol/l) | 3,9±0,1 | 4±0,1 | NS | 3,2±1 | NS |
| Colesterol total (mg/dl) | 181±17 | 177±18 | NS | 195±55 | NS |
| Colesterol HDL (mg/dl) | 47±7 | 40±5 | NS | 50±7 | NS |
| Triglicéridos(mg/dl) | 99±12 | 115±12 | NS | 188±100 | NS |
| Aldosterona (ng/dl) | 17,4 (2,8-70) | 21,6 (2,5-97) | 0,0001 | 52 (23-127) | 0,001 |
| ARP (ng/ml/h) | 1,4 (0,2-5) | 1,6 (0,2-50) | 0,03 | 0,2 (0,2-0,7) | 0,001 |
| CR (mUI/ml) | 22,3 (5,2-88) | 28,6 (0,6-501) | NS | 3,7 (0,9-15) | 0,001 |
| RAA (A/ARP) | 12 (2,2-34,5) | 12 (0,2-101) | NS | 177,5 (50-635) | 0,001 |
| RAC (A/CR) | 0,7 (0,1-2,1) | 0,8 (0,02-25) | NS | 8,7 (2,4-115) | 0,001 |
ARP: actividad de renina plasmática; CR: concentración de renina; F: femenino; HAP: hiperaldosteronismo primario; HTA: hipertensión; IMC: índice de masa corporal, peso/talla2; M: masculino; NS: no significativo estadísticamente; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RAA: cociente aldosterona/actividad de renina plasmática; RAC: cociente aldosterona/concentración de renina.
Los valores se expresan como media ±desviación estándar y las determinaciones del sistema de renina-angiotensina-aldosterona (SRAA), como mediana y rango.
Los resultados de las determinaciones del SRAA se muestran en la tabla 1. Al comparar el grupo control con pacientes hipertensos se detectaron diferencias significativas en los valores de A y ARP. Los pacientes hipertensos tuvieron valores más altos de A (p=0,0001) y menores de ARP (p=0,03), sin diferencias significativas en la CR ni en los cocientes RAA y RAC (tabla 1). Cabe mencionar que, a pesar de las diferencias encontradas entre controles e HTA, los valores individuales de las determinaciones en ambos grupos estuvieron dentro del rango normal.
En todos los pacientes del grupo control los cocientes RAA y RAC fueron normales. Entre los pacientes hipertensos se encontraron 39 cocientes patológicos, en los que se realizaron pruebas de confirmación. En este grupo, 27 fueron hipertensos esenciales y en 12 pacientes se confirmó el diagnóstico de HAP.
En el primer grupo se realizaron 25 pruebas de captopril y 2 de sobrecarga salina, siendo todas negativas.
Doce pacientes presentaron diagnóstico de HAP. En este grupo realizamos 7 pruebas de captopril, una prueba de sobrecarga salina y en 4 casos realizamos ambas pruebas. En estos últimos las pruebas fueron realizadas para confirmar los resultados, que en todos los casos fueron concordantes.
Se realizó cateterismo venoso en un tercio de los pacientes (4 casos) en distintos centros hospitalarios (porque dicho estudio no está disponible en nuestra institución), no mostrando selectividad. Por este motivo, basándonos en características clínicas y de imágenes, 6pacientes fueron sometidos a adrenalectomía unilateral. La anatomía patológica confirmó 3adenomas productores de aldosterona (APA), un carcinoma adrenal, un paciente con adenomas corticales múltiples y una que fue informada como suprarrenal normal (tras la cirugía la paciente normalizó transitoriamente los valores de aldosterona, pero persistió hipertensa). Cuatro pacientes se encuentran bajo tratamiento médico, con sospecha de hiperplasia bilateral idiopática (IHA). Dos pacientes tienen imagen compatible con adenoma en TAC, pero en ellos no fue posible realizar cateterismo (uno de ellos no aceptó ser sometido al procedimiento y el otro paciente tuvo contraindicación médica por antecedentes de enfermedad coronaria), por lo que se encuentran bajo tratamiento médico.
Los pacientes con HAP tuvieron una mediana (rango) de aldosterona de 52 (23-127) ng/dl, RAA de 177,5 (50-653) (ng/dl)/(ng/ml/h) y de RAC de 8,7 (2,4-115) (ng/dl)/(μUI/ml), que fue significativamente mayor que en los otros dos grupos.
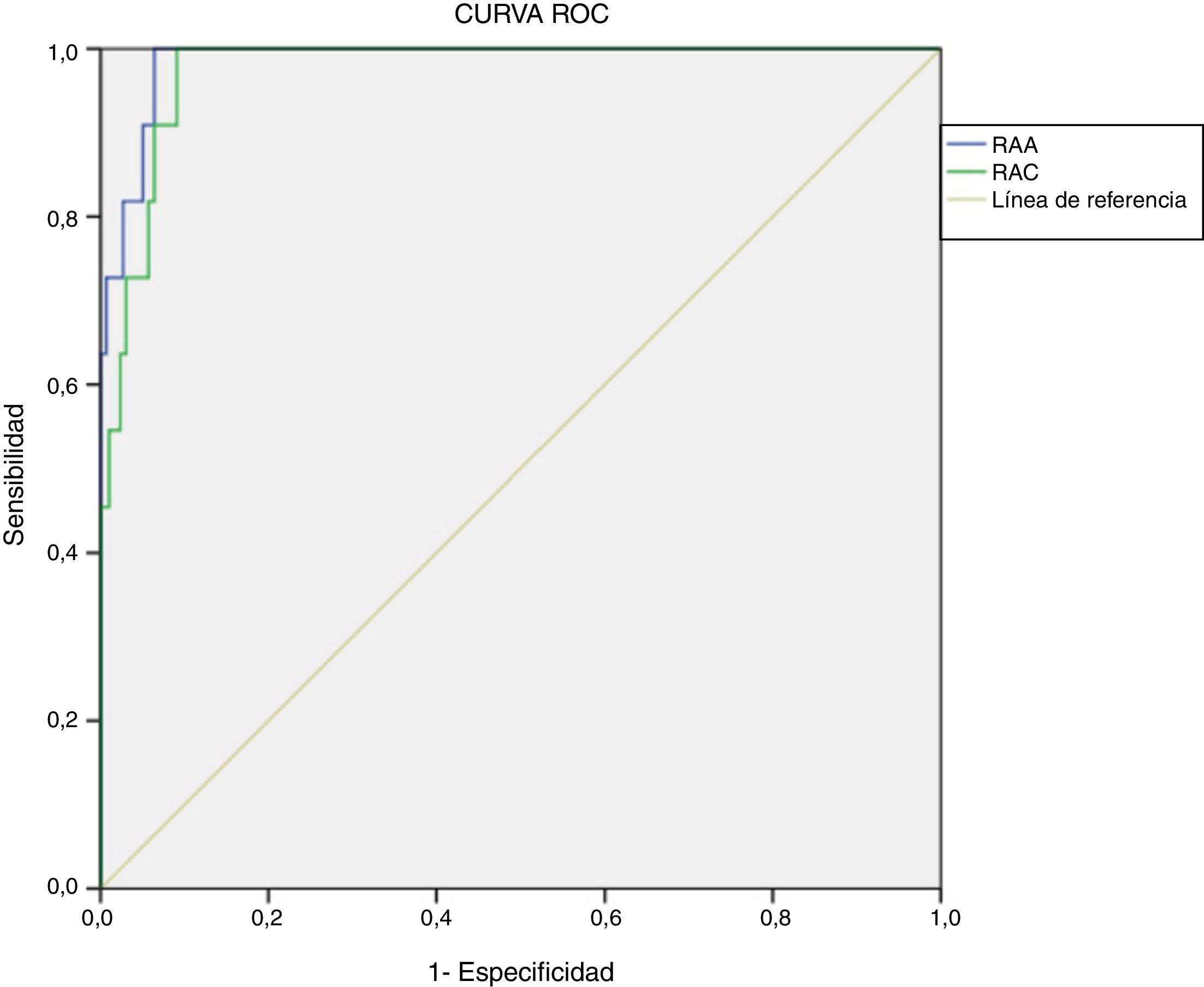
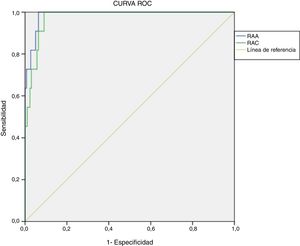
Determinación de puntos de corte con metodología actualRetrospectivamente, se calcularon curvas ROC para RAA (área bajo la curva=0,987, p<0,001, IC95%: 0,972-1,000) y RAC (área bajo la curva=0,975, p<0,001, IC95%: 0,954-0,996). El valor de corte óptimo, teniendo en cuenta la mejor relación de especificidad y sensibilidad, para diagnóstico presuntivo de HAP fue de 48,9(ng/dl)/(ng/ml/h) para la RAA (sensibilidad 100% y especificidad 93,6%) y de 2,3(ng/dl)/(μUI/ml) para la RAC (sensibilidad 100% y especificidad 90,9%) (fig. 2).
Para este valor de RAA el valor predictivo positivo (VPP) fue 37,50% (IC95%: 19,16-55,84%) y el valor predictivo negativo (VPN) 100% (IC95%: 99,83-100%), el índice de Youden (J) 0,94 (IC95%: 0,91-0,96). Con respecto a la RAC, el VPP fue 31,43% (IC95%: 14,62-48,24%) y el VPN 100% (IC95%: 99,82-100%), J=0,92 (IC95%: 0,89-0,95).
En todos los pacientes con RAA entre 36 y 48,9(ng/dl)/(ng/ml/h) las pruebas de confirmación realizadas fueron negativas.
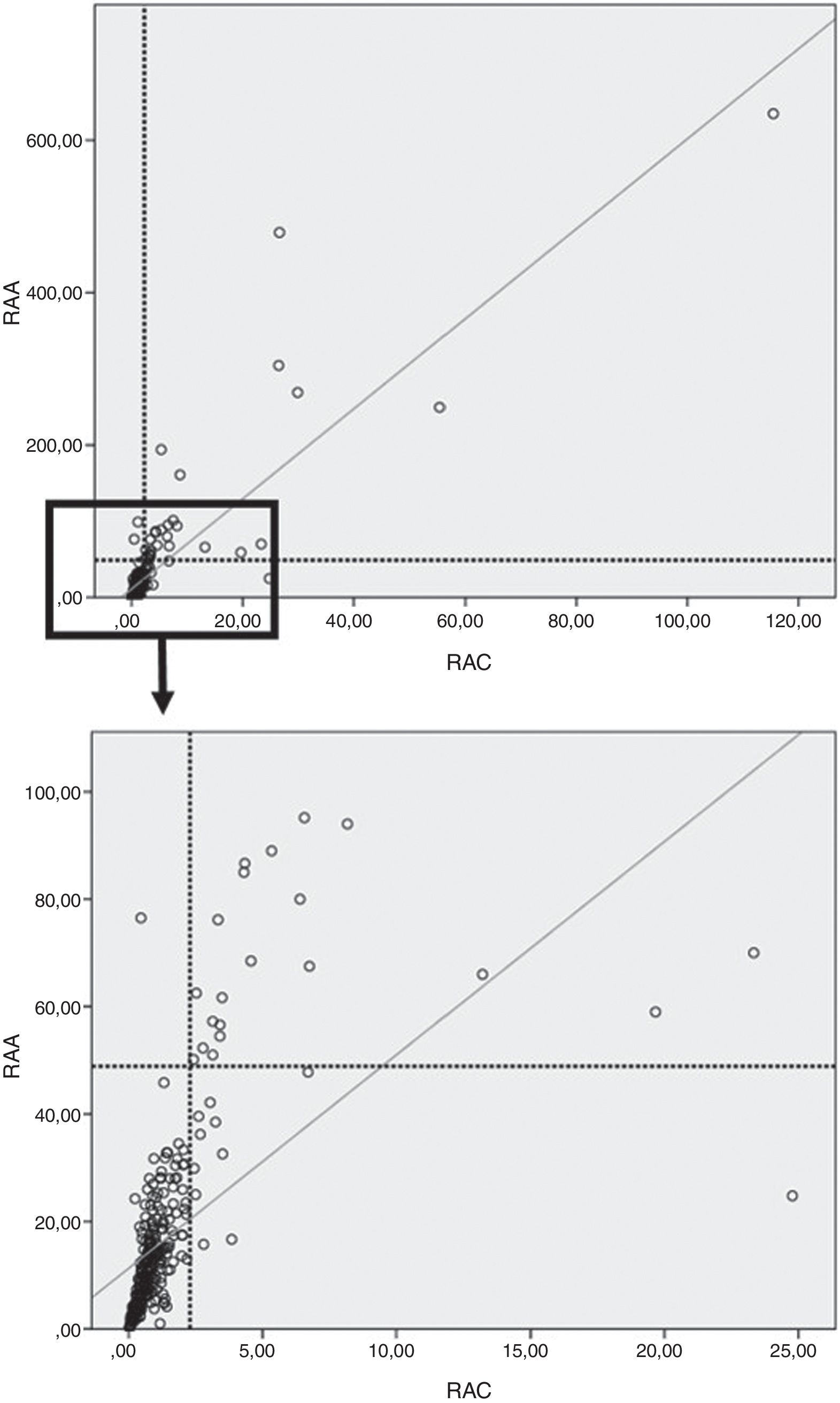
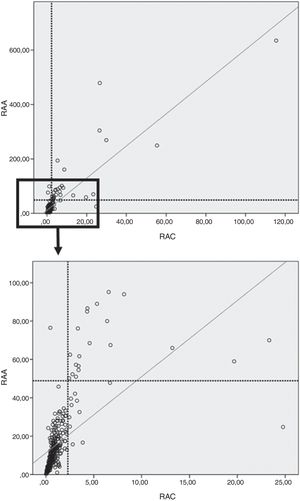
En nuestro trabajo, al evaluar la población total (controles, HTA esenciales y HAP) hubo una CDP entre RAA y RAC del 96,6%.
Se observó, además, una buena correlación entre RAA y RAC tanto en la población total (ρ=0,83; p<0,0001) (fig. 3) como en el grupo control (ρ=0,74; p<0,0001), HTA esenciales (ρ=0,85; p<0,0001) y HAP (r=0,89; p<0,0001).
DiscusiónEn este estudio definimos valores de corte de 48,9(ng/dl)/(ng/ml/h) para la RAA (sensibilidad 100% y especificidad 93,6%) y de 2,3 (ng/dl)/(μUI/ml) para la RAC (sensibilidad 100% y especificidad 90,9%), determinando una prevalencia de HAP en nuestra población del 5,9%, lo que coincide con lo descrito actualmente en la bibliografía2.
La detección temprana de HAP en pacientes hipertensos es fundamental para resolver la patología, y además permite revertir los daños orgánicos secundarios al exceso de aldosterona. El cociente A/R se utiliza ampliamente como una prueba de detección de HAP en pacientes hipertensos, pero es preciso disponer de determinaciones de alta sensibilidad para lograr este objetivo. Los rangos de las guías son amplios y variables, por lo que se sugiere que cada población tenga su valor de referencia propio. En las guías de la Endocrine Society2 el rango varía entre 20-40(ng/dl)/(ng/ml/h) para la RAA y entre 2,4-4,9(ng/dl)/(μUI/ml) para la RAC. La Sociedad Taiwanesa10 plantea iguales valores para RAA y un rango entre 2,4-7,7(ng/dl)/(μUI/ml) para la RAC. En 2009 la Sociedad Japonesa de Endocrinología11 planteó un valor de RAA mayor a 20(ng/dl)/(ng(ml/h) para sospecha de HAP, y en el Estudio PAPY12 (Prevalencia de HAP en Hipertensos) se utilizó un valor de RAA mayor a 40(ng/dl)/(ng(ml/h).
En el estudio multicéntrico realizado por la SAEM5 se fijaron valores de corte de 36(ng/dl)/(ng/ml/h) para la RAA y de 2,39(ng/dl)/(μUI/dl) para la RAC.
Con la población de HAP diagnosticados con pruebas de confirmación evaluamos retrospectivamente los puntos de corte a fin de optimizarlos acorde a nuestra metodología, definiendo nuevos valores de corte, que fueron de 48,9(ng/dl)/(ng/ml/h) para la RAA y de 2,3(ng/dl)/(μUI/ml) para la RAC. Consideramos que la diferencia de los puntos de corte de SAEM con nuestros resultados obedece fundamentalmente al cambio en la metodología con la evolución tecnológica, si bien no puede descartarse que pueda en parte deberse a la diferente población. Rossi et al.7, utilizando nuestra misma metodología, fijan valores de corte de RAA de 38,7(ng/dl)/(ng/ml/h) y de RAC entre 2 y 3(ng/dl)/(mU/l) con alta especificidad y sensibilidad. Los mismos son muy cercanos a los nuestros.
Cabe destacar que, al actualizar los valores de corte, podemos evitar realizar pruebas confirmatorias innecesarias. En esta población, comparando el punto de corte de RAA del trabajo de SAEM5 con el del presente estudio, se hubieran evitado el 18% de las pruebas de confirmación.
La determinación de concentración de renina que utilizamos en este estudio (quimioluminiscencia LIAISON, DiaSorin) es más fácil de implementar en el laboratorio clínico (por mejor reproducibilidad, menor tiempo de procesamiento e independencia del sustrato-angiotensinógeno), por lo que es la usada de rutina y desde hace algunos años por centros de referencia internacional con amplia experiencia en el tema7,13,14. Rossi et al.7 encontraron una excelente concordancia (r=0,92, p<0,0001) entre las mediciones de ARP y la CR, siendo la RAC superior a la RAA para la detección de APA en una población de hipertensos. Unger et al.15 también encontraron una muy buena correlación (r=0,91, p<0,001) entre ambas metodologías de medición de renina en una población de pacientes con incidentaloma adrenal sin suspensión de la medicación hipertensiva, afirmando la superioridad clínica de la CR dados los beneficios técnicos de esta determinación. En el estudio de Glinicki et al.16 se encontraron además muy buenas correlaciones entre RAA y RAC tanto en posición supina como a las 2h de bipedestación, similar a lo observado por Ferrari et al.17. En nuestro trabajo, RAA y RAC mostraron una muy buena correlación tanto en la población total como en los subgrupos analizados, con una CDP del 96,6%. Ambas áreas bajo la curva fueron comparables con sensibilidad y especificidad similares para la detección de HAP. Así, y teniendo en cuenta los beneficios técnicos previamente descritos y su estabilidad frente a las diferentes situaciones clínicas reportada por los autores, creemos que la RAC resulta una herramienta útil en la práctica clínica, equivalente o superior a la RAA.
Según nuestro conocimiento, este es el primer trabajo realizado en nuestro país con esta metodología de CR y RAC. Como fortalezas de nuestro trabajo cabe mencionar: 1)todos los pacientes fueron reclutados y estudiados en un mismo centro, lo que garantizó la uniformidad en el protocolo de diagnóstico, y 2)todos los pacientes fueron evaluados con ambas formas de medición de renina.
Por otra parte, debemos reconocer como debilidades: 1)el bajo número de pacientes hipertensos de sexo masculino; 2)no se realizaron pruebas confirmatorias en todos los pacientes evaluados (solo en pacientes con cocientes RAA y RAC patológicos), y 3)no se contó con diagnóstico anatomopatológico en el 100% de los pacientes con HAP.
ConclusionesHemos determinado en nuestra población nuevos valores de corte de RAA de 48,9(ng/dl)/(ng/ml/h) y RAC de 2,3(ng/dl)/(μUI/ml) para el cribado de HAP, encontrando una prevalencia de HAP del 5,9% tras la confirmación diagnóstica. A nuestro conocimiento, este es el primer trabajo realizado en nuestro país con metodología automatizada para la medición de renina (quimioluminiscencia LIAISON, DiaSorin), también utilizada en centros internacionales de referencia en el manejo de esta patología. En nuestra experiencia, RAA y RAC tuvieron muy buena sensibilidad y concordancia como métodos de cribado.
Se requiere ampliar el estudio con un mayor número de pacientes para confirmar los resultados obtenidos en el presente trabajo y evaluar el impacto de los mismos en el diagnóstico y tratamiento de los pacientes con hipertensión secundaria.
Conflicto de interesesNinguno.