Nuestro objetivo es evaluar la eficacia y la seguridad del tratamiento mediante inyección percutánea de etanol guiada por ecografía (IPE-US) de los quistes tiroideos sintomáticos en 2 consultas de alta resolución (CAR) de nódulo tiroideo de la Comunidad Valenciana.
Pacientes y métodosIncluimos 33 pacientes (51±12 años, 78% mujeres) con quistes tiroideos sintomáticos que recidivaron tras drenaje inicial, con citología benigna previa al procedimiento. Mediante ecografía medimos diámetros y volumen, aspiramos el contenido del quiste e instilamos entre 2 y 4ml de etanol (según volumen quístico). Realizamos seguimiento ecográfico al mes, 3, 6 y 12 meses, calculamos el volumen total y la tasa de reducción del volumen (TRV). Evaluamos el dolor percibido mediante una escala analógica visual.
ResultadosLa mediana del volumen inicial fue 11,6ml (8,5-16,5). Realizamos un único procedimiento de IPE-US en 22 casos (67%), 2 en 8 (24%) y 3 en 3 (9%). El 49% de los pacientes no experimentó dolor, dolor leve el 39% y moderado un 12%. No hubo ninguna otra complicación. A los 6 meses de seguimiento la mediana de la TRV fue del 93% (84-98). Se alcanzó una reducción superior al 50% en todos los casos, mayor al 70 en el 94% y mayor del 90 en el 56%. Completaron 12 meses de seguimiento 24 pacientes, siendo su TRV del 97% (93-98).
ConclusionesLa IPE-US es eficaz y segura en el tratamiento de quistes tiroideos sintomáticos, por lo que puede ser considerada como primera línea de tratamiento e incluirse en la cartera de servicios de una CAR de nódulo tiroideo.
Our aim was to evaluate the efficacy and security of ultrasound-guided percutaneous ethanol injection therapy (US-PEIT) for the treatment of recurrent symptomatic thyroid cysts in two high-resolution consultations of thyroid nodule in the Valencian Community.
Patients and methodsThe study comprised thirty-three consecutive patients (51±12 years, 76% women) with symptomatic benign thyroid cysts relapsed after drainage and benign cytology prior to treatment. Through ultrasound, maximum cyst diameter and volume were determined, and the content of the cyst was drained. We then instilled between 2 and 4mL of ethanol (according to initial volume). We followed up with ultrasound at one, 3, 6 and 12 months and we calculated the total volume and the Volume Reduction Rate (VRR). We evaluated the perceived pain using a visual analog scale.
ResultsThe initial median cyst volume was 11.6mL (8.5-16.5) A single session of US-PEIT was required in 22 patients (67%), two in 8 (24%) and three in 3 (9%). During PEIT, 49% of the patients experienced virtually no pain, 39% mild pain and 12% moderate pain. There were no complications. After 6 months of follow up the median VRR was 93% (84-98). All the patients achieved a volume reduction of more than 50%, 94% of more than 70% and 56% of more than 90%. Twenty-four patients completed a year of follow-up, achieving a VRR of 97% (93-98).
ConclusionsIn our experience US-PEIT has proven to be an effective, safe treatment of symptomatic thyroid cysts. For this reason it can be considered as the first line of treatment and included in the portfolio of services of a high-resolution consultation.
La prevalencia de nódulos tiroideos palpables es del 5% en mujeres y del 1% en varones en zonas iodo-suficientes. Sin embargo, la utilización de equipos de ultrasonidos de alta resolución permite detectar nódulos tiroideos entre un 19-68% de la población, con mayor frecuencia en mujeres y en ancianos1. Aproximadamente el 15-25% de los nódulos son predominantemente quísticos. Basándonos en criterios ecográficos, hablamos de quistes puros cuando el contenido quístico del nódulo es superior al 90%, y de predominio quístico cuando el contenido quístico es del 50-90%2. Los quistes tiroideos son en general benignos, pero pueden requerir tratamiento por provocar síntomas compresivos o molestias estéticas. Tras drenaje percutáneo la recurrencia del quiste se observa en más del 80% de los casos3. El tratamiento quirúrgico ha sido la primera línea de tratamiento de los quistes tiroideos recurrentes. Sin embargo, los trabajos iniciales de Verde et al.4 y Zingrillo et al.5, demuestran que la inyección percutánea de etanol guiada por ecografía (IPE-US) es una alternativa eficaz y segura al tratamiento quirúrgico. La inyección de etanol al 96-99% en la cavidad del quiste induce trombosis de los pequeños vasos y necrosis coagulativa en la pared del quiste, con edema intersticial e inflamación granulomatosa, seguida de fibrosis, contracción y disminución en el volumen de la lesión5,6. La IPE-US se recomienda en lesiones quísticas que ocupen más del 60% del volumen total del nódulo, y se considera terapéuticamente exitosa cuando consigue una tasa de reducción del volumen (TRV) superior al 50% del volumen inicial del quiste6.
En los últimos años, numerosos grupos han publicado su experiencia, con un porcentaje de éxito entre el 70 y el 100%, y con unas TRV entre el 70 y el 90%7–11. Además, la técnica es segura para los pacientes, siendo bien tolerada, provocando escaso dolor, complicaciones en general ausentes, mejorando la calidad de vida de los pacientes12,13. En este sentido, las últimas actualizaciones de las principales guías de las sociedades científicas posicionan la IPE-US como primera línea para el tratamiento de los quistes tiroideos recurrentes tras drenaje inicial1,2. Sin embargo, son pocos los grupos que han comunicado sus resultados tras introducir esta técnica en su práctica clínica, con el objetivo principal de ofrecer una alternativa al tratamiento quirúrgico en los pacientes con esta enfermedad1,14.
El objetivo de nuestro estudio es analizar los resultados de nuestra experiencia en el tratamiento con IPE-US de los quistes tiroideos sintomáticos recurrentes en 2 consultas de alta resolución (CAR) de nódulo tiroideo de 2 hospitales de la Comunidad Valenciana, para valorar la inclusión de dicho procedimiento como primera línea de tratamiento en nuestra cartera de servicios.
Pacientes y métodosSeleccionamos 33 pacientes de forma consecutiva atendidos en las CAR de nódulo tiroideo del Hospital General Universitario de Castellón y el Hospital Universitario Doctor Peset de Valencia entre octubre de 2017 y junio de 2019. Todos los pacientes presentaban nódulos tiroideos de al menos 5ml de volumen, con una proporción de componente quístico superior al 80% del volumen total. Los quistes recidivaron tras al menos una aspiración del contenido, y presentaban clínica compresiva o molestias estéticas. Todos los pacientes completaron un seguimiento de al menos 6 meses.
Los pacientes incluidos en el estudio debían ser mayores de 18 años, no presentaban comorbilidades mayores, ni historia de irradiación en cuello, tratamiento con radioyodo o cirugía previa. En todos los casos se realizó una historia clínica, una exploración física y se obtuvieron muestras de sangre para determinaciones de laboratorio. Todos los pacientes presentaron niveles normales de TSH y tiroxina libre en situación basal. Así mismo, todos recibieron explicación detallada del procedimiento y firmaron un consentimiento informado. El estudio fue conducido de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité de Ética del Hospital General Universitario de Castellón.
Ecografía tiroideaLa ecografía, el drenaje inicial y la IPE-US fueron realizados por un examinador experto en ecografía tiroidea en cada centro hospitalario utilizando una sonda lineal de 12-15MHz. Ambos examinadores estaban acreditados por la Sociedad Española de Endocrinología y Nutrición (SEEN) en ecografía cervical y técnicas por ultrasonidos en el nivel II-intermedio15. Realizamos una evaluación morfológica de la glándula tiroidea, incluyendo la ecoestructura, la ecogenicidad, medimos los diámetros y valoramos las características ecográficas de cada nódulo detectado. En caso de detección de nódulos tiroideos, realizamos PAAF de los mismos de acuerdo con los criterios ACR TI-RADS 201716.
El volumen del quiste fue calculado utilizando el modelo elipsoide. Multiplicamos los 3 diámetros (transverso, anteroposterior y longitudinal) expresados en centímetros, y el resultado se multiplicó por la constante 0,52417. En todos los quistes realizamos punción aspiración con aguja fina (PAAF) de la cápsula o de la parte sólida del quiste, y otra punción para el drenaje del contenido quístico. El drenaje fue realizado con una aguja de 21G conectada a una jeringa de 20ml. El estudio citológico fue de benignidad en todos los casos.
Procedimiento de la inyección percutánea de etanolSe ofreció la realización de IPE-US si el quiste presentaba crecimiento significativo tras el primer drenaje, presentaba síntomas compresivos o molestias estéticas. Además, los pacientes prefirieron no someterse a cirugía tras explicar en detalle el procedimiento. El procedimiento fue similar al descrito por Reverter et al.12, modificando la cantidad de etanol administrada, que fue algo superior, según aconsejan otros autores11,13, En función del volumen aspirado la cantidad de etanol administrada fue: Volumen aspirado <10ml: 2ml de etanol; entre 10 y 14,9ml: 2,5ml; entre 15 y 19,9ml: 3ml; entre 20 y 30ml: 3,5ml; si> 30ml: 4ml de etanol.
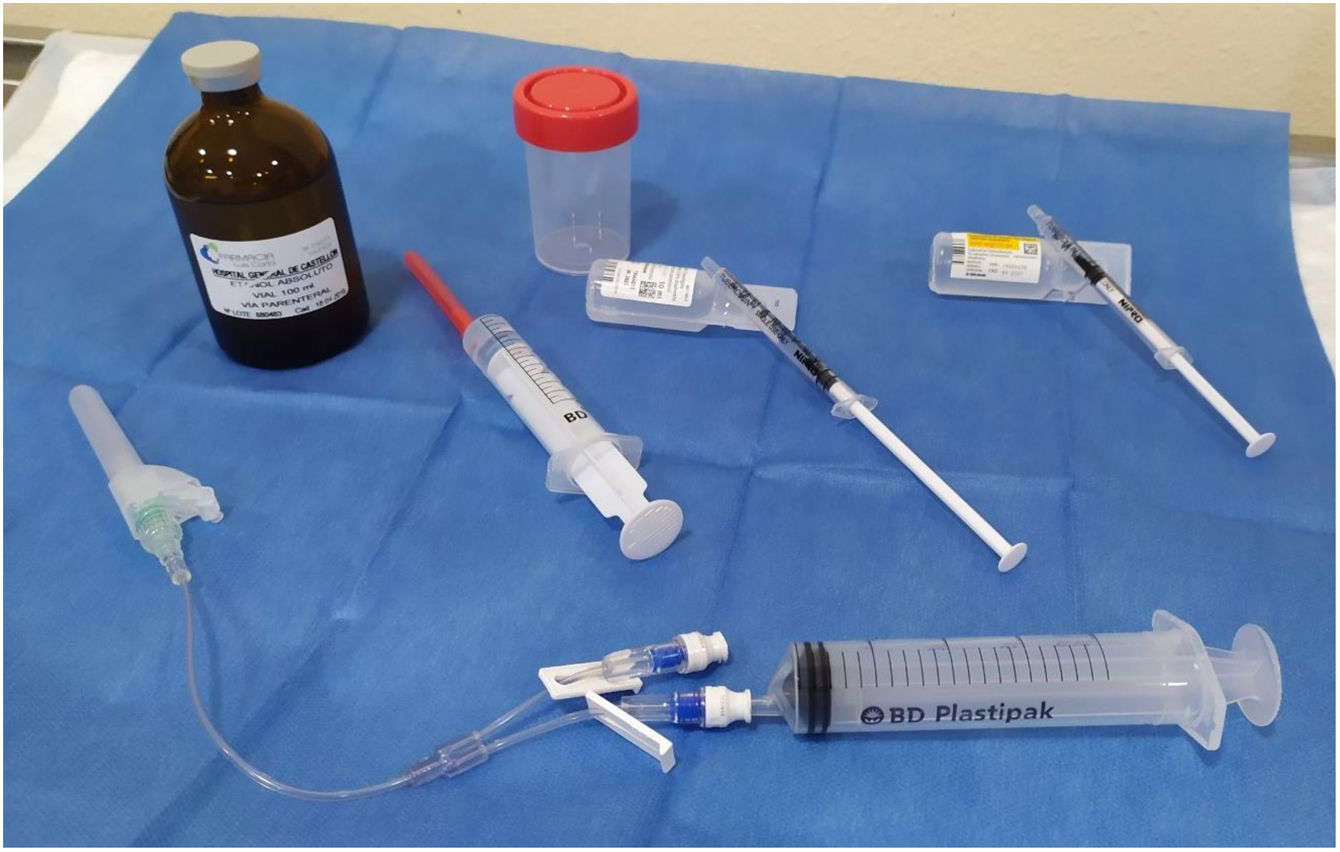
Los materiales utilizados se exponen y detallan en la figura 1. Los pacientes mantuvieron la misma posición que en la PAAF, tumbados en posición supina con el cuello en hiperextensión. Tras esterilización de la piel, empleamos una aguja de 21G montada sobre un conector alargadera con 2 luces, una conectada a una jeringa de 20ml para el drenaje del quiste, y la otra para la administración de lidocaína y etanol. Drenamos el quiste, dejando una mínima cantidad de coloide para visualizar correctamente la punta de la aguja y orientando la punta de la aguja en sentido opuesto a la localización del nervio recurrente. Tras retirar la jeringa, por la otra luz administramos 0,5ml de lidocaína al 5%. A los 2min, se reemplazó la jeringa con lidocaína por otra conteniendo etanol al 96%, el cuál fue inyectado lentamente, en pequeños bolos de 0,5ml. En una única aplicación, se administraron entre 2 y 4ml de etanol, una cantidad aproximada al 15-25% del volumen inicial del quiste (2, 2,5, 3, 3,5 o 4ml según el volumen inicial del quiste fuera, respectivamente <10ml, entre 10 y 14,9, entre 15 y 19,9, entre 20 y 30 o >30ml). La punta de la aguja no dejó de visualizarse durante todo el procedimiento y el etanol introducido no fue aspirado posteriormente en ningún caso. El paciente fue instruido para indicar cualquier tipo de dolor con el fin de evitar la salida del alcohol hacia las estructuras del cuello. Además, para evitar la salida de etanol del quiste, la retirada de la aguja se realizó en inspiración profunda. Todos los pacientes permanecieron en observación durante 30min antes de recibir el alta. Ambos examinadores realizaron juntos dos procedimientos, uno en cada centro para garantizar la realización del mismo protocolo y la utilización del mismo material en ambos hospitales.
Material utilizado para el drenaje y la inyección percutánea de etanol. Abajo, jeringa de 21G, conector alargadera con 2 luces, una para drenaje y otra para inyección. A nivel intermedio de izquierda a derecha jeringa con etanol, jeringa con suero salino para lavado y jeringa con 0,5ml de lidocaína al 5%. Arriba etanol absoluto para utilización parenteral y bote estéril para depósito del líquido quístico drenado.
Durante las visitas de seguimiento, la reducción del volumen del quiste fue estimada mediante la TRV calculada mediante la siguiente fórmula: {(Volumen inicial-Volumen final)/Volumen inicial}×1009. La TRV fue evaluada mediante control ecográfico al mes, 3 y 6 meses tras la última IPE-US. A los 12 meses se realizó un último control para confirmar la resolución del quiste. En caso de falta de respuesta, considerada como una reducción de volumen inferior al 50% confirmada ecográficamente en el control de los 3 o 6 meses, realizamos una nueva IPE-US, debiendo haber transcurrido un mínimo de 3 meses desde el anterior procedimiento. Del mismo modo si en el control de los 3 o 6 meses, el volumen era superior a los 5ml, o persistían los síntomas, se proponía una nueva IPE-US aunque la TRV fuera superior al 50%.
Valoración del dolorLos pacientes fueron preguntados por el grado de sensación de dolor experimentado tras la instilación de alcohol inmediatamente tras la finalización del procedimiento, utilizando una escala analógica visual (EAV) de 10cm, considerando como 0 la ausencia de dolor y 10 como un dolor insoportable. Al paciente se le pide que indique sobre esta línea donde se sitúa la intensidad de su dolor. La distancia hasta la marca numérica del paciente cuantifica la intensidad de su dolor, estableciendo el tercio inferior como dolor leve, el tercio medio como dolor moderado, y el tercio superior como dolor grave.
Análisis estadísticoEl análisis estadístico de los datos se realizó con el programa STATA v.14. La práctica totalidad de los parámetros analizados, no presentaba una distribución normal según el test de Shapiro-Wilk. Por tanto, los valores fueron expresados como mediana y rango intercuartil (percentil: 25-75). Para comparar los cambios entre el volumen inicial del quiste y la TRV al mes, 3 y 6 meses de la IPE-US utilizamos la prueba U de Mann-Whitney. Para los estudios de correlación utilizamos el test de correlación de Spearman. Consideramos estadísticamente significativo un valor de p<0,05, y una correlación significativa un coeficiente de correlación de Spearman>0,25.
ResultadosRealizamos drenaje inicial de 40 quistes tiroideos, de los cuales 33 recidivaron y fueron sintomáticos (82% de recurrencia), con un volumen superior a 5ml, incluyéndose en el protocolo de estudio (6 varones y 27 mujeres). La edad media fue de 51,1±12,5 años. En todos los casos las hormonas tiroideas fueron normales y la citología benigna. La mediana del volumen inicial calculado de los quistes antes del procedimiento fue de 11,6ml (8,5-16,5) y la mediana del diámetro máximo fue de 3,5cm (3,0-4,3). El volumen aspirado fue 9ml (6-15) y el volumen de etanol inyectado fue de 2,5ml (2-3). La mediana de los procedimientos realizados fue 1 IPE-US (1-2), (media de 1,4±0,6 IPE-US), requiriendo una única IPE-US 22 pacientes (67%), dos 8 pacientes (24%) y tres 3 pacientes (9%). En ningún caso realizamos más de 3 IPE-US. No encontramos diferencias en el volumen inicial del quiste entre los pacientes a quién realizamos una IPE-US y en los que realizamos 2 o 3 (11,7 [8,4-20,2] y 11,5 [8,8-15,8], respectivamente, NS). Todos los pacientes que requirieron más de una IPE-US presentaron recurrencia en el control del primer mes de seguimiento.
La sensación de dolor recogida durante el procedimiento de IPE-US mediante EAV de 10cm fue de 1 (1-3), (media: 1,9±1,4cm), virtualmente ausente en 16 (49%), leve en 13 (39%) y moderada en 4 casos (12%). Ningún paciente refirió dolor intenso ni presentó otras complicaciones, y tan solo 2 pacientes refirieron persistencia del dolor tras la IPE-US, y necesidad de tratamiento con antiinflamatorios no esteroideos, aunque en ninguno de los casos el dolor perduró más allá de las 24h.
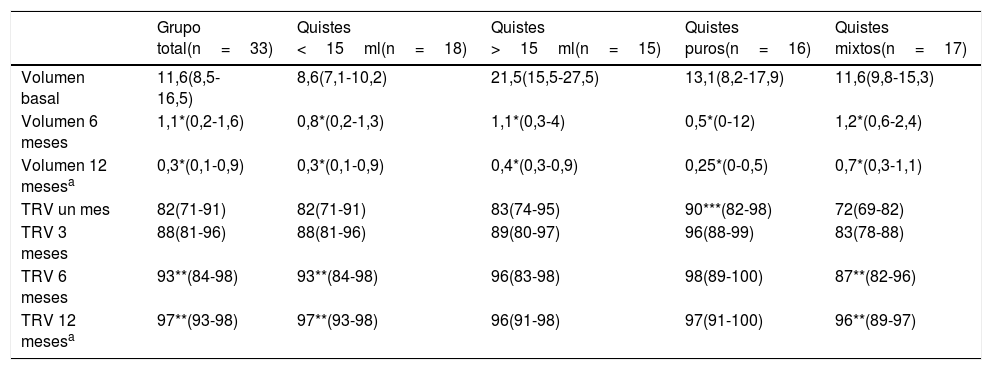
En todos los casos la IPE-US fue eficaz, consiguiendo la reducción del volumen del quiste en más de un 50%, y la ausencia de recurrencia durante el seguimiento. El volumen de los quistes a los 6 meses del procedimiento fue de 1,1ml (0,2-1,6) y el diámetro mayor a los 6 meses de seguimiento fue de 1,6cm (0,6-2,1). La TRV fue del 82% (71-91) el primer mes, del 88% (81-96) al tercer mes y del 93% (84-98) a los 6 meses, siendo estadísticamente significativa la diferencia entre la TRV el primer y el sexto mes (p<0,01) (tabla 1). En todos los casos se alcanzó una TRV>50%, siendo mayor del 70% en 31 casos (94%), mayor del 80% en 28 (82%), mayor al 90% en 19 (56%) y una desaparición completa en 6 casos (18%). En 24 pacientes se completó el seguimiento 12 meses, sin observar cambios significativos respecto al control de los 6 meses (volumen 12 meses: 0,3ml [0,1-0,9]; TRV 12 meses 97% [93-98]) y en ningún caso existió aumento de tamaño o reaparición del quiste entre los 6 y 12 meses.
Resultados de la IPE-US de acuerdo a las características del nódulo
| Grupo total(n=33) | Quistes <15ml(n=18) | Quistes >15ml(n=15) | Quistes puros(n=16) | Quistes mixtos(n=17) | |
|---|---|---|---|---|---|
| Volumen basal | 11,6(8,5-16,5) | 8,6(7,1-10,2) | 21,5(15,5-27,5) | 13,1(8,2-17,9) | 11,6(9,8-15,3) |
| Volumen 6 meses | 1,1*(0,2-1,6) | 0,8*(0,2-1,3) | 1,1*(0,3-4) | 0,5*(0-12) | 1,2*(0,6-2,4) |
| Volumen 12 mesesa | 0,3*(0,1-0,9) | 0,3*(0,1-0,9) | 0,4*(0,3-0,9) | 0,25*(0-0,5) | 0,7*(0,3-1,1) |
| TRV un mes | 82(71-91) | 82(71-91) | 83(74-95) | 90***(82-98) | 72(69-82) |
| TRV 3 meses | 88(81-96) | 88(81-96) | 89(80-97) | 96(88-99) | 83(78-88) |
| TRV 6 meses | 93**(84-98) | 93**(84-98) | 96(83-98) | 98(89-100) | 87**(82-96) |
| TRV 12 mesesa | 97**(93-98) | 97**(93-98) | 96(91-98) | 97(91-100) | 96**(89-97) |
IPE-US: inyección percutánea de etanol guiada por ecografía; TRV: tasa de reducción de volumen.
Valoramos las posibles diferencias entre los quistes según fueran puros o mixtos o su volumen inicial fuera mayor o menor de 15ml (tabla 1). Con respecto a las características del quiste, 16 fueron quistes puros y 17 mixtos de predominio quístico. No hallamos diferencias en ninguna de las características analizadas excepto en la TRV el primer mes, que fue superior en los quistes puros frente a los mixtos (90 [82-98] vs. 72% [69-82]; p<0,01). Aunque la TRV siempre fue superior en los quistes puros frente a los mixtos, a partir del tercer mes esta diferencia no alcanzó la significación estadística. No hallamos diferencias en el número de procedimientos necesarios de IPE-US entre quistes puros y mixtos. La TRV entre el primer y sexto mes fue significativamente superior en quistes mixtos (72 [69-82] vs. 87% [82-96]; p<0,01), pero no en los puros. No hallamos diferencias en las variables analizadas entre los quistes menores de 15ml (n=18) y mayores de 15ml (n=15), salvo en la cantidad de etanol administrada, ya que ésta estaba condicionada por el volumen del quiste (2 [2,0-2,4] vs. 3ml [2,5-3,5]; p<0,001). La respuesta inicial fue discretamente superior en los quistes mayores de 15ml frente a los menores, sin alcanzar la significación estadística. Sí fue estadísticamente significativa la TRV entre el primer y sexto mes en los quistes menores de 15ml (80 [71-86] primer mes vs. 93% [86-97] sexto mes; p<0,01).
En el estudio de correlación no hallamos ninguna asociación entre las distintas variables estudiadas.
DiscusiónEn nuestra experiencia los quistes tiroideos benignos sintomáticos que recidivan tras un drenaje inicial tratados con IPE-US muestran una reducción media de volumen del 89% a los 6 meses del tratamiento, y de un 93% a los 12 meses, sin presentar complicaciones, confirmando que se trata de un procedimiento eficaz, seguro y bien tolerado por los pacientes, que puede realizarse de forma ambulatoria y, por tanto, debe considerarse como primera línea de tratamiento como alternativa a la cirugía. Los datos publicados en la literatura demuestran que mediante la IPE-US se consigue una reducción de volumen significativa, e incluso la reabsorción completa de los quistes tiroideos, sin apenas efectos adversos8,11,13. De hecho, en su última actualización, las Guías de la American Thyroid Association y las de la American Association of Clinical Endocrinologists/Assoziacione Medici Endocrinologi recomiendan la IPE-US como primera línea de tratamiento para las lesiones tiroideas quísticas1–14.
El drenaje de los quistes tiroideos es un tratamiento poco eficaz ya que el porcentaje de recurrencias es de aproximadamente el 80%7,18. En nuestra experiencia la recurrencia tras drenaje inicial fue del 82%. Por otra parte, el tratamiento mediante IPE-US ha mostrado superioridad frente al drenaje único (85,6 vs. 7,3%)4,10 y frente a la inyección de suero salino (82 vs. 48%)7.
En amplias cohortes como la publicada por Lee y Ahn9 (n=432), Halenka et al.11 (n=200) y Negro et al.13 (n=101) la TRV de los quistes tratados mediante IPE-US se situó entre el 73 y el 95%. Además, la IPE-US es un tratamiento eficaz a largo plazo. Raggiunti et al. observaron una reducción del 93% del volumen tras 7 años de seguimiento19. En nuestro estudio la TRV fue del 89% a los 6 meses y del 93% al año, en la línea de los publicado en estas amplias series, y también de los datos comunicados por Reverter et al. en un estudio de 30 pacientes realizado en España12.
No existe un protocolo definido para el procedimiento de IPE-US, actualmente se mantienen algunas controversias fundamentalmente en lo referente a la aspiración o no del etanol inyectado, al volumen de etanol administrado, y en la utilización o no de anestésico local. En las publicaciones iniciales el procedimiento IPE-US se realizaba inyectando un volumen relativamente grande de alcohol (50-100% del volumen aspirado) reabsorbiendo el alcohol tras dejarlo unos minutos en el interior del quiste4,6,10,18,20. Sin embargo, en los trabajos más recientes, la cantidad inyectada de alcohol es menor y no se aspira el alcohol una vez inyectado. Kim et al. compararon la aspiración o no del etanol inyectado en 60 quistes tiroideos8. Si bien ambas aproximaciones consiguieron resultados similares en cuanto a la reducción del volumen inicial, la aspiración requirió un tiempo medio del procedimiento de 14min superior a la no aspiración y precisó de una segunda punción, presentando un mayor riesgo de hemorragia intraquística durante el procedimiento (23 vs. 3%). En los últimos años, prácticamente todos los trabajos publicados realizan la IPE-US sin aspiración del etanol inyectado11–13.
Mayor controversia existe respecto al volumen de etanol inyectado por sesión. Reverter et al. comunican excelentes resultados inyectando un máximo de 2ml de etanol por sesión12. Otros grupos utilizan un volumen de etanol también pequeño, pero individualizado, entre un 15 y un 25% del volumen inicial del quiste11,13,19. Nosotros no aspiramos el etanol inyectado y utilizamos un volumen mínimo de etanol de 2ml para quistes de 5ml y un máximo de 4ml de etanol para quistes mayores de 30ml. En nuestra opinión, siguen siendo volúmenes pequeños de etanol, con lo que mantenemos la seguridad para el paciente, pero podrían permitir reducir el número de procedimientos IPE-US. En este sentido Reverter et al. administrando 2ml en todos los casos, realizaron un único procedimiento IPE-US en el 45% de pacientes, 2 en el 31% y 3 en el 13%. Ellos encuentran una asociación entre el volumen inicial y el número de procedimientos realizados, siendo necesarios 3 o más si los quistes eran superiores a 30ml12. Negro el al. administran un volumen de etanol también pequeño, pero ajustado al volumen inicial del quiste, empleando un volumen de etanol medio de 1,6, 2,8 y 3,4ml según el volumen del quiste fuera menor de 10ml, entre 10-20ml o entre 20-30ml, realizan una única IPE-US en un 86, 56 y 61%, respectivamente13. En nuestro estudio con una aproximación muy parecida a la de Negro et al. el 67% de los pacientes requirieron una única IPE-US. Pensamos que nuestros buenos resultados, además de por el volumen de etanol administrado podrían deberse a que no incluimos quistes extremadamente grandes (>100ml) y tan solo 3 quistes eran mayores a 30ml.
Aunque algunos estudios concluyen que el volumen inicial del quiste es el único factor que influye en la TRV10,12,18, otros autores reportan mejores resultados en quistes menores de 10ml6,7,20. Sí que parece existir una clara asociación entre volumen inicial del quiste y número de procedimientos necesarios12,19. Aunque la respuesta inicial en los nódulos puramente quísticos es mayor a los mixtos, no hay diferencias en la TRV entre ambos a medio y largo plazo9,21. Se ha sugerido que la parte sólida del nódulo podría ser más resistente a la difusión del etanol, lo que podría explicar esta mayor respuesta inicial de los quistes puros inmediatamente tras la IPE-US. Sin embargo, el etanol es absorbido de forma progresiva por la parte sólida del nódulo, y su acción esclerosante persiste en el tiempo, provocando de forma lenta y progresiva la reducción del tamaño de los nódulos con componente sólido22. Además de esto, la aspiración previa del fluido del quiste antes de la IPE-US, también podría contribuir a una mayor reducción inicial de los quistes puros. Nosotros no hallamos diferencias en las variables estudiadas en los quistes según el tamaño inicial, pero sí observamos una reducción de volumen más rápida inicialmente en los quistes puros y en los mayores de 15ml, que desapareció a medio y largo plazo.
Se ha sugerido que los cambios provocados por el etanol en el tejido tiroideo, como necrosis y fibrosis, podrían ocasionar complicaciones en caso de ser necesaria una cirugía posterior de la glándula3. Sin embargo, con la IPE-US solo el nódulo sufre la acción del etanol sin afectar al tejido tiroideo extranodular, por tanto, no imposibilita un posterior tratamiento quirúrgico, que puede realizarse con seguridad23.
Una de las prioridades en todos los procedimientos de intervención es la seguridad del paciente. Nosotros evaluamos específicamente la sensación de dolor mediante una escala visual analógica y la mayoría de los pacientes reportaron ausencia de dolor o dolor mínimo. En trabajos previos se describe la presencia de sensación de quemazón transitoria, discreta en la mayoría de los casos, y de mayor intensidad en los quistes de gran tamaño7,24. Esto podría estar relacionado con el elevado volumen de etanol inyectado, y por no administrar anestesia local. Nosotros como en el protocolo de Reverter et al.12, instilamos una pequeña cantidad de lidocaína en el interior de la cavidad justo antes de la administración de etanol. Pensamos que la ausencia de dolor reportada por la mayoría de los pacientes aconseja incluir la administración de lidocaína en el procedimiento. Sin embargo, la administración de lidocaína alarga el procedimiento, y diversos autores reportan resultados similares en cuanto a sensación de dolor sin la utilización de lidocaína11. Finalmente, un último aspecto a valorar es la calidad de vida. Los estudios que han valorado la misma no muestran diferencias en el estado de salud general de los pacientes comparados con la población general, pero sí una mejoría importante en los síntomas relacionados con el quiste tiroideo12,13.
Las principales limitaciones de este estudio son el número de casos limitado, ya que se trata de un procedimiento eficaz y seguro en el momento actual, no contar con grupo control y no haber realizado un cuestionario de calidad de vida. El objetivo del estudio era evaluar la eficacia y seguridad del procedimiento para valorar su introducción como procedimiento en la cartera de servicios del departamento, ya que es el tratamiento recomendado como primera línea por las principales sociedades científicas. Consideramos que el número de casos tratados y nuestra experiencia puede ser de utilidad para otras CAR de nódulo tiroideo.
ConclusionesLos buenos resultados observados en nuestra práctica clínica en el tratamiento de los quistes tiroideos sintomáticos mediante IPE-US y la seguridad proporcionada a los pacientes, con un dolor percibido mínimo y con ausencia de complicaciones, nos hacen considerar la IPE-US como primera línea de tratamiento en nuestros hospitales. La inclusión de este procedimiento en nuestros centros supondrá una importante reducción en el número de intervenciones quirúrgicas, de estancias hospitalarias, de molestias para los pacientes, de bajas laborales y posibles complicaciones. Teniendo en cuenta que esta enfermedad afecta con frecuencia a personas jóvenes, consideramos que la IPE-US debe ser ofrecida como primera línea de tratamiento a todos los pacientes que presenten recidiva del quiste tras el primer drenaje, confirmada la benignidad del mismo. Proponemos realizar el procedimiento sin aspirar el etanol inyectado, administrando pequeños volúmenes de alcohol, entre 2 y 4ml según el volumen inicial del quiste y utilizar lidocaína como anestésico antes de la instilación del etanol. Nos parece necesario compartir los resultados y unificar los protocolos del procedimiento en los distintos centros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo se ha podido realizar gracias a la concesión de una beca de un ecógrafo Sonosite M-Turbo® por la Sociedad Española de Endocrinología y Nutrición y la Sociedad Valenciana de Endocrinología, Diabetes y Nutrición al Hospital General Universitario de Castellón.