Nuestro objetivo fue analizar si existen diferencias en los niveles de estrés oxidativo salival de pacientes con DM2 en comparación con sujetos sanos no diabéticos, y si dicho estrés oxidativo se puede asociar a la presencia de enfermedad periodontal en pacientes con diabetes.
Material y métodosSe realizó un estudio observacional que incluyó 70 pacientes, estableciéndose 3 grupos de estudio en función del control metabólico: 19 pacientes sin diabetes (grupo control); 24 pacientes DM2 con buen control metabólico (HbA1c<7%), y 27 pacientes DM2 con mal control metabólico (HbA1c>7%). En todos ellos se midieron los siguientes parámetros de estrés oxidativo salival: glutatión peroxidasa (GPx), glutatión reductasa (GRd), glutatión reducido (GSH) y glutatión oxidado (GSSG). El estado de salud periodontal se determinó mediante el índice periodontal comunitario (CPI), recomendado por la OMS.
ResultadosEl grupo de diabetes con buen control metabólico mostró un incremento significativo en la actividad de GPx y GRd con respecto al grupo control (p<0,001). La actividad de dichas enzimas fue significativamente menor en los pacientes con diabetes con mal control metabólico en comparación con el grupo control y de diabéticos bien controlados (p<0,001). Los 2 grupos de pacientes con diabetes mostraron mayor cociente GSSG/GSH e índice CPI con respecto al grupo control, resultando también ambos parámetros significativamente aumentados en el grupo de diabetes con mal control metabólico respecto a los bien controlados.
ConclusionesUn peor control metabólico se asocia a mayores niveles de estrés oxidativo en saliva de pacientes con DM2, así como a un peor estado de salud periodontal.
The aim of this study was to determine whether there are differences in salivary oxidative stress between patients with diabetes mellitus type 2 (DM2) and healthy non-diabetic patients, and whether this oxidative stress is associated with the presence of periodontal disease in diabetic patients.
Material and methodsThis observational study included 70 patients divided into three groups according to metabolic control levels: 19 non-diabetic patients (control group); 24 patients with good metabolic control (HbA1c<7%), and 27 patients DM2 with poor metabolic control (HbA1c>7%). The following oxidative stress parameters were measured in all subjects: glutathione peroxidase (GPx), glutathione reductase (GRd), reduced glutathione (GSH) and oxidized glutathione (GSSG). Periodontal health was determined by means of the community periodontal index (CPI) recommended by the WHO.
ResultsThe diabetic group with good metabolic control showed a significant increase in GPx and GRd activity in comparison with the control group (P<.001). The activity of the enzymes measured was significantly less in patients with poor metabolic control in comparison with the control group and well-controlled diabetic groups (P<.001). Both diabetic groups showed higher GSSG/GSH quotients and CPI in comparison with the control group, and both parameters were significantly higher in diabetic patients with poor metabolic control in comparison with well-controlled diabetic patients.
ConclusionsPoor metabolic control in DM2 patients is associated with higher levels of salivary oxidative stress and worse periodontal health.
Las enfermedades periodontales constituyen un grupo de patologías inflamatorias crónicas causadas por las bacterias del biofilm subgingival que afectan a los tejidos de soporte dentario, dando lugar a destrucción tisular con formación de bolsas periodontales y reabsorción ósea. La consecuencia final es la pérdida de inserción clínica y de piezas dentarias1. Actualmente, las enfermedades periodontales se consideran como una infección crónica localizada en la cavidad oral que puede activar la respuesta inmunoinflamatoria del huésped a niveles local y sistémico2. Se sabe que las enfermedades periodontales ejercen una influencia importante sobre la patogénesis de numerosas enfermedades sistémicas, entre ellas la diabetes mellitus3. A mediados de la década de los 90 se estableció el soporte científico que avalaba la asociación entre diabetes mellitus y periodontitis, que comenzó a designarse como «la sexta complicación diabética»4. La evidencia científica actual refleja que existe una relación bidireccional entre diabetes mellitus y enfermedades periodontales, de tal modo que se considera que la diabetes mellitus está asociada a un incremento en la incidencia y progresión de periodontitis, y que a su vez, la infección periodontal está asociada con un peor control glucémico en pacientes con diabetes5.
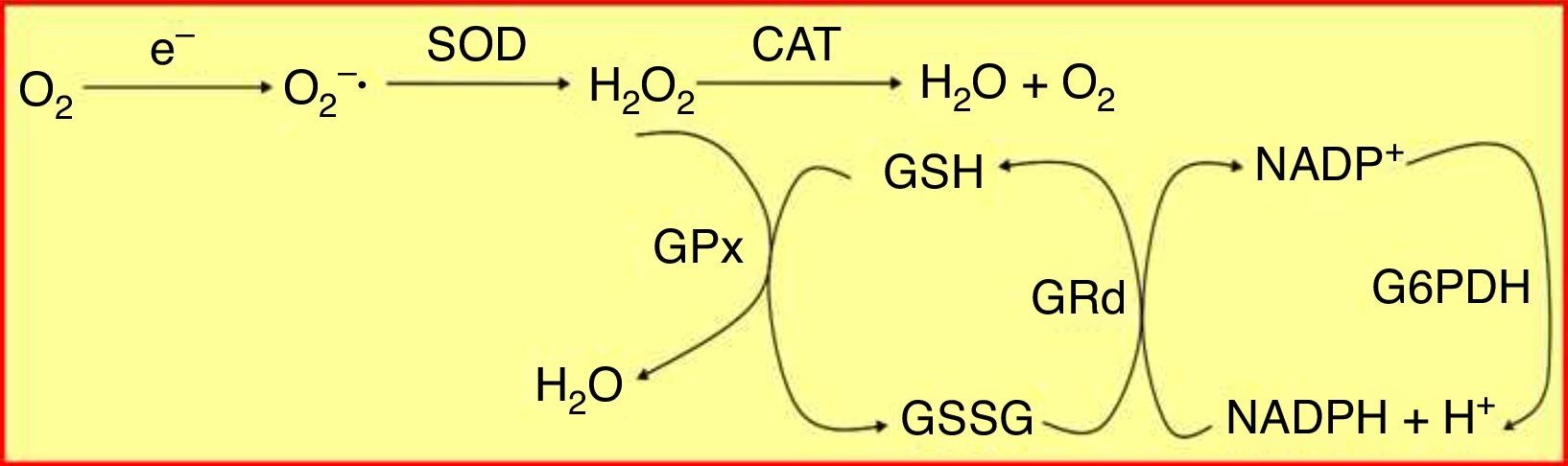
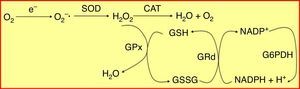
El estrés oxidativo constituye un elemento fundamental en la fisiopatología del proceso inflamatorio crónico que caracteriza tanto a las enfermedades periodontales como a la diabetes mellitus5,6. Para proteger a las células del daño producido por los radicales libres existen distintos sistemas de defensa antioxidante. El sistema del glutatión, que constituye cuantitativamente el principal mecanismo de defensa antioxidante de la célula, se basa en un pool enzimático específico y variado que contribuye a mantener la homeostasis celular frente al ataque oxidativo, e incluye la glutatión peroxidasa (GPx) y la glutatión reductasa (GRd)7, que actúan y se interrelacionan entre sí como muestra la figura 1.
Sistema enzimático glutatión peroxidasa/glutatión reductasa (GPx/GRd). El glutatión se encuentra principalmente en su estado reducido (GSH) y, en mucha menor proporción, en su forma oxidada (GSSG). La GRd forma junto con la GPx el conjunto de la maquinaria antioxidante dependiente de glutatión. Dicho sistema trabaja de forma cíclica, es decir, el GSH que oxida la GPx para neutralizar el H2O2 es a su vez reducido de nuevo por la GRd, utilizando como cofactor NADPH.
CAT: catalasa; G6PDH: glucosa 6-fosfato deshidrogenasa; H2O2: peróxido de hidrógeno; NADPH: dinucleótido de nicotinamida y de adenina fosfato reducido; O2−•: radical anión superóxido; SOD: superóxido dismutasa.
Desde el punto de vista clínico, la mayor incidencia de enfermedades periodontales que padecen los pacientes con diabetes se ha vinculado a mayores niveles de estrés oxidativo en el suero de estos pacientes debido a una excesiva producción de especies reactivas de oxígeno (ERO) y una disminución de los mecanismos de defensa antioxidante8. En relación con los niveles de estrés oxidativo y capacidad antioxidante de la saliva de pacientes con diabetes, los estudios realizados hasta la fecha son escasos, con gran variabilidad entre los distintos parámetros medidos y las metodologías aplicadas.
El objetivo del presente trabajo fue: i) analizar si existen diferencias en los niveles de estrés oxidativo salival de pacientes con DM2 en comparación con sujetos sanos sin diabetes y si dicho estrés oxidativo guarda relación con el control metabólico de la enfermedad; ii) valorar si la presencia de enfermedad periodontal en pacientes con DM2 se asocia a un mayor grado de estrés oxidativo en saliva.
Material y métodosEl estudio fue llevado a cabo en la Facultad de Odontología de la Universidad de Granada en colaboración con el Servicio de Endocrinología y Nutrición del Hospital Universitario Virgen Macarena, con la participación de la Unidad de Diabetes. El proyecto fue aprobado el 7 de octubre de 2015 por el Comité de Ética en Investigación de la Universidad de Granada.
ParticipantesSe incluyeron sujetos diagnosticados de DM2 y controles sanos, con edades comprendidas entre los 18 y 65 años, que seguían tratamiento en la Unidad de Odontología en Pacientes Especiales de la Facultad de Odontología de la Universidad de Granada. Todos eran pacientes ambulatorios que firmaron previamente un consentimiento informado del estudio que se iba a realizar. Se excluyeron de dicho estudio pacientes con DM1 u otras formas menos comunes de diabetes, mujeres gestantes, fumadores activos, pacientes que presentasen lesiones en la mucosa oral, y aquellos que estuviesen en tratamiento con antibióticos en los 30 días previos a la exploración oral y toma de muestras salivales.
Sobre una muestra total de 70 pacientes, se establecieron 3 grupos de estudio en función del control metabólico objetivado mediante la hemoglobina glucosilada (HbA1c) determinada el día de la primera visita, independientemente del estado periodontal:
- •
Grupo control: constituido por 19 pacientes sin diabetes ni prediabetes (HbA1c<5,7%), incluidos en el estudio de forma aleatoria procedentes de las primeras visitas realizadas a la Facultad de Odontología de la Universidad de Granada. Se incluyeron en este grupo tanto pacientes con enfermedad periodontal como libres de esta, que acudían a recibir cualquier otro tipo de tratamiento odontológico (tartrectomía, obturaciones, restauraciones protésicas).
- •
Grupo de diabéticos con buen control metabólico: constituido por 24 pacientes con DM2 con HbA1c<7%.
- •
Grupo de diabéticos con mal control metabólico: constituido por 27 pacientes con DM2 con HbA1c>7%.
En todos los participantes se recogió una muestra de saliva, donde se determinaron los siguientes parámetros de estrés oxidativo: GPx, GRd, glutatión reducido (GSH) y glutatión oxidado (GSSG). En los 3 grupos de estudio se realizó un examen bucodental detallado, que incluyó la exploración periodontal de los pacientes. El procesado para realizar la cuantificación del estrés oxidativo en las muestras salivales obtenidas se realizó en el Centro de Instrumentación Científica de la Universidad de Granada.
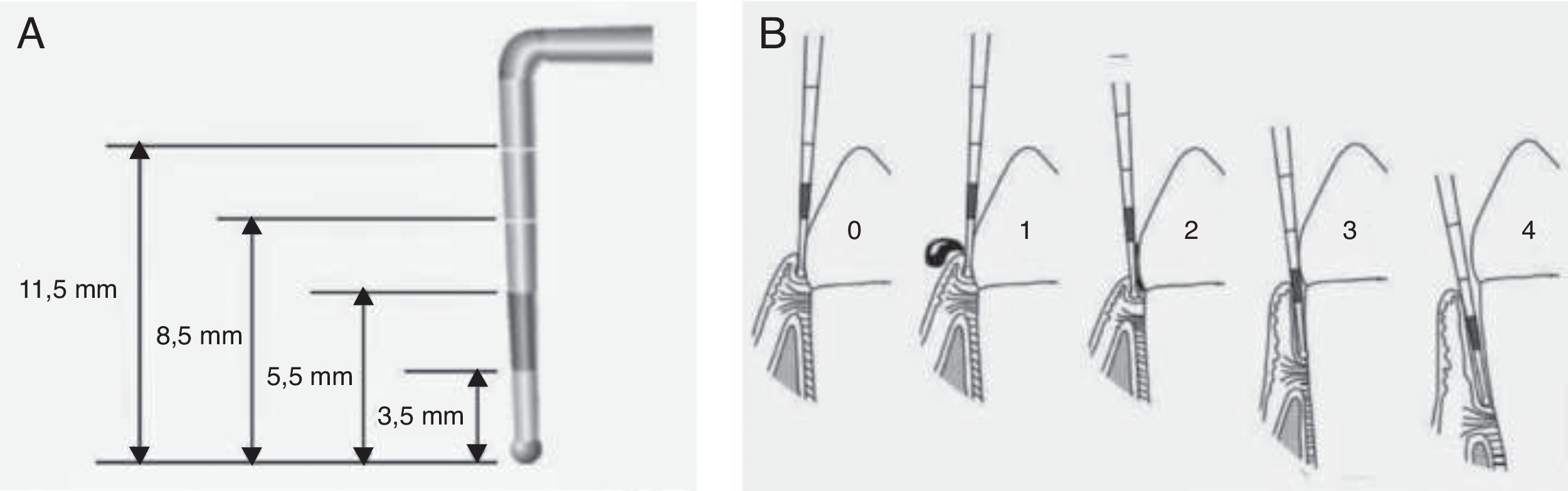
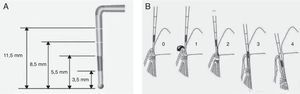
Determinación del estado periodontalPara la determinación del estado de salud periodontal se utilizó el índice periodontal comunitario (community periodontal index [CPI]) validado por la OMS, que mide la presencia de sangrado gingival, cálculo y bolsas periodontales, además de la pérdida de inserción o fijación de los dientes9. Para ello se utiliza una sonda específicamente diseñada denominada sonda periodontal de la OMS, con una pequeña bola de 0,5mm de diámetro en su extremo y que tiene marcada en negro la zona comprendida entre 3,5 y 5,5mm, con 2 marcas añadidas a los 8,5 y 11,5mm (fig. 2A). Para la medición de la profundidad de bolsa periodontal y cálculo del índice CPI se divide la boca en 6 segmentos como unidades básicas de examen. El registro por sextante se establece tras el examen de los primeros y segundos molares en el sector posterior y de un central en el anterior (10 dientes índice). Los códigos para el registro del estado periodontal según este índice se muestran en la figura 2B.
Determinación del índice periodontal comunitario. Es necesario utilizar la sonda periodontal de la OMS, que termina en bola y tiene marcada en negro la zona comprendida entre los 3,5 y 5,5mm, con 2 marcas adicionales a los 8,5 y 11,5mm (A). Cada sextante se valora de acuerdo con los siguientes códigos. 0: salud periodontal; 1: hemorragia al sondaje suave; 2: presencia de cálculo supra o subgingival, ninguna bolsa excede los 3mm; 3: bolsas de 4-5mm (banda negra de la sonda parcialmente oculta); 4: bolsas iguales o mayores de 6mm (banda negra oculta) (B).
Se obtuvo el flujo salival estimulado entre las 8:30 y 9:00 horas de la man¿ana. Para ello, el paciente masticaba una lámina o pastilla de parafina durante 5min, al menos una hora después de consumir alimentos y bebidas. La saliva secretada se eliminaba durante los 2min. A partir de ahí se recogía en un bote de plástico durante 5min. La saliva se obtenía antes de realizar cualquier tipo de intervención intraoral (exploración, cepillado, etc.). Posteriormente se centrifugaba a 3.000rpm durante 20min, tras lo cual se colocaba en microtubos Eppendorf y se congelaba a –80°C.
Determinación de la actividad de glutatión peroxidasa y glutatión reductasaPara la determinación de la actividad de la GPx, se incubaron 120μl de saliva en un volumen final de 3ml con tampón fosfato-EDTA (100mM, pH 7.5, EDTA-Na2 1mM), en presencia de 30μl de NADPH (20mM), 100μl de GSH (60mM) y 4μl (1UI) de GRd, durante 5min a temperatura ambiente. A continuación se añadió 100μl de solución de hidroperóxido de cumeno (36mM) y se midió la actividad de GPx después de la oxidación del NADPH durante 3min a 340nm en un espectrofotómetro de cubeta10. De manera análoga se midió la actividad de la GRd; 35μl de muestra se añadieron a 508,5μl de una solución extemporánea compuesta por tampón fosfato (100mM, pH 7,5) y GSSG a una concentración de 2,5mM. Tras una incubación durante 5min a temperatura ambiente, se añadieron 8,5μl de NADPH 12mM para disparar la reacción y la oxidación del NADPH se midió durante 3min a 340nm en el mismo espectrofotómetro de cubeta. En ambos casos se restó la oxidación no enzimática del NADPH de la tasa global de oxidación. La actividad de ambas enzimas se expresó en nmol/min/mg proteína.
Determinación de glutatión oxidado y glutatión reducidoPara la medición del GSH, se incubaron 10μl de saliva con 10μl de una solución de etanol oftalaldehído (OPT, 1mg/ml) y 180μl de tampón fosfato (fosfato de sodio 100mM, 2,5mM EDTA-Na2, pH 8.0) durante 15min a temperatura ambiente. A continuación, la fluorescencia de las muestras fue leída en un fluorímetro de placas. Para cuantificar el GSH se comparó la fluorescencia emitida por las muestras con las de una curva de disoluciones estándar con concentraciones conocidas de GSH11.
Para la medición de la concentración de GSSG, se incubaron alícuotas de 25μl de saliva con 10μl de solución de N-etilmaleimida (NEM, 5mg/ml en agua destilada) durante 40min a temperatura ambiente. La NEM previene la oxidación del GSH presente en la muestra a GSSG. Tras la incubación, se añaden 760μl de NaOH 0.1N. A continuación se añaden a los pocillos de una microplaca 10μl de la muestra con NEM y NaOH, 10μl de OPT y 180μl de NaOH. El OPT reacciona con el GSSG a pH alcalino, emitiendo fluorescencia en proporción directa a la cantidad de GSSG presente. Se incuba 15min a temperatura ambiente y se lee la fluorescencia en un fluorímetro de placas. Para cuantificar el GSSG se comparó la fluorescencia emitida por las muestras con las de una curva de disoluciones estándar con concentraciones conocidas de GSSG11. Los valores de GSH y GSSG se expresaron en nmol/mg proteína.
Análisis estadísticoTodos los datos han sido expresados como media±desviación estándar. Para analizar las diferencias entre las distintas variables se utilizó el test de ANOVA de una vía, seguido de un test de Bonferroni para comparar las diferencias entre cada uno de los grupos de estudio. Los cálculos se realizaron con la versión 21.0 del programa SPSS con licencia de la Universidad de Granada. El nivel de significación estadística se estableció en p<0,05.
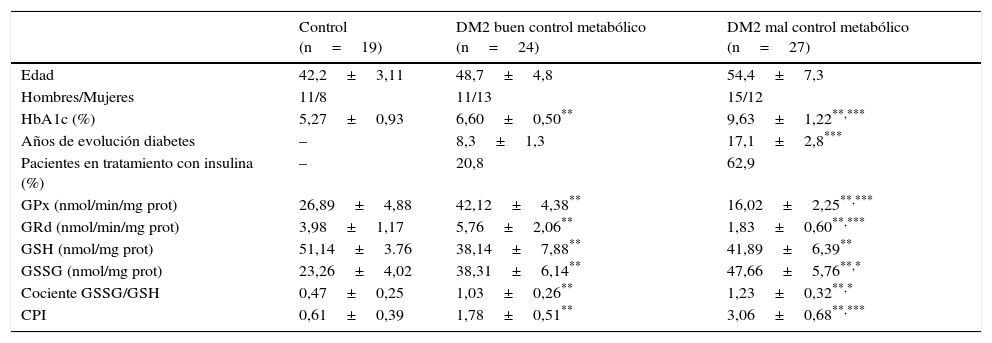
ResultadosEn la tabla 1 se muestran los estadísticos descriptivos y concentraciones salivales de GPx, GRd, GSH, GSSG, cociente GSSG/GSH e índice CPI en individuos sanos y sujetos con DM2 con buen y mal control metabólico incluidos en el estudio.
Estadísticos descriptivos y parámetros determinados en saliva de individuos sanos y pacientes con DM2
| Control (n=19) | DM2 buen control metabólico (n=24) | DM2 mal control metabólico (n=27) | |
|---|---|---|---|
| Edad | 42,2±3,11 | 48,7±4,8 | 54,4±7,3 |
| Hombres/Mujeres | 11/8 | 11/13 | 15/12 |
| HbA1c (%) | 5,27±0,93 | 6,60±0,50** | 9,63±1,22**,*** |
| Años de evolución diabetes | – | 8,3±1,3 | 17,1±2,8*** |
| Pacientes en tratamiento con insulina (%) | – | 20,8 | 62,9 |
| GPx (nmol/min/mg prot) | 26,89±4,88 | 42,12±4,38** | 16,02±2,25**,*** |
| GRd (nmol/min/mg prot) | 3,98±1,17 | 5,76±2,06** | 1,83±0,60**,*** |
| GSH (nmol/mg prot) | 51,14±3.76 | 38,14±7,88** | 41,89±6,39** |
| GSSG (nmol/mg prot) | 23,26±4,02 | 38,31±6,14** | 47,66±5,76**,* |
| Cociente GSSG/GSH | 0,47±0,25 | 1,03±0,26** | 1,23±0,32**,* |
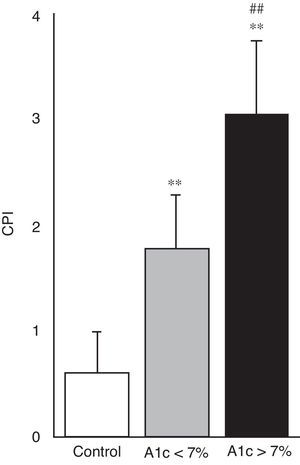
| CPI | 0,61±0,39 | 1,78±0,51** | 3,06±0,68**,*** |
Buen control metabólico: HbA1c<7%.
Mal control metabólico: HbA1c>7%.
CPI: índice periodontal comunitario; DM2: diabetes mellitus de tipo 2; GPx: glutatión peroxidasa; GRd: glutatión reductasa; GSH: glutatión reducido; GSSG: glutatión oxidado; HbA1c: hemoglobina glucosilada.
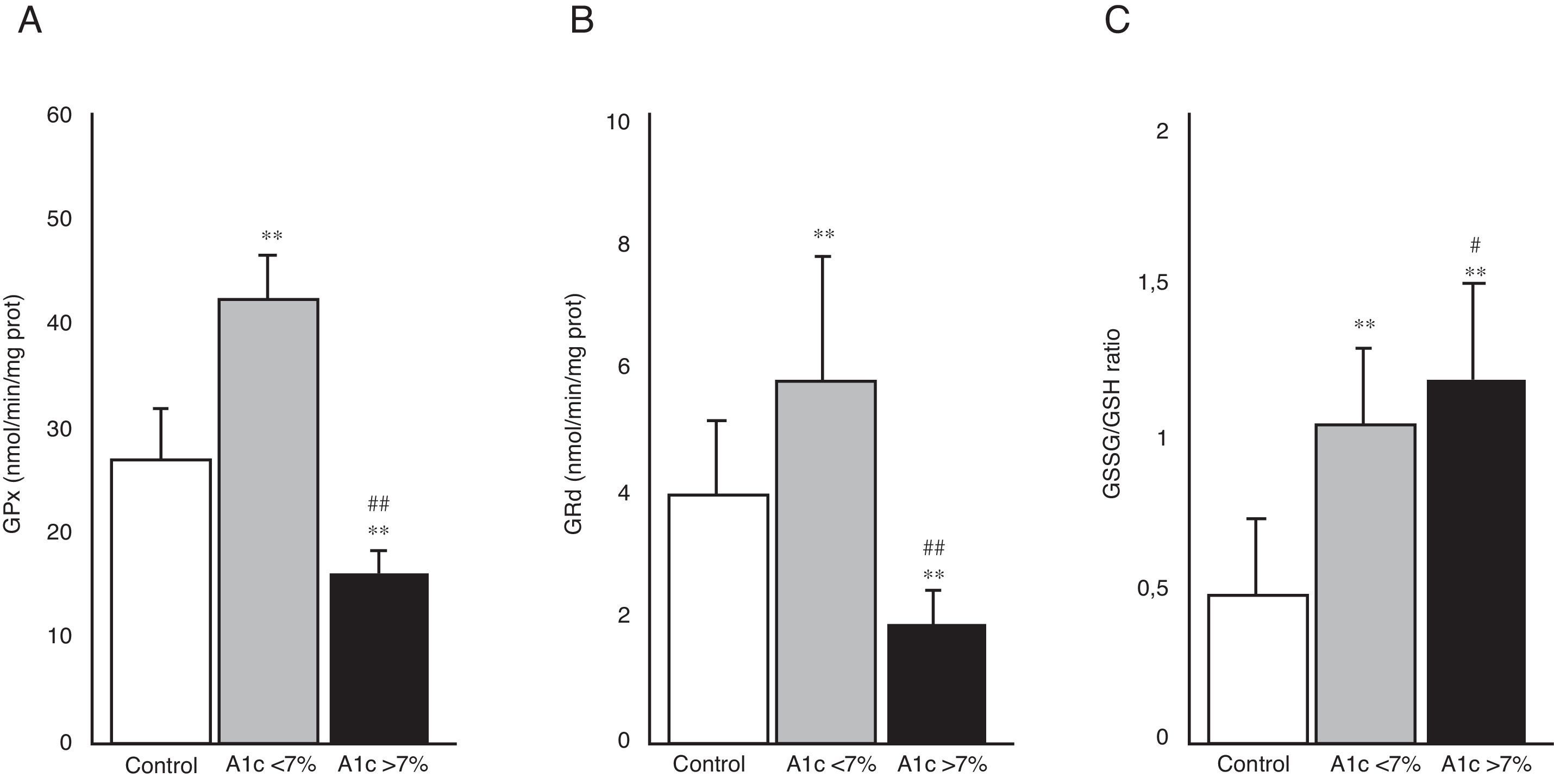
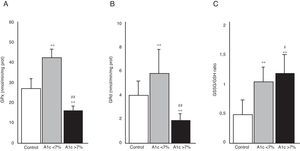
En la figura 3 se aprecia la actividad de las enzimas GPx (A) y GRd (B), así como el cociente GSSG/GSH (C) en los 3 grupos de estudio. El grupo de DM2 con buen control metabólico (HbA1c<7%) presentó un aumento en la actividad de ambas enzimas en comparación con los niveles del grupo control (p<0,001). En contraposición, los pacientes con diabetes con mal control metabólico (HbA1c>7%) mostraron una disminución significativa en la actividad de GPx y GRd con respecto al grupo control (p<0,001) y también en comparación al grupo de diabetes con buen control metabólico (p<0,001). La figura 3C representa el cociente GSSG/GSH, calculado a partir de los niveles de GSSG y GSH determinados en las muestras de saliva de los pacientes incluidos en el estudio. Se puede apreciar como dicho cociente fue significativamente mayor en ambos grupos de pacientes diabéticos con respecto al grupo control (p<0,001). Existió también una diferencia significativa entre los diabéticos con mal control metabólico y los bien controlados (p<0,05).
Actividad de las enzimas glutatión peroxidasa (GPx) (A), glutatión reductasa (GRd) (B) y cociente glutatión oxidado/glutatión reducido (GSSG/GSH) (C) en los grupos control, DM2 con buen control metabólico (A1c<7%) y DM2 con mal control metabólico (A1c>7%).
#p<0,05 vs. A1c<7%.
**p<0,001 vs. grupo control.
##p<0,001 vs. A1c<7%.
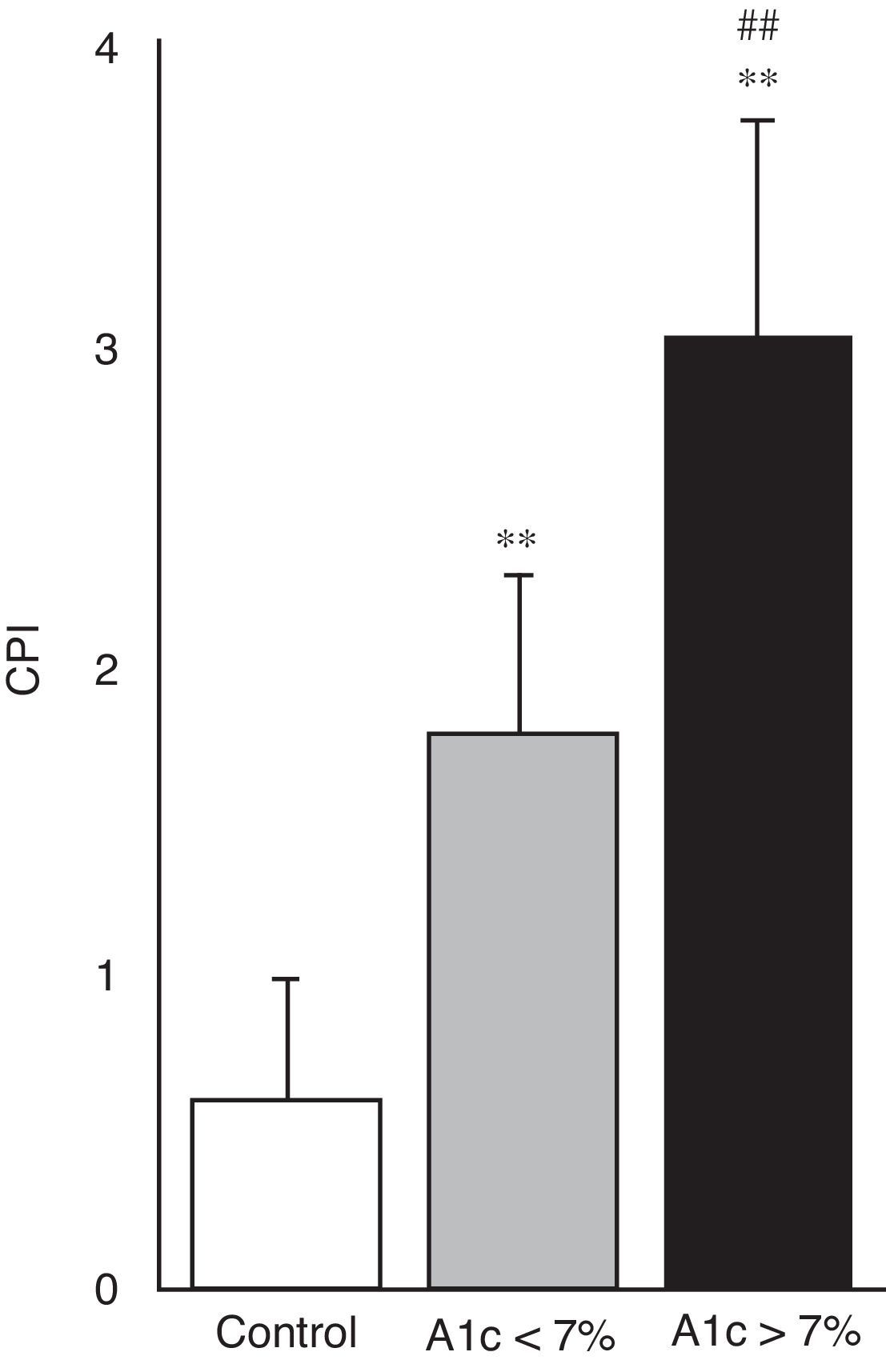
En la figura 4 se puede apreciar el estado de salud periodontal, objetivado mediante el índice CPI, en los 3 grupos de estudio. Ambos grupos de pacientes con diabetes mostraron mayor índice CPI y por tanto un peor estado periodontal en comparación con sujetos control (p<0,001); igualmente fue mayor el CPI en el grupo de diabetes con mal control respecto a los bien controlados (3,06±0,68 vs. 1,78±0,51; p<0,001).
DiscusiónNumerosos trabajos han puesto de manifiesto que el estrés oxidativo se encuentra aumentado en el suero de pacientes con diabetes debido a una excesiva producción de ERO y una disminución de los mecanismos de defensa antioxidante8,12. Los estudios realizados en saliva son escasos, aunque la evidencia disponible indica que podría sufrir cambios proporcionales similares13,14.
Nuestros resultados muestran que tanto el cociente GSSG/GSH como el estado de salud periodontal, objetivado mediante el índice CPI, difieren significativamente en pacientes con diabetes en comparación con los controles. En los diabéticos ambos parámetros son significativamente mayores en sujetos con peor control metabólico respecto a los que presentan buen control metabólico (figs. 3C y 4). Por tanto, nuestro estudio pone de manifiesto que un peor control metabólico en pacientes con DM2 se asocia a mayores niveles de estrés oxidativo en saliva y a un peor estado de salud periodontal.
Independientemente del tipo de diabetes, la evidencia disponible refleja que el incremento del estrés oxidativo a nivel sérico se asocia a la presencia de complicaciones microangiopáticas, macroangiopáticas y neuropáticas de la diabetes mellitus12. Además, el aumento en la generación de ERO en sujetos con diabetes empeora la acción de la insulina a nivel periférico y contribuye a la disfunción de la célula beta pancreática15.
Las investigaciones realizadas hasta la fecha que tratan de dilucidar si la capacidad antioxidante en saliva de pacientes diabéticos difiere de la de individuos sanos son muy escasas. Belce et al. encontraron una disminución del ácido siálico y de la superóxido dismutasa (SOD) en saliva total no estimulada de pacientes DM1, concluyendo que los valores menores de estas moléculas podrían justificar el peor estado de salud bucodental de este tipo de pacientes16. Por el contrario, otros estudios han mostrado una mayor actividad antioxidante en saliva de pacientes con DM1, aumentando los marcadores antioxidantes paralelamente a la HbA1c13,17. En nuestro trabajo obtuvimos un incremento del cociente GSSG/GSH salival en pacientes con diabetes a expensas de 2 factores: un aumento del GSSG y una disminución en los niveles de GSH. A pesar de la mayor edad de los pacientes con diabetes (no significativa estadísticamente), no disponemos de estudios que evalúen el efecto de este factor de forma independiente sobre los marcadores de estrés oxidativo en saliva. El cociente GSSG/GSH constituye el mejor biomarcador de estrés oxidativo celular y su aumento, que fue mayor en el grupo de diabéticos con peor control metabólico, podría ser reflejo de una mayor degradación del GSH en reacciones de óxido-reducción, en detrimento de su síntesis14. El GSH es un tripéptido ubicuo que constituye el principal antioxidante no enzimático del organismo, protegiendo a las células del daño causado por los radicales libres; su función principal es la depuración directa de ERO y la restitución de otros antioxidantes como la vitamina E y el ácido ascórbico a su estado reducido18. Nuestro estudio coincide con otros trabajos que muestran como la hiperglucemia crónica y el estrés oxidativo que acontece en pacientes diabéticos se acompañan de una mayor oxidación del GSH, con la consecuente disminución en sus niveles séricos19. En saliva, Gumus et al. realizaron en 2009 el primer estudio de casos y controles en el que discriminaron entre tipos de diabetes, encontrando una disminución significativa en los niveles de GSH en pacientes DM1 con respecto a los DM2 y sujetos control; dicha disminución no se tradujo en una menor capacidad antioxidante salival de los individuos con DM120.
Otro marcador a considerar en las muestras salivales de nuestros participantes son los cambios en las enzimas del ciclo del glutatión: GPx y GRd (fig. 3A y B). Ambas enzimas traducen la capacidad de la célula para mantener el índice GSSG/GSH y, por tanto, reflejan la capacidad de defensa antioxidante del organismo. En nuestro trabajo se observó un aumento en la actividad de GPx y GRd en pacientes con diabetes y buen control metabólico respecto al grupo control. Dicho aumento podría reflejar un mecanismo compensatorio del organismo en un intento de prevenir el daño oxidativo14. Ante un incremento en la producción de ERO consecuencia de la hiperglucemia crónica mantenida, en un principio se estimula la actividad de la SOD y otras enzimas antioxidantes como GPx y GRd para tratar de depurar el exceso de radicales libres existente14. Por otro lado, en el grupo de diabéticos con mal control metabólico (HbA1c media de 9,63%) se apreció una disminución en la actividad de ambas enzimas, tanto con respecto al grupo control como a los diabéticos bien controlados (p<0,001 en ambos casos). Se sabe que un deficiente control metabólico se traduciría en una intensa producción de radicales libres durante un tiempo prolongado, agotando la capacidad compensadora de los sistemas enzimáticos antioxidantes y originando un daño estructural a las proteínas expuestas a los productos de glicosilación avanzada21. La glicación de proteínas no solo ocurre con la hemoglobina, sino también con proteínas que participan en los sistemas de defensa antioxidante como SOD, GPx y GRd, y que actúan frente a las ERO22. De manera que una diabetes mal controlada con un sistema del glutatión dañado por inactivación de la GPx y GRd podría contribuir al desarrollo y/o progresión de distintas complicaciones de la enfermedad12,23.
En relación con dichas complicaciones, la aportación más importante de nuestro trabajo fue tratar de correlacionar este aumento del estrés oxidativo en saliva con la principal manifestación de la diabetes a nivel de la cavidad oral: la enfermedad periodontal. En la figura 4 se puede observar como ambos grupos de pacientes con DM2 presentaron un mayor índice CPI, indicativo de un peor estado de salud periodontal, con respecto a los sujetos controles. Y dentro de los pacientes con diabetes, aquellos con mal control metabólico mostraron un peor estado periodontal respecto al grupo con buen control metabólico. Dado que el cociente GSSG/GSH se considera un biomarcador fiable de estrés oxidativo celular, el aumento de sus niveles de forma conjunta al aumento del índice CPI apoya la hipótesis de la participación del estrés oxidativo en la patogénesis de la enfermedad periodontal en pacientes con diabetes. Numerosos trabajos apoyan esta hipótesis y respaldan nuestros resultados8,20. Se ha demostrado que en pacientes con enfermedad periodontal los polimorfonucleares neutrófilos (PMN) están activados funcionalmente y producen elevados niveles de anión superóxido (O2•−) y otras ERO. Del mismo modo, se ha observado un aumento de la respuesta oxidativa de los PMN periféricos en pacientes con periodontitis juvenil y del adulto. Este incremento de la respuesta oxidativa se ha relacionado con el estado clínico periodontal del paciente8,24.
Por tanto, podemos concluir a la luz de nuestros resultados que un peor control metabólico en pacientes con DM2 originaría mayores niveles de estrés oxidativo salival, y este a su vez se traduciría en un peor estado de salud periodontal. En cuanto a su relevancia clínica, el presente trabajo pretende poner de manifiesto la utilidad de la determinación salival de determinados marcadores del ciclo del glutatión (GSSG/GSH, GPx, GRd) como posibles predictores de la aparición y/o progresión de enfermedad periodontal en pacientes con DM2. Entre las limitaciones del estudio se encuentran el pequeño tamaño muestral, que ha impedido la selección de un grupo control de pacientes sin diabetes y con enfermedad periodontal. Otra posible limitación es la gran variabilidad existente en la literatura en cuanto a poblaciones de diabéticos estudiadas, parámetros medidos y metodologías aplicadas. Todo ello hace que no existan estándares o protocolos de referencia a los que podamos acudir a la hora de determinar el estrés oxidativo salival y comparar nuestro trabajo, lo que hace necesarios más estudios en este campo. Además, una cuestión interesante que quedaría por evaluar en futuras investigaciones es cómo los agentes antioxidantes podrían influir en las alteraciones periodontales de pacientes con diabetes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.