Los inhibidores de la enzima 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa son el tratamiento de elección de la dislipidemia, tanto para pacientes en prevención primaria como secundaria de episodios cardiovasculares. Sus beneficios se basan en el descenso del colesterol ligado a las lipoproteínas de baja densidad, el aumento del colesterol ligado a las lipoproteínas de alta densidad, la disminución de las concentraciones de triglicéridos y la inhibición de la síntesis de isoprenoides. Por estos mecanismos consiguen estabilizar las placas de ateroma, mejorar la función endotelial, disminuir el grado de inflamación y reducir el riesgo de trombosis1.
Sin embargo, las estatinas tienen algunos efectos secundarios, de los cuales los más conocidos son los efectos a nivel muscular, desde las mialgias sin elevación de creatina fosfocinasas (CPK) hasta la rabdomiolisis, en la que hay una elevación muy importante de los niveles de CPK, y también otras entidades menos frecuentes, como la miopatía necrosante inmunomediada (MNIM)2.
La MNIM es una complicación extremadamente infrecuente de las estatinas. El objetivo de este trabajo es presentar un caso clínico que experimentó este problema y revisar y actualizar el conocimiento de este raro efecto secundario.
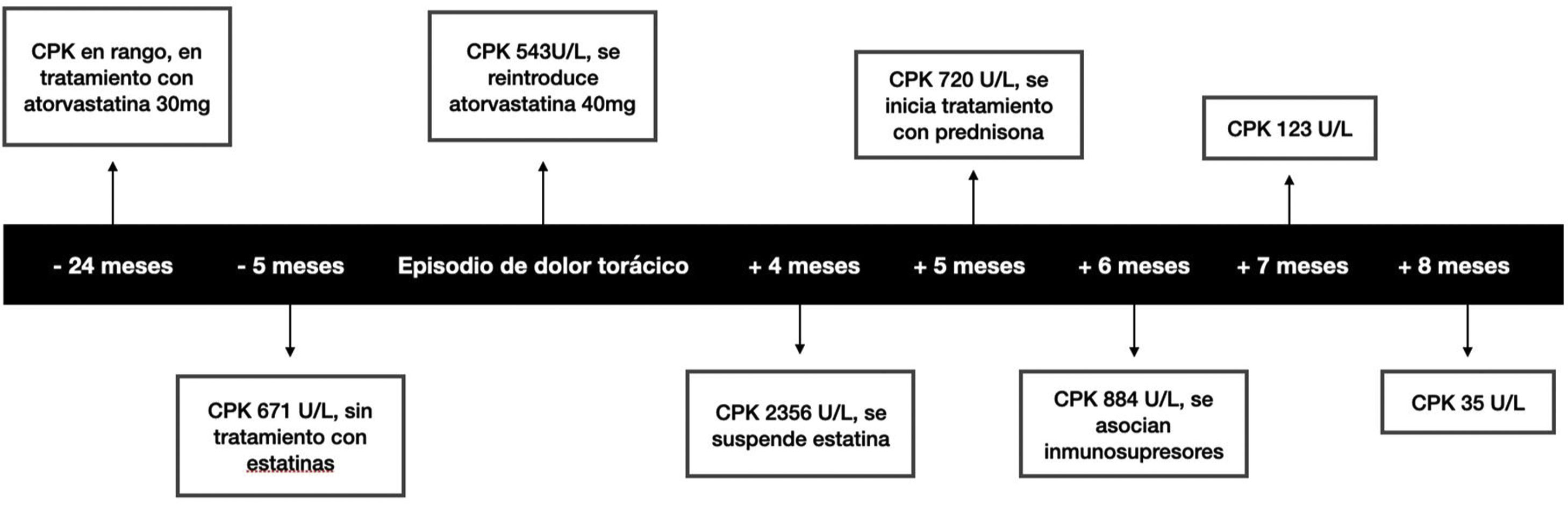
Caso clínicoPresentamos el caso de un varón de 68 años con antecedentes de hipertensión arterial, ateromatosis carotídea y dislipidemia, en tratamiento con ácido acetilsalicílico 100mg, valsartán 80mg y rosuvastatina 20mg. Como antecedentes familiares destacables, su madre y hermana estaban diagnosticadas de artritis reumatoide. El paciente fue derivado al Servicio de Endocrinología y Nutrición por aumento de las CPK. Revisando su historial médico se objetivó que había estado 2 años en tratamiento con atorvastatina 30mg con CPK normales, había abandonado el tratamiento y en el análisis a los 5 meses se evidenciaban unas CPK de 671U/L (1-190U/L). Posteriormente ingresó en Cardiología por dolor torácico atípico, y en el análisis inicial destacaba una troponina ultrasensible de 24,4pg/mL (<14pg/mL) y CPK de 543U/L. Durante el ingreso, se realizó una prueba de esfuerzo y un cateterismo cardiaco, sin hallazgos, a pesar de lo cual se reinició rosuvastatina 20mg ante un colesterol ligado a lipoproteínas de baja densidad de 159mg/dL. Tras el inicio del hipolipidemiante persistía la elevación progresiva de las CPK, por lo que fue derivado a nuestras consultas. En la primera visita, se suspende rosuvastatina, se inicia ezetimiba 10mg y se consulta con Neurología.
En la valoración por Neurología refería leve dolor muscular y cierto grado de debilidad en la cintura escapular. Las CPK seguían en ascenso pese a la retirada de las estatinas (fig. 1). En la resonancia magnética se evidenciaron áreas difusas de hiperintensidad de señal STIR compatibles con focos de miopatía inflamatoria. En la tomografía computarizada de cuerpo completo no se objetivaron hallazgos patológicos. Se realizó una biopsia del músculo tibial anterior derecho, en la que se observaron fibras regenerativas y fibras de aspecto necrótico, cambios compatibles con la miopatía inflamatoria necrosante inmunomediada. En el suero se detectaron anticuerpos anti-HMGCR positivos, que actúan contra la enzima HMG-CoA reductasa. Se inició tratamiento con prednisona a dosis de 1mg/kg/día y posteriormente se añadió micofenolato mofetilo 500mg cada 12horas, con mejoría de las CPK hasta 35U/L. Para el control de su dislipidemia se inició tratamiento con alirocumab 75mg cada 2 semanas, con buen control.
La incidencia de la MNIM se estima en 2 o 3 casos por cada 100.000 pacientes expuestos2, a diferencia de las mialgias producidas por el uso de estatinas, que es un efecto adverso mucho más frecuente y difícil de cuantificar, que podría afectar a entre el 2 y el 20% de los pacientes en tratamiento con ellas. En una revisión de 100 pacientes con MNIM, se objetivó que al contrario de la rabdomiolisis inducida por estatinas que tuvo lugar al inicio del tratamiento, los pacientes con MNIM estuvieron de media 40 meses en tratamiento con estatinas hasta el inicio de la clínica3,4. Clínicamente, se manifiesta como debilidad progresiva de los músculos proximales que no mejora a pesar de la retirada de las estatinas, lo cual nos permite diferenciar esta entidad de otros tipos de miopatía inducida por estatinas en los que sí que se produce mejoría tras su retirada. En raras ocasiones puede producir disfagia, artralgia o fenómenos de Raynaud5. Analíticamente se objetiva una elevación de los niveles de CPK2,6. Otras causas de MNIM pueden ser las enfermedades autoinmunes del tejido conectivo, las infecciones virales o los síndromes paraneoplásicos7.
Respecto a la fisiopatología del cuadro, no ha quedado totalmente aclarada. Actualmente se postula que el daño muscular es producido por los anticuerpos anti-HMGCR, que actúan contra la enzima HMG-CoA reductasa presente en las células musculares, que es más abundante en las mismas tras el uso de estatinas. Se ha descrito una mayor incidencia del alelo del antígeno leucocitario humano DRB1*11:01 en pacientes con anticuerpos anti-HMGCR positivos, lo cual podría implicar cierta susceptibilidad genética a este cuadro2,4,6.
Para el diagnóstico definitivo se debe llevar a cabo un estudio serológico para detectar los anticuerpos anti-HMGCR que ayudan a diferenciar esta entidad de otras causas de miopatía necrosante autoinmune6, y una biopsia muscular, en la que normalmente se evidencia necrosis con regeneración de fibras musculares y poca inflamación asociada8,9.
El tratamiento actual de la MNIM está basado en la inmunosupresión y el cese del tratamiento con estatinas. Se puede iniciar tratamiento con corticoides a altas dosis y posteriormente añadir otros inmunosupresores (micofenolato mofetilo, azatioprina o metotrexato), sin haberse objetivado diferencias de eficacia entre estos fármacos. Se han descrito casos de empleo de rituximab o inmunoglobulinas en casos refractarios al tratamiento inicial2,3. A la hora de monitorizar la respuesta al tratamiento, es importante registrar la mejoría clínica referida por el paciente o emplear algún test para cuantificar la mejora en la fuerza muscular, como la dinamometría8. Además, se pueden emplear los niveles de CPK como marcador de actividad de la enfermedad, aunque se debe tener en cuenta que algunos pacientes pueden mantener niveles elevados de CPK pese a la mejoría clínica6.