Definir las características clínicas de los pacientes con diabetes autoinmune latente del adulto (LADA), conocer su control metabólico y las complicaciones crónicas asociadas que presentan.
MétodosSeleccionamos pacientes con DM seguidos en las consultas de endocrinología de hospitales públicos de la Comunidad de Madrid que reunían los siguientes criterios: edad al diagnóstico de DM >30años, independencia inicial de insulina durante al menos 6meses y positividad de anticuerpos antiGAD. Analizamos datos clínicos relativos al diagnóstico de LADA, autoinmunidad asociada, niveles de péptidoC, pauta terapéutica, control metabólico y presencia de complicaciones crónicas.
ResultadosNúmero de pacientes: 193. Mujeres: 56%. Antecedentes familiares de DM: 62%. Edad al diagnóstico de DM: 49años. Retraso en confirmación LADA: 3,5años. Tiempo de insulino-independencia: 12meses. PéptidoC basal suero: 0,66ng/ml (0,22nmol/l). Pauta de insulina basal-bolus: 76,7%. Dosis total diaria: 35,1U/día, correspondiente a 0,51U/kg. Sin fármacos orales asociados: 33,5%. Presencia de otras patologías autoinmunes: 57%. Glucemia en ayunas: 160,5mg/dl (8,91mmol/l). HbA1c: 7,7%. IMC: 25,4kg/m2 (sobrepeso: 31,5%; obesidad: 8%). Presión arterial: 128/75. Colesterol HDL: 65mg/dl (16,9mmol/l). Colesterol LDL: 96mg/dl (24,96mmol/l). Triglicéridos: 89mg/dl (1,01mmol/l). Complicaciones crónicas: 28%; microangiopatía: 23,1%; macroangiopatía: 4,9%.
ConclusionesEl reconocimiento de LADA puede retrasarse varios años. La reserva pancreática de insulina de los pacientes es heterogénea y el grado medio de control glucémico deficiente a pesar de utilizar mayoritariamente insulinoterapia intensiva. Con frecuencia presentan sobrepeso, aunque tienen un control adecuado de la presión arterial y perfil lipídico y baja incidencia de complicaciones macroangiopáticas.
To report the clinical characteristics of patients with latent autoimmune diabetes in adults (LADA), and to ascertain their metabolic control and associated chronic complications.
MethodsPatients with DM attending specialized medical care in Madrid who met the following criteria: age at diagnosis of DM >30years, initial insulin independence for at least 6months and positive GAD antibodies were enrolled. Clinical profiles, data on LADA diagnosis, associated autoimmunity, C-peptide levels, therapeutic regimen, metabolic control, and presence of chronic complications were analyzed.
ResultsNumber of patients; 193; 56% females. Family history of DM: 62%. Age at DM diagnosis: 49years. Delay in confirmation of LADA: 3.5years. Insulin-independence time: 12months. Baseline serum C-peptide levels: 0.66ng/ml. Basal-bolus regimen: 76.7%. Total daily dose: 35.1U/day, corresponding to 0.51U/Kg. With no associated oral antidiabetic drugs: 33.5%. Other autoimmune diseases: 57%. Fasting plasma glucose: 160.5mg/dL. HbA1c: 7.7%. BMI: 25.4kg/m2 (overweight, 31.5%; obesity, 8%). Blood pressure: 128/75. HDL cholesterol: 65mg/dL. LDL cholesterol: 96mg/dL. Triglycerides: 89mg/dL. Known chronic complications: 28%.
ConclusionsRecognition of LADA may be delayed by several years. There is a heterogeneous pancreatic insulin reserve which is negative related to glycemic parameters. Most patients are poorly controlled despite intensive insulin therapy. They often have overweight, but have adequate control of BP and lipid profile and a low incidence of macrovascular complications.
La diabetes mellitus (DM) es una enfermedad compleja y heterogénea desde un punto de vista fisiopatológico y desborda con frecuencia los márgenes un tanto rígidos de las categorías contempladas en la clasificación actualmente vigente1.
La denominada diabetes autoinmune latente del adulto (LADA) es una forma de diabetes autoinmune lentamente progresiva que a menudo no es reconocida como tal y se confunde con otros tipos de DM. Sin embargo, se ha observado positividad para anticuerpos antiislote (ICA) en más de un 10% de adultos con supuesta DM tipo2 (DM2)2,3, por lo que LADA supone la forma de diabetes autoinmune más prevalente en el adulto y probablemente también sea la forma más prevalente de diabetes autoinmune en general4.
Aunque LADA está indudablemente relacionada con la DM tipo1 (DM1), su presentación clínica ofrece con frecuencia rasgos atribuibles a DM2 y se diagnostica y trata erróneamente a menudo durante periodos significativos de tiempo. A ello contribuye el hecho de que los criterios diagnósticos actuales utilizados para identificar esta variante de diabetes son imprecisos y sujetos a controversia.
El objetivo de este trabajo es ayudar a caracterizar desde el punto de vista clínico a los pacientes LADA con seguimiento médico especializado, estudiar su control metabólico y la presencia de complicaciones crónicas relativas a la DM.
MétodosSe trata de un estudio transversal retrospectivo realizado sobre la base de pacientes con DM atendidos en los servicios de endocrinología pertenecientes a la red pública de la Comunidad de Madrid. La detección de casos se ha llevado a cabo tras una búsqueda sistemática en nuestras agendas de consultas y bases de datos (sin que ello deba representar el total de la casuística de cada hospital) de pacientes que presentaban los criterios referidos a continuación. El proceso de selección se ha efectuado durante el periodo comprendido entre mayo de 2015 y febrero de 2016, y la base de datos se ha formalizado mediante la recogida de información disponible en las historias clínicas hospitalarias.
Los pacientes incluidos reunían los 3 criterios de LADA propuestos por la Immunology of Diabetes Society (IDS)5: diagnóstico de diabetes según los criterios establecidos a una edad superior a los 30años, independencia de insulina durante al menos 6meses tras el diagnóstico y positividad de anticuerpos frente a la decarboxilasa del ácido glutámico (GADA). Se han excluido los casos de diabetes secundaria, gestacional y asociados a procesos malignos.
Hemos recogido datos de edad, sexo, peso, talla, índice de masa corporal (IMC), antecedentes familiares de diabetes, fecha de diagnóstico clínico de diabetes y de confirmación de LADA, título de GADA, patologías autoinmunes asociadas o presencia de anticuerpos órganos-específicos, péptidoC plasmático basal, pauta y dosis de insulina, otros fármacos antihiperglucemiantes y cardiovasculares asociados, grado de control metabólico glucémico, lipídico y presión arterial, filtrado glomerular estimado, relación albúmina/creatinina urinaria y presencia de complicaciones micro y macroangiopáticas. Los datos bioquímicos e inmunológicos han sido evaluados en los laboratorios de referencia de los respectivos centros hospitalarios.
El estudio estadístico se ha llevado a cabo mediante el programa GraphPad Prism6. Los datos con distribución normal se han expresado como media (desviación estándar). En caso contrario se han expresado como mediana (rango). El título de GADA se ha expresado como el cociente del valor absoluto resultante entre el límite superior de la normalidad para cada laboratorio. La asociación o la interdependencia entre dos variables se han calculado mediante el coeficiente de correlación de Spearman.
ResultadosEn la tabla 1 se recogen las características demográficas e información relativa a la diabetes de nuestros pacientes. Hemos recogido datos de 193 individuos, de los cuales 108 (56%) eran mujeres. Un 38% de los pacientes no tenían antecedentes familiares conocidos de DM, un 37% reflejaban historia familiar de DM2, un 16% de DM1 y en un 8,7% no se aclaraba el tipo de DM.
Características clínicas de la población estudiada
| Pacientes, n | 193 |
| Mujer/Varón, n (%) | 108/85 (56/44) |
| Antecedentes familiares de DM (%) | |
| No conocidos | 38 |
| DM2 | 37 |
| DM1 | 16 |
| No aclarada | 9 |
| Edad al diagnóstico de DM, años (DE) | 48,9 (11,2) |
| Retraso en confirmación LADA, años (rango) | 3,5 (0-36) |
| Insulino-independencia, meses (P10-P90) | 12 (0-63) |
| Índice de masa corporal, kg/m* (DE) | 25;4 (4,2) |
| Sobrepeso (IMC 25-30), % | 31,5 |
| Obesidad (IMC > 30), % | 8 |
| Péptido C plasma, ng/ml (DE) | 0,66 (0,8) |
| Ac antiGAD/límite sup normal, (DE) | 5,4±2,1 |
| Patologías autoinmunes asociadas/positividad de Ac organoespecíficos, % | 56,0 |
| Dosis total de insulina diaria, unidades (DE) | 35,1 (19,6) |
| Unidades de insulina/kg peso (DE) | 0,51 (0,24) |
La edad media al diagnóstico de DM fue de 48,9±11,2años. El diagnóstico de LADA, entendiendo este como la fecha en que se evidenció la positividad de GADA, se efectuó con un retraso de 3,5años (rango 0-36) tras el diagnóstico clínico de DM.
El título de GADA, expresado como la ratio GADA/límite superior de normalidad, era de 5,4±2,1U/l. No observamos correlación alguna entre el título de GADA, niveles de péptidoC ni tiempo de insulino-independencia.
Los pacientes fueron tratados con dieta y fármacos antihiperglucemiantes orales exclusivamente durante una mediana 12meses (P10: 1; P90: 63).
El IMC era de 25,4±4,2kg/m2. El 31,5% de los pacientes presentaban sobrepeso (IMC: 25-29,9), mientras que el 8% mostraban obesidad (IMC>30). No encontramos correlación entre IMC y control glucémico.
La determinación de péptido C plasmático basal de los pacientes se llevó a cabo en diferentes momentos evolutivos de la DM. Los niveles medios fueron de 0,66±0,8ng/ml, aunque observamos una importante heterogeneidad en los valores obtenidos, que guardaban una clara asociación con el tiempo de evolución de la DM, presentando una correlación negativa significativa (rho de Spearman: −0,52; p<0,0001). Del conjunto de pacientes, un 27% de ellos presentaban niveles de péptidoC <0,05ng/ml, un 49% tenían niveles entre 0,05 y 1,0ng/ml, mientras que un 24% mostraban niveles >1,0ng/ml. La mayoría (70%) de los pacientes de este último subgrupo presentaban una evolución conocida de la diabetes inferior a un año en el momento de la determinación de péptidoC.
La pauta de insulina mayoritaria (76,7%) en nuestros pacientes era el régimen basal-bolus, seguido de insulina basal (13,2%), premezclas (4,2%), basal-plus (2,6%) e ISCI (0,5%). Solamente el 2,6% de los pacientes no seguían tratamiento con insulina.
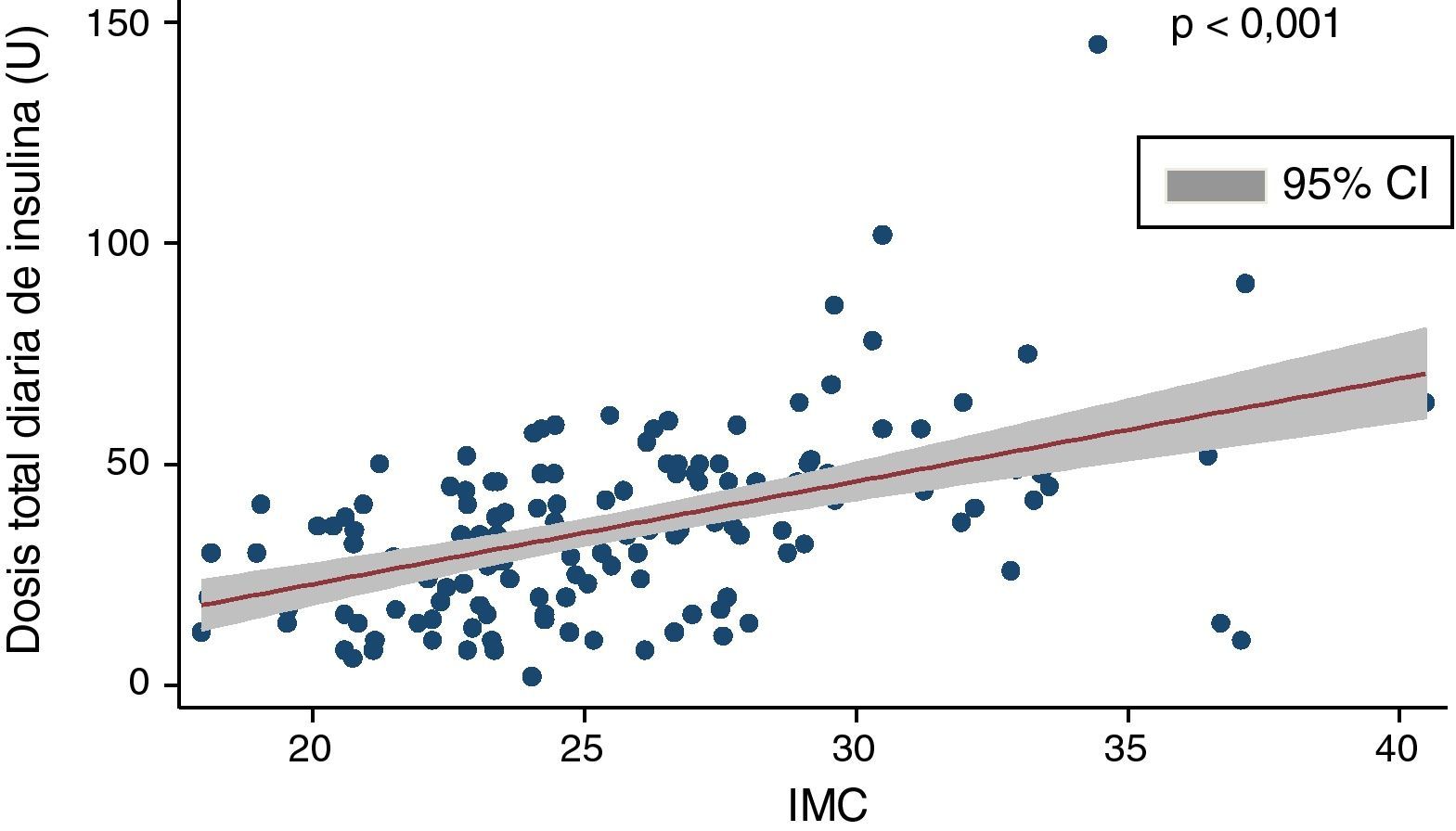
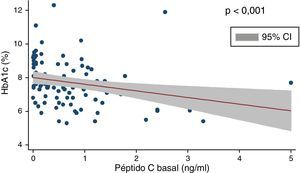
La dosis media de insulina era de 35,1±19,6U/día, que ajustada al peso corporal de los pacientes se correspondía con 0,51±0,24U/kg. Encontramos una correlación positiva y significativa (Coef 2,32; p<0,001) entre dosis total de insulina e IMC (fig. 1) y una correlación negativa entre dosis total diaria de insulina y niveles de péptidoC (rho de Spearman: −0,33; p<0,01).
El 66,5% de los pacientes no llevaban fármacos no-insulínicos asociados. El más utilizado fue metformina (25,7%), seguido de IDPP4 (7,3%), GLP1ar (2,2%) y SGLT2 (1,1%). El uso de secretagogos y glitazonas fue muy reducido (0,6%).
El porcentaje de pacientes con otras enfermedades autoinmunes o positividad de Ac organoespecíficos fue del 57,0%. La tiroiditis crónica fue la patología asociada más prevalente (32,9% de los casos). Otros procesos autoinmunes observados fueron gastritis atrófica (3,2%), vitíligo (2,4%), enfermedad de Graves (1,9%), enfermedad de Crohn (1,2%) y enfermedad celiaca (1,2%).
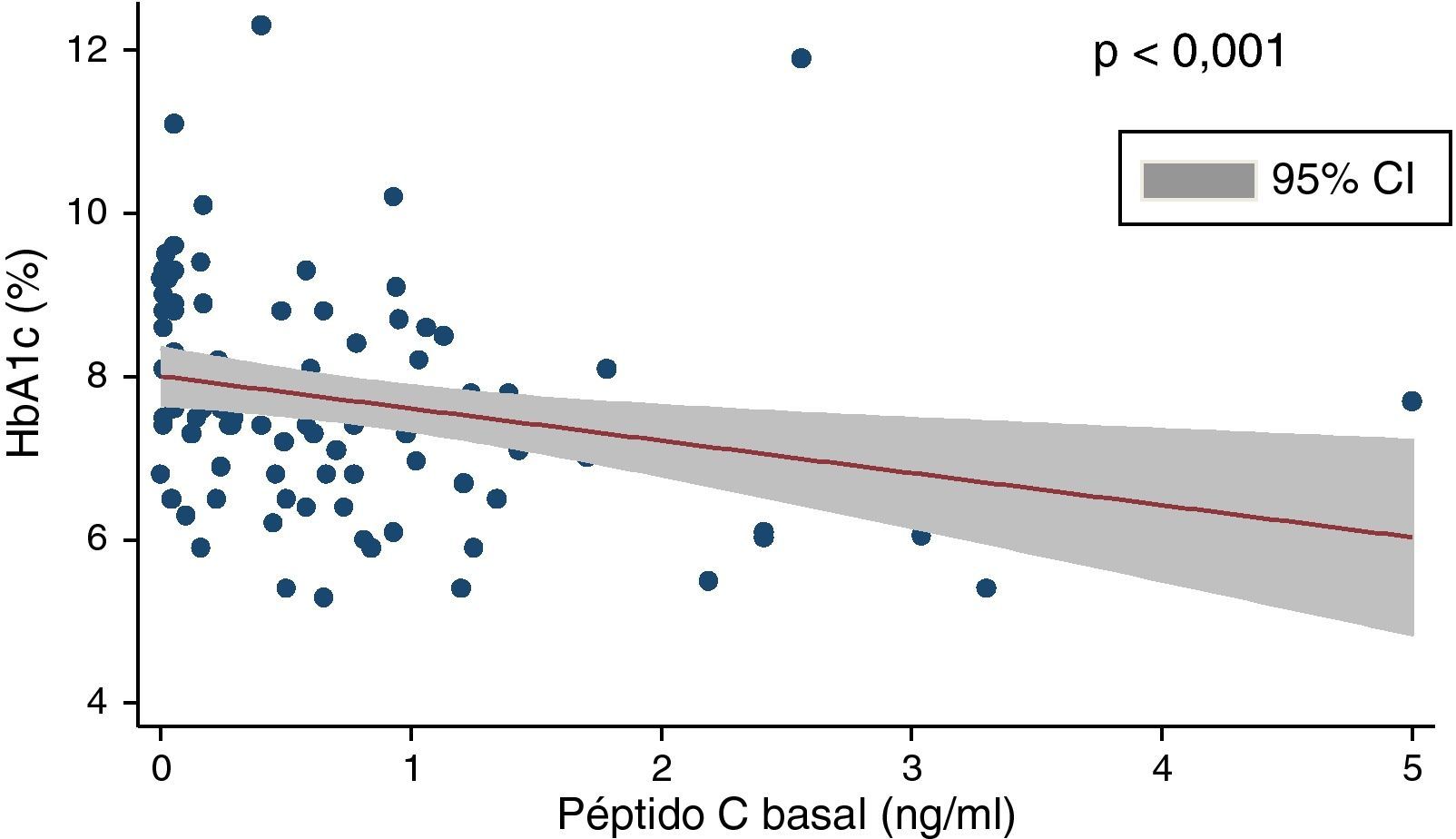
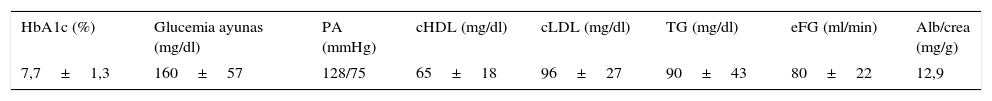
En la tabla 2 se muestran los datos relativos al control metabólico de los pacientes. La glucemia en ayunas era de 160,5±57,3mg/dl, y la HbA1c, de 7,7±1,26%. Solo un 31,7% de los pacientes mostraban criterios de adecuado control metabólico (HbA1c≤7,0 en 2 de los últimos 3 controles realizados), un 31,1% tenían niveles de HbA1c comprendidos entre 7,1 y 8,0, un 23,6% entre 8,1 y 9,0 y un 13,4% mostraban valores >9%. Hallamos una correlación negativa significativa (rho de Spearman: −0,40; p<0,001) entre HbA1c y péptidoC (fig. 1) y entre glucosa en ayunas y péptidoC (rho de Spearman: −0,27; p<0,01).
Datos relativos al control metabólico de los pacientes
| HbA1c (%) | Glucemia ayunas (mg/dl) | PA (mmHg) | cHDL (mg/dl) | cLDL (mg/dl) | TG (mg/dl) | eFG (ml/min) | Alb/crea (mg/g) |
|---|---|---|---|---|---|---|---|
| 7,7±1,3 | 160±57 | 128/75 | 65±18 | 96±27 | 90±43 | 80±22 | 12,9 |
Alb/crea: ratio albúmina/creatinina en orina; cHDL: colesterol HDL; cLDL: colesterol LDL; eFG: estimación del filtrado glomerular; PA: presión arterial; TG: triglicéridos.
En general el control lipídico general fue muy satisfactorio: colesterol HDL 65±18mg/dl; colesterol LDL 96±27mg/dl; triglicéridos 89±44mg/dl. El filtrado glomerular estimado (eFG) fue de 80±22ml/min y solamente en un 5% de los casos se observaron valores propios de insuficiencia renal (eFG<60ml/min). La ratio albúmina/creatinina urinaria media fue de 12,9mg/g. El 7,6% de los pacientes cumplían criterios de microalbuminuria (ratio 30-300mg/g) y apenas el 0,6% presentaban macroalbuminuria (ratio >300mg/g). La cifra media de presión arterial observada fue de 128/75mmHg.
El 44,4% de los pacientes seguían tratamiento con fármacos antihipertensivos, el 55% con estatinas, el 7,8% con otros hipolipemiantes y el 18,3% con antiagregantes plaquetarios.
Una mayoría de los pacientes (72,0%) no mostraban evidencia clínica de complicaciones crónicas relacionadas con la diabetes (tabla 3). Dentro del 28% restante, la mayor parte de las complicaciones observadas (23,1%) eran microangiopáticas: retinopatía no proliferativa 7,2%, retinopatía proliferativa 3,3%, edema macular diabético 1,6%, nefropatía incipiente 6,6%, nefropatía avanzada 1,1%, neuropatía sensitiva 3,3%. Solamente en el 4,9% de los pacientes se detallaba diagnóstico de alguna complicación macroangiopática: cardiopatía isquémica 3,3%, enfermedad arterial periférica 1,6%. No hemos recogido ningún caso de accidente cerebrovascular.
Complicaciones crónicas y fármacos de esfera cardiovascular
| No compl. | Compl. micro | Compl. macro | AntiHTA | Estatinas | Otros hipolipemiantes | AAS |
|---|---|---|---|---|---|---|
| 72,0% | 23,1% | 4,9% | 44,4% | 55,0% | 7,8% | 18,3% |
AAS: ácido acetilsalicílico; AntiHTA: antihipertensivos; Compl: complicaciones; macro: macroangiopáticas; micro: microangiopáticas.
En la actualidad LADA se considera un extremo del espectro de las diabetes autoinmunes, aunque no constituye un grupo diferenciado dentro de la clasificación general de diabetes, sino una variante dentro de la categoría de DM1.
La diabetes autoinmune latente ya fue descrita4 en 1986 como una forma de DM que se desarrollaba en adultos, sin dependencia de insulina durante un periodo inicial pero con un fracaso precoz a hipoglucemiantes orales, presencia de ICA y otros anticuerpos organoespecíficos frecuentemente asociados. Los pacientes descritos en dicha publicación tenían un menor IMC y menor reserva pancreática de péptidoC al compararlos con los adultos diabéticos ICA negativos.
El término LADA se introdujo en 19956 para describir a un subgrupo de pacientes con las características clínicas referidas que presentaba positividad de GADA.
Dada la heterogeneidad fisiopatológica de la diabetes, resulta frecuentemente una simplicidad pretender atribuir de forma exclusiva la categoría de DM1 o DM2 a pacientes que presentan una predisposición genética a ambos tipos de diabetes o que están sujetos a la influencia de factores ambientales que condicionan el desarrollo de resistencia insulínica. De hecho, se ha observado que los pacientes con LADA comparten características genéticas propias de la DM1 clásica7,8, pero con frecuencia también presentan similitudes genéticas con DM29, lo cual sugiere una naturaleza entremezclada en esta forma de diabetes.
El diagnóstico de LADA en la población estudiada en el presente trabajo se ha basado en la positividad de GADA en pacientes en los que se sospechaba clínicamente dicha entidad (diagnóstico en edad adulta, ausencia de cetoacidosis e insulino-independencia inicial, variabilidad glucémica con componente posprandial marcado, etc.). Por tanto, las características de los sujetos no son equiparables a las de los estudios de cribado inmunológico no selectivo realizados en pacientes fenotípicamente DM2.
A este respecto, tal como se ha señalado previamente en nuestro medio10, no creemos que sea efectivo realizar un cribado generalizado de LADA en la población diabética adulta. No obstante, debería descartarse de forma sistemática cuando un adulto con diabetes no encaja con el estereotipo habitual de DM2.
Nuestros pacientes tienen como grupo un IMC más bajo del esperado para la población DM2, aunque presentan con frecuencia sobrepeso, lo cual concuerda con otros estudios realizados11. Por ello la presencia de un IMC elevado no debe excluir o retrasar el cribado de LADA si coexisten otros factores clínicos de sospecha.
Diversos estudios han observado que los niveles de péptidoC plásmático son menores como grupo en los sujetos con LADA en relación con DM212,13. En nuestro estudio evidenciamos una importante heterogeneidad en la reserva pancreática que además guarda una correlación negativa con el control glucémico. Por ello, si se sospecha clínicamente LADA, la presencia de niveles detectables de péptidoC no debe excluir esta entidad hasta obtener los resultados del estudio inmunológico.
No existen actualmente directrices para el tratamiento de LADA, aunque algunos estudios han evidenciado que la administración temprana de insulina o fármacos orales sensibilizadores puede ser beneficiosa para preservar la reserva pancreática a largo plazo, mientras que las sulfonilureas podrían reducir el tiempo de insulino-independencia14-16. En nuestro trabajo hallamos una correlación negativa entre niveles de péptidoC y control glucémico, lo que subraya la importancia de realizar una identificación temprana de LADA tanto para incrementar el tiempo de insulino-independencia como para mejorar el control metabólico de los pacientes.
Se ha señalado que el título de GADA guarda una relación inversa con la reserva pancreática y podría ser un indicador del riesgo de progresión hacia la dependencia de insulina14,17-19. En nuestro trabajo no hemos encontrado asociación entre los valores de GADA, niveles de péptidoC ni tiempo de insulino-independencia, pero debemos reconocer que el nuestro no es un estudio prospectivo y el estudio inmunológico y metabólico no se corresponde con el comienzo clínico sino que se ha demorado con frecuencia hasta varios años.
El presente trabajo tiene otras limitaciones evidentes. Se trata de un estudio observacional basado en la información contenida en las historias clínicas, lo cual está sujeto a defectos o a errores de recogida de datos. El sesgo por omisión, especialmente en la presencia de complicaciones crónicas, podría ser significativo y subestimar su prevalencia, sin tener en cuenta las formas subclínicas. La selección de los pacientes se ha realizado siguiendo los criterios diagnósticos más consensuados5, pero somos conscientes de sus limitaciones: el criterio de edad es arbitrario, el tiempo de insulino-independencia es muy médico-dependiente y los niveles de GADA pueden disminuir con el tiempo e incluso negativizarse en casos de larga evolución20. Con menor rigidez de selección el número de casos recogido hubiera aumentado notablemente, pero también habríamos aumentado el número de falsos positivos. Por último, reconocemos que, al tratarse de pacientes atendidos en atención especializada, la población estudiada probablemente no represente fidedignamente el colectivo global de LADA.
A pesar de estas limitaciones, creemos que nuestro trabajo puede ayudar a definir en nuestro medio a los pacientes con LADA para poder identificarlos como tal con prontitud y seleccionar el tratamiento más adecuado, evitando de esta forma años de incomprensión por parte de paciente, de los familiares y del equipo médico.
Como conclusión, señalamos que en la población estudiada el diagnóstico de LADA puede retrasarse hasta varios años. Existe bastante heterogeneidad en la reserva pancreática de insulina de los pacientes, la cual se relaciona negativamente con el tiempo de evolución de la enfermedad. El tratamiento de los pacientes con LADA resulta con frecuencia complicado, como lo refleja el deficiente control glucémico a pesar del alto grado de cumplimentación de pautas de insulinización completas. Sin embargo, observamos un satisfactorio grado de control de otros objetivos terapéuticos, como presión arterial y perfil lipídico, junto a una baja incidencia de complicaciones macroangiopáticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Miguel Sampedro por su ayuda en el tratamiento estadístico y elaboración de gráficas.
Alpañés, Macarena; Andía, Victor, Arranz, Alfonso; Arrieta, Francisco; Brito, Miguel; Calle Alfonso; Canovas, Gloria; del Cañizo, Francisco; Cruces, Eva; Durán, María; García, Elena; Gargallo, Manuel; González, Noemí; González, Olga; Lecumberri, Edurne; Lisbona, Arturo; Maillo, Maria Angeles; Nattero, Lía; Parra, Paola; Sánchez, Iván.