El síndrome triple A es un trastorno multisistémico, de herencia autosómica recesiva, originado por mutaciones en el gen AAAS localizado en el cromosoma 12q13 que codifica la proteína ALADIN. Se caracteriza por alacrimia, acalasia e insuficiencia suprarrenal secundaria a resistencia a hormona adrenocorticotrópica (ACTH).
Presentamos el caso de una mujer de 39 años, que acudió a consultas de Neurología por dificultad para la marcha, presente desde la infancia pero con empeoramiento progresivo en los últimos años. Entre sus antecedentes familiares destaca una hermana con acalasia. Como antecedentes personales presentaba bronquiectasias desde la infancia y cirugía por pies cavos. Su tratamiento consistía en colecalciferol 25.000 UI/mes.
Desde la infancia refería dificultad en la marcha, debilidad de las extremidades, disfagia, diaforesis sin causa conocida, fotofobia y alacrimia. En los últimos 3-4 años presentaba astenia e hipotensión.
La exploración física objetivó una voz nasal y atrofia de la musculatura. El peso era de 57,2kg, la talla de 163cm (IMC 21,5kg/m2) y la tensión arterial 120/86mmHg. Presentaba hipoalgesia en guante y calcetín y los reflejos osteotendinosos eran vivos. La agudeza visual era 0,2 y presentaba atrofia óptica junto con conjuntivitis seca severa.
El electroneurograma objetivó disminución de amplitudes en los nervios mediano, cubital y tibial. La biopsia muscular fue inespecífica y la resonancia cerebral tampoco mostró alteraciones.
La analítica fue normal e incluyó bioquímica rutinaria con hemograma, ácido láctico, creatina-fosfocinasa (CPK), ácidos orgánicos en orina, aminoácidos en plasma y orina, acilcarnitinas, ácido fitánico, betacolestanol. Sólo destacaban valores de glucemia basal en el límite bajo de la normalidad.
Ante este cuadro neurológico complejo, se solicitó estudio de exoma clínico, que detectó una variante en homocigosis en el gen AAAS: c.1058T>C (p.Ile353Thr) (NM_015665). Esta variante aparece descrita en las bases de datos consultadas como variante de significado clínico incierto (rs765757844). Se realizó el estudio en los hermanos, y se confirmó que la hermana, sintomática (aunque con menor afectación) era portadora también en homocigosis. En el otro hermano sano se detectó en heterocigosis. Teniendo en cuenta estos resultados y que el análisis bioinformático realizado predecía que da lugar a enfermedad, se consideró como variante patogénica y se confirmó así el diagnóstico de síndrome triple A. La paciente fue remitida a consultas de Endocrinología.
La analítica solicitada objetivó: glucosa 71mg/dL, proteínas totales 7,65g/dL, albúmina 4,39g/dL, prealbúmina 17,3mg/dL, creatinina 0,55mg/dL, colesterol total 140mg/dL, triglicéridos 97mg/dL, sodio 139 mmol/L, potasio 4,2 mmol/L, calcio corregido 9,1mg/dL, cortisol basal 8,4μg/dL, DHEAS 0,4μg/mL, ACTH 31 pg/mL, ácido fólico 2,73 ng/mL, vitamina B12 309 pg/mL, TSH 1,62μUI/mL. El resto de la analítica, incluyendo hormonas hipofisarias y eje renina-angiotensina-aldosterona, fue normal.
El test de Synacthen (ACTH 23,9 pg/mL, cortisol basal 12,7 y a los 30 minutos 16,5μg/dL) diagnosticó la insuficiencia suprarrenal parcial y se inició tratamiento sustitutivo con hidroaltesona, remitiendo la astenia e hipotensión.
Tras el diagnóstico de acalasia con manometría, se implementaron modificaciones dietéticas.
Además de la triada mencionada, existen casos de triple A con neuropatía autonómica (síndrome 4A) o con 2 de las manifestaciones (síndrome 2A). La incidencia real es desconocida, debido a los casos sin diagnosticar y a aquellos pacientes que fallecerán por crisis adrenales, generalmente durante la infancia1.
La alacrimia parece el síntoma más común (> 90% pacientes) y precoz pero puede pasar desapercibida hasta que no aparecen los signos de sequedad ocular (queratopatía, úlcera corneal).
En el 70% de los casos, el síntoma que propicia el diagnóstico es la insuficiencia suprarrenal. Generalmente se manifiesta en la infancia y más excepcionalmente en la segunda década de la vida. La edad media de aparición en la serie de pacientes evaluados por Grant era 1-8,3 años de vida2. Ya que las crisis adrenales son la principal causa de mortalidad en los pacientes con síndrome triple A no tratados y se ha descrito algún caso con inicio en la tercera década de la vida, no debe excluirse el diagnóstico si en la valoración inicial el eje suprarrenal es normal3.
Existe gran variabilidad en el grado de insuficiencia suprarrenal que puede aparecer en este síndrome, ya que incluso existen dos casos de síndrome triple A con diagnóstico en la cuarta y sexta década de la vida sin presentar en ese momento insuficiencia suprarrenal4,5.
Para considerarse insuficiencia suprarrenal secundaria a resistencia a ACTH, los niveles de ésta deberían ser al menos el doble del límite superior normal de referencia. El valor normal de ACTH y la aparición tardía del déficit hormonal son otra excepcionalidad de este caso. Podría hipotetizarse que esta nueva mutación se asocie con el desarrollo progresivo y tardío de insuficiencia suprarrenal por mecanismos diferentes a la resistencia a ACTH. No obstante, y debido al valor límite de cortisol que presentó la paciente, queda pendiente una reevaluación con el test de hipoglucemia insulínica.
En cambio, el déficit de mineralocorticoides sólo aparece en el 15% de los casos por lo que la mayoría de los pacientes no precisan tratamiento con fludrocortisona6,7.
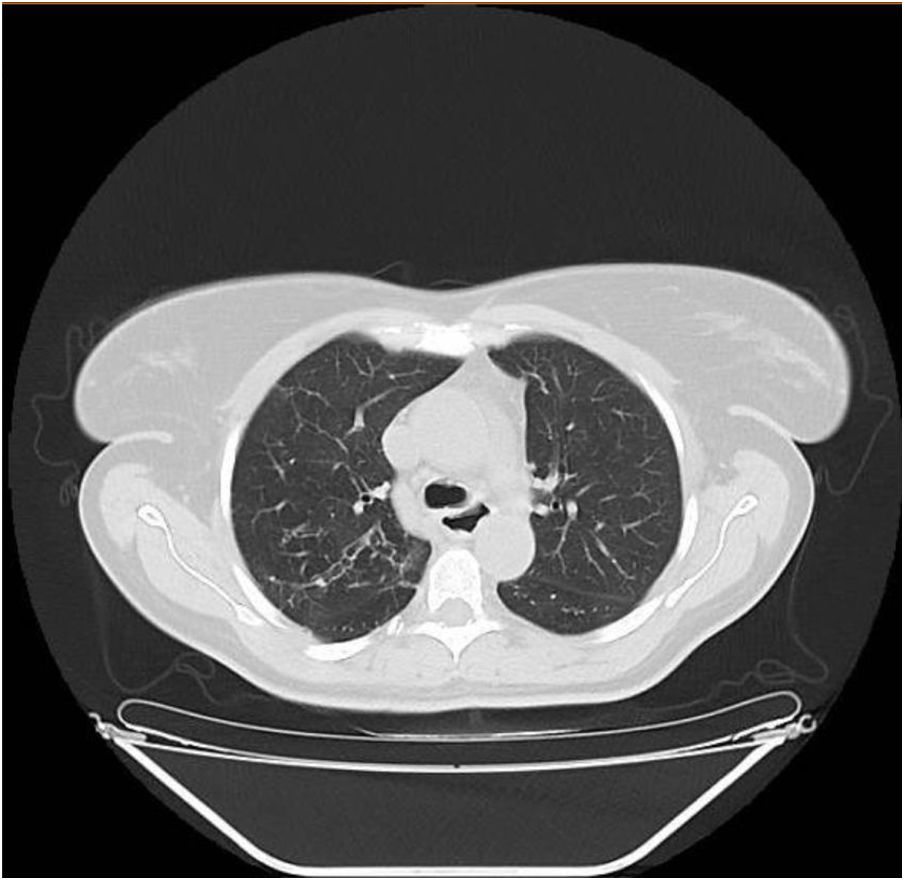
La acalasia en menores de 15 años sólo aparece en el 5% de los casos. Nuestra paciente muy probablemente ya presentaba acalasia en la infancia (sintomatología compatible y bronquiectasias, figura 1). La evaluación nutricional es vital ya que incluso aquellos en los que se realiza la miotomía, la ganancia de peso postintervención es menor que en aquellos pacientes con acalasia no asociada a síndromes genéticos8.
La edad de aparición de la clínica neurológica es variable, pero por lo general aparece en la edad adulta9. El diagnóstico diferencial incluye la adrenoleucodistrofia o esclerosis múltiple, entre otros10. Una vez tratada la insuficiencia suprarrenal, el factor pronóstico más relevante es la sintomatología neurológica (progresiva). Esta incluye neuropatía periférica sensitivo-motora, síndrome piramidal, trastornos autonómicos, disfunción bulbar, atrofia óptica o ataxia.
El síndrome triple A es debido a mutaciones patológicas en el gen AAAS, el cual codifica para la nucleoporina ALADIN. Estas mutaciones alteran el transporte de proteínas necesarias para la reparación del ADN (apraxatina, DNA ligasa I), lo que provoca hipersensibilidad al estrés oxidativo. Este incremento en el estrés oxidativo a nivel nuclear parece ser responsable de la progresión clínica en el síndrome triple A.
Se han descrito más de 75 mutaciones en el gen AAAS sin encontrarse asociación genotipo-fenotipo. De hecho, el fenotipo es variable incluso entre individuos con el mismo genotipo11. Por ello, aunque el estudio genético es imprescindible para el diagnóstico, no aporta información sobre el fenotipo o el pronóstico del paciente. Algunos pacientes no presentan mutaciones en dicho gen, por lo que pueden existir otros genes implicados.
El caso descrito es único no sólo por ser el primero asociado a la variante c.1058T>C, sino por la afectación precoz neurológica/digestiva y aparición tardía de insuficiencia suprarrenal de mecanismo fisiopatológico desconocido.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.