Los tumores hipofisarios (TH) suponen el 15% de los tumores intracraneales, y afectan del 10,7 al 14,4% de la población, si bien la incidencia de los TH clínicamente relevantes es de 5,1 casos/100.000 habitantes. El tratamiento quirúrgico está indicado en los TH que cursan con hipersecreción hormonal (a excepción de los TH productores de prolactina), así como en aquellos con clínica compresiva local o neurológica global. Los pacientes con TH requieren una atención multidisciplinar, idealmente en un centro de excelencia y basada en un protocolo asistencial bien definido. Con el objetivo de facilitar y estandarizar la práctica clínica ante este tipo de tumores, el presente documento recoge el posicionamiento del Área de Conocimiento de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición (SEEN) y la Sociedad Española de Neurocirugía (SENEC) sobre el manejo y el seguimiento prequirúrgico, quirúrgico y posquirúrgico del paciente con un TH.
Pituitary tumors (PT) account for 15% of intracranial tumors affect 10.7 to 14.4% of the population although the incidence of clinically relevant PT is 5.1 cases/100,000 inhabitants. Surgical treatment is indicated in PTs with hormone hypersecretion (except for prolactin-producing PTs) and those with local compressive or global neurological symptoms. Multidisciplinary care, is essential for patients with PTs, preferably delivered in a center of excellence and based on a well-defined care protocol. In order to facilitate and standardize the clinical procedures for this type of tumor, this document gathers the positioning of the Neuroendocrinology Knowledge Area of the Spanish Society of Endocrinology and Nutrition (SEEN) and the Spanish Society of Neurosurgery (SENEC) on the management of patients with PTs and their preoperative, surgical and postoperative follow-up.
Los tumores hipofisarios (TH) suponen el 15% de los tumores intracraneales. Se detectan incidentalmente entre el 10,7 y el 14,4% de la población, si bien la incidencia de TH clínicamente relevantes es de 5,1 casos por 100.000 habitantes/año y su prevalencia es superior a 100 casos por 100.000 habitantes1,2. Suelen ser adenomas benignos de comportamiento indolente3, aunque ocasionalmente pueden mostrar un carácter agresivo causando una morbilidad significativa4. Cuando cursan con compresión local o con hipersecreción hormonal, la cirugía es habitualmente el tratamiento de elección a excepción de los prolactinomas, en los que la cirugía se reserva para casos con resistencia o intolerancia al tratamiento médico y/o con afectación visual aguda1,5,6.
Idealmente los pacientes con TH deben ser atendidos por un equipo multidisciplinar experto (que incluya al menos: endocrinología, neurocirugía, neurorradiología y oftalmología) que, tras evaluar cada caso, establecerá los actos asistenciales necesarios, entre ellos la indicación quirúrgica7.
Hasta la actualidad, no se ha publicado ningún documento de consenso europeo8 sobre el manejo perioperatorio de los pacientes con TH. El Área de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición (SEEN), ha constituido un grupo de endocrinólogos y neurocirujanos expertos en esta enfermedad con el fin de elaborar un documento de consenso multidisciplinar sobre el manejo periquirúrgico de los pacientes con TH.
Indicaciones quirúrgicas en los tumores hipofisariosLa cirugía hipofisaria está indicada en los tumores del área selar con hipersecreción hormonal (a excepción de la prolactina), con clínica compresiva local (quiasma, nervios ópticos, nervios oculomotores o hipopituitarismo), o con clínica neurológica global (hidrocefalia, hipertensión intracraneal, etc.).
En el caso de los TH secretores de prolactina, se ha propuesto la intervención quirúrgica con intención curativa como tratamiento de primera línea en mujeres con macroprolactinomas con deseo gestacional a corto plazo9.
Las indicaciones quirúrgicas de los TH y de otras lesiones del área selar y paraselar10,11 se resumen en la tabla 1.
Indicaciones generales de la cirugía hipofisaria en los TH y otras lesiones selares
| Indicaciones de cirugía primaria en los TH |
| • TH funcionantes distintos a prolactinomas: acromegalia12, TSHoma52, enfermedad de Cushing53, gonadotropinomas |
| • Prolactinomas resistentes al tratamiento médico o casos con intolerancia al mismo9,54. Prolactinomas con importante componente quístico y compresión visual asociada o con compromiso visual significativo agudo o rápidamente progresivo |
| • TH no funcionantes >1cm sintomáticos: con clínica compresiva (pérdida visual, oftalmoparesia, déficits neurológicos, hidrocefalia obstructiva, cefaleas (refractarias, no atribuibles a otras causas), cercano o que comprime el quiasma o nervios ópticos y/o con signos de hipopituitarismo35 |
| • TH no funcionante asintomático >2cm o con crecimiento progresivo en pruebas de imagen35,55 |
| • TH asociado a apoplejía hipofisaria que presente alteración severa del nivel de conciencia y/o disminución de agudeza visual y/o defectos graves en el campo visual de presentación aguda, persistente o con deterioro progresivo56 |
| Indicaciones de reintervención en los TH |
| • De carácter urgente:- Epistaxis aguda sin respuesta a tratamiento conservador- Neumoencéfalo posquirúrgico a tensión- Sangrado intracraneal con efecto masa |
| • Programado:- Resección subtotal previa con efecto masa clínica o radiológicamente significativo sobre el aparato óptico- Hiperproducción hormonal persistente tras una cirugía hipofisaria fallida con tumor resecable en la RM o en la PET con 11C-metionina- Crecimiento progresivo de resto tumoral quirúrgicamente accesible o resecable especialmente tras fracaso de otras opciones de segunda línea (farmacológicas o RT)- Reducción del TH para facilitar una RT/RC eficaz |
| Indicaciones de cirugía en otras lesiones del área selar/paraselar |
| • Craneofaringiomas10 |
| • Sospecha de metástasis hipofisaria asociada a clínica compresiva11 |
| • Cualquier otra lesión selar asociada a clínica compresiva, cercana o que comprime el quiasma o nervios ópticos y/o con signos de hipopituitarismo |
PET: tomografía por emisión de positrones; RC: radiocirugía; RM: resonancia magnética nuclear; RT: radioterapia; TH: tumor hipofisario; TSHoma: tirotropinoma.
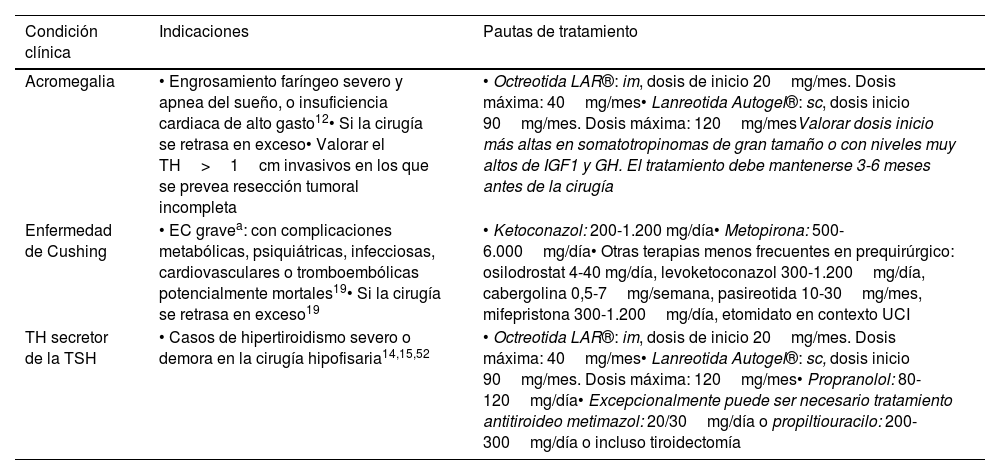
El tratamiento prequirúrgico con análogos de la somatostatina de primera generación (ASS-1G) durante 3-6 meses está indicado en pacientes con engrosamiento faríngeo severo, apnea del sueño, o insuficiencia cardiaca de alto gasto12. Además, en la práctica clínica, es frecuente su indicación cuando el periodo de espera hasta la intervención se estima prolongado, así como en pacientes con macroadenomas invasivos con escasa posibilidad de curación quirúrgica. Las pautas de tratamiento se resumen en la tabla 2.
Tratamiento médico prequirúrgico de la hipersecreción y de los déficits hormonales: indicaciones y pautas de tratamiento
| Condición clínica | Indicaciones | Pautas de tratamiento |
|---|---|---|
| Acromegalia | • Engrosamiento faríngeo severo y apnea del sueño, o insuficiencia cardiaca de alto gasto12• Si la cirugía se retrasa en exceso• Valorar el TH>1cm invasivos en los que se prevea resección tumoral incompleta | • Octreotida LAR®: im, dosis de inicio 20mg/mes. Dosis máxima: 40mg/mes• Lanreotida Autogel®: sc, dosis inicio 90mg/mes. Dosis máxima: 120mg/mesValorar dosis inicio más altas en somatotropinomas de gran tamaño o con niveles muy altos de IGF1 y GH. El tratamiento debe mantenerse 3-6 meses antes de la cirugía |
| Enfermedad de Cushing | • EC gravea: con complicaciones metabólicas, psiquiátricas, infecciosas, cardiovasculares o tromboembólicas potencialmente mortales19• Si la cirugía se retrasa en exceso19 | • Ketoconazol: 200-1.200 mg/día• Metopirona: 500-6.000mg/día• Otras terapias menos frecuentes en prequirúrgico: osilodrostat 4-40 mg/día, levoketoconazol 300-1.200mg/día, cabergolina 0,5-7mg/semana, pasireotida 10-30mg/mes, mifepristona 300-1.200mg/día, etomidato en contexto UCI |
| TH secretor de la TSH | • Casos de hipertiroidismo severo o demora en la cirugía hipofisaria14,15,52 | • Octreotida LAR®: im, dosis de inicio 20mg/mes. Dosis máxima: 40mg/mes• Lanreotida Autogel®: sc, dosis inicio 90mg/mes. Dosis máxima: 120mg/mes• Propranolol: 80-120mg/día• Excepcionalmente puede ser necesario tratamiento antitiroideo metimazol: 20/30mg/día o propiltiouracilo: 200-300mg/día o incluso tiroidectomía |
EC: enfermedad de Cushing; GH: hormona del crecimiento; IGF1: insulin-like growth factor-1; im: intramuscular; sc: subcutáneo; TH: tumor hipofisario; TSH: hormona estimulante de la tiroides; UCI: unidad de cuidados intensivos.
Si existe la necesidad de una rápida normalización del cortisol, se recomienda el tratamiento con un inhibidor de la esteroidogénesis suprarrenal; osilodrostat y metirapona son los que tienen la acción más rápida y están disponibles por vía oral19.
En la enfermedad de Cushing debe procurarse el control prequirúrgico del hipercortisolismo para minimizar la morbimortalidad quirúrgica7,13. Para ello, disponemos de fármacos de acción central sobre la secreción de corticotropina (ACTH), de inhibidores de la esteroidogénesis adrenal y de antagonistas del receptor de glucocorticoides (GC) (tabla 2).
Tumores hipofisarios secretores de hormona estimulante de la tiroidesPreviamente a la intervención es conveniente el tratamiento con ASS-1G, generalmente asociados a propranolol, para normalizar la función tiroidea14,15 (tabla 2).
Tratamiento médico prequirúrgico de los déficits hormonalesIdealmente debe valorarse la función hipofisaria antes de la intervención y sustituir, si existen, los déficits de ACTH, de hormona estimulante de la tiroides (TSH) y las posibles alteraciones iónicas tal y como se indica en la tabla 3.
Tratamiento prequirúrgico de los déficits hormonales
| Condición clínica | Indicaciones | Pautas de tratamiento |
|---|---|---|
| Administración de glucocorticoides profilácticos o por déficit de la ACTH | Administrar si:• Eje hipófiso-adrenal no evaluado• IA previa: cortisol sérico 8-9am <5μg/dl o entre 5-8μg/dl asociado a otros déficits hipofisarios o cortisol tras test de 1-24 ACTH <18μg/dla• Tratamiento crónico previo con GC• Hipofisectomía total o sección del tallo hipofisario• Apoplejía hipofisariaNo se recomienda:• Cortisol sérico 8-9am≥15μg/dl o tras test de 1-24 ACTH≥18μg/dlו Cortisol sérico 8-9am≥ 9μg/dl en entornos estrechamente monitorizados57,58• En casos de adenomectomía selectiva transesfenoidal | • Profiláctico (protocolo de Inder et al.59)• Dosis ajustadas y pauta de tratamiento corta para reevaluación posquirúrgica precoz59:Hidrocortisona:• día −1 (antes de cirugía): 20-40mg/día oral• día 0 (cirugía): 50-100mg iv de inducción, seguidos de 50mg/8h iv• día 1: 25mg/8h iv• día 2: 25mg vo a las 8 am y suspender• días 3-5: reevaluar cortisol basalDexametasona:• día 0 (cirugía): 4mg iv de inducción• día 1: 2mg iv/vo a las 8 am• día 3: 0,5mg iv/vo a las 8 am y suspender• días 3-5: reevaluar cortisol basal |
| Déficit de la TSH | • Hipotiroidismo secundario o primario | • Levotiroxina: 1,4 a 1,7μg/kg/día• Dosis más bajas en ancianos, cardiópatas y en hipotiroidismos severos de larga evolución60• Siempre con corrección previa del déficit de ACTH si este existe |
| Déficit de la ADH | • Infrecuente en TH, frecuente en lesiones con extensión supraselar: craneofaringiomas y metástasis hipofisarias61 | • Desmopresina vo, sublingual, intranasal o iv (equivalencias: 200μg vo=120μg sublingual=10mg intranasal=1μg iv) |
| Déficit de GH | • No se recomienda tratamiento | • No se recomienda tratamiento |
| Déficit de la FSH/LH | • Valorar tratamiento si la cirugía se va a demorar de forma significativa y es un paciente sintomático | • Varones: Testosterona im; undecanoato de testosterona (1.000mg/cada 10-14 semanas); cipionato de testosterona (100-250mg/cada 2-4 semanas). Testosterona transdérmica: gel de testosterona (50mg/día)• Mujeres: Estrógenos orales o transdérmicos. Asociar progestágenos si útero intacto |
ACTH: hormona adrenocorticotropa; ADH: hormona antidiurética; FSH: hormona foliculoestimulante; GC: glucocorticoides; GH: hormona del crecimiento; IA: insuficiencia adrenal; im: intramuscular; iv: intravenoso; LH: hormona luteinizante; sc: subcutáneo; TH: tumor hipofisario; TSH: hormona estimulante de la tiroides; vo: vía oral.
Se recomienda establecer los puntos de corte de referencia de la población a estudio en cada centro. En pacientes en tratamiento con anticonceptivos hormonales orales se deben considerar puntos de corte más elevados (habitualmente >21μg/dl)62.
Solo se recomienda la cobertura perioperatoria con GC en los siguientes escenarios: pacientes con insuficiencia adrenal (IA) confirmada, en casos en los que la integridad del eje adrenal no se ha podido evaluar, en pacientes en tratamiento crónico previo con GC, y en aquellos casos en los que se prevé que el procedimiento quirúrgico vaya a generar un déficit de ACTH (hipofisectomía total o sección del tallo hipofisario, cirugía por enfermedad de Cushing o por apoplejía hipofisaria)16 (tabla 3).
Profilaxis antitrombótica y antibióticaLa enfermedad de Cushing aumenta más de 10 veces la incidencia de eventos tromboembólicos venosos respecto a los pacientes con TH no funcionantes sometidos a cirugía17,18. Por ello, se recomienda el tratamiento con heparinas de bajo peso molecular entre 2-14 días antes de la intervención y hasta 2-6 semanas después de la intervención19 en los pacientes de mayor riesgo: antecedentes de embolia, pruebas de coagulación anormal, hipercortisolismo grave, tratamiento con estrógenos, escasa movilidad, estancia hospitalaria prolongada y, en casos con altas concentraciones de cortisol posoperatorio o de terapia de reemplazo con GC a dosis elevadas en pacientes con IA.
La profilaxis antibiótica reduce de forma muy significativa la tasa de infecciones posquirúrgicas20, por lo que se recomienda la administración intravenosa de antibióticos en la inducción anestésica de la cirugía hipofisaria21. Además, en el caso del abordaje endoscópico endonasal22 se recomienda el tratamiento con antibióticos durante las 24-48h poscirugía23.
Procedimientos quirúrgicosObjetivos de la cirugíaLos objetivos de la cirugía en los TH son: 1) la exéresis tumoral, 2) la descompresión de la vía visual y del tejido glandular hipofisario y 3) la remisión de la enfermedad endocrinológica causada por los tumores hiperfuncionantes.
Procedimientos quirúrgicosEl abordaje endoscópico es la técnica más empleada en la actualidad24. El abordaje transcraneal está indicado cuando el TH presenta invasión cerebral, o rodea a los vasos del polígono de Willis o a los nervios ópticos25.
Selección de la vía y técnica quirúrgicaAbordaje transesfenoidalTras la adecuada colocación del paciente en la mesa operatoria, se dan 3 fases quirúrgicas: 1) Fase nasal: luxación lateral del cornete medio para exponer el receso esfeno-etmoidal, 2) Fase esfenoidal: apertura de la pared anterior esfenoidal con el objetivo de exponer la silla turca y las estructuras neurovasculares paraselares y 3) Fase selar: incisión de la duramadre para iniciar la extirpación tumoral.
En los microadenomas se recomienda identificar la seudocápsula que los rodea para realizar su exéresis completa. En los macroadenomas primero se vacía el core tumoral, para posteriormente realizar una resección extracapsular del mismo26. Para finalizar, la reconstrucción selar es obligatoria para conferir estanqueidad en el compartimento licuoral cerebral.
Abordaje transcranealLa opción más empleada es el abordaje frontotemporal (pterional).
Técnicas complementarias intraoperatoriasNavegadorSe recomienda su uso en aquellos casos en los que no hay referencias anatómicas intraoperatorias identificables: en reintervenciones, tumores gigantes que engloban la arteria carótida e infiltran el seno esferoidal, en presencia de anomalías vasculares y en variantes anatómicas en la neumatización del seno esfenoidal27,28.
Doppler intraoperatorioSerá especialmente recomendable su uso en reintervenciones y tumores gigantes, o en caso de invasión del seno cavernoso con distorsión de la anatomía quirúrgica.
Resonancia magnética intraoperatoriaSu beneficio deriva fundamentalmente de la detección de remanentes tumorales intraselares que hubieran podido pasar inadvertidos durante la intervención. Actualmente la resonancia magnética (RM) intraoperatoria está implantada en pocos centros, y su uso por lo tanto no está generalizado29.
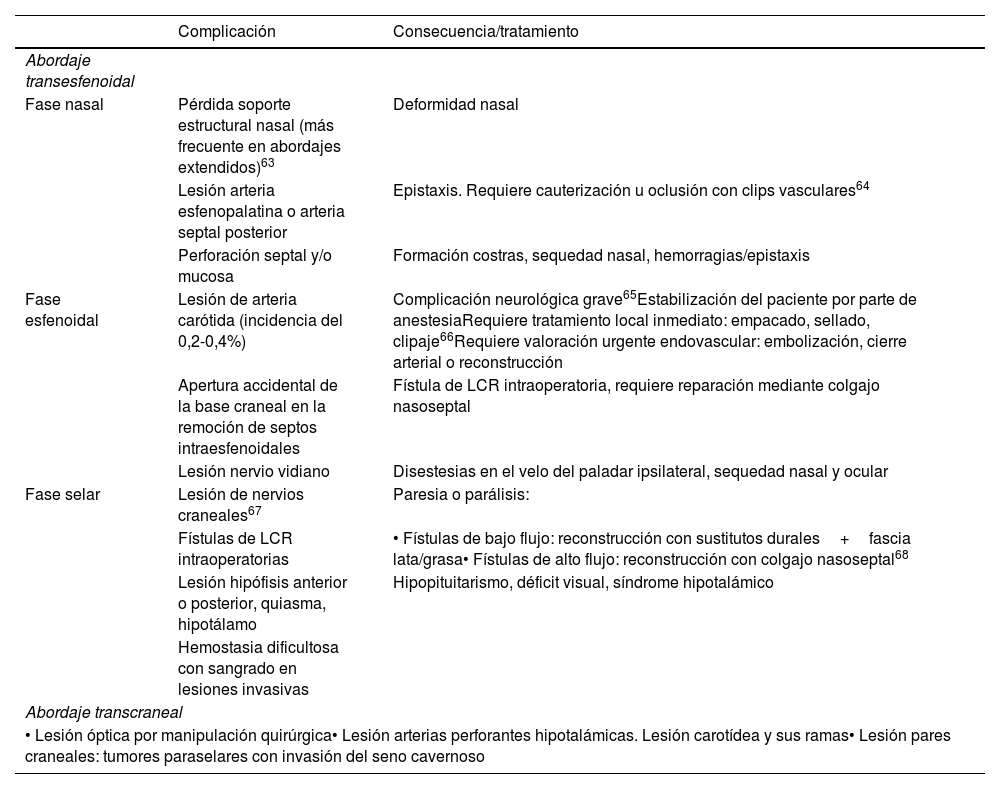
Complicaciones intraoperatoriasCentrándonos en el abordaje transesfenoidal, las principales complicaciones y su repercusión se detallan en la tabla 4.
Complicaciones intraoperatorias
| Complicación | Consecuencia/tratamiento | |
|---|---|---|
| Abordaje transesfenoidal | ||
| Fase nasal | Pérdida soporte estructural nasal (más frecuente en abordajes extendidos)63 | Deformidad nasal |
| Lesión arteria esfenopalatina o arteria septal posterior | Epistaxis. Requiere cauterización u oclusión con clips vasculares64 | |
| Perforación septal y/o mucosa | Formación costras, sequedad nasal, hemorragias/epistaxis | |
| Fase esfenoidal | Lesión de arteria carótida (incidencia del 0,2-0,4%) | Complicación neurológica grave65Estabilización del paciente por parte de anestesiaRequiere tratamiento local inmediato: empacado, sellado, clipaje66Requiere valoración urgente endovascular: embolización, cierre arterial o reconstrucción |
| Apertura accidental de la base craneal en la remoción de septos intraesfenoidales | Fístula de LCR intraoperatoria, requiere reparación mediante colgajo nasoseptal | |
| Lesión nervio vidiano | Disestesias en el velo del paladar ipsilateral, sequedad nasal y ocular | |
| Fase selar | Lesión de nervios craneales67 | Paresia o parálisis: |
| Fístulas de LCR intraoperatorias | • Fístulas de bajo flujo: reconstrucción con sustitutos durales+fascia lata/grasa• Fístulas de alto flujo: reconstrucción con colgajo nasoseptal68 | |
| Lesión hipófisis anterior o posterior, quiasma, hipotálamo | Hipopituitarismo, déficit visual, síndrome hipotalámico | |
| Hemostasia dificultosa con sangrado en lesiones invasivas | ||
| Abordaje transcraneal | ||
| • Lesión óptica por manipulación quirúrgica• Lesión arterias perforantes hipotalámicas. Lesión carotídea y sus ramas• Lesión pares craneales: tumores paraselares con invasión del seno cavernoso | ||
LCR: líquido cefalorraquídeo.
En el informe quirúrgico debe quedar reflejado: 1) la vía de abordaje, 2) la descripción de la técnica quirúrgica completa en sus distintas fases, 3) la descripción de la lesión y 4) la técnica de cierre empleada. En la tabla 5 se presenta una propuesta de informe básico.
Contenido del informe tras la cirugía de tumor hipofisario
| Tipo de abordaje | ||
|---|---|---|
| • Transesfenoidal | Descripción: | Observaciones |
| ∘ Endonasal endoscópico | • Sellar | |
| ∘ Microscópico | • Expandido | |
| • Transcraneal | ∘ Transtuberculum/planum | |
| ∘ Transcavernoso | ||
| ∘ Transclival |
| Técnica quirúrgica | ||
|---|---|---|
| Fase nasal | ||
| Estructuras resecadas | • Cornete medio (uni/bilateral) | |
| • Etmoidectomía parcial/completa (uni/bilateral) | ||
| • Tabique post/anterior (perforaciones) | ||
| Fase intraselar | ||
| Grado de resección: | Intracapsular | Sangrado arterial: |
| Total | Extracapsular | Sí |
| Parcial | Destechamiento art. carótida (dcha./izq.): | No |
| Resto tumoral intencional | Sí | Sangrado venoso: |
| Localización | No | Sí |
| Justificación: | Apertura del diafragma selar: | No |
| Salida LCR | Sí | |
| Lesión nerviosa | No | |
| Descripción del tumor hipofisario | Consistencia | |
| Vascularización | ||
| Invasión seno cavernoso izquierdo: Sí. No | ||
| Invasión seno cavernoso derecho: Sí. No | ||
| Glándula normal: Sí. No | ||
| Plano de clivaje | ||
| Glándula | ||
| Estructuras vecinas | ||
| Fase intra-aracnoideaa | ||
| Planos de disección | ||
| Adherencia a estructuras | ||
| Relación con el III ventrículo | ||
| Reconstrucción cierre | ||
|---|---|---|
| • Colgajo libre | • Mucosa cornete medio | • Parche dural |
| • Colgajo pediculado | • Nasoseptal (dcho./izq.), pared lateral | • Sellador |
| • Materiales sintéticos | • Cornete inferior (dcho./izq.) | • Sonda |
| • Materiales autólogos | • Grasa | • Taponamiento nasal |
| • Fascia lata | ||
| Eventos sistémicos |
|---|
| • Reacciones alérgicas |
| • Dificultad vía aérea |
| • Inestabilidad cardiorrespiratoria |
| • Vagal hiperactividad vagal |
LCR: líquido cefalorraquídeo.
El informe histopatológico estandarizado es fundamental para clasificar el tipo de lesión, y permitirá ajustar los tratamientos posteriores, e intentar predecir su comportamiento futuro30.
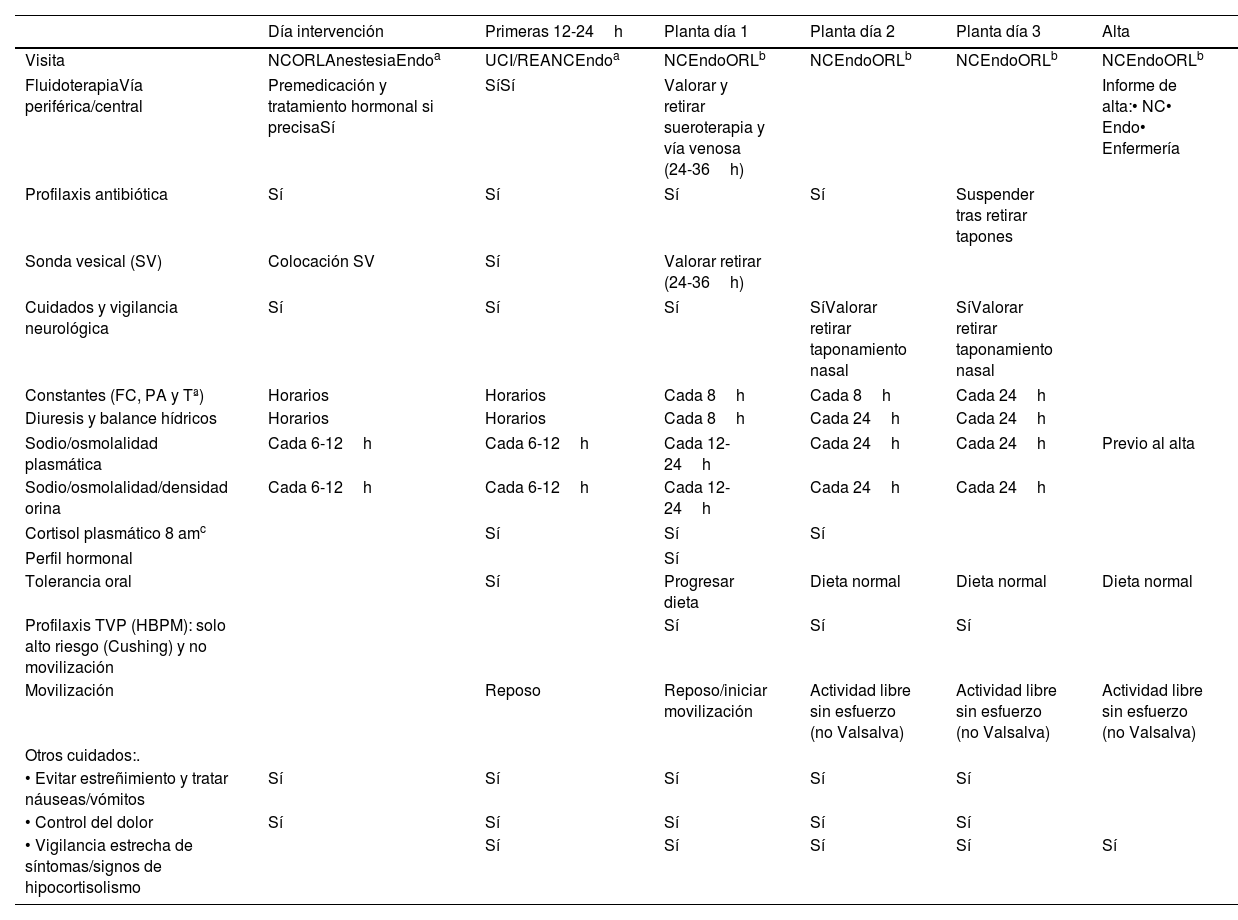
Control posquirúrgicoEn la fase posquirúrgica tenemos 2 etapas bien diferenciadas, la primera engloba el día de la intervención y las primeras 24h, y la segunda se corresponde con el ingreso del paciente en planta.
Día de intervención y primeras 24 h en la unidad de reanimación anestésicaEl manejo en el pre- y posoperatorio inmediato se describe en la tabla 6.
Día de intervención y primeras 24h en la unidad de reanimación anestésica
| Preoperatorio e intraoperatorio | • Revisión de tratamientos previos (antihipertensivos, antianginosos, antiarrítmicos, broncodilatadores, etc.) que se administrarán según protocolos generales de cirugía intracraneal69• Valoración de necesidad de cobertura perioperatoria con corticoides• Manejo de la hiperglucemia y de la diabetes mediante los protocolos habituales de hospitalización. Se recomienda suspender los hipoglucemiantes orales el día previo a la intervención• Canalizar 2 vías venosas periféricas para fluidoterapia convencional (valorar vía central en casos de alto riesgo quirúrgico [abordajes expandidos])• Sondaje vesical: balances hídricos horarios• Profilaxis antiemética: las náuseas o vómitos presentes hasta en el 40% de los casos pueden incrementar la presión intracraneal70• Profilaxis antibiótica• Tratamiento del dolor: AINE, opiáceos en segunda línea y con especial precaución en pacientes SAHS• Evitar los sedantes de acción prolongada que interfieran con la evaluación del estado neurológico del paciente |
| Poscirugía | Traslado del paciente a la UCI en el caso de34:• Lesiones gigantes con importante extensión supraselar que requieran un abordaje complejo y prolongado• Complicaciones quirúrgicas graves• Comorbilidades médicas graves |
| Controles (primeras 2-24h posquirúrgicas):• Horario: constantes (FC, PA, Tª), diuresis y balance hídrico• Cada 6-12h: sodio y osmolalidad plasmática y urinaria, densidad urinaria• Cada 24h (primeras 72h): cortisol plasmático basal |
AINE: antinflamatorio no esteroideo; DM2: diabetes mellitus tipo 2; FC: frecuencia cardiaca; PA: presión arterial; REA: unidad de reanimación anestésica; SAHS: síndrome de apnea del sueño; Tª: temperatura; UCI: unidad de cuidados intensivos.
En general, el paciente puede pasar a planta en las 12-24h posteriores a la intervención. En planta se controlarán las constantes habitualmente cada 8h incluido el balance hídrico. La vía venosa, la fluidoterapia y la sonda vesical se podrán retirar a las 24-36h. El ionograma con sodio, y la osmolalidad en plasma y en orina junto con la densidad urinaria se pueden espaciar a cada 12-24h según la situación clínica y los balances hídricos. A las 48-72h es recomendable realizar un perfil hipofisario para evaluar la aparición de nuevos déficits hormonales, además de orientar en la valoración de remisión y/o persistencia de la enfermedad en los TH funcionantes junto con el resto de las exploraciones31–33 (tabla 7).
Cronograma del perioperatorio inmediato
| Día intervención | Primeras 12-24h | Planta día 1 | Planta día 2 | Planta día 3 | Alta | |
|---|---|---|---|---|---|---|
| Visita | NCORLAnestesiaEndoa | UCI/REANCEndoa | NCEndoORLb | NCEndoORLb | NCEndoORLb | NCEndoORLb |
| FluidoterapiaVía periférica/central | Premedicación y tratamiento hormonal si precisaSí | SíSí | Valorar y retirar sueroterapia y vía venosa (24-36h) | Informe de alta:• NC• Endo• Enfermería | ||
| Profilaxis antibiótica | Sí | Sí | Sí | Sí | Suspender tras retirar tapones | |
| Sonda vesical (SV) | Colocación SV | Sí | Valorar retirar (24-36h) | |||
| Cuidados y vigilancia neurológica | Sí | Sí | Sí | SíValorar retirar taponamiento nasal | SíValorar retirar taponamiento nasal | |
| Constantes (FC, PA y Tª) | Horarios | Horarios | Cada 8h | Cada 8h | Cada 24h | |
| Diuresis y balance hídricos | Horarios | Horarios | Cada 8h | Cada 24h | Cada 24h | |
| Sodio/osmolalidad plasmática | Cada 6-12h | Cada 6-12h | Cada 12-24h | Cada 24h | Cada 24h | Previo al alta |
| Sodio/osmolalidad/densidad orina | Cada 6-12h | Cada 6-12h | Cada 12-24h | Cada 24h | Cada 24h | |
| Cortisol plasmático 8 amc | Sí | Sí | Sí | |||
| Perfil hormonal | Sí | |||||
| Tolerancia oral | Sí | Progresar dieta | Dieta normal | Dieta normal | Dieta normal | |
| Profilaxis TVP (HBPM): solo alto riesgo (Cushing) y no movilización | Sí | Sí | Sí | |||
| Movilización | Reposo | Reposo/iniciar movilización | Actividad libre sin esfuerzo (no Valsalva) | Actividad libre sin esfuerzo (no Valsalva) | Actividad libre sin esfuerzo (no Valsalva) | |
| Otros cuidados:. | ||||||
| • Evitar estreñimiento y tratar náuseas/vómitos | Sí | Sí | Sí | Sí | Sí | |
| • Control del dolor | Sí | Sí | Sí | Sí | Sí | |
| • Vigilancia estrecha de síntomas/signos de hipocortisolismo | Sí | Sí | Sí | Sí | Sí | |
am: antes de mediodía; Endo: endocrinología; FC: frecuencia cardiaca; HBPM: heparina de bajo peso molecular; NC: neurocirugía; ORL: otorrinolaringólogo; PA: presión arterial; REA: unidad reanimación anestésica; Tª: temperatura; TVP: trombosis venosa profunda; UCI: unidad de cuidados intensivos.
En relación con la profilaxis del tromboembolismo venoso tras la cirugía, las medias de compresión elástica externa, la elevación de los miembros inferiores y favorecer la deambulación precoz (evitando maniobras de Valsalva), pueden evitar el uso de la heparina subcutánea de manera rutinaria31,34. El manejo en la planta de hospitalización se resume en la tabla 7.
Complicaciones neuroquirúrgicas posoperatoriasLas principales complicaciones en el posoperatorio inmediato y su manejo se describen en la tabla 8.
Complicaciones posoperatorias precoces, incidencia y manejo66,71,72
| Complicaciones | Incidencia | Manejo |
|---|---|---|
| Nasosinusales | 0,24-4,8% | • Epistaxis significativa: estabilización y taponamiento (2-5 días) o reexploración quirúrgica urgente• Realizar arteriografía cerebral urgente o angioTC en caso de sospecha de lesión de la ACI |
| Fístula LCR | 1,1-3% | • Valorar tras la retirada del taponamiento: muestra de líquido exudado nasal para determinación de β-traza o β2-transferrina73,74• Cierre quirúrgico precoz±drenaje lumbar (IMC>25kg/m2 o alto flujo) |
| Meningitis | 0,3-2,1% | Tratamiento fístula, punción lumbar y antibioterapia (vancomicina+cefepime/ceftazidima/meropenem) |
| Hidrocefalia agudaNeumoencéfalo hipertensivo | 0,8-1,6% | UCI, DVE |
| HSAVasoespasmo | 0,1-0,7% | UCI, tratamiento médico: euvolemia, evitar hipoTA, nimodipino |
| Visuales:• Agudeza visual, diplopía | 0,3-4% | • TC craneal urgente: reintervención en caso de hematoma selar• Pauta corta de dexametasona (si es secundario a la manipulación quirúrgica) |
ACI: arteria carótida interna; DVE: drenaje ventricular exterior; HSA: hemorragia subaracnoidea; IMC: índice de masa corporal; TA: tensión arterial; UCI: unidad de cuidados intensivos.
La cirugía puede conseguir recuperar función hipofisaria hasta en el 30% de los pacientes con hipopituitarismo preexistente, pero induce nuevas deficiencias hormonales entre el 2 y el 15% de los casos35. En la enfermedad de Cushing, hasta el 25% de los casos desarrollan algún grado de hipopituitarismo por la mayor manipulación hipofisaria durante la cirugía y por la localización medial de los corticotropinomas.
Evaluación de la función hipofisaria anterior en el posoperatorio inmediatoLa valoración clínica del paciente junto a la determinación del cortisol plasmático matutino es la prueba más utilizada y sencilla para valorar la integridad del eje hipotálamo-hipófiso-adrenal (HHA). Un valor de cortisol matutino a las 72h de la cirugía inferior a 2,1μg/dl (<60nmol/l) es indicativo de IA posquirúrgica. Por el contrario, en pacientes sin déficit de ACTH previo y tras una cirugía hipofisaria selectica, un valor superior a 9,7μg/dl (>270nmol/l) sugiere suficiencia suprarrenal36. En el periodo posoperatorio ni el estímulo con ACTH (Synacthen®), ni la hipoglucemia insulínica son útiles para la evaluación del eje HHA.
El diagnóstico de hipotiroidismo central es bioquímico y se caracteriza por niveles reducidos de tiroxina libre (T4L) junto con una TSH inapropiadamente baja, normal o levemente elevada. Tras la cirugía, se recomienda iniciar tratamiento con levotiroxina si las cifras de T4L disminuyen un 20% o si aparecen síntomas35.
Los déficits de GH, FSH y LH no se evalúan en el posoperatorio inmediato, ya que su recuperación puede postergarse por más de un año.
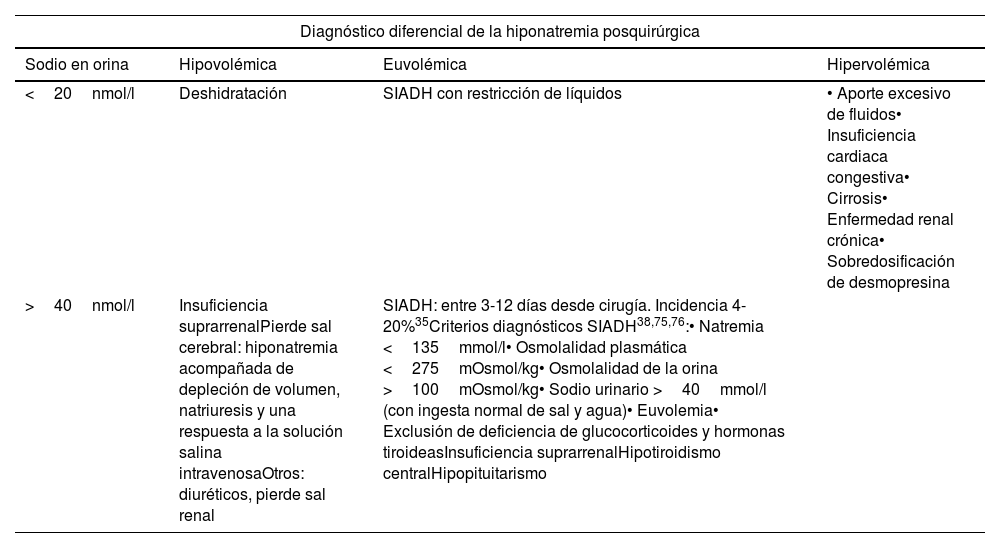
Evaluación de la función hipofisaria posterior en el posoperatorio inmediato: complicaciones hidroelectrolíticasHiponatremiaEl estudio diagnóstico de la hiponatremia y los criterios diagnósticos de la secreción inadecuada de vasopresina o hormona antidiurética (SIADH) se resumen en la tabla 9.
Diagnóstico diferencial de la hiponatremia tras la cirugía de un tumor hipofisario y criterios diagnósticos del SIADH
| Diagnóstico diferencial de la hiponatremia posquirúrgica | |||
|---|---|---|---|
| Sodio en orina | Hipovolémica | Euvolémica | Hipervolémica |
| <20nmol/l | Deshidratación | SIADH con restricción de líquidos | • Aporte excesivo de fluidos• Insuficiencia cardiaca congestiva• Cirrosis• Enfermedad renal crónica• Sobredosificación de desmopresina |
| >40nmol/l | Insuficiencia suprarrenalPierde sal cerebral: hiponatremia acompañada de depleción de volumen, natriuresis y una respuesta a la solución salina intravenosaOtros: diuréticos, pierde sal renal | SIADH: entre 3-12 días desde cirugía. Incidencia 4-20%35Criterios diagnósticos SIADH38,75,76:• Natremia <135mmol/l• Osmolalidad plasmática <275mOsmol/kg• Osmolalidad de la orina >100mOsmol/kg• Sodio urinario >40mmol/l (con ingesta normal de sal y agua)• Euvolemia• Exclusión de deficiencia de glucocorticoides y hormonas tiroideasInsuficiencia suprarrenalHipotiroidismo centralHipopituitarismo | |
SIADH: síndrome de la secreción insuficiente de la hormona antidiurética.
Fuente: adaptado de Garrahy et al.37.
La mayoría de las hiponatremias neuroquirúrgicas suelen ser leves. Sin embargo, la hiponatremia moderada-grave (sodio <120 mmol/l o descenso de la natremia superior a 10mmol/l en 48h), es la causa más frecuente de nueva hospitalización tras cirugía. Dentro de las estrategias de tratamiento, las principales son: la restricción de líquidos, evitar una fluidoterapia excesiva en posoperatorio, y favorecer la autorregulación (beber según la sed).
La administración de solución salina hipertónica al 3% (SSH3%) debe reservarse para la hiponatremia moderada o grave (<125mmoL/l) y/o sintomática. Se recomienda administrar una infusión de SSH3% a una velocidad de 0,5 a 2ml/kg/h o utilizar bolos de SSH3% a dosis de 2-4ml/kg (100-150ml) cada 20-40min con el objetivo de incrementar el sodio plasmático no más de 8mmol/ en 24h para reducir el riesgo de desmielinización osmótica35,37,38.
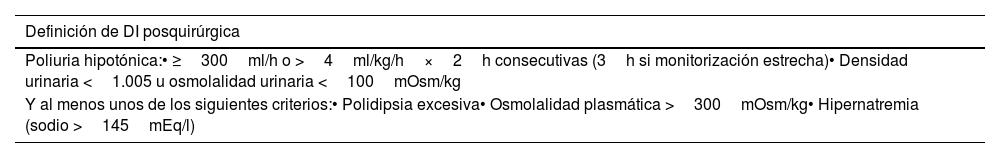
Diabetes insípida (déficit de vasopresina)La diabetes insípida (DI) transitoria es la complicación más frecuente de la cirugía hipofisaria. La poliuria es el síntoma más evidente, y puede ser debida a distintos factores: fluidoterapia excesiva, ingesta excesiva de líquidos por el taponamiento nasal, cobertura con GC a dosis elevadas, o enfermedad de Cushing y acromegalia en las que el descenso de cortisol y GH dará como resultado un balance de líquidos negativo durante las primeras 48h tras la cirugía. El diagnóstico de la DI se basa en hallazgos clínicos y de laboratorio (tabla 10).
Definición de diabetes insípida tras cirugía de hipófisis
| Definición de DI posquirúrgica |
|---|
| Poliuria hipotónica:• ≥300ml/h o >4ml/kg/h×2h consecutivas (3h si monitorización estrecha)• Densidad urinaria <1.005 u osmolalidad urinaria <100mOsm/kg |
| Y al menos unos de los siguientes criterios:• Polidipsia excesiva• Osmolalidad plasmática >300mOsm/kg• Hipernatremia (sodio >145mEq/l) |
DI: diabetes insípida.
Fuente: adaptado de De Vries et al.77.
El objetivo del tratamiento de la DI es asegurar el mantenimiento de la homeostasis osmótica. Se recomienda que el paciente haga «higiene de líquidos» (que beba según la sed). Si el paciente no es capaz de reponer por vía oral las pérdidas urinarias, se debe mantener la fluidoterapia para adecuar los balances hídricos. El tratamiento farmacológico con desmopresina debe estar condicionado a la presencia del cuadro poliúrico-polidípsico con balances hídricos negativos o con hipernatremia.
Evaluación mediante resonancia magnética inmediataLa RM precoz (24-48h poscirugía) puede ser de utilidad para evaluar la resección tumoral, detectar enfermedad residual, evaluar la preservación de la glándula y del tallo hipofisario (prever posibles déficits), así como para valorar una posible reintervención precoz o planificar una terapia adyuvante39,40.
Tratamiento médico y recomendaciones al altaEs recomendable un informe conjunto realizado por neurocirugía y endocrinología junto con el alta de los cuidados de enfermería. Debe incluir recomendaciones generales (tabla 11) e individuales de acuerdo con el estado hormonal posquirúrgico, el riesgo de hiponatremia, el tipo de abordaje quirúrgico y el desarrollo de fugas de LCR intraoperatorias.
Recomendaciones al alta tras la cirugía hipofisaria34,75,77-79
| Recomendaciones al alta: |
| • Higiene de líquidos: beber solo si se tiene sed |
| • Restricción de líquidos: 1l/día durante una semana (en pacientes seleccionados) |
| • Aerosol nasal de suero salino cada 12h |
| • Conocer síntomas de insuficiencia suprarrenal o hiponatremia (anorexia, náuseas, astenia, hipotensión o somnolencia) |
| • Conocer síntomas de diabetes insípida (polidipsia excesiva, poliuria inadecuada, nicturia) |
| • Conocer síntomas de sospecha de meningitis o fistula LCR (fiebre, cefalea intensa, rigidez de nuca, rinolicuorrea) |
| • Evitar maniobras de Valsalva al menos el primer mes |
| • En casos de apnea del sueño no usar CPAP hasta cicatrización de la mucosa nasal (4-6 semanas) |
| • Evitar baños de vapor o saunas, sumergir la cabeza o viajar en avión |
CPAP: presión positiva continua en la vía aérea: LCR: líquido cefalorraquídeo.
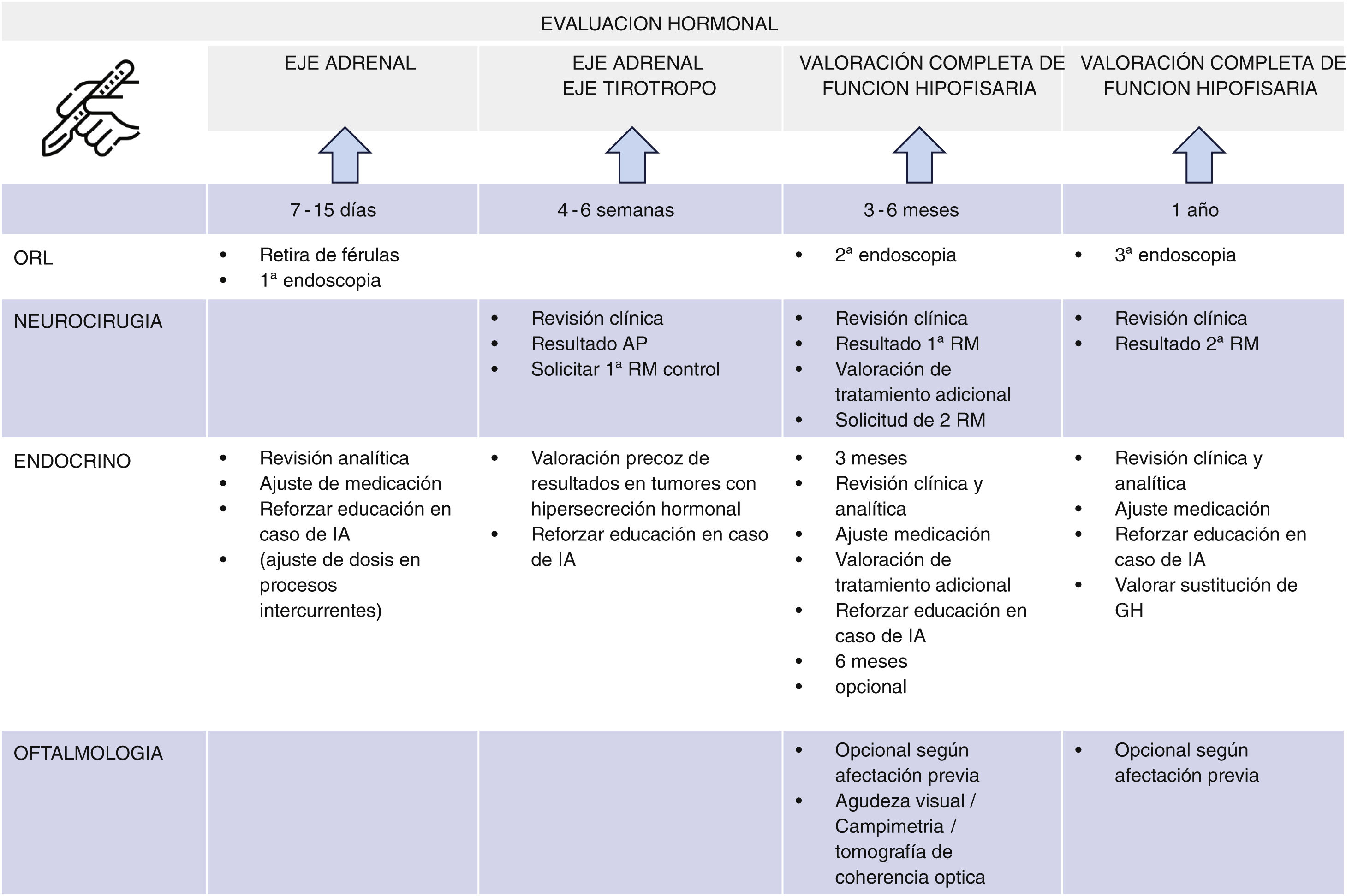
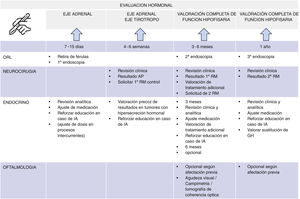
El seguimiento recomendado se resume en la figura 1 e incluye las siguientes visitas31.
Cronograma de seguimiento multidisciplinar posquirúrgica del paciente con un tumor hipofisario. Tiempos recomendados para las revisiones médicas, determinaciones hormonales y evaluación de las pruebas de imagen.
AP: anatomía patológica; GH: hormona del crecimiento; IA: insuficiencia suprarrenal; RM: resonancia magnética.
* Siempre que haya afectación visual. ** La evaluación de la sustitución del déficit de la GH no se plantea hasta el año poscirugía, una vez constatada estabilidad y correcta suplementación del resto de ejes hipofisarios.
- •
Evaluación basal del eje adrenal: ajuste/retirada de tratamiento y reforzar pautas de actuación en días de enfermedad en pacientes con IA.
- •
Balance hídrico y ionograma.
- •
Valoración de posibles complicaciones posquirúrgicas.
- •
Revisión del informe de anatomía patológica.
- •
En tumores funcionantes con exéresis probablemente incompleta, evaluación funcional de la hipersecreción para valorar inicio de tratamiento médico.
- •
Valoración del eje adrenal y tirotropo.
- •
Valoración de posibles complicaciones posquirúrgicas.
- •
Revisión otorrinolaringología.
- •
Solicitud control RM.
Evaluación completa que incluirá:
- •
Perfil hormonal completo de la función hipofisaria con evaluación específica de normalización bioquímica en tumores funcionantes, evaluación de la recuperación o pérdida de función hipofisaria (tabla 12).
Tabla 12.Valoración posoperatoria de la adenohipófisis
Diagnóstico Tratamiento y control Comentarios Insuficiencia adrenal central (IA) Cribado:• Cortisol sérico 8-9 am y ACTH plasmática antes de la toma de GC matinalLos resultados de laboratorio «normales» no excluyen un diagnóstico de IAConfirmación:4-6 semanas poscirugíaUse uno (o más) entre:• Prueba de estimulación con ACTH para cortisol• Prueba de hipoglucemia inducida por insulina Tratamiento:GC en general hidrocortisona 15-20mg/d divididos en 2 o 3 tomasSeguimiento:El control de la terapia de reemplazo de esteroides no es analítico (ni cortisol ni ACTH basal). Se basa en la clínica del paciente y en el control del peso corporal, la presión arterial y calidad de vida • El tratamiento de la IA puede desenmascarar la DI central• Adiestramiento del paciente y familiares en días de enfermedad o intercurrenciaEl test de Synacthen® no debe realizarse antes de 6 semanas poscirugía (la glándula adrenal requiere tiempo para desestructurarse en ausencia de ACTH) Hipotiroidismo central Cribado:TSH sérica y T4L6-8 semanas poscirugía Tratamiento:Titular T4L cada 6-8 semanas hasta una dosis de mantenimiento (normalmente alrededor de 1,6μg/kg)Seguimiento: Determinación en suero de T4L con el objetivo de mantener los niveles en zona media/superior del rango de referencia • La TSH sérica no es útil durante el seguimiento de hipotiroidismo central• Excluir IA antes de iniciar levotiroxina (T4L mejora el aclaramiento de cortisol y puede causar una crisis suprarrenal) Hipogonadismo central Cribado:LH sérica, FSH, prolactina testosterona total (en varones), y estradiol (en mujeres premenopáusicas)Confirmación:3 meses poscirugía• En varones: una segunda determinación testosterona puede ser necesaria, además de SHBG y testosterona biodisponible en casos seleccionados Tratamiento:• Varones: testosterona si no desean fertilidad• Mujeres: estrógenos si no desea fertilidad. Agregar progestágenos si el paciente tiene un útero intactoSeguimiento:Varones: testosterona total, PSA y hematocritoMujeres: la presencia de la menstruación regular indica un nivel estrogénico adecuado de terapia de reemplazo. Nivel de estradiol sérico y FSH es opcional• Gonadotropinas: control de tratamiento de fertilidad • Menstruaciones regulares en ausencia de tratamiento hormonal o anticonceptivos descartan el hipogonadismo• La vía transdérmica de los estrógenos interfiere menos en el caso de la terapia de reemplazo con GH concurrente (la vía oral reduce la sensibilidad periférica a la GH)• La EC y la hiperprolactinemia pueden causar hipogonadismo per se. Por lo que la evaluación bioquímica del hipogonadismo central no se debe realizar hasta varios meses después de confirmar el éxito quirúrgico (los efectos del hipercortisolismo pueden permanecer a más largo plazo) Déficit de GH adulto El inicio de tratamiento con GH en pacientes sin déficit previo no se plantea hasta pasado un año de la cirugía, siempre con otros déficits asociados de función hipofisaria y sin resto tumoral significativoCribado:IGF-1 séricoConfirmación:• No requiere si hay 3 ejes afectados• Hipoglucemia insulínica• Estimulación de GHRH+arginina• Estimulación con glucagón Tratamiento:rhGHIniciar con dosis bajas: 0,15-0,3mg/díaDosis de mantenimiento: 0,15-1mg/díaSeguimiento:• IGF-1 sérico objetivo la mitad superior del rango de referencia ajustados por edad• La calidad de vida, el peso corporal, la glucosa, la circunferencia de la cintura y la presión arterial también son parámetros importantes • El tratamiento con GH puede desenmascarar la IA o el hipotiroidismo central• Excluir IA: rhGH bloquea la conversión de cortisona a cortisol• Excluir hipotiroidismo central:∘ La rhGH puede reducir la T4 libre∘ Conduce a falsos negativos de las pruebas dinámicas• Las mujeres fértiles (estrógenos) generalmente requieren una dosis de GH superior a la de los varones ACTH: hormona adrenocorticotrópica; IA: insuficiencia suprarrenal; EC: enfermedad de Cushing; DI: diabetes insípida; FSH: hormona estimulante del folículo; GC: glucocorticoides; GH: hormona del crecimiento; GHRH: hormona liberadora de la hormona del crecimiento; IGF-1: factor de crecimiento similar a la insulina tipo 1; LH: hormona luteinizante; T4L: levotiroxina; rhGH: hormona del crecimiento humana recombinante; SHBG: globulina transportadora de hormonas sexuales; TRH: hormona liberadora de tirotropina; TSH: hormona estimulante de la tiroides.
- •
Analítica básica con ionograma, glucosa/HbA1c y en casos de alteraciones hidroelectrolíticas o DI, osmolaridad plasmática, volumen urinario, osmolaridad urinaria y Na+/K+ en orina.
- •
Revisión en neurocirugía: clínica y valoración de la RM poscirugía.
- •
Reevaluación oftalmológica en el caso de defectos previos.
- •
Revisión de otorrinolaringología según sea preciso.
Evaluación hormonal completa incluyendo eje somatotropo, en este momento se evalúa la sustitución con GH, solicitud de una nueva RM (fig. 1).
Criterios de control/curación en los tumores hipofisariosEnfermedad de CushingEl desarrollo de una IA central transitoria después de la cirugía hipofisaria es un indicador de curación y/o remisión.
El punto de corte de cortisol basal poscirugía que establece remisión/curación no es unánime, así como tampoco el momento exacto de su determinación. Se ha de iniciar tratamiento sustitutivo con hidrocortisona cuando el cortisol sérico se encuentra por debajo de 5,0μg/dl, o los pacientes presenten síntomas de IA (tabla 13).
Criterios de control en los tumores hipofisarios funcionantes
| Criterios de curación/controls | |
|---|---|
| Enfermedad de Cushing | La IA transitoria después de la cirugía hipofisaria indica remisiónCortisol basal a las 8 am: suele realizarse entre 1 y 7 días poscirugía (antes de la administración matutina de GC):• Remisión muy probable cortisol basal <50nmol/l (1,8-2μg/dl)• Remisión probable cortisol <138nmol/l (5μg/dl)• Enfermedad persistente probable para valores >200nmol/l (7,2μg/dl)• El paciente puede desarrollar un «síndrome de abstinencia de GC» inmediatamente después de la cirugía: puede durar hasta 6-12 meses. Se caracteriza por síntomas similares a los de IA a pesar de la terapia de reemplazo de GC adecuada. Los pacientes pueden beneficiarse del uso temporal de dosis más altas de GC, o de una disminución más lenta de las dosis orales de reemplazo en el período posoperatorio• Recuperada la IA posquirúrgica los niveles de ACTH y cortisol plasmático y urinario serán normales• RM 3-6 meses y anual si restos |
| Acromegalia | Evaluación temprana GH, no hay puntos de cortes establecidos:• IGF-1 a las 6 semanas puede ser útil en muchos casos• Un valor de IGF-1 normal y un valor de GH indetectable indican remisión quirúrgica• Si la GH es detectable (es decir >0,4g/l [si la medición se realiza con métodos ultrasensibles] o >1g/l [para métodos menos sensibles]), la medición de GH después de la sobrecarga de glucosa puede proporcionar información importante12 y es recomendable realizar si GH es >1g/l• RM 3-6 meses y anual si hay restos |
| Prolactinoma | • Una prolactina sérica <10ng/ml en el primer día posoperatorio predice la remisión bioquímica temprana y posterior80• Revalorar prolactina basal y resto de ejes (especialmente el gonadotropo) a partir de las 12 semanas de la cirugía• RM 3-6 meses y anual si restos |
| TSHoma | • Normalización de T4• Normalización o supresión prolongada de TSH incluso con hipotiroidismo central• RM 3-6 meses y anual sin restos |
ACTH: hormona adrenocorticotrópica GC: glucocorticoides; GH: hormono IA: insuficiencia adrenal; IGF-1: factor de crecimiento similar a la insulina tipo 1; RM: resonancia magnética; T4: tiroxina; TSH: hormona estimulante de la tiroides; TSHoma: tirotropinoma.
Incluso en los pacientes en remisión después de la cirugía hipofisaria el seguimiento ha de ser crónico debido a la posibilidad de recurrencia a largo plazo (descrita en un 5-35% de los pacientes)19 y para el manejo del síndrome post-Cushing.
AcromegaliaSe han propuesto diferentes niveles de GH el primer día tras cirugía41–43, incluso a las 6h44, como predictores de remisión. La concentración de IGF-1 a las 6 semanas de la cirugía suele emplearse para evaluar la remisión45. Algunos casos con niveles de IGF-1 ligeramente elevados en ese momento pueden terminar normalizando la concentración de IGF-1 en 3-6 meses46. Por lo tanto, es especialmente relevante la determinación de GH e IGF-1 basales a partir de las 12 semanas y añadir un test de GH tras sobrecarga oral de glucosa en los pacientes con niveles de GH >1μg/l12,47,48 (tabla 13).
ProlactinomaEn la práctica clínica habitual, se realiza una evaluación funcional (prolactina, función hipofisaria, especialmente eje gonadotropo) y de imagen a partir de las 12 semanas tras la cirugía. Según los resultados se valora la necesidad de tratamiento complementario según el diagnóstico histológico, y los criterios de agresividad tumoral.
TirotropinomaEn el caso de curación quirúrgica se corrige el hipertiroidismo central, y la TSH posoperatoria suele ser indetectable o baja semanas o incluso meses49. Puede llegar a causar un hipotiroidismo central transitorio o permanente ya sea por compresión tumoral previa de la glándula hipofisaria y de las células tirotropas normales, o por daño quirúrgico. En estos casos, es necesaria una terapia de reemplazo con T4L.
Tumor no funcionanteLa valoración hormonal para evaluar la recuperación o pérdida de función hipofisaria se realiza habitualmente a los 2-3 meses de la cirugía. La monitorización radiológica posquirúrgica es esencial en los TH no funcionantes debido a la falta de un marcador hormonal y de síntomas clínicos precoces que alerten de la progresión50.
En general la RM para la evaluación de restos se realizará a los 3-6 meses. El siguiente control es anual, y ambas RM sirven como referencia para el seguimiento posterior50.
Cuando no hay resto tumoral o éste es dudoso, la RM se repite anualmente durante 5 años y luego a los 7, 10 y 15 años50,51. Por el contrario, cuando hay un resto tumoral o imagen sospechosa, la RM se repite anualmente durante 5 años, y luego cada 2-3 años en ausencia de progresión, ajustando el calendario caso por caso según el tamaño del tumor, su progresión y la distancia a las vías ópticas.
FinanciaciónEl artículo fue financiado por la Fundación de la Sociedad Española de Endocrinología y Nutrición (FSEEN) gracias a una beca sin restricciones de Pfizer. Pfizer no ha participado en la redacción ni en su contenido. Este documento ha recibido el aval de la SEEN y de la Sociedad Española de Neurocirugía (SENEC).
Contribución de los autoresTodos los autores contribuyeron a la redacción del manuscrito, realizaron una revisión crítica del contenido y aprobaron la versión final del mismo.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses con respecto al contenido de este artículo.
Los autores agradecen la colaboración de la Dra. Miriam Ejarque y la Dra. Vanessa Marfil de Medical Statistics Consulting S.L., en la preparación y edición del manuscrito.
La versión íntegra del documento puede consultarse en línea en: https://www.seen.es/portal/areas-conocimiento/neuroendocrinologia/documentos/consensos-guias/recomendaciones-manejo-perioperatorio-tumores-hipofisarios