Se revisa el concepto de prebióticos, probióticos y simbióticos y su empleo en diferentes situaciones de la práctica clínica diaria relacionados con la nutrición clínica. Se analiza su papel en el tratamiento y/o prevención de la diarrea (aguda, por antibióticos, rádica), en la enfermedad inflamatoria intestinal (colitis ulcerosa y reservoritis), sobre la salud colónica (estreñimiento, intestino irritable), hepatopatías (esteatosis y encefalopatía mínima), en pacientes de cuidados intensivos, quirúrgicos y sometidos a trasplante hepático. Si bien parece demostrada su eficacia en la prevención de la diarrea por antibióticos y en la reservoritis en la colitis ulcerosa, son necesarios más estudios para poder establecer recomendaciones en la mayoría de escenarios clínicos. El riesgo de infección asociado al uso de probióticos es relativamente bajo; no obstante, existen grupos seleccionados de pacientes en los que se recomienda emplearos con cautela (como la infusión a nivel yeyunal).
The concept of prebiotics, probiotics, and symbiotics and their use in different situations of daily clinical practice related to clinical nutrition is reviewed, as well as their role in the treatment/prevention of diarrhea (acute, induced by antibiotics, secondary to radiotherapy), inflammatory bowel disease (ulcerative colitis and pouchitis), in colonic health (constipation, irritable bowel), in liver disease (steatosis and minimum encephalopathy), and in intensive care, surgical, and liver transplantation. While their effectiveness for preventing antibiotic-induced diarrhea and pouchitis in ulcerative colitis appears to be shown, additional studies are needed to establish recommendations in most clinical settings. The risk of infection associated to use of probiotics is relatively low; however, there are selected groups of patients in whom they should be used with caution (as jejunum infusion).
La superficie de la luz intestinal contiene billones de microorganismos vivos en un número equivalente a unas 10 veces el de células que componen una persona adulta. La mayoría de ellos se localizan en el colon, donde residen ciertas especies de bacterias. El intestino humano es, por tanto, un verdadero ecosistema esencial para la absorción eficiente de nutrientes y para el mantenimiento de la salud en general. En una versión persa del antiguo testamento, en el Génesis ya se apuntaba que la longevidad de Abraham era debida al consumo de «leche agria». Ya en el año 76 después de Jesucristo el historiador romano Plinio recomendaba la administración de lácteos fermentados para tratar la gastroenteritis. En 1908 el premio nobel Elie Metchnikoff atribuyó la longevidad de ciertas poblaciones balcánicas al consumo habitual de lácteos fermentados, que contenían lactobacilos que «reducirían las toxinas producidas por las bacterias intestinales, promoviendo la salud y prolongando la vida». A principios del sigloxx se describió que la bacteria Lactobacillus acidophilus podía sobrevivir en el intestino humano.
La fermentación ácido-láctica de alimentos procedentes de plantas parece que fue incorporada por los homínidos hace aproximadamente 1,5 millones de años. Esta práctica fue ampliamente usada en Europa hasta la revolución industrial, y todavía hoy en día es empleada habitualmente por diversas comunidades africanas, ya que es una forma segura y simple de conservar los alimentos. La ingesta de lácteos fermentados se incorporó, posiblemente, a la alimentación humana en fechas más recientes (hace unos 10.000años). En su evolución, los homínidos fueron adaptando su tracto gastrointestinal a un aporte diario más o menos elevado de bacterias ácido-lácticas vivas. En los países industrializados, durante el sigloxx se dejó de ingerir este tipo de alimentos, lo que posiblemente haya condicionado diferentes problemas gastrointestinales e inmunológicos. En la década de los ochenta se incorporó el concepto de que ciertos componentes no digeribles de la dieta podrían favorecer el crecimiento de determinadas cepas de bacterias en el intestino que se asocian a efectos beneficiosos para la salud1.
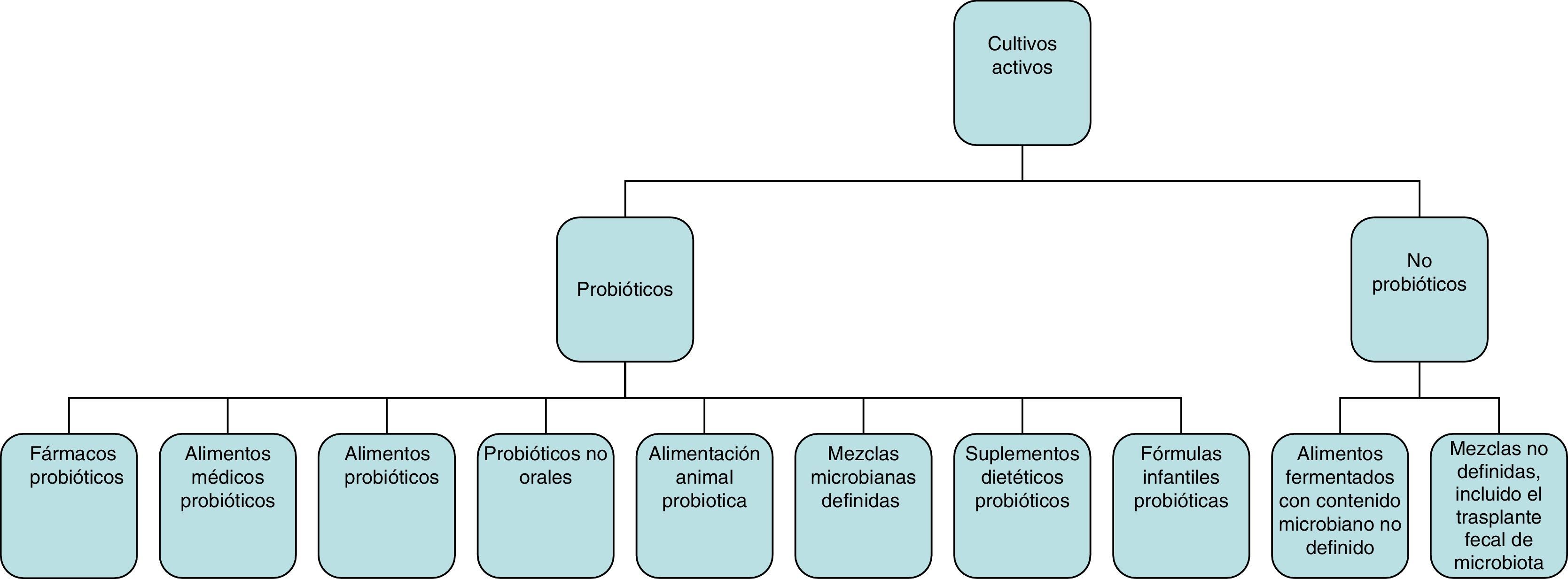
Concepto de probióticos, prebióticos y simbióticosSi bien la definición inicial de los probióticos propuesta en 1965 se refería a sustancias secretadas por los microorganismos que estimulan el crecimiento de otros (en oposición a los «antibióticos»)2,3, la definición de la OMS de «probiótico» se refiere a microorganismos vivos que cuando son administrados en cantidad adecuada ejercen un efecto beneficioso sobre la salud del huésped4. Según la Asociación Científica Internacional para los Probióticos y Prebióticos, el espectro de los productos y preparaciones que pueden considerarse como probióticos es muy amplio (fig. 1) y abarca desde fármacos probióticos (p.ej., VSL#3), alimentos de usos médicos especiales con probióticos (p.ej., nutrición enteral con probióticos), alimentos probióticos (p.ej., leches fermentadas con estudios que demuestran un beneficio sobre la salud), fórmulas infantiles (p.ej., leches en polvo) a probióticos de administración no oral (p.ej., vaginales). Para ser considerado probiótico es necesario que se hayan realizado estudios en humanos que efectivamente demuestren los beneficios concretos sobre la salud de las cepas concretas (p.ej., Lactobacillus rhamnosus GG; no solo del género Lactobacillus o la especie rhamnosus)3. Los alimentos fermentados que contienen organismos vivos en muchas ocasiones no cumplirían el concepto de probióticos si no se han estudiado específicamente sus efectos y/o no se conoce la cantidad que contienen. Por el contrario, algunos alimentos fermentados como el yogurt sí podrían considerarse, en algunas circunstancias, probióticos en función de algunos efectos específicos, por ejemplo, por la evidencia de que mejora la digestión de la lactosa en intolerantes; los beneficios no dependen solo de que el producto contenga menos lactosa, sino de que las bacterias probióticas podrían incrementar, además, la actividad de la lactasa en el intestino delgado.
Espectro de preparaciones y formas de administración que cumplirían el criterio de probióticos para uso en la práctica clínica.
Tomado de Hill et al.2.
No se considera como probiótico el trasplante fecal o los alimentos con microorganismos muertos2.
Para producir los efectos beneficiosos sobre el huésped los probióticos no necesariamente deben colonizar el órgano diana, aunque sí llegar vivos con una cantidad suficiente como para afectar a su microecología y metabolismo. Así, la mayoría de cepas probióticas son capaces de llegar al colon vivas (en un porcentaje variable) pasando por todo el tracto gastrointestinal superior, y su viabilidad dependerá de muchos factores: por un lado, los intrínsecos del probiótico, y por otro, dependientes del huésped, como, por ejemplo, el grado de acidez en el estómago, la longitud de la exposición al ácido, la concentración y la duración de la exposición a las sales biliares y otras5. Por poner un ejemplo, las cepas Lactobacillus casei Shirota, Lactobacillus rhamnosus GG (ATCC 53103), Lactobacillus johnsonii LA1 o Lactobacillus acidophilus NFCB 1748 han demostrado ser seguras y provocar beneficios para la salud en humanos, a la vez que presentan una elevada estabilidad en medio ácido y son resistentes a los ácidos biliares; sin embargo, solo las 3 últimas son capaces de adherirse a la mucosa y solo Lactobacillus rhamnosus GG y johnsonii LA1 producen colonización colónica6.
El término «prebiótico» se refiere a ingredientes fermentados selectivamente que dan lugar a cambios específicos en la composición y/o la actividad de la flora gastrointestinal, confiriendo así beneficios a la salud del huésped3. Esta definición se solapa en parte con la definición de fibra dietética, aunque añade la selectividad de los prebióticos sobre ciertos microorganismos en concreto (p.ej., la ingestión de fructo-oligosacáridos y la inulina favorecen a las bifidobacterias de forma selectiva).
El término «fibra dietética» es más amplio y se refiere a diversos hidratos de carbono y la lignina que resisten la hidrólisis por las enzimas digestivas humanas, pero que pueden ser fermentados por la microflora colónica y/o excretadas parcialmente por las heces. Esta definición incluiría dentro del concepto de fibra a los polisacáridos no almidón (celulosas, hemicelulosas, pectinas, gomas y mucílagos), la inulina, los fructo-oligosacáridos, los galacto-oligosacáridos, el almidón resistente (almidón y los productos procedentes de la degradación del almidón, que no son digeridos en el intestino delgado de los individuos sanos)7. Algunos de estos componentes de la fibra cumplen estrictamente los criterios para ser considerados como prebióticos (inulina, fructo-oligosacáridos, galacto-oligosacáridos, oligosacáridos derivados de la soja, xilo-oligosacáridos, pirodextrinas e isomalto-oligosacáridos). Sin embargo, otros componentes de la fibra son difíciles de clasificar; por ejemplo, la goma guar, un tipo de fibra soluble fermentable, promueve en parte el crecimiento de bacterias probióticas pero también actúa como sustrato general (no específico) de las bacterias colónicas («alimento colónico fermentable»), por lo que no podría considerarse en sentido estricto como tal «prebiótico». De igual forma, algunas fracciones del almidón resistente sí que actuarían específicamente como prebióticos y otras simplemente como «alimento colónico fermentable» para las bacterias sacarolíticas. En esta revisión nos centraremos preferentemente en el empleo de prebióticos (en sentido estricto), si bien haremos algunas referencias someras a los efectos de la fibra (fermentable) en algunas patologías concretas.
Los hidratos de carbono no digeribles en el colon son fermentados a ácidos grasos de cadena corta (AGCC) principalmente acetato, propionato y butirato y muchos otros metabolitos y gases. Los AGCC acidifican el pH luminal, lo que suprime el crecimiento de determinados patógenos e influencia la motilidad intestinal. Por otro lado, son absorbidos por la mucosa colónica y contribuyen a aportar energía para el huésped. El acetato se metaboliza principalmente en el músculo, los riñones, el corazón y el cerebro; el propionato lo hace en el hígado y es un sustrato neoglucogénico y podría inhibir la síntesis de colesterol y regular la lipogénesis en el tejido adiposo; el butirato es metabolizado preferentemente por el epitelio colónico, donde sirve como sustrato preferencial y regula el crecimiento y la diferenciación celular por diferentes mecanismos. Entre otros efectos podría, por ejemplo, reducir el cáncer de colon estimulando la apoptosis y mejorar la inflamación en la enfermedad inflamatoria intestinal. La medición de los AGCC es difícil in vivo. No obstante, existen modelos in vitro que nos permiten evaluar su producción. Por ejemplo, algunas dextrinas de trigo producen menos gas que la goma guar hidrolizada y que la inulina al fermentarse, lo que sugiere que las primeras podrían tolerarse mejor in vivo que las otras dos fibras. Por el contrario, la inulina parece producir significativamente más butirato que las maltodextrinas modificadas, teniendo la goma guar un comportamiento intermedio8. Por ello, algunas fibras prebióticas podrían emplearse, al menos teóricamente, de manera preferencial como tratamiento de algunas patologías frente a otras en función de su metabolismo colónico.
El término «simbióticos» se refiere a los productos que contienen probióticos y prebióticos. En sentido estricto debería ser reservado a productos en los que el componente prebiótico selectivamente favorece al componente probiótico (p.ej., oligofructosa y bifidobacterias pero no oligofructosa con Lactobacillus (L) casei; no obstante, si se entiende la sinergia ampliamente, esta última combinación sería posible)1.
En la tabla 1 se listan los principales pro, pre y simbióticos empleados en la práctica clínica. En la tabla 2 se recogen las marcas y fabricantes de los principales prebióticos comercializados en el mundo. En este capítulo nos centraremos preferentemente en los trabajos realizados con probióticos, prebióticos y simbióticos (en especial los aleatorizados y controlados) en los que las variables de resultados sean clínicamente importantes (no hablaremos, salvo excepciones, de trabajos en que se evalúen aspectos fisiopatológicos) y que tengan relación (directa o indirecta) con la nutrición clínica y dietética (p.ej., no abordaremos posibles efectos sobre la respuesta inmunológica y clínica en atopia o vaginitis). En la tabla 3 se resumen los principales efectos buscados con el uso de pre, pro y simbióticos en la práctica clínica.
Principales pro, pre y simbióticos empleados en estudios clínicos
| Principales probióticos de cepa única empleados en estudios clínicos |
| • Saccharomyces boulardii • Lactobacillus rhamnosus GG • Bifidobacterium bifidum • Lactobacillus plantarum 299 • Lactobacillus sporogens • Enterococcus SF68 • Bifidobacterium lactis BB12 (L) • Lactobacillus reuteri • Lactobacillus casei (L) • Bifidobacterium longum BB 536 (L) • Lactobacillus acidophilus LA1 • Escherichia coli Nissle 1917 (serotipo 06:K5:H1) |
| Principales probióticos de varias cepas empleados en estudios clínicos |
| • Lactobacillus acidophilus y L. bulgaricus • Lactobacillus acidophilus y Bifidobacterium lactis • Lactobacillus acidophilus y Bifidobacterium infantis • Bifidobacterium longum BB 536+L. acidophilus NCFB 1748 (L) • Bifidobacterium lactis Bb12 (BB12) y Lactobacillus rhamnosus GG • Bifidobacterium bifidum+Streptococcus thermophilus • Bifidobacterium lactis y Streptococcus thermophilus (L) • Lactobacillus acidophilus+L. bulgaricus+Streptococcus thermophilus (L) • VSL#3: 4 cepas de lactobacilos (Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii subespecie bulgaricus y Lactobacillus plantarum), 3 cepas de bifidobacterias (Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium breve) y Streptococcus salivarius subespecie thermophilus • TREVIS: Streptococcus acidophilus, LA5, Bifidobacterium lactis BP12, Streptococcus thermophilus y Lactobacillus bulgaricus • Ecologic 641: 4 lactobacilos (Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus salivarius y Lactococcus lactis) y 2 bifidobacterias (Bifidobacterium bifidum y Bifidobacterium lactis) • Ergyphilus: 1010Lactobacillus rhamnosus GG, Lactobacillus casei, Lactobacillus acidophilus y Bifidobacterium bifidus • Jinshuangqi: Bifidobacterium longum > 10UFC, Lactobacillus bulgaricus > 10UFCy Streptococcus thermophilus > 10UFC |
| Principales prebióticos empleados en estudios clínicos |
| • Fruto-oligosacáridos (FOS) • Galacto-oligosacáridos (GOS) • Inulina • Trans-galacto-oligosacáridos (TOS) • Beneo Synergy 1 (SYN1): oligofructosa-inulina • Lactulosa • Fibra de avenaa • Cebada germinada (rico en hemicelulosa)a • Goma guar hidrolizadaa • Almidón resistentea • Plantago ovataa • Betaglucanoa • Pectinaa |
| Principales simbióticos empleados en estudios clínicos |
| • Lactobacillus plantarum 299 y 10g de fibra de avena • Lactobacillus sporogens+Fruto-oligosacáridos • Synbiotic 2000: 101UFC de cada: Pediococcus pentoseceus 5-33:3, Leuconostoc mesenteroides 32-77:1, Lactobacillus paracasei sp. paracasei 19, Lactobacillus plantarum 2362 y 2,5g de cada uno de betaglucanos, inulina, pectina y almidón resistente • Synbiotic 2000 Forte: 101UFC de: Pediococcus pentoseceus 5-33:3, Leuconostoc mesenteroides 32-77:1, Lactobacillus paracasei sp. paracasei 19, Lactobacillus plantarum 2362 y 2,5g de cada uno de: inulina, fibra de avena, pectina y almidón resistente • Oligofructosa+inulina (SYN1)+Lactobacillus rhamnosus GG y Bifidobacterium lactis Bb12 • Golden Bifid: Bifidobacterium bifidum, Lactobacillus bulgaricus y Streptococcus thermophilus con FOS |
L: son probióticos suministrados en productos lácteos.
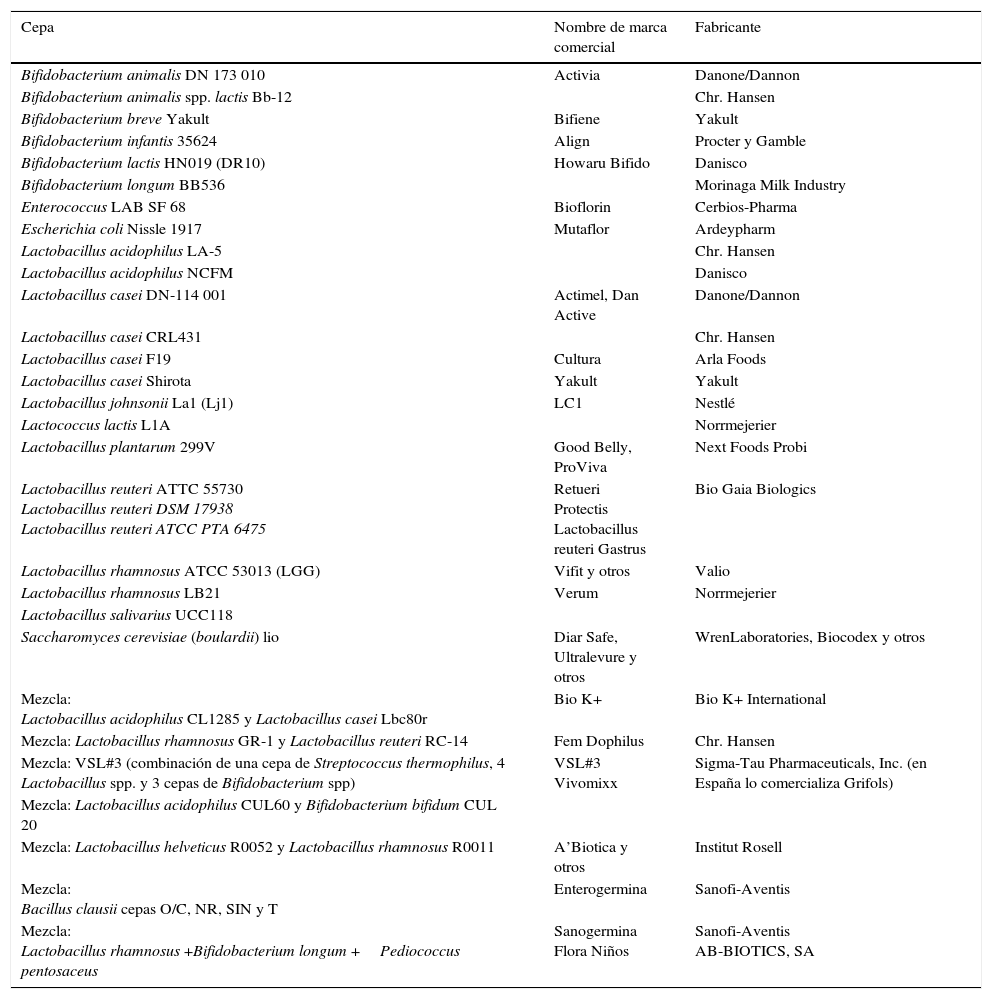
Ejemplos de marcas comerciales y fabricantes de probióticos
| Cepa | Nombre de marca comercial | Fabricante |
|---|---|---|
| Bifidobacterium animalis DN 173 010 | Activia | Danone/Dannon |
| Bifidobacterium animalis spp. lactis Bb-12 | Chr. Hansen | |
| Bifidobacterium breve Yakult | Bifiene | Yakult |
| Bifidobacterium infantis 35624 | Align | Procter y Gamble |
| Bifidobacterium lactis HN019 (DR10) | Howaru Bifido | Danisco |
| Bifidobacterium longum BB536 | Morinaga Milk Industry | |
| Enterococcus LAB SF 68 | Bioflorin | Cerbios-Pharma |
| Escherichia coli Nissle 1917 | Mutaflor | Ardeypharm |
| Lactobacillus acidophilus LA-5 | Chr. Hansen | |
| Lactobacillus acidophilus NCFM | Danisco | |
| Lactobacillus casei DN-114 001 | Actimel, Dan Active | Danone/Dannon |
| Lactobacillus casei CRL431 | Chr. Hansen | |
| Lactobacillus casei F19 | Cultura | Arla Foods |
| Lactobacillus casei Shirota | Yakult | Yakult |
| Lactobacillus johnsonii La1 (Lj1) | LC1 | Nestlé |
| Lactococcus lactis L1A | Norrmejerier | |
| Lactobacillus plantarum 299V | Good Belly, ProViva | Next Foods Probi |
| Lactobacillus reuteri ATTC 55730 Lactobacillus reuteri DSM 17938 Lactobacillus reuteri ATCC PTA 6475 | Retueri Protectis Lactobacillus reuteri Gastrus | Bio Gaia Biologics |
| Lactobacillus rhamnosus ATCC 53013 (LGG) | Vifit y otros | Valio |
| Lactobacillus rhamnosus LB21 | Verum | Norrmejerier |
| Lactobacillus salivarius UCC118 | ||
| Saccharomyces cerevisiae (boulardii) lio | Diar Safe, Ultralevure y otros | WrenLaboratories, Biocodex y otros |
| Mezcla: Lactobacillus acidophilus CL1285 y Lactobacillus casei Lbc80r | Bio K+ | Bio K+ International |
| Mezcla: Lactobacillus rhamnosus GR-1 y Lactobacillus reuteri RC-14 | Fem Dophilus | Chr. Hansen |
| Mezcla: VSL#3 (combinación de una cepa de Streptococcus thermophilus, 4 Lactobacillus spp. y 3 cepas de Bifidobacterium spp) | VSL#3 Vivomixx | Sigma-Tau Pharmaceuticals, Inc. (en España lo comercializa Grifols) |
| Mezcla: Lactobacillus acidophilus CUL60 y Bifidobacterium bifidum CUL 20 | ||
| Mezcla: Lactobacillus helveticus R0052 y Lactobacillus rhamnosus R0011 | A’Biotica y otros | Institut Rosell |
| Mezcla: Bacillus clausii cepas O/C, NR, SIN y T | Enterogermina | Sanofi-Aventis |
| Mezcla: Lactobacillus rhamnosus +Bifidobacterium longum +Pediococcus pentosaceus | Sanogermina Flora Niños | Sanofi-Aventis AB-BIOTICS, SA |
Modificada de World Gastroenterology Organisation Practice Guideline, 20113
Efectos esperablesa de los prebióticos, probióticos y simbióticos en la práctica clínica
| Efectos metabólicos |
| Favorecen la absorción de agua y calcio |
| Modulan el metabolismo lipídico |
| Efecto masa: prevención y tratamiento del estreñimiento |
| Efectos protectores |
| Prevención de infecciones intestinales (diarrea aguda, crónica, por antibióticos o asociada a Clostridium difficile) |
| Prevención de infecciones sistémicas debido a la translocación bacteriana (pacientes graves) |
| Reducción de manifestaciones de atopia |
| Prevención de infecciones vaginales y de parto prematuro |
| Mejora de la esteatosis hepática |
| Mejora de la encefalopatía hepática |
| Mejora de la tasa de erradicación de Helicobacter pylori |
| Mejora de la intolerancia a la lactosa |
| Efectos tróficos |
| Prevención y control de la enfermedad inflamatoria intestinal |
| Reducción del riesgo de cáncer colorrectal |
El consenso de la asociación científica internacional sobre probióticos y prebióticos recoge una serie de posibles mecanismos de acción, desde algunos muy comunes a la mayoría de los probióticos estudiados, hasta otros muy raros específicos de algunas cepas:
Mecanismos muy frecuentes (comunes a la mayoría de los probióticos)Resistencia a la colonización.
Producción de ácidos grasos de cadena corta y de acidificación del medio.
Regulación del tránsito gastrointestinal.
Normalización de la microbiota.
Aumento de la regeneración de enterocitos.
Exclusión competitiva de patógenos.
Síntesis de vitaminas.
Antagonismo directo frente a otras bacterias.
Reforzamiento de la barrera intestinal.
Metabolismo sobre las sales biliares.
Actividades enzimáticas.
Neutralización de carcinógenos.
Efectos neurológicos.
Efectos inmunológicos.
Efectos endocrinológicos.
Producción de sustancias bioactivas.
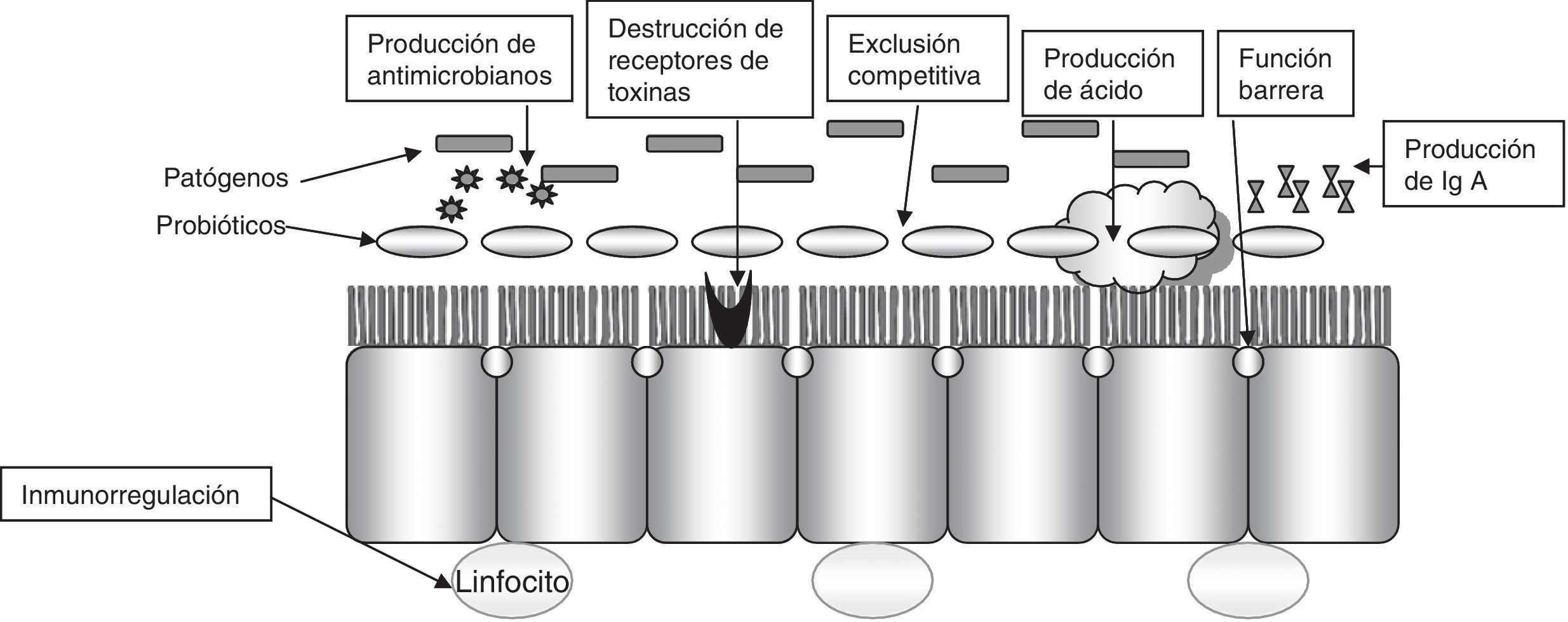
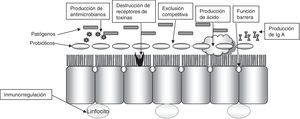
La diarrea por antibióticos es una complicación muy frecuente en el ámbito hospitalario (13-60%). Así mismo, la enfermedad por Clostridium difficile es una importante causa de diarrea y colitis nosocomial que incrementa las estancias hospitalarias en 3-7días, el riesgo de nuevas infecciones nosocomiales (en un 20-65%), los costes y la mortalidad (la multiplica por 2 o 3 veces, según los estudios). En estos pacientes el uso de probióticos se plantea con el objetivo de restablecer la microflora intestinal, aumentar la respuesta inmunitaria, competir con las bacterias patógenas y retirar sus toxinas (fig. 2).
Mecanismos de actividad probiótica.
Modificado de Ewaschuk et al.60.
Uno de los probióticos más estudiados ha sido Saccharomyces boulardii. En un metaanálisis reciente de 21 estudios (4.780 pacientes) la administración de Saccharomyces boulardii redujo el riesgo de diarrea asociada a antibióticos tanto en niños como en adultos de un 19 a un 8,5%, con un riesgo relativo de 0,47, requiriendo tratar 10 personas para evitar un caso. En algunos estudios también redujo la diarrea por Clostridium difficile, aunque fue solo significativo en el grupo de los niños9. Por tanto, su uso puede contemplarse con un grado de recomendación fuerte (basándose en un nivel de evidencia moderado). Se debe comenzar a la vez que el tratamiento antibiótico, a dosis de entre 250 y 1.000mg en adultos (máximo 500mg en niños), y mantenerlo al menos hasta que finalice el mismo (no está claro si se debería mantener algo más tras su conclusión).
En otro metaanálisis en el que se incluyeron 82 ensayos aleatorizados en los que se empleaban diferentes especies (generalmente Lactobacillus —solos o combinados con bifidobacterias—, enterococos o Saccharomyces boulardii) también se encontró un descenso en el riesgo de diarrea asociada a antibióticos, con un riesgo relativo de 0,58, necesitando tratar 13 sujetos para prevenir un caso. Aunque se encontraron resultados positivos en general con todos los probióticos empleados, se reconoce que existe una importante heterogeneidad en los estudios, por lo que la evidencia es insuficiente para afirmar si el efecto varía sistemáticamente en función de la población (adultos o niños), del tipo o de la duración del antibiótico usado, o incluso de la preparación probiótica empleada; de igual forma se destaca la necesidad de definir mejor cuáles son la dosis y el tiempo óptimo para cada preparación probiótica10.
En estudios aleatorizados y controlados en el que se administraba una bebida probiótica fermentada con Lactobacillus casei DN-114001, Lactobacillus bulgaricus y Streptococcus thermophilus, 2 veces al día, se redujo la incidencia de diarrea por antibióticos y por Clostridium difficile11, por lo que algunos consensos lo recomiendan, aunque el grado de recomendación sería débil con evidencia baja12.
Los pacientes que reciben nutrición enteral por sonda podrían beneficiarse del uso de probióticos para prevenir o tratar la diarrea asociada. No obstante, los resultados no son homogéneos y, además, existe una amplia variabilidad en las cepas estudiadas y en las fórmulas de nutrición empleadas (con adición o no de fibra y con diferentes tipos de fibra, incluyendo prebióticos)13. Por ejemplo, se han empleado diferentes cepas frente a placebo, como Lactobacillus acidophilus +Lactobacillus bulgaricus 3g/día; VSL#3 (9·1011 bacterias/día); Saccharomyces boulardii (2g/día); Lactobacillus rhamnosus GG (2·1010 bacterias/día)+inulina 560mg/día; Ergyphilus (2·1010 bacterias/día); Lactobacillus paracasei + Bifidobacterium longum +FOS +inulina +goma de acacia; Bifidobacterium breve 1·108+Lactobacillus casei Shirota 1·108+GOS 15g; mezcla de bifidobacterias con nutrición enteral con mezcla de fibras y otros inmunonutrientes14-21. En menos de la mitad de los estudios se objetivaron beneficios significativos en cuanto a la reducción de diarrea, y el número de pacientes estudiados con cada cepa es pequeño. Por tanto, aunque es un campo muy sugerente, no se pueden hacer, en la actualidad, recomendaciones basadas en la evidencia sobre su empleo en nutrición enteral. De hecho, las guías de práctica clínica canadienses de 2015 sobre nutrición en el paciente crítico evalúan el uso de probióticos y simbióticos en pacientes de UCI, concomitantemente a nutrición enteral por sonda (tanto a nivel gástrico, como yeyunal), y concluyen que no existe influencia del uso de probióticos sobre la diarrea22.
Respecto a la prevención primaria de la enfermedad por Clostridium difficile en pacientes tratados con antibióticos, aunque hacen falta más estudios, los probióticos también reducen la incidencia de dicha enfermedad especialmente con la administración de las cepas de Saccharomyces boulardii y posiblemente otros Lactobacillus, como el GG12,23. Por el contrario, un metaanálisis reciente concluye que solo 4 cepas de probióticos han demostrado reducir significativamente la incidencia de diarrea por Clostridium difficile (entre los que no se encuentra Lactobacillus GG): Saccharomyces boulardii (2·1010 unidades formadoras de colonias[UFC] día), Lactobacillus casei DN114001 (bebida probiótica 2 veces al día), una mezcla de Lactobacillus acidophilus y Bifidobacterium bifidum (2·1010 UFC/día) y una mezcla de Lactobacillus acidophilus, Lactobacillus casei y Lactobacillus rhamnosus)24. Otros probióticos podrían ser eficaces, pero la escasez de estudios impide sacar conclusiones. También, para la prevención secundaria de la infección recurrente por Clostridium difficile con grados de evidencia bajos se podrían emplear especies como Saccharomyces boulardii y LGG12, aunque no todos los autores concluyen lo mismo24.
En niños, la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) recomienda para el tratamiento de la gastroenteritis aguda, además de la rehidratación, el uso de Lactobacillus rhamnosus GG (a dosis ≥1010 UFC al día durante 5-7 días) y Saccharomyces boulardii (250 a 750mg diarios durante 5-7 días) con recomendación fuerte (con nivel de evidencia bajo),y recomendación débil el Lactobacillus reuteri (a dosis de 108 una a 4 veces diarias durante 5-7días)25. Una revisión Cochrane reciente llega a similares conclusiones, recomendando únicamente el empleo de Lactobacillus rhamnosus GG y Saccharomyces boulardii a dosis entre 5 y 40 millones de UFC26.
De igual forma los probióticos parecen reducir el riesgo de diarrea nosocomial por rotavirus en niños con Lactobacillus GG pero no con otras especies, como Lactobacillus reuteri o Bifidobacterium lactis.
En el caso de pacientes que reciben antibióticos con el objetivo de erradicar el Helicobacter pylori, se han realizado estudios a los que se añadían probióticos con el objetivo de mejorar la tasa de erradicación y, además, prevenir efectos secundarios como la diarrea por antibióticos. Se han realizado varios metaanálisis en los que se objetiva que la adición de probióticos podría aumentar la eficacia de la erradicación con un odds ratio (OR) que varía entre 1,2 y 2 veces respecto al grupo control. Aunque hacen falta más trabajos, parece que las cepas que podrían ser más efectivas serían Lactobacillus acidophilus (1,25·109 UFC) (OR: 1,24), leches fermentadas con Lactobacillus casei DN-114001 (2 envases diarios) (OR: 1,47), yogures con Lactobacillus gasseri (OR: 1,19) (2 envases diarios) y Bifidobacterium infantis (2·109) (OR: 1,21). Por el contrario, otras cepas, como el Saccharomyces boulardii, no serían igual de eficaces. Los tratamientos varían mucho en cuanto a dosis y duración pero, en general, se aportan durante 7días hasta 4 semanas. Se ha visto que la efectividad podría ser mayor cuando las pautas antibióticas consiguen una menor erradicación, es decir, en los casos en que la terapia antibiótica es menos efectiva. Al igual que en otros escenarios clínicos en los que se reciben antibióticos, los probióticos también parecen reducir la incidencia de diarrea (con OR de entre 0,16 y 0,47)27,28. La recomendación del uso de probióticos para esta indicación (como prevención de la diarrea) sería débil (con nivel de evidencia bajo)27.
El uso de probióticos para el manejo de la enteritis rádica ha sido estudiado en varios ensayos clínicos frente a placebo con empleo de diferentes especies y cepas de probióticos (farmacológicos como lactobacilos, bifidobacterias, VSL#3 o contenidos en leches fermentadas), objetivándose un descenso en la incidencia de diarrea en un metaanálisis. No obstante, al igual que en otras situaciones clínicas, existe una amplia heterogeneidad en los estudios que no permite extraer conclusiones definitivas12,29.
Como reflexión, derivada del análisis de estos trabajos, es importante señalar que no todos los probióticos (ni la combinación de los mismos) actúan de igual forma, por lo que es necesario demostrar sus efectos en trabajos bien diseñados (con un grupo homogéneo de pacientes y con suficiente número) para cada situación clínica y con cepas determinadas, por lo que no se pueden extrapolar los datos de unas a otras.
Se han realizado varios estudios aleatorizados y controlados sobre el empleo de prebióticos (fructo-oligosacáridos solos o asociado a inulina) para prevenir la diarrea por antibióticos en pacientes hospitalizados o ambulatorios. Si bien su aporte modificaba el recuento de bifidobacterias, en pocos casos se consigue disminuir la incidencia de diarrea por antibióticos30
Estreñimiento, ritmo intestinal y salud colónicaLos prebióticos, en general, tienen un efecto positivo pero poco importante sobre el número y la cantidad de las deposiciones. La inulina podría aumentar la frecuencia y consistencia de las deposiciones en el estreñimiento crónico31. La fibra (especialmente la parte insoluble o escasamente fermentable) aumenta modestamente (y significativamente) el número de deposiciones semanales (de media 1,4-1,5 movimientos por semana). En el colon irritable los trabajos publicados tanto con prebióticos como con fibra (mezcla o preferentemente soluble) aportan resultados contradictorios32. Teóricamente y en algunos trabajos, su empleo se ha asociado a un empeoramiento de los síntomas de flatulencia, por lo que una dieta baja en «fodmaps» (bajo en componentes fermentables como los oligosacáridos, disacáridos, monosacáridos y polioles, es decir, algunos prebióticos) podría mejorar los síntomas en algunos pacientes33; no obstante, en otros estudios la fibra (p.ej., goma guar hidrolizada) parece mejorar los síntomas y la calidad de vida en pacientes con colon irritable y con síntomas predominantes de estreñimiento34,35. Las semillas de Plantago ovata (ispaghulahusk) podrían mejorar los síntomas o el dolor abdominal en pacientes con colon irritable. El uso de probióticos (bifidobacterias, lactobacilos o combinaciones Bifidobacterium infantis B5624, Bifidobacterium animalis o VSL#3) podría reducir, también, los síntomas asociados, aunque son necesarios más trabajos para recomendarlos de forma rutinaria1,12,36
Se ha propuesto a partir de numerosos trabajos realizados en animales que ciertos prebióticos, probióticos y simbióticos reducirían el riesgo de cáncer de colon. En un estudio aleatorizado, controlado frente a placebo con el uso de simbióticos (oligofructosa +inulina [SYN1] +Lactobacillus rhamnosus GG y Bifidobacterium lactis Bb12) en pacientes intervenidos de pólipos colónicos y cáncer de colon, además de mejorar la flora fecal, también lo hicieron diversos biomarcadores (genéticos, celulares, inflamatorios e inmunológicos) reduciendo el riesgo teórico de cáncer de colon37. En diversos estudios epidemiológicos la ingesta de alimentos ricos en fibra (mixta [fermentable o no]), especialmente de fruta y verduras frescas, se ha asociado claramente con un descenso probable del riesgo de cáncer de colon y recto7. Sin embargo, los estudios clínicos aleatorizados de prevención secundaria (de aparición de pólipos colónicos) realizados hasta la fecha, con dieta alta en fibra o suplementada (no con prebióticos), no han aportado los resultados esperados; posiblemente el tiempo de seguimiento y de la suplementación o la selección de los pacientes hayan influido en estos hallazgos1.
En niños pretérmino, la suplementación con probióticos podría reducir la incidencia de enterocolitis necrosante y su mortalidad asociada. Aunque algún metaanálisis ha llegado a esta conclusión con un nivel de evidencia alto, otros no apoyan dicha aseveración, por lo que no recomiendan su empleo rutinario en niños pretérmino38. En cualquier caso, aunque no pueda incluirse en ficha técnica, en casos individuales y valorando riesgos y beneficios, las combinaciones de Lactobacillus acidophilus y Bifidobacterium infantis o Bifidobacterium bifidum o las cepas únicas de Lactobacillus LGG o Bb12 serían las más adecuadas. Por el contrario, el empleo de cepas aisladas de Bifidobacterium breve, Lactobacillus acidophilus, Escherichia coli Nissle 1917 o Saccharomyces boulardii no han demostrado adecuadamente su efectividad. De nuevo, como en otras patologías, queda por resolver cuál es la dosificación óptima, el tipo de probióticos a emplear (especie, cepa, combinación de varios) o la duración de la suplementación y las características de los niños. Extrapolar datos de unos estudios a otros sería inapropiado39.
Enfermedad inflamatoria intestinalLa enfermedad inflamatoria intestinal (EII) es un trastorno crónico recurrente en el que se observa una interacción anómala de la flora intestinal y el huésped. Estos pacientes presentan un riesgo aumentado de desarrollar cáncer colorrectal. En los últimos años se ha propuesto el uso de probióticos, prebióticos y simbióticos con el objeto de restaurar la microflora intestinal (eco-medicina) y reducir la inflamación.
Los probióticos se han empleado en numerosos trabajos en modelos animales con resultados prometedores. En estudios en humanos el empleo de un probiótico multicepa (VSL#3, que contiene 4 cepas de lactobacilos —Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii sp. bulgaricus y Lactobacillus plantarum—, 3 cepas de bifidobacterias —Bifidobacterium longum, Bifidobacterium infantis y Bifidobacterium breve— y Streptococcus salivarius sp. thermophilus) ha demostrado, con un nivel de evidencia elevado, descenso de la actividad (prevención de aparición y mantenimiento de la remisión) de la reservoritis (también conocido como pouchitis —una inflamación no específica del reservorio ileal—) en la colitis ulcerosa (CU) tras anastomosis ileal12,40. La recomendación para emplearlo en esta indicación sería débil (con nivel de evidencia moderado, porque el número de pacientes estudiados es bajo). Las dosis más habituales serían en la pouchitis de 2 a 4 sobres al día (cada sobre contiene 450.000 millones de bacterias vivas 4,5·1011 UFC; también existen las cápsulas con 112.000 millones de bacterias vivas).
Otros trabajos han encontrado discretas mejorías en la reducción de actividad de la enfermedad (asociado al tratamiento convencional) en pacientes con CU, y afectación leve-moderada, con el empleo de VSL#3, Escherichia coli Nissle, Lactobacillus GG o con leches fermentadas con bifidobacterias y/o lactobacilos (comparado o no con placebo u otros tratamientos, como la mesalazina)41, pero no está tan claro si induce reducción o mantenimiento de la remisión, necesitándose más estudios12,42.
Sin embargo, los ensayos con probióticos en la enfermedad de Crohn con el objetivo de inducir o mantener la remisión (con varias cepas como Lactobacillus GG, VSL3, Lactobacillus johnsonii LA1, Escherichia coli Nissle 1917, Saccharomyces boulardii) han mostrado resultados discordantes y, en general, menos satisfactorios que en la CU12,40.
Sería necesario, además, valorar qué cepas son las más eficaces y cómo los factores del huésped (como la carga genética de los pacientes) influyen en la respuesta terapéutica.
El uso de prebióticos como tratamiento único o asociados a probióticos (simbióticos) también se propone en la EII por su efecto sobre el crecimiento de los lactobacilos y bifidobacterias endógenas, favoreciendo: la producción de ácidos grasos de cadena corta (en particular el butirato, que es un nutriente preferencial para los enterocitos), la prevención de la adherencia de bacterias patógenas, la producción de antibióticos y el descenso del pH intraluminal. Los prebióticos más estudiados son la inulina, el almidón resistente, los oligosacáridos como los fructo-oligosacáridos (FOS) y los galacto-oligosacáridos (GOS). Los prebióticos y la fibra se han empleado especialmente en la CU. Por otro lado, en el tratamiento de la reservoritis en la CU, la fibra inulina y la fibra procedente de semillas de Plantago ovata podrían ser útiles también en la prevención de brotes. En la reservoritis, la inulina frente a placebo podría disminuir su severidad (endoscópica e histológica) y mejorar el perfil microbiológico. Otra opción en la EII es el uso de simbióticos en un intento de favorecer la sinergia de ambos tratamientos alcanzando efectos mayores que con el uso aislado de ambos. En algunos trabajos se ha observado mejoría de parámetros endoscópicos e inflamatorios. En cualquier caso son todavía pocos estudios y no permiten extraer conclusiones relevantes43.
Enfermedad hepáticaLa esteatosis hepática no alcohólica abarca un amplio espectro de enfermedades, desde la esteatosis simple a la cirrosis, pasando por la esteatohepatitis y la fibrosis. Se ha propuesto que los probióticos (p.ej., VSL#3) podrían modular la flora intestinal influenciando el eje intestino-hígado y mejorando dicha enfermedad. En la esteatosis hepática alcohólica el uso de probióticos y simbióticos (VSL#3, LGG, o lactobacilos, bifidobacterias y oligosacáridos) también han demostrado efectos beneficiosos en algunos trabajos. Aunque existen estudios que objetivan mejorías del cuadro en cuanto a parámetros analíticos (transaminasas, peroxidación lipídica), el grado de evidencia todavía es bajo12,44,45.
En pacientes cirróticos con encefalopatía mínima se ha estudiado el uso de probióticos, prebióticos y simbióticos, demostrándose una mejoría en el amonio y de la encefalopatía en algunos aspectos de la calidad de vida, así como en la ecología intestinal. Por el contrario, en encefalopatía establecida no se ha demostrado ningún efecto cuando se han empleado probióticos45.
En pacientes sometidos a trasplante hepático se ha publicado un metaanálisis en el que se incluyen 4 estudios prospectivos en los que se emplearon simbióticos (generalmente Lactobacillus plantarum 299 y 10g de fibra de avena) frente a la fibra prebiótica contenida en el preparado. En el grupo que recibió el simbiótico frente a únicamente la fibra prebiótica contenida en el preparado, disminuyó significativamente la incidencia de infecciones bacterianas postoperatorias (7 vs 35%), debiendo tratar a 3,6 pacientes para prevenir un evento46. Además disminuyeron los días de estancia hospitalaria en UCI y la duración del tratamiento antibiótico. Estos prometedores resultados deberán ser confirmados en otros trabajos.
Pacientes de cuidados intensivos y quirúrgicosSe han realizado diferentes estudios aleatorizados en pacientes sometidos a cirugía mayor abdominal (incluyendo politraumatizados, cáncer, cirugía de estómago, colon etc.), comparando generalmente simbióticos adicionados a la nutrición enteral (los más usados, Symbiotic 2000 o Lactobacillus plantarum + fibra de avena) frente a la fibra probiótica contenida en los preparados y frente a otro grupo control con nutrición parenteral o enteral (estándar con fibra, peptídica o con glutamina). En algunos estudios, pero no en todos, los preparados simbióticos redujeron la incidencia de infecciones bacterianas respecto a la nutrición parenteral total o respecto a otras formulaciones de nutrición enteral y con resultados intermedios respecto a la fibra prebiótica.
En un metaanálisis realizado en pacientes de UCI se ha evaluado el uso de Synbiotic 2000 FORTE (combinación de Bifidobacterium longum +Lactobacillus bulgaricus +Streptococcus thermophilus) vs un grupo control (glutamina +fibra fermentable) en la prevención de la neumonía asociada a ventilación mecánica, objetivándose un descenso significativo en su incidencia. No obstante, de nuevo, dado que la calidad de la evidencia es baja y dada la alta heterogeneidad en los resultados, no pueden extraerse conclusiones definitivas47. En otro metaanálisis reciente también se concluye que existe una reducción de la neumonía asociada a ventilación mecánica empleando combinaciones de probióticos y simbióticos o aisladamente, administrados bien oralmente, por sonda nasogástrica o por absorción a través de la mucosa de la orofaringe. Además, los pacientes críticos que posiblemente se beneficiarían más con el uso de probióticos (o simbióticos) serían los politraumatizados y los quirúrgicos en cuanto a la reducción de la estancia hospitalaria en UCI; no obstante, a diferencia de otros trabajos, no objetivaron reducciones de otros parámetros, como infecciones, incidencia de diarrea, estancia hospitalaria global o mortalidad48.
Las guías canadienses de práctica clínica sobre nutrición en pacientes críticos de 2015 recomiendan valorar el empleo de probióticos en pacientes de UCI en base a una reducción de las infecciones y una tendencia a disminución de neumonías asociada a ventilación mecánica y de la estancia en UCI, sin efectos sobre la mortalidad. La heterogeneidad de los resultados es elevada. No encontraron evidencias de aumento del riesgo de mortalidad o de efectos secundarios (a diferencia del estudio Propratia en pancreatitis aguda; ver más adelante) a pesar de infundirse muchos a nivel yeyunal (no nasogástrico). De todas formas, no pueden hacer recomendaciones sobre el tipo de probióticos a usar. Sí resaltan que no se debería usar Saccharomyces boulardii en pacientes críticos, por el riesgo de infección fúngica22.
Es necesario, por tanto, definir mejor las especies, cepas, dosis, duración del tratamiento en cada una de la situaciones clínicas para hacer recomendaciones claras basadas en la evidencia22,49.
Pancreatitis aguda graveA partir del año 2005 se publicaron 2 trabajos del grupo de Oláh, realizados en pacientes con pancreatitis aguda grave, con moderado número de pacientes (45 y 62), en los que se valoraba el uso de simbióticos (Lactobacillus plantarum o Symbiotic 2000) vs prebióticos únicamente (fibra de avena o la aportada en Symbiotic 2000, respectivamente), en infusión por sonda nasoyeyunal50. En el primer trabajo la incidencia de necrosis infectadas o abscesos fue claramente menor con los simbióticos (4,5 vs 30%); en el segundo, se observó una menor incidencia, no estadísticamente significativa, de fracaso multiorgánico, sepsis y mortalidad; no obstante, sí descendió significativamente la incidencia de fracaso multiorgánico y de síndrome de respuesta inflamatoria sistémica valorados conjuntamente. Sin embargo, en el año 2008 se publicaron los resultados del ensayo PROPATRIA. Este estudio, magníficamente diseñado (doble ciego, aleatorizado y con un número suficiente de pacientes [296]), testaba si el probiótico Ecologic® 641 (compuesto de 6 cepas de bacterias: Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus salivarius, Lactococcus lactis y 2 bifidobacterias: Bifidobacterium bifidum y Bifidobacterium lactis en una dosis total de 1010 bacterias vivas) administrado junto con una fórmula enteral con mezcla de fibras (incluyendo prebióticos, polisacárido de soja, goma arábica, almidón resistente, inulina, alfa celulosa y oligofructosa), reducía las infecciones en la pancreatitis aguda grave, frente a la infusión de la misma fórmula enteral sin probióticos. Aunque no se observaron diferencias en el número de infecciones entre los 2 grupos, se produjo un aumento significativo de la mortalidad en el grupo de probióticos (16 vs 6%). En el subgrupo de sujetos con pancreatitis necrosante fallecieron el 41% en el grupo de probióticos, frente al 15% en el grupo placebo. Nueve pacientes sufrieron isquemia mesentérica (8 fallecieron) en el grupo de probióticos. Tanto la bacteriemia como la infección de la necrosis, el fallo multiorgánico y la mortalidad parecieron asociarse a una alteración precoz de la barrera intestinal durante la pancreatitis. En los pacientes con fallo multiorgánico se objetivó que el uso de los probióticos aumentó la translocación bacteriana51. A la vista de estos resultados se ha planteado que la administración en yeyuno de probióticos, junto con fibra prebiótica en pacientes graves (no solo con pancreatitis aguda severa) posiblemente provoque efectos negativos en la perfusión intestinal, favoreciendo el fracaso multiorgánico, la necrosis intestinal y la muerte. Parece prudente, por ahora, no infundir probióticos mediante esta vía de administración en pacientes críticos para la práctica clínica rutinaria y emplearlos únicamente en el contexto de estudios aleatorizados bien diseñados. Por otro lado, es necesario conocer más de la biología de la interacción de determinadas cepas probióticas sobre la integridad intestinal y las interacciones entre la flora endógena y los pre y probióticos antes de generalizar el uso de esta terapia, que no ha resultado tan inocua como se pensaba inicialmente. En este sentido, es importante volver a enfatizar, que no todas las cepas de probióticos tendrían el mismo perfil de seguridad ni de eficacia, en los diferentes escenarios clínicos.
Absorción de calcio y salud óseaSe han realizado algunos estudios aleatorizados y controlados en los que se ha evaluado la absorción de calcio tras la administración de prebióticos (FOS, GOS, inulina o combinaciones de varios de ellos), objetivándose en algunos un aumento en la misma. En un estudio aleatorizado en el que se empleaba inulina frente a placebo, administrada durante un año en adolescentes, se mejoraba no solo la absorción cálcica, sino además la densidad mineral ósea52. Estos resultados, y otros realizados con probióticos en modelos animales que mejoran diferentes aspectos fisiopatológicos en la salud ósea, podrían ser interesantes para su aplicación en la práctica clínica, siendo necesaria más investigación al respecto53.
Probióticos, prebióticos y simbióticos en enfermedades metabólicas, obesidad y diabetesTanto en estudios experimentales en animales como observacionales en humanos (y algunos de intervención, con trasplantes fecales) se ha objetivado que la composición de la microbiota intestinal difiere en personas obesas frente a delgadas, en diabéticos frente a no diabéticos, y en otras patologías como la esteatosis hepática o enfermedades cardiovasculares y renales frente a personas sanas. Los cambios en la composición y/o actividad de la microbiota intestinal por la administración de nutrientes con propiedades prebióticas o probióticos puede modular la expresión de genes y el metabolismo del huésped (a múltiples niveles como en el tejido adiposo, muscular, hepático, e incluso modulación de la saciedad), con lo que influiría en los trastornos metabólicos relacionados. Algunos prebióticos y probióticos podrían contrarrestar las alteraciones metabólicas asociadas a la obesidad y a la diabetes, como la resistencia insulínica, la hiperglucemia, la inflamación, la dislipidemia o la esteatosis hepática, por poner algunos ejemplos54. No obstante, estas hipótesis deben ser confirmadas en humanos en ensayos controlados bien diseñados. Por ejemplo, la adición de probióticos (estudios realizados preferentemente con diversos tipos de Lactobacillus) podría contribuir modestamente a mejorar el control glucémico55; de igual forma, el uso de prebióticos (como GOS, inulina, FOS…), probióticos y simbióticos se asocia a discretas mejorías del control lipídico a corto y medio plazo56,57, por lo que podrían ser considerados como coadyuvantes de otros tratamientos. No obstante, muchos de los efectos comunicados son todavía y, en general, de escasa relevancia para la práctica clínica58.
Riesgos de los probióticos en la práctica clínicaDado el rápido incremento objetivado en el empleo de probióticos en los últimos años y en circunstancias clínicas muy diversas es interesante preguntarse acerca de su seguridad, especialmente si se emplean en situaciones en las que su eficacia no ha sido demostrada por la evidencia científica. Ya se han comentado los posibles riesgos de la infusión de probióticos a nivel yeyunal en pacientes críticos. Otro tema sería valorar el riesgo de infección por probióticos. En este sentido, sabemos que los lactobacilos y las bifidobacterias abundan tanto en la dieta de los humanos como en el intestino sano. Las infecciones por estos microorganismos podrían ocurrir de forma natural incluso sin estar relacionadas con la ingesta de estos microorganismos. Aunque son pocos, la mayoría de los casos clínicos publicados de bacteriemia, sepsis o endocarditis por lactobacilos han sido producidos por Lactobacillus rhamnosus GG o por Lactobacillus casei. Las infecciones por bifidobacterias son excepcionales en la literatura, aunque se han descrito bacteriemias, sepsis y colangitis por Bacillus subtilis. También se han publicado sepsis fúngicas producidas por Saccharomyces boulardii. Todos los casos de infecciones sistémicas por probióticos se han producido en pacientes con enfermedades graves de base (diabetes mellitus, valvulopatías, prematuros, problemas hematológicos, sida, pacientes de cuidados intensivos, con nutrición parenteral, con yeyunostomías, síndrome de intestino corto, trasplantados, pacientes con cáncer, etc.). La mayoría de estos casos se resolvieron con tratamiento antibiótico, pero en algunos derivaron a shock séptico e incluso provocaron la muerte. Es posible que diferentes cepas de probióticos tengan diferentes perfiles de seguridad. No obstante, en estudios prospectivos y aleatorizados realizados en adultos inmunodeprimidos y niños infectados por VIH y en neonatos pretérmino no se han comunicado casos de sepsis por Lactobacillus. A nivel general, la balanza de beneficios frente a los riesgos parece inclinada hacia los primeros, ya que el riesgo de infección por el consumo de probióticos sería similar al de la infección por cepas comensales y, en general, bajo, incluso en pacientes inmunodeprimidos. No obstante, existen grupos seleccionados de pacientes en los cuales se recomienda emplear con precaución, en especial en determinados pacientes inmunodeprimidos. Boyle et al.59 propusieron una serie de factores predisponentes a la sepsis por probióticos (tabla 4). El riesgo de sepsis por estas bacterias debería balancearse con el riesgo de sepsis por otras especies patógenas de bacterias y con el riesgo de sufrir la enfermedad que se pretende prevenir (p.ej., la enterocolitis necrosante en neonatos).
Criterios para evaluar el riesgo de sepsis por probióticos en la práctica clínica
| Criterios mayores |
| Inmunodeficiencia severa incluyendo estados de desnutrición grave o cáncer |
| Neonatos prematuros |
| Criterios menores |
| Catéteres venosos centrales |
| Barrera epitelial intestinal incompetente (procesos diarreicos severos, inflamación intestinal) |
| Administración de probióticos por yeyunostomía |
| Administración concomitante de antibióticos de amplio espectro a los cuales los probióticos son resistentes (por ejemplo, muchos lactobacilos son naturalmente resistentes a la vancomicina) |
| Probióticos con capacidad de alta adhesión a la mucosa intestinal o patogenicidad conocida |
| Enfermedad valvular (únicamente para lactobacilos) |
Modificada de Boyle et al.59.
La utilización de probióticos, de prebióticos y de simbióticos está emergiendo como una terapia prometedora y, en general, segura en diferentes escenarios clínicos. Si bien parece demostrada su eficacia en la prevención de la diarrea por antibióticos, en la reducción de la incidencia de enterocolitis necrosante en recién nacidos pretérmino y en la prevención y tratamiento de la reservoritis en la CU, en el resto de campos son necesarios más trabajos para poder establecer recomendaciones definitivas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.