El yodo es un micronutriente esencial en la alimentación de la embarazada que transfiere al embrión-feto a través del transporte placentario. Existen antecedentes de su importancia para el desarrollo neurológico, pero no ha sido estudiada la relación entre ingesta de yodo y peso placentario ni su repercusión en el neonato (RN).
Materiales y métodosSe analizó ingesta de yodo en 77 embarazadas, mediante eliminación urinaria de yodo (EUI) con la técnica modificada por Pino (normal ≥150μg/l). Se midió el peso placentario (PP: normal ≥500g). En el recién nacido se evaluó peso, talla y perímetro cefálico (PC). Se obtuvo el índice placentario (IP: peso placentario/ peso recién nacido) considerando normal ≥0,15.
ResultadosLa EUI fue normal en 50 embarazadas (media±DE, 279μg/l±70,22μg/l) y disminuida en 27 (94μg/l ±31,49μg/l). Los RN de madres con EUI baja tenían un peso (3.357g±416,30g; n: 27) no diferente a las madres con yodurias normales (3.489g±560,59g; n: 50). Pero las madres con EUI bajo tenían un 44% de placentas con PP<500g y el análisis de los PC en los RN con bajo PP mostró que eran estadísticamente menores (PP3500g: 36,05cm±0,55cm, n: 54; PP<500g: 33,93cm±15cm, n: 23, p<0,019). El estudio con los IP fue similar aunque no alcanzó la significación estadística 0,17±0,04 (p: 0,066). Los demás parámetros no mostraron diferencias significativas.
ConclusiónEl estudio evidencia una relación entre el PP y PC. Este hallazgo puede ser relacionado con la ingesta de yodo durante el embarazo.
Iodine is considered to be an essential micronutrient in pregnant women. Iodine placental transport to the embryo-fetus is essential for hormone synthesis and is crucial for nervous system development. However, the relationship between iodine intake and placental weight and its potential implications for the newborn have not been studied.
Material and methodsIodine intake was analyzed in 77 pregnant women based on urinary iodine excretion (UIE) levels, measured using Pino¿s modified method (normal value, ≥ 150μg/L). Placental weight was measured (PW: normal, ≥500g). In the newborn, weight, height, and head perimeter (HP) were also measured. Placental index (PI: placental weight/newborn weight) was calculated, and was considered normal if ≥0.15.
ResultsUIE was normal in 50 pregnant women (mean±SD, 279μg/L±70.22μg/L) and decreased in 27 (94μg/L±31.49μg/L). Newborns of mothers with low UIE had a similar weight (3357g±416.30g; n: 27) to those of mothers with normal UIE (3489g±560.59g; n: 50). Forty-four percent of mothers with low UIE had PW <500g, and statistically lower HPs were found in newborns of mothers with low PW (PW3500g: 36.05cm±0.55cm, n: 54; PW <500g: 33.93cm±15cm, n:23, p<0.019). Similar results were found with PI, but they did not reach statistical significance (0,17±0,04; p=0.066). No differences were seen in all other parameters.
ConclusionThe study suggests the existence of a relationship between PW and HP. This finding may be related to iodine intake during pregnancy.
La placenta es el órgano que permite el pasaje del yodo inorgánico, halógeno clasificado dentro de los micronutrientes de importancia para las síntesis de hormonas tiroideas1–3. Estas juegan un papel fundamental para el crecimiento y desarrollo de la vida fetal y extrauterina a través de la regulación de procesos metabólicos que favorecen el crecimiento somático, la función cardíaca, la maduración pulmonar y el desarrollo y diferenciación de células del sistema nervioso central4,5. Durante la primera mitad de la gestación, las hormonas tiroideas utilizadas por el feto son básicamente de origen materno, y la tiroides fetal va generando progresivamente su propia síntesis hasta ser capaz de garantizar toda la tiroxina que necesita el recién nacido a término6,7. Si la embarazada ingiere menos yodo del necesario, puede presentar una hipotiroxinemia que repercuta negativamente sobre el desarrollo del cerebro en el feto8. La única fuente de yodo en el niño lactante es la leche materna, lo que obliga a garantizar también un aporte suficiente de yodo a la madre lactante9.
El yodo no presenta un pool de almacenamiento en el organismo, por lo que ha de ser repuesto continuamente10. Durante el embarazo aumenta la demanda de hormonas tiroideas8,11 por lo cual la ingesta de yodo diaria recomendada en la mujer embarazada y lactante es de 200-300μg/día. Ha sido demostrado que en una mujer embarazada teniendo en cuenta el efecto de dilución por el mayor volumen urinario, la yoduria sería de 166μg/l12 lo que correspondería a valores considerados normales11.
La deficiencia de yodo es reconocida actualmente como la principal causa de discapacidad humana que puede ser prevenida mediante la obligatoriedad de la yodación de la sal de mesa13. En la actualidad se conoce que, en algunas regiones, en la población de mujeres embarazadas existe un 38,7% de baja ingesta de yodo, por ello resulta imperioso establecer los medios que permitan asegurar la adecuada suplementación de yodo de la sal de mesa11.
La OMS y la Federación Panamericana de Sociedades de Endocrinología piden determinar cuáles son las zonas endémicas por déficit en la ingesta de yodo (DDI), utilizando como diagnóstico la excreción urinaria de yodo11, la ecografía de tiroides9 y la titulación del contenido de yodo en la sal de consumo9,11. La OMS informó que el 33% de los países ha logrado el control bromatológico de la sal de mesa, estando nuestro país dentro del grupo B donde el grado de DDI aun es considerado de leve a moderado, ya que la deficiencia persiste en algunas áreas14.
No existen estudios que evalúen la EUI durante la gestación y su repercusión en el peso de la placenta (PP) y de esta sobre parámetros antropométricos de los recién nacidos, por lo cual nos planteamos determinar si existe una relación entre el déficit de yodo y el peso placentario.
Materiales y métodosSe incluyó al total de embarazadas (77) asistidas en Servicios de Endocrinología y Diabetes y Tocoginecología del Establecimiento Asistencial Dr. Lucio Molas de Santa Rosa, La Pampa, Argentina, durante el período marzo-agosto 2009. Se solicitó dos muestras de orina (matutina y vespertina) para determinar la eliminación urinaria de yodo (EUI) según método de Sandell Kholtoff, modificado por Pino15, adoptando para el análisis estadístico la menor concentración de los dos valores obtenidos. Se consideró EUI normal al valor de 150μg/l recomendado por WHO/UNICEF/ICCIDD11.
En un embarazo a término (37- 41 semanas de gestación) la placenta tiene una forma de torta circular u oval de 18 a 20 cm de diámetro y 2,5 cm de espesor máximo en el centro, siendo menor en sus bordes. Adoptamos una mediana de peso de 500 gramos (g) (Pc10: 280g y Pc 90: 700g)16. El control de peso de los recién nacidos y de la torta placentaria se realizó en una balanza marca CoArMe. Después del alumbramiento se colocó la placenta sobre una mesa quirúrgica, se retiraron las membranas y se cortó el cordón umbilical en su inserción. Luego se realizó un lavado con solución fisiológica helada hasta lograr escurrir todos sus líquidos y se obtuvo el peso real de la torta placentaria, descontando membranas y cordón. Se consignaron antecedentes maternos durante la gestación (hipertensión arterial, diabetes y tabaquismo) para alto o bajo peso placentario.
Se registró peso, talla de la embarazada, se obtuvo el IMC (peso/talla2) y de acuerdo Atallah-Mardones las pacientes fueron clasificadas en: bajo peso, peso normal, sobrepeso y obesidad16. En el recién nacido se analizó su peso, talla y perímetro cefálico (PC). Se consideró bajo peso <2.500g; peso normal 2.500-3.999g; alto peso ≥4.000g. Se obtuvo la relación entre el peso del recién nacido y el peso de la torta placentaria denominándolo índice placentario (IP) considerando normal ≥0,1516.
Se efectuaron análisis estadísticos entre variables mediante el test exacto de Fisher y prueba de T de dos colas mediante el programa Graphpad Prism versión 4 para Windows. La normalidad de las variables se evaluó mediante test de Kolmogorov-Smirnov. Los datos están expresados como media±DE de la media (DE). Se consideró estadísticamente significativo una p<0,05.
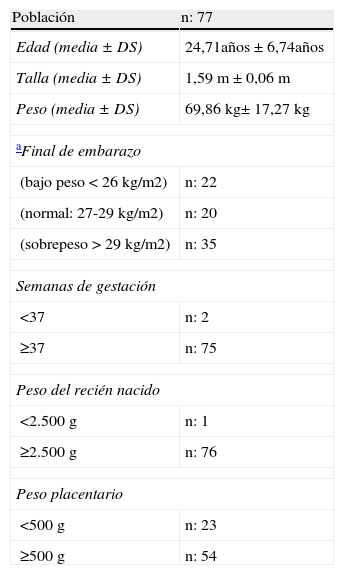
ResultadosEn la tabla 1 se muestran las características de los grupos analizados. Prevaleció en 69 de las 77 parturientas estudiadas una edad mayor a 17 años, con un intervalo entre 15 y 42 años (media±DE: 24,71 años± 6,74). Dos de las 77 tuvieron parto anticipado (antes de las 37 semanas) y el resto a término. El 29% (22/77) de las parturientas tenían bajo peso, 26% (20/77) peso normal y 45% (35/77) sobrepeso u obesidad. Se encontró que 9/77 (12%) de las parturientas tenían antecedente de hipertensión arterial gestacional, de ellas 1/9 tenía un peso placentario (PP) <500g, 5/9 entre 500-700g y 3/9 ≥700g.
Descripción de la población estudiada
| Población | n: 77 |
| Edad (media±DS) | 24,71años±6,74años |
| Talla (media±DS) | 1,59 m±0,06m |
| Peso (media±DS) | 69,86 kg± 17,27kg |
| aFinal de embarazo | |
| (bajo peso<26 kg/m2) | n: 22 |
| (normal: 27-29 kg/m2) | n: 20 |
| (sobrepeso>29 kg/m2) | n: 35 |
| Semanas de gestación | |
| <37 | n: 2 |
| ≥37 | n: 75 |
| Peso del recién nacido | |
| <2.500g | n: 1 |
| ≥2.500g | n: 76 |
| Peso placentario | |
| <500g | n: 23 |
| ≥500g | n: 54 |
Mardones: bajo peso<26,55, normal: 26,55-28,9, sobrepeso y obesidad>28,9
No se encontraron diferencias estadísticas en el PP en cuanto a edad, estado nutricional, ni en las semanas de gestación de las parturientas. De las 23 placentas que pesaron menos de 500g se halló que el 9% (2/23) tuvieron partos pretérmino, mientras que las con PP≥500g este porcentaje fue de 4% (2/54) (p: NS). Se halló solo un caso de bajo peso al nacer entre los 23 nacidos con PP<500g.
El peso placentario (PP) promedio fue 484,9g±110,04g (media±DE) con un intervalo de 280g a 900g, mientras que el índice placentario (IP) fue de 0,17±0,04. Un solo niño tuvo un peso al nacer menor de 2.500g en tanto que 65/77 (84%) fue entre 2.500-4.000g y 11/77 (14%) fue ≥4.000g. No se evidenciarion diferencias en el peso ni en la talla de los recién nacidos entre ambos grupos.
De las 77 embarazadas, cuando comenzaron su embarazo 13 fumaban, aunque ninguna de ellas podía ser considerada como fumadora (más de 20 cigarrillos diarios) pero en el tercer trimestre solamente 8 fumaban aunque en forma ocasional. No se pudo encontrar una asociación entre el hábito de fumar y las variables en estudio.
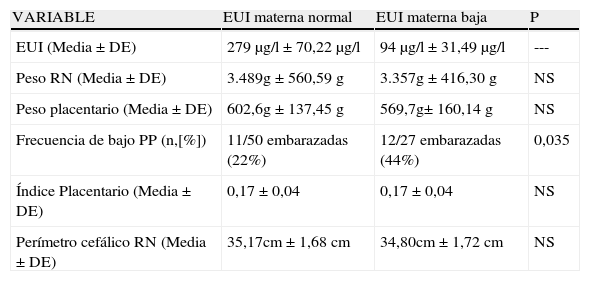
En la tabla 2 se analiza la eliminación urinaria de yodo (EUI) en relación con las variables consideradas. Las diferencias entre las yodurias (media±DE; normal 279μg/l±70,22μg/l, n: 50; baja: 94μg/l±31,49μg/l, n: 27) no tuvo influencia sobre PP, el IP o el PC (tabla 2). La edad gestacional en el grupo con EUI normal y bajo no tuvo diferencias significativas (no mostrado).
Variables maternas y fetales relacionadas con la excreción urinaria de yodo
| VARIABLE | EUI materna normal | EUI materna baja | P |
| EUI (Media±DE) | 279μg/l±70,22μg/l | 94μg/l±31,49μg/l | --- |
| Peso RN (Media±DE) | 3.489g±560,59g | 3.357g±416,30g | NS |
| Peso placentario (Media±DE) | 602,6g±137,45g | 569,7g± 160,14g | NS |
| Frecuencia de bajo PP (n,[%]) | 11/50 embarazadas (22%) | 12/27 embarazadas (44%) | 0,035 |
| Índice Placentario (Media±DE) | 0,17±0,04 | 0,17±0,04 | NS |
| Perímetro cefálico RN (Media±DE) | 35,17cm±1,68cm | 34,80cm±1,72cm | NS |
EUI: eliminación urinaria de yodo; RN: recién nacido; PP: peso placentario.
EUI Normal n:50
EUI Baja n:27
Sin embargo, cuando se analizó el perímetro cefálico en relación al PP se estableció una diferencia estadísticamente significativa (PP≥500g, PC: 36,05cm±0,55cm, n: 54; PP<500g, PC: 33,93cm±15,0cm, n: 23; p<0,019) y lo mismo ocurrió con el IP, aunque en este caso quedó al borde de la significación (IP≥0,15, PC: 35,78cm±4,05cm, n: 58; IP<0,15, PC: 34,32cm±1,80cm, n: 19; p=0,066).
Cuando se trató de analizar el PC corregido por la talla, el nomograma resultó muy escueto para poder clasificar todos los valores hallados, por lo que no fue utilizado.
Los resultados mostrados en la tabla ii sugieren que no existe relación entre la EUI y el PC, pero un análisis cuidadoso permite observar que la frecuencia de PP<500g es mayor en las embarazadas con eliminación de yodo disminuido (EUI normal: 11/50-22%; 12/27-44%, p<0,035) lo que sugeriría que la ingesta de yodo en la población estudiada, podría ser un factor en el bajo PP. Esto se refuerza porque con un 95% de confianza y «odds ratio» de 3 (1,06 - 8,5 veces) significa que las madres con un PP<500g están 3 veces mas asociadas con deficiencia de yodo, esto es que su posibilidad estadística de tener una EUI disminuida es 3 veces mayor que una embarazada con un PP≥500g.
DiscusiónLa placenta humana es la unidad materno-fetal que permite desarrollo embrionario y fetal por el aporte de oxígeno y diálisis de deshechos fetales, transporte de nutrientes y funciones endocrino-metabólicas1–4. El yodo es un micronutriente que transporta la placenta, utilizado por el feto para la formación de hormonas tiroideas cuya función es favorecer el crecimiento somático y neurológico6–17.
La falta de correlación estadística entre PP y semanas de gestación halladas por otros autores6–17, lo atribuimos a que el 94,5% de nuestras parturientas tuvieron recién nacidos a término y la edad gestacional es una de las principales determinantes del peso placentario6–17. Probablemente la diferencia entre recién nacido a término y el pretérmino se deba a que el peso y diámetro de las placentas presentarían una mayor área de vellosidades coriales libres-terminales y un mayor número de vasos sanguíneos por vellosidad18. El PP fue similar a lo encontrado por Martina et al.19 en Perú en placentas de madres sin factores de riesgo. Argumentan estos autores19 que en la altura, a diferencia del nivel del mar, es mayor el PP y menor el peso del RN. Otros autores se refieren al índice vascular placentario como la relación entre el peso del árbol vascular y el PP19. En la altura aumentan los dos pesos, pero no se sabe cuál tendría predominio en esta relación. Las placentas estudiadas en la altura tendrían incrementada la vasculatura placentaria por la hipoxia19. Torry20 et al. lo atribuyen a que los capilares fetales de la placenta no son estructuras estáticas y pueden adaptarse a una variedad de cambios y al stress. Otros autores consideran que en el retraso de crecimiento intrauterino, los abortos espontáneos y la preeclampsia habría un defecto en la producción del factor de crecimiento angiogénico21.
En nuestro estudio se observó que el 25% de las placentas analizadas tenían un IP<0,15, que se relacionó con PP<500g, validando la importancia de este índice en donde habría un menor PP respecto al peso del recién nacido19. Hindmarsh et al.22 indican que el peso del recién nacido estaría relacionado con el peso placentario en un 41% e inversamente con la multiparidad y el tabaquismo de la madre durante la gestación.
Anteriormente hemos demostrado23 en una población hospitalaria que el 38,7% de las embarazadas tenían baja ingesta de yodo, permitiendo la búsqueda y detección precoz de disfunción tiroidea en estas embarazadas. El 35% (n: 23) de las placentas evaluadas provinieron de embarazadas con baja ingesta de yodo en algún trimestre del embarazo, con una relación estadísticamente significativa entre la baja EUI y el bajo PP, acompañado de un PC disminuido en relación a las placentas de mayor peso. Se podría hipotetizar que en placentas mas pequeñas habría una disminución en el aporte de nutrientes y una disminución en el transporte de yodo con una menor síntesis de hormonas tiroideas fetales1–3. El PC hallado se encuentra dentro de los percentiles 10 y 50 dependiendo del nomograma utilizado y el sexo, pero la diferencia estadística sugiere una dificultad metabólica que debe ser corregida.
Acordamos con Hindmarsh et al.22 que el peso placentario determina el crecimiento del niño como un proceso continuo, por ello el PP se relacionó con el peso del recién nacido y el perímetro cefálico, pero en una zona con déficit crónico de yodo su carencia podría ser considerada como un factor a tener en cuenta en el desarrollo placentario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Secretaría de Ciencia y Técnica de la Facultad de Ciencias Exactas y Naturales de la UNLP (Proyecto de investigación N.° 75). A los jefes de servicios médicos y personal de enfermería de los Servicios de Tocoginecología, Endocrinología y Diabetes y Neonatología por su importante colaboración permanente. Al bioquímico Ricardo Fernandez Orsi y la técnica Mariela Mayer para el análisis de la yoduria. Al Dr. Rodolfo Rey por su colaboración estadística.