En los últimos años se ha demostrado que los ácidos grasos poliinsaturados (AGPI) tienen efectos antiinflamatorios y como reguladores del metabolismo lipídico. No obstante, no se conocen en profundidad los mecanismos epigenómicos implicados en estos procesos. El objetivo de esta revisión fue describir las evidencias científicas que apoyan que el consumo regular de AGPI puede reducir la obesidad mediante modificaciones de las marcas epigenéticas.
Material y métodosSe realizó una búsqueda de publicaciones recientes llevadas a cabo en ensayos clínicos en humanos, modelos animales o ensayos in vitro.
ResultadosExiste un posible efecto terapéutico de los AGPI sobre la prevención y desarrollo de la obesidad gracias a su capacidad de modificar reversiblemente la metilación de los promotores de genes asociados con el metabolismo lipídico y de modular la actividad de determinados microARN.
ConclusionesLos resultados publicados hasta la fecha referentes al rol de los AGPI en la prevención de la obesidad contribuyen al mejor conocimiento y entendimiento de las modificaciones epigenéticas de la obesidad. Los AGPI han demostrado poder modificar epigenéticamente diferentes genes adipogénicos mediante la metilación de sus promotores o mediante la regulación de su interacción con diversos microARN.
In recent years it has been demonstrated that polyunsaturated fatty acids (PUFA) have anti-inflammatory and as regulators of lipid metabolism. However, the epigenomic mechanisms involved in these processes are not known in depth. The aim of this review was to describe the scientific evidence supports that regular consumption of PUFA may reduce obesity and overweight by altering epigenetic marks.
Material and methodsA search of recent publications was carried out in human clinical trials, as well as animal model and in vitro experiments.
ResultsExist a possible therapeutic effect of PUFAs on the prevention and development of obesity due to their ability to reversively modify the methylation of the promoters of genes associated with lipid metabolism and to modulate the activity of certain microRNAs.
ConclusionsA better knowledge and understanding of the PUFAs role in epigenetic regulation of obesity is possible with the current published results. The PUFAs may modulate the promotor epigenetic marks in several adipogenic genes and regulate the expression of several miRNAs.
El sobrepeso y la obesidad son definidos como una acumulación anormal o excesiva de grasa que puede afectar a la salud1. Se trata de un complejo trastorno multifactorial en el que interaccionan factores tanto genéticos como ambientales. El índice de masa corporal (IMC) es el instrumento comúnmente más utilizado para clasificar el sobrepeso y la obesidad, y puede definirse como la relación entre el peso en kilogramos y el cuadrado de la altura en metros (kg/m2)1. Valores iguales o superiores a 25 corresponden a sobrepeso y los iguales o superiores a 30, a obesidad1. Esta medida correlaciona bien con la adiposidad corporal. El exceso de peso se asocia con una mayor morbimortalidad, incluyendo un mayor riesgo de diabetes mellitus tipo 2, ateroesclerosis, hipertensión arterial, hiperlipidemia, osteoartritis, el síndrome de la apnea del sueño y algunos tipos de cáncer2.
Estamos ante una pandemia que ha ido incrementándose desde hace décadas2 y continúa en aumento3. En un estudio sobre la población mundial publicado en 2008 se estimó que un 23,2% de la población adulta presentaba sobrepeso y un 9,8% obesidad: unos 937 millones y 396 millones de personas con sobrepeso y obesidad respectivamente3. En ese mismo estudio se llega a proyectar para 2030 una población adulta con sobrepeso de hasta 2.160 millones de personas y 1.120 millones de obesos, de continuar las tendencias seculares vistas hasta el momento3. La situación en España es también preocupante. En un trabajo publicado en 20114 se describe que la prevalencia de sobrepeso en individuos adultos alcanzó el 34,2%, siendo mayor en varones (43,9%) que en mujeres (25,7%). Sin existir diferencias entre sexos, la obesidad fue del 13,6%4. Esta creciente prevalencia de la obesidad está relacionada con el aumento del síndrome metabólico5. La definición de este síndrome, estrechamente vinculado a la grasa abdominal, suele hacer referencia a intolerancia a la glucosa, obesidad abdominal, hipertensión y dislipidemia, que afectan seriamente la salud de las personas que lo padecen5,6. Por todo ello, la obesidad es un importante problema de salud pública y, debido a las comorbilidades asociadas, presenta elevados costes económicos2. A nivel mundial la carga económica de la obesidad se ha estimado entre el 0,7 y el 2,8% del gasto total sanitario, con un impacto económico del 9,1% para sobrepeso y obesidad2. El modelo más comúnmente aceptado para explicar la obesidad humana se basa en la interacción entre predisposición genética, anomalías metabólicas y factores ambientales, tales como la vida sedentaria y una alimentación poco saludable. Específicamente, a partir de estudios de gemelos, adopciones y familiares se ha estimado que el componente genético sería la causa de cerca del 40% de la variabilidad interindividual de los valores de obesidad7,8. Más concretamente, estudios de gemelos en comparación con los de familia y de adopción revelan que entre un 60 y un 90% de la varianza del IMC dentro de la población se puede explicar por efectos genéticos9. Los estudios de linkage y asociación han localizado numerosos loci de la obesidad a lo largo del genoma10. El papel central que en la obesidad y sobrepeso tiene el metabolismo de lípidos justifica que las variedades genéticas de aquellos genes que codifican para las proteínas implicadas en las rutas metabólicas de la adipogénesis, la ingesta de energía, la lipólisis o el gasto energético hayan sido extensamente analizados. Así, por ejemplo, se han estudiado los polimorfismos en el gen de la apolipoproteína B11 y A511, de la CD36 (en inglés, cluster of differentiation 36)12, de la USF1 (en inglés, upstream transcription factor 1)13,14, de la FADS3 (en inglés, fatty acid desaturase 3)14, GCKR (en inglés, glucokinase regulatory protein)15; de la INSIG2 (en inglés, insulin-induced gene 2)16, de la ENPP1 (en inglés, ectonucleotide pyrophosphatase/phosphodiesterase 1)17, de la FTO (en inglés, fat mass and obesity-associated protein)18 y de la CTNNBL1 (en inglés, catenin beta like 1)19. Hasta el presente, se conocen más de 40 variantes genéticas asociadas con la obesidad y la distribución de grasa corporal20 (tabla 1). Sin embargo, estos estudios con marcadores genéticos no pueden dar cuenta completamente de la heredabilidad de la obesidad. Esto puede ser, en parte, debido a la naturaleza poligenética de la obesidad, en la que diferentes variantes de la secuencia de ADN ejercen un pequeño efecto y por las cuales se necesita una población de análisis muy amplia para detectarla10. Otra posible explicación es la existencia de otras formas de variación como pueden ser las modificaciones y alteraciones epigenéticas20. Actualmente se puede definir epigenética como la herencia de la actividad del ADN que no depende de la secuencia per se sino de las modificaciones químicas del ADN y de las proteínas reguladoras adyacentes21. Las marcas epigenéticas más conocidas son la adición de un grupo metilo al ADN en la citosina del dinucleótido CpG21. Estos dinucleótidos son abundantes en las regiones promotoras de muchos genes. La hipermetilación suele asociarse a la disminución en la expresión génica (silenciamiento); por el contrario, la hipometilación se asocia con un aumento de la expresión22,23. Relacionado con el nivel de metilación del ADN, encontramos el concepto de la «impronta genética». El concepto describe la herencia de la información epigenética específica de uno de los progenitores. Ciertos genes adquieren una impronta materna o paterna durante la gametogénesis y como resultado son ampliamente expresados a partir de un solo alelo durante el desarrollo embrionario y en los tejidos adultos24. Una impronta genética defectuosa se asocia con trastornos del desarrollo y fenotipos clínicos entre los cuales suele incluirse el peso corporal anormal24. Un ejemplo bien conocido es el síndrome de Prader-Willi, caracterizado por un deterioro cognitivo y un apetito voraz e incontrolable, que a menudo se asocia con el desarrollo de obesidad severa en los primeros 6 años de vida24. Otra marca epigenética estudiada es la modificación de las proteínas llamadas histonas. Las histonas, además de empaquetar el ADN, juegan un rol muy importante en las modificaciones postraduccionales de sus aminoácidos (e. g. acetilación de la lisina, metilación de la arginina, fosforilación de la serina)21. Otras marcas epigenéticas en estudio vienen definidas por la disposición de estructuras de alto orden formadas por los complejos ADN-histonas (los llamados nucleosomas) y la actividad de los ARN no codificantes como los microARN, ARN de interferencia, los ARN no codificantes de cadena larga, los ARN antisentido, entre otros)25,26. Estos ARN no codificantes regulan postranscripcionalmente la expresión génica mediante su emparejamiento con la región no traducible 3′ del ARN mensajero (3′ UTR)27. Por ejemplo, el miR-33 y el miR-122 controlan el metabolismo de los triglicéridos y la biosíntesis de colesterol en el hígado de ratón, e indican que su desregulación está asociada directamente con el desarrollo de enfermedades metabólicas como la obesidad y el síndrome metabólico28,29. También es conocida la implicación de los ARN no codificantes de cadena larga (lncARN) en la plasticidad del tejido adiposo y en la regulación de la adipogénesis30,31.
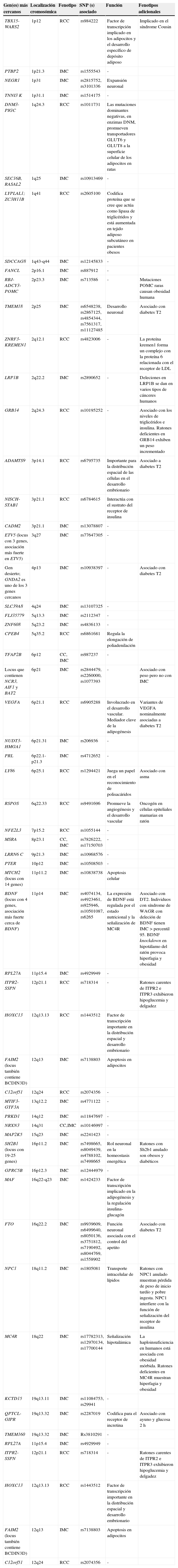
Los 54 loci asociados a fenotipos de obesidad antropométrica
| Gen(es) más cercanos | Localización cromosómica | Fenotipo | SNP (s) asociado | Función | Fenotipos adicionales |
|---|---|---|---|---|---|
| TBX15-WARS2 | 1p12 | RCC | rs984222 | Factor de transcripción implicado en los adipocitos y el desarrollo específico de depósito adiposo | Implicado en el síndrome Cousin |
| PTBP2 | 1p21.3 | IMC | rs1555543 | - | |
| NEGR1 | 1p31 | IMC | rs2815752, rs3101336 | Expansión neuronal | |
| TNNI3K | 1p31.1 | IMC | rs1514175 | - | |
| DNM3-PIGC | 1q24.3 | RCC | rs1011731 | Las mutaciones dominantes negativas, en enzimas DNM, promueven transportadores GLUT6 y GLUT8 a la superficie celular de los adipocitos en ratas | |
| SEC16B, RASAL2 | 1q25 | IMC | rs10913469 | - | |
| LYPLAL1; ZC3H11B | 1q41 | RCC | rs2605100 | Codifica proteína que se cree que actúa como lipasa de triglicéridos y está aumentada en tejido adiposo subcutáneo en pacientes obesos | |
| SDCCAG8 | 1q43-q44 | IMC | rs12145833 | - | |
| FANCL | 2p16.1 | IMC | rs887912 | - | |
| RBJ-ADCY3-POMC | 2p23.3 | IMC | rs713586 | - | Mutaciones POMC raras causan obesidad humana |
| TMEM18 | 2p25 | IMC | rs6548238, rs2867125, rs4854344, rs7561317, rs11127485 | Desarrollo neuronal | Asociado con diabetes T2 |
| ZNRF3-KREMEN1 | 2q12.1 | RCC | rs4823006 | - | La proteína kremen1 forma un complejo con la proteína 6 relacionada con el receptor de LDL |
| LRP1B | 2q22.2 | IMC | rs2890652 | - | Deleciones en LRP1B se dan en varios tipos de cánceres humanos |
| GRB14 | 2q24.3 | RCC | rs10195252 | - | Asociado con los niveles de triglicéridos e insulina. Ratones deficientes en GRB14 exhiben un peso incrementado |
| ADAMTS9 | 3p14.1 | RCC | rs6795735 | Importante para la distribución espacial de las células en el desarrollo embrionario | Asociado a diabetes T2 |
| NISCH-STAB1 | 3p21.1 | RCC | rs6784615 | Interactúa con el sustrato del receptor de insulina | |
| CADM2 | 3p21.1 | IMC | rs13078807 | - | |
| ETV5 (locus con 3 genes, asociación más fuerte en ETV5) | 3q27 | IMC | rs77647305 | - | |
| Gen desierto; GNDA2 es uno de los 3 genes cercanos | 4p13 | IMC | rs10938397 | - | Asociado con diabetes T2 |
| SLC39A8 | 4q24 | IMC | rs13107325 | - | |
| FLJ35779 | 5q13.3 | IMC | rs2112347 | - | |
| ZNF608 | 5q23.2 | IMC | rs4836133 | - | |
| CPEB4 | 5q35.2 | RCC | rs6861681 | Regula la elongación de poliadenilación | |
| TFAP2B | 6p12 | CC, IMC | rs987237 | - | |
| Locus que contienen NCR3, AIF1 y BAT2 | 6p21 | IMC | rs2844479, rs2260000, rs1077393 | - | Asociado con peso pero no con IMC |
| VEGFA | 6p21.1 | RCC | rs6905288 | Involucrado en el desarrollo vascular. Mediador clave de la adipogénesis | Variantes de VEGFA nominalmente asociadas a diabetes T2 |
| NUDT3-HMGA1 | 6p21.31 | IMC | rs206936 | - | |
| PRL | 6p22.1-p21.3 | IMC | rs4712652 | - | |
| LY86 | 6p25.1 | RCC | rs1294421 | Juega un papel en el reconocimiento de polisacáridos | Asociado con asma |
| RSPOS | 6q22.33 | RCC | rs9491696 | Promueve la angiogénesis y el desarrollo vascular | Oncogén en células epiteliales mamarias en ratón |
| NFE2L3 | 7p15.2 | RCC | rs1055144 | - | |
| MSRA | 8p23.1 | CC, IMC | rs7826222, rs17150703 | - | |
| LRRN6C | 9p21.3 | IMC | rs10968576 | - | |
| PTER | 10p12 | IMC | rs10508503 | - | |
| MTCH2 (locus con 14 genes) | 11p11.2 | IMC | rs10838738 | Apoptosis celular | |
| BDNF (locus con 4 genes, asociación más fuerte cerca de BDNF) | 11p14 | IMC | rs4074134, rs4923461, rs925946, rs10501087, rs6265 | La expresión de BDNF está regulada por el estado nutricional y la señalización de MC4R | Asociado con DT2. Individuos con síndrome de WAGR con deleción de BDNF tienen IMC > percentil 95. BDNF knockdown en hipotálamo del ratón provoca hiperfagia y obesidad |
| RPL27A | 11p15.4 | IMC | rs4929949 | - | |
| ITPR2-SSPN | 12p21.1 | RCC | rs718314 | - | Ratones carentes de ITPR2 e ITPR3 exhibieron hipoglucemia y delgadez |
| HOXC13 | 12q13.13 | RCC | rs1443512 | Factor de transcripción importante en la distribución espacial y desarrollo embrionario | |
| FAIM2 (locus también contiene BCDIN3D) | 12q13 | IMC | rs7138803 | Apoptosis en adipocitos | |
| C12orf51 | 12q24 | RCC | rs2074356 | - | |
| MTIF3-GTF3A | 13q12.2 | IMC | rs4771122 | - | |
| PRKD1 | 14q12 | IMC | rs11847697 | - | |
| NRXN3 | 14q31 | CC,IMC | rs10146997 | - | |
| MAP2K5 | 15q23 | IMC | rs2241423 | - | |
| SH2B1 (locus con 19-25 genes) | 16p11.2 | IMC | rs7498665, rs8049439, rs4788102, rs7498665 | Rol neuronal en la homeostasis energética | Ratones con Sh2b1 anulado son obesos y diabéticos |
| GPRC5B | 16p12.3 | IMC | rs12444979 | - | |
| MAF | 16q22-q23 | IMC | rs1424233 | Factor de transcripción implicado en la adipogénesis y la regulación insulina-glucagón | |
| FTO | 16q22.2 | IMC | rs9939609, rs6499640, rs8050136, rs3751812, rs7190492, rs8044769, rs1558902 | Función neuronal asociada con el control del apetito | Asociado con diabetes T2 |
| NPC1 | 18q11.2 | IMC | rs1805081 | Transporte intracelular de lípidos | Ratones con NPC1 anulado muestran pérdida de peso de inicio tardío y pobre ingesta. NPC1 interfiere con la función de señalización del receptor de insulina |
| MC4R | 18q22 | IMC | rs17782313, rs12970134, rs17700144 | Señalización hipotalámica | La haploinsuficiencia en humanos está asociada con obesidad mórbida. Ratones deficientes en MC4R muestran hiperfagia y obesidad |
| KCTD15 | 19q13.11 | IMC | rs11084753, rs29941 | - | |
| QPTCL-GIPR | 19q13.32 | IMC | rs2287019 | Codifica para el receptor de incretina | Asociado con ayuno y glucosa 2 h |
| TMEM160 | 19q13.32 | IMC | Rs3810291 | - | |
| RPL27A | 11p15.4 | IMC | rs4929949 | - | |
| ITPR2-SSPN | 12p21.1 | RCC | rs718314 | - | Ratones carentes de ITPR2 e ITPR3 exhibieron hipoglucemia y delgadez |
| HOXC13 | 12q13.13 | RCC | rs1443512 | Factor de transcripción importante en la distribución espacial y desarrollo embrionario | |
| FAIM2 (locus también contiene BCDIN3D) | 12q13 | IMC | rs7138803 | Apoptosis en adipocitos | |
| C12orf51 | 12q24 | RCC | rs2074356 | - |
CC: circunferencia de la cintura; IMC: índice de masa corporal; POMC: RRC: relación cintura-cadera.
Fuente: Datos adaptados de Herrera et al.20.
Como se ha descrito anteriormente, la obesidad es un trastorno multifactorial y poligénico, en el que interaccionan factores genéticos y epigenéticos con factores ambientales como la actividad física, el alcohol, el tabaco, pero, de entre todos, probablemente el más importante es la nutrición32. Además, los cambios epigenéticos presentan una gran plasticidad y responden a las señales ambientales, incluyendo la dieta33. Debido a la influencia del metabolismo materno sobre el desarrollo del embrión durante la gestación, se ha indicado que el estatus nutricional materno durante la gestación puede inducir disfunciones epigenéticas en los neonatos34–40. Aunque la afectación del epigenoma acontece en periodos puntuales, en los primeros estadios de la embriogénesis y de la infancia, existe también la posibilidad de intervenir en la edad adulta33. Se ha observado que la exposición a dietas ricas o deficientes en determinados nutrientes durante largos períodos (años) de tiempo, induce cambios epigenéticos con consecuencias para la salud y el riesgo de enfermedad33. Así, los polifenoles ejercen su actividad antilipidémica y antiaterogénica no solo mediante la regulación de la expresión de diferentes genes asociados con el sistema inmunológico y el metabolismo energético, sino también mediante la inducción de cambios en el patrón de metilación de islas CpG del ADN41,42, la acetilación de las histonas43 y la modulación de la expresión de algunos miARN44 en adultos. A este respecto, Joven et al.45 utilizaron ratones hiperlipidémicos con deficiencia en el receptor de LDL para evaluar el papel de los polifenoles en la prevención de enfermedad metabólica a través de la regulación de la expresión de los microARN hepáticos miR-103/107 y miR-122. En sus resultados destacaron que la administración oral de polifenoles revirtió los cambios producidos en los microARN inespecíficos miR-103/107 tras la ingesta crónica de polifenoles, y una falta de respuesta del miARN específico miR-122, especulando sobre una posible implicación de los polifenoles en el metabolismo celular a nivel hepático. Estos autores señalaron que la modulación de la expresión de los microARN puede constituir un importante y adicional mecanismo de intervención de enfermedades crónicas. A pesar de lo dicho, se precisan más estudios en humanos para esclarecer los efectos epigenéticos de los polifenoles y otros componentes como son los AGPI de cadena larga.
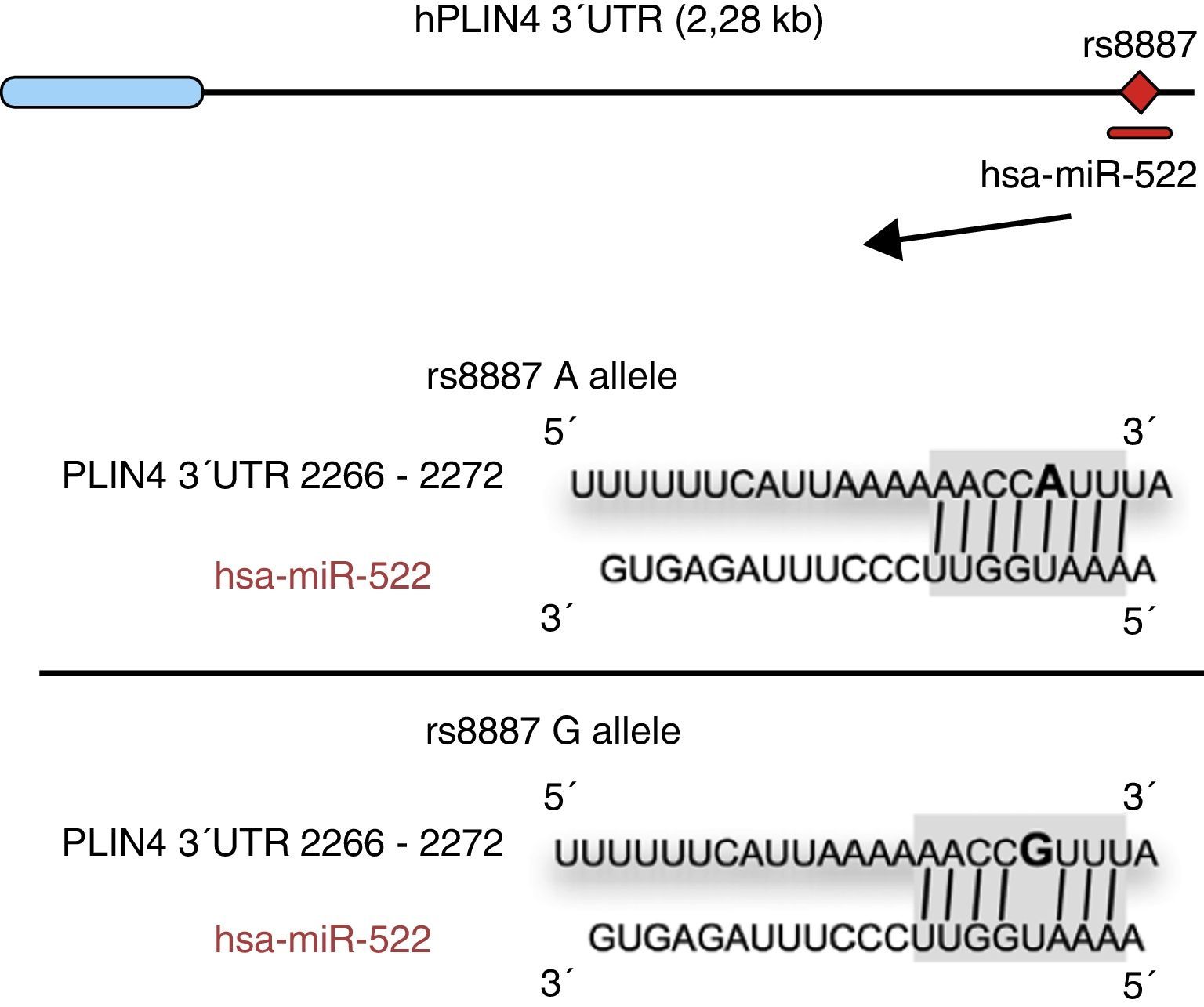
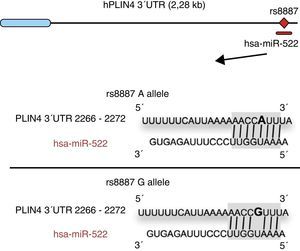
Los ácidos grasos omega-3 (n-3) se han asociado con diversas propiedades y usos terapéuticos en humanos46–53. Así, la ingestión de las cantidades recomendadas de los n-3 docosahexaenico (DHA) y ácido eicosapentaenico reduce el riesgo de muerte y enfermedades coronarias mediante la prevención de arritmias, la formación de prostaglandinas y precursores de los leucotrienos, la inhibición de las citosinas inflamatorias, promoción de la lipólisis y la oxidación de ácidos grasos, así como la inhibición de la lipogénesis, la reducción de triglicéridos totales y las lipoproteínas de muy baja densidad (VDVDLc). Recientemente, entre otras propiedades, se ha observado que dietas con alto contenido de n-3 reducen el riesgo de desarrollar diferentes tipos de cáncer (e. g. cánceres colorrectales y de mama) y su proliferación celular54–58. Los procesos moleculares asociados con las propiedades antilipidémicas y antiaterogénicas, así como antiinflamatoria y de desarrollo celular, de los n-3 son consecuencia de su capacidad de regulación de la expresión de diferentes genes asociados con el sistema inmunológico y el metabolismo energético59–62, o su capacidad de regulación epigenética, mediante la inducción de cambios en el patrón de metilación de islas CpG del ADN63, y la modulación de la expresión de algunos miARN64–66. A este respecto, por ejemplo, se ha reportado que los AGPI tipo n-3 modifican la interacción entre el miR-522 y la región 3′ UTR del gen perilipina 4 (PLIN4), que resulta en una alteración de los fenotipos relacionados con la obesidad (fig. 1)67. No obstante, son pocos los estudios que describen el efecto de la ingestión de diferentes tipos de ácidos grasos poliinsaturados (AGPI) sobre las modificaciones epigenéticas y la expresión genética resultante. Existe, pues, la necesidad de contrastar los datos públicos e ilustrar la relación entre la ingestión de AGPI, especialmente, n-3, y las modificaciones epigenéticas. Así, el objetivo del presente estudio es realizar una revisión de los estudios más recientes sobre los efectos de la ingestión de los AGPI y el riesgo de padecer obesidad o sobrepeso, intentando esclarecer los mecanismos epigenéticos asociados, especialmente la metilación del ADN y el rol de los ARN no codificantes.
El alelo menor A rs8887 crea un nuevo miR-522 MRE en el gen PLIN4 39UTR. Diagrama de miR-522: PLIN4 39UTR secuencias con el alelo A o G. El sitio para miR-522 sombreado en gris, y la variante rs8887 en negrita. Adaptado de Richardson et al.67.
En la presente revisión se ha realizado una búsqueda de publicaciones recientes en las siguientes bases de datos electrónicas especializadas: NCBI, Elsevier Journal, Scielo, Science Direct, Springer Link. Se han reunido resultados de trabajos llevados a cabo en ensayos in vitro, modelos animales y estudios en humanos. Adicionalmente se han incluido revisiones que recopilan y analizan la efectividad de los AGPI en determinados tratamientos, como puede ser el hipotensor y el hipolipidemiante, entre otros. También se han analizado los conceptos de epigenéticos relacionados con los ARN no codificantes, y las modificaciones químicas de las histonas, la obesidad, la hipertensión y la aterosclerosis para describir con más detalle los posibles mecanismos epigenéticos de los AGPI. Las palabras clave utilizadas han sido: ácidos grasos poliinsaturados, acetilación de histonas, metilación del ADN, microARN, epigenética, obesidad, sobrepeso y síndrome metabólico. Se han revisado un total de 84 artículos, incluyendo revisiones. Los artículos seleccionados se dividieron en las siguientes categorías: 1) artículos genéricos sobre la epigenética, la obesidad y los AGPI; 2) artículos sobre la relación entre el consumo de AGPI y la metilación del ADN, la acetilación de histonas y la modulación de los ARN no codificantes.
Resultados y discusiónHay pocos trabajos que estudien el efecto epigenético de la ingestión de AGPI tipo n-3 y n-6 y su rol en el control y prevención de la obesidad. Los estudios que analizan los efectos de los AGPI en las modificaciones epigenéticas y que se han utilizado en la presente revisión se han agrupado en función del tipo de marca epigenética: 1) adición de un grupo metilo al ADN en la citosina del dinucleótido CpG; 2) modificación de las proteínas llamadas histonas; 3) modificación de la expresión de ARN no codantes. En cada una de ellas se especifica los resultados y conclusiones más relevantes.
Como se ha mencionado anteriormente, durante los primeros días de desarrollo embrionario existen diferentes olas de desmetilación, seguidas de un incremento de metilación de novo en el embrión y los tejidos extraembrionarios como la placenta68,69. Guo et al.68 han demostrado que la mayor ola de desmetilación se completa en el estadio de 2 células. Poco después de esta implantación hay una ola de remetilación, estableciéndose los patrones epigenéticos para los distintos tipos celulares33,68. Durante la gestación puede existir un primer contacto entre el embrión y los nutrientes o metabolitos secundarios de la madre, influyendo el epigenoma fetal y aumentando o disminuyendo el riesgo de desarrollo de algunas enfermedades. Kulkarni et al.63 describieron que la suplementación de n-3 (45g de aceite de pescado y 25g de aceite de soja por cada kg de dieta) en ratas gestantes conjuntamente con un exceso de ácido fólico y una deficiencia de vitamina B12, aumentó la metilación del ADN en la placenta a niveles control. Así, los niveles reducidos de metilación del ADN en placentas de ratas fueron revertidos al suplementarse la dieta con DHA, demostrando que los niveles DHA juegan un rol muy importante en determinar los niveles de metilación de la placenta. Estos resultados están de acuerdo con aquellos obtenidos en estudios con modelos animales en los que la suplementación de n-3 durante la gestación70 o durante los primeros días posnatales71 pudieron prevenir o limitar los afectos adversos de la programación fetal. En ratones adultos con obesidad, Fan et al.72 demostraron que la regulación de la expresión de los genes de la leptina, el receptor de leptina y el neuropéptido precursor de propiomelanocortina (POMC) se modificó por medio de la suplementación de la dieta con n-3 (35g/kg de aceite de soja; 17,5g/kg de aceite de soja y 17,5g/kg de aceite de pescado; 35g/kg de aceite de pescado para cada uno de los 3 grupos no deficientes en n-3) pero no se modificó la metilación de los promotores de dichos genes72. Otros estudios realizados en modelos animales han demostrado que el efecto de la suplementación de n-3 en la metilación del ADN depende del gen estudiado y del tejido, especialmente durante la gestación y la lactancia63,73,74. Así, Niculescu et al.74 han podido demostrar la asociación entre la disponibilidad de ácido α-linolénico (ALA; suplementación de 75.367 nmol/mg/día) durante la gestación y la lactancia en ratones, y alteraciones en la metilación del ADN del gen FADS2 (en inglés, fatty acid desaturase 2) y del intrón número 1 en los hígados de las madres y los hijos al final del período de lactancia. FADS2 es una enzima desaturasa que cataliza diferentes pasos en la ruta de biosíntesis de los AGPI de cadena larga, a partir de ácido linoleico (n-6) y ALA75. Además, este estudio indica que la interacción materna con ALA durante la gestación y lactancia podría alterar diferencialmente el metabolismo de n-3 y n-674. En humanos, un estudio reciente realizado en mujeres jóvenes con sobrepeso y tratadas mediante una dieta calórico-restrictiva ha demostrado que la suplementación de n-3 derivados del aceite de pescado (>1.300mg/día en forma de 6 cápsulas diarias) induce pequeños cambios epigenéticos que reducen la metilación del ADN del gen CD36 de células mononucleares de la sangre, una vez ajustado por el peso corporal de las mujeres76.
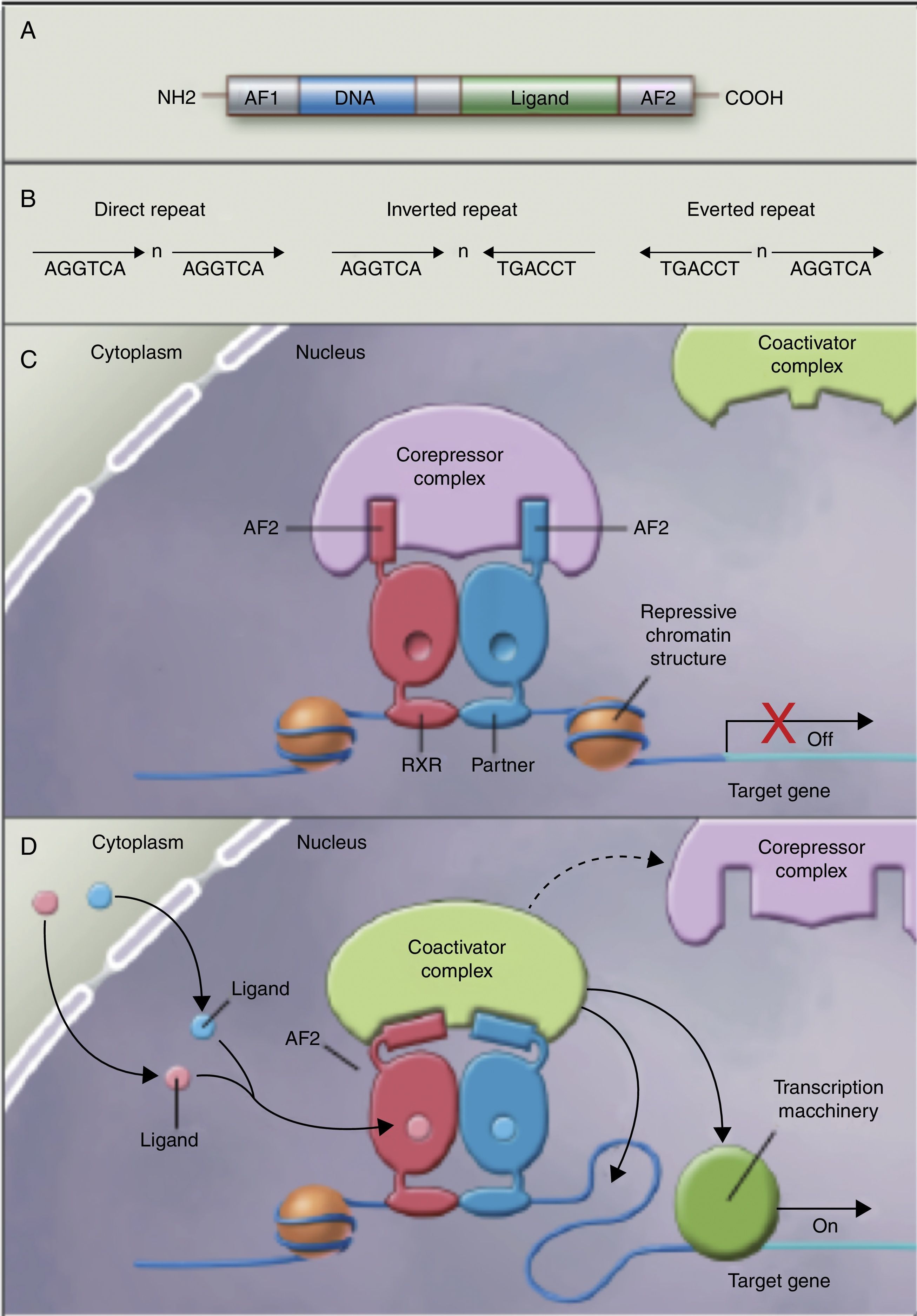
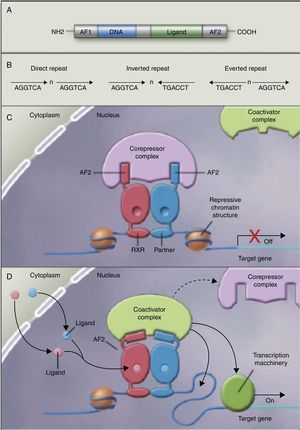
Los autores no han encontrado estudios que relacionen el efecto de la ingestión de los AGPI y sus metabolitos con la acetilación de histonas y la consiguiente remodelación de la cromatina, la cual es importante para la expresión de genes de la superfamilia de receptores nucleares asociados con el control y desarrollo de la obesidad y el metabolismo de los lípidos77. Aunque aún no existen estudios al respecto, algunos autores78 empiezan a pensar que los AGPI de cadena larga podrían permitir el control de la expresión de PPAR (en inglés, peroxisome proliferator-activated receptor gamma) y sus genes diana mediante la remodelación secuencial de la cromatina. En otras palabras, la ingestión de AGPI podría modificar el complejo multiproteico correpresor con actividad histona desacetilasa, modificar la remodelación de la cromatina, permitiendo la unión del factor de transcripción en su promotor, facilitando su transcripción y la expresión de todos los genes diana, muchos de los cuales están relacionados con la obesidad (fig. 2).
Receptores nucleares como factores de transcripción dependientes de ligando. A) Estructura canónica de un elemento de respuesta nuclear (NRE), incluye la función N-terminal de activación (AF1), la unión al ADN, la unión al ligando y los dominios C-terminal (AF2). B) Número de nucleótidos entre los elementos centrales (n) que confiere especificidad adicional. C y D) Heterodímero sin ligando y con ligando asociados al complejo correpresor y coactivador recíprocamente. Adaptado de Shulman et al.84.
Por último, la presente revisión pretende describir los estudios que han demostrado una regulación de los ARN no codificantes por parte de AGPI y sus posibles implicaciones en la obesidad. Recientemente se ha podido demostrar el primer ejemplo de una variante genética que genera un lugar de unión para un microARN (miARN) que influye en los rasgos relacionados con la obesidad mediante una interacción gen-dieta modulada por AGPI tipo n-367. Los miARN son transcritos pequeños no codificantes de aproximadamente 21-25 nucleótidos. Los miARNs juegan un papel determinante en la regulación de los genes asociaodos con los procesos de diferenciación celular y desarrollo, de proliferación y mantenimineto de la homeostasis, entre otros. Estos miARN, asociados a complejos multienzimáticos, son guiados para el reconocimiento de secuencias complementarias en la región 3′ UTR o 5′ UTR de mARN79. En general, la interacción entre ambos deriva en la degradación del mARN y en la represión traducción, y en consecuente reducción de la actividad proteica. Richardson et al.67 investigaron las asociaciones entre 7 SNP en el gen PLIN4 (rs8887, rs11673616, rs892158, rs7250947, rs8102428, rs1609717, rs884164) con fenotipos relacionados con la obesidad a partir de 2 muestras de individuos de ascendencia europea67. Los autores efectuaron un metaanálisis que demostró interacciones significativas entre el polimorfismo rs8887 para el alelo menor A del gen PLIN4, la ingestión de AGPI tipo n-3 y las medidas antropométricas. La PLIN4 es una proteína de la familia PAT con gran afinidad para las gotas de almacenamiento de lípidos80, las cuales influyen en el riesgo de desarrollar enfermedades metabólicas81. Además, los autores demostraron que, a nivel estructural, la presencia del alelo A en la región no traducible 3′ (3′ UTR) del gen PLIN4 creaba un elemento de reconocimiento (MRE) para el miR-522, no siendo así en el caso del alelo G (fig. 1). Los datos proporcionados por este estudio muestran que una elevada ingesta de n-3 para los portadores del alelo A podría provocar una disminución antropométrica con respecto a los no portadores, específicamente comparados con los homocigotos para el alelo G ya que en ellos no se daría interacción entre el miARN y la región 3′ UTR del gen PLIN467. Una menor expresión del gen PLIN4 debida al miR-522 podría contribuir a fenotipos relacionados con la obesidad, pero son necesarios más estudios para corroborarlo, así como para encontrar si el mecanismo propuesto puede darse para otros miARN. En otro trabajo reciente, Baselga et al.82 pudieron contrarrestar los efectos dislipidémicos de 2 miARN al suplementar la dieta de ratas obesas con proantocianidinas y DHA. Los miARN analizados (miR-122 y miR-33a) son importantes reguladores del metabolismo lipídico en el hígado83. El objetivo del estudio fue evaluar si los niveles de miR-122 y miR-33a en el hígado correlacionaban con la lipidemia inducida nutricionalmente en diferentes modelos de ratas. Con este propósito se analizaron los niveles hepáticos de ambos miARN en ratas dislipidémicas alimentadas con dieta cafetería (CD) sin suplementar y ratas alimentadas con CD y suplementada con proantocianidinas o DHA. Los autores comprobaron que la CD incrementaba los niveles de miR-122 y miR-33a hepáticos. En cambio, en las ratas suplementadas con DHA, los niveles de ambos miARN revertieron, con aún mayor reducción en aquellas suplementadas con ambos compuestos (proantocianidinas y DHA). Respecto al perfil lipídico, el tratamiento crónico con proantocianidinas mejoró el índice aterogénico alterado por la CD, normalizándose los niveles plasmáticos de triglicéridos (TG) y LDL, además de reducir el nivel total de lípidos y de TG en el hígado. En contraste, las ratas alimentadas con CD suplementadas con DHA normalizaron los niveles plasmáticos de colesterol total y LDL, sin verse afectado el contenido lipídico en el hígado. La administración simultánea de ambos tratamientos (polifenoles y DHA) supuso un efecto hipolipidémico con un decrecimiento similar en hígado y plasma al de los tratamientos por separado, concluyendo los autores que su efecto fue complementario y no sinérgico o aditivo, aunque más estudios son necesarios para elucidar el mecanismo por el cual las proantocianidinas y el DHA reprimen miR-122 y miR-33a82.
ConclusionesLa ingestión de AGPI se ha asociado a diferentes propiedades terapéuticas. Específicamente, los resultados de la presente revisión nos hacen proponer que la ingestión de los AGPI puede controlar parámetros relacionados con la obesidad mediante mecanismos epigenéticos diferentes. Los primeros resultados indican una capacidad de los AGPI para modificar la metilación de los promotores de genes adipogénicos y consecuentemente su expresión de manera reversible. Este es un gran resultado, pues las alteraciones epigenéticas pueden ser uno de los puntos más débiles en el desarrollo de la obesidad, debido a que podemos inactivar o activar genes epigenéticamente inactivados usando los nutrientes adecuados. Hasta el momento, no existe información referente a la modulación genética a través de mecanismos epigenéticos alternativos como podría ser por medio de modificaciones de las histonas. No obstante, los primeros resultados sobre la posible asociación entre los AGPI y la represión en la expresión de genes asociados con el metabolismo lipídico mediante los miARN empieza a ser evidente en modelos animales.
Con los resultados publicados hasta la fecha, no es posible definir una dosis de AGPI asociada a sus propiedades terapéuticas. Aun así, dichos resultados representan interesantes descubrimientos que deben ser estudiados extensamente, pues el conocimiento de la distribución y funcionalidad de los AGPI en pacientes con obesidad puede ser útil para conseguir un tratamiento terapéutico. De igual interés será seguir investigando en el campo de tratamientos no farmacológicos alternativos como son los alimentos funcionales. Hasta la fecha solo se han estudiado un número limitado de AGPI y, dado que los efectos de diferentes componentes no son equivalentes, los resultados no pueden ser generalizados. Así pues, futuros estudios a gran escala, controlados en dosis, componentes activos, biodisponibilidad y otras variables críticas como el background genético, serán cruciales para aportar la evidencia científica necesaria requerida para determinar las modificaciones epigenéticas de los AGPI y su contribución en el desarrollo y prevención de la obesidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.