Comparar el efecto de diferentes hipoglucemiantes en indicadores analíticos y ecográficos de la esteatosis hepática no alcohólica (EHNA) en pacientes con diabetes tipo 2 no controlados solo con metformina.
MétodosEstudio prospectivo de pacientes diabéticos tratados con metformina, en combinación con gliclazida, pioglitazona, sitagliptina, exenatida o liraglutida. En el momento basal y a los 6 meses la EHNA fue valorada por ecografía abdominal y se calculó el índice de fibrosis de la EHNA.
ResultadosCincuenta y ocho pacientes completaron los 6 meses de seguimiento: 15 recibieron gliclazida, 13 pioglitazona, 15 sitagliptina, 7 exenatida y 8 liraglutida. La EHNA afectó basalmente al 57,8% de los casos y su evolución ecográfica varió dependiendo de la evolución del peso (p=0,009) y de la cintura (p=0,012). Los porcentajes de sujetos que experimentaron una mejoría ecográfica en los diferentes grupos de tratamiento fueron: 33,3% con gliclazida, 37,5% con pioglitazona, 45,5% con sitagliptina, 80% con exenatida y 33% con liraglutida (p=0,28).
ConclusionesLa evolución ecográfica cualitativa de la EHNA en el paciente diabético tratado con metformina en combinación con otros hipoglucemiantes está vinculada a la evolución del peso y del perímetro de cintura. Son precisos ensayos clínicos de larga duración para evaluar si las terapias incretínicas se asocian a mejores resultados hepáticos que otras terapias hipoglucemiantes.
To compare the effect of different hypoglycemic drugs on laboratory and ultrasonographic markers of non-alcoholic fatty liver disease (NAFLD) in patients with type 2 diabetes not controlled on metformin alone.
MethodsProspective study of diabetic patients treated with metformin in combination with gliclazide, pioglitazone, sitagliptin, exenatide, or liraglutide. NAFLD was assessed by abdominal ultrasound and NAFLD fibrosis score was calculated at baseline and 6 months.
ResultsFifty-eight patients completed 6 months of follow-up: 15 received gliclazide, 13 pioglitazone, 15 sitagliptin, 7 exenatide, and 8 liraglutide. NAFLD affected 57.8% of patients at baseline, and its ultrasonographic course varied depending on changes in weight (P=.009) and waist circumference (P=.012). The proportions of patients who experienced ultrasonographic improvement in the different treatment groups were: 33.3% with gliclazide, 37.5% with pioglitazone, 45.5% with sitagliptin, 80% with exenatide, and 33% with liraglutide (P=.28).
ConclusionsQualitative ultrasonographic NAFLD improvement in diabetic patients treated with metformin in combination with other hypoglycemic drugs is associated to change over time in weight and waist circumference. Long-term clinical trials are needed to assess whether incretin therapies result in better liver outcomes than other hypoglycemic therapies.
La esteatosis hepática no alcohólica (EHNA) afecta al 69,4% de los pacientes diabéticos1 y se asocia a un aumento de la mortalidad tanto por causas cardiovasculares como hepáticas2. Se define como la acumulación de grasa en el hígado por encima del 5-10% de su peso3 y progresa en un 12-20% de los sujetos a esteatohepatitis con fibrosis leve o moderada, que evoluciona en un 13% de los pacientes a cirrosis en 4-5 años4. Se prevé que para 2020, en paralelo a la epidemia mundial de obesidad, la esteatohepatitis no alcohólica se convertirá en la principal causa de trasplante hepático5.
El tratamiento más aceptado de la EHNA consiste en una dieta hipocalórica y ejercicio físico con el fin de perder el 5-10% de peso en 6-12 meses6. Dada la dificultad para mantener estas medidas dietéticas a largo plazo, se está investigando la eficacia de diferentes fármacos en la EHNA3. Por el momento, la mayoría de los estudios se han realizado con metformina y pioglitazona. En cuanto a la primera, no ha mostrado efectos beneficiosos en la histología hepática7 y la Asociación Americana para el Estudio de las Enfermedades Hepáticas la ha desaconsejado6. Respecto a la pioglitazona, los resultados en algunos ensayos podrían justificar su administración en la EHNA, pero se han descrito problemas de seguridad a largo plazo8. Los datos sobre el papel de los inhibidores de la dipeptidil peptidasa-4 y los agonistas del receptor del péptido similar al glucagón tipo-1 son todavía limitados9.
La metformina ha demostrado reducir la mortalidad global en los pacientes diabéticos10 y múltiples guías clínicas la consideran de primera elección en estos pacientes. En la práctica clínica, el 53,9% de los pacientes diabéticos en monoterapia con metformina no está bajo control (HbA1c>7%)11. Para seleccionar un segundo hipoglucemiante añadido a la metformina en estos pacientes no controlados, el tratamiento podría individualizarse en función de la edad, la duración de la diabetes, las complicaciones asociadas o el riesgo de hipoglucemia12. Todavía no se ha probado la hipótesis de si el efecto de los hipoglucemiantes de segunda línea en la EHNA también podría representar un criterio para individualizar el tratamiento en los pacientes diabéticos no controlados solo con metformina.
El objetivo de este estudio ha sido comparar el efecto de diferentes hipoglucemiantes de segundo escalón en indicadores analíticos y ecográficos cualitativos de EHNA en pacientes con diabetes tipo 2 no controlados solo con metformina.
MétodosDiseño del estudioSe ha realizado un estudio piloto de seguimiento longitudinal, no aleatorizado, de 5 hipoglucemiantes, con un diseño paralelo: gliclazida, pioglitazona, sitagliptina, exenatida, liraglutida. La asignación de los pacientes a las ramas de tratamiento estaba determinada por la práctica habitual de los médicos que los seleccionaron, que tuvieron acceso a las fichas técnicas de estos fármacos y se adhirieron estrictamente a las mismas.
Criterios de inclusiónLos criterios de inclusión fueron pacientes mayores de 18 años de ambos sexos tratados en 2013 en algún centro de salud de Lanzarote por diabetes mellitus tipo 2, con metformina como único hipoglucemiante y con una HbA1c>6,5%. Todos los pacientes recibieron una hoja informativa sobre el estudio y dieron su consentimiento informado por escrito. El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Dr. Negrín y fue financiado por la Fundación Canaria del Colegio de Médicos de Las Palmas.
SeguimientoEl seguimiento de los pacientes se articuló en 4 visitas: la de selección, la inicial, la intermedia a los 3 meses y la final a los 6 meses. La visita de selección se utilizó para realizar una historia clínica completa y para determinar peso, talla, perímetro de cintura y tensión arterial. El índice de masa corporal (IMC) se calculó dividiendo el peso en kilogramos entre la altura en metros al cuadrado. En el intervalo de 2 semanas entre la visita de selección y la visita inicial, se extrajo una analítica para la determinación basal de HbA1c, hemograma, creatinina, colesterol total, lipoproteínas de baja densidad, lipoproteínas de alta densidad, triglicéridos, bilirrubina total, alanina aminotransferasa (ALT), aspartato aminotransferasa, ratio normalizada internacional y albúmina. El síndrome metabólico se evaluó según los criterios de la Federación Internacional de Diabetes y asumiendo los puntos de corte de perímetro de cintura específicos para nuestra población (>94,5cm para los hombres y>89,5cm para las mujeres)13.
En la visita inicial se prescribió alguno de los siguientes fármacos, junto con metformina (850mg/8-12h):
- -
Gliclazida 30mg antes del desayuno. Si la HbA1c se mantenía>6,5% a los 3 meses, se aumentó a 60mg/día.
- -
Pioglitazona 15mg en desayuno. Si la HbA1c se mantenía>6,5% a los 3 meses, se aumentó a 30mg/día.
- -
Sitagliptina 50mg en desayuno y cena.
- -
Exenatida 5μg antes de almuerzo y cena. Se aumentó a 10μg 2 veces/día tras el primer mes.
- -
Liraglutida 0,6mg antes del almuerzo. Se aumentó a 1,2mg/día tras la primera semana.
A los 3 y 6 meses se midieron de nuevo todos los parámetros inicialmente valorados y se evaluaron los posibles efectos adversos.
Evaluación de la esteatosis hepática no alcohólicaUn explorador experimentado (>1.500 ecografías) y desconocedor de los datos del paciente realizó la ecografía abdominal en el intervalo de 2 semanas entre las visitas de selección y la inicial a todos los pacientes incluidos con un consumo de alcohol≤20g/día. El mismo procedimiento se repitió a los 6 meses de seguimiento en todos los pacientes diagnosticados de EHNA, de forma ciega con respecto al hipoglucemiante utilizado. Otras causas posibles de EHNA (hepatitis viral crónica, hepatitis autoinmune, hemocromatosis, enfermedad de Wilson, déficit de alfa-1-antitripsina, hipotiroidismo, cirrosis biliar primaria, enfermedad hepática inducida por fármacos) se excluyeron en todos los pacientes por la determinación de serología vírica para hepatitis B y C, anticuerpos antinucleares, anticuerpos antimitocondriales, anticuerpos antimúsculo liso, anticuerpos antimicrosomales hepatorrenales, niveles séricos de ferritina, saturación de transferrina, ceruloplasmina, alfa1-antitripsina, hormona estimulante del tiroides y hormona tiroidea libre14.
La ecografía abdominal se efectuó a todos los participantes con un transductor de 3,5MHz (Aloka Co, Ltd., P-42109B). Se evaluaron una vista sagital del lóbulo hepático derecho, una vista transversal del segmento hepático lateral izquierdo y una vista transversal del hígado. Se estudió cualquier área focal de ecotextura alterada. Los pacientes se clasificaron cualitativamente en 4 grupos, según la gravedad de la ecogenicidad del parénquima hepático15:
- -
0: ausencia de esteatosis con ecogenicidad normal.
- -
I: esteatosis leve con aumento ligero y difuso de ecos finos en el parénquima hepático y visualización normal de diafragma y venas suprahepáticas.
- -
II: esteatosis moderada con aumento difuso de ecos finos en el hígado y visualización ligeramente alterada de diafragma y venas suprahepáticas.
- -
III: esteatosis grave con marcado aumento de ecos finos y visualización pobre o nula de diafragma, venas suprahepáticas y lóbulo derecho posterior del hígado.
El índice de fibrosis de la EHNA (IFE) se calculó en todos los pacientes al inicio y a los 6 meses de seguimiento. Esta herramienta considera la edad, el IMC, el diagnóstico de diabetes o glucemia basal alterada, el cociente aspartato aminotransferasa /ALT, y el recuento de plaquetas y albúmina. Los pacientes se clasificaron en 3 grupos según la probabilidad de fibrosis hepática avanzada16:
- -
Alta probabilidad. Si IFE>0,675.
- -
Baja probabilidad. Si IFE<−1,455.
- -
Riesgo indeterminado. Si IFE está entre −1,455 y 0,675.
Se compararon entre los grupos de tratamiento (gliclazida, pioglitazona, sitagliptina, exenatida, liraglutida) el porcentaje de pacientes con esteatosis hepática que experimentó una mejoría cualitativa de la imagen ecográfica a los 6 meses, y los valores finales obtenidos en el IFE. Los resultados de las variables cuantitativas se expresaron como las medias y las desviaciones estándar, y los de las variables categóricas, como porcentajes. Para las variables cuantitativas se utilizó la técnica ANOVA o la de Kruskal-Wallis según se comprobase o no la distribución normal, y la técnica Chi-cuadrado se empleó para las variables categóricas. Se calculó la correlación entre las variables cuantitativas a través de los coeficientes de Pearson o Spearman según se demostrase o no la distribución normal. La evolución ecográfica de la EHNA se estudió según una técnica de regresión ordinal. El análisis estadístico de los datos se llevó a cabo con el programa SPSS versión 21.0 (Chicago, IL, EE. UU.). Se fijó para todas las pruebas un nivel de significación de p<0,05 bilateral.
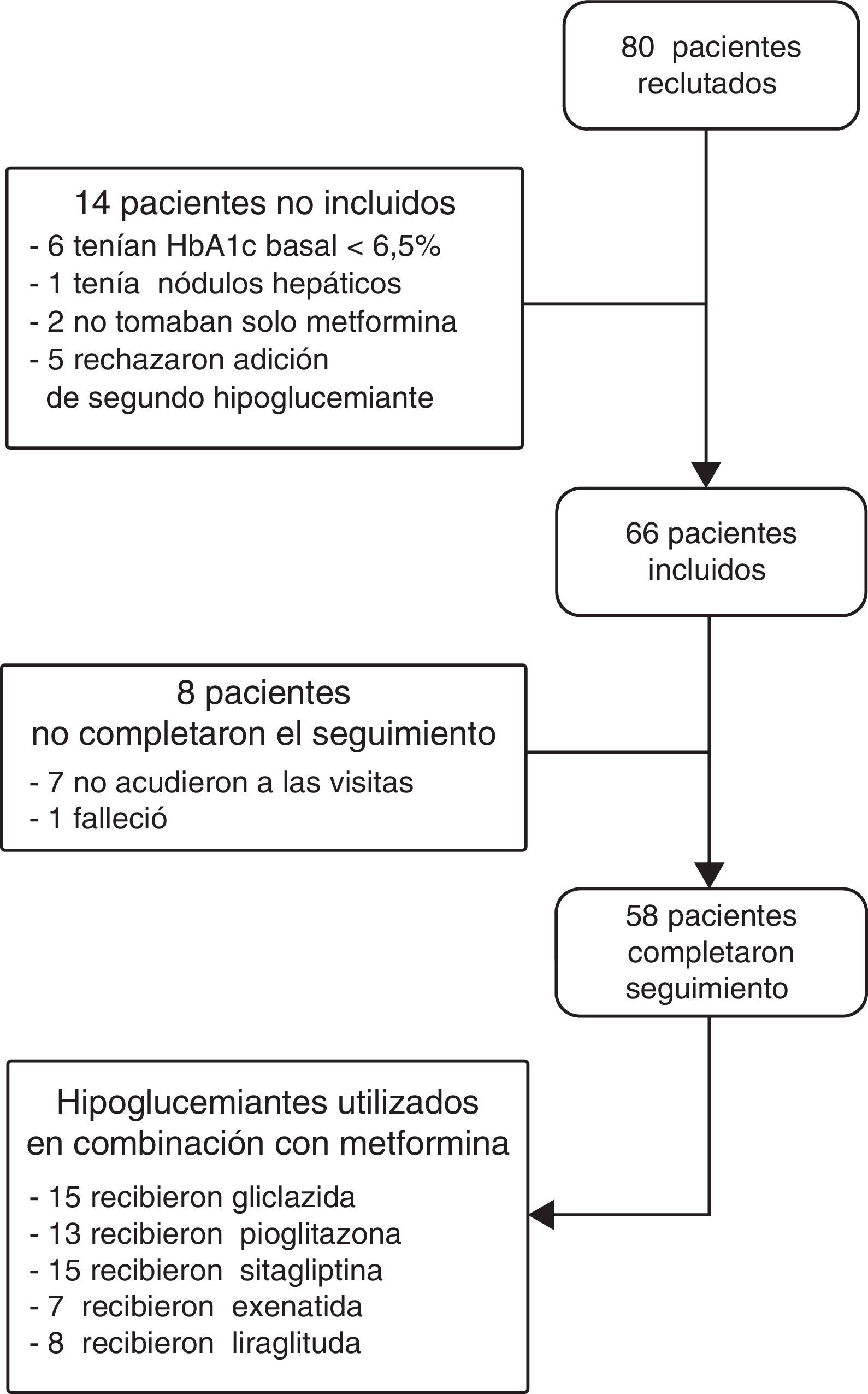
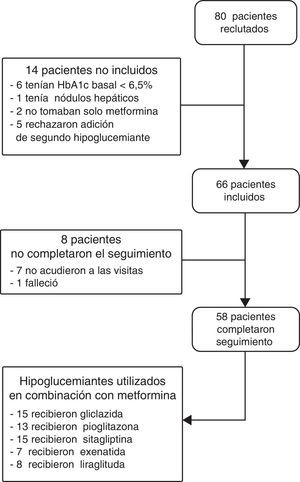
ResultadosPacientes incluidos y seguridad de los fármacosSe seleccionaron 80 pacientes, 66 cumplieron los criterios de inclusión y 58 completaron los 6 meses de seguimiento: 15 recibieron tratamiento con gliclazida, 13 con pioglitazona, 15 con sitagliptina, 7 con exenatida y 8 con liraglutida (fig. 1). El 5,6% de los pacientes con gliclazida presentaron hipoglucemia y el 20% de los tratados con liraglutida tuvieron náuseas. Entre los 8 pacientes que resultaron pérdidas, 7 no acudieron a las visitas programadas y uno falleció. Esta muerte se produjo por un adenocarcinoma de páncreas metastásico en un paciente que recibió tratamiento con exenatida durante un mes.
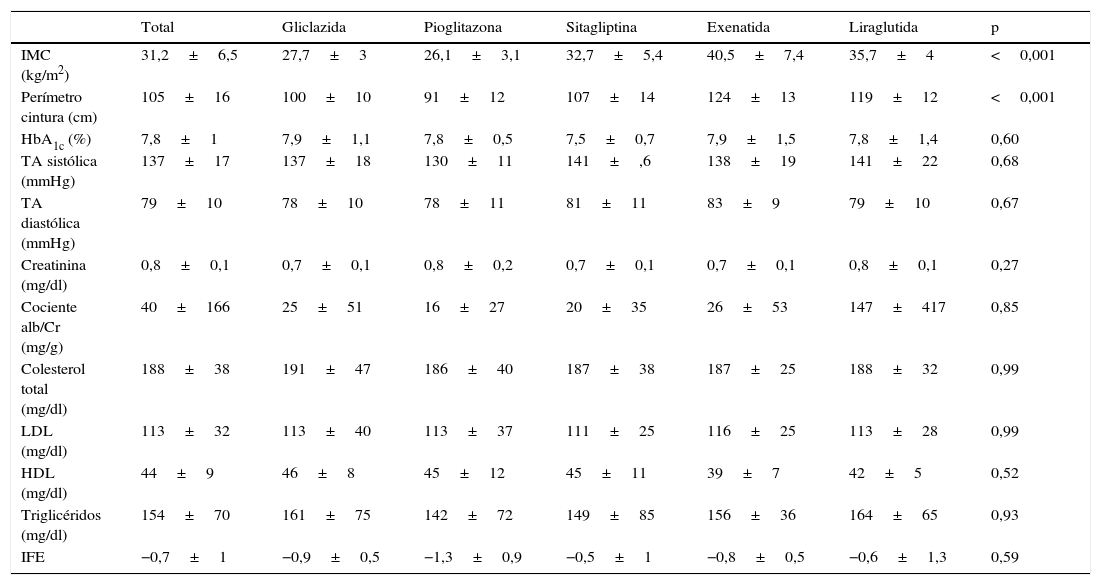
Características basalesLas características basales fueron: edad media 55,4±9,4 años; duración media de la diabetes 5,9±5,3 años; proporción de mujeres 39,4%; número diario medio de fármacos por paciente 7±3,8; proporción con síndrome metabólico 81,8%. Según el grupo de tratamiento asignado, se observaron diferencias basales en el IMC y el perímetro de cintura (tabla 1), pero no en la proporción de pacientes con síndrome metabólico: 83,3% con gliclazida, 60% con pioglitazona, 80% con sitagliptina, 100% con exenatida y 100% con liraglutida (p=0,06).
Características basales según el hipoglucemiante
| Total | Gliclazida | Pioglitazona | Sitagliptina | Exenatida | Liraglutida | p | |
|---|---|---|---|---|---|---|---|
| IMC (kg/m2) | 31,2±6,5 | 27,7±3 | 26,1±3,1 | 32,7±5,4 | 40,5±7,4 | 35,7±4 | <0,001 |
| Perímetro cintura (cm) | 105±16 | 100±10 | 91±12 | 107±14 | 124±13 | 119±12 | <0,001 |
| HbA1c (%) | 7,8±1 | 7,9±1,1 | 7,8±0,5 | 7,5±0,7 | 7,9±1,5 | 7,8±1,4 | 0,60 |
| TA sistólica (mmHg) | 137±17 | 137±18 | 130±11 | 141±,6 | 138±19 | 141±22 | 0,68 |
| TA diastólica (mmHg) | 79±10 | 78±10 | 78±11 | 81±11 | 83±9 | 79±10 | 0,67 |
| Creatinina (mg/dl) | 0,8±0,1 | 0,7±0,1 | 0,8±0,2 | 0,7±0,1 | 0,7±0,1 | 0,8±0,1 | 0,27 |
| Cociente alb/Cr (mg/g) | 40±166 | 25±51 | 16±27 | 20±35 | 26±53 | 147±417 | 0,85 |
| Colesterol total (mg/dl) | 188±38 | 191±47 | 186±40 | 187±38 | 187±25 | 188±32 | 0,99 |
| LDL (mg/dl) | 113±32 | 113±40 | 113±37 | 111±25 | 116±25 | 113±28 | 0,99 |
| HDL (mg/dl) | 44±9 | 46±8 | 45±12 | 45±11 | 39±7 | 42±5 | 0,52 |
| Triglicéridos (mg/dl) | 154±70 | 161±75 | 142±72 | 149±85 | 156±36 | 164±65 | 0,93 |
| IFE | −0,7±1 | −0,9±0,5 | −1,3±0,9 | −0,5±1 | −0,8±0,5 | −0,6±1,3 | 0,59 |
Cociente alb/Cr: cociente albúmina/creatinina; HDL: lipoproteína de alta densidad; IFE: índice de fibrosis de la esteatosis hepática no alcohólica; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad.
Los datos se expresan como media±DE.
En la tabla 2 se expone para cada grupo de tratamiento la evolución del peso, el perímetro de cintura, la HbA1c, la tensión arterial, la creatinina, el cociente albúmina/creatinina, el colesterol total, las lipoproteínas de baja densidad, las lipoproteínas de alta densidad y los triglicéridos.
Cambio en los parámetros metabólicos a los 6 meses según el hipoglucemiante
| Gliclazida | Pioglitazona | Sitagliptina | Exenatida | Liraglutida | p | |
|---|---|---|---|---|---|---|
| Peso (kg) | 0,9±3 | 2,3±3,3 | −0,9±2,2 | −4,1±9,8 | −1,1±5 | 0,10 |
| Perímetro cintura (cm) | 2,9±3,3 | 6,1±9,2 | −1,2±9,3 | −1,4±9,3 | 0,3±5,6 | 0,10 |
| HbA1c (%) | −0,5±1,3 | −0,7±0,8 | −1,2±0,8 | −1,3±1,8 | −1,4±1,5 | 0,29 |
| TA sistólica (mmHg) | −3,1±12,5 | −3,8±14,3 | −5,8±18 | −12,1±21,9 | −6,1±17,1 | 0,80 |
| TA diastólica (mmHg) | −1,2±8,5 | −2,3±9,7 | −4,6±12,6 | −4,2±11,3 | 0,7±9,8 | 0,77 |
| Creatinina (mg/dl) | 0±0,08 | 0,01±0,1 | 0,03±0,07 | 0,07±0,09 | 0,04±0,08 | 0,46 |
| Cociente alb/Cr (mg/g) | −12,9±29,2 | −6,4±24,2 | 0,1±23,1 | −30,6±59,8 | −107,7±296,2 | 0,68 |
| Colesterol total (mg/dl) | −9,3±45,6 | −4,2±30,7 | −22±41,6 | −31,9±33 | −41,4±48 | 0,23 |
| LDL (mg/dl) | −5±41,8 | −7,3±29,1 | −18,4±37,3 | −32,2±35 | −35,1±42,9 | 0,27 |
| HDL (mg/dl) | 3,8±6,2 | 5±10,7 | 3,1±7,6 | 0±5,9 | 1,5±5,4 | 0,65 |
| Triglicéridos (mg/dl) | −31,2±59,5 | −9,6±53,6 | −20,1±42,5 | 1,5±36,2 | −39,3±80,5 | 0,54 |
Cociente alb/Cr: cociente albúmina/creatinina; HDL: lipoproteína de alta densidad; LDL: lipoproteína de baja densidad.
Los datos se expresan como media±DE.
La hipertransaminasemia (ALT>41UI/l) se diagnosticó en el 17,5% de los pacientes y fue 7 veces más frecuente entre los que tenían EHNA (27% entre aquellos con EHNA vs. 3,8% entre aquellos sin esta comorbilidad, p=0,02). No se encontraron diferencias entre los grupos de tratamiento en la variación de la ALT a los 6 meses: la reducción media de ALT fue 1,3±9,2UI/l con gliclazida, 6,6±21,9UI/l con pioglitazona, 5,4±21,2UI/l con sitagliptina, 3,1±6,8UI/l con exenatida y 10,2±12,9UI/l con liraglutida (p=0,804).
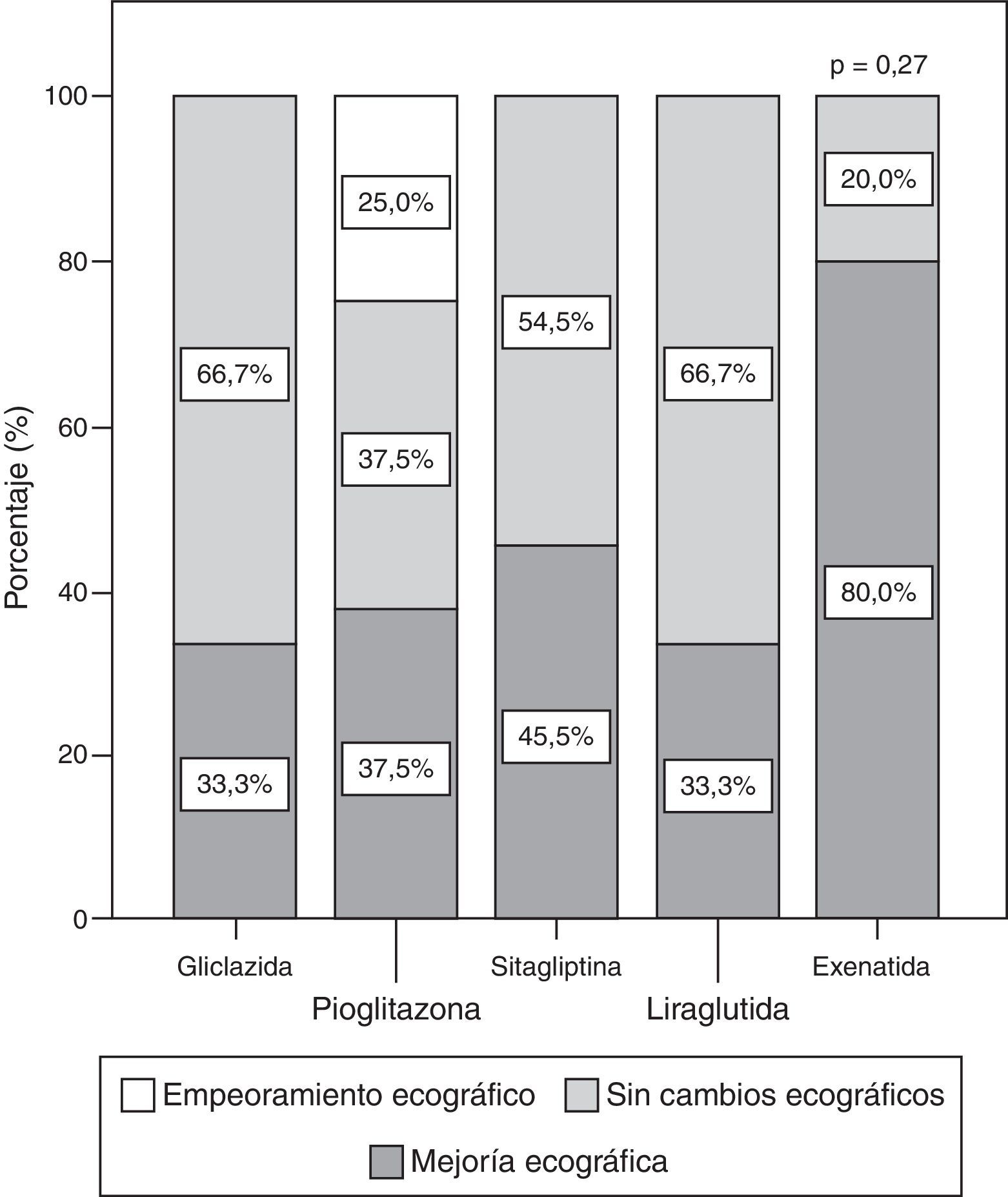
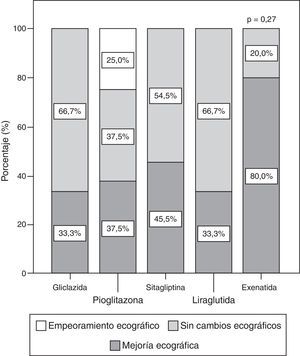
Evolución ecográfica cualitativa de la esteatosis hepática no alcohólicaLa EHNA afectó basalmente al 57,8% de los pacientes estudiados y resultó 2,6 veces más frecuente entre los que tenían síndrome metabólico (65,4% entre aquellos con síndrome metabólico vs. 25% entre aquellos sin este síndrome, p=0,02). La EHNA fue inicialmente más frecuente (p=0,001) entre los pacientes tratados con terapias incretínicas (80% si sitagliptina, 85,7% si exenatida, 88,9% si liraglutida) que entre los tratados con pioglitazona (46,7%) o gliclazida (22,2%). A los 6 meses se observó una mejoría ecográfica cualitativa de la EHNA en el 46,8% del total de los pacientes, y los porcentajes de sujetos que experimentaron mejoría ecográfica en los diferentes grupos de tratamiento fueron (fig. 2): 33,3% con gliclazida, 37,5% con pioglitazona, 45,5% con sitagliptina, 80% con exenatida y 33% con liraglutida (p=0,28).
La evolución ecográfica cualitativa de la EHNA varió dependiendo de la evolución del peso: los que presentaron una mejoría ecográfica cualitativa perdieron una media de 3,5±6,8kg, mientras que aquellos sin cambios ecográficos ganaron una media de 1,2±2,9kg y aquellos con un empeoramiento ecográfico aumentaron su peso una media de 7,1±7kg (p=0,009). La evolución ecográfica cualitativa de la EHNA también estuvo vinculada a la evolución del perímetro de cintura: los pacientes con mejoría ecográfica disminuyeron el perímetro de cintura una media de 4,4±7,2cm, mientras que aquellos sin cambios o con un empeoramiento ecográfico aumentaron el perímetro de cintura una media, respectivamente, de 2,6±7,3cm y 9±11,3cm (p=0,012). Al ajustar la evolución ecográfica de la EHNA en función de la evolución ponderal y el hipoglucemiante utilizado se comprobó que la pérdida ponderal se asocia de forma independiente a una mejoría ecográfica de la EHNA (p=0,001), y que la administración de exenatida tiende a asociarse a mejores resultados ecográficos que los demás hipoglucemiantes, sin alcanzar significación estadística (p=0,066).
Se encontró una tendencia a obtener mejores valores de HbA1c final en los pacientes con mejor evolución ecográfica de la EHNA: los pacientes con mejoría ecográfica tuvieron una HbA1c final media de 6,1±0,7%, los pacientes sin cambios ecográficos tuvieron una HbA1c final media de 6,6±0,9%, y los pacientes con empeoramiento ecográfico tuvieron una HbA1c final media de 7,6±0,9% (p=0,062).
Evolución del IFEEl IFE basal fue compatible con una alta probabilidad de fibrosis en el 10,3% de los pacientes, con una baja probabilidad de fibrosis en el 20,7% de los sujetos y con un nivel indeterminado de fibrosis en el 69% de los casos. Su valor medio fue peor entre los pacientes con síndrome metabólico (−0,698 vs. −3,092 en aquellos sin síndrome metabólico, p=0,019) y no hubo diferencias significativas en el valor basal medio del IFE entre los grupos de tratamiento (tabla 1). El IFE a los 6 meses de seguimiento cambió en el conjunto de pacientes una media de 0,072±0,463, y no se observaron diferencias en esta variación del IFE en función del hipoglucemiante recibido (−0,212±0,239 con gliclazida, 0,126±0,348 con pioglitazona, 0,227±0,412 con sitagliptina, −0,105±0,85 con exenatida, −0,106±0,372 con liraglutida, p=0,504).
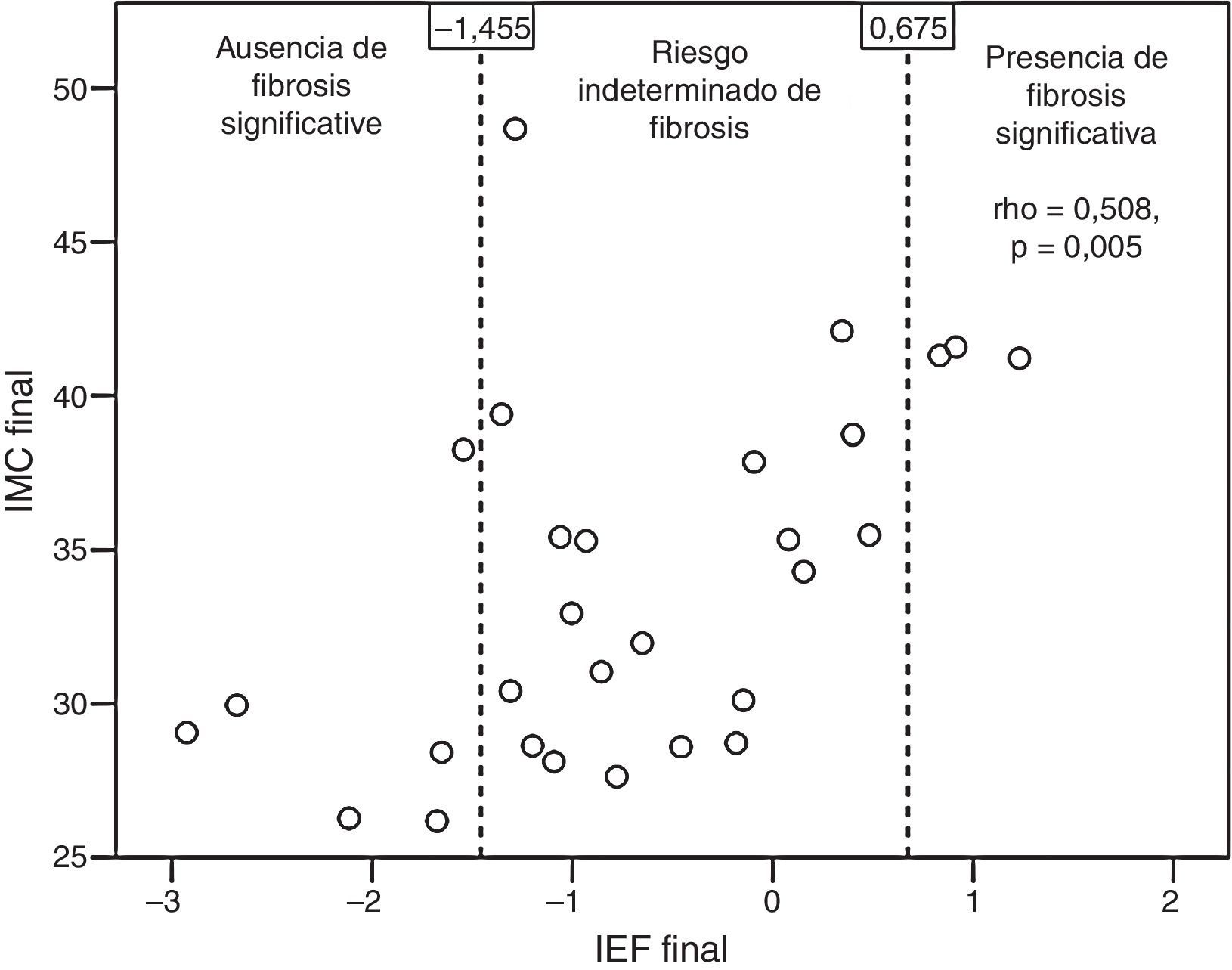
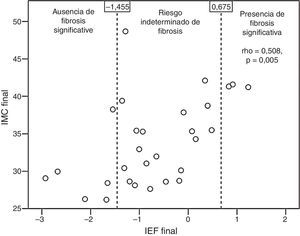
Los pacientes con mejoría ecográfica cualitativa a los 6 meses lograron una variación media favorable del IFE (−0,002±0,648), mientras que aquellos sin esta mejoría alcanzaron una variación media desfavorable del IFE (0,173±0,211), sin llegar a una diferencia estadísticamente significativa (p=0,365). Los pacientes tratados con estatinas tendieron a mostrar un mejor valor medio del IFE final (−0,937±0,983) que aquellos sin estatinas (−0,108±0,975, p=0,052). El IFE final se correlacionó de forma significativa con el IMC final (rho=0,508, p=0,005; fig. 3), el perímetro de cintura final (rho=0,43, p=0,02), la ratio normalizada internacional final (rho=0,537, p=0,012) y el número diario de fármacos por paciente (rho=0,439, p=0,017).
DiscusiónLa prevalencia observada de EHNA ha sido ligeramente inferior a la publicada por Leite et al. (69,4%), que estudiaron 180 pacientes con diabetes tipo 2 tratados con metformina en el 82,7% de los casos1. Esta población de estudio no es directamente comparable a la nuestra, que había recibido en su totalidad metformina como único tratamiento inicial. Esta alta prevalencia de EHNA en pacientes diabéticos podría explicar que revisiones recientes recomienden incluir resultados analíticos, ecográficos o histológicos relacionados con la EHNA en estudios con población diabética17. En nuestro estudio piloto hemos usado el IFE, una herramienta que ha demostrado un área bajo la curva ROC de 0,85, con una sensibilidad del 90% y una especificidad del 97% en la identificación de la esteatohepatitis asociada a fibrosis avanzada, adquiriendo una especial relevancia pronóstica en la valoración de la EHNA18.
El hallazgo de que la evolución ecográfica cualitativa de la EHNA se relacione estrechamente con la evolución del peso y la cintura concuerda con la correlación de 0,57 entre tejido adiposo visceral e hígado graso en pacientes con diabetes tipo 2 apuntada por Kelley et al.19. Una limitación de nuestro estudio reside en su tamaño muestral, que puede haber condicionado el no encontrar valores finales de HbA1c significativamente mejores en el grupo de pacientes con mejoría ecográfica, ni un IFE final significativamente mejor en el grupo de enfermos tratados con estatinas. Una ventaja puede haber sido el comparar directamente entre sí el efecto sobre la EHNA de distintos hipoglucemiantes con interés en un perfil de paciente tan común como el diabético en monoterapia con metformina.
La guía clínica para el manejo de la EHNA propuesta por la Universidad de California San Diego recomienda tratar la EHNA del diabético mediante una intervención en el estilo de vida y pioglitazona, con o sin metformina20. Aunque un metaanálisis con 862 participantes, el 38% diabéticos, demostró que las tiazolidindionas mejoran la esteatosis, el balonamiento hepatocelular y los fenómenos inflamatorios, retrasando la progresión de la fibrosis21, la pioglitazona se ha vinculado con múltiples efectos adversos: cáncer de vejiga, osteoporosis, ganancia de peso, edematización de los miembros inferiores e insuficiencia cardiaca congestiva22.
Ante estos efectos adversos, otras alternativas farmacológicas pueden ser de interés. En nuestro estudio piloto, la exenatida en combinación con metformina alcanzó los porcentajes más altos de mejoría ecográfica cualitativa de la EHNA, aunque sin significación estadística en posible relación con el pequeño tamaño muestral examinado. Klonoff et al. apreciaron que exenatida asociada con metformina o sulfonilureas mejora la ALT tras un seguimiento de 3 años de 217 pacientes23. Cuthbertson et al. informaron de una reducción del 42% en la grasa intrahepática cuantificada mediante espectroscopia de resonancia magnética protónica al utilizar durante 6 meses agonistas del receptor de péptido similar al glucagón tipo-1 en 25 pacientes diabéticos (19 con exenatida y 6 con liraglutida, en combinación con metformina y sulfonilureas o inhibidores de la dipeptidil peptidasa-4)24. Gupta et al. demostraron que el receptor de péptido similar al glucagón tipo-1 está presente en los hepatocitos humanos y relacionaron su papel en la reducción de los triglicéridos hepatocitarios con la activación de elementos clave del sustrato receptor de la insulina de tipo 2 en los hepatocitos25. Se ha publicado que exenatida presenta una mayor capacidad de enlentecimiento gástrico que liraglutida26, anula el incremento posprandial de triglicéridos27 y, en consecuencia, disminuye la exposición del tejido hepático a los triglicéridos. Con respecto a la seguridad del fármaco, consideramos poco probable que el fallecimiento registrado por adenocarcinoma pancreático metastásico esté en relación con la exenatida iniciada en el paciente antes de conocer este diagnóstico, ya que el enfermo recibió el tratamiento durante solo un mes, la propia diabetes mellitus tipo 2 aumenta un 51% el riesgo de muerte por carcinoma pancreático28 y, de acuerdo con el estudio de Li at al., los incretín miméticos no parecen acelerar el desarrollo del adenocarcinoma pancreático29.
Se hace necesario un mayor esfuerzo investigador en el abordaje diagnóstico y terapéutico de la EHNA en el paciente diabético. En cuanto al diagnóstico, llama la atención que el 69% de los pacientes diabéticos haya presentado un riesgo de fibrosis indeterminado. Si bien la biopsia hepática está considerada la prueba de referencia en la evaluación diagnóstica de la EHNA, no está exenta de complicaciones potencialmente graves, como la hemorragia3, ni de variabilidad inter e intraobservador30, y de ahí el interés de pruebas no invasivas para determinar la probabilidad de fibrosis hepática avanzada, como el FibroScan®. Este ha alcanzado un área bajo la curva ROC de 0,94, con una sensibilidad de 0,94 y una especificidad de 0,95, en un metaanálisis que incluyó 32 artículos sobre pacientes con EHNA18, aunque su rentabilidad diagnóstica se reduce significativamente en los pacientes con obesidad14. En cuanto al tratamiento, podrían resultar de especial interés estudios sobre el efecto de las terapias incretínicas en la EHNA que cuenten con un diseño experimental y, al contemplar mecanismos de aleatorización en la inclusión de pacientes, valoren este efecto en grupos de pacientes homogéneos en características basales relevantes, como el IMC o el perímetro de cintura. Por otro lado, que el riesgo de fibrosis significativa se correlacione con el número de fármacos tomados por los pacientes nos invita a profundizar en el potencial efecto esteatogénico de las interacciones entre distintos fármacos, así como a revisar en cada paciente la medicación que toma para evitar, en la medida de lo posible, aquellos medicamentos de esteatogenicidad ya conocida20.
ConclusiónLa evolución ecográfica cualitativa de la EHNA en el paciente diabético tratado con metformina en combinación con otros hipoglucemiantes está vinculada a la evolución del peso y del perímetro de cintura. Son precisos ensayos clínicos de larga duración para evaluar si las terapias incretínicas se asocian a mejores resultados hepáticos que otras terapias hipoglucemiantes.
FinanciaciónEste estudio ha sido promovido por sus investigadores de forma independiente a la industria farmacéutica y ha sido financiado por la Fundación Canaria del Colegio de Médicos de Las Palmas (España). Esta fuente de financiación no ha participado en el diseño del estudio, ni en la recopilación, análisis o interpretación de los datos, ni en la redacción del manuscrito, ni en la decisión de presentarlo para su publicación.
AutoríaEGD contribuyó al diseño del estudio, seleccionó y siguió pacientes, analizó los datos y escribió el manuscrito. DG contribuyó al diseño del estudio, realizó las ecografías hepáticas y revisó el manuscrito. VG, CM, CrM, YL, DP, TG y GT seleccionaron y siguieron pacientes, y revisaron el manuscrito.
Conflicto de interesesLos autores no tienen conflicto de intereses en relación con el contenido del estudio.