En la última década ha habido una auténtica eclosión de trabajos que relacionan el traumatismo craneoencefálico (TCE) con hipopituitarismo. Esta condición puede afectar el proceso de rehabilitación por lo que se requiere identificar a estos pacientes, pero hasta ahora, la metodología utilizada ha sido muy diversa y los resultados muy dispares. Es probable que la indidencia del hipopituitarismo haya sido sobrevalorada. Esta revisión se centra en el impacto del TCE sobre la función hipofisaria, el método diagnóstico, factores de riesgo y opciones de tratamiento.
There have been in the past decade a growing number of studies relating head trauma to hypopituitarism. This condition may affect the rehabilitation process, and identification of such patients is therefore required. However, the widely different methods used so far for this purpose have provided inconsistent results. The incidence rate of hypopituitarism has probably been overestimated. This review focuses on the impact of head trauma on pituitary function, the diagnostic method, risk factors, and treatment options.
El traumatismo craneoencefálico (TCE) constituye un problema sanitario de primera magnitud en todo el mundo, ya que la incidencia es de 180 a 250 casos por 100.000 habitantes y año. En los países desarrollados es la principal causa de muerte en los adultos jóvenes y, en los supervivientes, existe una alta incidencia de alteraciones cognitivas, físicas y emocionales que, en la mayoría de los casos, son permanentes1,2.
La primera descripción que relaciona un TCE con alteración de la función hipofisaria fue realizada por Simmonds hace casi un siglo3. No obstante, la aparición de un hipopituitarismo después de TCE fue considerada como un hecho muy poco frecuente hasta el punto que, en una serie de 595 hipopituitarismos publicada en 1942, solo se recogía el antecedente de TCE en 4 casos4. Sin embargo, en las décadas siguientes, se observó una descripción constante de casos aislados, algunos de ellos recopilados en una publicación de Edwards y Clark5. Asimismo, en los estudios necrópsicos, se detectó una alteración hipofisaria hasta en el 30% de los fallecidos por TCE6,7. Todo ello llevó a la sospecha de que el hipopituitarismo postraumático no era un hecho tan excepcional como se creía. La revisión de Benvenga et al.7, en 2000, incluyó 367 casos y supuso la inclusión definitiva del TCE entre los mecanismos etiopatogénicos del hipopituitarismo.
A partir de entonces, ha habido una eclosión de trabajos sobre la incidencia del hipopituitarismo tras TCE y, en 2009, se publicó un documento de consenso por parte de la Sociedad Española de Endocrinología y Nutrición8. No obstante, trabajos más recientes parecen indicar que la afectación hipofisaria después de TCE puede estar sobrevalorada9. Aunque existen otras modalidades de agresión cerebral como causa de hipopituitarismo, cuya causa más frecuente es la hemorragia subaracnoidea10, el propósito de esta revisión se circunscribe al TCE.
Etiopatogenia de lesión hipotálamo-hipofisaria tras traumatismo craneoencefálicoLa hipófisis está localizada en el interior de una estructura ósea, la silla turca, que la rodea por completo, excepto en la parte superior, donde se sitúa el diafragma selar, estructura formada por una capa densa de tejido conectivo, a través de la cual se dispone el tallo hipofisario, que aporta el 80-90% del flujo sanguíneo. Constituye un sistema portal que transporta las hormonas hipotalámicas responsables de la regulación de la secreción adenohipofisaria. Estos largos vasos hipofisarios y los capilares del tallo son especialmente vulnerables a la tumefacción intraselar producida por las heridas traumáticas y, por tanto, el proceso puede derivar en un infarto hipofisario5,7.
Los mecanismos propuestos para justificar el edema y la hemorragia causantes de la lesión hipofisaria incluyen: 1) la lesión cerebral difusa por colisión de las estructuras cerebrales con las estructuras craneales, 2) el mecanismo de golpe-contragolpe que explica lesiones cerebrales por colisión contra estructuras óseas situadas en el lado opuesto a la colisión traumática, 3) la hemorragia o hematoma secundarios a roturas vasculares, y 4) las heridas penetrantes desde el exterior que hacen que las estructuras craneales como piel, cabellos, hueso, etc., se conviertan en factores agresivos para las estructuras cerebrales8. Dichas lesiones han sido demostradas en los estudios autópsicos de pacientes fallecidos por TCE. En ellos se observan diferentes grados de edema, hemorragia y necrosis y, a menudo, coexisten los 3 tipos de lesión10–12, constituyen el mecanismo primario daño hipotálamo-hipofisario y pueden ser estudiados por diferentes técnicas de imagen13,14.
Existe una serie de mecanismos secundarios que se producen a partir de la lesión primaria. Incluye la hipotensión arterial, hiperglucemia, hipertensión intracraneana, hipertermia, hiponatremia e hipoxia que pueden provocar la muerte neuronal a través de diferentes procesos como el aumento de radicales libres, estrés oxidativo, neuroglucopenia, aumento de los aminoácidos excitatorios como glutamato, lactato y adenosina que contribuyen en el mantenimiento de la lesión primaria8.
De forma interesante, Tanriverdi et al. han involucrado un mecanismo autoinmunitario que favorecería la aparición de hipopituitarismo tras TCE15. Estos autores detectaron la presencia de anticuerpos anti-hipófisis en el 46% de un grupo de sujetos que 3 años antes habían presentado un TCE. Al mismo tiempo demostraron que la presencia de anticuerpos era un factor predictor para el desarrollo de hipopituitarismo. Sugieren que la autoinmunidad puede ser un factor que contribuye en el desarrollo del hipopituitarismo post-TCE, ya que permitiría que antígenos secuestrados en el tejido hipotálamo-hipofisario lesionado pasaran al torrente circulatorio y fueran susceptibles de desencadenar una respuesta humoral capaz de perpetuar la disfunción neuroendocrina. Al ser una respuesta más tardía, también podría explicar por qué algunos casos desarrollan la insuficiencia hipofisaria meses después del TCE. Los autores especulan que el mecanismo de neuroinflamación puede estar involucrado el la disfunción hipofisaria tardía que ocurre tras el TCE.
Manifestaciones clínicasLa sintomatología derivada de las lesiones encefálicas se caracteriza principalmente por deficiencias neurológicas y cognitivas que dependen de la gravedad de las mismas. En la fase aguda, pueden enmascarar, parcial o totalmente, manifestaciones derivadas de la insuficiencia hipofisaria. Las más frecuentes se relacionan con alteraciones de la arginina vasopresina, hormona antidiurética (ADH), ya sea diabetes insípida o síndrome de secreción inadecuada de arginina vasopresina (SIADH), y con diferentes síndromes que cursan con pérdida salina. La falta de diagnóstico de las mismas puede poner en riesgo la vida del paciente, ya de por sí comprometida por la lesión neurológica. La producción del resto de hormonas hipofisarias también puede estar alterada. Clínicamente, el déficit de cortisol y hormonas tiroideas puede añadir mayor gravedad al proceso, aunque en ocasiones forman parte de mecanismos de adaptación a la nueva situación clínica que son reversibles si se supera la fase aguda.
Los individuos que superan la fase aguda frecuentemente continúan presentado deficiencias neurológicas. En este caso, la falta de detección del hipopituitarismo puede incidir en la recuperación de las mismas, ya que la falta de tiroxina, hormona de crecimiento (GH) y hormonas sexuales puede dificultar el proceso de rehabilitación. En relación con la GH, está ampliamente reconocido que su deficiencia puede afectar la calidad de vida, la densidad mineral ósea y la composición corporal7,8. Existe una similitud en relación a los cambios psicológicos, la disminución de fuerza muscular y la capacidad de ejercicio que presentan tanto los pacientes con TCE como el resto de afectados por la deficiencia de GH en el adulto. Como el déficit de GH tras TCE puede ser transitorio, es necesario esperar un período superior a 12 meses para asegurar que la deficiencia de GH sea permanente para plantear un tratamiento sustitutivo con GH en los casos de TCE.
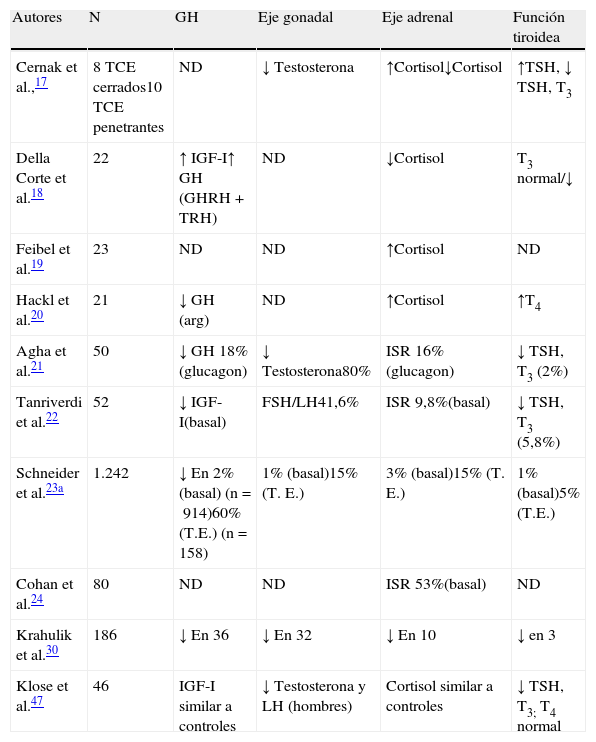
Impacto del traumatismo craneoencefálico sobre la función hipofisariaFase agudaLos primeros días que siguen al TCE se caracterizan por una serie de alteraciones que algunos autores han englobado en el término «disfunción neuroendocrina de la fase aguda del TCE»16. Los datos iniciales se obtuvieron a partir de determinaciones basales de hormonas hipofisarias y las correspondientes a las glándulas periféricas. Se trataba de estudios que no estaban específicamente diseñados para investigar la frecuencia del hipopituitarismo, sino que su objetivo era relacionar los resultados obtenidos con la gravedad del traumatismo u otros factores susceptibles de convertirse en factores pronóstico17–20. Los trabajos más recientes son estudios de cohortes que ponen más énfasis en las deficiencias hormonales21,22. Del conjunto de resultados, se observa una falta de acuerdo acerca de la naturaleza de los cambios neuroendocrinos posteriores al TCE y estas variaciones pueden ser debidas a criterios dispares en la selección de pacientes, diseño del estudio, gravedad del traumatismo, momento de las determinaciones hormonales y la metodología empleada16. En la tabla 1 se detalla el conjunto de alteraciones detectadas en las diferentes series.
Resumen de los resultados obtenidos en la fase aguda del TCE
| Autores | N | GH | Eje gonadal | Eje adrenal | Función tiroidea |
| Cernak et al.,17 | 8 TCE cerrados10 TCE penetrantes | ND | ↓ Testosterona | ↑Cortisol↓Cortisol | ↑TSH, ↓ TSH, T3 |
| Della Corte et al.18 | 22 | ↑ IGF-I↑ GH (GHRH+TRH) | ND | ↓Cortisol | T3 normal/↓ |
| Feibel et al.19 | 23 | ND | ND | ↑Cortisol | ND |
| Hackl et al.20 | 21 | ↓ GH (arg) | ND | ↑Cortisol | ↑T4 |
| Agha et al.21 | 50 | ↓ GH 18%(glucagon) | ↓ Testosterona80% | ISR 16%(glucagon) | ↓ TSH, T3 (2%) |
| Tanriverdi et al.22 | 52 | ↓ IGF-I(basal) | FSH/LH41,6% | ISR 9,8%(basal) | ↓ TSH, T3 (5,8%) |
| Schneider et al.23a | 1.242 | ↓ En 2% (basal) (n=914)60% (T.E.) (n=158) | 1% (basal)15% (T. E.) | 3% (basal)15% (T. E.) | 1% (basal)5% (T.E.) |
| Cohan et al.24 | 80 | ND | ND | ISR 53%(basal) | ND |
| Krahulik et al.30 | 186 | ↓ En 36 | ↓ En 32 | ↓ En 10 | ↓ en 3 |
| Klose et al.47 | 46 | IGF-I similar a controles | ↓ Testosterona y LH (hombres) | Cortisol similar a controles | ↓ TSH, T3; T4 normal |
Merece destacar la afectación del eje adrenal ya que puede amenazar a vida del paciente. El cortisol aumenta inmediatamente después del TCE y desciende gradualmente hasta la normalidad en pocos días17,18,20. Esta activación del eje adrenal ha sido relacionada con el aumento de la presión intracraneana19. La insuficiencia suprarrenal, derivada de una ausencia de dicha activación se sitúa alrededor del 10-20%16,22,23, aunque en un estudio se cifra en el 53% si solo se tiene en cuenta el cortisol basal24. La disminución del cortisol plasmático se ha relacionado con la gravedad del traumatismo valorada según la escala de Glasgow (GCS)25 en los casos leves o moderados y la normalización del cortisol era un buen indicador de mejor pronóstico26,27. En contraste, en los TCE graves se ha observado una disminución del cortisol en los primeros días, para elevarse posteriormente28. Se han descrito crisis suprarrenales en algunos casos con TCE grave que posteriormente presentaron respuestas espectaculares al tratamiento con glucocorticoides16. En la misma línea, Cohan et al. señalaron que la hipotensión arterial que requería tratamiento era más común en los pacientes con insuficiencia suprarrenal24.
De igual forma que el cortisol, varios estudios describen la activación del eje somatotrópico después del traumatismo. La GH aumenta después del TCE y se ha observado un aumento paradójico después del estímulo con glucosa, que se normaliza en la fase de recuperación28,29. La falta de este aumento de GH ha sido observada en el 18% por Behan et al.16 y en el 20% de los casos en el estudio de Tanriverdi et al. y, en este último, se relacionaba con concentraciones bajas de IGF122. Porcentajes más elevados han sido descritos por Schneider et al.23 y por Krahulik et al.30. Se han descrito respuestas exageradas de GH a GHRH y una respuesta paradójica a TRH que se relacionan con peor pronóstico18. Hackl et al. reportan una falta de respuesta de GH al test de arginina y, en los casos muy graves, este hecho se asociaba a una mortalidad cercana al 100%20.
Como en otras situaciones agudas, la supresión del eje gonadal es un hecho muy frecuente en el TCE17,20,31–33, con prevalencias superiores al 50% en la mayoría de los estudios, aunque la gran mayoría experimentan recuperación de la función.
La disminución de gonadotrofinas puede reflejar una respuesta adaptativa a la lesión o la situación característica del paciente crítico y tiene una significación incierta. El sentido de estos cambios puede reflejar la existencia de un mecanismo defensivo adecuado que reduzca el uso de energía y substratos correspondientes a funciones menos vitales. No obstante, en algunos estudios, la concentración de testosterona se correlaciona con la gravedad del TCE17,31, al contrario que los resultados de Lee et al.34. Puede detectarse también una hiperprolactinemia, aunque cabe decir que los resultados son muy variables35, pero algunos autores han detectado una correlación positiva con la gravedad de la lesión36.
Existen resultados dispares sobre las alteraciones del eje tiroideo. Algunos autores no han encontrado cambios en la concentración de tiroxina17,18, mientras que otros han descrito concentraciones bajas de T431 o altas19. La T3 suele ser baja o en el límite inferior de la normalidad17. También se han descrito resultados discordantes con la TSH, bajos o normales, pero que se incrementan en pocos días. No se conoce el significado de estos hallazgos. Se ha demostrado que la disminución de las hormonas tiroideas y la TSH se relaciona con un pronóstico desfavorable17 y una respuesta plana a TRH se sigue de una elevada mortalidad20. No obstante, en otros casos no se ha observado correlación alguna18.
Como se ha comentado anteriormente, la afectación de la neurohipófisis tiene una prevalencia variable, aunque existen pocas series que hayan valorado el estado de la secreción de la ADH, ya sea en forma de diabetes insípida o de SIADH. En el estudio de Behan et al.16, la secreción de ADH está alterada en un 40% de los casos. La diabetes insípida puede estar presente hasta en un 26% de pacientes37,38, asociada a casos más graves y a edema cerebral importante. La presencia de SIADH es también muy variable, hasta el 36% de los casos16. La disparidad de estos resultados refleja, de nuevo, diferencias en la selección de pacientes, criterios diagnósticos del SIADH y el momento de la determinación de la natremia después del TCE, ya que puede detectarse a las 48 horas del traumatismo, pero, en ocasiones, puede retardarse hasta casi 3 semanas. No existe correlación con la gravedad del traumatismo, ni con la afectación de la adenohipófisis. Las alteraciones de la neurohipófisis son transitorias en la mayoría de los casos.
La afectación de, al menos, uno de los ejes hipotálamo-hipofisarios es frecuente. En las últimas series, oscila entre el 30 y el 60% y se detectan déficits múltiples en el 20-30% de los casos.
Nuestro grupo ha tenido la oportunidad de estudiar, de forma prospectiva, 46 casos de TCE moderado o grave. Los resultados preliminares de 36 casos (26 hombres y 10 mujeres) en la fase aguda fueron presentados en el Congreso de la SEEN de 201039. Todos los varones tenían déficit de gonadotrofinas, 17 casos (47%) con déficit de cortisol, TSH disminuida en 16 (44%), hiperprolactinemia en 22 (61%), IGF-I disminuido en 7 (19%) y 4 con diabetes insípida (11%), Había más de un eje afectado en 31 casos. Los TCE graves (GCS inferior a 8) tenían más ejes afectados así como los que presentaban un mayor grado de lesión cerebral difusa.
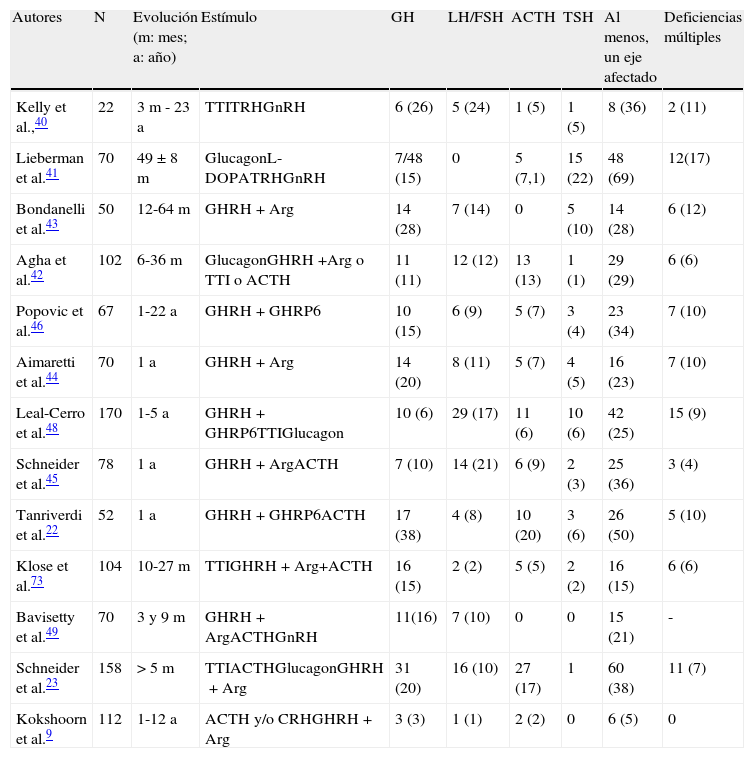
Fase crónicaLa mayoría de las series valoran los resultados de la función hipofisaria entre 3 y 12 meses después del TCE. La mayoría han sido publicados en la última década. En la tabla 2, se exponen los resultados de prevalencia de todos ellos. Los primeros estudios utilizaban una metodología muy dispar. En el estudio de Kelly et al.40, se valoraron 22 pacientes con TCE moderado o grave, con una mediana de 26 meses después de la lesión. No se describía la relevancia clínica de las deficiencias hormonales y la interpretación venía complicada por el hecho que todos los casos con hipopituitarismo habían presentado episodios de hipoxia o hipotensión arterial durante la fase aguda. Lieberman et al.41 reclutaron sus 70 pacientes de un centro de rehabilitación, pero solo los que tenían alteradas las hormonas basales fueron sometidos a pruebas de estimulación hipofisaria. Se estudió la reserva de GH en 48 casos mediante el estímulo con glucagón. Se encontró una respuesta disminuida en 7 casos (14,6%), pero solo en 5 de ellos se confirmó el resultado con la prueba de la L-dopa. En el 45% de los casos, el cortisol basal era inferior a 7 mcg/dl, pero solo en 5 casos no existía respuesta al estímulo con ACTH. Un 51,4% tenían, al menos, un eje alterado y un 17,1% tenían deficiencias múltiples. En un estudio prospectivo en el que se valoraron 102 casos consecutivos no seleccionados que sobrevivieron a la fase aguda, 17 meses después del traumatismo, Agha et al.42 utilizaron una metodología más uniforme. Cada caso fue sometido a 2 pruebas de estimulación y eran catalogados como deficientes para GH y ACTH si ambas pruebas estaban alteradas. El 29% tenía al menos un eje afectado. Un 11% tenía déficit de GH, un 13% ACTH, 12% gonadotrofinas, 1% TSH e hiperprolactinemia en el 13%. Solo en un caso se detectó panhipopituitarismo. Estudios posteriores conformaron estos resultados22,43–45. Es de destacar que, si bien una proporción variable de casos recuperaron la función hipofisaria al final del estudio, también se registró un número de casos no despreciable en los que la insuficiencia hipofisaria aparecía más tardíamente. Resultados parecidos se recogen en los trabajos de Popovic et al.46 y de Klose et al.47. En el primero, se detectó hipopituitarismo en el 34% y déficit múltiple en el 10%. La afectación más frecuente fue GH (15%), seguida de gonadotrofinas con un 9%. Refieren una correlación entre la alteración de la respuesta de GH y la aparición de discapacidades neurocognitivas y la existencia de un estado depresivo. En el segundo estudio, se registra un 16% de los casos con hipopituitarismo y en las conclusiones, los autores remarcan que se trata de una prevalencia menor de la anteriormente descrita y que pudieron existir factores de confusión como la obesidad.
Datos sobre prevalencia de las alteraciones hipofisarias en la fase crónica del traumatismo cranoencefálico
| Autores | N | Evolución (m: mes; a: año) | Estímulo | GH | LH/FSH | ACTH | TSH | Al menos, un eje afectado | Deficiencias múltiples |
| Kelly et al.,40 | 22 | 3m - 23 a | TTITRHGnRH | 6 (26) | 5 (24) | 1 (5) | 1 (5) | 8 (36) | 2 (11) |
| Lieberman et al.41 | 70 | 49±8m | GlucagonL-DOPATRHGnRH | 7/48 (15) | 0 | 5 (7,1) | 15 (22) | 48 (69) | 12(17) |
| Bondanelli et al.43 | 50 | 12-64m | GHRH+Arg | 14 (28) | 7 (14) | 0 | 5 (10) | 14 (28) | 6 (12) |
| Agha et al.42 | 102 | 6-36m | GlucagonGHRH +Arg o TTI o ACTH | 11 (11) | 12 (12) | 13 (13) | 1 (1) | 29 (29) | 6 (6) |
| Popovic et al.46 | 67 | 1-22 a | GHRH+GHRP6 | 10 (15) | 6 (9) | 5 (7) | 3 (4) | 23 (34) | 7 (10) |
| Aimaretti et al.44 | 70 | 1 a | GHRH+Arg | 14 (20) | 8 (11) | 5 (7) | 4 (5) | 16 (23) | 7 (10) |
| Leal-Cerro et al.48 | 170 | 1-5 a | GHRH+GHRP6TTIGlucagon | 10 (6) | 29 (17) | 11 (6) | 10 (6) | 42 (25) | 15 (9) |
| Schneider et al.45 | 78 | 1 a | GHRH+ArgACTH | 7 (10) | 14 (21) | 6 (9) | 2 (3) | 25 (36) | 3 (4) |
| Tanriverdi et al.22 | 52 | 1 a | GHRH+GHRP6ACTH | 17 (38) | 4 (8) | 10 (20) | 3 (6) | 26 (50) | 5 (10) |
| Klose et al.73 | 104 | 10-27m | TTIGHRH+Arg+ACTH | 16 (15) | 2 (2) | 5 (5) | 2 (2) | 16 (15) | 6 (6) |
| Bavisetty et al.49 | 70 | 3 y 9m | GHRH+ArgACTHGnRH | 11(16) | 7 (10) | 0 | 0 | 15 (21) | - |
| Schneider et al.23 | 158 | > 5m | TTIACTHGlucagonGHRH+Arg | 31 (20) | 16 (10) | 27 (17) | 1 | 60 (38) | 11 (7) |
| Kokshoorn et al.9 | 112 | 1-12 a | ACTH y/o CRHGHRH+Arg | 3 (3) | 1 (1) | 2 (2) | 0 | 6 (5) | 0 |
Los resultados entre paréntesis corresponden a porcentajes. Arg: arginina; T. T. I.: test de tolerancia insulínica.
Por el número de pacientes, 170 casos, cabe destacar el trabajo de Leal-Cerro et al.48. Se trata de un estudio a 12 meses, como mínimo, del TCE, con un énfasis especial en la deficiencia de GH. Una cuarta parte de los casos presentaron afectación de, al menos, un eje y tenían afectación combinada en 15 casos (8,8%). Las gonadotrofinas fueron las más afectadas, con 29 casos (17%) y en menor medida, la ACTH con 11 casos (6,4%), la TSH y la GH con 10 casos (5,8%) y diabetes insípida, que solo se registró en 3 casos (1,7%). Una característica remarcable de esta serie es que el hipopituitarismo no había sido sospechado clínicamente con anterioridad y señalan que probablemente existía un déficit subclínico y que la prevalencia también es más baja que las series anteriores, hecho que atribuyen a que el intervalo de tiempo es mayor y que utilizan, sobre todo en el caso de la GH, criterios mucho más estrictos.
Más recientemente, existen 4 estudios remarcables. En el trabajo de Bavisetty et al.49 se estudian 70 casos, 3 y 9 meses después del TCE. Refieren la existencia de cualquier déficit hormonal tributario de tratamiento sustitutivo en el 21%. Se correlaciona con la gravedad de la lesión. El déficit de GH, que se da en el 16% de los casos, se asocia a mayor afectación de la calidad de vida, estado depresivo y a discapacidad. Además, en otro 29% se detectan anormalidades menores que califican de subclínicas y concluyen que la significación clínica de estas debería ser valorada en estudios posteriores. En el estudio de Krahulik et al.30, además de los datos obtenidos en la fase aguda mencionados anteriormente, se analizan los resultados a 3, 6 y 12 meses. El 55% de los casos que tenían alteraciones en la fase aguda se recuperó de sus deficiencias hormonales, otro 8% lo hizo a los 6 meses y 2 pacientes a los 12 meses. Por el contrario, solo en 11 casos se diagnosticó una alteración que no presentaba en la fase aguda. Los ejes más afectados eran el somatotropo y el gonadotropo.
Cabe destacar los resultados del estudio germánico publicado recientemente por Schneider et al.23, que recoge datos de 825 TCE en 14 centros de Alemania y uno en Austria. La prevalencia de cualquier déficit era del 38% si solo se tenían en cuenta los resultados de los estudios basales, T4 libre, cortisol, IGF-I en todos los casos y testosterona en hombres, o del 32% cuando el diagnóstico fue realizado por el equipo médico encargado del caso. No obstante, cuando se emplearon pruebas de estimulación, para el estudio de la GH y la ACTH, que solo se realizaron en 158 casos, el porcentaje de alteración subió al 60%. El estudio fue realizado por lo menos 5 meses después del traumatismo.
Por último, y como exponente de esta enorme disparidad de resultados, Kokshoorn et al.9 han estudiado 112 casos, un 30% con un GCS inferior a 7 y solo han detectado un déficit de gonadotrofinas, 2 insuficiencias suprarrenales y 3 deficiencias de GH. Utilizaron la hipoglucemia insulínica para la valoración de la reserva de GH y ACTH o, si estaba contraindicada, ACTH/CRH o GHRH. Un 80% de los casos fueron sometidos a dichas pruebas de estimulación. Los puntos de corte se ajustaron para índice de masa corporal (IMC)50. Precisamente, los autores explican estos resultados discordantes con las series anteriores por la falta de ajuste para IMC en estas últimas. De hecho, según sus resultados, los 6 casos con afectación hipofisaria tenían un IMC significativamente más elevado que el resto. Las diferencias en la prevalencia pueden explicarse por realizar la valoración en un tiempo de evolución diferente y recomiendan realizar las pruebas un mínimo de 12 meses después del traumatismo.
Hipopituitarismo postraumático en la infancia y adolescenciaLa incidencia de TCE entre los 5 y los 14 años es elevada. En el 75% de los casos, se trata de lesiones no intencionadas, fundamentalmente accidentes de tráfico, caídas y, más en la adolescencia, lesiones deportivas16. Sin embargo, hay que tener en cuenta pequeños traumatismos y algunos casos de malos tratos como causa importante de TCE en los niños menores de un año y que pueden no tenerse en cuenta en el momento de realizar la historia clínica. El primer estudio sistemático en la edad pediátrica fue realizado por Einaudi et al., en 200651, en el que 22 niños fueron estudiados de forma retrospectiva y otros 30 de forma prospectiva, de los cuales el 66% fue reevaluado un año después. Se detectaron respuestas hormonales alteradas en el 16% de los casos retrospectivos y solo en el 8% del estudio prospectivo. El déficit de GH fue el más frecuente. La prevalencia de hipopituitarismo fue más baja que en las poblaciones adultas publicadas. Sin embargo, en otro estudio de 26 niños con un promedio de evolución de 30 meses, Niederland et al.52 describieron una prevalencia de afectación hipofisaria del 61%. El déficit de GH afectaba al 42%. No obstante, no existían diferencias en la talla de los individuos deficientes de GH y los no deficientes. El punto de corte (menos de 7ng/ml) era probablemente demasiado elevado para la L-dopa y, de ese modo, la prevalencia de déficit de GH pudiera estar ampliamente sobredimensionada.
En la revisión de Acerini et al.53, se describen 20 casos seleccionados a partir de una revisión de la literatura de los que el 85% tenían déficit de GH, 75% de TSH, 55% de ACTH, 80% de gonadotrofinas y el 10% tenían diabetes insípida. Los porcentajes de esta serie son difícilmente extrapolables y en esta revisión se citan datos no publicados de una compilación del KIGS en donde solo 141 entre más de 23.000 casos de déficit de GH tenía un TCE como antecedente. Los autores enfatizan la necesidad de estudios prospectivos para valorar esta prevalencia aprentementte baja. Los estudios posteriores ofrecen unos resultados que confirman esta prevalencia más baja que en las series de adultos. En un estudio retrospectivo de 117 TCE graves (GCS inferior a 8)54, en el momento de la valoración, 4 casos ya habían sido previamente diagnosticados. A partir de los resultados de un cuestionario, estudiaron otros 29 casos, de los que 9 tenían afectación hipofisaria, la cual era múltiple en 4 pacientes. En las conclusiones y a pesar de esta prevalencia moderada, los autores recomiendan valorar la función hipofisaria en los traumatismos graves. Más recientemente, se han publicado 2 trabajos con resultados opuestos. Khadr et al.55 realizaron un estudio restrospectivo de 33 casos sin encontrar ningún déficit significativo, aunque se detectaron respuestas subóptimas de GH en 7 casos, así como en 11 casos respecto a la respuesta de cortisol que no requirieron tratamiento sustitutivo. Por último, Moon et al.56, en un estudio de casos y controles, valoran 20 pacientes, 5 años después del TCE. Solo detectaron un déficit de gonadotrofinas que, además, rechazó continuar el estudio. Los autores recomiendan no efectuar estudios sistemáticos de la función hipofisaria en niños con TCE.
Valoración de la función hipofisaria tras traumatismo craneoencefálicoEl TCE puede ser calificado de leve, moderado o grave. La mayoría de estudios incluyen pacientes de los 2 últimos grupos (GCS entre 3 y 13 o evidencia radiológica de lesión cerebral). Precisamente, es mucho más probable que los pacientes con traumatismos graves o moderados continúen presentado una morbilidad mayor que los casos más leves y puedan beneficiarse de una valoración rutinaria para descartar y, en su caso, tratar el hipopituitarismo. La existencia de factores de riesgo, como la lesión axonal difusa, las fracturas de base del cráneo y una mayor edad confieren prioridad en el momento de decidir practicar un estudio hipofisario. Los casos más leves solo deben ser estudiados si existiese evidencia clínica.
En la fase aguda, la insuficiencia suprarrenal no debe pasar desapercibida, ya que puede amenazar la vida del paciente. Según el criterio establecido por Agha et al.35, un cortisol basal menor de 200 nmol/l sugiere déficit de ACTH y está indicado el tratamiento con dosis adecuadas de glucocorticoides. Entre 200 y 400 nmol/L debe realizarse una valoración clínica y tratar si aparece hipotensión arterial, hiponatremia o hipoglucemia. Sin embargo, según la opinión de Kokshoorn et al.57, estos puntos de corte deberían ser modificados a 100 y 500 nmol/l, respectivamente. Las pruebas dinámicas no son útiles en la fase aguda en estos pacientes y se recomienda medir el cortisol basal en los primeros 7 días16. El documento de consenso de la SEEN8 incide también en la necesidad de valorar el eje adrenal y añade la importancia de descartar alteraciones hidroelectrolíticas (diabetes insípida, SIADH y otras situaciones caracterizadas por pérdida salina) y el eje tiroideo. No obstante, la valoración de la función tiroidea no es prioritaria para otros grupos16,35. Hay una práctica unanimidad en no realizar estudios de secreción de GH y gonadotrofinas en la fase aguda, más allá de las concentraciones basales de hormonas hipofisarias y sus hormonas periféricas correspondientes.
En la fase crónica, es necesario el uso de pruebas dinámicas para el estudio de los ejes somatotropo y adrenal. La opinión de varios grupos coincide en que deben valorarse todos los TCE moderados o graves (GCS 3-13) y los TCE leves solo serían tributarios de estudio si existieran signos y síntomas sugestivos de afectación hipofisaria8,10,16,35,44,46–48.
El Consenso de la SEEN8 aconseja valorar la secreción de GH a partir de los 12 meses o antes si hubiera evidencia o sospecha clínica o existieran otros déficits confirmados. Para ello es necesario practicar una prueba que evalúe la reserva hipofisaria de GH, ya que la determinación basal aislada de GH o IGF-I no tiene valor diagnóstico. En los casos en que se consulta por clínica compatible con hipopituitarismo y existe un antecedente de TCE, son obligatorios tanto el estudio hormonal basal como el estudio de la reserva de GH. El Consenso Internacional para el estudio de la deficiencia de GH58 estableció en 2007 que la hipoglucemia insulínica, la prueba de GHRH combinada con arginina o GHRP6 y la estimulación con glucagón son los test validados de estimulación de la secreción de GH en el adulto. Una concentración baja de IGF-I es un indicador de deficiencia de GH en presencia de hipopituitarismo, pero un IGF-I normal no descarta déficit de GH. El Consenso estableció que el TCE es una indicación de utilización de estas pruebas.
Existe controversia en relación a la idoneidad de estas pruebas de estímulo de la secreción de GH. En un estudio de Schneider et al.59 comparan los resultados entre la hipoglucemia insulínica y la prueba de GHRH más arginina en 21 pacientes con TCE. Señalan la existencia de una discrepancia del 61% entre ambos test, de forma que 12 pacientes fueron clasificados como deficientes de GH mediante GHRH más ariginina, cuando tenían una respuesta normal con la hipoglucemia insulínica. Atribuyen, en parte esta discrepancia al IMC, ya que en todos estos casos era mayor de 28. Cuando se ajustaron los puntos de corte (4,2, 8,0 y 11,5ng/ml para obesos, sobrepeso y normopeso, respectivamente) la discrepancia disminuyó al 14,3% con solo 3 pacientes con test discordantes.
Desde hace más de una década, se sabe que la prueba de GHRH más arginina o GHRP6 es segura y fiable como alternativa a la hipoglucemia insulínica60–62. No obstante, aunque se ha sugerido un punto de corte en los 9ng/ml, los resultados de Schneider et al., demuestran que debe tenerse en cuenta el IMC, de la misma manera que ocurre en individuos sanos63,64. Todo ello puede provocar que una considerable proporción de sujetos obesos se clasifiquen como deficientes de GH utilizando el punto de corte clásico de la prueba de GHRH más arginina, aunque presenten una respuesta normal a la hipoglucemia insulínica. Así pues, si se utiliza este punto de corte en sujetos obesos, una gran cantidad recibirá tratamiento con GH de forma injustificada. Como que la mayoría de pacientes ganan peso después de un TCE, es importante tener en cuenta los posibles efectos de la obesidad en el momento de valorar su función hipofisaria.
La hipoglucemia insulínica valora la integridad de las funciones hipotalámica e hipofisaria contrariamente a otras pruebas y se ha considerado como la referencia para el estudio de GH y ACTH. Sin embargo, no puede ser practicada en casos de enfermedad cardiovascular grave o en caso de crisis comiciales no controladas y esto consituye una limitación importante en individuos con TCE. Algunos autores la han utilizado sin efectos adversos10,42 pero otros han utilizado test alternativos. Se han utilizado diferentes puntos de corte y diferentes métodos analíticos que pueden ser importantes en el momento de definir el déficit hormonal. Además, algunos autores utilizan 2 pruebas para confirmar anormalidades mientras que otros utilizan un solo test. De este modo, la fortaleza de los métodos diagnósticos varía entre los diferentes estudios.
El problema es establecer si el hipopituitarismo postraumático, especialmente el déficit de GH, ha sido sobreestimado en los estudios transversales. Se ha documentado57 que su prevalencia es mayor si se utiliza la prueba del glucagón o GHRH-GHRP6 comparados con GHRH más arginina o la hipoglucemia insulínica. Además, los estudios que utilizan 2 pruebas de estimulación dan unas prevalencias más bajas que los que solo utilizan una de ellas. Aparte del problema del sobrepeso y la obesidad que hace que un mayor número de casos sean diagnosticados de deficiencia de GH, otro aspecto importante es que muchos pacientes presentan un solo déficit y es posible que una sola prueba de estimulación sea insuficiente para una correcta fiabilidad del resultado. La aplicación de un segundo test sería muy útil si el resultado se confirma pero añadiría más confusión si los resultados son discordantes.
Existen problemas similares para el estudio del eje adrenal, donde según el test empleado, se ha publicado una prevalencia de insuficiencia suprarrenal entre el 5 y el 19%57. La utilización del cortisol basal es útil si el valor es inferior a 100 nmol/L o superior a 500 nmol/L. En los casos graves, el uso del test de la ACTH ha demostrado su eficacia65,66, pero los resultados pueden no ser completamente fiables en insuficiencia suprarrenal leve67. La hipoglucemia insulínica es todavía el test de referencia y tiene la ventaja de que valora simultáneamente las reservas de GH y ACTH. Existen variaciones sobre los resultados dependiendo del test utilizado.
El diagnóstico del hipotiroidismo central se basa en las concentraciones de T4 libre, cuyos valores presentan una gran variabilidad interindividual68. Por tanto, es difícil establecer un punto de corte ya que un determinado valor de T4 libre puede indicar hipotiroidismo en un paciente y no en otro. La TSH basal tiene una utilidad limitada en el diagnóstico del hipotiroidismo central ya que pueden detectarse valores normales o incluso elevados de TSH69. La respuesta de TSH frente al estímulo de TRH tiene limitaciones ya que los pacientes con hipotiroidismo central pueden tener diferentes patrones de respuesta a TRH, ya sean ausentes o aumentadas que se solapan con los resultados obtenidos en individuos sanos. La respuesta de la TSH depende de la dosis de TRH y es más elevada en mujeres mientras que declina con la edad70.
Con respecto a la valoración del eje gonadal, la determinación de la concentración basal de FSH y LH puede ser suficiente en hombres y mujeres posmenopáusicas. Para premenopáusicas, es preciso valorar el momento del ciclo menstrual. La elección del tiempo de evolución para estudiar la función gonadal es también importante. Antes de los 6 meses, los resultados obtenidos pueden ser transitorios71 y pueden considerarse definitivos en la mayoría de los casos si de detectan a partir de los 12 meses57.
En resumen, debido a la alta incidencia de TCE en la población general y la incidencia de hipopituitarismo en este conjunto de pacientes, en la línea de lo establecido en el Documento de Consenso de la SEEN, sería recomendable incluir sistemáticamente en la anamnesis de las historias clínicas si ha habido antecedentes de TCE que justifiquen la realización de un perfil hormonal que incluya FSH/LH, testosterona, ACTH, cortisol plasmático, TSH, T4 libre, prolactina e IGF-I. Si existiesen alteraciones hormonales o evidencia clínica, es imperativo valorar la secreción de GH y el eje adrenal. La hipoglucemia insulínica sigue siendo la prueba de referencia aunque en un apreciable volumen de enfermos no podrá realizarse al existir contraindicaciones. En estos casos puede utilizarse el test de estimulación con ACTH y la prueba GHRH combinada con arginina o GHRP6, aunque es posible que no esté disponible en un buen número de centros. En este caso, la estimulación con glucagón es una opción perfectamente válida, que permitirá también valorar ambas ejes hormonales.
Factores predictoresCon la intención de identificar los pacientes con TCE que con mayor probabilidad vayan a presentar un hipopituitarismo, se ha intentado averiguar si existen factores predictores. En el trabajo pionero de Benvenga et al.7, la mayoría de los pacientes con afectación hipofisaria habían presentado un accidente de tráfico, tenían fracturas craneales, se correlacionaba con la existencia de coma y la duración del mismo y tenían lesiones hemorrágicas en la zona hipotalamo-hipofisaria.
La escala de GCS25 es la más utilizada para valorar la gravedad de la lesión cerebral en la práctica clínica. Valora la apertura de los ojos y las respuestas verbales y motoras en una escala de 3 a 15. Los TCE se dividen en graves, moderados o leves según la GCS sea 3-8, 9-13 o 14-15, respectivamente. En algunos estudios no se ha descrito ninguna relación22,42,44–46,72 mientras que en otros el hipopituitarismo es más frecuente cuanto más grave sea el TCE30,43,73. En la revisión de Schneider et al.10, también se describe una correlación entre la aparición de hipopituitarismo en la fase crónica y la gravedad del TCE según la GCS. En el registro germánico23 no se detectan relaciones entre la existencia de déficits hormonales y el IMC, GCS, Glasgow Outcome Score o la escala de Hunt y Hess, pero sí con la edad que era menor cuanto más ejes estaban afectados. Si solo se analizaba el conjunto de casos en los que se utilizaron pruebas de estimulación de GH y ACTH, entonces sí había relación con la gravedad según el GCS. La presencia de diabetes insípida en la fase aguda no se correlaciona con la alteración adenohipofisaria, pero sí con la gravedad del coma y el edema cerebral37.
Algunos estudios han encontrado relación entre los hallazgos radiológicos y el hipopituitarismo. Así, se ha visto que el edema cerebral puede ser un factor predictor40,49,74 y otros han observado un aumento de la existencia de silla turca vacía30.
La presencia de lesión axonal difusa, como tipo de lesión también se ha relacionado con hipopituitarismo en algunas series45. Los mismos autores también han encontrado un aumento de la incidencia de fracturas de la base del cráneo de igual forma que en la serie de Bondanelli et al.43. Por último, la presencia de una presión intracraneal aumentada también ha sido descrita como predictora de hipopituitarismo73.
TratamientoEl tratamiento sustitutivo del hipopituitarismo en los pacientes que han sufrido un TCE forma parte del conjunto de medidas terapéuticas de cada caso en particular. Este tratamiento revierte los síntomas y normaliza los factores de riesgo asociados con las deficiencias hormonales. En el TCE, no obstante, la lesión cerebral puede ser sutil y muchas veces solo existen alteraciones hipofisarias subclínicas. Además, estos pacientes sufren a menudo otras secuelas múltiples del traumatismo, como estados depresivos, alteraciones neuropsicológicas o cambios de personalidad. Así pues, no está claro si pueden beneficiarse de tratamiento sustitutivo en la misma medida que lo hacen los sujetos con causas más clásicas de hipopituitarismo.
Fase agudaA causa de las consecuencias potencialmente graves de la alteración de los ejes adrenal y tiroideo o de la neurohipófisis, es importante tratar adecuadamente estos enfermos si existe una evidencia clínica y bioquímica claras. El déficit de gonadotrofinas es a menudo transitorio en la fase aguda10 por lo que no se ha establecido indicación alguna para sustituir con esteroides sexuales.
El tratamiento con desmopresina está justificado en cualquier caso que presente diabetes insípida, es decir, poliuria con osmolalidad urinaria disminuida y osmolalidad plasmática elevada. La sustitución con glucocorticoides carece de criterios bien definidos en esta etapa. A pesar de los resultados negativos del estudio CRASH, único estudio que, con más de 10.000 pacientes con TCE, sugería que el que el grupo tratado con glucocorticoides presentaba una mortalidad de más del doble que el grupo que no los recibió75, parece razonable, tal como establece el Consenso de la SEEN8, tratar a los pacientes con déficit importante de cortisol (inferior a 100 nmol/l) con dosis altas de hidrocortisona, del orden de 50mg cada 6 horas, como mínimo. En los casos en que el cortisol se sitúe entre los 100 y los 200 nmol/l, puede utilizarse la dosis sustitutiva de 25mg al día, aproximadamente. Entre 200 y 500 nmol/l, la mayoría de autores recomiendan tratar si existe hipotensión, hiponatremia o hipoglucemia.
El tratamiento del hipotiroidismo central se justifica, en la fase aguda, si la T4 libre fuera inferior a 0,7ng/ml, en 2 ocasiones separadas al menos por 48 horas.
No está justificado el tratamiento con GH en esta fase, en ningún caso.
Fase crónicaLas deficiencias hormonales que persistan en la fase crónica, deben ser consideradas de igual forma que en otras causas de hipopituitarismo, o sea cuando las concentraciones de la hormona periférica y la hormona hipofisaria estén por debajo del valor normal. En la fase intermedia, entre los 3 y los 6 meses, solo deberían ser tratados aquellos déficits que tengan trascendencia clínica.
El caso de la deficiencia de GH merece una atención especial. El tratamiento con GH está indicado con adultos con deficiencia grave de GH y sus efectos beneficiosos están bien documentados76. Por tanto, en los adultos tras un TCE con déficit persistente de GH tanto clínico como bioquímico asociado a otras deficiencias hipofisarias, debe considerarse iniciar un tratamiento con GH, aunque siempre a partir de los 12 meses de evolución.
Existen estudios preliminares con pocos casos en los que se ha observado un efecto beneficioso de la GH en individuos que han sufrido un TCE y que presentan una deficiencia de GH, en relación con aspectos neurocognitivos y psiquiàtricos77–79. Por otra parte, Tanriverdi et al.80han descrito 2 casos de boxeadores retirados con déficit de GH y que han presentado mejoría sustancial en relación con el perfil lipídico, la calidad de vida y la composición corporal. Sin embargo, se necesitan estudios más amplios para valorar el beneficio del tratamiento con GH en relación a la rehabilitación, recuperación funcional, composición corporal y función neuropsiquiátrica de estos pacientes.
Dada la probabilidad de recuperación de la función hipofisaria en un numero sustancial de pacientes, es necesario reevaluar periódicamente a los pacientes con hipopituitarismo tras TCE.
ConclusionesLa elevada incidencia del TCE en la población general hace que deba considerarse como un problema importante de salud. Los pacientes que han sufrido un TCE, además de una mortalidad considerable, presentarán grados elevados de discapacidad física y psicológica, que requerirá de un largo y costoso proceso de rehabilitación. Desde hace casi un siglo, se ha relacionado el TCE con la aparición de alteraciones hipotálamo-hipofisarias que configurar el llamado hipopituitarismo postraumatismo craneoencefálico. En la última década, se ha publicado un número considerable de trabajos en los que se describen prevalencias muy variables de deficiencias hormonales hipofisarias. Estas variaciones se deben en gran parte al uso de una metodología dispar, que hace que el hipopituitarismo tras TCE pueda haber sido sobreestimado. Sin embargo, existe un número apreciable de casos con una verdadera afectación de la secreción hormonal de la hipófisis, lo cual aumenta la importancia de que se adopten métodos estandarizados de estudio para poder obtener resultados válidos acerca del impacto del TCE sobre la función hipofisaria. De este modo, podrán evaluarse los resultados del tratamiento hormonal sustitutivo en este grupo de pacientes y de los efectos beneficiosos que puede proporcionar en relación con la rehabilitación y recuperación funcional de los mismos.
FinanciaciónEl autor ha sido beneficiario de una ayuda económica por parte de Pfizer Inc, para el estudio de un grupo de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.