La diabetes mellitus es una enfermedad metabólica que afecta a algo más de 300 millones de individuos en el mundo. Entre sus complicaciones, la neuropatía es frecuente y puede afectar nervios sensitivos, motores y autonómicos. Su fisiopatología no está totalmente esclarecida, se han propuesto varias hipótesis y el papel de la mitocondria ocupa un lugar importante. En este artículo, se revisan los mecanismos implicados en la disfunción mitocondrial y el desarrollo de la neuropatía diabética, que involucran principalmente el estrés oxidativo e inflamatorio, las alteraciones de la regulación del calcio intracelular, los procesos de apoptosis, y los cambios en la estructura y función de dicha organela que pueden llevar a la producción de neuropatía diabética.
Diabetes is a metabolic disease affecting approximately 300 million people worldwide. Neuropathy is one of its frequent complications, and may affect sensory, motor, and autonomic nerves. Its pathophysiology has not fully been elucidated. Several hypotheses have been proposed, and mitochondria have been suggested to play a significant role. This article reviews the mechanisms involved in mitochondrial dysfunction and development of diabetic neuropathy, consisting mainly of oxidative and inflammatory stress, changes in intracellular calcium regulation, apoptotic processes, and changes in mitochondrial structure and function that may lead to development of diabetic neuropathy.
La diabetes mellitus es una enfermedad caracterizada por hiperglucemia con déficit de insulina o resistencia a la misma. La hiperglucemia crónica afecta principalmente a la retina, el riñón, el nervio periférico y el sistema cardiovascular. En la neuropatía se afectan los nervios sensitivos, motores y autonómicos, tanto en sus porciones proximales como distales. Se puede manifestar con dolor de tipo neuropático, caracterizado por sensaciones parestésicas y de descarga eléctrica, hormigueos, dolor quemante, y lancinante de predominio distal y simétrico, acompañado de alodinia térmica y mecánica; también puede producir alteraciones del tracto digestivo como gastroparesia y seudo-obstrucción intestinal, disfunción eréctil, arritmia cardiaca de predominio auricular; también puede originar úlceras de origen neuropático en los pies que son causa de amputación1.
Se estima que la prevalencia de la diabetes en la población mundial es de 300 millones de individuos2. Actualmente, en los Estados Unidos el 6,2% de la población tiene diabetes3 y cerca del 50% presenta algún tipo de neuropatía. El riesgo de desarrollar neuropatía sintomática en el grupo de pacientes diabéticos es aproximadamente del 4 al 10% a los 5 años del diagnóstico y mayor del 15% a los 20 años4.
Los mecanismos que conducen a la neuropatía diabética no están aún bien definidos; se propone que son consecuencia de la hiperglucemia o de la pérdida de la regulación dependiente de la insulina. Se han planteado diferentes mecanismos fisiopatológicos. Uno de ellos es el que implica a la vía de los polioles, en la que el incremento en la glucosa lleva a un aumento en la actividad de la enzima aldosa reductasa y con ello a la producción de polioles que ocasionan disminución de la actividad de la bomba sodio/potasio (Na/K) y una depleción de los equivalentes reductores como el NADPH (dinucleótido de nicotinamida adenina fosfato, reducido) con un descenso secundario de la producción de glutatión y, por consiguiente, inducción de estrés oxidativo intracelular5. Otro potencial mecanismo implica a la glucosilación de las proteínas que ocasiona un funcionamiento anormal en el nervio y la activación de los receptores de productos de glucosilación final avanzada (AGE), que se relacionan con la expresión de mediadores inflamatorios6. También se ha implicado la existencia de una reducción de factores neurotróficos y de hormonas circulantes, como el factor de crecimiento nervioso (NGF) y la neurotrofina-3 (NT-3), encargados de mantener el fenotipo normal de las neuronas sensitivas7. Además, se ha planteado que la disfunción mitocondrial puede ser un mediador central en la neuropatía diabética. La mitocondria, organela encargada de la fosforilación oxidativa, cuyo fin es la producción de adenosina trifosfato (ATP), está implicada en diferentes vías para la generación de la neuropatía periférica, principalmente, en relación con su papel en los axones de mayor longitud y de tipo sensitivo8. El objetivo de este artículo es revisar estos mecanismos, discutir y comprender cómo influyen en el desarrollo de la neuropatía, cómo interactúan y sus posibles implicaciones terapéuticas.
Estructura y función mitocondrialLa mitocondria es una organela celular que, al parecer, se originó de una relación simbiótica entre una bacteria y una célula eucariota hace aproximadamente mil millones de años9. Miden entre 0,5 y 10 micras, y su ubicación en los distintos grupos celulares varía según las necesidades energéticas, teniendo gran importancia en músculo, cerebro y nervio10. Está conformada por la membrana mitocondrial externa (permeable a moléculas pequeñas), el espacio intermembranal, la membrana mitocondrial interna (que solo es permeable a iones específicos), las crestas y la matriz mitocondrial, en la que se encuentran iones, metabolitos y el ácido desoxiribonucleico (ADN) mitocondrial.
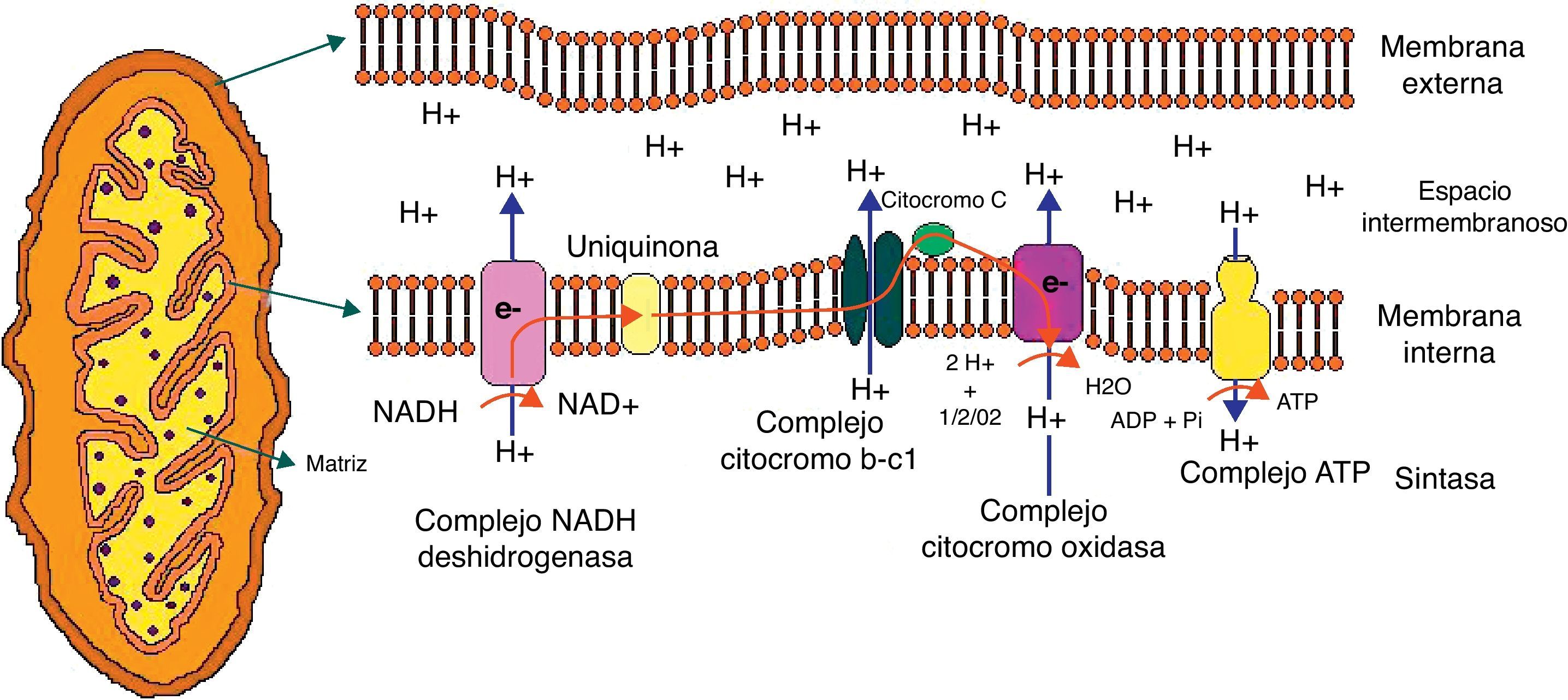
La mitocondria es altamente eficiente en la utilización del oxígeno y de los sustratos principalmente derivados de la glucosa, para producir energía celular en forma de ATP; de esta manera, los electrones provenientes de los sustratos oxidados son transferidos al oxígeno, por una serie de reacciones de reducción para generar agua11. En este proceso, los protones son bombeados desde la matriz mitocondrial para cruzar la membrana mitocondrial interna por medio de los complejos respiratorios que componen la cadena de la fosforilación oxidativa (fig. 1).
Representación gráfica de la mitocondria y de la transferencia de protones a través de la membrana mitocondrial por los componentes de la cadena de fosforilación oxidativa.
Abreviaturas utilizadas en la figura:
ATP: adenosin trifosfato; ADP: adenosin difosfato; e: electrones; H: hidrogeno; H2O: agua; NAD: nicotinamida adenín dinucleótido; NADH: nicotinamida adenín dinucleótido reducida; Pi; fosfato; O2; oxígeno.
La cadena respiratoria está compuesta por 5 complejos enzimáticos multipolipeptídicos que comprenden el sistema de fosforilación oxidativa: el complejo i (NADH ubiquinona reductasa); el complejo ii (FADH2 succinato ubiquinona reductasa); el complejo iii (ubiquinol citocromo C reductasa); el complejo iv (citocromoC oxidasa y 2 transportadores de electrones móviles ubiquinona y citocromo C) y, finalmente, el complejo v (ATP sintasa). Los electrones generados desde los equivalentes reductores (NADH y FADH2) pasan entre los complejos y generan un aumento de energía que permite el bombeo de protones a los complejos i, iii y iv; al final, la generación del gradiente de protones en la membrana mitocondrial interna es usada para la generación de ATP12.
Aunque la gran mayoría de las proteínas mitocondriales (cerca de 900) son originadas por el genoma nuclear e importadas a la mitocondria, existe, sin embargo, en esta organela un genoma que es esencial para la función respiratoria. El ADN mitocondrial que tiene un tamaño de 16 kilobases, es circular y contiene 37 genes; 13 de estos genes codifican para las subunidades proteicas de los complejos respiratorios i, iii, iv y v. Solamente el complejo ii está compuesto por proteínas codificadas por genes nucleares13.
Las funciones de la mitocondria varían en un espectro que relaciona la vida y la muerte celular. Entre ellas se destacan la producción de especies reactivas de oxígeno (EOR), la apertura del poro de permeabilidad de transición (PT), la respiración celular, la síntesis de ATP y la producción de proteínas involucradas en la apoptosis, como el factor inductor de apoptosis (AIF)14. Además, la mitocondria secuestra calcio citoplasmático y regula las implicaciones de este catión en el funcionamiento celular, de manera que mantiene la homeostasis de calcio al regular el secuestro directo de calcio.
La mitocondria realiza procesos de fusión y de fisión. El primero de ellos consiste en la unión de las membranas externas e interna con la matriz mitocondrial para producir una mitocondria más grande. En dicho proceso participan unas proteínas llamadas mitofusinas que son GTPasas localizadas en la membrana externa y los genes que codifican para ellas son Mfn1 y Mfn215. El proceso opuesto a la fusión, la fisión mitocondrial, depende de la proteína relacionada con dinamina (Drp1); en este proceso se crean pequeñas mitocondrias múltiples. El balance entre la fusión y la fisión mitocondrial es regulado en respuesta a diferentes estímulos; así, el aumento del calcio intracelular incrementa la fisión; por su parte, una disminución en el movimiento mitocondrial resulta en una disminución secundaria de la fusión mitocondrial16.
Las regiones sinápticas del axón tienen abundante número de mitocondrias, lo que refleja la intensidad en la demanda de ATP para realizar procesos tales como la fusión y reciclaje de las vesículas dependientes de ATP, así como las bombas ATPasas que controlan el ambiente iónico de la membrana sináptica. Por ello, las mitocondrias se ubican principalmente en zonas de alta demanda energética como los dominios pre y postsinápticos, el segmento inicial del axón para la generación del potencial de acción, los nodos de Ranvier, los conos de crecimiento y las terminaciones nerviosas libres. Las localizaciones descritas para la mitocondria están a menudo a distancia del sitio de biogénesis en el soma de la neurona17; así, para proveer de ATP y del buffer del calcio en las zonas requeridas existen mecanismos de transporte mitocondrial. Por otra parte, las mitocondrias dañadas deben ser llevadas en forma retrógrada al cuerpo celular para su reparación o degradación.
La mitocondria tiene procesos para transporte bidireccional, detención, inicio y cambio de dirección; dicho transporte, cuando ocurre a largas distancias es dependiente de ATP por vía de proteínas motoras que se desplazan a lo largo de los microtúbulos, mientras que el citoesqueleto de actina y los neurofilamentos son más importantes para el anclaje y para movimientos de corta distancia de las mitocondrias18. El transporte anterógrado es mediado por miembros de la superfamilia de kinesina (KIF)19. Por otra parte, el transporte retrógrado de la mitocondria es mediado por la proteína dineína y proteínas accesorias de cadena ligera, entre ellas la dinactina.
Mitocondria y neuropatía diabéticaComo se mencionó previamente, la prevalencia de neuropatía en pacientes diabéticos puede llegar hasta un 50%4,20. Se han descrito varias alteraciones en el nervio periférico que incluyen microangiopatía endoneural, degeneración axónica, pérdida de las células de Schwann, desmielinización paranodal y pérdida de fibras mielínicas y amielínicas21–24.
La mitocondria ha sido relacionada con la fisiopatología de la neuropatía diabética8. En estudios en ratas diabéticas se encuentran cambios estructurales en las mitocondrias, alteración en el número de neurofilamentos y edema en las terminales axónicas de nervios del sistema nervioso periférico y autónomo25. Además, se han descrito alteraciones en la función de esta organela en relación con el estrés oxidativo, con la disfunción en la homeostasis intracelular del calcio, con mecanismos implicados en la apoptosis y con anomalías en el transporte axónico.
Estructura mitocondrial y diabetes mellitusHay estudios que evidencian cambios en las mitocondrias de las células de Schwann 26,27. En uno de ellos, en el nervio ciático y el nervio sural de ratas alimentadas con dietas altamente ricas en galactosa se describieron mitocondrias aumentadas de tamaño, con disrupción de las crestas o completa ausencia de las mismas27; asimismo, en los nervios periféricos se demostró acumulación de glucógeno en la membrana externa de las mitocondrias.
Las anomalías ultraestructurales de la mitocondria son una parte importante en la neuropatología autonómica simpática en humanos y en una variedad de modelos en ratones28; estas involucran incrementos en el número de las mitocondrias y vacuolas autofágicas, mezcladas con vesículas sinápticas en los ganglios simpáticos tanto en diabetes tipo 1 como en tipo 229,30.
Mitocondria, estrés oxidativo y diabetes mellitusLas especies reactivas de oxígeno (EOR) son generadas por las mitocondrias como productos normales de los procesos de oxidación, y son eliminadas eficazmente por sistemas intrínsecos antioxidantes; estos compuestos, al acumularse, se relacionan con incremento del estrés oxidativo y con alteración en el funcionamiento mitocondrial. Asimismo, se han visto involucradas como intermediarias de los procesos apoptóticos en la lesión del DNA mitocondrial y en neurodegeneración. Actualmente se postula esta vía como un mecanismo patogénico de la neuropatía diabética sensitiva31,32.
Todos los componentes del sistema nervioso periférico (nervios sensitivos, motores y autonómicos) se afectan en la diabetes, pero la neurodegeneración es más prominente en los axones de mayor longitud de las neuronas sensitivas, en las que el estrés oxidativo se considera un proceso patológico clave que ocasiona daño al nervio33,34.
En células endoteliales aórticas cultivadas se ha mostrado que las altas concentraciones intracelulares de glucosa generan un aumento en la entrega de electrones a la cadena de transportadores en la mitocondria, lo que ocasiona una hiperpolarizacion mitocondrial que conduce a la producción de especies reactivas de oxígeno8. Este proceso dependiente de la mitocondria se propone como un mediador de las complicaciones por estrés oxidativo de la diabetes. El mecanismo que lo explica radica en que las altas concentraciones de glucosa incrementan el NADH en la mitocondria y este incremento en la disponibilidad de electrones o saturación, causa la reducción del oxígeno a radicales superóxido en la parte proximal de la cadena de electrones; estos se asocian con cambios degenerativos en la estructura mitocondrial35. Sin embargo, otros estudios muestran, en ratas diabéticas, que en las neuronas del ganglio de la raíz dorsal (GDR) y en sus axones, la membrana mitocondrial interna se despolariza y no se hiperpolariza3. Por ello, se ha considerado que en la diabetes hay un cambio del potencial de la membrana mitocondrial interna en poblaciones de neuronas sensitivas, lo que tiene como consecuencia la alteración en las vías metabólicas y en la cadena de transporte de electrones, probablemente, causado por déficit de los factores neurotróficos.
El tratamiento con insulina o con NT-3 aumenta la entrega de equivalentes reductores a la cadena de transporte de electrones, con una mejoría en la disminución del potencial de membrana al hacerlo menos negativo y con un aumento adicional en la síntesis de ATP36. Los mecanismos por los cuales la insulina y el NT3 causan una estabilidad en el potencial de membrana mitocondrial incluyen la vía fosfoinositol 3 Kinasa (PI3 Kinasa). Esta vía lleva a la activación de factores como la protein qinasa B y el factor de transcripción de AMPc de respuesta a la unión de elementos proteicos (CREB) que regulan la expresión génica de factores de las vías metabólicas y de la cadena de electrones asociada con la mitocondria neuronal.
En animales y en humanos, la disfunción vascular juega un papel esencial en la patogenia de la neuropatía diabética32. Este factor relacionado con la microangiopatía en el nervio incluye la alteración en el flujo sanguíneo y la hipoxia endoneural. De igual forma, existen cambios estructurales en la microvasculatura nerviosa que ayudan a reducir la perfusión endoneural; estos incluyen engrosamiento de la membrana basal, la degeneración de los pericitos, la hiperplasia de las células endoteliales, la presencia de comunicaciones arterio-venosas anómalas y la vulnerabilidad endotelial vascular32. Se ha aceptado que el estrés oxidativo produce el daño en la neuropatía diabética y se asocia con un papel central en la microangiopatía en el nervio. Estos hallazgos evidencian probablemente la existencia de un punto común en el que la disfunción mitocondrial y el subsiguiente estrés oxidativo pueden conducir y potenciar los cambios vasculares, para generar el daño vascular responsable de la microangiopatía de la diabetes: retinopatía, nefropatía y neuropatía35.
El estrés oxidativo está demostrado en neuronas sensitivas y en el nervio periférico por un incremento en la producción de EOR35,37–39, la peroxidacion lipídica38 y la nitrosilación proteica40,41. El resultado es la disfunción energética en el nervio con disminución de los intermediarios altamente energéticos, alteración del transporte axónico de proteínas y pobre funcionamiento de las bombas iónicas42. Las EOR producidas pueden dañar la mitocondria y su DNA. El acúmulo de estos daños en el nervio producen una reducción de su función y estos cambios en la dinámica mitocondrial se relacionan con disminución en la cantidad en los axones y acumulación en los somas de las neuronas del GRD.
En conclusión, el estrés oxidativo se asocia con un aumento en la producción de EOR, que secundariamente conduce a la disfunción mitocondrial, procesos que están probablemente implicados en el desarrollo de la neuropatía diabética. Los cambios secundarios en el nervio incluyen reducción de los intermediarios de energía, procesos de peroxidación lipídica y disminución en la cantidad de mitocondrias, entre otros. Asimismo, la hiperglucemia y el estrés oxidativo se han relacionado con cambios en el valor del potencial de membrana mitocondrial en neuronas del ganglio de la raíz dorsal, que mejora tras la administración de insulina y factores neurotróficos. Por otra parte, existe una vía común que añade el estrés oxidativo con la microangiopatía para incrementar la lesión en el nervio, de manera que no ocurre un proceso causal único sino que la sumación y potenciación de estos explica la patogenia.
Mitocondria, calcio y diabetes mellitusComo se mencionó previamente, la mitocondria ejerce diversas funciones para mantener la homeostasis intracelular, entre ellas la regulación del calcio. Existen sensores de calcio para el transporte del mismo como respuesta fisiológica. Las concentraciones de calcio libre en la célula varían desde 50 a 100nM en el citosol y aproximadamente 0,5 a 1mM en el lúmen del retículo endoplásmico, de manera que cualquier cambio que conduzca a una elevación de estos niveles en el citosol puede tener consecuencias patológicas, incluso la muerte celular42,43. Por esta razón, la disfunción mitocondrial se asocia con alteraciones en la homeostasis del calcio y se ha establecido un papel principal de estos cambios en la fisiopatología de la neuropatía diabética44,45.
En neuronas del ganglio de la raíz dorsal, así como en músculo liso, células secretoras, y osteoblastos de ratones en estudios experimentales de diabetes por estreptozotocina (STZ) y en pacientes diabéticos, se han observado anomalías en el balance del calcio intracelular3. Estos cambios se caracterizan por incremento en la concentración intracelular de calcio, disminución en la actividad de los transportadores de dicho catión y disminución de las señales evocadas por calcio.
En las neuronas de las ratas diabéticas por SZT, se ha observado que puede ocurrir un aumento en la concentración intramitocondrial de calcio por alteración en los transportadores. Este cambio en la homeostasis del calcio puede estimular una mayor producción de EOR en el interior de la mitocondria y, secundariamente, la generación de estrés oxidativo. La causa de este fenómeno se relaciona con el aumento del ciclo del ácido tricarboxílico y la fosforilación oxidativa ocasionado por el aumento del calcio intracelular, lo que hace más rápido el trabajo mitocondrial y consume más oxígeno, con un aumento concomitante de EOR46–49.
En estudios in vivo e in vitro se ha mostrado que el factor crítico de la disfunción mitocondrial no es la hiperglucemia sino el déficit de insulina y de los factores neurotróficos, que son responsables de mantener el potencial de membrana mitocondrial y de incrementar la síntesis de ATP50. En las circunstancias anteriores, la terapia con insulina y los factores neurotróficos normalizaron la polaridad de la membrana mitocondrial y los niveles de calcio intracelular36.
Un incremento en la concentración intracelular de calcio puede causar una despolarización mitocondrial completa o parcial de la membrana interna. Esta despolarización es prolongada en las neuronas del GRD de ratas con diabetes y puede ser bloqueada con carbonilcianida-m-clorofenilhidrazona (CCCP), un agente que promueve la unión del calcio a la mitocondria. Esto muestra la importancia de la función de tamponamiento que realiza la mitocondria con el calcio en las neuronas diabéticas51.
Por otra parte, la caída de los niveles de ATP en las mitocondrias disfuncionales puede llevar a menor actividad de las bombas de Na/K ATPasa, lo que resulta en un aumento en el calcio intracelular y en una inversión del intercambiador Na/Ca, con un incremento secundario en el calcio intracelular que no es secuestrado por la mitocondria, lo que es deletéreo y lleva finalmente a degeneración axónica.
En conclusión, la alteración en la homeostasis del calcio por disfunción mitocondrial es un factor relacionado con la neuropatía diabética, con hallazgos que demuestran en neuronas del GRD en ratas y en pacientes diabéticos, incremento en las concentraciones intracelulares y un balance desequilibrado del transporte del mismo. Esta condición se asocia con despolarización mitocondrial, disfunción de las bombas iónicas y generación de EOR; algunas de estas condiciones relacionadas con la regulación del calcio pueden mejorar con la terapia insulínica.
Mitocondria, apoptosis y diabetes mellitusLa mitocondria tiene un papel preponderante en la apoptosis, una de las vías de muerte celular programada. Esta organela se encuentra implicada en este proceso al promover la traslocación de citocromo C (proapoptótico) al citosol y, secundariamente, puede inducir la apoptosis; por otra parte, también se encuentran proteínas antiapoptóticas en la mitocondria, de manera que existe una regulación entre la vida y la muerte mediada por ella. La activación de la apoptosis se asocia con la neuropatía diabética sensitiva por una disfunción mitocondrial concomitante52.
Estudios en cultivos de neuronas sensitivas embrionarias de ratas demuestran que con un incremento de las concentraciones de glucosa (45mM) se causa una despolarización crónica mitocondrial con depleción de ATP, seguida de apoptosis como resultado de la disfunción mitocondrial y de la activación secundaria de las caspasas 3 y 9. En este mismo estudio, el aumento de la glucosa en las neuronas se asoció con mayor producción local de EOR, como hallazgo previo a la inducción de la apoptosis53.
En modelos de ratones con diabetes tipo 1 hay pérdida de neuronas no mielínicas, pero no hay información que apoye la presencia de apoptosis o mitocondrias anormales54; sin embargo, en otros estudios de neuronas en ratas diabéticas se demostró una alteración en la morfología y en el crecimiento axónico por los niveles de glucosa elevados, que asociados a los procesos de estrés oxidativo resultan en degeneración axónica pero no en muerte celular55. Estos resultados plantean la posibilidad de la existencia de mecanismos diferentes de respuesta ante la hiperglucemia en el axón comparado al cuerpo neuronal y de la misma manera a las mitocondrias encontradas en cada uno de estos sitios; ello puede explicar las diferencias en los resultados de los estudios.
La pérdida de factores como AKT (también denominada PKB/Akt, serina/treonina kinasa) en la diabetes induce la translocación de factores proapoptóticos hacia la membrana mitocondrial externa y es importante en la neurodegeneración en neuronas embrionarias y maduras en las que se involucra la despolarización mitocondrial como un proceso que precede a la apoptosis56.
Estudios en ratas con diabetes inducida por STZ muestran disminución en las velocidades de conducción del nervio periférico, comparadas con sus controles, y evidencian mayor apoptosis en las neuronas del GRD de las diabéticas. Asimismo, el potencial de membrana mitocondrial fue más positivo en estas ratas que en los controles, y la restauración a la euglucemia en 2 semanas disminuyó la apoptosis y normalizó el potencial de la membrana mitocondrial57. En este mismo estudio, los niveles de las proteínas antiapoptóticas Bcl2 (aisladas de células de linfoma B2) disminuyeron en las neuronas sensitivas de las ratas diabéticas y hubo translocación del citocromo C desde la membrana al citoplasma con inducción de apoptosis.
En conclusión, existen estudios que han permitido relacionar la apoptosis y la disfunción mitocondrial con el desarrollo y la fisiopatología de la neuropatía sensitiva diabética; sin embargo, otros estudios no son directamente concluyentes con esta relación. Las discrepancias en los diferentes resultados pueden proponerse que subyacen a los diferentes modelos animales usados así como a la metodología empleada y el tiempo de seguimiento usado. Entre los mecanismos involucrados se propone una despolarización crónica de la membrana mitocondrial que precede la apoptosis secundaria al aumento de glucosa en GRD; además, las proteínas antiapoptóticas se han encontrado disminuidas y se ha observado presencia de traslocación de factores proapoptóticos hacia el citosol.
Transporte axónico, mitocondria y diabetes mellitusLas mitocondrias alcanzan su ubicación según los sitios de mayor requerimiento energético; por eso, se requiere el transporte de estos organelas mediado por proteínas y dependiente de los factores que fueron mencionados previamente, como el nivel de ATP, el calcio y los procesos de fusión/fisión. Si bien, ha sido descrita la ubicación normal de las mitocondrias en el axón, se ha documentado que estas tienen diferentes ubicaciones en los estados patológicos como en algunas neuropatías, en los que se observa su acumulación en los segmentos axónicos desmielinizados y en regiones de disrupción de la unión axoglial58.
La disminución en la producción de ATP secundaria a la disfunción mitocondrial en la diabetes puede ser resultado de la hipoinsulinemia23 y lleva a una disminución en el transporte axónico de las proteínas, así como a una caída en la síntesis proteica; estos factores sumados se asocian con la degeneración axónica distal.
La alteración en el transporte axónico de mitocondrias lleva a acúmulo de las mismas. Estos agregados de mitocondrias pueden contribuir al desarrollo de patología local como resultado del incremento en la producción de EOR, pérdida de la producción energética normal y anomalías en la regulación del calcio59.
El impacto de las concentraciones altas de glucosa en el tráfico mitocondrial y en las funciones asociadas no ha sido aclarado. En un estudio de células hepáticas de ratas y mioblastos se demuestra que la fragmentación mitocondrial es un proceso inducido por glucosa, necesario en la respiración mitocondrial y en la producción de EOR60. Por otra parte, el tratamiento de células beta pancreáticas y de neuronas con glucosa resulta en fragmentación/fisión de las mitocondrias y, en algunos escenarios, este proceso es seguido de muerte celular y apoptosis61.
En síntesis, no hay resultados directos que demuestren una relación clara entre la neuropatía diabética y el transporte mitocondrial; sin embargo, indirectamente, se ha relacionado la disfunción mitocondrial con reducción en el nivel de ATP y del transporte de proteínas por el axón, así como acúmulo de mitocondrias en los cuerpos neuronales, lo que hace sospechar cambios en su transporte a lo largo del axón.
ConclusiónLa neuropatía diabética es una complicación con un importante impacto que implica el compromiso de los nervios sensitivos, motores y autonómicos. Clásicamente, en su fisiopatología se han propuesto la vía de los polioles y la glucosilación de proteínas como mecanismos causales. La disfunción mitocondrial se ha planteado como otro agente causal de la neuropatía diabética.
La alteración mitocondrial incluye aumento en la generación de EOR, disminución en el potencial de membrana mitocondrial, disfunción en la regulación intramitocondrial del calcio, depleción en la producción de ATP y, en consecuencia, defectos en el transporte axónico y aumento de productos que pueden conducir a la apoptosis, mecanismos que sumados pueden llevar a la degeneración axónica. Estos hallazgos predominan en los nervios de mayor longitud. En la actualidad, permanecen sin respuesta las causas que explican la predilección del compromiso mitocondrial por los ganglios de la raíz dorsal y por los nervios sensitivos.
No está definida aun la fisiopatología que explique completamente los mecanismos causales de la neuropatía diabética. Varios estudios provienen de modelos animales, principalmente ratones, por lo que es necesario realizar más investigaciones en humanos; sin embargo, existen limitaciones como la dificultad para la realización de las biopsias, los riesgos intrínsecos al procedimiento y el acceso a la tecnología especial para esta que hacen más complejo el abordaje de los estudios.
El papel que juegan las alteraciones mitocondriales en la fisiopatología de la neuropatía diabética debería permitir en el futuro la búsqueda de nuevos recursos terapéuticos que se dirijan a la corrección de la disfunción mitocondrial y a mejorar la calidad de vida de los pacientes diabéticos.
Conflicto de interesesLos autores declaran no tener ningún confclito de intereses.