La hipoacusia ocupacional por ruido se considera dentro de los planes de prevención de enfermedades profesionales más comunes. Además del examen de las condiciones laborales se deben tener en cuenta otros factores personales que aumentan el riesgo de hipoacusia, como la diabetes.
ObjetivosExplorar la pérdida de audición en el ámbito laboral y su relación con las alteraciones de las cifras de glucemia basal en ayunas.
MétodosSe realizó un estudio observacional y transversal en el que se incluyeron 1.636 trabajadores de empresas del sector servicios. Se hicieron audiometrías tonales completas midiendo: alta frecuencia (AF), índice de pérdida precoz (ELI), índice promedio conversacional (SAL) y pérdida pérdida monoaural y binaural. Los resultados se categorizaron según las cifras de glucemia basal: G1 (<100mg/dl), G2 (100-125mg/dl) y G3 (>125mg/dl).
ResultadosSegún la AF y el ELI el 11% de los trabajadores en cada caso presentaron claro indicio de sordera. Las mujeres con niveles G3 obtuvieron diferencias significativas en los resultados del índice AF y ELI respecto al grupo G1 (p=0,038 y 0,046, respectivamente). Se encontró una asociación positiva de hipoacusia y niveles de glucemia G3 en las pruebas de AF (OR: 0,338; p=0,002), ELI (OR: 0,407; p=0,007) y monoaural del oído izquierdo (OR: 4,77×10-5; p=0,006).
ConclusionesPese a las limitaciones metodológicas de este estudio, existen indicios para pensar que los trabajadores con niveles elevados de glucemia basal podrían presentar un mayor riesgo de padecer hipoacusia de altas frecuencias.
Hearing loss due to noise is considered within the prevention plans of the most common occupational diseases. In addition to evaluation of working conditions, other personal factors increasing the risk of hypoacusis, such as diabetes, should be taken into account.
ObjectivesTo explore hearing loss in the workplace and its relationship to impaired fasting baseline blood glucose levels.
MethodsAn observational, cross-sectional study enrolling 1636 workers from service companies was conducted. Full audiometric evaluation was performed at different frequencies: high frequency (HF), early loss index (ELI), speech average loss (SAL), and monaural and binaural loss. Results were categorized by baseline blood glucose levels: G1 (<100mg/dl), G2 (100-125mg/dl), and G3 (>125mg/dl).
ResultsBased on both HF and ELI, 11% of workers had clear indication of deafness. Women with G3 levels showed significant differences in the results of HF and ELI indexes as compared to the G1 group (P=.038 and .046, respectively). A positive association was found between hearing loss and G3 blood glucose levels in HF (OR: .338; p=.002), ELI (OR: .407; p=.007), and the monaural test in the left ear (OR: 4.77×10-5; p=.006).
ConclusionsDespite the methodological limitations of this study, there is evidence for an increased risk of high frequency hearing loss in workers with high baseline blood glucose levels.
La pérdida auditiva dentro del marco laboral se caracteriza por una sordera de tipo neurosensorial causada por la exposición a ruidos continuos con un nivel de sonoridad diario equivalente o superior a 80 decibelios de la escala A (dBA)1. Aunque algunos medicamentos ototóxicos y la exposición a otros agentes, tales como sustancias químicas y vibraciones, podrían causar sordera en el trabajador, el ruido está considerado como el factor más importante. La exposición al ruido produce un traumatismo del epitelio sensorial de la cóclea2. Al principio los cambios vasculares, químicos y metabólicos son reversibles, llegando con el tiempo a recuperarse la audición. No obstante, si la exposición al ruido persiste se produce un daño irreparable debido a la pérdida permanente de los estereocilios y la destrucción de las células sensitivas2. El mayor problema asociado a la sordera neurosensorial es que la pérdida de audición se produce lentamente y de forma progresiva, por lo que es difícil que el trabajador lo identifique antes de que sea irreversible.
Algunas características individuales pueden suponer un incremento en el riesgo de desarrollo de hipoacusia, como son: la edad avanzada, el sexo femenino y enfermedades como la diabetes mellitus (DM)3–6. La evolución crónica de la diabetes habitualmente cursa con complicaciones vasculares, neurológicas y metabólicas3,7. Las consecuencias metabólicas de la DM con repercusión auditiva incluyen la microangiopatía, la neuropatía primaria y la tendencia a la hiperviscosidad sanguínea8,9. Las 2 primeras están asociadas a una afectación auditiva a más largo plazo y, en pacientes con DM, da lugar a daño bilateral de tipo neurosensorial con pérdida progresiva de las frecuencias más altas7,10,11. Algunas investigaciones indican que la diabetes podría tener relación con la pérdida súbita de audición que afecta a las frecuencias bajas y medias8. En este sentido, cobraría importancia el aumento de la viscosidad de la sangre que puede presentarse de forma repentina en los pacientes diabéticos. En este proceso se ve involucrada la fisiología de la circulación coclear, dado que se compone de lechos vasculares terminales de estrecho calibre y longitud pronunciada en los que la viscosidad de la sangre aumentada podría afectar al flujo normal8,12.
Por todo ello, parece clara la necesidad de incluir la DM dentro de los factores de riesgo asociados a la pérdida de audición, y tenerla en cuenta en los protocolos de exploración otoneurológica, como parte de los programas de prevención de la hipoacusia profesional.
El presente estudio se realizó con el objetivo de valorar los parámetros de hipoacusia en una muestra de población trabajadora perteneciente a empresas incluidas en el sector servicios en España y no expuesta a ruidos >80dBA, mediante la evaluación de los índices audiométricos en las distintas frecuencias (bajas, medias, altas y muy altas), y relacionarlos con las cifras de glucemia basal en ayunas.
Material y métodosSe realizó un estudio observacional y transversal desde noviembre de 2010 hasta noviembre de 2011. Los datos de los trabajadores se recogieron en una única visita durante los reconocimientos periódicos de vigilancia de la salud, en empresas del sector servicios y sociosanitarias ubicadas en Valencia, Castellón, Palma de Mallorca e Ibiza. Se excluyeron aquellos sujetos que presentaban riesgo por exposición a ruido laboral (>80dBA), por la toma de medicamentos ototóxicos o por antecedentes familiares de sordera. El estudio se llevó a cabo siguiendo la normativa vigente sobre prevención de riesgos laborales en España13 y con el conocimiento del comité de seguridad y salud de las empresas.
Previa firma del consentimiento informado de los pacientes se les realizó una audiometría tonal liminar por vía aérea en las distintas frecuencias (bajas, medias, altas y muy altas) usando un aparato audiométrico calibrado (Sibelmed Mod. AS5-AOM). El procedimiento para la realización de la exploración audiológica y el análisis de los resultados se ha descrito previamente en las notas técnicas de prevención (NTP) 270, 287, 284 y 28514–17 y en el RD 1316/89 de 27 de octubre18.
Las variables de respuesta que se midieron fueron: la audiometría de altas frecuencias (AF), el índice de pérdida precoz (Early loss Index [ELI]), el índice promedio conversacional (Speech Average Loss [SAL]), la pérdida de audición monoaural del oído derecho (OD) e izquierdo (OI), así como binaural. La AF utiliza por vía aérea las frecuencias más agudas, entre 8.000-20.000Hz. La escala ELI mide la pérdida auditiva producida por un trauma acústico, principalmente en las frecuencias agudas de 4.000Hz, con un rango entre 3.000 y 6.000Hz. Los resultados finales se corrigieron según la correspondiente presbiacusia. La pérdida auditiva derivada del AF y ELI se clasificó de la siguiente manera: grado A, normal o excelente cuando se registraba una pérdida <8dB; grado B, normal buena, cuando la pérdida era de 8-14dB; grado C, normal con pérdida de 15-22dB; grado D, sospecha de sordera, con pérdida de 23-29dB; y grado E, claro indicio de sordera para pérdidas >30dB19.
Por su parte, la escala SAL registra el grado de audición en las frecuencias conversacionales (500, 1.000 y 2.000Hz), cuya valoración se realiza de la siguiente manera: grado A, normal con pérdida en el peor oído de <16dB; grado B, casi normal con pérdida en uno de los 2 oídos de 16-30dB; grado C, ligero empeoramiento con pérdida en el mejor oído de 31-45dB; grado D, serio empeoramiento con una pérdida de 46-60dB en el mejor oído; grado E, grave empeoramiento con una pérdida en el mejor oído de 61-90dB; y grado F, profundo empeoramiento con una disminución en el mejor oído de >90dB19. Finalmente, la pérdida de audición monoaural de ambos oídos y binaural se calculó según se detalla en la NTP 136, cuya clasificación es la siguiente: normal (N) 0-26dB; leve-moderada (L-M) 26-71dB; y severa-profunda (S-P)>71dB19.
Para establecer la relación entre la glucemia e hipoacusia laboral a todos los participantes se les extrajo una muestra de sangre venosa para la determinación de los niveles de glucemia en ayunas el mismo día de las evaluaciones auditivas. Los resultados de glucemia basal se categorizaron en 3 grupos: G1 (<100mg/dl), G2 (100-125mg/dl) y G3 (>125mg/dl). Los valores de referencia indicativos de una glucemia basal elevada se identificaron en función de los puntos de corte habitualmente establecidos para definir glucemia normal, glucemia basal alterada y DM20. Asimismo, se identificaron los sujetos del estudio con diagnóstico previo de DM mediante la información disponible en la historia clínica.
Se realizó un análisis estadístico comparativo de los parámetros de hipoacusia seleccionados respecto a los distintos grupos de glucemia, para lo que se aplicó el test de Kruskal-Wallis. Para el estudio de efecto entre la pérdida auditiva y los niveles basales de glucemia indicativos de diabetes se utilizó un modelo de regresión logístico multinomial ordinal (odds ratio [OR] e intervalo de confianza [IC] del 95%). Se consideró un nivel de significación estadística cuando p<0,05.
Como variables explicativas del modelo se introdujeron el sexo, la edad, el puesto de trabajo y el nivel de glucemia basal de cada uno de los sujetos observados. Se utilizó el criterio de información de Akaike (AIC) y la diferencia de Deviance para la selección de variables en cada uno de los modelos.
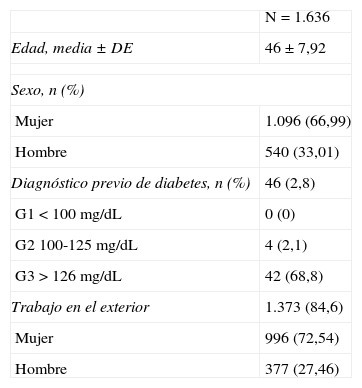
ResultadosSe incluyeron en el estudio 1.641 participantes, de los que 5 fueron excluidos por tener antecedentes familiares de sordera, por lo que finalmente se analizaron los datos de 1.636 sujetos. Respecto a las características basales de la población en estudio (tabla 1), la media de edad fue 46±7,92 años, con un mayor porcentaje de mujeres participantes en la muestra final (66,99%). En total 46 sujetos presentaban diagnóstico previo de DM, 2 de ellos de tipo 1 en tratamiento con insulina, y 44 de tipo 2 en tratamiento con antidiabéticos orales. Su distribución por grupos fue la siguiente: en el G1 (<100mg/dl) no se identificó ningún sujeto previamente diagnosticado con diabetes; en el G2 (100-125mg/dl) se detectaron 4 (2,1%); y en el G3 (>125mg/dl) 42 (68,8%). Además, 1.373 (84,6%) sujetos en la población de estudio, 377 hombres y 996 mujeres, trabajaban parte de su jornada en el exterior del centro de trabajo.
Características basales de la población en estudio
| N=1.636 | |
| Edad, media±DE | 46±7,92 |
| Sexo, n (%) | |
| Mujer | 1.096 (66,99) |
| Hombre | 540 (33,01) |
| Diagnóstico previo de diabetes, n (%) | 46 (2,8) |
| G1<100mg/dL | 0 (0) |
| G2 100-125mg/dL | 4 (2,1) |
| G3>126mg/dL | 42 (68,8) |
| Trabajo en el exterior | 1.373 (84,6) |
| Mujer | 996 (72,54) |
| Hombre | 377 (27,46) |
Respecto a la determinación de la glucemia en ayunas la mayoría de los trabajadores presentó niveles inferiores a 125mg/dl; concretamente 1.384 (84,6%) presentaron niveles encuadrados en el grupo G1 (<100mg/dl) y 191 (11,7%) en el grupo G2 (100-125mg/dl), mientras que 61 (3,7%) participantes mostraron niveles del grupo G3 (>125mg/dl).
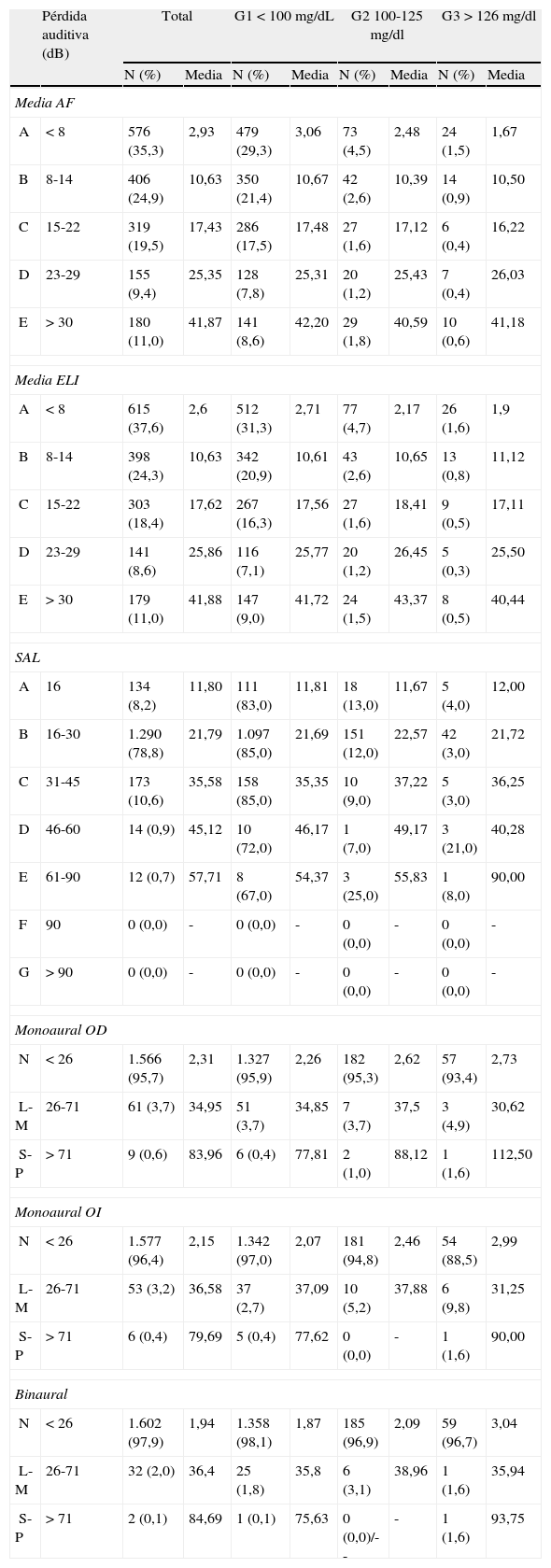
La distribución de los participantes según el grado de hipoacusia detectado en las exploraciones audiométricas AF, ELI, SAL, monoaural de OI y OD, y binaural categorizado en función de su glucemia basal se recoge en la tabla 2. En total, 180 (11%) trabajadores presentaron claro indicio de sordera (grado E) con una media del parámetro de hipoacusia de 41,87 de las frecuencias más altas según la audiometría de AF y 179 (11%) con una media de 41,88 según el índice ELI. En cambio, no se detectaron pérdidas auditivas graves en las frecuencias conversacionales SAL. Respecto a los resultados monoaurales en OD y OI, así como binaurales, categorizados según los grupos de glucemia, tampoco se identificaron pérdidas graves dado que los hallazgos fueron normales (<26dB) en el 95,4% de la población en estudio.
Distribución de la población de estudio y valor medio del parámetro de hipoacusia (medido en dB con corrección por presbiacusia) según los resultados obtenidos en la exploración auditiva y categorizados por los niveles basales de glucemia en ayunas
| Pérdida auditiva (dB) | Total | G1<100 mg/dL | G2 100-125 mg/dl | G3>126 mg/dl | |||||
| N (%) | Media | N (%) | Media | N (%) | Media | N (%) | Media | ||
| Media AF | |||||||||
| A | <8 | 576 (35,3) | 2,93 | 479 (29,3) | 3,06 | 73 (4,5) | 2,48 | 24 (1,5) | 1,67 |
| B | 8-14 | 406 (24,9) | 10,63 | 350 (21,4) | 10,67 | 42 (2,6) | 10,39 | 14 (0,9) | 10,50 |
| C | 15-22 | 319 (19,5) | 17,43 | 286 (17,5) | 17,48 | 27 (1,6) | 17,12 | 6 (0,4) | 16,22 |
| D | 23-29 | 155 (9,4) | 25,35 | 128 (7,8) | 25,31 | 20 (1,2) | 25,43 | 7 (0,4) | 26,03 |
| E | >30 | 180 (11,0) | 41,87 | 141 (8,6) | 42,20 | 29 (1,8) | 40,59 | 10 (0,6) | 41,18 |
| Media ELI | |||||||||
| A | <8 | 615 (37,6) | 2,6 | 512 (31,3) | 2,71 | 77 (4,7) | 2,17 | 26 (1,6) | 1,9 |
| B | 8-14 | 398 (24,3) | 10,63 | 342 (20,9) | 10,61 | 43 (2,6) | 10,65 | 13 (0,8) | 11,12 |
| C | 15-22 | 303 (18,4) | 17,62 | 267 (16,3) | 17,56 | 27 (1,6) | 18,41 | 9 (0,5) | 17,11 |
| D | 23-29 | 141 (8,6) | 25,86 | 116 (7,1) | 25,77 | 20 (1,2) | 26,45 | 5 (0,3) | 25,50 |
| E | >30 | 179 (11,0) | 41,88 | 147 (9,0) | 41,72 | 24 (1,5) | 43,37 | 8 (0,5) | 40,44 |
| SAL | |||||||||
| A | 16 | 134 (8,2) | 11,80 | 111 (83,0) | 11,81 | 18 (13,0) | 11,67 | 5 (4,0) | 12,00 |
| B | 16-30 | 1.290 (78,8) | 21,79 | 1.097 (85,0) | 21,69 | 151 (12,0) | 22,57 | 42 (3,0) | 21,72 |
| C | 31-45 | 173 (10,6) | 35,58 | 158 (85,0) | 35,35 | 10 (9,0) | 37,22 | 5 (3,0) | 36,25 |
| D | 46-60 | 14 (0,9) | 45,12 | 10 (72,0) | 46,17 | 1 (7,0) | 49,17 | 3 (21,0) | 40,28 |
| E | 61-90 | 12 (0,7) | 57,71 | 8 (67,0) | 54,37 | 3 (25,0) | 55,83 | 1 (8,0) | 90,00 |
| F | 90 | 0 (0,0) | - | 0 (0,0) | - | 0 (0,0) | - | 0 (0,0) | - |
| G | >90 | 0 (0,0) | - | 0 (0,0) | - | 0 (0,0) | - | 0 (0,0) | - |
| Monoaural OD | |||||||||
| N | <26 | 1.566 (95,7) | 2,31 | 1.327 (95,9) | 2,26 | 182 (95,3) | 2,62 | 57 (93,4) | 2,73 |
| L-M | 26-71 | 61 (3,7) | 34,95 | 51 (3,7) | 34,85 | 7 (3,7) | 37,5 | 3 (4,9) | 30,62 |
| S-P | >71 | 9 (0,6) | 83,96 | 6 (0,4) | 77,81 | 2 (1,0) | 88,12 | 1 (1,6) | 112,50 |
| Monoaural OI | |||||||||
| N | <26 | 1.577 (96,4) | 2,15 | 1.342 (97,0) | 2,07 | 181 (94,8) | 2,46 | 54 (88,5) | 2,99 |
| L-M | 26-71 | 53 (3,2) | 36,58 | 37 (2,7) | 37,09 | 10 (5,2) | 37,88 | 6 (9,8) | 31,25 |
| S-P | >71 | 6 (0,4) | 79,69 | 5 (0,4) | 77,62 | 0 (0,0) | - | 1 (1,6) | 90,00 |
| Binaural | |||||||||
| N | <26 | 1.602 (97,9) | 1,94 | 1.358 (98,1) | 1,87 | 185 (96,9) | 2,09 | 59 (96,7) | 3,04 |
| L-M | 26-71 | 32 (2,0) | 36,4 | 25 (1,8) | 35,8 | 6 (3,1) | 38,96 | 1 (1,6) | 35,94 |
| S-P | >71 | 2 (0,1) | 84,69 | 1 (0,1) | 75,63 | 0 (0,0)/-- | - | 1 (1,6) | 93,75 |
AF: audiometría de alta frecuencia; dB: decibelios; ELI: índice de pérdida precoz; G1, G2 y G3: niveles de glucemia en ayunas de los participantes en el estudio; SAL: índice promedio conversacional.
Índices de AF y ELI (media de ambos oídos): grado A normal o excelente cuando se registraba una pérdida <8dB; grado B normal buena cuando la pérdida era de 8-14dB; grado C normal con pérdida de 15-22dB; grado D sospecha de sordera, con pérdida de 23-29dB; y grado E claro indicio de sordera con pérdidas >30dB.
Índice de SAL: grado A normal con pérdida en el peor oído de <16dB; grado B casi normal con pérdida en uno de los 2 oídos de 16-30dB; grado C ligero empeoramiento con pérdida en el mejor oído de 31-45dB; grado D serio empeoramiento con una pérdida de 46-60dB en el mejor oído; grado E grave empeoramiento con una pérdida en el mejor oído de 61-90dB; y grado F profundo empeoramiento con una disminución en el mejor oído de >90dB.
Índices monoaural y binaural: grado N con pérdida <26dB; grado L-M con pérdida entre 26-71dB; y grado S-P, con pérdida >71dB.
Los valores negativos obtenidos en cada uno de los parámetros examinados fueron sustituidos por valores nulos.
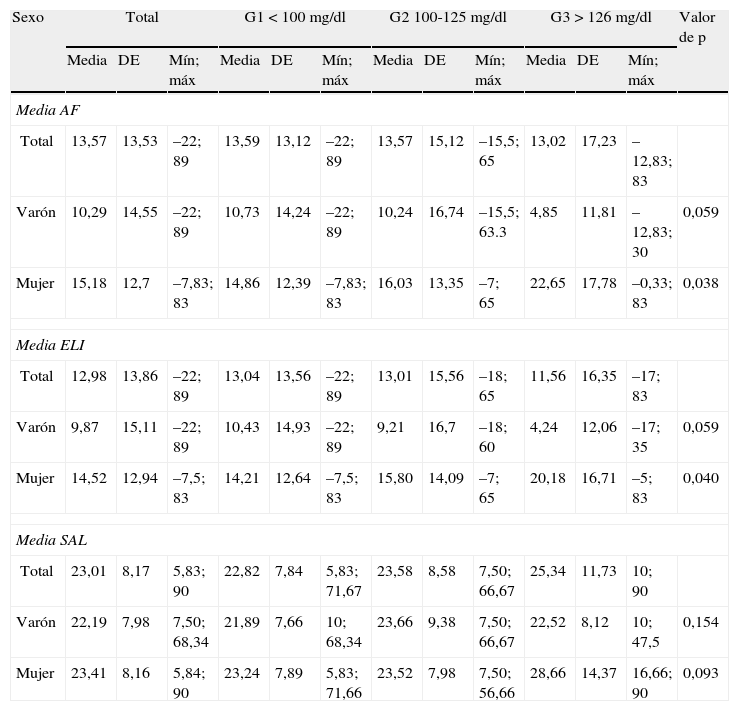
La descripción de los parámetros auditivos según los resultados del test de Kruskal-Wallis para las categorías de glucemia y sexo se han recogido en la tabla 3. Las mujeres presentaron diferencias en el índice AF de la media de los 2 oídos (con corrección por presbiacusia) (p=0,038) y su representación gráfica mostró que eran las trabajadoras con nivel G3 de la glucemia las que presentaban una pérdida significativamente más elevada de audición de las frecuencias agudas con respecto al grupo G1 (p=0,038 [fig. 1A]). No se obtuvo, en cambio, diferencias significativas en los hombres (p=0,059) (fig. 1A). De igual forma, el análisis de los resultados del índice ELI dio lugar a diferencias significativas en las mujeres con niveles G3 de glucemia (p=0,046), mientras que en los hombres no se alcanzó significación estadística en esta frecuencia (p=0,092) (fig. 1B). No se detectaron, en cambio, diferencias significativas en el índice de SAL en las mujeres ni en los hombres (p=0,154 y 0,093, respectivamente; fig. 1C).
Descripción de los parámetros auditivos AF, ELI y SAL (media de oído izquierdo y derecho) según el total de pacientes observados y las categorías de la glucemia basal consideradas en el estudio
| Sexo | Total | G1<100 mg/dl | G2 100-125mg/dl | G3>126mg/dl | Valor de p | ||||||||
| Media | DE | Mín; máx | Media | DE | Mín; máx | Media | DE | Mín; máx | Media | DE | Mín; máx | ||
| Media AF | |||||||||||||
| Total | 13,57 | 13,53 | –22; 89 | 13,59 | 13,12 | –22; 89 | 13,57 | 15,12 | –15,5; 65 | 13,02 | 17,23 | –12,83; 83 | |
| Varón | 10,29 | 14,55 | –22; 89 | 10,73 | 14,24 | –22; 89 | 10,24 | 16,74 | –15,5; 63.3 | 4,85 | 11,81 | –12,83; 30 | 0,059 |
| Mujer | 15,18 | 12,7 | –7,83; 83 | 14,86 | 12,39 | –7,83; 83 | 16,03 | 13,35 | –7; 65 | 22,65 | 17,78 | –0,33; 83 | 0,038 |
| Media ELI | |||||||||||||
| Total | 12,98 | 13,86 | –22; 89 | 13,04 | 13,56 | –22; 89 | 13,01 | 15,56 | –18; 65 | 11,56 | 16,35 | –17; 83 | |
| Varón | 9,87 | 15,11 | –22; 89 | 10,43 | 14,93 | –22; 89 | 9,21 | 16,7 | –18; 60 | 4,24 | 12,06 | –17; 35 | 0,059 |
| Mujer | 14,52 | 12,94 | –7,5; 83 | 14,21 | 12,64 | –7,5; 83 | 15,80 | 14,09 | –7; 65 | 20,18 | 16,71 | –5; 83 | 0,040 |
| Media SAL | |||||||||||||
| Total | 23,01 | 8,17 | 5,83; 90 | 22,82 | 7,84 | 5,83; 71,67 | 23,58 | 8,58 | 7,50; 66,67 | 25,34 | 11,73 | 10; 90 | |
| Varón | 22,19 | 7,98 | 7,50; 68,34 | 21,89 | 7,66 | 10; 68,34 | 23,66 | 9,38 | 7,50; 66,67 | 22,52 | 8,12 | 10; 47,5 | 0,154 |
| Mujer | 23,41 | 8,16 | 5,84; 90 | 23,24 | 7,89 | 5,83; 71,66 | 23,52 | 7,98 | 7,50; 56,66 | 28,66 | 14,37 | 16,66; 90 | 0,093 |
DE: desviación estándar.
P-valores obtenidos a partir del test de Kruskal–Wallis para cada parámetro de hipoacusia y según sexos y niveles de glucemia basal. Los datos se muestran como valor medio del parámetro de hipoacusia.
Resultado de la audiometría en relación con los niveles basales de glucemia presentados por trabajadores activos de empresas del sector servicios no sometidos a ruidos persistentes (<80dBA) ni medicamentos ototóxicos y sin antecedentes de sordera en la familia (n=1.636). A. Audiometría de alta frecuencia (AF). Se representa la mediana del índice AF de los 2 oídos, los cuartiles y el máximo y mínimo. Niveles basales de glucemia en ayunas: G1 (<100mg/dl), G2 (100-125mg/dl) y G3 (>125mg/dl). En las mujeres se encuentran diferencias estadísticamente significativas entre los grupos G1 y G3 de glucemia basal (p=0,038). B. Audiometría del índice de pérdida precoz (ELI). Se representa la mediana del índice ELI de los 2 oídos, los cuartiles y el máximo y mínimo. Niveles basales de glucemia en ayunas: G1 (<100mg/dl), G2 (100-125mg/dl) y G3 (>125mg/dl). En las mujeres se encuentran diferencias estadísticamente significativas entre los grupos G1 y G3 de glucemia basal (p=0,046). C. Audiometría del índice promedio conversacional (SAL). Se representa la mediana del índice SAL de los 2 oídos, los cuartiles y el máximo y mínimo. Niveles basales de glucemia en ayunas: G1 (<100mg/dl), G2 (100-125mg/dl) y G3 (>125mg/dl). No se encuentran diferencias estadísticamente significativas entre los distintos grupos de glucemia basal para el índice SAL en hombres y mujeres (p=0,154 y 0,093, respectivamente).
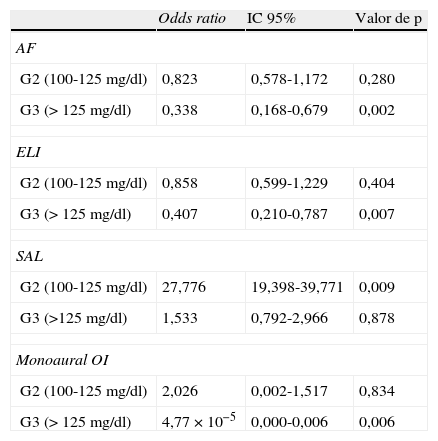
Los resultados del análisis de regresión logística se recogen en la tabla 4. Se encontró una asociación positiva de hipoacusia en las frecuencias más altas según la audiometría AF y ELI en el grupo categorizado con niveles >125mg/dl (OR: 0,338; IC 95%: 0,168-0,679; p=0,002 y OR: 0,407; IC 95%: 0,210-0,787; p=0,007, respectivamente). Igualmente significativo fue el efecto en el monoaural del OI (OR: 4,77×10−5; IC 95%: 0,000-0,006; p=0,006). También se observó un efecto estadísticamente significativo en la pérdida de audición del índice SAL en el grupo de participantes con niveles G2 (p=0,009).
Efecto de los niveles de glucemia basal de los participantes en el estudio en los distintos índices audiométricos explorados
| Odds ratio | IC 95% | Valor de p | |
| AF | |||
| G2 (100-125mg/dl) | 0,823 | 0,578-1,172 | 0,280 |
| G3 (>125mg/dl) | 0,338 | 0,168-0,679 | 0,002 |
| ELI | |||
| G2 (100-125mg/dl) | 0,858 | 0,599-1,229 | 0,404 |
| G3 (>125mg/dl) | 0,407 | 0,210-0,787 | 0,007 |
| SAL | |||
| G2 (100-125mg/dl) | 27,776 | 19,398-39,771 | 0,009 |
| G3 (>125mg/dl) | 1,533 | 0,792-2,966 | 0,878 |
| Monoaural OI | |||
| G2 (100-125mg/dl) | 2,026 | 0,002-1,517 | 0,834 |
| G3 (>125mg/dl) | 4,77×10−5 | 0,000-0,006 | 0,006 |
AF: audiometría de alta frecuencia; ELI: índice de pérdida precoz; G2 y G3: niveles basales de glucemia de los participantes en el studio; IC: intervalo de confianza; OI: oído izquierdo; SAL: índice promedio conversacional.
El valor de p corresponde a las comparaciones respecto a G1 (<100mg/dl).
En este modelo logístico multinomial ordinal se utilizó la media de cada índice con sus categorías ordinales de clasificación para estudiar el efecto de los niveles de glucemia basal (datos mostrados), así como la edad, el sexo y el puesto de trabajo (datos no mostrados).
La audición ocupa un lugar prioritario en la comunicación humana y su pérdida afecta al proceso de razonamiento, a la salud mental y a las perspectivas educativas y profesionales, fomentándose así el aislamiento social del individuo que la padece. Según datos facilitados por la OMS en el workshop «Contaminación auditiva» en el xxxiii Congreso de la Sociedad Panamericana de Otorrinolaringología y Cirugía de Cabeza y Cuello, el 76% de la población que vive en centros urbanos sufre un impacto acústico muy superior al recomendable21. Los sectores laborales que presentan mayor exposición a ruidos persistentes son la construcción, la industria manufacturera o la agricultura. No obstante, estos grupos de alto riesgo se han estudiado más extensamente y existen datos disponibles en la bibliografía actual22–24. Por ello, para la realización de este estudio se seleccionó el sector servicios, dado que agrupa una amplia gama de actividades (transporte, comercio, turismo, sanidad, educación, etc.) y cuenta con una proporción cada vez mayor de trabajadores, especialmente mujeres25, tal y como hemos podido observar en nuestros resultados (66,99%).
En este estudio la pérdida neurosensorial de los trabajadores se ha explorado de forma completa evaluando un intervalo de frecuencias entre 500-8.000Hz, como habitualmente encontramos en la bibliografía, pero además se realizó una audiometría de AF que comprende los agudos entre 8.000-20.000Hz.
Además, existen algunos factores extralaborales como son la DM, la edad avanzada y el sexo femenino, que pueden incrementar el riesgo de padecer pérdida de audición. Este trabajo se centra en el análisis de los resultados obtenidos en las audiometrías según la determinación de glucemia basal obtenida en sangre venosa y en ayunas, por lo que los datos se categorizaron en 3 grupos (G1: <100mg/dl, G2: 100-125mg/dl y G3: >125mg/dl). Los valores se obtuvieron a partir de una única extracción de sangre venosa, lo que podría representar una limitación a la hora de interpretar su validez, dado que se recomienda repetir la determinación con el fin de confirmar los resultados20. Esto podría explicar la baja prevalencia de sujetos con valores de glucemia en ayunas >125mg/dl (3,7%), que contrasta con las estimaciones publicadas recientemente en la literatura (31-45 años: 6,68% en hombres y 2,2% en mujeres, y 46-60 años: 23,8% en hombres y 10,9% en mujeres)26. No obstante, el 68,8% de los sujetos del grupo G3 eran diabéticos previamente diagnosticados, lo que podría servir como control positivo, si bien no se puede concretar el tiempo de evolución de su enfermedad. Por último, cabe destacar que este estudio se realizó durante el reconocimiento periódico de la salud de los trabajadores, lo que imposibilita realizar cualquier seguimiento a corto plazo sin encarecer considerablemente los costes del mismo.
Según nuestros datos las mujeres con niveles G3 de glucemia en ayunas presentaban una disminución estadísticamente significativa de audición en las frecuencias más altas, según audiometría AF y ELI, en comparación con las mujeres del grupo G1. Este resultado también se mostró en el análisis de regresión logística, donde se obtuvo una asociación positiva entre hipoacusia en las frecuencias agudas de AF, ELI y niveles G3 de glucemia. Estudios previos ya habían descrito esta asociación entre las alteraciones diabéticas y la pérdida de las frecuencias altas hasta 8.000Hz7,10,11,27,28. Sin embargo, estos estudios se realizaron en pacientes diabéticos diagnosticados, tratados y de varios años de evolución, lo que limita la comparación con nuestro trabajo, que a pesar de estudiar una gran muestra solo incluía una pequeña proporción de sujetos con niveles de glucosa sugestivos de diabetes. No existe una explicación clara de la mayor asociación de las alteraciones audiométricas en mujeres, si bien se presentan en mujeres con trabajos en el exterior de las oficinas al menos la mitad de su jornada. En las mujeres con cifras de glucemia elevada no debería justificarse tan solo por su trabajo en exteriores. La bibliografía existente relaciona la pérdida auditiva en diabéticos con aspectos ligados al tiempo de evolución de la enfermedad, tipo de diabetes, cifras de hemoglobina glucosilada o eficacia del control, e incluso con la edad del paciente27,29–31. Existen, asimismo, pocos estudios que hagan un seguimiento del deterioro audiométrico a lo largo del tiempo en los pacientes diabéticos. Garcia Callejo et al. realizaron un estudio comparativo en una pequeña muestra de trabajadores diabéticos y en controles sanos sometidos a un nivel acústico diario equivalente a 80dB12. La exploración audiométrica inicial a los 6 meses de su incorporación laboral no detectó diferencias significativas, mientras que a los 5 años de seguimiento se mostró una afectación binaural e indicios de sordera según ELI (tipo E) significativamente superior en los sujetos diabéticos12.
Sería por tanto interesante diseñar en el futuro nuevos estudios comparativos entre trabajadores sanos y diabéticos que aporten información relevante sobre la propia diabetes, en cuanto a tipo de diabetes, determinación de HbA1, duración de la enfermedad, tratamiento o comorbilidades, así como del deterioro auditivo a lo largo del tiempo. En la literatura se propone que la duración mínima de la diabetes tipo 2 asociada a alguna deficiencia auditiva es de 5 años11 y 10 años para la diabetes tipo 132. Asimismo, algunos autores han correlacionado la presencia de diabetes asociada a enfermedad coronaria o retinopatía con un riesgo significativamente mayor de hipoacusia7.
En resumen, la hipoacusia laboral es una enfermedad altamente frecuente en los trabajadores españoles con un gran impacto socioeconómico, debido fundamentalmente a que se presenta de forma irreversible cuando es detectada por el trabajador. A la vista de nuestros resultados las alteraciones del metabolismo hidrocarbonado evaluadas mediante la glucemia basal son un factor de riesgo para el deterioro auditivo de las frecuencias altas en una población laboral no expuesta a un ruido excesivo (<80dB), lo que da un valor añadido a estos datos, ya que probablemente reflejan mejor la población general.
Por tanto, tan importante como la obtención de información acerca del puesto de trabajo y del riesgo de ruido es la identificación de otros factores extralaborales agravantes o condicionantes, tales como presencia de cifras elevadas de glucemia sugestivas de diabetes. La valoración global de estos datos por parte de un equipo multidisciplinar de especialistas, en el que se incluya al médico de trabajo, permitiría actuar coordinadamente con un mejor uso de los recursos disponibles y, posiblemente, obtener mejores resultados a medio y largo plazo en la prevención de la hipoacusia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLos autores han contado con el apoyo de Irantzu Izco-Basurko y Teresa Hernando (COCIENTE S.L.) para la redacción de este manuscrito. Esta ayuda ha sido financiada por Novo Nordisk Pharma S.A.