Se trata de una mujer de 51 años que consultó al Servicio de Endocrinología por primera vez hace 4 años por hipoglucemias, algunas de ellas con clínica neuroglucopénica. Los episodios se iniciaban con síntomas adrenérgicos (temblor, sudoración, hambre intensa), pero en ocasiones evolucionaban o se presentaban desde el inicio con confusión y presíncope con caída al suelo. La sospecha de hipoglucemia había sido comprobada con un reflectómetro, obteniéndose cifras entre 30 y 40mg/dL. La paciente decía sufrir las hipoglucemias en cualquier momento del día, pero más frecuentemente en periodo posprandial. No tenía antecedentes médicos ni quirúrgicos de interés y como tratamiento farmacológico tomaba únicamente tibolona para la sintomatología menopáusica. Entre sus antecedentes familiares solo destaca madre afecta de diabetes mellitus tipo 2.
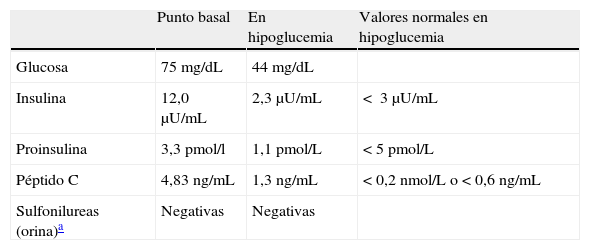
Se remitió al hospital para estudio, realizándose un primer test de ayuno en el que solo se evidenció hipoglucemia al final del tercer día (44mg/dL) y con el único hallazgo relevante de un péptido C no suprimido durante la misma (1,3ng/mL) (tabla 1).
Valores del test de ayuno.
| Punto basal | En hipoglucemia | Valores normales en hipoglucemia | |
| Glucosa | 75mg/dL | 44mg/dL | |
| Insulina | 12,0μU/mL | 2,3μU/mL | < 3μU/mL |
| Proinsulina | 3,3pmol/l | 1,1pmol/L | <5pmol/L |
| Péptido C | 4,83ng/mL | 1,3ng/mL | <0,2 nmol/L o <0,6ng/mL |
| Sulfonilureas (orina)a | Negativas | Negativas |
Ante el hallazgo de un péptido C no suprimido en la hipoglucemia se solicitaron varias pruebas de imagen buscando un insulinoma: un TC y una RM pancreática sin hallazgos, un octreoscan negativo y dos ecoendoscopias, la primera negativa y la segunda con una lesión de 9×10mm en cola de páncreas cuya punción aspiración con aguja fina resultó ser un bazo ectópico.
La paciente seguía presentando episodios de hipoglucemia grave, por lo cual, y a pesar de las pruebas de localización negativas, se decidió intervenir quirúrgicamente para identificar y resecar un posible insulinoma. En octubre de 2007 se practicó una pancreatectomía parcial de cola. La anatomía patológica de la pieza pancreática demostraba hiperplasia difusa de células beta compatible con nesidioblastosis.
Tras la intervención la paciente permaneció asintomática sin episodios de hipoglucemia durante aproximadamente un año.
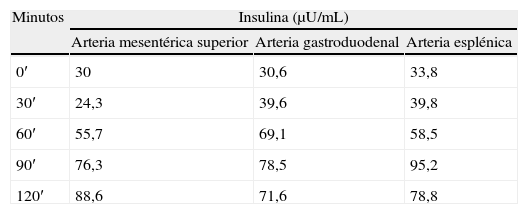
En agosto de 2008 la paciente consultó de nuevo por clínica de hipoglucemias, menos importantes, sin neuroglucopenia, que controlaba con la ingesta continua de pequeñas cantidades de hidratos de carbono. Se solicitaron nuevas pruebas de imagen (TC y ecoendoscopia) que fueron nuevamente negativas. Con la sospecha de que la primera excisión quirúrgica no hubiera sido suficientemente amplia o que no se hubiera practicado en el territorio pancreático más afecto, se remitió a otro centro para un test de estímulo intraarterial con calcio mediante radiología intervencionista. Allí se repitió un segundo test de ayuno, que esta vez fue totalmente negativo (sin hipoglucemias en ningún momento y con péptido C e insulina correctamente suprimidos), y posteriormente el estímulo intrarterial, con los resultados que se resumen en la tabla 2: en los 3 territorios arteriales estudiados se duplicaban o triplicaban las concentraciones basales de insulina.
Ante dichos resultados se contactó de nuevo con Cirugía General y se realizó reintervención, esta vez mediante esplenopancreatectomía corporocaudal. El informe de Anatomía Patológica reveló de nuevo hiperplasia e hipertrofia de islotes pancreáticos compatible con nesidioblastosis difusa del adulto.
Desde la cirugía la paciente no ha experimentado nuevos episodios de hipoglucemia, pero ha desarrollado una diabetes mellitus pancreatopriva y ha precisado de insulinización con 20UI de insulina glargina, con lo que mantiene control glucémico óptimo
El diagnóstico de hipoglucemia debe establecerse en base a la presencia de la tríada de Whipple: síntomas de hipoglucemia, concentraciones bajas de glucemia en sangre venosa coincidiendo con tales síntomas y desaparición de los mismos tras el aumento de la glucemia. Los síntomas pueden ser de tipo adrenérgico (sudoración, temblor…) o cursar con clínica neuroglucopénica (confusión, focalidad neurológica, convulsiones, pérdida de consciencia). Los primeros aparecen con concentraciones de glucemia inferiores a 60mg/dL y son relativamente inespecíficos. Los últimos no suelen aparecer hasta que la glucemia no desciende por debajo de 50mg/dL y son mucho más específicos. En general, cuanto más grave sea la neuroglucopenia, más probable es el trastorno de hipoglucemias por hiperinsulinismo.
Existen varias formas de clasificar los trastornos por hipoglucemia, la más clásica es aquella que distingue entre hipoglucemias de ayuno e hipoglucemias posprandiales (las que aparecen en las 4-5 horas siguientes a una ingesta). Una vez descartados los fármacos, las hipoglucemias de ayuno se han identificado habitualmente con trastornos orgánicos como el hiperinsulinismo por insulinoma, la hepatopatía terminal, el déficit de hormonas contrainsulares o los grandes tumores mesenquimales, en tanto que las hipoglucemias posprandiales se han relacionado más frecuentemente con trastornos de tipo «funcional» como la prediabetes, o las hipoglucemias alimentarias de los pacientes sometidos a cirugía del tracto gastrointestinal superior, relacionadas estas últimas con el síndrome de vaciado gástrico acelerado y el dumping. Esta clasificación antigua no incluye el Noninsulinoma Pancreatogenous Hypoglycemia Syndrome (NIPHS, ‘síndrome de hiperinsulinismo pancreático no insulinoma’), descrito hace más de una década y que sufría la paciente del caso clínico.
El NIPHS es un síndrome caracterizado por la existencia de hipersinsulinismo endógeno no causado por un insulinoma. Clínicamente se caracteriza por la aparición de hipoglucemias con neuroglucopenia en el periodo posprandial, test de ayuno negativo (aunque hay excepciones en los casos recogidos en la literatura), estudios de imagen negativos para insulinoma, y test de estímulo con calcio intraarterial positivo en uno o varios de los territorios arteriales pancreáticos estudiados1. A diferencia del insulinoma, es más frecuente en varones. La anatomía patológica del páncreas en estos pacientes muestra hipertrofia de células beta, islotes con núcleos agrandados e hipercromáticos y aumento de islotes periductales, hallazgos histológicos característicos de la nesidioblastosis y similares a aquellos que se encuentran en los neonatos y niños pequeños aquejados de hipoglucemia hiperinsulinémica persistente. En los niños estas alteraciones se han relacionado con la existencia de mutaciones en los genes Kir6.2 y SUR12, mutaciones que sin embargo están ausentes en los casos descritos de adultos con NIPHS1. La patogenia del trastorno en adultos es todavía desconocida, aunque se ha descrito la sobreexpresión de la citocina humana INGAP, implicada en la neogénesis de islotes, en páncreas resecados en estos pacientes3.
Se desconoce si los hallazgos anatomopatológicos pueden correlacionarse directamente con el síndrome clínico, ya que cambios sutiles similares a los de la nesidioblastosis pueden observarse hasta en un 36% de autopsias de pacientes sin hipoglucemias4.
El diagnóstico de NIPHS debe sospecharse ante la presencia de episodios de hipoglucemia hiperinsulinémica con test de ayuno y pruebas de localización de insulinoma ambos negativos. Dado que el test de ayuno suele ser negativo, el diagnóstico de hiperinsulinismo puede hacerse bien con una hipoglucemia espontánea presenciada en la consulta/hospital, bien provocándola con un test de comida mixta, en el que el paciente consume una comida similar a aquella que le produce los síntomas en casa, y es observado durante 5 horas, obteniéndose muestras cada 30 minutos para glucosa, insulina, péptido c y proinsulina. Una vez evidenciado el hiperinsulinismo en hipoglucemia, y con las pruebas de imagen para insulinoma negativas, estaría indicado realizar el test de estímulo con calcio intraarterial. Este último test consiste en infundir gluconato cálcico, un secretagogo para la célula beta patológica, en las arterias nutricias del páncreas (mesentérica superior, gastroduodenal y esplénica) y obtener muestras para insulina a nivel de las venas hepáticas. Se considera un resultado positivo la duplicación o triplicación de los valores basales de insulina sérica, lo cual ocurre exclusivamente al prefundir la/las arterias que irrigan la región pancreática con islotes hiperfuncionantes, ya sea por insulinoma o nesidioblastosis, y no ocurre al perfundir un territorio pancreático normal. En el caso de los insulinomas ocultos, el test suele ser positivo únicamente para el territorio arterial que irriga el tumor, mientras que en el NIPHS suele ser positivo para múltiples territorios, como en la paciente del caso5.
El tratamiento en caso de hipoglucemias graves es quirúrgico: pancreatectomía parcial, subtotal o idealmente guiada por el gradiente del test del calcio, es decir, resecando el territorio pancreático a la izquierda de la vena mesentérica superior cuando el test solo es positivo tras la infusión en la arteria esplénica, y ampliando la resección hacia la derecha de la mesentérica superior cuando es positivo tras la infusión de alguna otra arteria adicional1. En la mayoría de los casos, la pancreatectomía incluso no total acaba con las hipoglucemias o las mejora de forma significativa, pero se han observado casos de recurrencia tras pancreatectomías parciales6,7. En el caso de nuestra paciente, la primera pancreatectomía distal hecha «a ciegas», esto es, sin test de estímulo con calcio intrarterial, resultó a la larga claramente insuficiente.
Respecto a las opciones de tratamiento médico, hay recogidos en la literatura casos de manejo satisfactorio con octreótido, verapamilo, y diazoxido8, aunque en general se recomienda abordaje quirúrgico en caso de hipoglucemias graves.
Otro grupo de pacientes en los que la pancreatectomía parcial revela a menudo nesidioblastosis en la pieza quirúrgica son aquellos pacientes sometidos a cirugía bariátrica que años después desarrollan hipoglucemias hipersinsulinémicas posprandiales.
Tampoco en estos está completamente definida la etiopatogenia del trastorno pero se han postulado varios mecanismos: la presencia de alteraciones previas en la función de la célula beta que habían permanecido enmascarados y asintomáticas debido a la insulinorresistencia de la obesidad, o bien la hiperplasia patológica de las células beta en respuesta a determinados factores humorales que se ven aumentados tras el by-pass gástrico. Concretamente se ha visto un incremento excesivo del GLP-1 en respuesta a una comida mixta en individuos con esta complicación, comparados con sujetos sometidos a by-pass que no habían presentado hipoglucemias9.
Es posible que exista algún nexo patogénico común entre el NIPHS espontáneo y la nesidioblastosis secundaria a la cirugía bariátrica, aunque tal nexo es desconocido. Por ahora, únicamente se ha descrito un aumento de factores de crecimiento y receptores de factores de crecimiento en páncreas de pacientes de ambos tipos respecto a páncreas control10.
En definitiva, aunque la forma habitual de presentación del hiperinsulinimo es la hipoglucemia de ayuno, existen ciertos casos de hipoglucemias posprandiales, sobre todo cuando son graves y se acompañan de neuroglucopenia, que nos obligan a considerar la existencia de nesidioblastosis, no solo en pacientes intervenidos de cirugía bariátrica sino también como fenómeno espontáneo.