El síndrome de Cushing (SC), debido a un adenoma hipofisario productor de ACTH, a tumores suprarrenales o a una secreción ectópica de ACTH, determina hipercortisolismo. Se asocia a mayor morbilidad, especialmente complicaciones metabólicas, cardiovasculares, osteoporosis, alteraciones psiquiátricas y deterioro cognitivo. A pesar de la «curación» bioquímica del hipercortisolismo y la mejora clínica tras tratamiento eficaz, estas complicaciones solo son parcialmente reversibles, observándose también una exacerbación de enfermedades autoinmunitarias. Todo ello conlleva un deterioro de la calidad de vida y un aumento de la mortalidad. En esta revisión se repasan las principales comorbilidades y consecuencias del SC a largo plazo, a pesar de su curación clínica y bioquímica.
Cushing syndrome (CS), due to an ACTH-secreting pituitary adenoma, adrenal tumors, or ectopic ACTH secretion, causes hypercortisolism. CS is associated with major morbidity, especially metabolic and cardiovascular complications, osteoporosis, psychiatric changes, and cognitive impairment. Despite biochemical “cure” of hypercortisolism and clinical improvement after effective treatment, these complications are only partially reversible. Exacerbation of prior autoimmune diseases is also seen. All of these lead to quality of life impairment and increased mortality. This review addresses the main comorbidities and long-term consequences of CS despite clinical and biochemical “cure”.
El síndrome de Cushing (SC) endógeno es consecuencia de la exposición crónica a concentraciones elevadas de glucocorticoides. El cortisol es el producto final de la estimulación del eje hipotalámico-hipófiso-adrenal (HHA), producido por la corteza adrenal en respuesta a la acción de la hormona adrenocorticotropa (ACTH).
La causa más frecuente de SC es una excesiva liberación de ACTH por un adenoma hipofisario (enfermedad de Cushing [EC]), aunque también puede existir una secreción ectópica de ACTH por una neoplasia. Por otro lado, la propia glándula suprarrenal puede secretar más cortisol por uno o varios adenomas, por hiperplasia adrenal bilateral, por un carcinoma, y más raramente por una displasia micronodular suprarrenal (en el síndrome de Carney) o por la presencia de receptores anómalos que determinan una hiperplasia macronodular bilateral independiente de la ACTH1. Característicamente en el SC desaparece el ritmo circadiano normal de la secreción de cortisol, con concentraciones máximas por la mañana y mínimas (prácticamente indetectables) a medianoche, así como el feedback fisiológico del eje HHA entre cortisol, ACTH y el péptido hipotalámico CRH.
En las últimas décadas se acumulan evidencias de que a pesar de corregir el hipercortisolismo tras tratamiento eficaz del SC, no se produce una remisión completa de las alteraciones clínicas asociadas2-4. Independientemente de la causa, la hipersecreción crónica de cortisol produce obesidad central, atrofia muscular y fatigabilidad, osteopenia, hipertensión arterial, intolerancia a la glucosa, hiperlipidemia, hipercoagulabilidad, altibajos emocionales y depresión, entre otros problemas. Esto conlleva un aumento del riesgo cardiovascular durante la fase activa de la enfermedad y muy probablemente también a largo plazo. Esto se ha ido evidenciando cada vez más en los últimos años, de manera que las comorbilidades y las complicaciones de la fase activa del SC, aunque mejoran claramente tras cirugía o tratamiento médico, persisten en parte tras el tratamiento, con consecuencias negativas sobre el sistema cardiovascular, el hueso, el cerebro, la calidad de vida relacionada con la salud (CVRS) e incluso mayor mortalidad2-4. El hecho de que se demore el diagnóstico correcto frecuentemente entre 2 y 5años hace que el hipercortisolismo ejerza su efecto deletéreo durante mucho tiempo, antes de ser diagnosticado y tratado5. Por lo tanto, el seguimiento a largo plazo de estos pacientes es obligado para controlar las complicaciones debidas a la exposición crónica previa a concentraciones elevadas de cortisol.
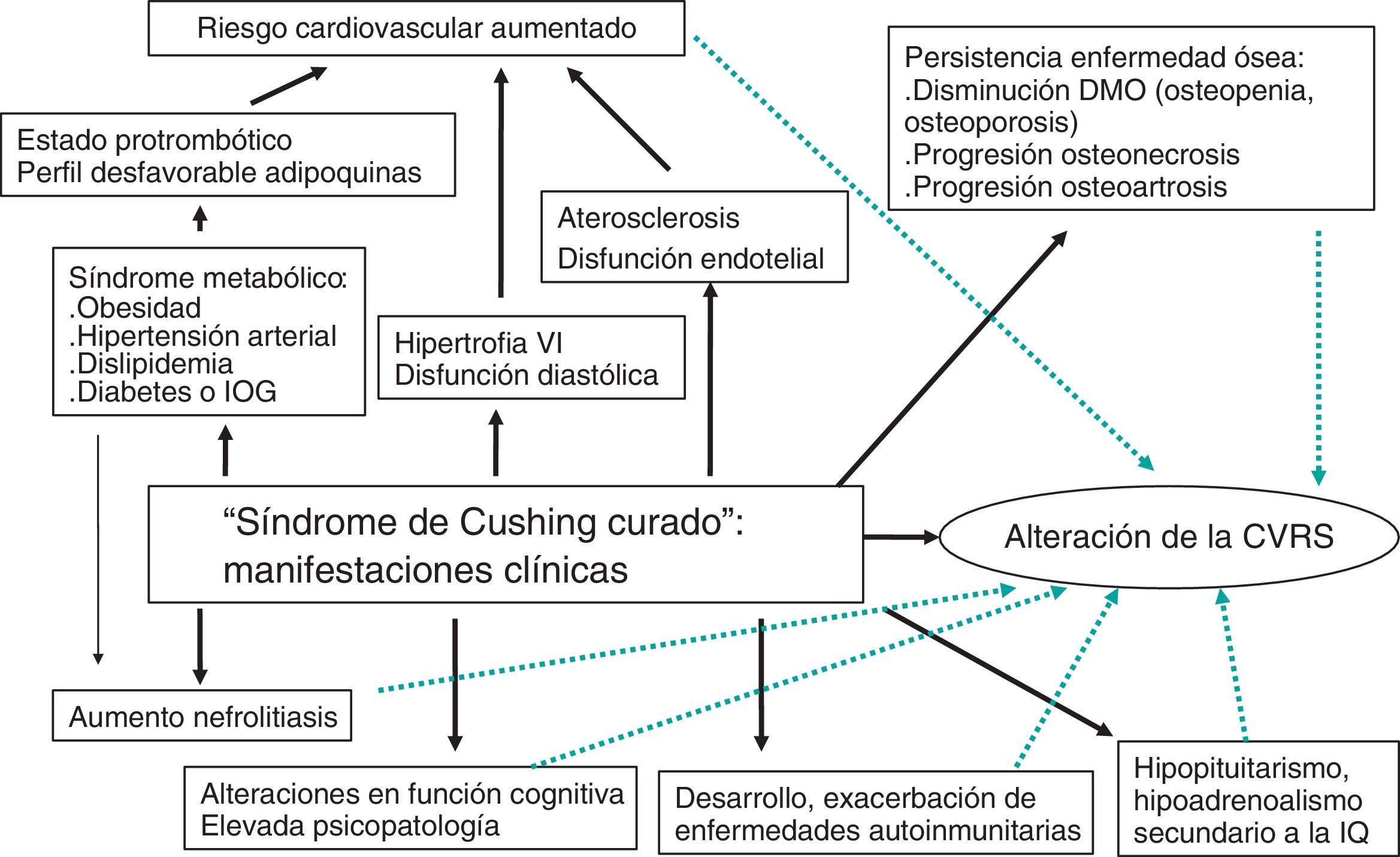
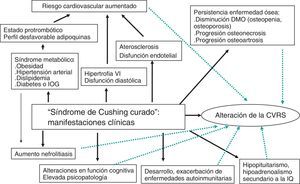
Esta revisión se centra en el pronóstico y las consecuencias clínicas que presentan pacientes diagnosticados de SC y que han sido «curados» tras tratamiento adecuado, y el impacto que estas comorbilidades tienen en la CVRS y la mortalidad (fig. 1).
Sistema cardiovascularEl hipercortisolismo determina aumento de factores de riesgo cardiovascular como obesidad central, intolerancia a la glucosa, hipertensión, dislipidemia e hipercoagulabilidad (asociadas al síndrome metabólico), y mayor incidencia de aterosclerosis. Esto impacta en su morbimortalidad y determina que la enfermedad cardíaca sea la principal causa de muerte en los pacientes con SC.
Este riesgo cardiovascular persiste elevado incluso 5años después de estar bioquímicamente curado el hipercortisolismo6. Se observó mayor índice de masa corporal (IMC), índice cintura/cadera, hipertensión arterial, concentración de glucemia e insulinemia en ayunas, fibrinógeno y un perfil lipídico desfavorable en comparación con el grupo control apareados por edad y sexo. Esto se acompañaba de incremento del grosor de la íntima media y menor coeficiente de distensibilidad, en comparación con el grupo control, incluso cuando se apareaban por IMC, confirmando una elevada prevalencia de aterosclerosis y factores de riesgo cardiovascular, similar a lo observado en la enfermedad activa, asociado a obesidad abdominal residual y/o a resistencia a la insulina. Un estudio de este mismo año observa que a pesar de la remisión del hipercortisolismo desde hace un promedio de 11años, existe mayor patología cardiovascular especialmente en mujeres (42% SC vs 18% controles; p<0,05) y pacientes menores de 45años. Incluso después de excluir pacientes con hipopituitarismo o dislipidemia, los pacientes menores de 45años presentan mayor prevalencia de calcificaciones coronarias y/o placas no calcificadas ateromatosas en comparación con controles sanos apareados (30% SC vs 0% controles; p<0,01)7.
En la misma línea, otro trabajo objetiva persistencia del aumento del perímetro abdominal en pacientes con SC (independientemente de la causa) tras un año de remisión hormonal8. Recientemente se ha comparado la composición corporal con resonancia magnética de cuerpo entero antes de la intervención y en remisión, 6meses después de no requerir ya tratamiento con glucocorticoides para tratar la inhibición del eje HHA. Aunque se produjo una reducción en gran parte de los depósitos grasos, en la mayoría de los pacientes persistía sobrepeso u obesidad, a pesar de la remisión de la EC. Asimismo, se redujo la insulinemia y la leptinemia, sin mejora de la adiponectina ni de los parámetros lipídicos (cHDL, cLDL, triglicéridos)9.
En un estudio caso-control también observamos que tras un promedio de 11años de remisión, pacientes con SC endógeno seguían presentando mayor masa grasa total y obesidad central que los controles ajustados por edad y sexo10.
El aumento de la obesidad central y de la grasa visceral es una característica fenotípica del SC y determina una producción alterada de adipocinas. Estas adipocinas pueden contribuir a la patogénesis de complicaciones vasculares, metabólicas e inflamatorias tales como daño endotelial, hipertensión arterial, alteración del remodelado óseo, aterosclerosis e inflamación de bajo grado11. El aumento de leptina, resistina y citocinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α) y la interleucina-6 (IL-6), se asocian a mayor riesgo cardiovascular. En estudios in vitro se ha visto que la leptina aumenta la actividad del enzima 11β-hidroxiesteroide deshidrogenada tipo 1 (11β-HSD1), que convierte la cortisona inactiva en cortisol12. Por tanto, esta y otras adipocinas y factores humorales podrían estimular más los niveles circulantes de cortisol, contribuyendo a las características típicas del síndrome metabólico, obesidad visceral e hiperleptinemia13. Sin embargo, el hecho de que 10días después de la cirugía de la EC se haya encontrado elevación de leptina a pesar de una caída del cortisol sugiere que otros factores, aparte del cortisol, juegan un papel en la hipersecreción de leptina, como por ejemplo la persistencia de una distribución anómala de la grasa14. A largo plazo, con la remisión del hipercortisolismo, la leptina disminuiría de forma progresiva, en paralelo a la disminución del IMC, la masa grasa y la insulina.
La adiponectina tiene actividad antiaterogénica y antiinflamatoria, y está disminuida en la obesidad y en situaciones de insulinorresistencia. Se ha observado que la adiponectina es baja en pacientes con SC activo y en pacientes curados desde hace una media de 11años, comparados con los controles10. El TNF-α es una citocina proinflamatoria con efectos reguladores sobre el metabolismo lipídico, la función de los adipocitos y la señalización insulínica. Su elevación se ha asociado a mayor riesgo de isquemia aguda coronaria recurrente. Se ha observado aumento del TNF-α y de la IL-6 en pacientes con SC activo pero también tras años de curación10. Este perfil desfavorable de adipocinas podría contribuir a este estado de inflamación de «bajo grado» presente en pacientes curados de su SC, con el consiguiente incremento persistente del riesgo cardiovascular10,15. Si coexiste déficit concomitante de hormona de crecimiento (GH) tras cirugía hipofisaria, empeora todavía más el riesgo cardiovascular y las alteraciones metabólicas10; estos parámetros metabólicos, las concentraciones de adipocinas y la composición corporal anómala pueden mejorar tras tratamiento sustitutivo con GH16,17.
Las alteraciones en el metabolismo de la glucosa (resistencia a la insulina, intolerancia a la glucosa y diabetes mellitus) son otros factores de riesgo cardiovascular importantes, y los glucocorticoides favorecen su desarrollo. La prevalencia de estas alteraciones es variable según las series, oscilando entre el 20 y el 47% los pacientes que tienen diabetes mellitus, y entre el 21 y el 64% los pacientes que presentan intolerancia a la glucosa6,18. Aunque su prevalencia se reduce con la curación bioquímica, a menudo persisten, observándose concentraciones más elevadas de insulina que en la población control10.
La hipertensión arterial moderada persistente, a pesar de un tratamiento eficaz del SC, parece estar asociada a mayor duración de la hipertensión en la fase activa del hipercortisolismo. Su patogenia parece ser multifactorial: inhibición del sistema vasodilatador, activación del sistema renina-angiotensina-aldosterona e inhibición del catabolismo periférico de las catecolaminas19. Además, el aumento de las concentraciones de cortisol puede exceder la capacidad de la enzima 11β-HSD2 (que inactiva el cortisol), facilitando la unión del cortisol a los receptores de mineralocorticoides, lo que conlleva un aumento del efecto de la aldosterona y de la fibrosis del miocardio. En los pacientes en remisión del hipercortisolismo en los que persiste la hipertensión arterial se han observado más alteraciones estructurales y funcionales cardíacas que en sujetos hipertensos controles, lo que sugiere que una exposición previa a hipercortisolismo empeora los efectos negativos de la hipertensión arterial19.
En esta misma línea, varios grupos han descrito lesiones cardíacas funcionales y estructurales, como hipertrofia ventricular izquierda, disfunción diastólica y disminución del rendimiento sistólico en pacientes con SC activo. Recientemente se ha observado aumento significativo de la fibrosis miocárdica en pacientes con SC activo comparado con controles sanos y con hipertensión arterial, sugiriendo por tanto que el hipercortisolismo podría tener un efecto directo sobre la fibrosis miocárdica independiente de la hipertrofia del ventrículo izquierdo (VI) y de la hipertensión arterial. Parece ser que esta fibrosis es uno de los factores más importantes para el desarrollo de disfunción cardíaca, y también uno de los factores que más condicionará el grado de regresión de la cardiomiopatía observada en el SC20. Se objetivó que a los 18meses del tratamiento exitoso del SC se producía una mejoría de la función sistólica y diastólica del VI en paralelo con una reducción de fibrosis miocárdica.
En un estudio en el que se compararon 15pacientes con SC y disfunción del VI subclínica con 30controles apareados por edad, sexo, fracción de eyección e hipertensión, objetivaron que estas anomalías en la estructura y en la función del VI fueron reversibles a los 18meses después de la normalización del hipercortisolismo21. Un trabajo más reciente observó que los parámetros anormales de la masa ventricular izquierda observados en el 70% de los pacientes con SC activo mejoraron considerablemente durante el seguimiento promedio de 4años tras remisión del hipercortisolismo, aunque seguían siendo mayores que en los controles22. En 25 pacientes con EC se objetivó persistencia del síndrome metabólico, más daño vascular y presencia de mayor número de placas ateroscleróticas en la arteria carótida común comparado con los controles (31,2% vs 6,2%, respectivamente) un año después de la remisión del hipercortisolismo23.
Así pues, tanto el exceso de cortisol como la hipertensión arterial contribuyen a alterar la masa cardíaca y aumentan la prevalencia de daño en los órganos diana. Es necesario subrayar la importancia de controlar la hipertensión arterial y otros factores de riesgo cardiovascular preoperatoriamente para mejorar el pronóstico a largo plazo.
Existe mayor riesgo de trombosis venosa (tromboembolismo) en los pacientes con SC, especialmente en el periodo postoperatorio. En pacientes sometidos a cirugía transesfenoidal por EC se ha visto que el riesgo de tromboembolismo es mayor que en pacientes operados por adenoma hipofisario no funcionante, apuntando hacia el papel del cortisol (o la ACTH) en la alteración de los factores hemostáticos24. Se han visto concentraciones más elevadas de factor viii, factor iv y factor Von Willebrand en los pacientes con SC, así como aumento de la síntesis del inhibidor del activador tisular del plasminógeno tipo1 (PAI-1), el principal inhibidor del sistema fibrinolítico25. Probablemente este riesgo aumentado de trombosis está favorecido no solo por esta hipercoagulabilidad inducida por el hipercortisolismo, sino también por la propia cirugía y la obesidad que presentan la mayoría de estos pacientes. Se ha visto mejoría de los parámetros del sistema hemostático un año después de la cirugía exitosa, aunque la hemostasia no se normaliza de forma completa26. Algunos trabajos sugieren realizar tromboprofilaxis el primer mes después de la cirugía, aunque hacen falta más estudios para evaluar el tiempo necesario para revertir este estado hipercoagulante después de la cirugía curativa.
Hay que tener en cuenta que tanto las deficiencias hormonales asociadas como el tratamiento sustitutivo, y en algunos casos la curación incompleta del SC, pueden estar implicados en estas complicaciones cardiovasculares. Particularmente los pacientes que no presentan hipocortisolismo tras adenomectomía transesfenoidal podrían tener un hipercortisolismo subclínico parecido a lo observado en algunos adenomas suprarrenales (fundamentalmente incidentalomas) donde este hipercortisolismo subclínico se correlaciona con el síndrome metabólico y con el aumento del riesgo cardiovascular27-29
En conclusión, el riesgo cardiovascular puede persistir elevado a pesar del control bioquímico del hipercortisolismo. Estas evidencias justifican que se investigue y trate adecuadamente la enfermedad cardiovascular. Aunque se requieren estudios más amplios para elaborar estrategias de manejo específicas para reducir el impacto cardiovascular negativo de la exposición previa a niveles elevados de cortisol, creemos justificable tratar a estos pacientes como otros de alto riesgo cardiovascular, similar a lo que se hace en la diabetes.
HuesoLa prevalencia de enfermedad ósea, principalmente osteoporosis, es elevada en los pacientes con SC y a menudo infraestimada30. Aproximadamente entre el 30 y el 50% de los pacientes con SC presentan fracturas, sobre todo a nivel vertebral5. Además de la osteoporosis, también se ha reportado osteoartrosis y osteonecrosis en pacientes con SC iatrogénico, pero raramente en pacientes con hipercortisolismo endógeno31-33.
Los glucocorticoides afectan de forma importante el metabolismo óseo disminuyendo la densidad mineral ósea (DMO). De forma directa, disminuyen la síntesis de colágeno y aumentan su degradación, dado que inhiben la acción, la replicación y la diferenciación de los osteoblastos. Asimismo, aumentan la acción y la supervivencia de los osteoclastos encargados de la degradación.
Además, in vivo los osteoblastos expresan 11β-HSD1, lo que amplifica localmente los efectos de los glucocorticoides; por lo tanto es una enzima que tiene implicaciones importantes en la acción de los glucocorticoides en el hueso. Esta pérdida de DMO también puede ser debida en parte a un hipogonadismo secundario y/o a una disminución de la GH o factor de crecimiento insulinoide tipoi (IGF-I) inducidas por el exceso de cortisol.
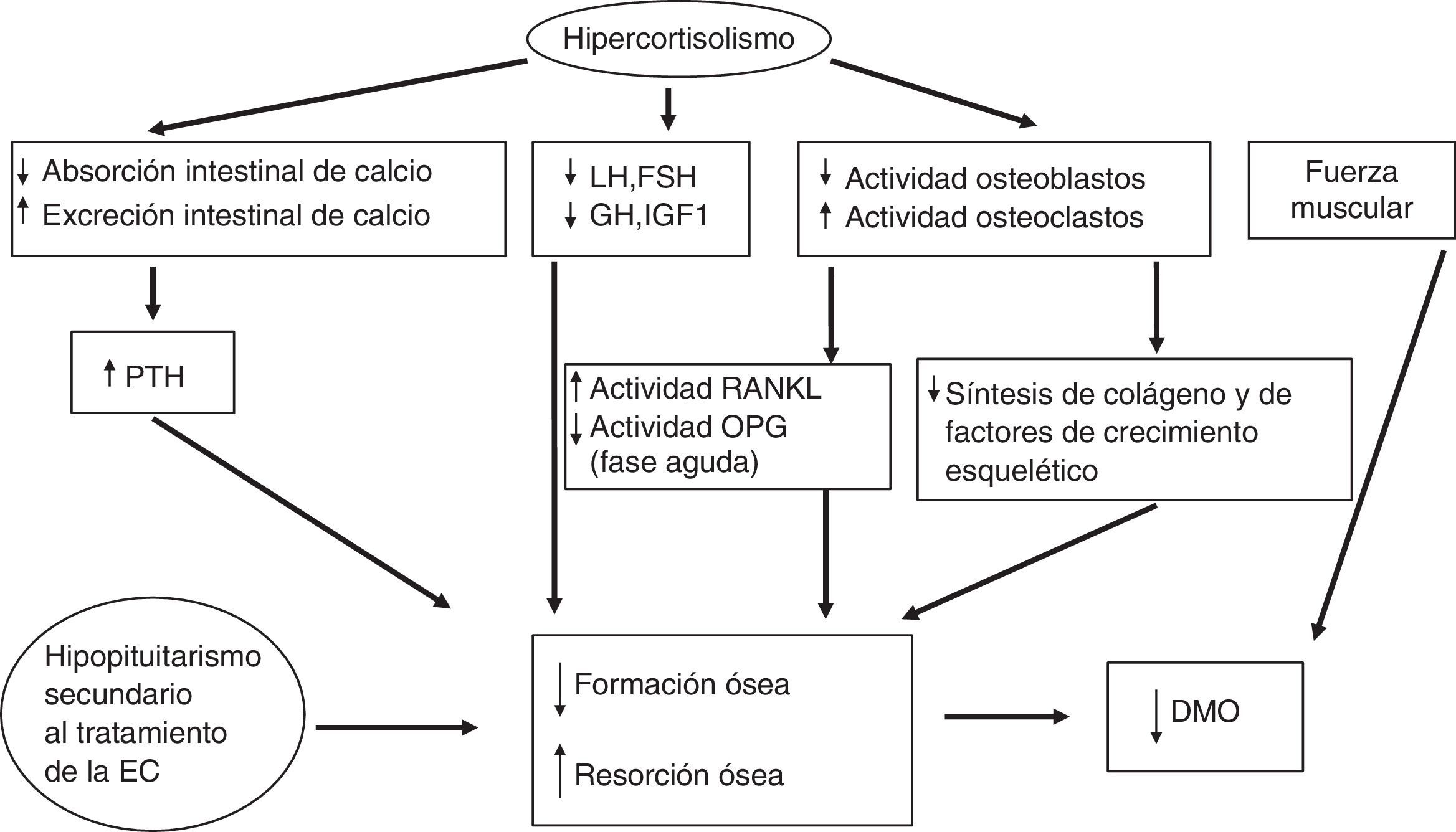
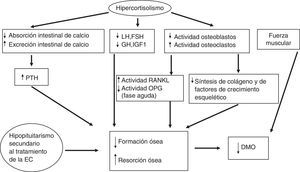
De forma indirecta, los glucocorticoides afectan el metabolismo del calcio, del fosfato, de la vitaminaD y de la parathormona (PTH) (disminuyen su absorción intestinal por un mecanismo independiente a la vitaminaD y la reabsorción renal de calcio, lo que en ambos casos induce un modesto aumento de las concentraciones de PTH); además inducen una pérdida de fuerza y de masa musculares. Uno de los efectos iniciales de los glucocorticoides a nivel celular es el aumento de la producción de RANKL (receptor activator of nuclear factor-kappa B-ligand, que promueve la osteoclastogénesis) y la reducción de la producción de osteoprotegerina (OPG) (un antagonista natural de RANKL)34, aunque en el hipercortisolismo crónico endógeno se han encontrado concentraciones más altas de OPG comparado con controles, manteniéndose elevados tras la normalización del hipercortisolismo especialmente en los pacientes con un riesgo coronario más elevado35,36. El sistema RANKL/OPG actúa como regulador paracrino de la calcificación vascular, dado que también se produce en las células endoteliales, y puede ser un marcador de aterosclerosis subclínica37. Por lo tanto, probablemente estas concentraciones elevadas de OPG en el SC podrían estar más relacionados con el daño cardiovascular que con el estatus del hueso. La fisiopatología de la enfermedad ósea en el SC se detalla en la figura 2.
Patogenia de la enfermedad ósea en la EC.DMO: densidad mineral ósea; EC: enfermedad de Cushing; FSH: hormona foliculoestimulante; GH: hormona del crecimiento; IGF-1: factor de crecimiento insulinoide tipoi; LH: hormona luteotropina; OPG: osteoprotegerina; PTH: hormona paratiroidea; RANKL: receptor activator of nuclear factor-kappa B-ligand.
Esta pérdida de masa ósea inducida por exceso de cortisol se ha visto que es más prominente en el hueso trabecular, presente en la columna lumbar o en el cuello femoral38. De hecho, los pacientes con SC tienen una predisposición especial a sufrir fracturas vertebrales que se presentan con dolor abdominal o disminución de la talla debido a compresión vertebral. No es raro que la DMO refleje valores inapropiadamente elevados en la columna.
La mayoría de trabajos describen una recuperación parcial de la DMO después del tratamiento del SC, aunque las series son pequeñas y el seguimiento mediano relativamente corto (no más de 2años). La serie con un seguimiento más largo después de la remisión del hipercortisolismo (seguimiento medio de 11años) observó disminución de la DMO en mujeres estrógeno-suficientes comparado con controles apareados por edad, sexo e IMC, pero no en las estrógeno-deficientes (por menopausia o hipogonadismo). Esto sugiere que el efecto protector de los estrógenos en la masa ósea se pierde con el hipercortisolismo. El tiempo de exposición previa al exceso de cortisol endógeno y la duración del tratamiento sustitutivo postoperatorio con glucocorticoides fueron predictores de la baja DMO39. Asimismo, la persistencia de una disminución de osteocalcina, tras la remisión del hipercortisolismo, sugiere que la actividad osteoblástica está disminuida, lo que favorecería la no recuperación completa de la DMO.
Además, se ha visto que el hipercortisolismo puede frenar el pico normal de masa ósea en un paciente en crecimiento, contribuyendo a un aumento de fracturas osteoporóticas incluso a largo plazo después de la remisión en jóvenes «curados» de un SC40. Probablemente son necesarias terapias adicionales para intentar maximizar el pico de masa ósea en pacientes que han presentado su SC en la infancia o adolescencia para minimizar los efectos secundarios a largo plazo.
Otras evidencias sugieren que las alteraciones en la masa ósea pueden ser reversibles después de remitir el hipercortisolismo. Es probable que en parte esto sea debido a que el tiempo de exposición previo a hipercortisolismo endógeno fuera inferior que en otros trabajos38,41. Un estudio prospectivo a largo plazo reporta que la DMO está incluso más aumentada después de la remisión del hipercortisolismo comparado con la situación basal de enfermedad activa, y que esta mejoría se mantiene con los años de la remisión del hipercortisolismo (seguimiento medio de 71meses)38. La recuperación de la DMO se correlaciona de forma positiva con el aumento de los niveles de osteocalcina y del telopéptido C terminal del colágeno tipo1 (CTX-1), marcadores de recambio óseo (r=0,92; p<0,001). Se especula sobre los mecanismos que determinan la recuperación de la DMO. Algunos lo atribuyen a un aumento de las concentraciones de osteocalcina al normalizar los glucocorticoides, y a la preservación de la arquitectura trabecular, a pesar del adelgazamiento inducido por los corticoides, de manera que los osteoblastos puedan seguir sintetizando hueso nuevo; esto no ocurre en la pérdida de hueso trabecular por otras causas de osteoporosis42.
En resumen, la recuperación de la DMO en la mayoría de los casos parece ser solo parcial en los pacientes con SC «curados»; especialmente en pacientes jóvenes que aún no han completado el crecimiento, la hipercortisolemia ejerce un efecto muy negativo sobre el hueso. Se carece de estudios amplios que evalúen la aparición de fracturas a largo plazo en pacientes diagnosticados de SC.
RiñónSe ha descrito la presencia de nefrolitiasis en la mitad de los pacientes con SC activo y en casi el 30% de los pacientes curados, una prevalencia muy superior a la población general43. La patogenia de la nefrolitiasis en el SC no está del todo clara. En parte podría ser consecuencia de la hipercalciuria. Probablemente exista un efecto sinérgico de diferentes alteraciones metabólicas y hemodinámicas producidas por el hipercortisolismo. De hecho, en los pacientes con litiasis renal se ha objetivado una mayor prevalencia de obesidad, hipertensión arterial y diabetes mellitus, condiciones muy frecuentes en el SC. Además, la excreción urinaria aumentada de ácido úrico y cistina son factores que favorecen la nefrolitiasis, y ambas pueden ser consecuencia del exceso de glucocorticoides44. En una serie larga donde investigan el papel de los diferentes factores litogénicos conocidos en pacientes con hipercortisolismo, observan que la hipertensión arterial y la excesiva excreción urinaria de ácido úrico son factores de riesgo independientes para presentar nefrolitiasis43.
Función cognitiva y comportamientoEl hipercortisolismo crónico se ha relacionado con alteraciones de la memoria, del comportamiento, del aprendizaje verbal y del lenguaje, de la actividad neuronal, y con otros procesos del sistema nervioso central. Además, estados psicopatológicos como la ansiedad, la depresión y la manía son muy prevalentes en los pacientes con SC activo, siendo la depresión mayor el trastorno más frecuente, con una prevalencia de entre el 54 y el 81% según las series45.
A pesar de que la literatura que evalúa la psicopatología después del tratamiento quirúrgico efectivo es escasa, se observa que la mayoría de las alteraciones mejoran al año después de la remisión del hipercortisolismo, aunque no parecen del todo reversibles a largo plazo46,47.
El hipocampo, la amígdala y la corteza cerebral, importantes estructuras implicadas en la función cognitiva y emocional, son muy ricos en receptores de glucocorticoides. Por lo tanto, son regiones particularmente vulnerables al exceso de cortisol. La patogenia de la pérdida de volumen cerebral inducida por concentraciones elevadas de glucocorticoides probablemente es multifactorial, desde la muerte celular inducida por los glucocorticoides, la interferencia con procesos de transmisión y metabolismo neuronal, hasta la disminución del contenido acuoso cerebral2. Los glucocorticoides pueden ocupar receptores tanto de mineralocorticoides como de glucocorticoides. El 11β-HSD2 (que convierte el cortisol en una molécula de cortisona inactiva) no se expresa en el hipocampo ni en otras estructuras límbicas, permitiendo por tanto, una activación sostenida de los receptores de mineralocorticoides por los glucocorticoides. En situaciones de niveles suprafisiológicos de glucocorticoides (donde ambos receptores están ocupados) se produce una disminución de la excitabilidad celular y una atrofia reversible de las dendritas apicales de las neuronas piramidales. Pero si el hipercortisolismo persiste, como ocurre en el hipercortisolismo endógeno, puede conducir a la muerte celular46.
En estudios con RM cerebrales de alto campo (3Teslas) se ha objetivado mayor atrofia cerebral comparada con controles normales de la misma edad, que no es totalmente reversible a pesar de la normalización del cortisol48. Se ha visto disminución del volumen del hipocampo en el 27% de los pacientes con SC activo comparado con los controles, con una correlación negativa con los niveles de cortisol en plasma. Este menor volumen del hipocampo se asoció a disfunciones en la memoria. De forma interesante, el volumen del hipocampo mejoró al año después de la cirugía comparado con la situación basal, y en algunos de estos pacientes se objetivó mejoría en los tests de función cognitiva49. Por otra parte, los glucocorticoides aumentan la acumulación sináptica de glutamato, confiriendo un estado de mayor susceptibilidad a las agresiones y muerte celular. Teniendo en cuenta que la dexametasona es muy potente para el tratamiento del edema cerebral, podría ser que esta pérdida de volumen en el SC fuera en parte secundaria a una disminución del contenido acuoso del tejido cerebral por el exceso de glucocorticoides46.
Recientemente, una serie larga de 74pacientes con EC con un seguimiento medio después de la remisión de 13años presentó peores resultados en términos de memoria y función ejecutiva comparado con controles apareados por edad, sexo y nivel educativo; también tuvieron peor rendimiento que pacientes intervenidos por macroadenoma hipofisario no funcionante. Los resultados mejoraron a mayor tiempo de remisión del hipercortisolismo. El hipopituitarismo y el tratamiento sustitutivo con hidrocortisona fueron predictores independientes de peores resultados en los tests cognitivos50. En la misma línea, otro trabajo reciente ha objetivado afectación de la memoria visual y verbal y atrofia cerebral (disminución del volumen de la materia gris total y cortical) en pacientes con SC en remisión comparado con controles. El subgrupo de pacientes con peores resultados en los tests de memoria también tenían una reducción significativa del volumen del hipocampo48.
El exceso de cortisol se ha asociado a alteraciones en algunos neurotransmisores, como disminución de la síntesis cerebral de serotonina, aumento de la actividad noradrenérgica y concentraciones bajas de ácido 5-hidroxiindolacético en líquido cefalorraquídeo, todos ellos relacionados con la patogenia de la depresión51. Doce meses después de la corrección del hipercortisolismo se observa persistencia de psicopatía (principalmente depresión atípica) en el 24% de los pacientes, aunque durante la fase activa de la enfermedad se registró psicopatía en el 66% de los casos. El pánico y las ideas suicidas aumentaron durante el seguimiento. También se han reportado trastornos adaptativos de la personalidad después del tratamiento de la SC, aunque no en todas las series52.
Todo ello sugiere que la exposición previa y crónica a concentraciones altas de glucocorticoides y la persistencia de alteraciones en el eje HHA después del restablecimiento del eucortisolismo pueden aumentar la vulnerabilidad individual a agentes estresantes53. No obstante, para tener conclusiones definitivas hacen falta más estudios con más pacientes, dado que la mayoría son series limitadas y características clínicas heterogéneas.
Podemos concluir que el SC se asocia a elevada prevalencia de psicopatología, principalmente depresión atípica. La exposición previa y crónica a niveles excesivamente elevados de cortisol puede tener efectos irreversibles en las estructuras del sistema nervioso central (principalmente en las áreas de función cognitiva y comportamiento).
Enfermedades autoinmunitariasLos glucocorticoides ejercen una acción inhibidora sobre el sistema inmunitario. De hecho, en la fase activa del SC existe una involución del tejido linfoide y una linfopenia con un aumento de la susceptibilidad a las infecciones.
Se ha descrito una situación opuesta después de la remisión del hipercortisolismo, donde se objetivada una exacerbación de enfermedades autoinmunitarias previamente existentes. La enfermedad celíaca, la artritis reumatoide, el desarrollo de sarcoidosis o el lupus eritematoso han sido descritos en distintas formas de SC tras de la corrección del hipercortisolismo54. De todas formas, la enfermedad autoinmunitaria más frecuentemente descrita es la tiroidits autoinmunitaria (enfermedad de Graves o tiroiditis de Hashimoto). Se objetivó una mayor positividad en la autoinmunidad tiroidea en el 35% de los pacientes «curados» de una EC comparado con los controles (10%). Parece ser que el desarrollo de enfermedad autoinmunitaria es más frecuente en los pacientes que presentan bocio multinodular o anticuerpos antitiroideos positivos durante la fase activa de la enfermedad, sugiriendo que las anomalías tiroideas preexistentes y una predisposición genética a la autoinmunidad son factores para el futuro desarrollo de trastornos autoinmunitarios de la tiroides después de la normalización del cortisol55.
La exacerbación de enfermedades autoinmunitarias parece estar relacionada con una mejoría de la actividad inmunitaria, suprimida por el hipercortisolismo endógeno durante la fase activa de la enfermedad; por ello conviene recordar que tras la remisión del SC puede «reaparecer» una enfermedad inmunitaria, silente durante la fase activa del SC.
Calidad de vida relacionada con la saludLa calidad de vida en los pacientes con SC está reducida en la enfermedad activa si se los compara con controles sanos y con pacientes con otros adenomas hipofisarios sin hipercortisolismo. Aunque tras la remisión bioquímica mejora la calidad de vida, no se normaliza del todo, incluso a largo plazo.
En una revisión reciente sobre epidemiología, tratamiento y consecuencias de haber sufrido una EC se describe que la CVRS está comprometida a pesar de la remisión de la enfermedad4. En otro estudio con 58pacientes curados de SC, con un promedio de remisión de 13años, se objetivó con cuestionarios genéricos peor CVRS comparado con el grupo control, en términos de fatiga, aspectos físicos, ansiedad, depresión y percepción de bienestar, especialmente en aquellos con hipopituitarismo asociado56,57. No objetivaron relación con el grado inicial de hipercortisolismo56.
Recientemente se ha elaborado una CVRS específica para el SC (CushingQoL), que incorpora los aspectos que más afectan y preocupan a los pacientes con SC. El marco temporal se refiere a las 4semanas previas. En 125pacientes con SC, algunos con enfermedad activa, otros en remisión o insuficiencia adrenal secundaria al tratamiento, se observó que el hipercortisolismo activo (con cortisoluria elevada) y el sexo femenino fueron los mayores predictores de baja CVRS. No observaron relación entre la CVRS y el tiempo transcurrido desde la cirugía curativa, ni con la presencia de hipopituitarismo, sugiriendo que probablemente las dimensiones evaluadas con el CushingQoL están más relacionadas con el hipercortisolismo que con las otras alteraciones hormonales. Estas alteraciones fueron independientes del origen del SC (adrenal o hipofisario)58. Recientemente se ha confirmado que el cuestionario CushingQoL tiene buenas propiedades psicométricas y sensibilidad al cambio para detectar cambios en condiciones de práctica clínica diaria59.
En pacientes con déficit de GH en tratamiento sustitutivo con GH recombinante humana y EC en remisión se ha observado no solo mejoría de los parámetros metabólicos, sino también de la CVRS a los 3años de haber iniciado tratamiento con GH17. La afectación de la CVRS en pacientes con EC y déficit de GH es mayor que en aquellos con déficit de GH de otras etiologías. Esto sugiere que la exposición previa a hipercortisolismo es un factor de gran impacto sobre la CVRS, más que otras disfunciones hormonales60.
Esta afectación de la CVRS, incluso años después del tratamiento, tiene consecuencias sociales y económicas. En una entrevista con 74pacientes con SC tratados, únicamente el 46% se sentían completamente recuperados, el 81% fueron capaces de volver al trabajo, pero al 11% se les concedió la invalidez permanente61.
Se concluye que a pesar de la reversibilidad del hipercortisolismo, la calidad de vida permanece alterada en pacientes tratados de SC, persistiendo alteraciones físicas y psicológicas, así como cambios metabólicos y cognitivos.
MortalidadEl SC es una enfermedad potencialmente letal. La EC no tratada se asocia a una supervivencia estimada del 50% a los 5años62. Varios estudios han reportado una mortalidad aumentada entre 2 y 5veces, comparada con la población de referencia, principalmente debido a causas cardiovasculares16,63,64. Un metaanálisis sobre la mortalidad en el SC publicado recientemente observa que la tasa media de mortalidad debida a EC (Standard Mortality Rate [SMR]) es de 1,84 (IC95%: 1,28-2,65). En pacientes con EC persistente después de la cirugía la SMR es de 3,73 (IC95%: 2,31-6,01), mientras que en pacientes con remisión completa tras la cirugía, su tasa de mortalidad no difiere de la de la población general (SMR: 1,23; IC95%: 0,51-2,97)64. Esta mortalidad está especialmente aumentada el primer año después de la cirugía en los pacientes sin curación inicial posquirúrgica, y en general a mayor tiempo de exposición al hipercortisolismo65. Estos resultados han sido confirmados por la mayor serie quirúrgica publicada hasta el momento, en la que se describen 31muertes en 285pacientes con EC durante un seguimiento medio de 11,1años. Comparados con la población normal, los pacientes con enfermedad persistente a pesar del tratamiento mueren con más frecuencia. Además, la supervivencia va disminuyendo a lo largo de los años en aquellos con enfermedad activa. Esto sugiere que debe intentarse conseguir la corrección del hipercortisolismo cuanto antes, para evitar comorbilidades y disminuir la mortalidad66.
Otro metaanálisis reciente, en el que evalúan únicamente pacientes con EC a lo largo de 50años, encuentra una mortalidad global que duplica la de la población general (SMR: 2,2; IC95%: 1,45-3,41), tanto en pacientes con enfermedad activa como en remisión. En los pacientes en remisión no encontraron diferencias en la mortalidad (SMR: 1,2; IC95%: 0,45-3,2) con respecto a la población general, pero sí en los pacientes con enfermedad activa (SMR: 5,5; IC95%: 2,7-11,3). En una cohorte de 60pacientes con un seguimiento medio de 15años se objetivaron 13defunciones, 9 de las cuales fueron por causas cardiovasculares, mayor de lo esperado en la población general (SMR 13,8; IC95%: 7,2-36,5). La presencia de enfermedad activa, mayor edad al diagnóstico, hipertensión y coexistencia de diabetes fueron los mayores determinantes de la mortalidad en esta serie67.
Desde la utilización de la cirugía transesfenoidal estas tasas de mortalidad han mejorado sustancialmente. De todas formas, la normalización del cortisol puede no ser suficiente para normalizar la mortalidad, ya que pueden coexistir otros factores de riesgo como hipopituitarismo, la propia cirugía o la persistencia de factores de riesgo cardiovascular.
La edad al diagnóstico y durante el seguimiento de la mayoría de los pacientes incluidos en los estudios oscila entre los 40 y los 60 años. Además, la mayor edad al diagnóstico se relaciona con un peor pronóstico67. Por ello, sería recomendable prolongar el seguimiento de estos pacientes más allá de 30años, para confirmar si la remisión del hipercortisolismo es compatible con la longevidad de la población general. Puesto que la mayoría de estos estudios están realizados con pocos pacientes —dada la rareza del SC—, con un número bajo de muertes y un tiempo de seguimiento variable, deben ser interpretados con cautela, si bien debe hacer reflexionar sobre el peor pronóstico aparente de los pacientes con SC curado.
En resumen, la tasa de mortalidad en los pacientes con EC «curados» podría ser similar a la de la población general, al menos tras 10 a 20años de seguimiento. Sin embargo, existen evidencias recientes que objetivan mayor riesgo cardiovascular persistente en los pacientes aparentemente «curados» de SC, por lo que parece recomendable tratarlos como pacientes de alto riesgo, implementado medidas profilácticas, como se hace en la diabetes mellitus.
ConclusionesEl hipercortisolismo persistente en el SC se asocia a un elevado número de complicaciones metabólicas, cardiovasculares y cognitivas, solo parcialmente reversibles después de la remisión del exceso de cortisol. Esto conlleva un deterioro en la calidad de vida a pesar de haber pasado años en remisión.
La monitorización crónica a largo plazo es obligatoria para controlar las comorbilidades y aclarar si la persistencia del riesgo metabólico y cardiovascular elevado tiene impacto en la supervivencia de estos pacientes diagnosticados de SC.
Dada la rareza del SC, sería deseable llevar a cabo estudios multicéntricos epidemiológicos exhaustivos que permitan conocer la causa de muerte y la morbilidad en estos pacientes, o estudios prospectivos como el del Registro Europeo de Síndrome de Cushing (ERCUSYN), que actualmente incluye más de 800pacientes. Solo de esta manera se podrá conocer en detalle el pronóstico a largo plazo y el desenlace final de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.