Obtener valores de referencia local de lípidos sanguíneos y presión arterial (PA), y determinar la prevalencia de síndrome metabólico (SM) en escolares y adolescentes de la ciudad de Mérida, Venezuela, y comparar resultados usando puntos de corte propios e internacionales.
Materiales y métodosParticiparon 916 estudiantes de 9 a 18 años de edad, de ambos sexos, provenientes de instituciones educativas. Se obtuvieron datos demográficos, antropométricos y de PA. Se cuantificaron glucemia en ayunas y perfil lipídico. Los valores de los lípidos y la PA se distribuyeron por percentiles (pc), según grupos de edad y sexo. Para el diagnóstico de SM se consideraron 2 clasificaciones, la del NCEP-ATP III-modificada por Cook et al. y la de la Federación Internacional de Diabetes, usando los pc de Mérida y de EE. UU. como puntos de corte. La concordancia entre ambas clasificaciones se estimó con el índice kappa (κ).
ResultadosLa prevalencia de SM fue del 2,2% por Cook-pc Mérida, frente al 1,8% por Cook-pc EE. UU., concordancia moderada (κ=0,54). La concordancia entre Cook et al. e IDF, usando pc Mérida, fue débil (κ=0,28). Usando los pc Mérida hubo mayor frecuencia de obesidad abdominal, hipertrigliceridemia y PA elevada, y menos de cHDL bajo. El riesgo (odds ratio) de presentar SM es mayor si la obesidad abdominal está presente (OR: 98,63; IC: 22,45-433,35; p=0,0001). El SM fue significativamente más frecuente en los obesos (18,3%; p=0,0001).
ConclusionesLa prevalencia de SM en esta muestra de niños y adolescentes fue del 2,2%. Los valores de lípidos y de PA fueron más bajos que los norteamericanos, europeos y asiáticos, y similares a los latinoamericanos. Se justifica la obtención de valores propios de referencia para diagnóstico certero de SM, así como un consenso mundial sobre sus criterios diagnósticos.
To obtain local reference values for blood lipids and blood pressure (BP), and to determine the prevalence of metabolic syndrome (MS) in children and adolescents from Mérida, Venezuela, and to compare results using local and international cut-off values.
Materials and methodsThe study enrolled 916 participants of both sexes aged 9-18 years of age from educational institutions. Demographic, anthropometric, and BP data were collected. Fasting blood glucose and lipid profile were measured. Percentile distribution of lipid and BP values was done by age group and sex. Prevalence of MS was estimated based on the NCEP-ATPIII classification (as modified by Cook et al.) and the classification of the International Diabetes Federation, using percentiles of Mérida and the USA as cut-off points. Agreement between both classifications was estimated using the kappa test (κ).
ResultsPrevalence of MS was 2.2% by Cook-Merida percentiles, as compared to 1.8% by Cook-USA percentiles, a moderate agreement (κ=0.54). Agreement between Cook et al. and IDF using Merida percentiles was weak (κ=0.28). There was a higher frequency of abdominal obesity, hypertriglyceridemia and hypertension, and a lower frequency of low HDL-C using Mérida percentiles. The risk (odds ratio) of having MS is greater if abdominal obesity exists (OR: 98.63, CI: 22.45-433.35, p=0.0001). MS was significantly more common in obese subjects (18.3%, p=0.0001).
ConclusionsPrevalence of MS in this sample of children and adolescents was 2.2%. Lipid and BP values were lower in Venezuelan as compared to US, European, and Asian children and adolescents, and similar to those in Latin-American references. Own reference values are required for accurate diagnosis of MS, as well as a worldwide consensus on its diagnostic criteria.
El síndrome metabólico (SM) se define como un grupo de anormalidades metabólicas presentes en un individuo, que conllevan una mayor frecuencia de enfermedad cardiovascular arteriosclerótica y diabetes mellitus tipo 21. Esta condición afecta a adultos y jóvenes y existe evidencia de que la presencia de factores de riesgo cardiovascular en la infancia se asocia con el desarrollo de enfermedad arterial coronaria en la etapa adulta2,3.
Debido al incremento en la prevalencia de sobrepeso y obesidad en la población pediátrica en las últimas 2 décadas, y al rápido incremento en la incidencia de diabetes mellitus tipo 2 en este grupo etario, se ha considerado pertinente establecer criterios de SM apropiados a esta población para predecir complicaciones en la edad adulta4. Existen controversias entre las diferentes clasificaciones y los puntos de corte que deben utilizarse para cada uno de los componentes del SM en niños, lo que ha ocasionado confusión y dificultad para comparar estudios entre poblaciones y establecer las implicaciones clínicas a largo plazo de este síndrome5.
Aunque los componentes del SM en niños y adolescentes son los mismos que se describen en adultos (obesidad, hipertrigliceridemia, bajo nivel de colesterol de la lipoproteína de alta densidad [cHDL], hipertensión arterial [HTA] y alteración del metabolismo de los hidratos de carbono), diversos estudios cuestionan la aplicación de los valores límites recomendados para adultos en la población pediátrica, ya que no consideran la dinámica del crecimiento y maduración de los niños, el efecto de los cambios hormonales de la pubertad en la secreción y sensibilidad a la insulina, las variaciones en el perfil de lípidos, el impacto de la herencia familiar y la etnia, variables que hacen que los criterios en niños sean difíciles de establecer6–8.
Una revisión de la literatura realizada por Ford y Li9 muestra que en los últimos años se han desarrollado innumerables definiciones de SM para niños y adolescentes, con el inconveniente de que muchos autores optan por desarrollar su propia definición aunque con características muy similares a las propuestas por el Programa Nacional de Educación del Colesterol (NCEP)10–16, que han sido empleadas en estudios comparativos con resultados diversos. Adicionalmente, muchos países no cuentan con referencias propias para medidas antropométricas o de lípidos por lo que utilizan los valores internacionales o de otros países para los diferentes percentiles (pc), lo cual puede dar resultados de frecuencia de SM diferentes a la realidad, independientemente del criterio utilizado. De allí la importancia de conocer los patrones de distribución normal de una determinada característica en la población, dependiendo de la edad y género, y usar puntos de corte que correspondan a los valores de referencia local o regional para los diferentes componentes del SM17. En Venezuela se dispone de valores de referencia para medidas antropométricas, presión arterial (PA), colesterol total (Ct) y triglicéridos (Tg), sin embargo, fueron tomados de una población infantil en el año 199318; se espera su actualización. No se dispone de valores de referencia nacional para circunferencia de cintura (CC), colesterol de la lipoproteína de baja densidad (cLDL), cHDL y colesterol no HDL, de gran importancia para detectar tempranamente el posible riesgo cardiometabólico de nuestros niños y adolescentes, y así realizar las intervenciones preventivas necesarias.
La ausencia de una clasificación estándar hace que la prevalencia de SM en la población de niños y adolescentes varíe ampliamente según los criterios utilizados. Así, en EE. UU., Cook et al.11 obtuvieron una prevalencia del 4,2% y de Ferranti et al.12, con criterios más estrictos, obtuvieron un 9,2%. En Latinoamérica, un estudio en Chile19 encontró una prevalencia de SM del 4% en los niños con sobrepeso y del 30% en los obesos. En Venezuela, en una evaluación de 370 niños entre 7 y 9 años de la ciudad de Mérida, se obtuvo una frecuencia de SM del 0,4% en niños con normopeso y del 38,9% en niños obesos20.
Dado que las diferencias en estilo de vida y/o determinantes genéticos son responsables de las variaciones en los valores de referencia entre las diversas poblaciones12,13, y en vista de las discrepancias que existen en la definición de SM en este grupo etario, en el cual el diagnóstico precoz y la intervención temprana mejorarían hipotéticamente la calidad de vida de los individuos en riesgo, se realizó un estudio poblacional en niños y adolescentes del Municipio Libertador de Mérida-Venezuela, para obtener valores de referencia propios y actualizados de PA y lípidos sanguíneos, así como para determinar la prevalencia de SM utilizando las clasificaciones más aceptadas para este fin y determinar si existen diferencias al utilizar puntos de corte locales en comparación con los puntos de corte internacionales para los diferentes componentes.
Materiales y métodosSujetosSe realizó un estudio observacional, analítico, de corte transversal. La muestra de este estudio formó parte del proyecto denominado «Evaluación del Crecimiento, Desarrollo y Factores de Riesgo Cardiometabólico en Escolares y Adolescentes de Mérida-Venezuela (CREDEFAR)», que se llevó a cabo en el Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) desde marzo de 2010 hasta junio de 2011, con la participación de los servicios de Endocrinología, de Nutrición, Crecimiento y Desarrollo Infantil y de Nutrición Clínica. La población y muestreo fueron explicados en una publicación anterior del estudio CREDEFAR21. Se obtuvo una muestra representativa de 927 niños y adolescentes de 9 a 18 años, provenientes de 8 instituciones públicas y 5 privadas del Municipio Libertador de la ciudad de Mérida. Se incluyeron aquellos cuyos padres, luego de haber leído el folleto informativo, aceptaron su participación en el estudio y firmaron el consentimiento informado. Se excluyeron 11 individuos, una embarazada, uno con diabetes tipo 1, 2 con talla baja en tratamiento con hormona de crecimiento, un sujeto con desnutrición crónica, uno con parálisis cerebral, 2 con antecedente de haber recibido metformina y 3 por tener los datos antropométricos incompletos. La muestra definitiva fue de 916 sujetos, la cual es superior a la estimada para esta investigación, que fue de 67 sujetos por año de edad, esto es 603 individuos; el cálculo se realizó usando la frecuencia de 4,6% de SM, obtenida en estudio anterior en nuestra ciudad en niños de 7 a 9 años de edad20, un error alfa de 0,05 y una población aproximada por año de edad de 4.000 sujetos, obtenida de la zona educativa regional.
ProcedimientoUna vez obtenida la autorización del Instituto Educativo correspondiente, los participantes fueron citados con su representante en el IAHULA donde se tomaron datos demográficos y se interrogó sobre antecedentes personales y familiares de enfermedad cardiovascular. Se realizó examen físico que incluyó la determinación de peso, talla, PA y CC. Se calculó el índice de masa corporal (IMC) según la fórmula IMC=peso (kg)/talla2 (m). Luego de 10h de ayuno se tomó una muestra de sangre venosa en la región antecubital del brazo para determinar la concentración de glucemia en ayunas (GA) y lipidograma.
Los datos antropométricos se obtuvieron con el participante en ropa interior y descalzo, siguiendo las normas y técnicas descritas por la Nacional Health and Nutrition Examination Survey del 200022, fueron pesados en una balanza estándar y la talla se determinó con el estadiómetro de Harpenden con el promedio de 3 medidas consecutivas. La CC fue medida con una cinta métrica inextensible a la mitad de la distancia entre el reborde costal y la cresta ilíaca (espina ilíaca anterosuperior) en bipedestación y espiración. Se registró la PA con un esfigmomanómetro de mercurio, en el brazo derecho extendido y con el sujeto sentado, prestando atención en mantener el cero a la altura de la aurícula derecha, con un manguito apropiado que cubriera completamente o por lo menos el 80% de la circunferencia del brazo sin sobrepasarlo y los dos tercios de la longitud del brazo.
La determinación de la glucemia, Tg, Ct y cHDL se realizó por métodos enzimáticos con reactivos de la casa comercial CIENVAR y autoanalizador HITACHI 911. El cHDL se separó de las otras lipoproteínas presentes en el suero por precipitación de las lipoproteínas de baja y muy baja densidad (LDL y VLDL) y de los quilomicrones con un reactivo precipitante formado por ácido fosfotúngstico e iones de magnesio, quedando en el sobrenadante solo el cHDL. El cLDL se calculó mediante la fórmula de Friedewald: cLDL=Ct−(Tg/5+cHDL). Los análisis se realizaron en el Laboratorio de Hormonas del IAHULA. Se cumplieron las normas éticas contempladas en la Declaración de Helsinki.
Categorización de las variables- -
Para el estado nutricional se utilizaron las curvas para niños y adolescentes venezolanos realizadas por FUNDACREDESA23 y se consideró: obesidad si el IMC era>pc 97, sobrepeso si era>pc 90 y≤pc 97, normopeso si el IMC se encontraba entre pc 10 y 90, y bajopeso si el IMC era<pc 10 para la edad y sexo. Además se obtuvo la frecuencia de sobrepeso y obesidad usando la definición de Cole et al.24 con el objeto de poder comparar a nivel internacional.
- -
Para el diagnóstico de SM se consideraron 2 clasificaciones, la de la ATP III-modificada por Cook et al.11 y la de la Federación Internacional de Diabetes (IDF) 200716. Los criterios de Cook et al. fueron: CC (cm)>pc 90 para edad y sexo, PA sistólica y diastólica (mm Hg)>pc 90 para edad y sexo, Tg (mg/dL)>pc 90 para edad y sexo, cHDL (mg/dL)<pc 10 para edad y sexo y GA≥100mg/dL. Los criterios según la IDF para sujetos de 9 a 16 años fueron: CC (cm)>pc 90 para edad y sexo, PA sistólica≥130 y/o diastólica≥85mm Hg, Tg≥150mg/dL, cHDL<40mg/dL y GA≥100mg/dL; para mayores de 16 años los criterios fueron: CC>90cm en hombres y>80cm en mujeres, PA sistólica≥130 y/o diastólica≥85mm Hg, Tg≥150mg/dL, cHDL<40mg/dL en hombres y<50mg/dL en mujeres y GA≥100mg/dL. Se diagnosticaron con SM según Cook et al. cuando cumplían al menos 3 criterios diagnósticos, y según IDF cuando tenían obesidad abdominal como criterio preestablecido más 2 criterios adicionales.
Para comparar los resultados utilizando referencias locales frente a referencias internacionales, se dividió la clasificación de Cook et al. en:
- •
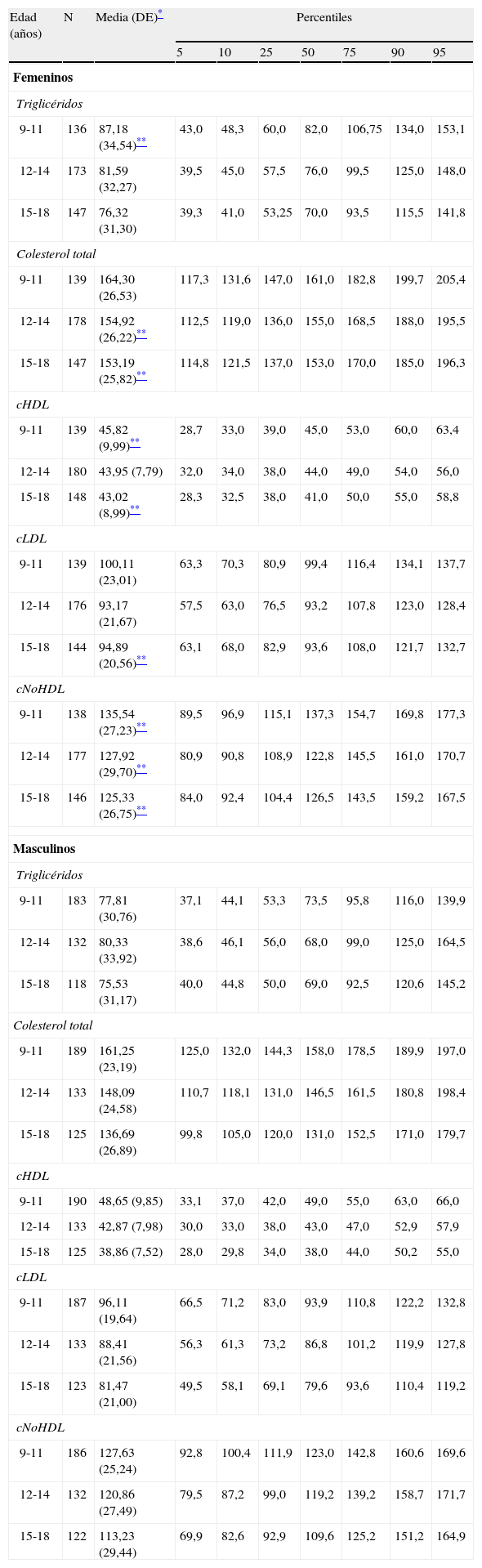
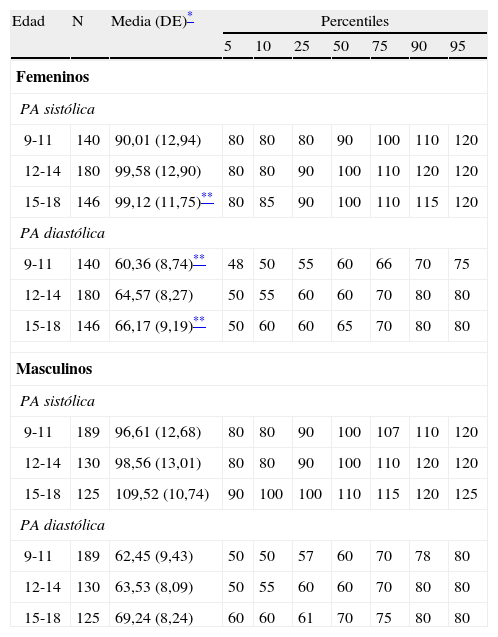
Cook-pc Mérida: utilizando para CC21, Tg, cHDL y PA los puntos de corte obtenidos en la distribución de la muestra de niños y adolescentes participantes en este estudio (CREDEFAR). En la tabla 1 se muestra la distribución percentilar de los lípidos sanguíneos por grupos de edad y sexo y, en la tabla 2 se presenta la distribución percentilar de la PA por grupos de edad y sexo.
Tabla 1.Distribución en percentiles de los niveles séricos de lípidos sanguíneos (mg/dL) por grupos de edad y sexo en los niños y adolescentes del Municipio Libertador de Mérida, Venezuela (estudio CREDEFAR)
Edad (años) N Media (DE)* Percentiles 5 10 25 50 75 90 95 Femeninos Triglicéridos 9-11 136 87,18 (34,54)** 43,0 48,3 60,0 82,0 106,75 134,0 153,1 12-14 173 81,59 (32,27) 39,5 45,0 57,5 76,0 99,5 125,0 148,0 15-18 147 76,32 (31,30) 39,3 41,0 53,25 70,0 93,5 115,5 141,8 Colesterol total 9-11 139 164,30 (26,53) 117,3 131,6 147,0 161,0 182,8 199,7 205,4 12-14 178 154,92 (26,22)** 112,5 119,0 136,0 155,0 168,5 188,0 195,5 15-18 147 153,19 (25,82)** 114,8 121,5 137,0 153,0 170,0 185,0 196,3 cHDL 9-11 139 45,82 (9,99)** 28,7 33,0 39,0 45,0 53,0 60,0 63,4 12-14 180 43,95 (7,79) 32,0 34,0 38,0 44,0 49,0 54,0 56,0 15-18 148 43,02 (8,99)** 28,3 32,5 38,0 41,0 50,0 55,0 58,8 cLDL 9-11 139 100,11 (23,01) 63,3 70,3 80,9 99,4 116,4 134,1 137,7 12-14 176 93,17 (21,67) 57,5 63,0 76,5 93,2 107,8 123,0 128,4 15-18 144 94,89 (20,56)** 63,1 68,0 82,9 93,6 108,0 121,7 132,7 cNoHDL 9-11 138 135,54 (27,23)** 89,5 96,9 115,1 137,3 154,7 169,8 177,3 12-14 177 127,92 (29,70)** 80,9 90,8 108,9 122,8 145,5 161,0 170,7 15-18 146 125,33 (26,75)** 84,0 92,4 104,4 126,5 143,5 159,2 167,5 Masculinos Triglicéridos 9-11 183 77,81 (30,76) 37,1 44,1 53,3 73,5 95,8 116,0 139,9 12-14 132 80,33 (33,92) 38,6 46,1 56,0 68,0 99,0 125,0 164,5 15-18 118 75,53 (31,17) 40,0 44,8 50,0 69,0 92,5 120,6 145,2 Colesterol total 9-11 189 161,25 (23,19) 125,0 132,0 144,3 158,0 178,5 189,9 197,0 12-14 133 148,09 (24,58) 110,7 118,1 131,0 146,5 161,5 180,8 198,4 15-18 125 136,69 (26,89) 99,8 105,0 120,0 131,0 152,5 171,0 179,7 cHDL 9-11 190 48,65 (9,85) 33,1 37,0 42,0 49,0 55,0 63,0 66,0 12-14 133 42,87 (7,98) 30,0 33,0 38,0 43,0 47,0 52,9 57,9 15-18 125 38,86 (7,52) 28,0 29,8 34,0 38,0 44,0 50,2 55,0 cLDL 9-11 187 96,11 (19,64) 66,5 71,2 83,0 93,9 110,8 122,2 132,8 12-14 133 88,41 (21,56) 56,3 61,3 73,2 86,8 101,2 119,9 127,8 15-18 123 81,47 (21,00) 49,5 58,1 69,1 79,6 93,6 110,4 119,2 cNoHDL 9-11 186 127,63 (25,24) 92,8 100,4 111,9 123,0 142,8 160,6 169,6 12-14 132 120,86 (27,49) 79,5 87,2 99,0 119,2 139,2 158,7 171,7 15-18 122 113,23 (29,44) 69,9 82,6 92,9 109,6 125,2 151,2 164,9 cHDL: colesterol de la lipoproteína de alta densidad; cLDL: colesterol de la lipoproteína de baja densidad; cNoHDL: colesterol no HDL; DE: desviación estándar.
Tabla 2.Distribución en percentiles de los valores de presión arterial (mm Hg) por grupos de edad y sexo en los niños y adolescentes del Municipio Libertador de Mérida, Venezuela (estudio CREDEFAR)
Edad N Media (DE)* Percentiles 5 10 25 50 75 90 95 Femeninos PA sistólica 9-11 140 90,01 (12,94) 80 80 80 90 100 110 120 12-14 180 99,58 (12,90) 80 80 90 100 110 120 120 15-18 146 99,12 (11,75)** 80 85 90 100 110 115 120 PA diastólica 9-11 140 60,36 (8,74)** 48 50 55 60 66 70 75 12-14 180 64,57 (8,27) 50 55 60 60 70 80 80 15-18 146 66,17 (9,19)** 50 60 60 65 70 80 80 Masculinos PA sistólica 9-11 189 96,61 (12,68) 80 80 90 100 107 110 120 12-14 130 98,56 (13,01) 80 80 90 100 110 120 120 15-18 125 109,52 (10,74) 90 100 100 110 115 120 125 PA diastólica 9-11 189 62,45 (9,43) 50 50 57 60 70 78 80 12-14 130 63,53 (8,09) 50 55 60 60 70 80 80 15-18 125 69,24 (8,24) 60 60 61 70 75 80 80 DE: desviación estándar; PA: presión arterial.
- •
Cook-pc EE. UU.: utilizando para los pc de CC, Tg y cHDL las referencias del NHANES III25 que se emplean como referencia en EE. UU., y para la PA las tablas del Cuarto Reporte para el Diagnóstico, Evaluación y Tratamiento de la Hipertensión Arterial en niños y adolescentes26.
De igual modo, la clasificación de la IDF se dividió en:
Análisis estadísticoPara realizar la distribución por percentiles (pc 5, 10, 25, 50, 75, 90 y 95) de los lípidos sanguíneos y de la PA de acuerdo a grupos de edad y sexo, la data obtenida fue explorada previamente, excluyendo los valores atípicos de estas variables (±3desviación estándar [DE] Z-Score). Para otros análisis, las variables continuas se presentan en media±DE y las categóricas en número y porcentaje. Para establecer las diferencias entre las variables continuas se aplicó el test de T de Student o el Análisis de Varianza (ANOVA) según el caso. Se calculó el porcentaje de niños y adolescentes con SM y con cada uno de sus componentes de acuerdo a las diferentes clasificaciones y puntos de corte. A través del índice kappa (κ) se estableció la concordancia entre los resultados, considerándose que esta es pobre si es<0,20; débil de 0,21-0,40; moderada de 0,41-0,60; buena si el valor obtenido es de 0,61-0,80; y muy buena si va de 0,81 a 1. Se calculó el riesgo relativo indirecto (RRi-odds ratio [OR]) de tener SM por la presencia de sus componentes. Se estableció la asociación de SM con el estado nutricional, el sexo, los grupos de edad y la procedencia de institutos públicos o privados mediante la aplicación del Chi cuadrado. Se consideró significativa una p<0,05. Los datos fueron procesados en SPSS versión 19.
ResultadosDe los 916 niños y adolescentes estudiados, 484 (52,8%) provenían de instituciones educativas públicas y 432 (47,2%) de privadas, 466 (50,9%) eran de sexo femenino y 450 (49,1%) masculino; el rango de edad fue de 9 a 18,6 años, con media y DE de 13,25 (2,56) años; el 36,4% (n=333) de 9 a 11 años, el 34,1% (n=312) de 12 a 14 años y el 29,6% (n=271) de 15 a 18 años. Al clasificar el estado nutricional según el IMC, 630 sujetos (68,8%) tenían estado nutricional normal, 128 (14%) bajopeso, 87 (9,5%) sobrepeso y 71 (7,8%) obesidad. Usando la definición de Cole et al.24, se obtuvo un 4,4% (n=40) de obesidad, un 17,3% (n=158) de sobrepeso y un 78,4% (n=717) de bajo-normopeso, mostrando una concordancia buena (κ=0,760) con la clasificación venezolana. La media y DE de la talla, el peso y el IMC de la muestra de CREDEFAR, así como su correspondiente pc por edad y sexo según las curvas venezolanas, se presentaron en la publicación anterior21.
La tabla 1 muestra la media, DE y los percentiles de los lípidos sanguíneos por grupos de edad y sexo de nuestra población. En general, el sexo femenino presentó niveles promedio mayores que el masculino, siendo significativa esta diferencia para los Tg en el grupo de 9-11 años, para el colesterol total, el cHDL y el cLDL en los grupos de mayor edad, y en todos los grupos de edad para el colesterol no HDL (p<0,05). La media de los diferentes lípidos disminuyó significativamente con el aumento de la edad, más evidente en el sexo masculino, siendo los valores menores los correspondientes al grupo de 15-18 años en ambos sexos (p<0,05).
La tabla 2 muestra la media, DE y los percentiles de la PA por grupos de edad y sexo de nuestra población. En general, el sexo masculino presentó cifras mayores que el femenino, siendo significativa esta diferencia para la PA sistólica en el grupo de 15-18 años, y para la PA diastólica en los grupos de 9-11 y 15-18 (p<0,05). Se observa que el valor promedio de la PA sistólica y diastólica se incrementa significativamente con el aumento de la edad (p<0,0001).
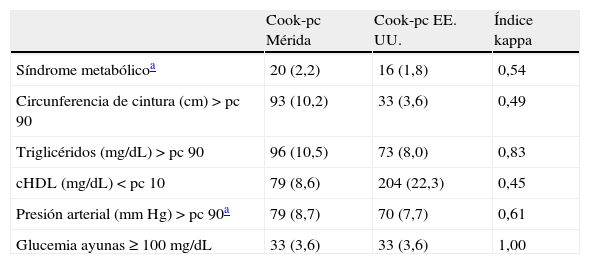
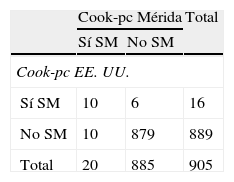
En la tabla 3 se presenta la prevalencia de SM y de sus componentes al utilizar la propuesta de Cook et al.11. El SM se diagnosticó en 20 sujetos (2,2%) al utilizar Cook-pc Mérida y en 16 (1,8%) al usar Cook-pc EE. UU.; la concordancia fue moderada (κ=0,54). En la tabla 3.1 incluida en el anexo 1 se especifican los casos con y sin SM; se observa que usando los pc de EE. UU. no se detectaron 10/20 (50%) participantes con SM y se sobrediagnosticaron 6 casos, en comparación con el uso de los pc de Mérida, y solo 10 casos fueron diagnosticados por ambos criterios. Con relación a los componentes del SM, la obesidad abdominal, determinada por CC, mostró una frecuencia mayor al usar el pc 90 local, con un total de 93 casos, frente a 33 cuando se empleó el pc de EE. UU. (10,2 vs. 3,6%); de igual modo las alteraciones en Tg fueron 96 (10,5%) vs. 73 (8%) y de PA fueron 79 (8,7%) vs. 70 (7,7%). Situación contraria se presentó al analizar los datos de cHDL, con mayor número de alteraciones al emplear pc de EE. UU. (22,3 vs. 8,6%). El dato de la PA faltó en 11 sujetos, por lo que la frecuencia de alteración de la misma y el diagnóstico de SM se realizó en 905 niños y adolescentes. La concordancia mediante el índice κ fue moderada para CC (κ=0,49) y cHDL (κ=0,45), fue buena para PA (κ=0,61) y muy buena para Tg (κ=0,83) y GA (κ=1). En esta población, acorde a las referencias locales, el factor de riesgo más frecuente fue la elevación de Tg (10,5%), seguida por la obesidad abdominal (10,2%), la elevación de la PA (8,7%) y la disminución del cHDL (8,6%).
Prevalencia de síndrome metabólico y de sus componentes según Cook et al. comparando valores de percentiles locales e internacionales
| Cook-pc Mérida | Cook-pc EE. UU. | Índice kappa | |
| Síndrome metabólicoa | 20 (2,2) | 16 (1,8) | 0,54 |
| Circunferencia de cintura (cm)>pc 90 | 93 (10,2) | 33 (3,6) | 0,49 |
| Triglicéridos (mg/dL)>pc 90 | 96 (10,5) | 73 (8,0) | 0,83 |
| cHDL (mg/dL)<pc 10 | 79 (8,6) | 204 (22,3) | 0,45 |
| Presión arterial (mm Hg)>pc 90a | 79 (8,7) | 70 (7,7) | 0,61 |
| Glucemia ayunas≥100mg/dL | 33 (3,6) | 33 (3,6) | 1,00 |
cHDL: colesterol de la lipoproteína de alta densidad; pc: percentil.
Datos expresados en número (porcentaje).
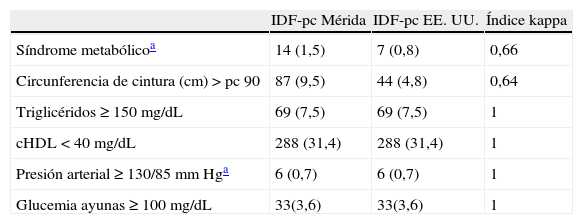
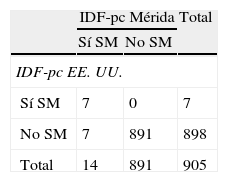
La tabla 4 muestra la prevalencia de SM y de sus componentes según la IDF. Se diagnosticaron más casos de SM al emplear IDF-pc Mérida, 14 (1,5%) vs. 7 (0,8%) con un valor κ=0,66. Hubo 7 casos diagnosticados por ambos métodos y 7/14 (50%) no diagnosticados con IDF-pc EE. UU. (tabla 4.1 incluida en el anexo 1). Se detectaron 87 casos (9,5%) de obesidad abdominal con el valor local vs. 44 (4,8%) con el de EE. UU. (κ=0,64). El resto de los criterios no mostró diferencia ya que se utilizaron valores fijos
Prevalencia de síndrome metabólico y de sus componentes según la Federación Internacional de Diabetes comparando valores de percentiles locales e internacionales
| IDF-pc Mérida | IDF-pc EE. UU. | Índice kappa | |
| Síndrome metabólicoa | 14 (1,5) | 7 (0,8) | 0,66 |
| Circunferencia de cintura (cm)>pc 90 | 87 (9,5) | 44 (4,8) | 0,64 |
| Triglicéridos≥150mg/dL | 69 (7,5) | 69 (7,5) | 1 |
| cHDL<40mg/dL | 288 (31,4) | 288 (31,4) | 1 |
| Presión arterial≥130/85mm Hga | 6 (0,7) | 6 (0,7) | 1 |
| Glucemia ayunas≥100mg/dL | 33(3,6) | 33(3,6) | 1 |
cHDL: colesterol de la lipoproteína de alta densidad; IDF: Federación Internacional de Diabetes; pc: percentil.
Datos expresados en número (porcentaje).
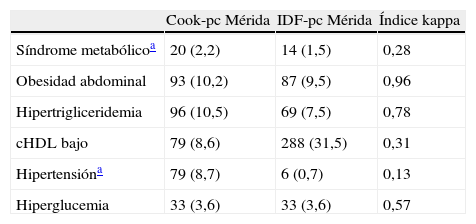
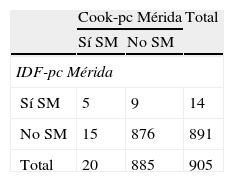
La tabla 5 muestra la prevalencia de SM y de sus componentes al utilizar los pc obtenidos localmente por CREDEFAR, comparando los criterios de Cook et al. con los de la IDF. Se diagnosticaron 20 casos (2,2%) con la clasificación Cook-pc Mérida y 14 casos (1,5%) con IDF-pc Mérida, sin embargo la concordancia entre ambas fue muy débil (κ=0,28), ya que solo 5 casos fueron detectados por ambos métodos (tabla 5.1 incluida en el anexo 1). La frecuencia de obesidad abdominal fue similar (10,2 vs. 9,5%); se detectó más hipertrigliceridemia con el criterio de Cook et al. que utiliza percentiles, que con el de IDF que usa el valor absoluto de 150mg/dL, 96 (10,5%) vs. 69 (7,5%); la concordancia para CC fue muy buena (κ=0,96) y para Tg buena (κ=0,78). Al analizar la frecuencia de cHDL bajo se evidenció un menor número de alteraciones utilizando Cook-pc Mérida en comparación con el valor absoluto de 40mg/dL propuesto por la IDF, 79 (8,6%) vs. 288 (31,5%); la concordancia fue débil (κ=0,31). Se detectaron más casos de HTA con el método de Cook-pc Mérida, 79 (8,7%) vs. 6 (0,7%) (κ=0,13). Para el criterio de GA se detectó igual número ya que se usó el punto de corte de 100mg/dL.
Prevalencia de SM y de sus componentes usando valores de percentiles locales y comparando criterios de Cook et al. con IDF
| Cook-pc Mérida | IDF-pc Mérida | Índice kappa | |
| Síndrome metabólicoa | 20 (2,2) | 14 (1,5) | 0,28 |
| Obesidad abdominal | 93 (10,2) | 87 (9,5) | 0,96 |
| Hipertrigliceridemia | 96 (10,5) | 69 (7,5) | 0,78 |
| cHDL bajo | 79 (8,6) | 288 (31,5) | 0,31 |
| Hipertensióna | 79 (8,7) | 6 (0,7) | 0,13 |
| Hiperglucemia | 33 (3,6) | 33 (3,6) | 0,57 |
cHDL: colesterol de la lipoproteína de alta densidad; IDF: Federación Internacional de Diabetes; pc: percentil.
Datos expresados en número (porcentaje).
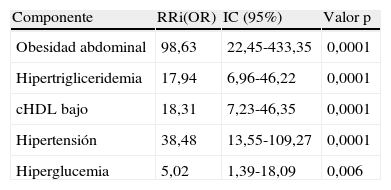
El RRi u OR de tener SM si un sujeto presenta algún componente del mismo se expone en la tabla 6. En esta muestra de niños y adolescentes, el riesgo de que un individuo con obesidad abdominal tenga SM es 98,6 veces mayor que aquel sin obesidad abdominal; 17,9 veces si tiene hipertrigliceridemia; 18,3 veces mayor si el nivel de cHDL es bajo; 38,4 veces si es hipertenso; y 5 veces más si muestra alteración de la GA.
Probabilidad de tener síndrome metabólico si presenta alguno de sus componentes, según los criterios de Cook-pc Mérida
| Componente | RRi(OR) | IC (95%) | Valor p |
| Obesidad abdominal | 98,63 | 22,45-433,35 | 0,0001 |
| Hipertrigliceridemia | 17,94 | 6,96-46,22 | 0,0001 |
| cHDL bajo | 18,31 | 7,23-46,35 | 0,0001 |
| Hipertensión | 38,48 | 13,55-109,27 | 0,0001 |
| Hiperglucemia | 5,02 | 1,39-18,09 | 0,006 |
cHDL: colesterol de la lipoproteína de alta densidad; IC: intervalo de confianza; OR: odds ratio; RRi: riesgo relativo indirecto.
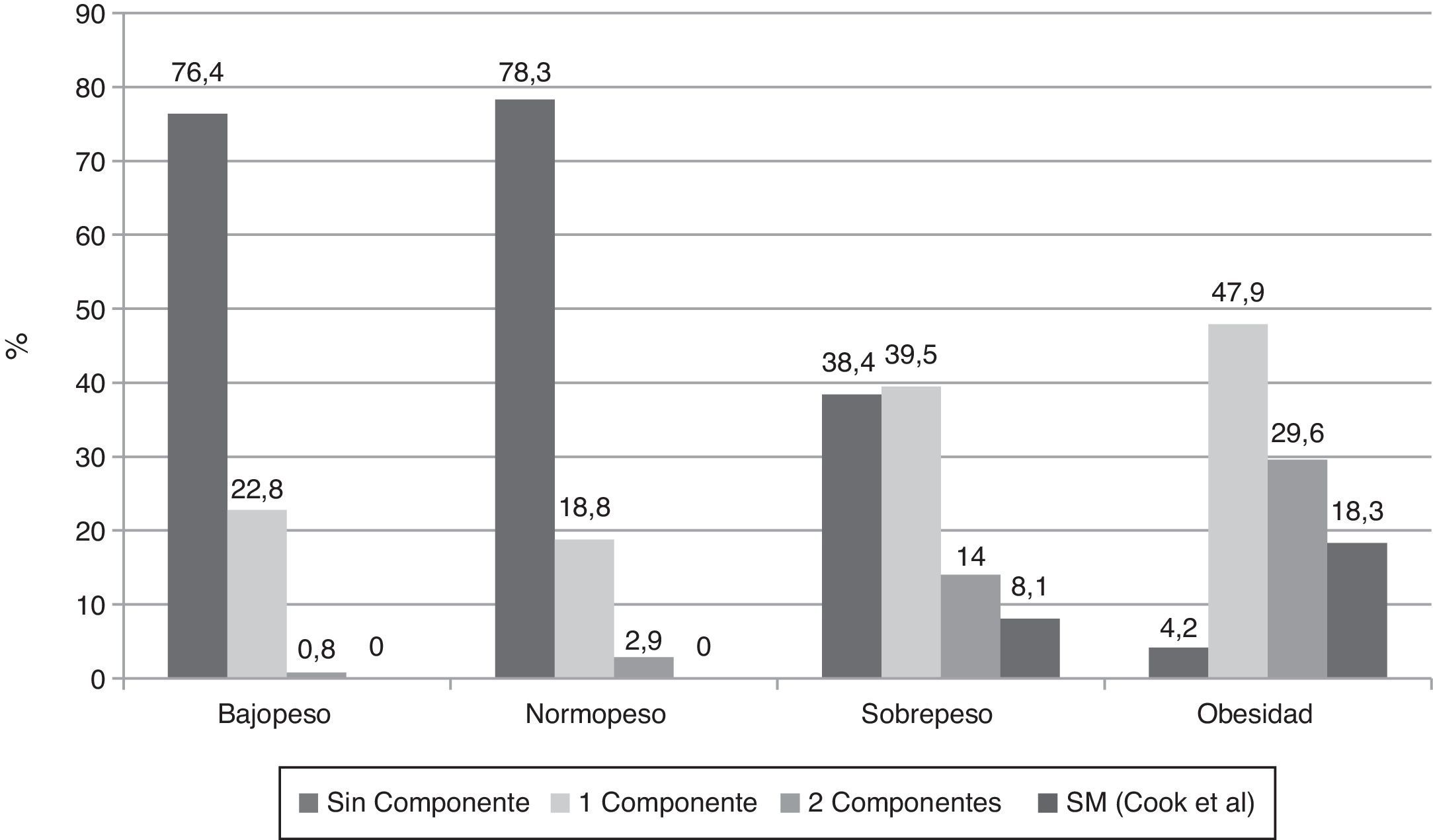
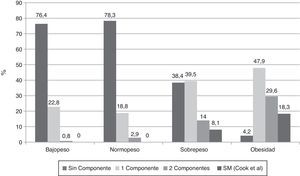
Al investigar la presencia de los diferentes componentes para SM en los sujetos clasificados de acuerdo al IMC y usando la propuesta de Cook-pc Mérida, se evidenció que el número de componentes es mayor en la medida que aumenta la adiposidad, asociación que fue significativa (p=0,0001). Así, en los sujetos con bajopeso y normopeso no hubo casos con SM, mientras que 7 (8,1%) individuos del grupo con sobrepeso y 13 (18,3%) del grupo de obesos presentaron SM (fig. 1). En el grupo de los 20 sujetos con SM, el componente más frecuente fue la obesidad abdominal (18/20 casos), seguido por la elevación de la PA (15/20 casos), la hipertrigliceridemia (13/20 casos), la disminución del cHDL (12/20 casos), y el menos frecuente fue la hiperglucemia de ayuno, en solo 3 de los 20 casos.
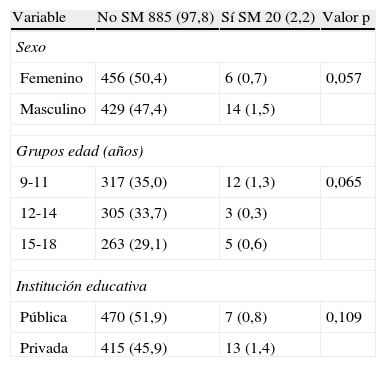
Se analizó la prevalencia de SM de acuerdo al sexo, grupos de edad y tipo de institución pública o privada según la propuesta de Cook-pc Mérida (tabla 7). El SM fue más frecuente en el sexo masculino 14 (1,5%) que en el femenino, donde solo se registraron 6 casos (0,7%), mostrando una significación marginal (p=0,057). La prevalencia fue discretamente mayor en el grupo de 9 a 11 años (1,3 vs. 0,3 y 0,6%) y entre los individuos que provenían de instituciones privadas 13 (1,4%) vs. 7 (0,8%) de institutos públicos, sin alcanzar diferencia estadística significativa.
Prevalencia de síndrome metabólico, según Cook-pc Mérida, en niños y adolescentes de acuerdo al sexo, grupos de edad y tipo de institución educativa
| Variable | No SM 885 (97,8) | Sí SM 20 (2,2) | Valor p |
| Sexo | |||
| Femenino | 456 (50,4) | 6 (0,7) | 0,057 |
| Masculino | 429 (47,4) | 14 (1,5) | |
| Grupos edad (años) | |||
| 9-11 | 317 (35,0) | 12 (1,3) | 0,065 |
| 12-14 | 305 (33,7) | 3 (0,3) | |
| 15-18 | 263 (29,1) | 5 (0,6) | |
| Institución educativa | |||
| Pública | 470 (51,9) | 7 (0,8) | 0,109 |
| Privada | 415 (45,9) | 13 (1,4) | |
SM: síndrome metabólico.
Datos en N (%).
En este estudio se presentan valores de referencia local del perfil lipídico y la PA en escolares y adolescentes del Municipio Libertador de la ciudad de Mérida, Venezuela (estudio CREDEFAR). El comportamiento de estas variables, estables durante la niñez y con diferencias entre géneros durante y después de la pubertad, es similar a la descrita por otros autores27–31, sin embargo cuantitativamente se obtuvieron diferencias. Al comparar nuestros valores de lípidos con los reportados recientemente por Cook et al.25 en niños norteamericanos, donde combinaron los datos existentes de NHANES (NHANES III 1988-1994 y NHANES 1999-2006) y de los principales estudios de EE. UU. en la infancia (Bogalusa Heart Study, Fels Longitudinal Study, Muscatine Study y Lipid Research Clinics prevalence Study), se observa que los nuestros fueron menores en todas las edades, y para el pc 90, las diferencias fueron más acentuadas a medida que avanzaba la edad, alcanzando a tener nuestros participantes cifras de Tg y Ct 10 a 20mg/dL más bajas para ambos sexos. El valor del pc 10 del cHDL de nuestra población es también 4-5mg/dL más bajo que el de los niños norteamericanos. Al comparar con estudios europeos28 y asiáticos32, se observa también que nuestros valores de lípidos son menores, mientras que son similares a los realizados en poblaciones latinoamericanas30,33,34. Con respecto a las cifras de PA, nuestros valores de presión sistólica son más bajos que los presentados en el Cuarto Reporte para el Diagnóstico, Evaluación y Tratamiento de la Hipertensión Arterial en niños y adolescentes26, con diferencias en el pc 90 de 10 a 15mm Hg, mientras que los valores de presión diastólica muestran diferencias menores, siendo los nuestros solo 2-4mm Hg más bajos. Las diferencias observadas enfatizan la necesidad de tener referencias propias; si nuestros niños y adolescentes se evalúan utilizando las referencias internacionales, probablemente se dejaría de detectar un número importante de individuos con dislipidemia e HTA, en quienes pasaría inadvertido este aviso de riesgo cardiometabólico.
La prevalencia de SM en niños y adolescentes varía según la clasificación y los valores de referencia utilizados. En nuestro estudio, la prevalencia de SM fue del 2,2%, cifra baja si se compara con la obtenida por Cook et al.11 en la población americana, que fue del 4,2%, así como la obtenida por Mardones et al.35 en las escuelas públicas de Santiago de Chile que fue del 7,3%, similar a la comunicada recientemente por Park et al.36 en adolescentes de Corea, de 2,3%, y mayor que la reportada por Ekelund et al.37 de 1,4% en jóvenes de Europa.
Al comparar el diagnóstico de SM según Cook-pc Mérida con Cook-pc EE. UU. se obtuvo una frecuencia discretamente mayor usando nuestros percentiles, de 20 (2,2%) vs. 16 (1,8%). Al analizar los diferentes componentes, es evidente que estas diferencias son debidas, por un lado a la CC, los Tg, y la PA, ya que nuestros valores de pc 90 son más bajos que los de EE. UU. y por tanto se detectan más sujetos con alteraciones; y por otro lado, debido al valor del pc 10 del cHDL, ya que el de EE. UU. es más alto y detecta a más individuos con alteraciones en nuestra población. Al final, la prevalencia de SM es similar, pero los individuos detectados son diferentes. Estos resultados muestran claramente cómo los valores internacionales no se corresponden con los nuestros, y al usarlos se podrían diagnosticar erróneamente los casos de SM. No se encontraron estudios en la literatura que comparen pc regionales con internacionales usando la clasificación de Cook et al. para SM, que sirvan para comparar nuestros resultados.
Utilizando los criterios de la IDF se encontraron 87 casos de obesidad abdominal por IDF-pc Mérida y 44 con IDF-pc EE. UU.; el resto de los criterios fueron iguales ya que esta clasificación recomienda valores fijos, no por pc. Con esta única variación en la CC, la frecuencia de SM fue de 14 casos (1,5%) al emplear IDF-pc Mérida vs. 7 (0,8%) al utilizar IDF-pc EE. UU., debido a la mayor detección de sujetos con obesidad abdominal con nuestros pc. Pirkola et al.38 en el 2008 publican los resultados de un estudio realizado en adolescentes de 16 años usando criterios de la IDF, y la prevalencia global de SM fue del 2,4% usando la definición pediátrica; al usar la definición de adultos la prevalencia fue del 1,7% con puntos de corte europeos para CC y del 1% con puntos de corte americanos; los autores concluyen que en la población de 16 años la definición pediátrica hace una estimación de prevalencia de SM más alta que la definición de adultos e igualmente se confirma la necesidad de usar percentiles de la propia población.
La clasificación propuesta por la IDF enfatiza el rol central de la obesidad abdominal y esta es una condición necesaria para diagnosticar SM, lo cual, según autores como Quah et al.39 podría subestimar a individuos con peso normal pero con otras alteraciones que los colocan en riesgo de desarrollar SM; adicionalmente, el uso de valores fijos para el resto de los criterios de SM (Tg, cHDL y PA) enmascara las frecuencias reales de alteración. En el estudio de Quah et al.39, ningún participante resultó hipertenso al aplicar el punto de corte de PA de 130/85mm Hg, mientras que el 15,4% tuvo HTA sistólica y el 9% HTA diastólica basados en los pc del NHBPEWG 199640. Observaciones similares se obtuvieron en nuestro estudio; al utilizar el punto de corte propuesto por IDF se excluye una buena proporción de casos al compararlos con el pc 90 de PA obtenido en CREDEFAR (6 vs. 79 casos).
Se evidenció una menor frecuencia de SM por IDF (1,5%) que por Cook et al. (2,2%), similar a la mayoría de los estudios41–43; algunos autores alegan que esta diferencia se debe a que la clasificación de la IDF detecta niños con SM de mayor edad, mayor CC y con mayor nivel de triglicéridos, mientras que los casos de severidad intermedia o leve son captados por los criterios derivados del ATP III41,42. Al comparar en nuestro estudio ambas clasificaciones, la concordancia en el diagnóstico de SM fue muy baja (κ=0,28), con apenas 5 casos diagnosticados por ambas clasificaciones. Esto se explica porque la clasificación IDF, al utilizar valores fijos de los diferentes componentes, detecta menos casos de hipertrigliceridemia (69 vs. 96) e HTA (6 vs. 79), pero muchos más casos de cHDL bajo (288 vs. 79) que la clasificación de Cook et al.; esta última permite el uso de pc regionales para la identificación del componente o factor de riesgo, lo cual se ajusta más a la realidad de cada población. Esta falta de concordancia fue reportada por Goodman et al.44 (2004), comparando en ese caso la prevalencia de SM en adolescentes según la definición de la Organización Mundial de la Salud y la del NCEP-ATP III, obteniendo un valor de κ=0,41; la definición de NCEP identificó solo un 40% de los individuos con SM por la Organización Mundial de la Salud, y la clasificación de la Organización Mundial de la Salud detectó un 66,7% de los individuos con SM por NCEP-ATP III. Los autores concluyen que existen diferencias clínicas y demográficas en la tipología del SM dependiendo de la definición y las discrepancias sugieren una variación en el elemento central de las diversas clasificaciones.
El diagnóstico de SM confiere un riesgo cardiovascular alto, ya que se trata de la presentación de varias alteraciones en un mismo individuo, sin embargo, cada uno de sus componentes es considerado por sí mismo un factor de riesgo independiente, por lo que debe recibir la atención debida desde la edad infantil aunque no se asocie con otro factor. Es de hacer notar que mientras se diagnosticaron 20 pacientes con SM (según Cook-pc Mérida), hubo 93 con obesidad abdominal, 96 con hipertrigliceridemia, 79 con cHDL bajo y 79 con HTA, que deben recibir tratamiento y seguimiento clínico. En este estudio se muestra que la presencia de cualquiera de los componentes del SM aumenta significativamente el riesgo de tener dicho síndrome, siendo la obesidad central la que confiere el mayor riesgo (RRi 98,63; p=0,0001); esto concuerda con lo reportado por Wang et al.43 quienes concluyen que la obesidad central es el elemento clave en la agregación de factores de riesgo metabólico en los niños. En nuestro estudio, el 90% de los sujetos con SM presentaron obesidad abdominal.
Sinha et al.45 en una cohorte de niños obesos reportaron que la alteración de la GA se observó en apenas el 0,8% tomando el punto de 110mg/dL, y comentan que este nivel de hiperglucemia de ayuno es indicativa de un estadio más avanzado de alteración en la homeostasis de la glucosa, que usualmente es precedido por intolerancia a los hidratos de carbono. En nuestro estudio, solo un participante tenía GA mayor de 110mg/dL. Autores como Nguyen et al.46 han demostrado que, en niños, el riesgo de diabetes comienza a aumentar a partir de una GA mayor de 86mg/dL. La reducción del punto de corte para el diagnóstico de alteración de la GA en niños para predecir la probabilidad de desarrollar diabetes mellitus en el futuro es un reto interesante que necesita más datos a largo plazo y es muy importante en vista del auge de la obesidad46. Por esta razón, se decidió en este trabajo corregir la propuesta diagnóstica de SM de Cook et al. con glucemia de 100mg/dL como punto de corte, que es la aceptada desde 1997 por la Asociación Americana de Diabetes47 para diagnóstico de GA alterada, en vez de 110mg/dL que era la original de Cook et al.11. Por otra parte, algunos investigadores48 han observado que las concentraciones séricas de glucosa no cambian significativamente a medida que aumenta la adiposidad, de hecho, fue la alteración menos frecuente en nuestra población (3,6%) así como el componente menos observado entre los sujetos con SM (15%). Un limitante en nuestro estudio es que no se conoce la frecuencia de intolerancia a la glucosa en esta muestra, ya que no se realizó la prueba de tolerancia oral a la glucosa.
En esta investigación se encontró que la frecuencia de SM se incrementa con la adiposidad, no hubo casos en aquellos con normopeso, 7 casos (8,1%) en los que tenían sobrepeso y 13 (18,3%) entre los obesos, similar a lo hallado por otros13,14,49; sin embargo, esta frecuencia de SM en nuestros niños obesos es baja en comparación con otros estudios como el de Cruz et al.13, donde reportan un 30% de afectados, el de Strufaldi et al.50 con un 25,8% de frecuencia en escolares obesos de Brasil y el de Suazo et al.51, quienes refieren una frecuencia del 26,3% en niños obesos de 6 a 12 años de Chile. Serán necesarios estudios comparativos sobre el tipo de alimentación, hábitos de ejercicio y herencia para tratar de dar explicación a este hecho. De acuerdo a nuestros resultados, compartimos lo referido por Weiss et al.14, de que la adiposidad es el factor central para la presentación del SM, independiente del sexo, la edad o el desarrollo puberal.
Sangun et al.41 en niños obesos entre 7 y 18 años encontraron mayor prevalencia de SM en el sexo masculino, así como Cook et al.11 en una muestra de sujetos de 12 a 19 años (6,1 vs. 2,1%), sin diferencias según el estadio puberal, similar a nuestros hallazgos, donde hubo una mayor frecuencia del SM entre los varones (significación marginal). Algunos autores52,53 consideran que la pubertad es uno de los períodos de mayor insulinorresistencia y por lo tanto con mayor probabilidad de desarrollar SM; en nuestro estudio no hubo diferencia significativa en relación con los grupos de edad, y se observó una tendencia a una mayor frecuencia de SM entre los escolares de 9 a 11 años de edad. La asociación entre el nivel socioeconómico y SM no está completamente establecida ni entendida y parece estar muy influenciada por factores conductuales como el sedentarismo y la ingesta de comidas hipercalóricas, situaciones que están fuertemente relacionadas con el síndrome54; en nuestros resultados, se observó una tendencia no significativa a mayores casos de SM en los institutos privados.
Se concluye que la prevalencia de SM en niños y adolescentes del Municipio Libertador de la ciudad de Mérida es baja, menor que la reportada en la literatura. Es necesario lograr un consenso mundial para el diagnóstico de SM en niños y adolescentes, así como enfatizar el uso de referencias de la propia población en pc por edad y sexo como punto de corte en el cálculo de los componentes del SM, ya que al aplicar los de otras poblaciones existe la posibilidad de sobrediagnosticar o infradiagnosticar los casos. De las clasificaciones estudiadas para el diagnóstico de SM, se prefiere usar la de Cook et al.11, ya que utiliza pc para la mayoría de los componentes, situación que toma en cuenta los cambios que suceden como consecuencia del crecimiento y desarrollo de los niños. En vista de que la presencia de componentes de SM aumenta en un individuo conforme se incrementa la adiposidad, es recomendable que los niños obesos sean investigados y tratados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece el financiamiento recibido por el Consejo de Desarrollo Científico, Humanístico, Tecnológico y del Arte de la Universidad de Los Andes (CDCHTA-ULA) bajo el proyecto M-1013-11-07-AA y ADG M-10, así como del Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) del Ministerio del Poder Popular para Ciencia, Tecnología e Innovación con el proyecto n.o 2012000970.