El sistema hormonal de la vitamina D es importante no solo por sus conocidos efectos esqueléticos, sino también por sus potenciales efectos sobre otros órganos y sistemas cada vez mejor conocidos. El receptor de vitamina D está presente en gran cantidad de tejidos y células del organismo que, además, son capaces de producir la forma activa de vitamina D responsable de la activación de hasta 200 genes que pueden explicar los efectos pleiotrópicos de esta hormona. Existe una evidencia creciente que relaciona la deficiencia de vitamina D y la predisposición a desarrollar diabetes mellitus tipo 1 y tipo 2, así como la evolución de ambas enfermedades. En particular, la influencia de la vitamina D en el desarrollo de la nefropatía diabética es relevante por su interacción con el sistema renina-angiotensina-aldosterona, el proceso inflamatorio y la albuminuria. Los activadores selectivos del receptor de vitamina D son moléculas capaces de producir efectos agonistas o antagonistas sobre diferentes tejidos. En concreto, el paricalcitol muestra un perfil muy favorable por su potencia para reducir la hormona paratiroidea con menores efectos sobre las concentraciones de concentraciones de calcio y fósforo. Además, en pacientes diabéticos con enfermedad renal, este fármaco ha demostrado efectos beneficiosos sobre la reducción de albuminuria, la tasa de hospitalizaciones y la mortalidad cardiovascular. Por lo tanto, la posibilidad de utilizar una nueva herramienta para mejorar el pronóstico de los pacientes diabéticos con enfermedad renal en diferentes estadios es un reto que debe ser afrontado.
The vitamin D hormone system has significant skeletal and extra-skeletal effects. Vitamin D receptor occurs in different tissues, and several cells other than renal cells are able to locally produce active vitamin D, which is responsible for transcriptional control of hundreds of genes related to its pleiotropic effects. There is increasing evidence relating vitamin D to development and course of type 1 and 2 diabetes mellitus. Specifically, influence of vitamin D on the renin-angiotensin-aldosterone system, inflammatory response, and urinary albumin excretion could explain the relevant impact of vitamin D status on diabetic nephropathy. Selective vitamin D receptor activators are molecules able to reproduce agonistic or antagonistic effects of active vitamin D depending on the tissue or even on the cell type. Specifically, paricalcitol has a beneficial profile because of its potency to reduce parathyroid hormone, with lower effects on serum calcium or phosphate levels. Moreover, in patients with diabetes and renal disease, paricalcitol decreases microalbuminuria, hospitalization rates, and cardiovascular mortality. Therefore, these molecules represent an attractive new option to improve prognosis of renal disease in patients with diabetes.
La vitamina D es una hormona singular ya que puede ser formada en la piel a partir de la exposición a la luz solar. La terminología en relación a la bioquímica de la vitamina D presenta cierta complejidad. La vitamina D tiene 2 formas y diversos metabolitos. Las 2 formas son la vitamina D2 (ergocalciferol) y la vitamina D3 (colecalciferol). La vitamina D3 es producida en la piel en respuesta a la radiación ultravioleta B, o puede ser obtenida a partir de ciertos alimentos (por ejemplo, pescados grasos, yema de huevo e hígado) o suplementos nutricionales. Como pocos alimentos naturales contienen cantidades significativas de vitamina D las aportaciones de la dieta provienen, fundamentalmente, de estos alimentos o de suplementos. La vitamina D2 se encuentra en algunos vegetales de la dieta y se produce comercialmente por la irradiación de levadura. Tanto la vitamina D2 como la D3 son usadas para la fortificación de los alimentos y la elaboración de suplementos1.
La vitamina D procedente de la piel o los alimentos es biológicamente inactiva y requiere de una primera hidroxilación en el hígado por la enzima 25-hidroxilasa para formar 25-hidroxivitamina D (25OHD o calcidiol). Algunos estudios sugieren que la vitamina D2 puede ser metabolizada más rápidamente que la D3, pero con una ingesta regular ambas formas pueden ser consideradas bioequivalentes2. Sin embargo, la 25OHD requiere una posterior hidroxilación en los riñones por la enzima 1α-hidroxilasa (CYP27B1) para formar la forma biológicamente más activa, la 1,25 dihidroxivitamina D [1,25(OH)2D o calcitriol]. Aunque la 25OHD posee actividad biológica esta es significativamente menor (unas 200 veces) que las del calcitriol. Las características de la 1,25(OH)2D son las de una hormona y, consecuentemente, la vitamina D es una prohormona más que una vitamina, siendo la estructura de la 1,25(OH)2D similar a la de otras hormonas esteroideas. Como otras hormonas, la 1,25(OH)2D circula en concentraciones en rango de picogramos que son 1.000 veces menores que la de su precursor la 25OHD.
La 1,25(OH)2D actúa sobre sus receptores nucleares que están presentes en intestino delgado, hueso, riñones y otros tejidos3. En el intestino delgado, la 1,25(OH)2D estimula la absorción intestinal de calcio y fósforo. En el hueso, interacciona con las células óseas, osteoblastos y osteoclastos, para movilizar el calcio y otros minerales. En el riñón, la 1,25(OH)2D estimula la reabsorción de calcio del filtrado glomerular. Las concentraciones de esta hormona están estrechamente reguladas. Así, la hormona paratiroidea (PTH) y los niveles bajos de calcio o fósforo aumentan su síntesis, mientras que el factor de crecimiento fibroblástico 23 (FGF23), producido por los osteocitos, la disminuyen4 (fig. 1). Un aspecto importante es que el receptor de vitamina D (RVD) está presente en una gran cantidad de tejidos y células (tabla 1). Por este motivo, la 1,25(OH)2D posee un amplio espectro de acciones biológicas que incluyen inhibir la proliferación celular, inducir la diferenciación avanzada, inhibir la angiogénesis, estimular la producción de insulina e inhibir la producción de renina, entre otras5. Además, diversos tejidos y células poseen actividad 1α-hidroxilasa. Como consecuencia, la producción local de 1,25(OH)2D es responsable de la regulación de hasta 200 genes que pueden explicar los efectos pleiotrópicos beneficiosos que se relacionan con esta hormona6. Por tanto, es posible establecer que el sistema hormonal de la vitamina D ejerce sus funciones por 2 mecanismos: el primero de tipo endocrino (regulado por calcio, fósforo, PTH y FGF23) y el segundo de tipo paracrino/autocrino (dependiente del sustrato de vitamina D, la 25OHD y no regulado por los factores que regulan el mecanismo endocrino). El primero está dirigido a la homeostasis del metabolismo mineral, y el segundo a todos sus efectos pleiotrópicos.
Células y tejidos que producen calcitriol (1,25[OH])2D y/o poseen receptores para vitamina D (RVD)
| Célula/Tejido | RVD | (1,25[OH])2D |
| Endocrino | ||
| Celulas B pancreáticas | + | + |
| Paratiroides | + | + |
| Parotidas | + | - |
| Células C tiroideas | + | - |
| Hipófisis | + | - |
| Adrenales | + | - |
| Musculoesquelético | ||
| Cartílago/Condrocitos | + | + |
| Osteoblastos | + | + |
| Fibras musculares | + | - |
| Cardiovascular | ||
| Miocitos | + | + |
| Músculo liso vascular | + | - |
| Endotelio | + | + |
| Gastrointestinal | ||
| Células inmunes, mucosa colón | + | + |
| Esófago | + | - |
| Estomago | + | - |
| Intestino | + | - |
| Células parénquima hepático | + | - |
| Túbulos renales | + | + |
| Reproductivo | ||
| Mama | + | + |
| Placenta | + | + |
| Próstata | + | + |
| Testículos | + | - |
| Ovarios | + | - |
| Útero | + | - |
| Neuronas cerebrales | + | + |
| Piel | ||
| Queratinocitos | + | + |
| Folículos pilosos | + | - |
| Sistema inmune | ||
| Macrófagos/Monocitos | + | + |
| Células dendríticas | + | + |
| Linfocitos | + | + |
| Timo | + | - |
| Médula ósea | + | + |
| Células alveolares pulmón | + | - |
| Retina | + | - |
| Tejido adiposo | + | - |
| Células tumorales | + | - |
La diabetes mellitus constituye una pandemia mundial y está asociada a complicaciones microvasculares, macrovasculares y a un exceso de mortalidad. Un reciente comunicado de la International Diabetes Federation señala que el número personas con diabetes en el mundo se aproxima a los 285 millones, y alcanzará los 435 millones en 20307. Por otra parte, la deficiencia o insuficiencia de vitamina D también es un problema global cuyas consecuencias van más allá de su tradicionalmente conocido efecto sobre el metabolismo óseo8. El interés por los efectos no esqueléticos de este sistema hormonal se ha incrementado por el descubrimiento de receptores de vitamina D en diversos tejidos como las células del islote pancreático, células del sistema inmunológico, macrófagos y endotelio vascular, entre otros. A través de efectos paracrinos la 1,25(OH)2D regula la expresión de diferentes genes en estos tejidos.
Existe una evidencia creciente que relaciona la deficiencia de vitamina D y la predisposición a desarrollar diabetes mellitus tipo 1 y 2 así como la evolución de ambas enfermedades. El estudio NHANES 2003-2006 en población de EE. UU. evaluó a 9.773 adultos mayores de 18 años, y mostró una asociación entre concentraciones de vitamina D, homeostasis de la glucosa y evolución de la diabetes9. Así, pudo comprobarse una relación inversa entre los valores de hemoglobina glucosilada (HbA1c) y las concentraciones de 25OHD en personas entre 35 y 74 años sin historia conocida de diabetes. Por este motivo, algunos autores proponen el cribado de insuficiencia de vitamina D en sujetos con HbA1c elevada y viceversa10. Los mecanismos biológicos subyacentes no son bien conocidos, pero existen estudios que están aportando datos que pueden explicar esta asociación. Un ejemplo es la constatación de la existencia de receptores de 1,25(OH)2D y actividad de la enzima 1α-hidroxilasa en la células β pancreáticas11. Estudios de intervención con suplementos de vitamina D han señalado un efecto favorable sobre la tolerancia a la glucosa y la resistencia a la insulina en humanos. En un metaanálisis reciente, Pittas et al. revisan el impacto de la vitamina D y el calcio sobre el control glucémico en pacientes con diabetes tipo 212. Sus resultados muestran que la insuficiencia de vitamina D puede dificultar el control glucémico y que la suplementación con ambos nutrientes puede ser necesaria para optimizar el control metabólico. Estos datos son consistentes con los obtenidos en estudios realizados en modelos animales. Entre los mecanismos biológicos sugeridos se encuentran la normalización del flujo de calcio transmembrana, necesario para la secreción de insulina, y el aumento en la expresión del receptor de insulina13. Además de la relación con la diabetes, diversos estudios epidemiológicos han mostrado una asociación entre la insuficiencia de vitamina D y la mortalidad cardiovascular14. El riesgo aumentado de obesidad, hipertensión (HTA) y dislipemia parecen ser los factores determinantes. No obstante, los estudios de intervención disponibles no han podido demostrar de forma consistente un efecto favorable sobre eventos cardiovasculares15.
La vitamina D también interacciona con vías metabólicas implicadas en el desarrollo y progresión de las complicaciones propias de la diabetes, en particular la nefropatía. Entre las relaciones más destacables se encuentran las que afectan al sistema renina-angiotensina-aldosterona (SRAA), el proceso inflamatorio y la albuminuria16. La vitamina D es un regulador negativo del SRAA como se ha demostrado en modelos animales que no expresan el receptor de vitamina D17. En un modelo de enfermedad renal crónica, un análogo de vitamina D fue capaz de reducir la expresión renal de renina, el receptor de renina, el angiotensinógeno y el receptor de angiotensina tipo 118. La vitamina D también inhibe la enzima convertidora del factor de necrosis tumoral α (TACE) que regula la enzima convertidora de angiotensina 2 (ACE2), la principal enzima que metaboliza a la angiotensina ii en el túbulo proximal. La diabetes está asociada con una expresión reducida de ACE2. Por lo tanto, la inhibición de TACE podría mejorar el balance del SRAA en el riñón y podría tener efectos protectores renales añadidos por la inhibición, dependiente de TACE, de otros mediadores patogénicos19.
La vitamina D tiene varias acciones antiinflamatorias incluyendo efectos sobre la síntesis de prostaglandinas, inhibición de la señalización del factor nuclear κβ y la inmunidad innata. Así, determinadas intervenciones farmacológicas han mostrado un efecto favorable sobre el perfil inflamatorio20. Todos estos efectos han sido implicados en la enfermedad renal crónica del diabético. Además, la deficiencia de vitamina D se asocia a un aumento en las concentraciones de proteína C reactiva (PCR). Algunos estudios con análogos de vitamina D han mostrado ser capaces de disminuir los valores de PCR, en paralelo con la albuminuria, en pacientes con enfermedad renal crónica21.
La diabetes se asocia con una división aberrante de megalina y cubilina, los principales transportadores endocíticos de la albúmina filtrada en el túbulo proximal22. Esta vía de recuperación es esencial para la captación de 25OHD y su posterior activación. La disfunción o deficiencia del complejo cubilina-megalina disminuye las concentraciones de vitamina D. De forma significativa, esta interacción actúa por ambas vías, ya que la vitamina D también inhibe la eliminación de megalina.
Los pacientes con diabetes y enfermedad renal crónica tienen tasas elevadas de deficiencia de vitamina D. Las pérdidas urinarias de proteínas relacionadas con la vitamina D, la disminución de la formación renal de 1,25(OH)2D y la expresión reducida del receptor de vitamina D (RVD) son características de estos pacientes23. Por lo tanto, en estos casos parece fundamentada la suplementación con vitamina D. La disponibilidad de activadores selectivos del receptor de vitamina D con menor riesgo de hipercalcemia o hiperfosfatemia es particularmente atractiva en el manejo de estos pacientes24.
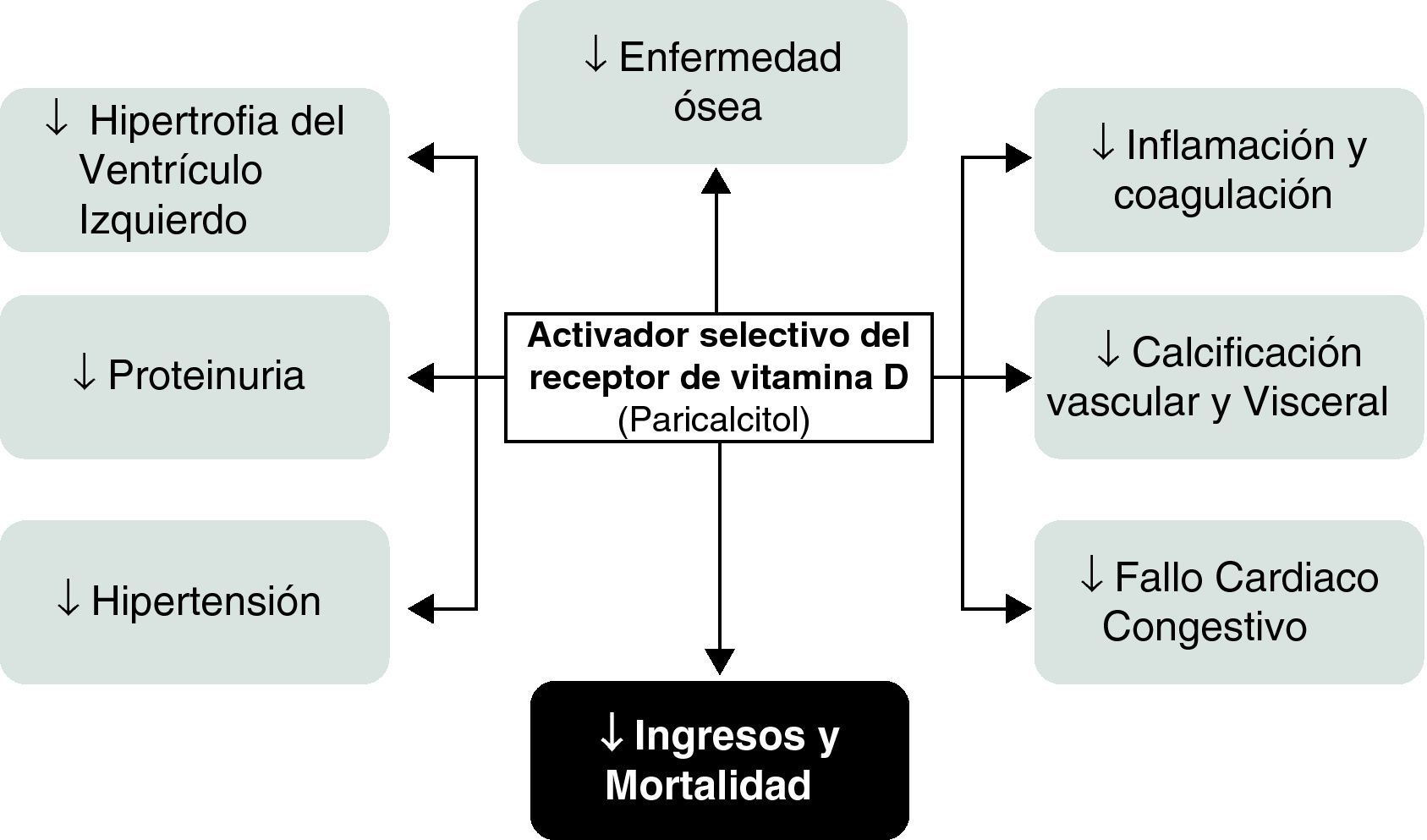
Activadores selectivos del receptor de vitamina DEl uso terapéutico de la hormona D activa -calcitriol- en la enfermedad renal crónica tiene el objetivo de elevar la absorción intestinal de calcio, protegiendo al hueso del desarrollo de ostemalacia e inhibiendo la secreción de PTH y la hiperplasia paratiroidea. Además, la amplia distribución tisular del RVD (riñón, páncreas, miocardio…) puede aportar beneficios adicionales aunque el desarrollo de hipercalcemia o hiperfosfatemia limitan o complican su uso. Hoy se considera que una parte significativa de las complicaciones que presentan los pacientes con insuficiencia renal crónica –especialmente las relacionadas con hipertensión, hipertrofia de ventrículo izquierdo, calcificaciones vasculares, y proteinuria, además de las puramente óseas como el hiperparatiroidismo secundario, están relacionadas con una deficiente actividad del RVD25.
Como ya se ha comentado, la vitamina D es, en realidad, un secosteroide hormonal con receptores distribuidos por muchos tejidos y emparentado con las hormonas sexuales. De hecho, el concepto de modulador selectivo de hormonas esteroideas se gestó en el estudio de diferentes sustancias con actividad estrogénica en algunos tejidos y anti-estrogénica en otros durante los años 80 del siglo pasado26,27.
Los complejos efectos mixtos agonistas/antagonistas de esos compuestos han llevado a la actual denominación de moduladores selectivos del receptor de vitamina D o activadores selectivos de dicho receptor. A nivel molecular, solo ahora estamos empezando a conocer cómo un modulador o activador selectivo concreto actúa como agonista en el RVD de un tejido o célula concreta y como antagonista en otro. Parece que los cambios conformacionales –de la estructura tridimensional y de las cargas eléctricas del RVD tras unirse a un ligando concreto, además de la homodimerización o de la heterodimerización con RXR- determina qué proteínas del núcleo celular –donde se encuentran tanto el material genético con los elementos de respuesta a vitamina D y el propio RVD- se le van a unir aumentando (co-activadores) o inhibiendo (co-represores) la expresión de esos genes. Además de los efectos genómicos modificando la expresión proteica de múltiples genes, pueden existir efectos no genómicos de estas sustancias28.
Se han desarrollado diferentes análogos de vitamina D29 con el objetivo de tratar el hiperparatiroidismo secundario en pacientes con enfermedad renal crónica pero con bajo riesgo de hipercalcemia e hiperfosfatemia. Sus efectos dependen tanto de sus diferencias farmacocinéticas –unión a proteínas transportadoras, tasa de captación y de metabolismo y catabolismo por células diana- como farmacodinámicas– puntos de interacción con la cavidad de ligandos del RVD, diferencias conformacionales del complejo receptor-hormona, interacciones con cofactores del complejo RXR/RVD/co-activadores, co-represores o proteosomas que explican diferencias en acciones en cada tejido y/o célula28.
Entre ellos, el paricalcitol [19-nor-1,25-(OH)2-vitamina D2], parece tener el mejor perfil por presentar un menor riesgo de efectos adversos sobre las concentraciones de calcio y fosforo sérico y mayor potencia reduciendo las concentraciones de PTH25,29, habiendo demostrado beneficios adicionales en sujetos diabéticos como la reducción de la albuminuria y de las hospitalizaciones y mortalidad en sujetos con enfermedad renal crónica30,31. A partir de los diversos estudios clínicos disponibles con paricalcitol podemos, por una parte profundizar en los conocimientos de los efectos de los activadores selectivos del RVD y, por otra, valorar sus potenciales aplicaciones más allá del control de los valores de PTH en los sujetos con diabetes.
Efectos de paricalcitol en los pacientes diabéticos con enfermedad renalLo primero que debe destacarse es que muchos de los estudios disponibles no se centran específicamente en pacientes diabéticos con enfermedad renal. De hecho, la mayor parte de la evidencia disponible proviene de estudios en los que los criterios de inclusión fueron la presencia de enfermedad renal crónica moderada a terminal –en diálisis periódica– no obstante, en los estudios en los que esta información está disponible, prácticamente la mitad de los pacientes incluidos son diabéticos y los análisis post hoc no muestran un menor beneficio en esta población (fig. 2).
Efecto sobre la PTHEl paricalcitol se desarrolló para tratar el hiperparatiroidismo secundario a insuficiencia renal crónica por déficit de producción de hormona D activa sin los efectos adversos de hipercalcemia e hiperfosfatemia que se pueden asociar al tratamiento con vitamina D activa. Su eficacia y seguridad en este contexto se demostró en 3 ensayos clínicos controlados de 12 semanas de duración –alguno con extensión hasta un año– en pacientes en hemodiálisis periódica revisados recientemente31. En conjunto, estos estudios probaron una reducción del 60% de las cifras de PTH con escaso riesgo de hipercalcemia e hiperfosfatemia.
También se ha comparado su eficacia frente a calcitriol en 263 pacientes en diálisis periódica32, en los que volvió a confirmarse una reducción de los valores de PTH de al menos el 50% de forma más rápida que calcitriol y con significativamente menos episodios de hipercalcemia o aumento del producto calcio-fósforo. Esta eficacia de paricalcitol en la reducción mantenida de las cifras de PTH se ha confirmado también en pacientes en estadios más precoces (3-4) de insuficiencia renal33.
El mecanismo para reducir el efecto calcémico de paricalcitol está relacionado con una menor estimulación de las proteínas de los enterocitos encargadas de la absorción del calcio de la dieta –calbindinas y otras…– frente a calcitriol34,35, produciéndose así una activación selectiva del RVD.
Efectos sobre la proteinuriaLa hipótesis de los potenciales efectos de paricalcitol sobre la albuminuria deriva de los conocidos efectos pleiotrópicos de vitamina D y, concretamente, sus efectos como inmuno-modulador y reduciendo la actividad del SRAA ya comentados anteriormente. No cabe duda de que la pérdida excesiva de proteínas es un claro factor de riesgo de progresión de la enfermedad renal y de riesgo cardiovascular, tanto en los pacientes con insuficiencia renal crónica36 como en los sujetos con diabetes37. Así, la activación del RVD en la célula tubular por calcitriol aumenta la expresión de megalina y, por tanto, la reabsorción de 25OHD y albúmina desde la luz tubular. Pues bien, el análisis conjunto de la proteinuria -evaluada por tira urinaria como análisis de seguridad de las 3 cohortes que habían demostrado la eficacia de paricalcitol reduciendo PTH- arrojó los primeros resultados positivos. Paricalcitol demostró una mejora de la proteinuria en 29 de 57 pacientes (51%) frente a 15 de 61 (25%) de los que recibieron placebo (P=0,004; odds ratio [OR] 3,2). Los resultados no se modificaron tras ajuste por edad, sexo, raza, HTA o uso de fármacos bloqueadores del SRAA. Además, lo que nos resulta más interesante como endocrinólogos, los pacientes con diabetes presentaron el mismo beneficio que el resto de la cohorte38. Estos datos se confirmaron en un ensayo clínico piloto con 24 pacientes que mostró una reducción de casi el 50% de la proteinuria ya medida formalmente19, y en otro posterior con 61 pacientes con distintos grados de insuficiencia renal (filtrado glomerular: 15-90mL/min/1,73m2) y proteinuria (> 400mg/24h) en los que 6 meses de tratamiento con paricalcitol redujo un 17,6% la proteinuria frente a una reducción del 2,9% para placebo (p<0,04)39.
Pero los datos más importantes sobre la reducción de la albuminuria provienen del estudio en 300 sujetos con diabetes tipo 2 y albuminuria (alrededor de 1g/24h) a pesar de estar en tratamiento con fármacos inhibidores del sistema renina-angiotensina-aldosterona tratados con placebo, o uno o 2 mcg de paricalcitol. Los tratados con paricalcitol, en conjunto, mostraron reducciones de albuminuria del 15% frente a placebo (10 y 20% frente a placebo para las dosis de 1 y 2 mcg, respectivamente) sin diferencia en efectos adversos frente a placebo40. Resulta evidente que estos datos en pacientes con diabetes aportan evidencias para una nueva aproximación para prevenir la albuminuria en estadios precoces (3 y superiores) de insuficiencia renal y reducir el elevado riesgo renal residual de esta población.
Por último, debe señalarse que se ha observado una elevación de la creatinina sérica y del aclaramiento de creatinina en pacientes tratados con paricalcitol, aunque estudios más específicos demuestran que el aclaramiento de creatinina e iotalamato no cambian mientras que la albuminuria se reduce significativamente con paricalcitol. Por lo tanto, se supone que paricalcitol incrementa a corto plazo la generación creatinina y las cifras de creatinina sérica pero sin afectar el filtrado glomerular41.
Efectos cardiovascularesLa enfermedad y las complicaciones cardiovasculares son la principal causa de mortalidad tanto entre los sujetos con diabetes37 como entre los que padecen de enfermedad renal crónica42. Los factores de riesgo tradicionales como el tabaquismo, la edad o la hipertensión no explican completamente esta elevada morbi-mortalidad, obteniéndose los mejores resultados con el tratamiento multifactorial agresivo37.
Efectos en el sistema renina angiotensia aldosteronaEl sistema renina-angiotensina-aldosterona, regulador de la homeostasis del volumen extracelular que contribuye a la estabilización de la presión arterial, está claramente implicado en el desarrollo de complicaciones asociadas a la diabetes y a la enfermedad renal. La inhibición de este sistema ha demostrado beneficios significativos en la prevención y el tratamiento de la enfermedad renal crónica diabética o de otra etiología, y un favorable impacto sobre el muy elevado riesgo cardiovascular que presentan estos sujetos37. Recientemente, se acumulan las experiencias que demuestran que la vitamina D activa y los activadores de su receptor tienen un efecto supresor sobre el SRAA mediante la reducción de la expresión del gen de la renina43. Los efectos anti-inflamatorios o los anti-fibrosantes de los activadores selectivos de vitamina D suman aspectos positivos que hacen atractivas a estas moléculas como potencial tratamiento en pacientes diabéticos con daño renal. Además, existen RVD en el sistema cardiovascular donde modulan la expresión de una gran cantidad de genes44,45.
El paricalcitol ha demostrado en modelos experimentales de nefrectomía casi total reducir la expresión de RNAm de angiotensinógeno, renina, receptor de renina y factor de crecimiento endotelial vascular entre un 30 y 50%. Estas reducciones de RNAm se vieron acompañadas por las esperadas reducciones en las concentraciones de proteínas: renina, receptor de renina, receptor de angiotensina tipo 1, factor de crecimiento endotelial vascular, así como por una mejoría, que los autores sugieren relacionado con el bloqueo del SRAA, de los daños tisulares –túbulo-intersticiales– asociados al modelo de insuficiencia renal crónica, de la hipertensión, de la proteinuria y del deterioro de la función renal17.
De hecho, el paricalcitol co-administrado junto a losartan ha demostrado impedir en modelos de diabetes la relativa pérdida de eficacia de los inhibidores del SRAA causada por el aumento compensador de renina. En estos modelos animales de diabetes tipo 1 y tipo 2, la coadministración impide el daño renal causado por la diabetes –proteinuria progresiva y glomeruroesclerosis- restaurando la barrera de filtrado glomerular mediante la supresión de la expresión de fibronectina, factor de crecimiento transformante β y proteina quimiotáctica de monocitos 1 y la restauración de las proteínas de diafragma de canales nefrina, Neph-1, Zo-1 y α-actinina-4. Estos beneficios se acompañan de un bloqueo de la renina intra-renal y de la acumulación de angiotensina ii inducida por la hiperglucemia y el losartán46,47.
Efectos sobre la hipertrofia de ventrículo izquierdoLas relaciones entre la insuficiencia renal y el desarrollo de hipertrofia de ventrículo izquierdo (HVI) son bien conocidas desde hace años48. Se ha descrito hasta un 87% de prevalencia de HVI concéntrica y excéntrica en los pacientes en prediálisis. Esta HVI, además, se relaciona con las concentraciones de PTH, mejorando la HVI tras paratiroidectomía en casos de hiperparatiroidismo secundario a insuficiencia renal avanzado49.
El paricalcitol reduce la HVI en modelos animales de insuficiencia renal (ratas urémicas por nefrectomía casi total)50. Esta mejoría de la HVI se asocia a regulación al alza del RVD y con una reducción del antígeno nuclear de células en proliferación (PCNA –una proteína nuclear expresada en las fases del ciclo celular G1 temprana y S, cofactor de la DNA polimerasa–) y del estrés oxidativo miocárdico51.
Incluso, más interés tienen los hallazgos en ratas Dahl sal-sensibles que desarrollan HTA con dieta rica en sal. En este contexto, el paricalcitol versus placebo produjo un menor peso cardiaco y pulmonar, una menor masa del ventrículo izquierdo, espesor de la pared posterior cardiaca y menor presión telediastólica, sin afectar a la presión arterial, aunque sí redujo significativamente las concentraciones de péptido natriurético cerebral (PNC) y el RNAm de PNC, factor natriurético atrial y renina52. También algunos otros datos en pacientes ilustran también este papel. Un estudio retrospectivo de 38 sujetos con insuficiencia renal tratados o no con paricalcitol durante 12 meses mostró una mejoría de la función diastólica del ventrículo izquierdo así como una reducción del espesor de la pared posterior (11%) y del septo (15%) en ecocardiografía53. No obstante, recientemente se ha publicado un ensayo clínico con paricalcitol en pacientes con enfermedad renal crónica que no ha mostrado efectos favorables sobre la HVI54.
Efectos en las calcificaciones vascularesLas calcificaciones vasculares están claramente asociadas un mayor incremento del riesgo cardiovascular, especialmente en casos de enfermedad renal crónica avanzada55,56, pero también en población general o en pacientes diabéticos en los que ha mostrado capacidad predictiva tras ajuste por la existencia de diabetes57,58.
Las dosis relevantes de paricalcitol se asocian –y correlacionan– en modelos experimentales con un menor depósito de calcio y un mejor resultado terapéutico, mientras que dosis muy elevadas pueden inducir calcificación vascular. Así, dosis de paricalcitol equivalentes a las terapéuticas reducen la calcificación aórtica y, a nivel molecular, la expresión génica en células de la aorta de osterix, Msx2, Cbfa1/Runx-2 y osteocalcina, marcadores osteoblásticos y osteogénicos y de progresión de la calcificación vascular, aunque no todos los activadores del receptor de vitamina D son tan eficaces o seguros a las dosis equivalentes a las empleadas en la clínica59,60. La rigidez vascular es una consecuencia, en parte, de la calcificación de la capa media arterial. Así, esta reducción de las calcificaciones mantiene los valores normales de la velocidad de la onda del pulso –medida de la rigidez vascular–61,62.
Efectos en la coagulaciónLa diabetes se asocia a una hiperactividad de los sistemas que controlan la coagulación63. Tanto el inhibidor del activador del plasminógeno (PAI-1), la trombospondina-1 (TBS1) y la trombomodulina (TM), se han visto implicados en el desarrollo de la arteriotrombosis.
Pues bien, en cultivos de células musculares lisas aórticas (CML), paricalcitol y calcitriol regulan a la baja y de forma dosis dependiente a PAI-1 (RNAm y proteína), así como a TBS1, mientras que tanto calcitriol como paricacitol regulan al alza tanto RNAm como proteína a TM (proteína con propiedades anti-angiogénicas) que parece ser un gen diana de vitamina D y de paricalcitol64. Si bien no se han detectado RVD ni las enzimas implicadas en su metabolismo en células endoteliales, resulta evidente la importancia de estos hallazgos en los sujetos con diabetes.
Otros efectos: efectos en la inflamación, papel inmuno-modulador, producción de insulina y antitumoralesEs creciente el reconocimiento del papel de la inflamación crónica en el desarrollo de daño orgánico en múltiples enfermedades, por ejemplo el riñón en la insuficiencia renal crónica, el páncreas en la diabetes o el árbol vascular en la enfermedad cardiovascular. El paricalcitol conserva los efectos inmunomoduladores de calcitriol al alterar la diferenciación de las células dendríticas inmaduras a partir de monocitos, bloqueando la producción de interleucina-12 y, por tanto, de células Treg65. En el riñón dañado por un modelo de obstrucción al flujo renal, se observa una reducción de la infiltración inflamatoria acompañada de una reducción de la expresión de quimiocinas RANTES y factor de necrosis tumoral α y relacionada con la inhibición de la vía NF-κB66. Estudios epidemiológicos indican que la insuficiencia de vitamina D podría tener un papel etiológico en varios canceres humanos67. Este papel inmuno-modulador que, como calcitriol, muestra efectos antiproliferativos en líneas de cáncer de próstata y de páncreas68,69, junto a los datos positivos de la modulación de la secreción de insulina por calcitriol y, probablemente por paricalcitol70, hacen su uso muy atractivo en potenciales estudios de prevención y/o tratamiento precoz de la diabetes que se encuentran en marcha (http://clinicaltrials.gov/ct2/show/NCT01003275).
Por último, se han comunicado efectos antiproliferativos de paricalcitol sobre cultivos celulares y modelos experimentales de leucemia mieloide y cáncer de colon mediados por su acción en el RVD, habiéndose propuesto la realización de ensayos clínicos en esas patologías71.
Efectos en hospitalizaciones y mortalidadUn estudio retrospectivo revisó las historias clínicas de 67.399 pacientes tratados solo con calcitriol o paricalcitol. Los pacientes fueron evaluados a lo largo de un periodo de 2 años con las siguientes variables finales: trasplante renal, muerte, cambio a otra formulación de vitamina D o derivación del paciente a otro centro. Los pacientes tratados con paricalcitol frente a los tratados con calcitriol mostraron mayor supervivencia (tasa de mortalidad 0,180/paciente y año frente a 0,223 para calcitriol; p<0,001). La diferencia fue significativa a 12 meses y aumentó con el tiempo de seguimiento, cifrándose la reducción de mortalidad tras ajuste en un 16%. En ninguno de los 42 estratos analizados el calcitriol fue superior mientras que el paricalcitol fue superior en 2824. Otros estudios han mostrado también mejoría de la supervivencia y una reducción de las hospitalizaciones en pacientes tratados con paricalcitol en un 14% (0,64 ingresos al año menos)72–74. El aumento de la supervivencia parece relacionarse con una reducción de la morbi-mortalidad cardiovascular75. Evidentemente son necesarios estudios prospectivos que confirmen estos datos, aunque el impacto favorable de paricalcitol es, hasta el momento, consistente. Debe señalarse además, que el porcentaje de pacientes diabéticos incluidos en estos estudios ronda el 50% (45-48%) y que en ellos los efectos beneficiosos de paricalcitol son indistinguibles de los del grupo completo.
Conclusiones y perspectivasLa relación entre el sistema hormonal, y también paracrino y autocrino, de la vitamina D con la evolución y el pronóstico de los pacientes diabéticos con enfermedad renal ha sido demostrada por un conjunto de evidencias. El desarrollo de los activadores selectivos del receptor de vitamina D con un mejor perfil de seguridad, como el paracalcitol, nos aporta una nueva herramienta para el manejo de estos pacientes que, en la actualidad, presentan una tasa inaceptable de morbimortalidad. El primer paso debe ser corregir el déficit de vitamina D, mecanismo subyacente de la acciones pleiotrópicas. Además, está justificada la puesta en marcha de nuevos estudios que identifiquen con precisión los beneficios de la intervención con este tipo de fármacos en los diferentes estadios de la enfermedad renal de los pacientes diabéticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.