La secreción ectópica (SE) de corticotropina (ACTH) representa aproximadamente el 10% de los síndromes de Cushing (SC) ACTH-dependientes. Cerca de un 50% de los casos son causados por tumores intratorácicos, la mayoría pequeños carcinoides bronquiales (CB) de muy difícil localización, tardando años en encontrarse. Las técnicas de imagen habitualmente empleadas para su localización incluyen la tomografía computerizada (TC), la resonancia magnética (RM), la gammagrafía con análogos de receptores de somatostatina (OctreoScan®) y con mucha menos experiencia la tomografía de emisión de positrones con fluorodexosiglucosa (PET-FDG18).
Presentamos un caso que se localizó con esta última técnica 6 años después de su presentación.
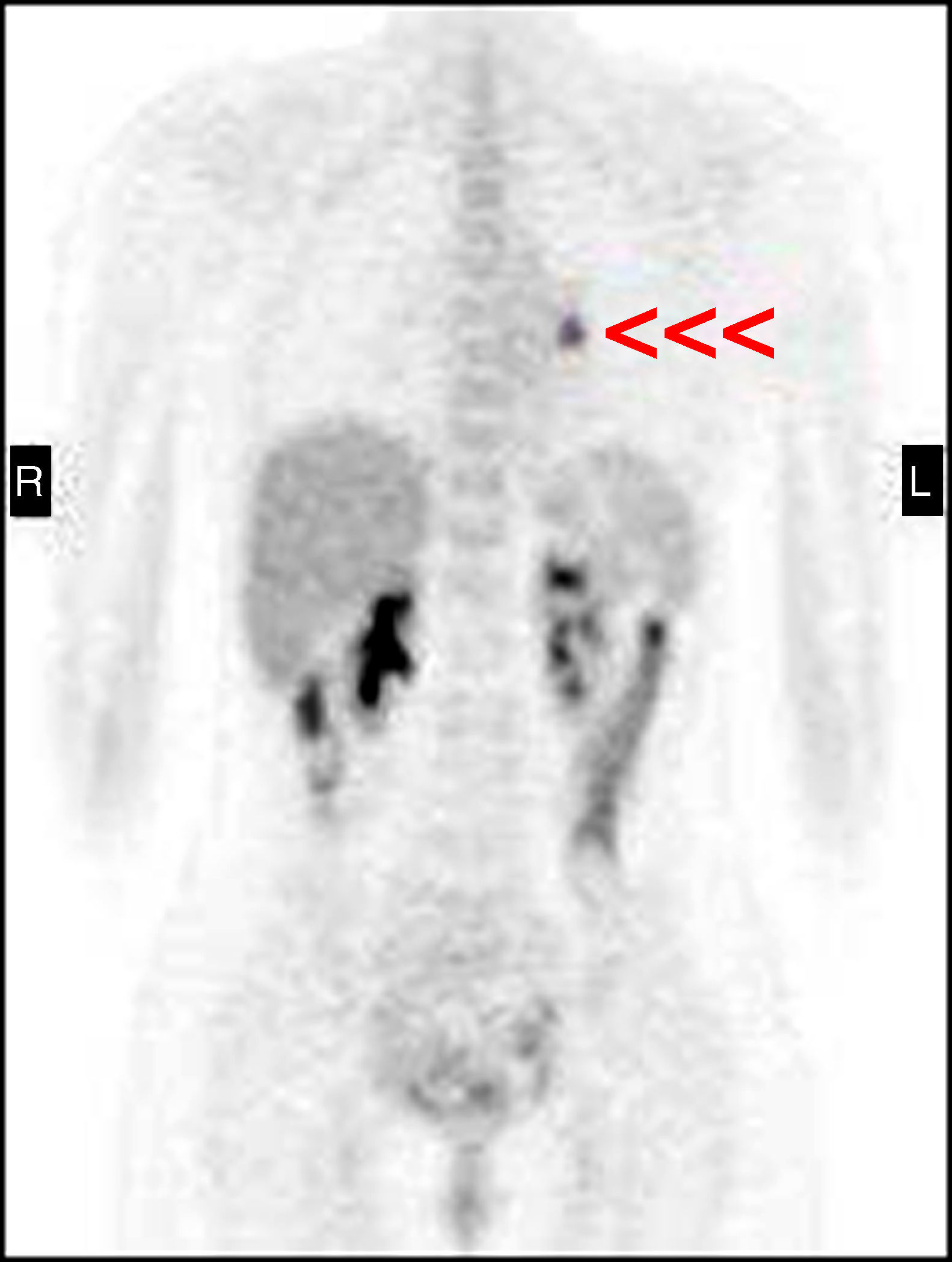
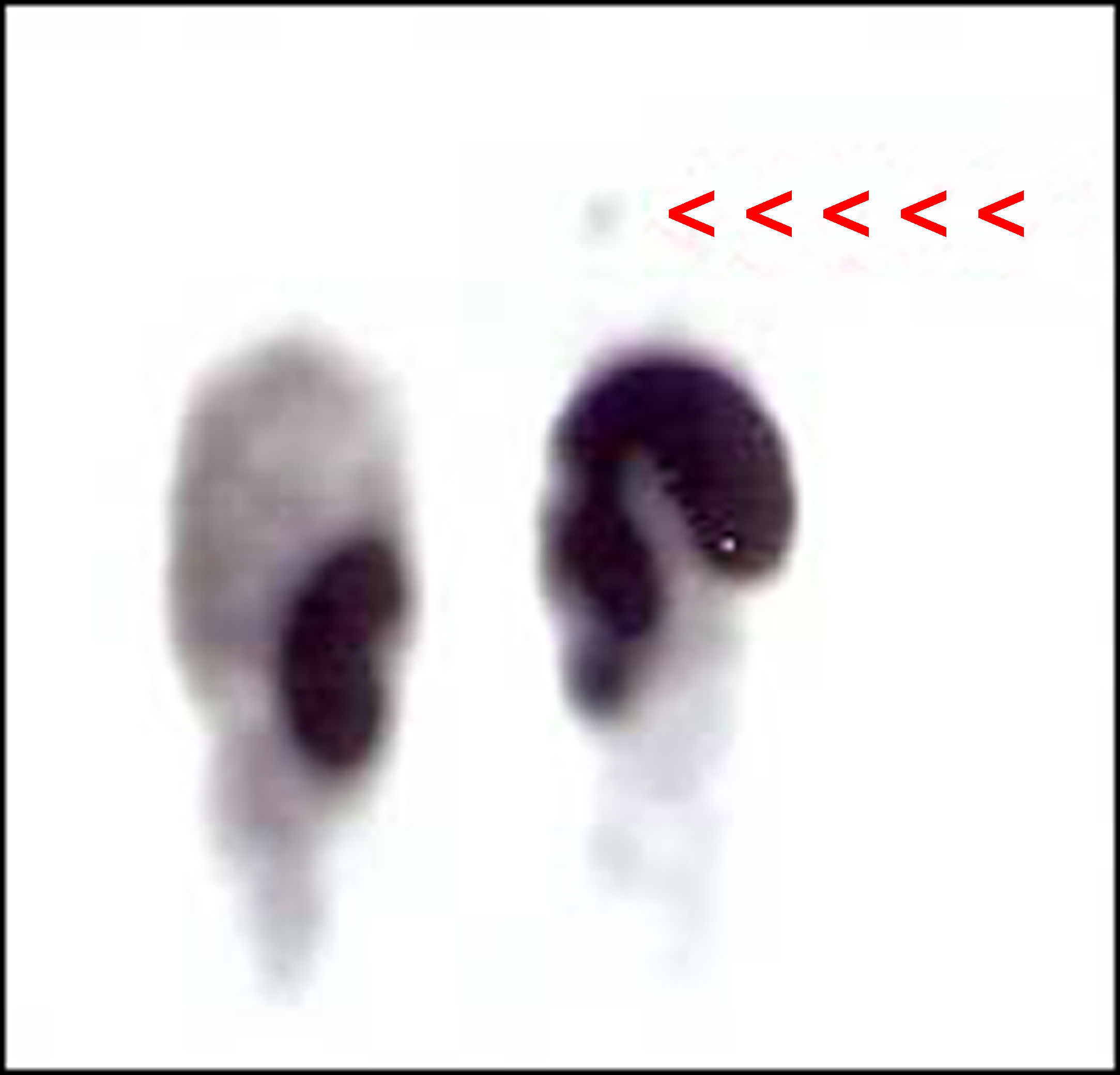
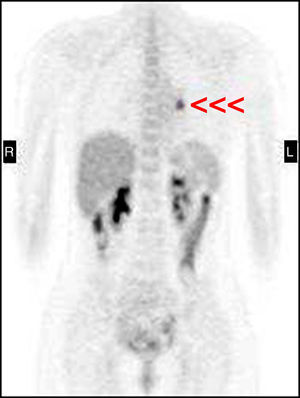
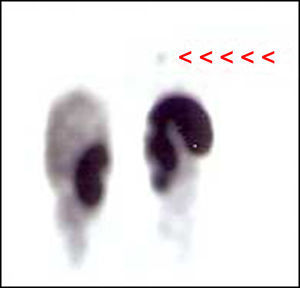
Mujer de 27 años sin antecedentes personales ni familiares de interés, que consultó en el año 2001 por presentar un cuadro de hirsutismo y acné de 6 meses de evolución. En la exploración física destacaba la presencia de cara de luna llena, estrías rojo-vinosas en abdomen, obesidad de tipo central y atrofia muscular con debilidad proximal, todos ellos datos sugestivos de hipercortisolismo. En las pruebas complementarias realizadas destacaba la presencia de hipopotasemia (2,7 mEq/L), cortisolurias elevadas (947 y 19.746 mcg/24 horas), ausencia de frenación del cortisol plasmático (17 mcg/dl) tras 1mg nocturno de dexametasona, una respuesta paradójica del cortisol plasmático tras la administración de 8mg de dexametasona en dosis única nocturna (33 mcg/dl) y cifras de ACTH elevadas (57 y 88 pg/ml). La RM hipofisaria no evidenció lesión alguna y el cateterismo de senos petrosos no mostró ningún gradiente. Ante estos hallazgos se estableció como diagnóstico más probable la existencia de un síndrome de Cushing ectópico (SCE) ACTH-dependiente. Sin embargo, tanto la radiografía de tórax realizada como la TC pulmonar y el OctreoScan® fueron normales. La TC abdominal solo mostró una hiperplasia adrenal bilateral. Dada la intensa clínica de la paciente y la imposibilidad de detectar el origen del cuadro, se inició tratamiento con ketoconazol en dosis crecientes por persistencia del mal control. Periódicamente se realizaron múltiples exploraciones radiológicas (OctreoScan® planar, TC y RM toraco-abdominal, PET, eco vaginal) que fueron siempre normales. Tres años después, tras escape al tratamiento con ketoconazol (cortisoluria 934 y 1.321 mcg/24h con 600mg ketoconazol/día), se realizó una adrenalectomía bilateral laparoscópica que logró descender las cortisolurias (538-611 mcg/24h), con cifras de ACTH oscilantes entre 266-491 pg/ml. Finalmente, en 2007 un rastreo con PET-FDG18 (fig. 1) mostró un depósito patológico de 1,5cm en región pulmonar hiliar izquierda, que posteriormente confirmó el OctreoScan-SPECT (fig. 2). La TC y RM (en secuencia stir), detectaron ese mismo nódulo de 1cm infrahiliar hipocaptante e hiperintenso, sugestivo de tumor carcinoide. Ante estos hallazgos, se realizó una lobectomía inferior izquierda que confirmó la existencia de un CB atípico de 1,1cm y una adenopatía hiliar con inmunohistoquímica positiva para ACTH. Tras la cirugía, las cifras de ACTH descendieron a menos de 5 pg/ml. Tres años tras la intervención, la paciente permanece libre de enfermedad.
La SE de ACTH era causada en el pasado mayoritariamente por carcinomas pulmonares de células pequeñas. Sin embargo, en las series más recientes, el CB aparece como el primero en frecuencia. Estos tumores frecuentemente plantean serios problemas diagnósticos1 y de localización. Esto es debido a que: 1) por su lento crecimiento producen un cuadro clínico prácticamente indistinguible del SC de origen hipofisario, 2) presentan resultados de laboratorio equívocos (supresión de cortisol plasmático tras la administración de dexametasona en el 50% de los casos), respuesta a metirapona, elevaciones moderadas de ACTH, y 3) la mayoría son pequeños (menos de 2cm), indistinguibles de vasos sanguíneos normales y por tanto difíciles de visualizar con técnicas de imagen convencionales1.
Las técnicas de imagen habitualmente empleadas para la localización de un SCE son la TC torácico-abdominal (con especial atención al territorio pulmonar) y la RM. Sin embargo, en el 30-50% de los casos y pese a su repetición a lo largo del tiempo, estas exploraciones no son diagnósticas, por lo que suele recurrirse a la realización de un OctreoScan®2. Dado que su utilidad depende del tipo y grado de expresión de receptores para la somatostatina, tamaño, localización y cantidad de radioactividad depositada en la lesión, éste no siempre es diagnóstico y ciertos tumores permanecen ocultos3. En nuestro caso esto podría deberse a: 1) el pequeño tamaño tumoral (aunque diversos estudios establecen que la positividad del OctreoScan® no estaría influenciada por esta variable1), 2) la inhibición inicial de la expresión de los receptores de somatostatina por el elevado hipercortisolismo, que disminuyó lo suficiente tras la adrenalectomía para que se pudiesen expresar (si bien existen casos descritos de resultados positivos en pacientes con intenso hipercortisolismo)1, o 3) una expresión baja de receptores dada la atipia tumoral1.
Con el fin de obtener mejores resultados, las imágenes planares del OctreoScan®, deben realizarse combinadas con tomografía por emisión de fotón único (SPECT). Éste ha demostrado mejorar claramente la sensibilidad del OctreoScan® planar, por lo que su asociación sería útil en caso de OctreoScan® normal con alta sospecha clínica de tumor neuroendocrino (como el nuestro) o ante imágenes planares de difícil valoración4.
El PET-FDG18 es una técnica fundamental en oncología empleada para la detección y monitorización de lesiones con gran actividad metabólica3, actividad proliferativa alta y habitualmente pobremente diferenciadas1. Sin embargo, dado que su sensibilidad viene delimitada por el turnover metabólico del tumor (menor en carcinoides y otros tumores de crecimiento lento), clásicamente se ha considerado a los CB como tumores PET-FDG18 negativos2. Actualmente, su utilidad en estas situaciones es controvertida: Pacak et al2, tras estudiar una serie de 17 pacientes con SCE oculto (RM/TC normal) concluyeron que esta técnica no añadía información adicional a la proporcionada por las pruebas convencionales, al no detectar ningún tumor que no hubiera detectado ya la TC o RM. Por el contrario, además del nuestro, hay descritos en la literatura varios casos1,3,5–7 en los que el PET-FDG18 (solo o combinado con TC) sí fue útil en la localización de SCE oculto por tumor carcinoide. Además, diversos estudios han mostrado su utilidad en la detección de tumores neuroendocrinos en general (secretores y no secretores)8,9, principalmente atípicos (por presentar mayor hipermetabolismo)10.
El desarrollo de nuevos trazadores para el PET (Ga68-DOTA-péptidos como DOTATOC, DOTANOC y DOTATATE) que se unen específicamente a receptores de la somatostatina presentes en los tumores neuroendocrinos (tipo 2, tipo 5 y en menor medida tipo 3), supondrá un cambio significativo en el seguimiento de estos tumores11. Esto es porque por su mayor resolución espacial (al combinar PET y TC) presentan una mayor sensibilidad para la detección de tumores neuroendocrinos bien diferenciados, en comparación con otras técnicas de imagen. Además, dado que el Ga68 es un producto obtenido de un generador en lugar de un ciclotrón, su obtención es más sencilla.
En conclusión, el PET-FDG18, y en un futuro próximo el PET/CT Ga68-DOTA-péptidos, puede ser útil en el estudio del SCE oculto cuando las técnicas convencionales (TC, RM, OctreoScan®) sean normales o muestren lesiones de significado incierto.