Como consecuencia de los cambios fisiológicos originados durante la gestación, los valores de referencia de las hormonas tiroideas en mujeres embarazadas son diferentes a los de la población general1. Tanto la Sociedad Española de Endocrinología y Nutrición (SEEN)2, como las Sociedades Científicas americanas y europeas3,4, recomiendan que las hormonas tiroideas durante la gestación se evalúen frente a valores de referencia para cada trimestre y población, con las técnicas de laboratorio propias. El objetivo de este trabajo fue establecer los valores de referencia durante el primer trimestre del embarazo para las hormonas TSH, T4 libre y T3 libre, la prevalencia de enfermedad tiroidea autoinmune y el grado de implantación del cribado universal de disfunción tiroidea, en el momento actual, de nuestra área de salud. Además, constituye el único estudio de los publicados hasta la fecha que establece 2 rangos de referencia dentro del primer trimestre gestacional (<11 semanas y de 11-13 semanas).
Se realizó un estudio prospectivo, incluyendo todas las gestantes que acudieron al servicio de análisis clínicos de nuestro Complejo Hospitalario para realizar cribado prenatal de aneuploidías (semanas 11 a 13), durante el periodo junio-julio de 2014. Junto a la muestra para la detección de cromosomopatías fetales se obtuvo otra muestra de sangre para determinación de TSH, T4 libre, T3 libre, anticuerpos anti-peroxidasa tiroidea y anticuerpos anti-tiroglobulina. Todos los parámetros analíticos se determinaron con un inmunoanálisis quimioluminiscente de micropartículas de 2 pasos, con protocolos Chemiflex®, en un analizador Architect® i2000sr de Abbott-Diagnostics (EE. UU.). Se calculó para cada variable el intervalo de confianza de los percentiles 2,5 y 97,5, que corresponden a los límites inferior y superior de los valores de referencia, siguiendo las recomendaciones de la International Federation of Clinical Chemistry5.
El tamaño muestral comprendió 454 gestantes, que suponen un 12% de los 3.516 partos ocurridos en nuestra área sanitaria en 2014. Para el cálculo de los valores de referencia se excluyeron 119 mujeres (26,2%): 74 (16,3%) presentaban autoinmunidad tiroidea positiva, 33 tenían antecedentes personales de enfermedad tiroidea (7,3%), 4 una diabetes previa (0,9%) y 5 una gestación gemelar (1,1%). Por último, fueron excluidas 3 gestantes por falta de algún dato analítico.
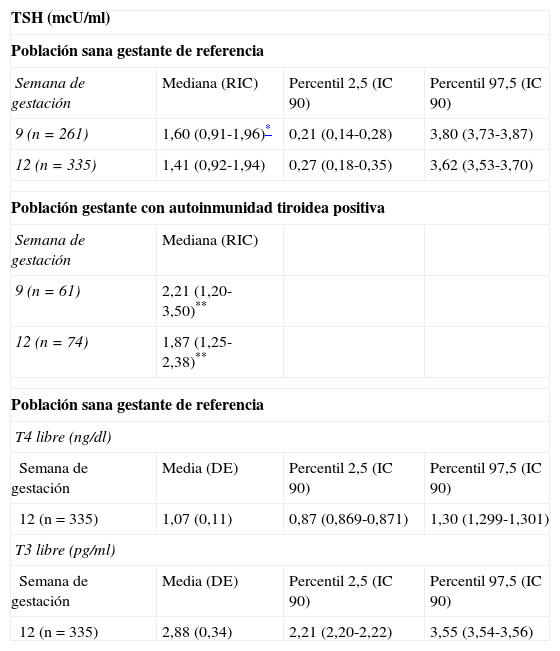
El grupo final sobre el que se calcularon los valores de referencia y que consideraremos como población gestante sana fue de 335 mujeres. De este grupo 261 (77,9%) presentaron estudio analítico previo, que contenía, al menos, la determinación de TSH en la primera parte del primer trimestre (antes de la semana 11). En la tabla 1 se presentan los valores de referencia obtenidos para hormonas tiroideas y TSH antes de la semana 11 (mediana semana 9), y entre las semanas 11-13 (mediana semana 12). Los resultados obtenidos a lo largo del primer trimestre fueron estadísticamente diferentes a los valores de referencia de la población no gestante, observando concentraciones significativamente superiores de TSH en pacientes con autoinmunidad tiroidea positiva.
Intervalos de referencia de los test de función tiroidea (P 2,5-P 97,5) en la población sana gestante y resultados de función tiroidea en las mujeres con autoinmunidad tiroidea positiva en los 2 periodos del estudio
| TSH (mcU/ml) | |||
| Población sana gestante de referencia | |||
| Semana de gestación | Mediana (RIC) | Percentil 2,5 (IC 90) | Percentil 97,5 (IC 90) |
| 9 (n=261) | 1,60 (0,91-1,96)* | 0,21 (0,14-0,28) | 3,80 (3,73-3,87) |
| 12 (n=335) | 1,41 (0,92-1,94) | 0,27 (0,18-0,35) | 3,62 (3,53-3,70) |
| Población gestante con autoinmunidad tiroidea positiva | |||
| Semana de gestación | Mediana (RIC) | ||
| 9 (n=61) | 2,21 (1,20-3,50)** | ||
| 12 (n=74) | 1,87 (1,25-2,38)** | ||
| Población sana gestante de referencia | |||
| T4 libre (ng/dl) | |||
| Semana de gestación | Media (DE) | Percentil 2,5 (IC 90) | Percentil 97,5 (IC 90) |
| 12 (n=335) | 1,07 (0,11) | 0,87 (0,869-0,871) | 1,30 (1,299-1,301) |
| T3 libre (pg/ml) | |||
| Semana de gestación | Media (DE) | Percentil 2,5 (IC 90) | Percentil 97,5 (IC 90) |
| 12 (n=335) | 2,88 (0,34) | 2,21 (2,20-2,22) | 3,55 (3,54-3,56) |
DE: desviación estándar; IC 90: intervalo de confianza del 90%; RIC: rango intercuartílico.
Existieron diferencias estadísticamente significativas (p<0,01) para los valores de TSH en la población sana gestante entre los 2 periodos del primer trimestre: primera parte antes de la semana 11 (mediana 9 semanas) y segunda parte entre la semana 11 y 13 (mediana 12 semanas).
**Existieron diferencias estadísticamente significativas (p<0,001) para los valores de TSH entre las mujeres embarazadas con autoinmunidad tiroidea y la población sana gestante de referencia, en los 2 periodos del trimestre.
Estos resultados no difieren sustancialmente de los obtenidos en los últimos 6 años por otros grupos de trabajo españoles en distintas áreas geográficas nacionales, con diferente metodología analítica y semana gestacional6–8. Cabe destacar que los intervalos de referencia para TSH y hormonas tiroideas obtenidos en este trabajo y en los estudios nacionales previos son claramente superiores respecto a los valores de referencia recomendados por las guías internacionales (<2,5mcU/ml)3,4, en el caso de no disponer de rangos de normalidad propios del primer trimestre. Considerar como valor máximo de normalidad 2,5mcU/ml para TSH en el primer trimestre tendría consecuencias inmediatas en el manejo de la disfunción tiroidea en el embarazo, suponiendo una importante sobrecarga asistencial y económica, además de sobrediagnosticar hipotiroidismo en un porcentaje no desdeñable de gestaciones.
Los intervalos de referencia para TSH en 2 periodos diferentes del primer trimestre (en la semana 9 y en la semana 12) nos permitirán filiar de forma más precisa la existencia de disfunción tiroidea en la población gestante de nuestra área geográfica. De forma ideal creemos que el cribado debe realizarse antes de la semana 10, para poder detectar precozmente la disfunción tiroidea, dado que el hipotiroidismo subclínico se asocia con un aumento del riesgo de complicaciones durante el embarazo y de déficits neurocognitivos del feto en desarrollo. En aquellas mujeres en las que no se ha realizado el estudio en la primera parte del trimestre podría utilizarse la extracción del cribado neonatal para obtener datos de función tiroidea y poder interpretarlos con valores de referencia específicos entre la semana 11 y 13. Los valores de TSH algo inferiores en este tramo del embarazo pueden estar en relación con la producción máxima de gonadotropina coriónica, que ocurre en la parte final del primer trimestre (a partir de la semana 9 de gestación). Estos resultados son similares a los obtenidos por Bocos-Terraz et al.6, que constataron valores de TSH entre las semanas 11 a 20 algo inferiores a los obtenidos antes de la semana 11.
Establecer valores de referencia propios permite conocer la verdadera prevalencia de disfunción tiroidea en nuestra población gestante, actualmente desconocida, y además, nos permitirá implementar programas de cribado universal en nuestra área sanitaria. En el momento actual el cribado se realiza, únicamente, al 77,9% de los embarazos, siendo la TSH la prueba mayoritariamente solicitada. En este sentido, la SEEN publicó un documento de consenso en el que recomienda realizar cribado universal frente a una búsqueda selectiva de disfunción tiroidea en el embarazo2. Destacar que las guías internacionales3,4 aún no reflejan esta recomendación, predominando la sugerencia de cribado dirigido.
La prevalencia de autoinmunidad tiroidea en este trabajo es una de las más altas descritas en los diferentes estudios nacionales6–8. En análisis previos realizados por nuestro grupo9 ya se objetivó un elevado porcentaje de autoinmunidad tiroidea en mujeres gestantes de nuestra zona: 11,6% y 9,9% presentaban anticuerpos anti-peroxidasa tiroidea y anti-tiroglobulina positivos, respectivamente. Esta elevada prevalencia de autoinmunidad tiroidea respaldaría los resultados de Jaén et al.10, que demostraban en gestantes del área urbana de Toledo una prevalencia de tiroiditis posparto muy superior a la descrita en otras áreas españolas (15,9%). Las mujeres con autoinmunidad tiroidea positiva presentan niveles de TSH más elevados que la población sin tiroiditis de base, por lo que deben ser excluidas del cálculo de los valores de referencia y constituyen, además, una población de riesgo para desarrollar disfunción tiroidea durante el embarazo y tras el parto. Faltan estudios de intervención y, por lo tanto, evidencia científica suficiente que demuestre el beneficio que el tratamiento con tiroxina pueda tener en este grupo de pacientes, tanto sobre los resultados obstétricos como desde el punto de vista del desarrollo neurológico fetal e infantil.
En conclusión, los intervalos de referencia para TSH y hormonas tiroideas obtenidos en este trabajo permitirán interpretar de forma adecuada los test de función tiroidea en las gestantes de nuestra área de salud, evitando un diagnóstico incorrecto de hipotiroidismo subclínico en un número importante de pacientes o permitiendo instaurar el tratamiento de forma precoz.
El conocimiento de los valores de referencia referidos a nuestra población y técnica de laboratorio nos ayudará a potenciar e implementar programas de cribado universal de disfunción tiroidea asociada a gestación, teniendo presente que, en aquellas mujeres en las cuales no se haya solicitado el estudio en la primera parte del primer trimestre, podría emplearse la extracción destinada al cribado prenatal de cromosomopatías, obteniendo los datos de la función tiroidea y su interpretación respecto a los valores de referencia específicos para las semanas 11 a 13. En un área geográfica con un porcentaje tan significativo de autoinmunidad tiroidea y tiroiditis posparto, una estrategia de futuro podría ser incluir en los test de cribado del primer trimestre, además de la TSH, la titulación de los anticuerpos anti-tiroideos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en relación con los datos publicados.
Este trabajo no hubiera sido posible sin la colaboración de Abbott-Diagnostics, por facilitarnos todo el material necesario para la realización de las determinaciones de TSH, T4L, T3L y anticuerpos anti-tiroideos; agradecemos muy especialmente a Elena Romero (especialista en inmunoquímica de Abbott Científica), sin cuya ayuda no hubiera sido posible realizar este estudio.