Presentamos el caso de un paciente varón de 34 años, afecto de enfermedad de Crohn en tratamiento crónico con 6-mercaptopurina, a quien se diagnosticó hiperplasia nodular regenerativa secundaria a este tratamiento. La sospecha clínica se realizó por alteraciones analíticas en el perfil hepático y por signos ecográficos de hipertensión portal. Finalmente, el diagnóstico se confirmó mediante biopsia hepática.
We report the case of a 34-year-old male patient with Crohn's disease, undergoing chronic treatment with 6-mercaptopurine, and who was diagnosed with nodular regenerative hyperplasia secondary to this treatment. The diagnosis was suspected when abnormalities in liver function tests were observed and ultrasonography showed signs of portal hypertension. The final diagnosis was confirmed by liver biopsy.
Las tiopurinas (6-mercaptopurina y azatioprina) son fármacos utilizados en enfermedades autoinmunes, como en el mantenimiento de la remisión de los pacientes con enfermedad inflamatoria intestinal, así como en enfermedades neoplásicas como leucemias o linfomas1,2. Sin embargo, los efectos secundarios de estos fármacos son frecuentes, y hasta un 15% de los pacientes los suspenden debido a ellos. La hepatotoxicidad es un efecto adverso que se llega a observar hasta en un 3,3% de los pacientes en tratamiento con fármacos tiopurínicos. Existen diferentes mecanismos de hepatotoxicidad relacionados con estos fármacos, y un amplio espectro de manifestaciones. Así, la hiperplasia nodular regenerativa (HNR) es una de las entidades que pueden producirse por el uso crónico de tiopurinas3.
Caso clínicoPresentamos el caso de un paciente varón de 34 años de 80kg de peso aproximadamente, a quien se diagnosticó enfermedad de Crohn en 2009 mediante colonoscopia y confirmación histológica. Presentaba una localización ileocólica (L3), con patrón estenosante (B2). Tras el diagnóstico se inició tratamiento con corticoides y 200mg de azatioprina, que 3 meses después tuvo que ser sustituido por 100mg diarios de 6-mercaptopurina debido a la intolerancia gastrointestinal, consiguiendo buen control clínico y analítico.
En enero de 2015, siguiendo controles habituales, se detectó alteración del perfil hepático y pancitopenia progresiva. Los datos de laboratorio en mayo del 2015 eran: leucocitos, 2.920/μl (3.900-11.000); plaquetas, 43.100/μl (130.000-420.000); recuento de hematíes, 3,50 células×106/μl (4,50-5,90); AST, 67U/l (5-34); ALT, 59U/l (0-55); GGT, 105U/l (12-64); FA, 118U/l (40-150); bilirrubina total, 1,8mg/dl (0,2-1,2); bilirrubina directa, 0,7mg/dl (0,0-0,5). Se descartó el consumo de alcohol, y las serologías víricas, los parámetros de autoinmunidad, los niveles de alfa-1 antitripsina y el metabolismo del hierro y cobre fueron normales. También se realizó un estudio de anemia que incluía perfil férrico, ácido fólico y vitamina B12, Coombs directo e indirecto, morfología en sangre periférica, estudio de hemoglobinuria paroxística nocturna y biopsia de médula ósea, que no aportaron datos relevantes.
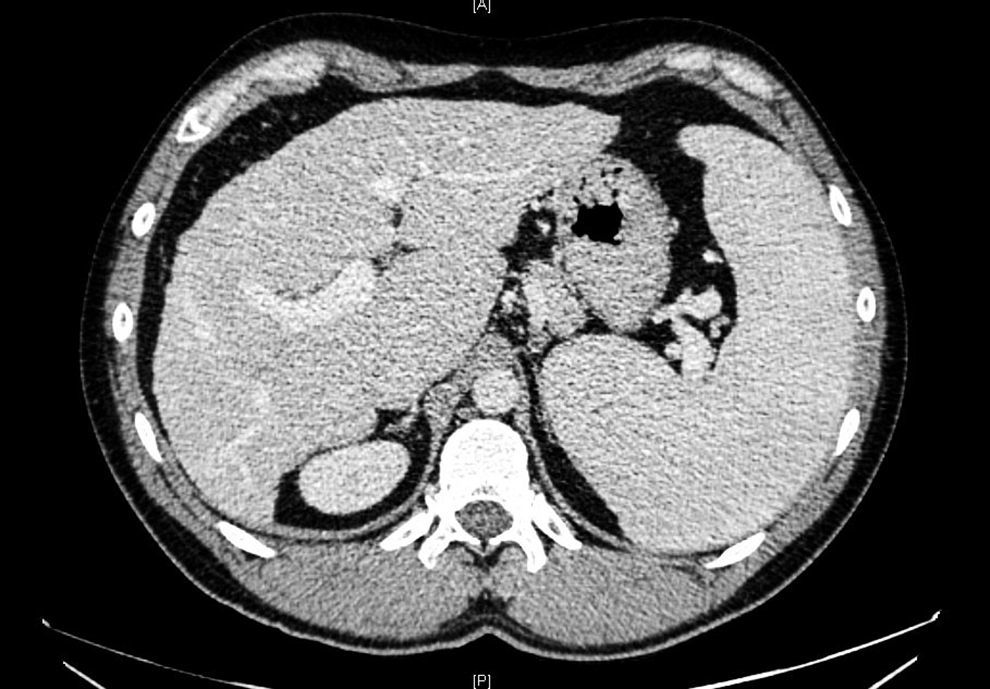
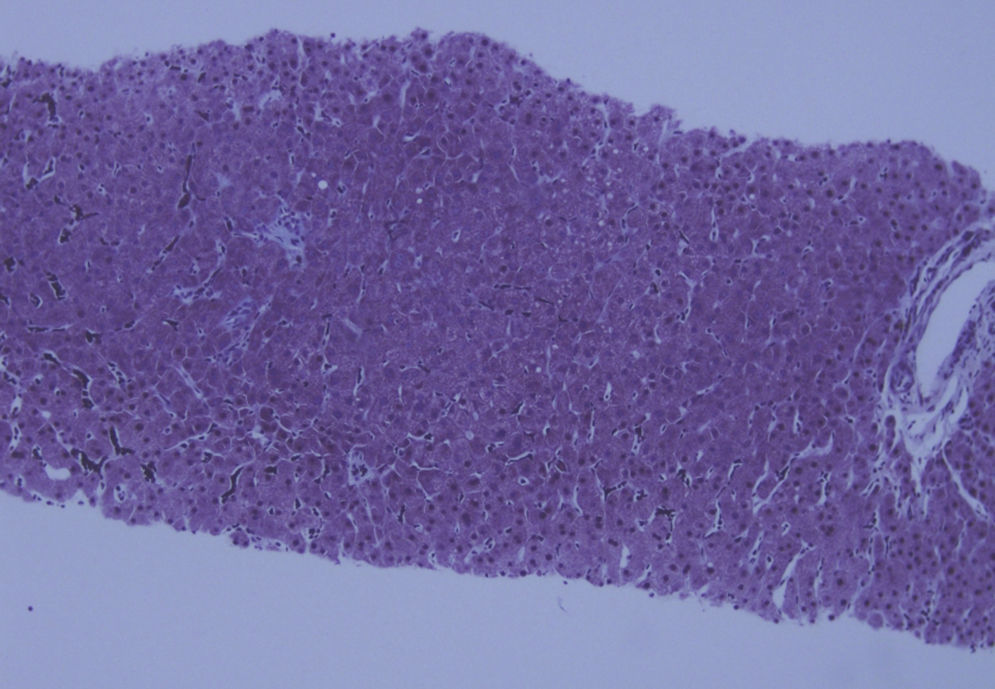
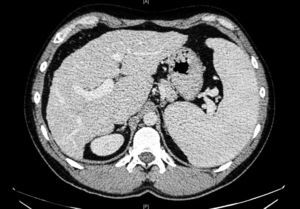
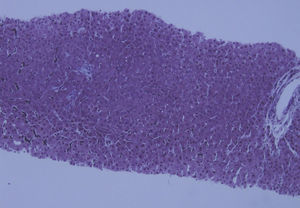
Ante dichos hallazgos se solicitó estudio de imagen por ecografía y TC abdominal, que evidenció un hígado de pequeño tamaño, de contornos nodulares e hipertrofia relativa del lóbulo hepático izquierdo, con signos de hipertensión portal (HTP) (fig. 1). La elastografía de transición reveló fibrosis de 14kPa y una gastroscopia descartó la presencia de varices esofágicas. Con la sospecha de HTP de causa no aclarada, se decidió completar el estudio mediante biopsia hepática por vía transyugular. El análisis histológico identificó una importante alteración arquitectural, con nódulos de regeneración y trabéculas regenerativas, muy evidentes con la tinción de reticulina, así como aumento de la celularidad inflamatoria sinusoidal, sin evidenciar actividad necroinflamatoria o fibrosis destacable. Dichos hallazgos eran compatibles con el diagnóstico de HNR (fig. 2).
En posteriores controles analíticos se evidenció un aumento progresivo en el número de leucocitos, hematíes y plaquetas, así como la normalización de los parámetros del perfil hepático, hasta una prácticamente normalización de todos los datos de laboratorio tras un año de la suspensión del tratamiento con 6-mercaptopurina.
DiscusiónLas tiopurinas son los fármacos inmunomoduladores convencionales más ampliamente utilizados en el tratamiento de la enfermedad inflamatoria intestinal (EII). Inhiben la síntesis de purinas de novo interfiriendo en la estructura del ADN y, por tanto, en la proliferación celular. Están indicadas en el tratamiento de mantenimiento de la remisión en la EII moderada a grave, cuando el paciente no responde a esteroides, estos están contraindicados o la dosis necesaria de los mismos produce efectos secundarios graves, alcanzando su máxima eficacia aproximadamente a los 3 meses de su inicio4.
La incidencia de efectos secundarios de las tiopurinas es elevada, representando el motivo de abandono del tratamiento hasta en un 15% de los casos. Se conocen 2 mecanismos de acción para dichas reacciones adversas: alérgicas o idiosincráticas y dosis-dependientes. Las primeras tienen lugar al inicio del tratamiento (3-4 primeras semanas), siendo dosis-independientes y con efecto positivo tras la reexposición; se incluyen síntomas generales como malestar general, náuseas y vómitos, diarrea, fiebre, exantema cutáneo, mialgias y artralgias diseminadas, pudiendo producir también episodios de pancreatitis aguda o algunos tipos de hepatitis. Las reacciones adversas dosis-dependientes están relacionadas con el déficit de la actividad enzimática de la tiopurinametiltransferasa (TMPT), por acumulación de metabolitos de la tioguanina, siendo ejemplos la mielosupresión, el desarrollo de neoplasias y algunos casos de toxicidad hepática3.
La hepatotoxicidad es un fenómeno que se observa en un 3,3% de los pacientes en tratamiento con tiopurinas, pudiendo presentarse entre los 3 meses y los 3 años de tratamiento5. Existen 3 formas de hepatotoxicidad por tiopurinas: a) la esteatosis hepática, manifestándose hasta en un 30% de los pacientes en tratamiento con estos fármacos, en forma de elevación de transaminasas séricas, que se resuelve al disminuir o suprimir la dosis; b) la hepatitis colestásica, que suele aparecer 1-3 meses después del inicio del tratamiento, coincidiendo con un aumento de dosis, presenta datos histológicos de necrosis hepatocelular con un variable componente de inflamación, y c) un tercer tipo de hepatotoxicidad que es secundario a una lesión endotelial, y engloba varias entidades: HNR, enfermedad venooclusiva y peliosis hepática2,3.
La HNR es una entidad benigna poco frecuente, descrita por primera vez por Ranstrom en 1953 como «adenomatosis miliar hepatocelular», que posteriormente Steiner Coind denominó HNR, término actualmente aceptado para esta lesión. También es conocida como HTP idiopática o fibrosis portal no cirrótica y, aunque en el pasado se consideraban estas entidades como diferentes enfermedades, actualmente se consideran diferentes estadios histológicos de una misma enfermedad. Es una causa de HTP no cirrótica, siendo clasificada como HTP intrahepática presinusoidal, con un pronóstico generalmente bueno, a diferencia de la HTP secundaria a la cirrosis6. Se debe al daño de las células endoteliales sinusoidales y de las vénulas hepáticas, que deriva en la oclusión no trombótica de los vasos y la posterior aparición de HTP7,8. Su etiología es incierta, aunque se ha relacionado con varios mecanismos etiopatogénicos como infecciones crónicas o recurrentes, infección por VIH, estados de hipercoagulabilidad, alteraciones inmunológicas, predisposición genética o exposición a algunos tóxicos y drogas, entre ellos las tiopurinas. Se ha postulado recientemente que el mecanismo de lesión de estos fármacos podría estar en relación con la depleción de glutatión que producen9.
La HNR debe sospecharse ante la presencia de alteraciones analíticas (pancitopenia, alteración del perfil hepático) y/o signos de HTP (esplenomegalia —típica de esta entidad—, ascitis y varices esofágicas), tras comprobar una correcta permeabilidad de las venas suprahepáticas y el eje esplenoportal en ausencia de cirrosis y de otras causas conocidas de HTP. Por tanto, se debe considerar el estudio hepático en todos los pacientes en tratamiento tiopurínico con trombocitopenia (a menudo el único factor predictor del desarrollo de hepatopatía en fases preclínicas) y/o signos/síntomas de HTP, siendo la técnica de elección para su diagnóstico la biopsia hepática.
La evolución de la HNR tras la supresión de los fármacos tiopurínicos es habitualmente favorable, con normalización de las alteraciones analíticas y regresión de los signos de HTP.
Consideramos de interés este caso clínico por poner en evidencia la importancia de la sospecha diagnóstica de esta entidad en todos los pacientes en tratamiento con fármacos tiopurínicos y datos de HTP.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesSe declara que no han existido conflictos de interés por parte de ningún autor en la elaboración de este documento.