Introducción
Las bartonellas son bacterias gramnegativas, aerobias, no móviles, que se comportan como intracelulares facultativos y de difícil cultivo. Si bien con anterioridad Bartonella se incluía en el orden de los Rickettsiales, los estudios taxonómicos basados en el gen 16S de ARN ribosomal (ARNr) han incluido estas bacterias en el subgrupo a2 de las proteobacterias, más próximas al género Brucella que al género Rickettsia1.
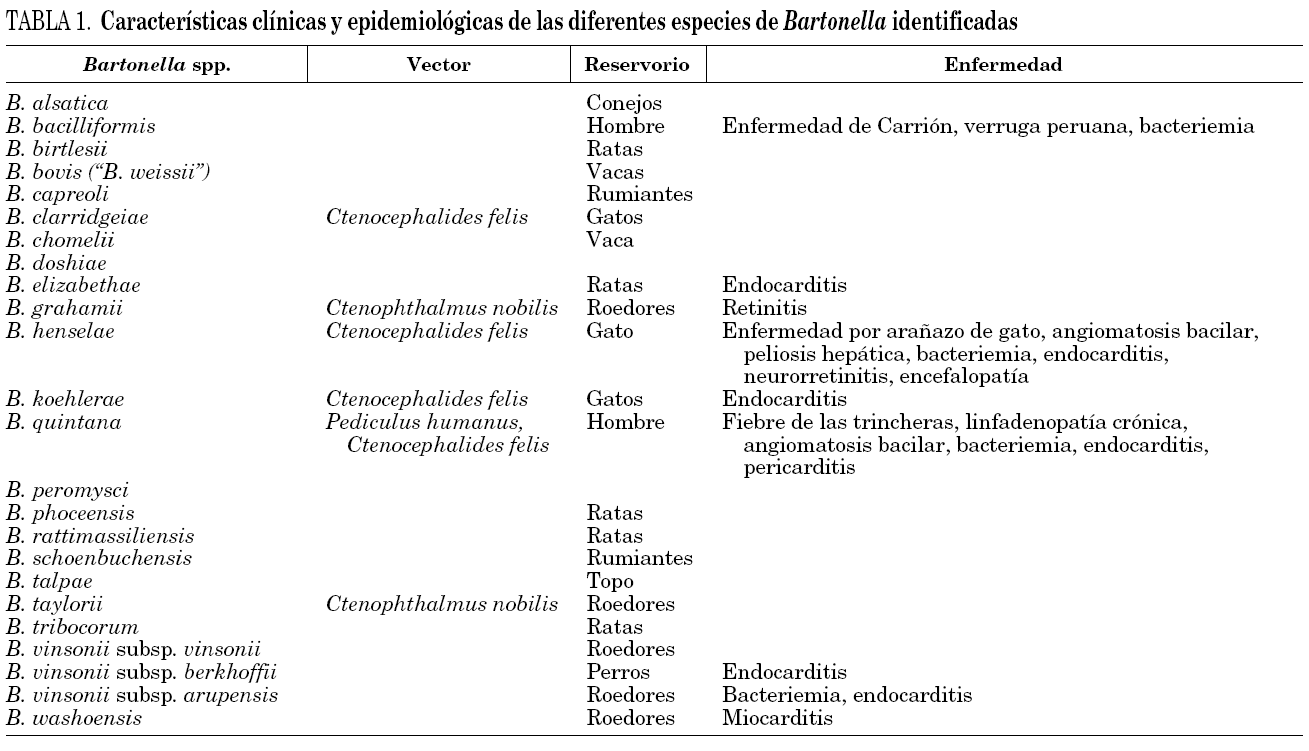
Hasta 1993 sólo había sido implicada en patología humana una especie de Bartonella, B. bacilliformis, causante de la enfermedad de Carrión. En 1993, el análisis filogenético y la secuenciación del gen 16S del ARNr hicieron recomendable una nueva clasificación incorporando al género Bartonella el género Rochalimaea. Además, en los últimos años, gracias a las modernas técnicas de biología molecular y de la mejora en las técnicas de cultivo, se han descrito nuevas especies de Bartonella y se ha podido implicar a alguna de ellas en patología humana (tabla 1).
Las principales especies de Bartonella implicadas en nuestro medio en enfermedades humanas son B. henselae y B. quintana. Ambas especies mantienen similitudes genéticas, pueden ser transmitidas por vectores, usan a los mamíferos como reservorios, infectan a los mismos tipos de células (endoteliales y eritrocitos) y producen cambios vasculoproliferativos en los pacientes inmunodeprimidos. Una de sus diferencias radica en el reservorio. Mientras que B. quintana usa sólo al hombre, B. henselae utiliza al gato2.
En España estas infecciones son relativamente frecuentes, nuestro grupo de trabajo ha detectado la presencia de diferentes especies de Bartonella (B. henselae y B. clarridgeiae) en pulgas de gato, llegando a una proporción del 15%. Además, hemos diagnosticado numerosos pacientes con enfermedad por arañazo de gato, y algunos pacientes con angiomatosis bacilar, y endocarditis (datos pendientes de publicación).
Epidemiología
Con la excepción de B. bacilliformis que está circunscrita a ciertas regiones de la cordillera de los Andes, el resto de bartonellas están ampliamente distribuidas por la geografía terrestre. La distribución de B. bacilliformis guarda relación con la distribución de su vector, Lutzomyia verrucarum3. Otros potenciales vectores de bartonellas son las pulgas de los gatos (Ctenocephalides felis). En estas pulgas se ha aislado B. henselae, B. clarridgeiae, B. koehlerae y B. quintana4. No obstante, y hasta la fecha, el único vector reconocido de B. quintana es el piojo corporal (Pediculus humanus corporis). En los últimos años también se ha descrito la presencia de Bartonella spp. en Ixodes ricinus5, si bien queda por conocer el papel epidemiológico que tienen las garrapatas en este tipo de infecciones.
Respecto a los reservorios, el gato es el reservorio natural de B. henselae y B. clarridgeiae6, y los ratones campestres (p. ej., Peromyscus leucopus) de B. vinsonii, B. grahamii, B. doshiae y B. taylorii. Hasta la fecha, no existe otro reservorio conocido que el hombre, para B. quintana y B. bacilliformis7. En los mamíferos, cada especie de Bartonella está adaptada a su reservorio, pudiendo producir bacteriemias persistentes debido al tropismo de este grupo de bacterias por los hematíes. En estos pueden persistir de forma asintomática largos períodos de tiempo8. Esta localización se ha demostrado en hematíes de gatos (B. henselae)9, de alcohólicos y de vagabundos (B. quintana)10.
Fisiopatología
Si bien la fisiopatología de la infección por las diferentes especies de Bartonella es compleja11, un rasgo común a todas ellas es su tropismo por los hematíes y por las células endoteliales. Los modelos de experimentación animal nos han permitido conocer que tras la inoculación de las bacterias en sangre, estas desaparecen rápidamente del torrente circulatorio, permaneciendo estéril durante al menos 72 h. Con posterioridad (del cuarto al quinto día tras la inoculación) estas bacterias reaparecen en sangre. Si bien no se conoce el primer nicho en el que se multiplican las bartonellas, existen evidencias que sugieren que esta multiplicación se realiza en las células endoteliales. Con posterioridad las bartonellas invaden los hematíes mediante la secreción de sustancias (deformina) que producen invaginaciones en la membrana del hematíe. Los hematíes infectados pueden tener una supervivencia normal (B. quintana) o reducida (B. bacilliformis), dependiendo del porcentaje de hematíes infectados. En pacientes con fiebre de las trincheras, B. quintana infecta al 0,005% de los hematíes; por el contrario, en pacientes con fiebre de Oroya (la forma aguda de la enfermedad de Carrión), B. bacilliformis infecta hasta el 80%. Una vez que las bartonellas salen al exterior de los hematíes, vuelven a infectar las células endoteliales, lo que perpetúa el ciclo infeccioso. En las células endoteliales las bartonellas invaden su endotelio vascular, produciendo factores mitogénicos que actúan de forma local y temporal. Además, las bartonellas producen vasoproliferación por dos vías. Por un lado, algunas especies como B. henselae y B. quintana producen sustancias antiapoptosis, que retrasan la muerte celular. Por otro, libera factores vasoproliferativos como el factor de crecimiento del endotelio vascular (VEGF). Junto a todo lo anterior, la infección por Bartonella spp. produce diversas interleucinas (IL-6, IL-8, IL-10, etc.), alguna de las cuales atenúan los efectos de la respuesta inflamatoria.
Por último, en algunas bartonellas como en el caso de B. henselae, la posibilidad de desarrollo de cuadros clínicos más o menos graves se ha relacionado con la existencia de diversos genotipos. Recientemente se ha comunicado la presencia en B. henselae variedad Houston-1 (genotipo I), de un sistema de secreción tipo IV (T4SS) similar al sistema de virulencia de Agrobacterium tumefaciens, que podría hacer de esta una variedad más patógena11.
Manifestaciones clínicas
Una de las características de las infecciones por Bartonella spp. es que una misma especie de Bartonella puede causar un amplio espectro de manifestaciones clínicas.
Enfermedad por arañazo de gato
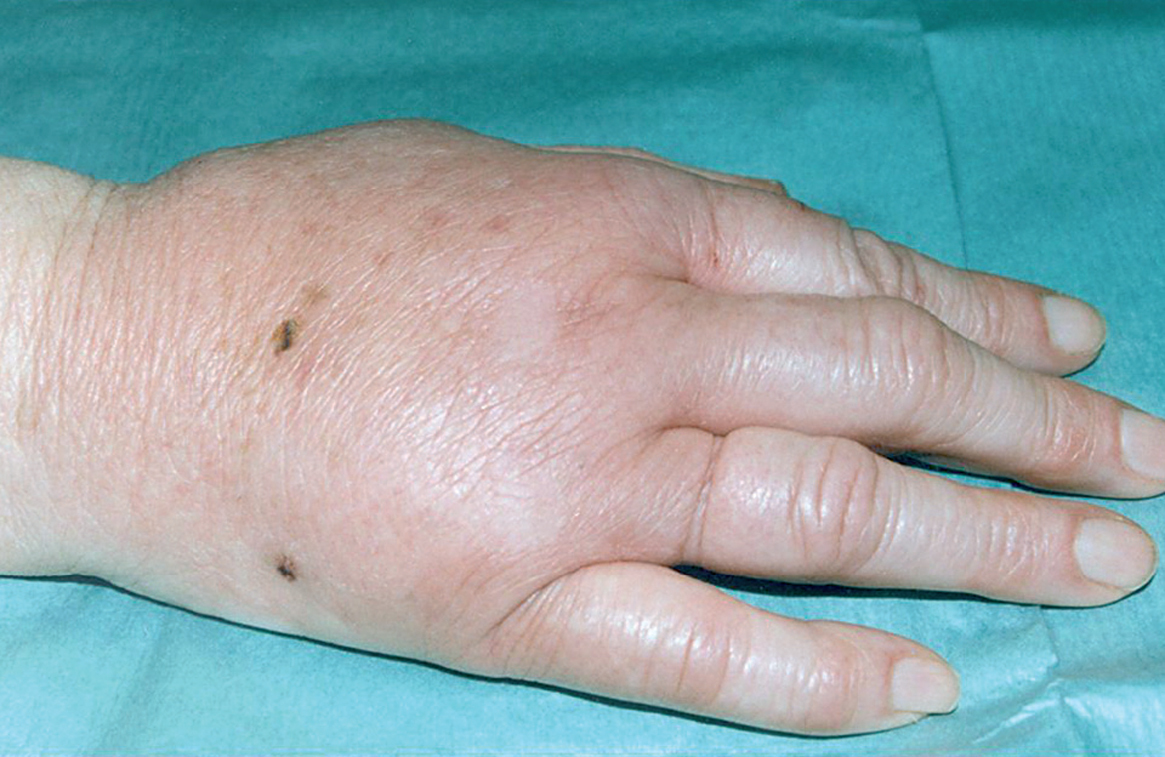
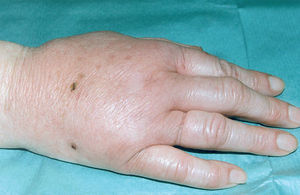
La enfermedad por arañazo de gato se considera la causa más frecuente de linfadenopatía crónica benigna en niños y jóvenes. En el 90% de los casos existe el antecedente de contacto con gatos o perros y en el 60% de los casos existen antecedentes de arañazo y/o mordisco por gatos o perros (fig. 1), con una mayor incidencia en los pacientes que poseen gatos menores de un año.
Figura 1. Edema locorregional y puntos de inoculación por mordedura de gato.
El cuadro clínico ha sido bien estudiado12. Tras un período de incubación que varía de 5 a 20 días, en la puerta de entrada o zona de inoculación se observan por lo general pequeñas pápulas eritematosas o pústulas. En la evolución del proceso, del 85 al 100% de los pacientes presentan adenopatías, a veces dolorosas, cercanas a los puntos previos de inoculación (axila, cuello, ingle). En el 80% de los casos se localizan en la parte superior del cuerpo. La afectación oculoganglionar o síndrome de Parinaud (conjuntivitis y linfadenopatía preauricular) es una forma de enfermedad por arañazo de gato que representa hasta el 6% de los casos. El proceso suele ser benigno y en la mayoría de los casos las linfadenopatías se resuelven de modo espontáneo en el curso de varios meses, si bien en el 10% puede producirse una supuración y fistulización. Durante el curso clínico de la enfermedad se ha descrito, entre otras, la presencia de fiebre (31%), mal estado general (30%), anorexia (15%), cefalea (14%), exantema (6%) y artralgias (4%).
Angiomatosis bacilar
B. henselae y B. quintana son los agentes responsables de este cuadro clínico que se produce fundamentalmente en pacientes inmunodeprimidos, en especial infectados por el virus de la inmunodeficiencia humana (VIH) con menos de 100/mm linfocitos CD413, aunque también se ha descrito en inmunocompetentes. Se trata de un proceso proliferativo vascular que suele afectar a la piel, si bien puede afectar a otros órganos (médula ósea, bazo, hígado). Las lesiones cutáneas son inespecíficas, de milímetros a centímetros; únicas o múltiples (hasta 100); de localización cutánea o subcutánea. Pueden consistir en pápulas sobre bases eritematosas, úlceras, nódulos o placas hiperpigmentadas. Son friables, sangran con facilidad y no suelen ser pruriginosas. En su evolución pueden persistir o bien resolverse espontáneamente. Todas las mucosas (oral, anal, conjuntiva, gastrointestinal, etc.) pueden verse afectadas. También pueden afectarse los huesos largos, produciendo lesiones óseas líticas extremadamente dolorosas13.
En el ámbito epidemiológico, los pacientes con angiomatosis bacilar infectados por B. henselae son propietarios de gatos, han sido arañados o mordidos por éstos, o sus gatos tenían pulgas. En estos casos se afectan más los ganglios linfáticos y el hígado13. Los pacientes infectados por B. quintana corresponden a grupos sociales desfavorecidos y refieren el antecedente de haber sido picados por piojos. En este caso, y a diferencia del anterior, la aparición de casos se detecta en brotes.
El aspecto externo de las lesiones cutáneas de angiomatosis bacilar es muy difícil de diferenciar del sarcoma de Kaposi, con el que además puede coexistir. Por este motivo toda lesión de aspecto vascular o tumoración cutánea de origen incierto se debe biopsiar para proceder a su examen histopatológico.
Peliosis hepática
Se trata de una lesión parenquimatosa hepática, caracterizada por una proliferación vascular con dilatación de los sinusoides hepáticos que llegan a formar lagos vasculares. También se ha descrito afectando al bazo. En lo que a la sintomatología se refiere, cursa con síntomas digestivos inespecíficos (náuseas, vómitos, dolor abdominal), fiebre y hepatoesplenomegalia. Esta entidad por lo general afecta a pacientes inmunodeprimidos (VIH) y se suele asociar a lesiones cutáneas de angiomatosis bacilar. En los pacientes con peliosis hepática está contraindicada la realización de una biopsia hepática por el alto riesgo de sangrado.
Fiebre de las trincheras
También denominada fiebre de los 5 días (quintana), fiebre pretibial o fiebre de Wolhinie. Esta enfermedad fue ampliamente descrita durante la Primera Guerra Mundial, y corresponde a la forma aguda de la infección por B. quintana. Unos 15 a 25 días después de sufrir la picadura de piojos los pacientes comienzan con fiebre, cefalea e intensos dolores óseos, en especial en las tibias. En ocasiones el cuadro se acompaña de artralgias y mialgias. La fiebre evoluciona en brotes (cada 5 días), pero cada nuevo brote es menos grave que el anterior. En la actualidad estamos asistiendo a la reaparición de este cuadro clínico en nuestras ciudades, lo que se denomina urban trench fever. Las descripciones de este último cuadro se han producido en grupos sociales desfavorecidos como vagabundos y alcohólicos14,15.
Bacteriemia persistente
La existencia de bacteriemias crónicas se ha demostrado en las infecciones por B. bacilliformis, B. henselae y B. quintana, siendo esta última la de más interés en nuestro medio. Al igual que la fiebre de las trincheras, afecta a los grupos más desfavorecidos. Estos pacientes pueden estar asintomáticos, incluso afebriles, si bien suelen presentar dolores óseos en las extremidades inferiores, sudoración profusa y lesiones por rascado junto con la presencia de piojos15,16. Aunque los pacientes se encuentren asintomáticos deben recibir tratamiento por el elevado riesgo que presentan para el desarrollo de endocarditis. Además, esta posibilidad siempre debe ser excluida.
Endocarditis
La endocarditis por Bartonella spp. representa, al menos en Francia, el 3% de todas las endocarditis17 y es junto a Coxiella burnetti la causa más frecuente de endocarditis con cultivo negativo. Hasta la fecha se han implicado como causa de endocarditis en humanos cinco especies de Bartonella (B. quintana, B. henselae, B. elizabethae, B. vinsonii subsp. berkhoffii y B. vinsonii subsp. arupensis), siendo las principales especies implicadas B. quintana (80%) y B. henselae (20%)18. De las otras tres especies sólo se ha descrito un caso de cada una. Desde el punto de vista epidemiológico, y al igual que ha ocurrido con otras manifestaciones clínicas, la endocarditis por B. quintana afecta a los grupos más desfavorecidos y con picaduras de piojos18. Los pacientes con endocarditis por B. henselae refieren el antecedente de contactos con gatos o picaduras de sus pulgas.
Los pacientes con endocarditis por B. quintana no presentan valvulopatía previa17-19 a diferencia de lo que se observa en la provocada por B. henselae. Desde el punto de vista evolutivo y pronóstico, la mayoría de los pacientes precisa de recambio valvular y la mortalidad llega a ser de hasta el 10%18, probablemente por el retraso diagnóstico.
Es importante conocer que dado que se han demostrado reacciones serológicas cruzadas entre Bartonella spp. y Chlamydia spp., es posible que muchas de las endocarditis por Chlamydia spp. diagnosticadas hace años sean en realidad endocarditis por Bartonella spp.17.
Enfermedad de Carrión: fiebre de Oroya y verruga peruana
A pesar de tratarse de un cuadro infeccioso exótico, la accesibilidad de los viajes y la llegada de población inmigrante procedente de Sudamérica, en especial de la zona de los Andes de Perú, hace que esta infección deba ser una entidad que se debe tener en cuenta.
La fiebre de Oroya es la forma aguda de la enfermedad de Carrión, de la que es responsable B. bacilliformis. Como consecuencia de la invasión masiva de los eritrocitos por el agente causal se produce un cuadro de anemia hemolítica y septicemia. Los pacientes presentan fiebre elevada junto con escalofríos, sudoración profusa, cefaleas, artromialgias y disminución del nivel de conciencia. Con frecuencia se acompaña de sobreinfecciones, en especial por Salmonella spp. El cuadro clínico es grave y sin tratamiento puede ser mortal (40-85%)20. La verruga peruana es la forma crónica de la enfermedad. Se caracteriza por la presencia de una o múltiples lesiones cutáneas de aspecto vascular, papulosas y pruriginosas, que sangran con facilidad y que se acompañan de dolor óseo21.
Otras manifestaciones
La infecciones por Bartonella spp. pueden afectar a todos los órganos y sistemas. Se han descrito manifestaciones respiratorias y otorrinolaringológicos (nódulos pulmonares, masa en cuello), gastrointestinales (hepatoesplenomegalia, hepatitis granulomatosa, absceso hepático), cardíacas (derrame pericárdico, miocarditis)22, hematológicas (anemia hemolítica)23, neurológicas (cefalea crónica, absceso cerebral, encefalitis, convulsiones, meningitis aséptica, mielitis)24 y oftalmológicas (síndrome de Parinaud, neuropatía óptica, retinitis aguda, uveítis, endoftalmitis)25. Por último, Bartonella spp. se reconoce como una causa de fiebre prolongada y de origen desconocido26.
Diagnóstico
Desde el punto de vista analítico, y con excepción de los rasgos típicos de la enfermedad de base, no existen datos específicos de infección por Bartonella spp.
El examen histológico es a menudo útil, aunque no patognomónico. En los pacientes con sospecha de enfermedad por arañazo de gato, el estudio de los ganglios afectados muestra granulomas necrosantes, microabscesos e hiperplasia folicular. Estos granulomas suelen presentar un aspecto de empalizada histiocítico-epitelioide, algunas células gigantes multinucleadas, neutrófilos y restos nucleares centrales. La tinción de Warthin-Starry sólo demuestra la existencia de bacilos en aquellos ganglios que contienen granulomas que supuran (30% de los casos). Existen otras técnicas como las de inmunohistoquímica también capaces de detectar la presencia de Bartonellas spp. En los pacientes con angiomatosis bacilar y con verruga peruana, se puede apreciar una neoformación lobular de los capilares junto con la presencia de un infiltrado inflamatorio de predominio de neutrofílico y leucocitoclasis en el intersticio. En la tinción de Warthin-Starry y con el microscopio electrónico se visualiza material granular en el intersticio que evidencia "pelotones celulares" que se corresponderían con las Bartonellas spp. Como ya se ha comentado, clínica e histológicamente la lesión es difícil de diferenciar del sarcoma de Kaposi por lo que es obligado la biopsia de estas lesiones. En la peliosis hepática se observan dilataciones capilares y múltiples hemangiomas cavernosos.
El diagnóstico microbiológico de las infecciones por Bartonella spp. se basa en técnicas como la detección de anticuerpos, la reacción en cadena de la polimerasa (PCR) y el cultivo.
El diagnóstico serológico es el más utilizado. Las técnicas para detectar anticuerpos séricos son la inmunofluorescencia indirecta y las pruebas de inmunoabsorción ligada a enzimas (ELISA). Dependiendo de la forma de obtención del antígeno (agar o cultivo celular) la respuesta serológica varía. Por otro lado, la presencia de variantes genotípicas (B. henseale Houston; B. henselae Marsella) puede explicar la existencia de discordancias serológicas. El punto de corte de diagnóstico para los pacientes con enfermedad por arañazo de gato es un título de IgG 1:64 y en aquellos con endocarditis 1:800. Por otro lado, entre B. henselae y B. quintana existen reacciones cruzadas, lo mismo que con otras especies de género Chlamydia y con C. burnetii27. La serología frente a Bartonella spp. puede ser negativa en los pacientes infectados por el VIH.
En los pacientes con infección por Bartonella spp., la amplificación mediante PCR de los genes de la citrato-sintasa (gltA) y de la fracción 16S del ARN ribosomal constituyen herramientas útiles para el diagnóstico de este grupo de enfermedades. Mediante esta técnica se pueden identificar Bartonellas spp. de diferentes muestras (sangre, adenopatía, etc.). Otros cebadores utilizados en las técnicas de PCR son los del espacio intergénico del 16S-23S ARNr (ITS), los del gen a de la riboflavin-sintasa (ribC), los de las proteínas del choque térmico (groEL) o los del gen que codifica las proteínas que interviene en la división celular (ftsZ)28. La PCR en tiempo real es más sensible y específica. Esta PCR es especialmente útil en los pacientes con endocarditis por Bartonella spp. en los que sólo se dispone de suero29.
Por último, las bacterias del género Bartonella pueden ser cultivadas mediante siembra en agar o mediante cultivos celulares. El cultivo en placas convencionales no es fácil, y requiere de incubaciones prolongadas (hasta 6 semanas de incubación). El cultivo requiere de condiciones especiales como el empleo de un medio enriquecido en sangre (de conejo o de caballo), una atmósfera húmeda y enriquecida con CO2 y una temperatura de 37 °C. El crecimiento de los subcultivos en placas de agar sangre es más rápido (3-5 días). La rentabilidad diagnóstica mejora si previamente al cultivo se someten los tubos de sangre a congelación (24 h a 85 °C) y posterior descongelación a temperatura ambiente con el fin de destruir los hematíes y facilitar la salida de las bartonellas al exterior. A diferencia de los métodos de cultivo convencional, los medios de cultivo que emplean líneas celulares (células endoteliales L929, HeLa) son más sensibles y en ellos el crecimiento es más rápido30. Las muestras empleadas para el cultivo pueden ser sangre o tejidos (válvulas cardíacas).
El aislado en sangre de Bartonellas spp. también puede realizarse mediante hemocultivos con lisis-centrifugación, pero evitando aquellos sistemas que contengan EDTA, dado que éstos disminuyen la posibilidad de aislado de Bartonella spp. Uno de los medios más sensibles para el crecimiento de las bartonellas es el medio aerobio BACTEC. Durante su incubación, y con independencia de que el sistema de hemocultivos no detecte el crecimiento de bacterias (las bartonellas producen escaso CO2), en aquellos casos en los que se sospeche la infección por Bartonella spp. se deben realizar exámenes sistemáticos de los frascos mediante tinción con naranja-acridina.
Tratamiento
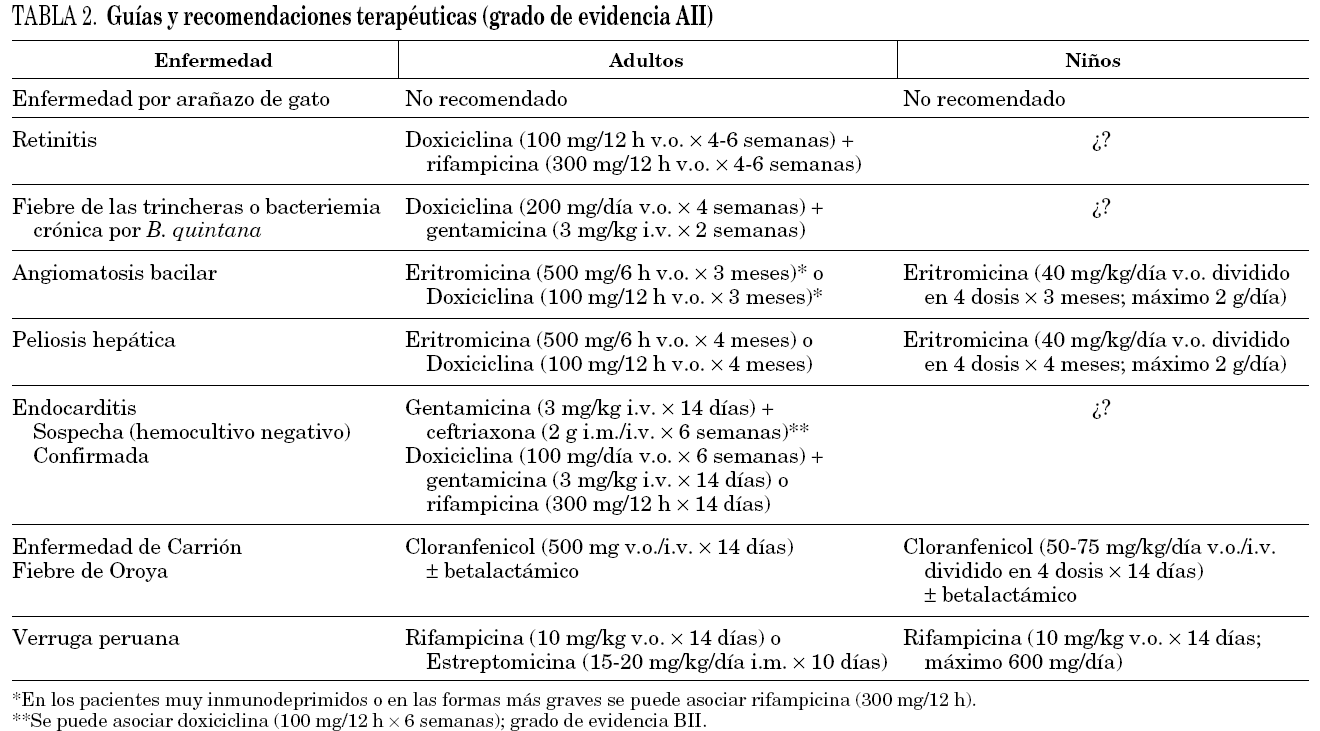
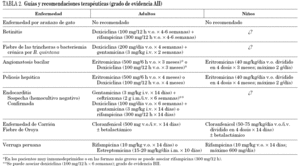
El tratamiento en los pacientes infectados por Bartonella spp. no es fácil ya que se debe adaptar a cada especie de Bartonella y a cada situación clínica31. En muchos casos (p. ej., enfermedad por arañazo de gato) el cuadro clínico se puede resolver sin problemas, mientras que en otros casos (endocarditis, peliosis hepática), la ausencia de un tratamiento acaba con la vida del paciente. Además, la concentración mínima inhibitoria de los fármacos se correlaciona mal con su eficacia in vivo. En las infecciones por Bartonella spp. la mayoría de los antibióticos tiene un efecto bacteriostático31, con excepción de los aminoglucósidos32. No obstante, debido a la escasa penetración de los aminoglucósidos en los hematíes las bartonellas se encuentran protegidas en el interior de los mismos33,34. Por este motivo, la acción bactericida de los aminoglucósidos debe producirse en aquellas bartonellas que están fuera del hematíe31, de ahí la necesidad de asociar en ocasiones varios antimicrobianos. En la tabla 2 se muestras algunas de las recomendaciones terapéuticas31.
En los enfermos con enfermedad por arañazo de gato, dado que en la mayor parte de los casos se resuelve de modo espontáneo, no suele ser preciso el empleo de antimicrobianos, a no ser que surjan complicaciones. En estos pacientes, hasta la fecha, sólo se ha realizado un estudio prospectivo (placebo frente a azitromicina)35. En este estudio no se demostró ningún beneficio en el empleo de antibiótico, salvo la mayor rapidez con la que disminuía el tamaño de la adenopatía en aquellos pacientes tratados con azitromicina. Por este motivo los pacientes inmunocompetentes no precisan recibir tratamiento de modo sistemático, a no ser que aparezcan complicaciones que hagan preciso su uso. En este caso será precisa la asociación de doxiciclina y rifampicina durante un período mínimo de 4 semanas31.
El tratamiento de la fiebre de las trincheras y de la bacteriemia crónica se realiza con éxito con la asociación de doxiciclina y gentamicina31. En los pacientes con angiomatosis bacilar y peliosis hepática, el tratamiento de elección es la eritromicina, pudiendo emplearse la doxiciclina en aquellos pacientes que no toleren la eritromicina31. El éxito terapéutico depende de la duración del tratamiento (tabla 2) que debe prolongarse en ocasiones durante meses, dado que tratamientos más cortos se relacionan con un mayor riesgo de recidivas, en especial en inmunodeprimidos.
En una reciente revisión sobre la evolución de los pacientes con endocarditis por Bartonella spp.19, la administración de un aminoglucósido durante al menos 14 días se asociaba a un mejor pronóstico. En aquellos pacientes con endocarditis con cultivos negativos y en los que se sospeche la infección por Bartonella spp., una opción terapéutica útil sería la administración de un aminoglucósido (gentamicina) junto a ceftriaxona, asociando o no doxiciclina19. Si se confirmara la sospecha, el tratamiento se basaría en la combinación de un aminoglucósido y doxiciclina. En el caso de insuficiencia renal, la sustitución del aminoglucósido por la rifampicina puede ser una alternativa útil31.
Por último, en los pacientes con fiebre de Oroya, el tratamiento de elección es el cloranfenicol, asociado a otros antibióticos, en especial betalactámicos dado el riesgo de sobreinfecciones21 o quinolonas. Para el tratamiento de la verruga peruana se emplea la rifampicina o la estreptomicina. También el ciprofloxacino y la azitromicina han mostrado ser efectivos31.
Prevención
La prevención de la infección por B. henselae se basa en evitar los arañazos y mordeduras de gatos pequeños (especialmente los menores de un año) y en la prevención de la parasitación por pulgas (desparasitación). Los pacientes inmunodeprimidos, en especial los pacientes infectados por el VIH, deberían evitar el contacto con gatos y perros, y en el caso de que no fuera posible, cortar las uñas de los gatos y vigilar la presencia de pulgas. Para prevenir la infección por B. quintana bastaría con utilizar normas básicas de higiene (lavado y cambio de ropa interior), lo que rompería el ciclo del piojo del cuerpo.
En resumen, las infecciones por Bartonella spp. representan un amplio espectro de infecciones emergentes y reemergentes cuya sintomatología puede llegar a ser mortal. El tratamiento de la infección por Bartonella spp. no está estandarizado y debe adaptarse a la situación clínica e inmunológica de los pacientes.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante 1 mes, que se realizará a través de la web de Ediciones Doyma.
RELACIÓN DE SERIES ACREDITADAS:
"Puesta al día en Métodos Microbiológicos para el Diagnóstico Clínico"
Disponible en: http://www.doyma.es/eimc/formacion
17 enero / 31 marzo 2005