Descripción clínica del caso
Una mujer de 37 años acudió a la consulta por esputos hemoptoicos durante 3 días consecutivos, sin dolor torácico, síndrome tóxico ni fiebre. No refería contactos previos con enfermos de tuberculosis, ni hábito tabáquico ni enólico. Comentaba haber viajado a Costa Rica hacía 8 años, a Tailandia hacía 4 años, a Estados Unidos (Nueva York) hacía 2 años y a Inglaterra hacía 3 meses.
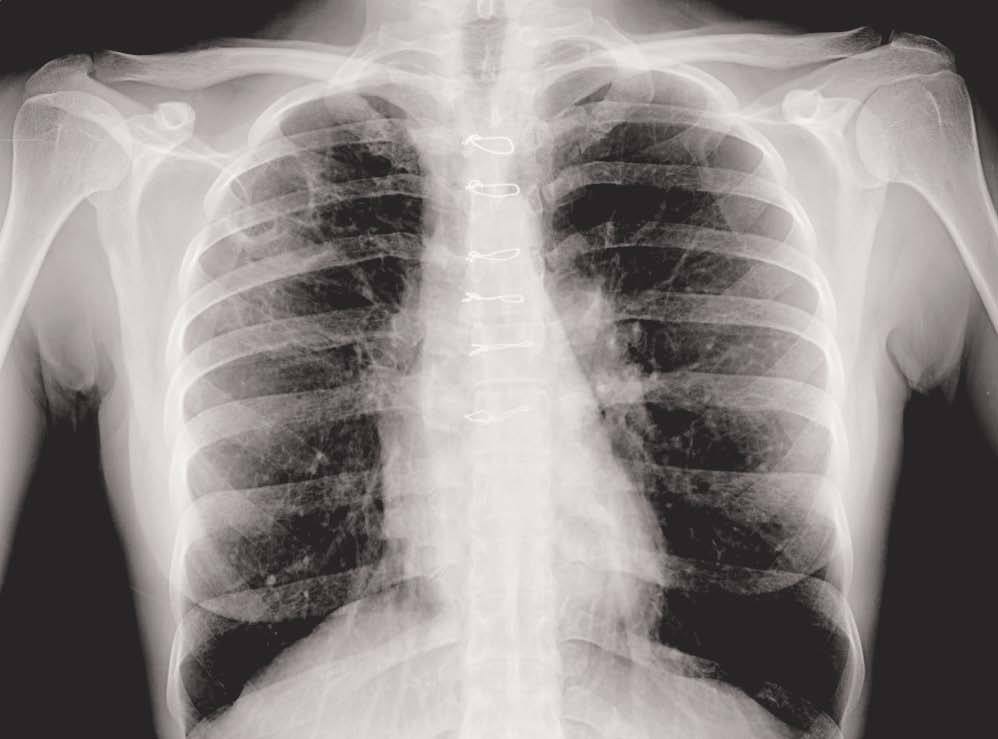
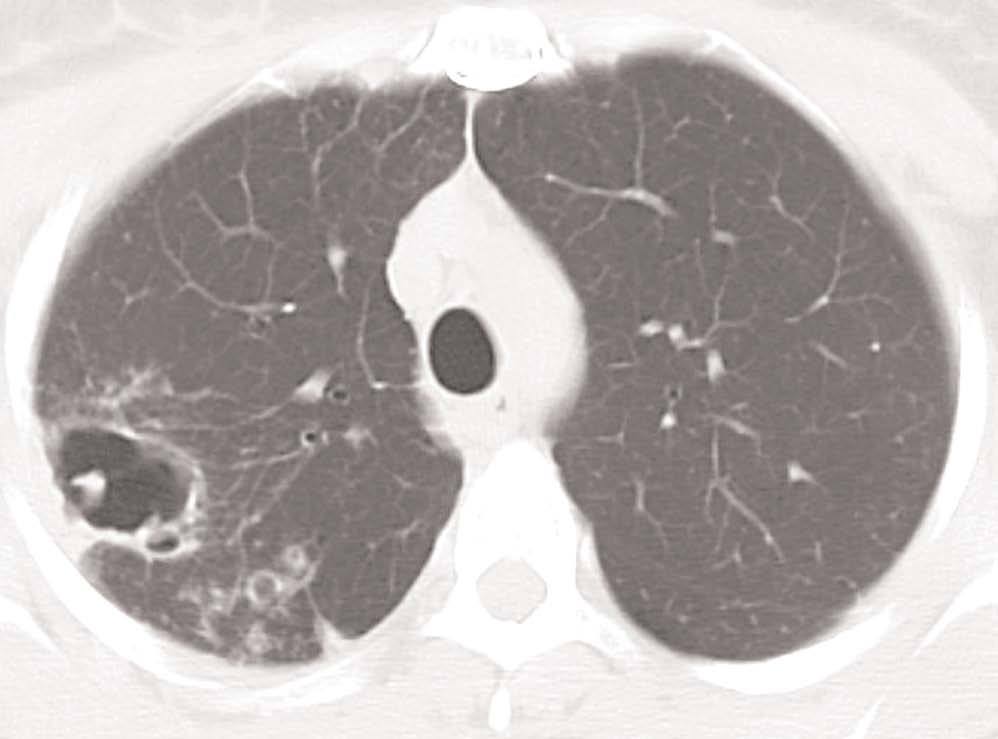
Se realizó una radiografía de tórax (fig. 1) y una tomografía computarizada (TC) de tórax (fig. 2) que mostró imágenes cavitadas en el lóbulo superior derecho (LSD). La intradermorreacción de Mantoux mostró ausencia de induración en dos ocasiones. La serología para el virus de la inmunodeficiencia humana (VIH), histoplasma y blastomices resultó negativa. Los estudios analíticos con anticuerpos antinucleares, c-ANCA, factor reumatoide e IgE de equinococus resultaron también negativos. Se practicó una fibrobroncoscopia que detectó la presencia de un bronquio traqueal procedente del LSD, realizándose lavado broncoalveolar (LBA) del mismo. La tinción de Zielh- Neelsen no mostró bacilos ácido-alcohol resistentes (BAAR) en el broncoaspirado (BAS) ni en el LBA, y la PCR fue negativa para Mycobacterium tuberculosis. Otras tinciones y cultivos también resultaron negativas para otras bacterias y hongos en el BAS y el LBA.
Figura 1. Radiografía de tórax: pérdida de volumen del lóbulo superior derecho con imágenes cavitadas.
Figura 2. TC torácica: imágenes cavitadas de paredes gruesas, en segmento posterior del lóbulo superior derecho con pequeños nódulos satélites alguno de ellos con cavitación.
Diagnóstico y evolución
El cultivo del LBA y BAS fue positivo para Mycobacterium xenopi. Ante este hallazgo se realizó una segunda fibrobroncoscopia con nuevo LBA que confirmó la positividad de los cultivos anteriores. Dos cultivos de esputo también resultaron positivos para el mismo microorganismo. El antibiograma determinó que la micobacteria era resistente a pirazinamida y sensible a rifampicina (R), isoniazida (H), estreptomicina (S) y etambutol (E), por lo que se inició el tratamiento con 2RHES/12RH.
Los cultivos de esputo realizados a partir del primer mes tras el inicio del tratamiento fueron negativos para M. xenopi. A los 12 meses de finalizarlo, los cultivos seguían negativos, y a los 24 meses, la paciente continuaba asintomática y sin signos de la enfermedad en la TC de control.
Comentario
Mycobacterium xenopi es un bacilo ácido-alcohol resistente, escotocromógeno, de crecimiento lento, que suele colonizar conducciones de agua, especialmente los grifos de agua caliente de los hospitales, donde se ha asociado con casos de enfermedad clínica1, ocasionando infecciones en forma de brotes nosocomiales. Pertenece al grupo de las denominadas micobacterias ambientales2. La enfermedad se manifiesta generalmente en pacientes con patología pulmonar crónica (enfisema, fibrosis pulmonar, silicosis y tuberculosis previa), infección por el VIH o con factores predisponentes (gastrectomía, toma crónica de corticoides, alcoholismo, neoplasias extrapulmonares, malnutrición o diabetes mellitus)3 aunque también puede aparecer en jóvenes sanos inmunocompetentes y sin factores de riesgo4 como ocurrió en el caso que presentamos.
Produce un cuadro clínico similar a la enfermedad tuberculosa, por lo que deberemos tenerla siempre presente ante una sospecha de tuberculosis y ausencia de crecimiento de M. tuberculosis en los cultivos. La reacción cutánea de la tuberculina no diferencia M. tuberculosis de M. xenopi, como tampoco diferencia infección y colonización por la micobacteria5. La enfermedad produce afectación radiológica en forma de cavitaciones pulmonares multiloculadas en el 70-90%6. Es frecuente la asociación con masas o nódulos cavitados junto con signos de fibrosis en zonas perilesionales en los lóbulos superiores, asentándose sobre lesiones enfisematosas preexistentes3.
El diagnóstico de la enfermedad por M. xenopi, siguiendo las directrices de la American Thoracic Society (ATS), exige la presencia de criterios clínicos, radiológicos y microbiológicos7, que se cumplían en nuestro caso. Actualmente las directrices de actuación en cuanto al tratamiento de esta enfermedad, recomiendan la asociación de un macrólido, rifampicina o rifabutina y etambutol, con o sin estreptomicina en la fase inicial, hasta al menos 12 meses tras la negativización de los cultivos7. Se ha dejado un tanto de lado el uso del tratamiento dependiente del antibiograma al haberse visto que la sensibilidad in vitro a antimicrobianos es variable8. La cirugía tiene sus indicaciones en casos de falta de respuesta al tratamiento o bien en caso de recaída una vez finalizado el mismo9,10.
Correspondencia: Dr. H. Ibáñez Bargues.
Servicio de Medicina Interna. Hospital de la Ribera.
Ctra. de Corbera, km 1, s/n. 46600 Alzira. Valencia. España.
Correo electrónico: heibar@alumni.uv.es
Manuscrito recibido el 22-6-2006; aceptado el 2-1-2007.