La infección fúngica invasora (IFI), causada por levaduras y hongos filamentosos, es un problema persistente, con alta morbimortalidad entre los pacientes con enfermedades hematológicas y los receptores de trasplante hematopoyético. El tratamiento de la IFI en estos pacientes ha llegado a ser de gran complejidad con la aparición de nuevos fármacos y pruebas diagnósticas que han dado lugar a diferentes estrategias terapéuticas (profilácticas, empíricas, anticipadas y dirigidas). Una evaluación adecuada del riesgo individual de IFI de cada paciente es crítica para elegir el mejor método profiláctico y terapéutico y aumentar así las tasas de supervivencia. Entre los antifúngicos disponibles, los más frecuentemente empleados son el fluconazol, los azoles con cobertura de hongos filamentosos (itraconazol, posaconazol, voriconazol), las candinas (anidulafungina, caspofungina, micafungina) y la anfotericina B (en particular, sus formulaciones lipídicas). En este documento se establecen recomendaciones sobre cuándo usar tratamiento antifúngico y sobre los criterios para la selección de unos u otros agentes terapéuticos en el contexto del paciente hematológico.
Invasive fungal infection (IFI), caused by both yeasts and moulds, is a persistent problem, with high morbidity and mortality rates among patients on chemotherapy for haematology diseases, and hematopoietic stem cell transplant recipients. Management of IFI in these types of patients has become highly complex with the advent of new antifungals and diagnostic tests, resulting in different therapeutic strategies (prophylactic, empirical, pre-emptive, and targeted). A proper assessment of the risk for IFI of each individual patient appears to be critical in order to use the best prophylactic and therapeutic approach, and to increase the survival rates. Among the available antifungals, the most frequently used are fluconazole, mould-active azoles (itraconazole, posaconazole, voriconazole), candins (anidulafungin, caspofungin, micafungin), and amphotericin B (particularly its lipids formulations). Specific recommendations for use and the criteria for selection of antifungal agents are discussed in this paper.
Globalmente considerada, la infección fúngica invasora (IFI) ha aumentado en frecuencia a lo largo de la última década1-3. Este incremento se debe, por una parte, a la existencia de un mayor número de pacientes sometidos a tratamientos inmunosupresores o a terapias invasivas y, por otra, a la mejora de los métodos diagnósticos, microbiológicos y no microbiológicos (tomografía computarizada de alta resolución, galactomanano, betaglucano, etc.). Pero a pesar del diagnóstico más precoz y del uso de los nuevos antifúngicos, la IFI continúa asociándose con una elevada morbimortalidad. La tasa de mortalidad media relacionada con la candidiasis invasora (CI) es superior al 30% y la de la aspergilosis invasora (AI) mayor al 50% en algunos grupos de pacientes, como aquellos con hemopatías malignas o los receptores de trasplante hematopoyético (TH)1-3.
Aunque los agentes etiológicos más frecuentes continúan siendo Candida albicans y Aspergillus fumigatus, el número de especies capaces de causar infecciones invasoras ha aumentado considerablemente. Así, en los últimos años se ha incrementado el número de patógenos de otras especies de Candida, Aspergillus, Trichosporon, Fusarium, Scedosporium y mucorales. Estas infecciones son más difíciles de diagnosticar y tratar, ya que los hongos emergentes son, en general, más resistentes a los antifúngicos disponibles, por lo que se asocian con una mayor mortalidad4.
Infección fúngica invasora por Candida en el paciente hematológicoDesde los años noventa, la incidencia de CI ha disminuido considerablemente en el paciente hematológico (no así en el paciente con tumores sólidos) debido al uso de fluconazol en profilaxis4,5. Sin embargo, la CI se asocia a elevada mortalidad, que puede cifrarse entre el 20 y el 50%, según las series1-3,6.
En el último estudio prospectivo de vigilancia poblacional realizado en España sobre candidemia durante los años 2010 y 2011, en 29 hospitales de 5 ciudades españolas con una población de 7.237.228 personas, se recogieron 752 casos de candidemia en 729 pacientes, lo que supone una incidencia de 10,4 episodios/105 habitantes/año. De los 752 casos, 283 (39%) correspondían a pacientes oncohematológicos, 45 (15,9%) episodios eran fungemias de brecha y 69 (24,4%) pacientes habían recibido azoles previamente (datos aún no publicados). C. albicans fue la especie más frecuentemente aislada (42%), seguida de C. parapsilosis (21,5%), C. glabrata (16%), C. tropicalis (9,7%), C. guilliermondii (3,1%), C. krusei (3%) y otras especies (4,9%). En pacientes hematológicos las especies no-C. albicans fueron más frecuentes que en los oncológicos (77,6% vs 52%, p<0,000). En concreto, C. tropicalis y C. guilliermondii fueron más frecuentes en pacientes hematológicos que en oncológicos (20% vs 7% y 8,8% vs 1,8%). C. krusei se relacionó con el uso previo de azoles. La tasa global de disminución de la sensibilidad al fluconazol (MIC<4) tendió a ser más alta en los pacientes hematológicos que en los otros grupos poblacionales (17% vs 13,5%, p=0,16). La mortalidad a los 30 días resultó del 29,7% (13,4% en los primeros 7 días), sin diferencias entre los pacientes oncológicos y hematológicos, siendo los datos similares a los globales del estudio CANDIPOP7.
Los factores de riesgo de CI en los enfermos oncohematológicos se dividen en 3 grupos: los relacionados con el huésped (mucositis, colonización previa por Candida), los relacionados con la enfermedad y su tratamiento (neutropenia, catéter venoso central [CVC], nutrición parenteral, cirugía abdominal, esteroides) y los relacionados con las complicaciones (enfermedad injerto contra receptor [EICR], infección por citomegalovirus [CMV], etc.)7. En la serie española, la candidemia estaba en relación con el CVC en el 37% de los casos, el 35% habían recibido inmunosupresores previamente (25,1% quimioterapia), el 9,5% presentaba mucositis y tan solo el 11,3% presentaban neutropenia7.
El hemocultivo, a pesar de su escasa sensibilidad global (∼50%), sigue siendo la mejor técnica para el diagnóstico de candidemia. Para la recuperación de levaduras en la sangre se recomienda el uso de los mismos sistemas automatizados de monitorización continua utilizados para bacterias. La detección de anticuerpos contra los mananos de C. albicans y la de anticuerpos contra el micelio de C. albicans han sido ensayadas en pacientes críticos y se dispone de pocos datos en el paciente oncohematológico. Aunque no sea un método comúnmente aplicado en nuestro país, la detección de (1→3)-β-D-glucano, componente no antigénico de la pared celular de la mayoría de los hongos patógenos (excepto Cryptococcus y zigomicetos), puede servir de ayuda en el diagnóstico de la IFI producida por Candida y Aspergillus. Por último, las técnicas de detección de ADN fúngico mediante la reacción en cadena de la polimerasa (PCR) se encuentran muy desarrolladas pero todavía no han sido estandarizadas8.
Las infecciones invasoras por Candida spp. pueden presentar diferentes formas clínicas de enfermedad: la candidemia (la más habitual; asociada o no a síntomas de diseminación), la candidiasis crónica diseminada (CCD, propia del paciente hematológico cuando recupera la neutropenia) y las diferentes infecciones focales invasoras (ocular, cardiaca, sistema nervioso central [SNC], urinaria, etc.). La clínica puede oscilar desde cuadros febriles sin focalidad aparente hasta un síndrome séptico indistinguible del bacteriano. Lesiones cutáneas en forma de pústulas con base eritematosa pueden aparecer tanto en sujetos neutropénicos como en aquellos sin neutropenia asociada. La existencia de mialgias puede ser frecuente y se atribuye a la formación de microabscesos en diferentes grupos musculares9.
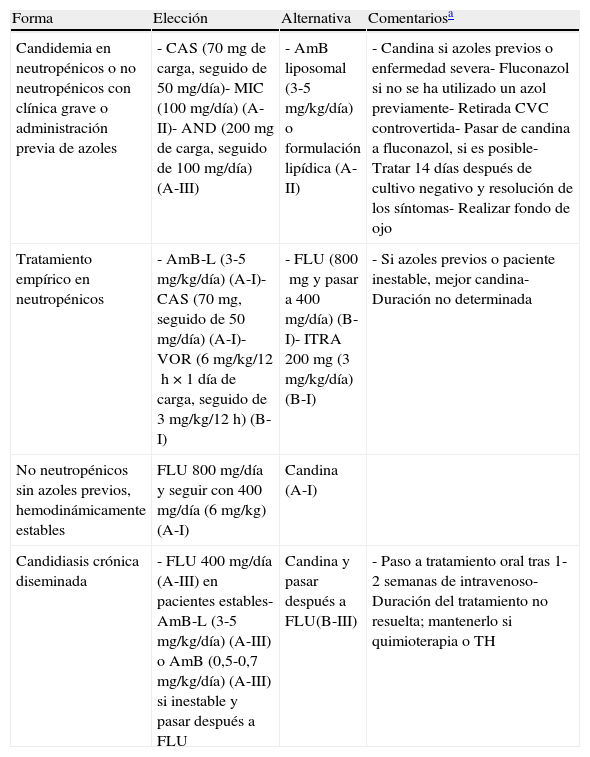
El tratamiento de la CI incluye la retirada de los CVC y las sondas urológicas cuando se considera que dichas localizaciones pueden ser el foco de origen de la infección10,11. La elección del tratamiento específico de la CI dependerá de la epidemiología del centro, de la gravedad de la clínica, de la enfermedad de base del paciente (hematológico, trasplantado, portador de CVC) y del uso de profilaxis previa con azoles. En la tabla 1 se exponen los tratamientos recomendados según los grados de evidencia de las principales guías terapéuticas. Una vez conocida la especie y su sensibilidad a los antifúngicos debe «desescalarse» el tratamiento, si las condiciones del paciente lo permiten12-15. Actualmente, la CCD se considera como un síndrome de reconstitución inmune en relación con el hongo, por lo que suele recomendarse la adición de corticoides al tratamiento antifúngico16.
Tratamiento de la candidiasis invasora
| Forma | Elección | Alternativa | Comentariosa |
| Candidemia en neutropénicos o no neutropénicos con clínica grave o administración previa de azoles | - CAS (70mg de carga, seguido de 50mg/día)- MIC (100mg/día) (A-II)- AND (200mg de carga, seguido de 100mg/día) (A-III) | - AmB liposomal (3-5mg/kg/día) o formulación lipídica (A-II) | - Candina si azoles previos o enfermedad severa- Fluconazol si no se ha utilizado un azol previamente- Retirada CVC controvertida- Pasar de candina a fluconazol, si es posible- Tratar 14 días después de cultivo negativo y resolución de los síntomas- Realizar fondo de ojo |
| Tratamiento empírico en neutropénicos | - AmB-L (3-5mg/kg/día) (A-I)- CAS (70mg, seguido de 50mg/día) (A-I)- VOR (6mg/kg/12h × 1día de carga, seguido de 3mg/kg/12h) (B-I) | - FLU (800mg y pasar a 400mg/día) (B-I)- ITRA 200mg (3 mg/kg/día) (B-I) | - Si azoles previos o paciente inestable, mejor candina- Duración no determinada |
| No neutropénicos sin azoles previos, hemodinámicamente estables | FLU 800mg/día y seguir con 400mg/día (6mg/kg) (A-I) | Candina (A-I) | |
| Candidiasis crónica diseminada | - FLU 400mg/día (A-III) en pacientes estables- AmB-L (3-5mg/kg/día) (A-III) o AmB (0,5-0,7mg/kg/día) (A-III) si inestable y pasar después a FLU | Candina y pasar después a FLU(B-III) | - Paso a tratamiento oral tras 1-2 semanas de intravenoso- Duración del tratamiento no resuelta; mantenerlo si quimioterapia o TH |
AmB: anfotericina B desoxicolato; AmB-L: anfotericina B liposomal; AND: anidulafungina; CAS: caspofungina; CVC: catéter venoso central; FLU: fluconazol; ITR: itraconazol; MIC: micafungina; TH: trasplante hematopoyético; VORI: voriconazol.
Las abreviaturas A-I, A-II, A-III, B-I, B-III se refieren a los niveles de evidencia/grados de recomendación estándar.
Una vez identificada la especie de Candida, en infecciones producidas por C. glabrata se prefiere una candina (B-III) o anfotericina B liposomal (3mg/kg) (B-III). Si se aísla una C. parapsilosis, el fluconazol es el tratamiento de elección (BIII) y la anfotericina B liposomal su alternativa (BIII). Para infecciones producidas por C. krusei se recomienda una candina, anfotericina B liposomal o voriconazol (B-III).
Las características de la IFI en los pacientes oncohematológicos están en constante evolución. Mientras en los años ochenta la CI era la micosis más prevalente, la generalización del uso de fluconazol profiláctico a principios de los noventa dio lugar a un espectacular descenso de la IFI por levaduras. Sin embargo, la IFI por hongos filamentosos (IFI-HF) en general, y la AI en particular, han continuado siendo un importante problema médico. Y esto es particularmente así en los portadores de leucemias agudas mieloblásticas y linfoblásticas (LAM, LAL), en los síndromes mielodisplásicos de alto riesgo (SMD) y en los pacientes sometidos a TH alogénico (alo-TH)17.
La incidencia reportada de IFI-HF probada o probable en los pacientes hematológicos de riesgo oscila entre el 4 y el 22%, tratándose de AI en la mayoría de los casos. Pero la verdadera dimensión del problema puede ser aún mayor, ya que es sabido que los métodos diagnósticos actuales no son suficientemente sensibles para detectar todos los casos de AI/IFI-HF en el huésped gravemente inmunodeprimido. Buena prueba de ello son los resultados de una gran serie de 1.017 autopsias de pacientes con hemopatías malignas del MD Anderson Cancer Center durante el periodo 1989-2003. El porcentaje de IFI probada por necropsia fue del 31%, la mayoría de las cuales (75%) no habían sido diagnosticadas en vida del paciente17.
En lo que se refiere a las especies de Aspergillus, la predominante como patógeno en el paciente hematológico sigue siendo A. fumigatus. No obstante, algunos autores han reportado un significativo aumento de AI por especies como A. flavus o A. terreus17.
Factores de riesgoLos principales factores de riesgo (FR) asociados al desarrollo de la AI en el paciente hematológico se pueden agrupar en: a)los que dependen del paciente y su situación clínica (factor huésped); b)los relacionados con el tratamiento que ha recibido; c)los específicos de los pacientes que se someten a un TH (procedimiento, donante, complicaciones); d)los relativos a las condiciones medioambientales, y, finalmente, e)los derivados de la patogenicidad intrínseca de cada especie de Aspergillus (tabla 2)17.
Principales factores de riesgo de aspergilosis invasora
| Dependencia | Factor de riesgo |
| Huésped | Neutropenia (profunda y prolongada) (tabla 3) |
| Linfopenia (particularmente T) | |
| Monocitopenia (?) | |
| Diagnóstico de LAM, LAL, SMD, AM o MM | |
| Enfermedad en fase avanzada (debut, refractariedad, recaída, progresión) | |
| Edad avanzada | |
| Sobrecarga de hierro | |
| Hiperglucemia persistente | |
| Acidosis | |
| Malnutrición | |
| Deficiente estado general | |
| Disfunción renal | |
| Disfunción hepática | |
| Patología pulmonar subyacente | |
| Antecedente de una aspergilosis invasora previa | |
| Historia de trasfusiones de hemoderivados repetidas | |
| Polimorfismos del paciente (p.ej., en ciertos alelos del gen del plasminógeno)a | |
| Tratamiento | Esteroides (dosis altas, duración prolongada) |
| Tratamiento de inducción, re-inducción o rescate | |
| Análogos de las purinas (fludarabina…) | |
| Citarabina (dosis intermedias o altas) | |
| Radioterapia (dosis altas) | |
| Anticuerpos monoclonales (alemtuzumab…) | |
| Globulina antitimocítica (ATG) (?) | |
| Trasplante | Cordón umbilical |
| Donante no emparentado | |
| Donante parcialmente incompatible (mismatched, haplo-idéntico) | |
| Selección de CD34/Depleción T | |
| EICR aguda grado II-IV/III-IV | |
| EICR crónica extensa | |
| Serología CMV: paciente+ o paciente– con donante+ | |
| Enfermedad por CMV | |
| Infección por virus respiratorios (VRS, influenza, parainfluenza) | |
| Polimorfismos del donante (p.ej., haplotipo S4 de los TLR)a | |
| Medio ambiente | Proximidad a áreas de construcción o remodelación |
| Estancia en habitaciones sin filtros HEPA | |
| Estancia en habitaciones sin flujo laminar (?) | |
| Verano (?) | |
| Diferencias geográficas (?) | |
| Hongo | Especie de Aspergillus (?) |
AM: aplasia medular; CMV: citomegalovirus; EICR: enfermedad injerto contra receptor; HEPA: high efficiency particulate air; LAL: leucemia aguda linfoblástica; LAM: leucemia aguda mieloblástica; MM: mieloma múltiple; SMD: síndrome mielodisplásico; TLR: toll-like receptors; VRS: virus respiratorio sincitial.
De Vallejo y Len17.
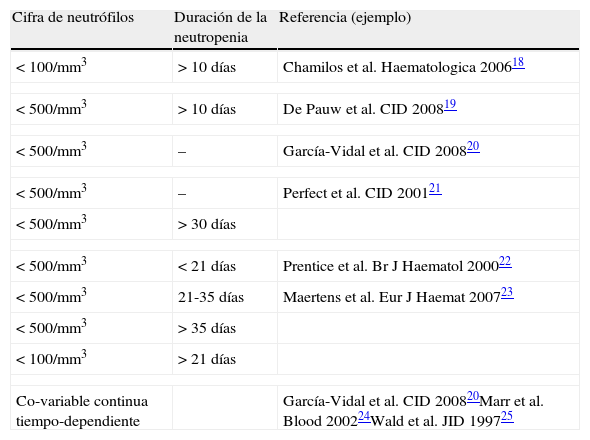
El FR del huésped mejor conocido es la neutropenia profunda y prolongada (tabla 3). La linfopenia (particularmente la de las poblaciones T) es, asimismo, un FR para el desarrollo de la AI, como lo son las alteraciones del sistema mononuclear fagocítico. Otros factores individuales a los que se ha atribuido un riesgo relativo superior son ciertas hemopatías (LAM, LAL, SMD, aplasia medular, mieloma múltiple), el estatus de enfermedad avanzada (debut, refractariedad, recaída, progresión) y la mayor edad del paciente. Factores biológicos (como la hiperglucemia persistente, la acidosis o la malnutrición) pueden influir de forma adversa sobre los mecanismos inmunitarios del paciente y aumentar el riesgo de AI. Un deficiente estado general y la existencia de disfunciones orgánicas (renal y hepática, fundamentalmente) favorecen también la presentación de AI. Así mismo, la presencia de patología pulmonar subyacente facilita el desarrollo de aspergilosis pulmonar invasora (API). El antecedente de una AI es otro factor predisponente bien conocido; de hecho, la reactivación de una AI previa durante un nuevo episodio de neutropenia o durante un trasplante acontece, según la literatura, en un 30-50% de las ocasiones si no se ha empleado la profilaxis secundaria adecuada17.
Niveles de riesgo de aspergilosis invasora en función de la profundidad y la duración de la neutropenia
| Cifra de neutrófilos | Duración de la neutropenia | Referencia (ejemplo) |
| < 100/mm3 | > 10 días | Chamilos et al. Haematologica 200618 |
| < 500/mm3 | > 10 días | De Pauw et al. CID 200819 |
| < 500/mm3 | – | García-Vidal et al. CID 200820 |
| < 500/mm3 | – | Perfect et al. CID 200121 |
| < 500/mm3 | > 30 días | |
| < 500/mm3 | < 21 días | Prentice et al. Br J Haematol 200022 |
| < 500/mm3 | 21-35 días | Maertens et al. Eur J Haemat 200723 |
| < 500/mm3 | > 35 días | |
| < 100/mm3 | > 21 días | |
| Co-variable continua tiempo-dependiente | García-Vidal et al. CID 200820Marr et al. Blood 200224Wald et al. JID 199725 | |
De Vallejo y Len17.
Entre los FR asociados al tratamiento destacan la quimioterapia de inducción o rescate de las leucemias agudas o de los SMD (frente a la fases de consolidación o intensificación), así como la terapia esteroidea prolongada y/o a altas dosis. Según se ha demostrado en varios estudios, los corticosteroides reducen la respuesta inmune del huésped frente a Aspergillus spp. mediante el deterioro de la capacidad del macrófago alveolar para eliminar las conidias fúngicas fagocitadas y de la disminución de la producción por parte del mismo de citocinas y quimiocinas pro-inflamatorias, importantes para el reclutamiento de neutrófilos y monocitos. Por otra parte, durante el tratamiento esteroideo se produce una alteración cualitativa de la función de los neutrófilos. El riesgo del tratamiento esteroideo se potencia cuando se asocian otros FR de AI, como la neutropenia profunda y/o prolongada17.
En el contexto del TH, los principales FR para el desarrollo de una AI precoz postrasplante son, además de la enfermedad y la edad del paciente mencionadas más arriba, el empleo de sangre de cordón umbilical como fuente de progenitores y la enfermedad por CMV. Mientras tanto, para la AI tardía postrasplante, el FR dominante suele ser la EICR crónica extensa, durante la cual, junto con una profunda inmunodeficiencia, se produce una alteración cualitativa de la función de los neutrófilos17.
En cuanto a los FR medioambientales, es importante tener en cuenta que, a diferencia de la mayoría de las infecciones que se presentan en el paciente hematológico, la AI suele ser de origen exógeno (nosocomial o extra-hospitalario). Por ello, la estancia hospitalaria en habitaciones sin filtros HEPA (high efficiency particulate air), así como la proximidad a áreas de construcción o remodelación (donde la concentración de conidias en el aire ambiental es alta), incrementan significativamente el riesgo de AI en el sujeto susceptible17.
Los señalados más arriba son los FR fundamentales, mientras que la patogenicidad intrínseca de la especie de Aspergillus a la que el paciente se expone tiene escasa correlación con el desarrollo o no de una AI. Sin embargo, la especie de Aspergillus sí puede tener implicaciones en la agresividad, la respuesta al tratamiento y el pronóstico de la complicación17.
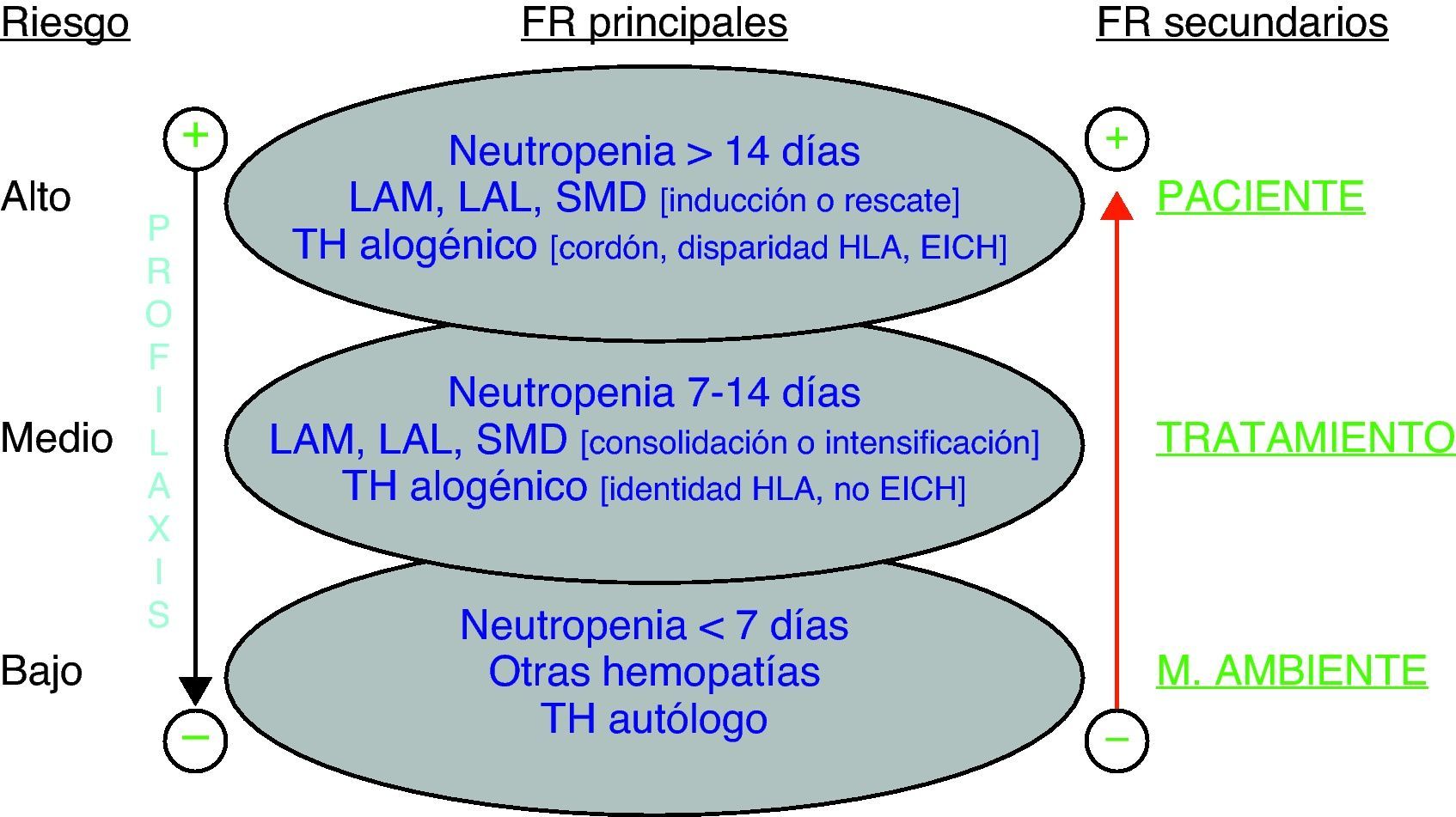
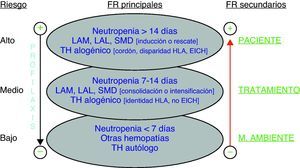
Con fines prácticos, considerados los FR en conjunto, se pueden establecer 3 niveles de riesgo de AI/IFI-HF, según se refleja en la figura 1.
Clasificación del riesgo de AI/IFI-HF. AI: aspergilosis invasora; EICH: enfermedad injerto contra huésped; FR: factores de riesgo; IFI-HF: infección fúngica invasora por hongos filamentosos; LAL: leucemia aguda linfoblástica; LAM: leucemia aguda mieloblástica; SMD: síndromes mielodisplásicos de alto riesgo; TH: trasplante hematopoyético. Profilaxis: se refiere a que el paciente esté recibiendo profilaxis eficaz frente a Aspergillus spp/hongos filamentosos. (De Barberán et al.26 y Vallejo y Barberán27).
Debido al rápido crecimiento del hongo, la AI es una complicación de naturaleza progresiva y, frecuentemente, refractaria al tratamiento. Esto es particularmente cierto cuando el diagnóstico es tardío y persisten los FR predisponentes. En el paciente hematológico, la AI tiene una marcada tendencia a invadir los vasos sanguíneos (angio-invasión) y a diseminarse por vía hematógena o por contigüidad, como expresión del fallo del sistema inmune para controlar la infección local. Dado que la puerta de entrada suele ser la vía respiratoria, las 2 formas más habituales de la AI primaria son la aspergilosis rino-sinusal aguda y, sobre todo, la API. Esta última se caracteriza porque gran parte de sus manifestaciones clínicas más habituales (como la tos, la disnea o la fiebre) son de carácter inespecífico. En algunas ocasiones el paciente presenta semiología de infarto pulmonar (dolor torácico, hemoptisis…), el cual se produce por la invasión y la obstrucción de una o varias arterias por émbolos fúngicos. Por otra parte, en el curso de la evolución de la API puede producirse cavitación de una o varias lesiones pulmonares y dar lugar a un neumotórax o una hemoptisis más o menos masiva. Estas manifestaciones, aunque pueden amenazar la vida del paciente, no tienen por qué reflejar progresión de la AI, sino que pueden presentarse durante el proceso de «curación», a menudo coincidiendo con la recuperación de la cifra de neutrófilos. En el mayor estudio de necropsias en pacientes con neoplasias hematológicas publicado recientemente, los autores observaron que la API presentaba un patrón histopatológico distinto según el contexto. Así, la API de los pacientes leucémicos con neutropenia se caracterizaba por abundante presencia de hifas angio-invasoras y extensa necrosis tisular coagulativa (no inflamatoria). Mientras tanto, en la API de los pacientes trasplantados con EICR se observaba escasa presencia fúngica e intensa inflamación de carácter neutrofílico. La AI rino-sinusal aguda se caracteriza por la invasión de la mucosa con infarto y la extensión centrífuga hacia estructuras contiguas y endocráneo (AI rino-cerebral). Su sintomatología puede incluir congestión nasal, dolor rino-sinusal u orbitario, cefalea, ceguera monocular, epistaxis, fiebre, tumefacción y proptosis. La AI en el paciente hematológico puede también afectar, habitualmente por diseminación hematógena del patógeno, al SNC, al tracto gastrointestinal y a otros órganos (peritoneo, piel, ojo, corazón, vía respiratoria, tracto urinario, suprarrenales, hígado, bazo, tiroides, hueso, oído, ganglio linfático, etc.)17.
Estrategia frente a la aspergilosis invasoraLa estrategia integral frente a la AI en el paciente hematológico incluye la profilaxis (farmacológica y no farmacológica) y el tratamiento. Este último comprende 4 estrategias no excluyentes: el tratamiento empírico del paciente neutropénico febril, el tratamiento anticipado (basado en pruebas radiológicas y de laboratorio de diagnóstico precoz), el tratamiento dirigido (de la AI probada o probable) de primera línea y el tratamiento de rescate (tabla 4)26,27.
Definición del tipo de tratamiento antifúngico en el paciente hematológico
| Situación clínica | Tratamiento antifúngico |
| Fiebre que persiste a pesar de estudios microbiológicos negativos y tratamiento antibiótico de amplio espectro | Empírico |
| Antígeno galactomanano positivo (en sangre o LBA) o TC de tórax o senos paranasales compatible con AI/IFI-HF | Anticipado |
| Evidencia de AI/IFI-HF | Dirigido |
El empleo de antifúngicos orales no absorbibles (solución de anfotericina B, nistatina, clotrimazol) puede reducir la colonización fúngica superficial de las mucosas oral y del tracto digestivo. Sin embargo, no ha demostrado que prevenga el desarrollo de invasión fúngica superficial ni invasora y no se recomienda, por tanto, como estrategia profiláctica. La anfotericina B liposomal intravenosa e inhalada ha demostrado utilidad en la prevención de la AI y la API, respectivamente. Pero los estudios publicados no han alcanzado, por ahora, niveles de evidencia suficientes como para que pueda ser considerada, por una u otra ruta de administración, el fármaco de elección en la profilaxis primaria. En lo que a las candinas se refiere, no existen evidencias suficientemente relevantes para su empleo sistemático como profilaxis de la AI en enfermos hematológicos. El itraconazol, en solución oral e intravenoso, ha mostrado ser claramente eficaz en la prevención de la AI, pero sus efectos adversos, principalmente los gastrointestinales, limitan su uso.
Un paso más ha supuesto la introducción de posaconazol. Este fármaco ha mostrado una alta eficacia y un excelente perfil de seguridad en la profilaxis de la AI en pacientes hematológicos de alto riesgo. El posaconazol está aprobado en España para la profilaxis de la IFI en pacientes que estén recibiendo quimioterapia de inducción para LAM o SMD (en los cuales se espera el desarrollo de neutropenia prolongada) y en receptores de TH que estén recibiendo terapia inmunosupresora para EICR. El posaconazol está disponible, a día de hoy, únicamente en forma de solución oral, y para su correcta absorción precisa la ingesta previa de alimentación rica en grasas. Estos 2 elementos pueden limitar su empleo en pacientes con mucositis y/o insuficiente ingesta oral de alimentos28-30.
El voriconazol, el tercero de los azoles de espectro extendido (con cobertura de hongos filamentosos), ha demostrado eficacia en la prevención de la AI en pacientes sometidos a alo-TH. Su posibilidad de administración intravenosa, así como su buena biodisponibilidad oral (administrado en ayunas), lo convierten en un fármaco de gran interés práctico en la prevención de la AI en el paciente hematológico31.
En cuanto a la profilaxis secundaria, la evidencia bibliográfica es escasa. Sin embargo, la mayoría de los centros emplean profilaxis frente a hongos filamentosos en los pacientes con antecedentes de IFI cuando presentan de nuevo algún factor de alto riesgo32.
La duración óptima de la profilaxis antifúngica frente a los hongos filamentosos no está completamente aclarada y depende de los FR subyacentes. Así pues, en los pacientes neutropénicos resulta lógico mantenerla hasta que los neutrófilos sean superiores a 1.000/μl, y en los portadores EICR activa hasta que se controle la actividad del brote y la dosis de corticoide sea, al menos, inferior a 0,5mg/kg/día de prednisona33,34.
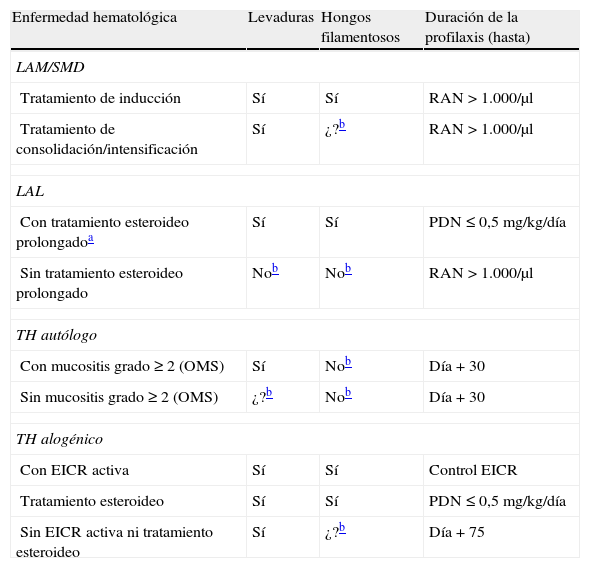
La tabla 5 refleja una síntesis de las recomendaciones de diferentes guías de sociedades científicas, las prácticas estándar de la mayoría de los centros y las principales publicaciones relativas a la profilaxis antifúngica primaria en los pacientes hematológicos33,34.
Síntesis de las recomendaciones sobre la profilaxis antifúngica primaria en enfermos hematológicos
| Enfermedad hematológica | Levaduras | Hongos filamentosos | Duración de la profilaxis (hasta) |
| LAM/SMD | |||
| Tratamiento de inducción | Sí | Sí | RAN>1.000/μl |
| Tratamiento de consolidación/intensificación | Sí | ¿?b | RAN>1.000/μl |
| LAL | |||
| Con tratamiento esteroideo prolongadoa | Sí | Sí | PDN≤0,5mg/kg/día |
| Sin tratamiento esteroideo prolongado | Nob | Nob | RAN>1.000/μl |
| TH autólogo | |||
| Con mucositis grado ≥2 (OMS) | Sí | Nob | Día+30 |
| Sin mucositis grado ≥2 (OMS) | ¿?b | Nob | Día+30 |
| TH alogénico | |||
| Con EICR activa | Sí | Sí | Control EICR |
| Tratamiento esteroideo | Sí | Sí | PDN≤0,5mg/kg/día |
| Sin EICR activa ni tratamiento esteroideo | Sí | ¿?b | Día+75 |
EICR: enfermedad injerto contra receptor; LAL: leucemia aguda linfoblástica; LAM: leucemia aguda mieloblástica; PDN: prednisona; RAN: recuento absoluto de neutrófilos en sangre; SMD: síndromes mielodisplásicos de alto riesgo; TH: trasplante hematopoyético; ¿?: datos insuficientes.
Modificado de Ruiz-Camps et al.33,34.
El tratamiento antifúngico en el paciente hematológico ha cambiado considerablemente con la llegada de nuevos antifúngicos y pruebas diagnósticas, que han ampliado las posibles estrategias terapéuticas. Del uso empírico casi exclusivo de anfotericina B deoxicolato (ABD) durante las 2 últimas décadas del sigloxx, se ha pasado al empleo de fármacos como las formas lipídicas de anfotericina B, las candinas y los azoles de espectro extendido, de igual o superior eficacia, menos tóxicos y mejor tolerados que la primera26,27.
La justificación del tratamiento empírico se basa en 2 estudios realizados con ABD en los años ochenta, en los que se redujeron la incidencia y la mortalidad de la AI/IFI. Más adelante han adquirido esta indicación las formas lipídicas de anfotericina B y la caspofungina. Actualmente, el tratamiento empírico se aconseja en los pacientes hematológicos con riesgo intermedio o alto de IFI que presenten fiebre prolongada sin foco aparente a pesar de tratamiento antibiótico de amplio espectro. El concepto de tratamiento anticipado (administración de antifúngicos en pacientes con positividad del galactomanano o presencia de una imagen compatible con IFI en la TC de tórax o de senos paranasales) aparece en el año 2005, con el objetivo de reducir el número de pacientes que reciben tratamiento empírico, manteniendo la precocidad del mismo. Pero este objetivo no siempre se alcanza debido, entre otros aspectos, a la demora en disponer los resultados del laboratorio, la relativamente baja sensibilidad del galactomanano en algunas circunstancias y la poca especificidad de la imagen radiológica. El tratamiento dirigido consiste en el empleo de antifúngicos cuando hay pruebas de enfermedad fúngica invasora18,19. El gold standard para el tratamiento de la AI en el paciente hematológico es el voriconazol, siendo la anfotericina B liposomal una buena alternativa terapéutica (tabla 6)35,36.
Tratamiento de la aspergilosis invasora
| Fármaco | IDSA | ECIL | SEIMC |
| Voriconazol | A-I | A-I | A-I |
| Anfotericina B liposomal | A-I | B-I | A-I |
| Anfotericina B complejo lipídico | – | B-II | – |
| Caspofungina | – | C-II | C-II |
| Itraconazol | – | C-III | D-III |
| Combinación | B-II | D-III | C-III |
A-I, B-I, B-II, C-II, C-III, D-III: se refieren a los niveles de evidencia/grados de recomendación estándar.
En negrita, mayores niveles de evidencia/recomendación.
De Fortún et al.36.
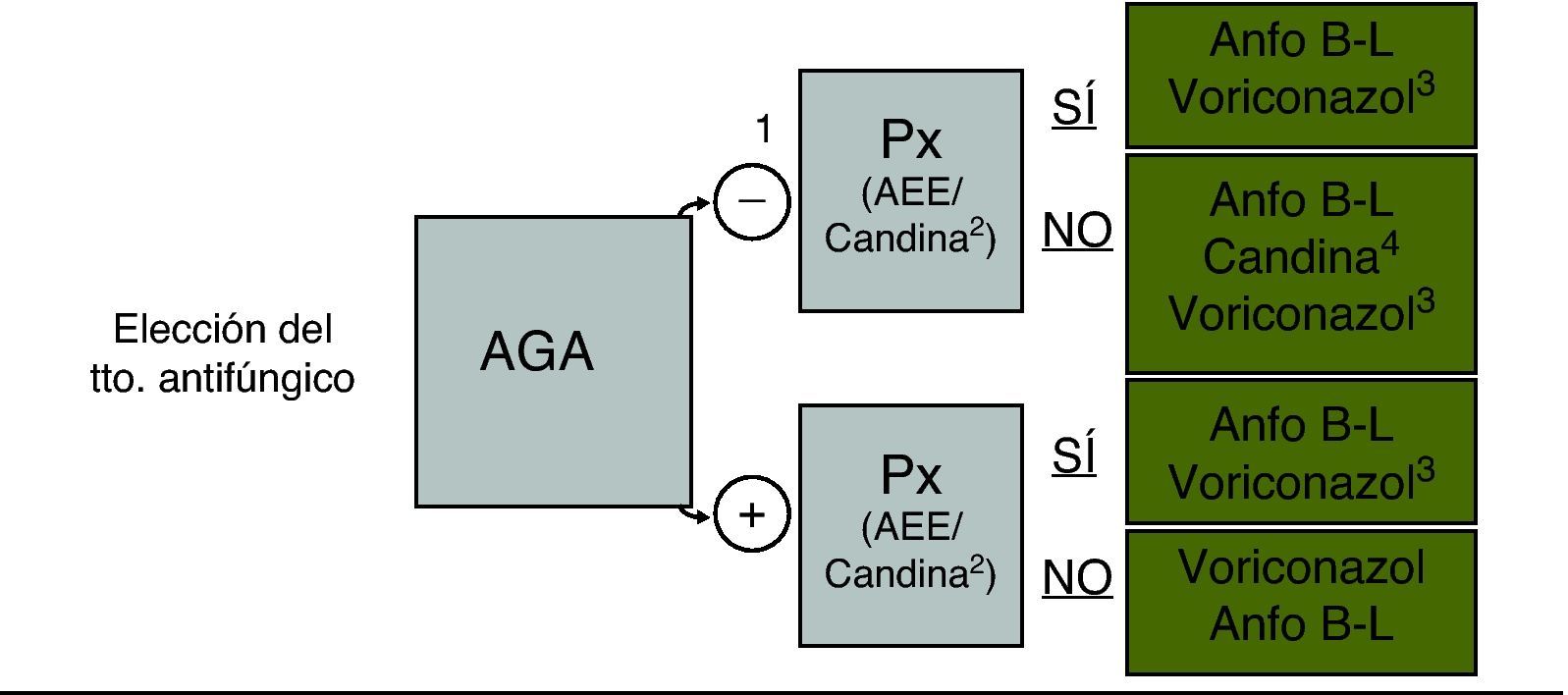
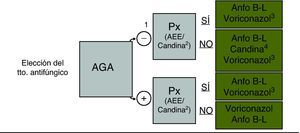
Más allá de la denominación teórica de cada uno de los enfoques terapéuticos, la decisión del inicio y del tipo de tratamiento antifúngico en cada paciente concreto debe establecerse en función de: a)el nivel de riesgo de AI/IFI; b)las características y la gravedad del cuadro clínico; c)la actividad frente a hongos filamentosos de la profilaxis antifúngica que el paciente haya recibido, y d)los resultados de las pruebas complementarias, básicamente el galactomanano y la TC de tórax y/o senos paranasales (figs. 2 y 3).
Selección del agente antifúngico en el paciente hematológico. 1: AGA negativo o no disponible; 2: la micafungina es la única candina con indicación en profilaxis; 3: considerar el uso de voriconazol si el paciente está recibiendo profilaxis con una candina; 4: si el cuadro clínico y/o los estudios de imagen son compatibles con IFI-HF se recomienda no usar una candina en monoterapia (la caspofungina es la única candina con indicación en el tratamiento empírico). AEE: azoles de espectro extendido (itraconazol, posaconazol, voriconazol); AGA: antígeno galactomanano; Anfo B-L: anfotericina B liposomal; IFI-HF: infección fúngica invasora por hongos filamentosos; Px: profilaxis; Tto: tratamiento. (De Barberán et al.26 y Vallejo y Barberán27).
Con respecto a la terapia combinada, hasta que se disponga de estudios clínicos prospectivos aleatorizados que demuestren que alguna/s combinación/es son más eficaces y no más tóxicas que la monoterapia, su uso indiscriminado debe ser desaconsejado. Sin embargo, en circunstancias como la AI con afectación pulmonar bilateral extensa o del SNC o el desarrollo de insuficiencia respiratoria, el empleo de voriconazol asociado a anfotericina B liposomal o una candina puede ser una alternativa razonable13. Recientemente se ha finalizado el primer estudio prospectivo, aleatorizado, doble ciego, comparando voriconazol más anidulafungina frente a voriconazol en monoterapia como tratamiento primario de pacientes con AI. La publicación de los resultados de este importante trabajo podría dar luz sobre la conveniencia o no de emplear terapia combinada más precozmente.
Tratamiento de rescate de la aspergilosis invasoraLa mayoría de los estudios publicados sobre el tratamiento de rescate de la AI son de escasa calidad metodológica, lo que hace que sus conclusiones no alcancen niveles altos de evidencia. Resultarían, pues, de gran ayuda futuros estudios aleatorizados, dirigidos a grupos bien definidos de pacientes y con criterios de respuesta lo más uniformes posible, que exploraran las distintas posibilidades de manejo de la AI refractaria al tratamiento de primera línea. En todo caso, la mayoría de los agentes terapéuticos han demostrado respuestas globales modestas, con escaso porcentaje de respuestas completas. Así pues, factores como la toxicidad esperable o la vía de administración de los distintos fármacos pueden ayudarnos a elegir una u otra opción terapéutica. La elección del tratamiento antifúngico de rescate también puede estar condicionada por la identificación del agente causal, si se logra. Por ejemplo, A. terreus o flavus son frecuentemente resistentes a la anfotericina B. También hay que tener en cuenta factores clínicos, como la afectación del SNC, en cuyo caso debemos emplear agentes con buena penetración en el mismo, como voriconazol, posaconazol o anfotericina B liposomal. Por otra parte, en el caso de emplear azoles de espectro extendido por vía oral sería aconsejable —aunque no fácil para la mayoría de los centros— disponer de niveles plasmáticos y, eventualmente, ajustar la dosis del fármaco a los mismos. En casos seleccionados, la terapia combinada podría ser una alternativa terapéutica de rescate razonable37.
Aspergilosis invasora en el paciente con cáncer no hematológicoLa AI no es frecuente en pacientes con tumores sólidos. La mayoría de casos descritos corresponden a pacientes con cáncer de pulmón en estadioIII-IV, con una incidencia que oscila entre el 1 y el 2%. En la mitad de los casos los pacientes han recibido tratamiento con esteroides o quimioterapia durante el último mes y tienen antecedentes de bronquitis crónica, sin haberse aislado Aspergillus previamente en esputo. La clínica suele ser muy inespecífica y en la TC predominan los infiltrados nodulares y las cavitaciones. La mortalidad se cifra entre el 50 y el 70%, constituyendo la AI uno de los últimos episodios38-40.
Infecciones por hongos emergentesLas IFI causadas por levaduras y hongos filamentosos emergentes han incrementado su incidencia durante las últimas 2 décadas1,3, sobre todo en América, y se asocian a tasas muy elevadas de morbilidad y mortalidad (65-90%) en los pacientes con hemopatías malignas o sometidos a TH. En estos pacientes se han descrito infecciones producidas por zigomicetos (Mucor spp., Rhizopus spp., Absidia spp.), otros mohos (Fusarium spp., Scedosporium spp., Acremonium spp., Penicillium spp., Paecilomyces spp. y Trichoderma spp.), Cryptococcus y otras levaduras (Trichosporon spp., Blastoschizomyces spp., Geotrichum spp., etc.)41.
Las infecciones producidas por otras levaduras pueden ser clínicamente indistinguibles de las originadas por Candida spp., y es frecuente que aparezcan en pacientes que han recibido previamente equinocandinas. En ocasiones se han presentado en forma de brotes hospitalarios y en la mayoría de los casos se aísla el hongo en el hemocultivo.
Las infecciones producidas por zigomicetos suelen afectar a la esfera rino-cerebral, maxilar y pulmonar con diseminación a otros órganos de la economía. Las infecciones producidas por otros hongos filamentosos se asemejan en muchos casos a la AI, aunque su diseminación es más frecuente. A diferencia de la AI pueden dar lugar a lesiones cutáneas, y el aislamiento del hongo en el hemocultivo es más frecuente (p.ej., Fusarium spp.). Las imágenes radiológicas de las infecciones producidas por hongos filamentosos emergentes suelen ser indistinguibles de las de la AI, por lo que para el diagnóstico etiológico suelen ser necesarias técnicas más agresivas, como la biopsia de la zona afectada. Existen esperanzas en las nuevas técnicas de biología molecular, como la PCR panfúngica, para el diagnóstico de estas infecciones.
En resumen, aunque estas IFI por hongos emergentes son infrecuentes, gran parte de su importancia reside en la agresividad de su comportamiento, en el grado de inmunosupresión del huésped en el que se asientan y en el amplio perfil de resistencia a la mayoría de los antifúngicos disponibles. Por todo ello, además de un diagnóstico precoz, la combinación de varios antifúngicos, asociados en algunas ocasiones a la cirugía (como ocurre el caso de las zigomicosis), constituye el tratamiento de elección de estas micosis42.
Conflicto de interesesAmbos autores han participado en eventos patrocinados por MSD, Gilead, Pfizer, Esteve, Astellas, y han formado parte de sus consejos asesores.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion