Las infecciones asociadas a los catéteres utilizados tanto para hemodiálisis como para diálisis peritoneal (DP) constituyen una de las causas de morbimortalidad más importante en pacientes que precisan un tratamiento sustitutivo renal permanente. Staphylococcus aureus en pacientes en hemodiálisis y S. aureus y Pseudomonas aeruginosa en pacientes en DP son los microorganismos más frecuentemente aislados. Actualmente, no están establecidas las pruebas diagnósticas más rentables en infecciones de catéter en pacientes en hemodiálisis, por lo que se utilizan los empleados para las infecciones de los catéteres venosos centrales (CVC) en general. El tratamiento es similar al de otros CVC con algunas recomendaciones especiales. En pacientes en DP la peritonitis es una de las complicaciones más graves. La mejoría de las condiciones higiénicas en la inserción de los catéteres, el tratamiento de los portadores nasales de S. aureus, el tratamiento regular del orificio de salida de los catéteres y el sellado del catéter se han asociado con una disminución en las infecciones asociadas a catéter en pacientes en hemodiálisis y DP.
Catheter-related infections in hemodialysis (HD) and peritoneal dialysis (PD) are one of the most common causes of morbidity and mortality in patients with end-stage renal disease. Staphylococcus aureus in HD patients and S. aureus and Pseudomonas aeruginosa in PD patients are the most common causative organisms isolated. Currently, the diagnostic tests with highest yield in suspected catheter-related infection in HD patients have not been established, and tests used for central venous catheters (CVC) in general are applied. Management of the infected HD catheter and the use of antimicrobial therapy are similar to the measures used for other CVCs, with some specific recommendations. Peritonitis is the most severe complication in PD patients. Improving hygiene conditions in catheter insertion, treatment of S. aureus nasal carriers, regular treatment of the catheter's exit site, and antibiotic lock therapy have been associated with a reduction of infectious episodes in HD and PD patients.
El número de pacientes afectados de insuficiencia renal crónica que precisan de tratamiento sustitutivo renal en nuestro país está aumentando en los últimos años en progresión lineal, y la prevalencia actual es de casi 1.000 pacientes por 1.000.000 habitantes. El 89% de estos pacientes inician el tratamiento sustitutivo renal mediante hemodiálisis y entre el 5 y el 24% dependiendo de las diferentes comunidades autónomas mediante diálisis peritoneal (DP), según datos publicados por el registro de la Sociedad Española de Nefrología1.
Actualmente, existen en el mundo unos 140.000 pacientes en DP, el 12% de la población total mundial en diálisis (aproximadamente 1.375.000 personas). Se prevé que en el año 2010 el número total de pacientes en diálisis será de unos dos millones, y en DP, de unos 240.000. En definitiva, aumentará el número de pacientes y se mantendrá la proporción entre las dos técnicas2.
Las infecciones asociadas a los catéteres utilizados tanto para hemodiálisis como DP constituyen una de las causas de morbimortalidad más importante en estos pacientes que precisan un tratamiento sustitutivo renal permanente.
A continuación, describiremos por separado las infecciones asociadas a los catéteres utilizados para la realización de hemodiálisis y DP.
Infecciones asociadas a catéteres de hemodiálisisLa fístula arteriovenosa interna (FAVI) en sus diferentes modalidades es, actualmente, el acceso vascular más idóneo para comenzar la hemodiálisis. Sin embargo, entre el 15 y el 50% de estos pacientes inician la hemodiálisis por medio de un catéter venoso central (CVC)bb0020, bb0025. Fue con la introducción en el año 1979 del catéter de subclavia Uldall5, cuando el uso de CVC comenzó a ganar popularidad como método rápido para establecer un acceso temporal de hemodiálisis (hasta la colocación o maduración de una fístula permanente arteriovenosa) o de acceso permanente para pacientes sin acceso vascular alternativo. En nuestro país, el 44% de los pacientes no disponen de acceso vascular permanente en el momento de iniciar la HD, y es el catéter su primer acceso vascular. Se calcula que el 11% de la población en hemodiálisis es portadora de un CVC4.
Dos hechos deben hacernos reflexionar sobre las consecuencias de las infecciones relacionadas con los catéteres en los pacientes en hemodálisis: la mortalidad (10-14%) y la morbilidad asociadas a esta complicación5.
EpidemiologíaEn Estados Unidos se estima que son sometidos a hemodiálisis, cada año, aproximadamente 150.000 pacientes por fallo renal crónico. En España alrededor de 15.000 pacientes reciben esta terapia1.
La infección es la causa más común de morbilidad y la segunda causa de mortalidad después de la enfermedad cardiovascular en pacientes en hemodiálisisbb0030, bb0035. El riesgo de muerte atribuible a sepsis es 100 veces más que en la población general. El 75% de las muertes son causadas por una bacteriemia y el acceso vascular en hemodiálisis es la primera fuente de bacteriemia. Además, los CVC son los que presentan mayor riesgo de bacteriemia y muerte comparados con otros accesos vascularesbb0030, bb0035, bb0040, bb0045.
En la actualidad, tanto las recomendaciones norteamericanas como las europeas sugieren limitar drásticamente la utilización de los catéteres para evitar el aumento de la morbimortalidad de los pacientes en hemodiálisis. Datos de estudios recientes indican que el 15,1% de los pacientes en hemodiálisis mediante catéter fallecen en los primeros 90 días desde el inicio de esta técnica comparado con sólo el 6,7% en los pacientes con FAVIbb0030, bb0035. Se recomienda utilizar la técnica de tunelización cuando sea necesario colocar un catéter como acceso vascular para ser utilizado durante más de 3 o 4 semanasbb0040, bb0045, bb0050. Esta técnica de colocación del catéter venoso central tunelizado (CVCT), introducida en 1988, ha mostrado reducir la incidencia de infecciones y la disfunción con respecto a los catéteres no tunelizados10. La mayoría de los catéteres que se colocan son percutáneos, mientras que el 10% son tunelizados. La incidencia de infección de catéter utilizado para hemodiálisis es por término medio de 3,5 episodios por 1.000 días de catéter, aunque varía entre los catéteres no tunelizados y los CVCT.
La bacteriemia relacionada con el catéter (BRC) constituye junto con la trombosis y la disfunción del catéter una de las complicaciones tardías más relevantes y frecuentes, y en uno de cada tres casos es la causa de la retirada de los mismos. Se estima que el catéter es el origen del 50-80% de las bacteriemias en pacientes en hemodiálisis y que el riesgo de bacteriemia es de hasta el 48% a los 6 meses de la inserción5. Según las distintas series, la incidencia media de BRC en los catéteres no tunelizados es de entre 3,5 y 6,5/1.000 días de catéter, mientras que en los CVCT es de 1,6-5,5 por 1.000 días de catéterbb0055, bb0060, bb0065, bb0070, bb0075. El lugar de inserción del catéter tiene un papel importante en el riesgo de infección. En los catéteres no tunelizados la vía femoral es la que se infecta con mayor frecuencia (7,6 episodios/1.000 días de catéter) comparada con la yugular (5,6 episodios/1.000 días de catéter) y la subclavia (2,7 episodios/1.000 días de catéter)bb0070, bb0075.
La colonización del catéter ocurre con mayor frecuencia a través de la luz al conectarlo a la vía de diálisis; por eso, los CVCT tienen una menor incidencia de infecciones gracias, sobre todo, a su sistema de inserción con manguito (cuffs), que actúa como barrera en el proceso de migración de microorganismos desde el exterior hacia la luz venosa.
Stevenson et al15 identificaron, sobre un total de 111.383 sesiones de hemodiálisis en pacientes ambulatorios, 471 infecciones (4,2 infecciones/1.000 sesiones de diálisis). Los datos epidemiológicos recogidos identificaron claramente que las infecciones dependían del tipo de acceso utilizados para la hemodiálisis; así, los pacientes portadores de FAVI tuvieron el menor índice de infección, seguidos de los CVCT y, finalmente, la mayor incidencia de infección la presentaron los CVC no tunelizados (riesgo relativo [RR] del 32,6; e intervalo de confianza [IC] del 95% de 18,6-57,4), con una diferencia estadísticamente significativa al compararlo con los demás accesos; p < 0,0001. En su serie la incidencia de la infección relacionada con el catéter por 1.000 días en los catéteres no tunelizados fue de 29,2 por paciente. Estos datos señalan la importancia de hemodializar más frecuentemente por accesos definitivos para disminuir las tasas de infección.
PatogeniaEl origen de la infección de los catéteres utilizados para hemodiálisis más frecuente es la colonización endoluminal que se produce a través de las conexiones externas por manipulación (26%). La colonización extraluminal por migración de la flora de la piel a través del trayecto cutáneo de fibrina alrededor del catéter es más frecuente en catéteres con menos de 10 días de inserción. Menos comunes son las infecciones producidas por vía hematógena desde otro punto de infección (3-10%) o por la contaminación de los líquidos de infusión16.
Algunos agentes, como los estafilococos coagulasa-negativo (ECN), producen complejos glucoproteicos denominados "slime" o limo que les confiere protección frente al sistema inmunitario y favorece su multiplicación. Otros microorganismos como P. aeruginosa y Candida spp. pueden producir sustancias similares, sobre todo en medios ricos en glucosa17.
Una vez que se realiza la implantación del catéter se genera por parte del huésped la producción de una biocapa a su alrededor. Esta capa es rica en fibrina y fibronectina, que facilita la adherencia de los estafilococos al catéter a través de proteínas expresadas en la superficie del microorganismo. En el caso de P. aeruginosa, la adherencia inicial está mediada por hidrofobinas y/o adhesinas de superficie del tipo lectinas18.
También se debe tener en cuenta que los pacientes con insuficiencia renal terminal presentan alteración de los mecanismos de defensa, debido, en parte, a las enfermedades subyacentes propias de estos pacientes (diabetes, neoplasias) asociadas a la malnutrición secundaria a la uremia y al tratamiento con hemodiálisisbb0100, bb0105. Además, la uremia y la inflamación inducida por los filtros de hemodiálisis pueden causar estrés oxidativo y activación de la apoptosis, con disminución del número de linfocitos T, lo que ocasiona un déficit de inmunidad celular que favorece la aparición de infeccionesbb0105, bb0110.
EtiologíaLos principales agentes causantes de infección por catéter son los estafilococos. Los ECN, en especial S. epidermidis son los microorganismos más frecuentemente aislados, debido a que forman parte de la flora cutánea, tienen pocos requerimientos nutritivos y gran capacidad de adherencia y colonización de las superficies plásticas. Sin embargo, debido a la elevada tasa de portadores de S. aureus en pacientes hemodializados (prevalencia: 30-60%), se observa una proporción más elevada de infecciones por este microorganismo que en otros grupos de pacientes. Este microorganismo, a su vez, causa con mayor frecuencia que los ECN bacteriemia y complicaciones metastásicas como osteomielitis y endocarditis22. En un estudio reciente de 69 pacientes en hemodiálisis que presentaron endocarditis, el 66,7% se dializaban a través de un catéter; S. aureus fue el microorganismo aislado en el 57,9% de los casos, de los cuales el 57,5% fueron sensibles a meticilina23. Otros estudios han publicado que S. aureus es el microorganismo implicado con mayor frecuencia en las BRC en pacientes en hemodiálisis, lo que constituye del 33 al 80% de las bacterias aisladas en los hemocultivosbb0115, bb0120, bb0125. La disminución de los portadores nasales de S. aureus ha supuesto una drástica reducción en las bacteriemias por esta bacteria25. Otros microorganismos de la piel como Streptococcus, Bacillus y Corynebacterium también se han implicado en BRC en pacientes en hemodiálisis. El aislamiento de bacilos gramnegativos (BGN) (Pseudomonas aeruginosa) o por hongos (Candida) es menos frecuente y suele estar relacionado con la contaminación, extrínseca. En la Tabla 1 se muestran los microorganismos aislados en distintas series de pacientes en hemodiálisis.
Tabla 1. Microorganismos implicados en la bacteriemia relacionada con catéteres de hemodiálisis según diferentes estudios 25
| Autor | Fecha | Núm. | Tasa * | Gram+(%) | SA (%) | ECN (%) | Enteroc (%) | Gram-(%) | Mixtas/ otros (%) | Desconocido (%) |
| Capdevila | 1990-1991 | 13 | NM | 62 | 15 | 38 | 0 | 31 | 7 | 0 |
| Swartz | 1990-1993 | 29 | 2,9/1.000 | 69 | 45 | 24 | 0 | 28 | 14 | 0 |
| Shaffer | 1992-1994 | 13 | NM | 62 | 0 | 54 | 8 | 15 | 15 | 8 |
| Uldall | 1993 | 1,6/1.000 | ||||||||
| Marr | 1995-1996 | 62 | 3,9/1.000 | 65 | 44 | 15 | 5 | 24 | 11 | 0 |
| Robinson | 1996-1997 | 40 | NM | 78 | 35 | 22 | 13 | 19 | 3 | 0 |
| Beathard | 1996-1997 | 67 | 3,4/1.000 | 85 | 36 | 44 | 20 | 33 | 18 | 0 |
| Tanriover | 1997-1998 | 69 | NM | 64 | 36 | |||||
| Develter | 1991-2002 | 59 | 1,7/1.000 | 58 | 41 | 1 | 0 | |||
| Saad | Nov 1995-oct 1997 | 86 | 5,5/1.000 | 52 | 22 | 40 | 20 | 27 | 21 | 0 |
| Tokars | Dic 1997-jul 1998 | 39 | 1,5/1.000 | 72 | 28 | 25 | 11 | 22 | 6 | 0 |
| Dopirak | Abr 1999-mar 2000 | 134 | 41,5/100 paciente/año | 62 | 20 | 29 | 13 | 30 | 8 | 0 |
| Taylor | Dic 1998-may 1999 | 94 | 3,1/1.000 | 82 | 32 | 40 | 8 | 10 | 8 | 0 |
| Tokars | Oct 1999-may 2001 | 917 | 1,8/1.000 | 44 | 32 | 32 | 10 | 18 | 1 | 0 |
| Ibrik | Mar 1996-jul 2005 | 25 | 2,8/1.000 | 84 | 12 | 4 | ||||
| Colville | Jul 2002-jun 2003 | 32 | NM | 22 | 22 | 20 | 33 | 3 |
ECN: estafilococos coagulasa negativos; Enteroc.: enterococos; Gram-: microorganismos gramnegativos; Gram+: microorganismos grampositivos; NM: no mostrado; Núm: número de infectados; SA: Staphylococcus aureus.
* La tasa es por 1.000 días de catéter venoso central.
Deben diferenciarse las infecciones locales asociadas al catéter (en el punto de entrada o en el trayecto subcutáneo) o generalizadas (bacteriemias) que pueden dar lugar a complicaciones graves (endocarditis, meningitis, osteomielitis, shock séptico)bb0115, bb0120. La progresiva colonización e infección del catéter puede pasar inadvertida hasta que el paciente presenta una bacteriemia. En este caso, la fiebre con o sin escalofríos es el síntoma capital, y se debe sospechar sepsis asociada al catéter en todo paciente portador de un catéter que presenta un cuadro febril sin foco aparente que lo justifique. Aunque la BRC puede ser continua, suele presentarse durante la utilización del catéter para hemodiálisis. En ocasiones, pueden presentarse signos locales orientadores como son el eritema y otros signos inflamatorios en el lugar de la punción cutánea o en el trayecto subcutáneobb0135, bb0140, bb0145.
La infección local puede manifestarse por la presencia de pus en el punto de inserción del catéter en la piel, inflamación cutánea o subcutánea, celulitis, trombosis venosa o tromboflebitis infecciosa. La salida de pus por el orificio de entrada orienta a infección en dicho lugar, mientras que cuando el trayecto subcutáneo está infectado el pus puede salir por otros puntos adyacentes y distintos del origen de la inserción del catéter26.
La infección general puede presentar signos menores (fiebre con o sin escalofríos y leucocitos) y mayores (sepsis con o sin shock). Todos estos signos pueden asociarse o no a un hemocultivo positivo, y a la inversa un hemocultivo positivo puede existir sin que estos signos estén presentes.
La clínica suele desaparecer al retirar el catéter infectado, a menos que exista una infección local del trayecto subcutáneo, una flebitis séptica u otra localización metastásica.
La colonización del catéter en pacientes en hemodiálisis sin asociarse a manifestaciones clínicas es frecuente y puede ocurrir en entre el 10 y el 55% de los catéteres de hemodiálisis26.
DiagnósticoActualmente no están establecidos los términos y las pruebas diagnósticas más rentables en el caso de infecciones de catéter en pacientes hemodializados, por lo que se utilizan tanto los términos como los métodos diagnósticos empleados para las infecciones de los CVC en general (Tabla 2)bb0150, bb0155, bb0160, bb0165.
Tabla 2. Definiciones de las infecciones relacionadas con catéter 29
Infección del punto de entrada
|
Bacteriemia relacionada con el catéter
|
El diagnóstico clínico es muy inespecífico. La simple retirada de un catéter infectado puede ser suficiente para que desaparezca la fiebre, y este hecho puede constituir una evidencia indirecta de infección, pero la confirmación de que una bacteriemia está relacionada con una infección por catéter se basa en el aislamiento del microorganismo responsable en el catéter. Ello tradicionalmente se realiza mediante la retirada del catéter y su posterior procesamiento microbiológico. El método semicuantitativo de Maki, que permite diferenciar entre infección (recuento superior a 15 unidades formadoras de colonias [ufc]) o simple colonización (recuento menor a 15 ufc), es el más utilizado. Un recuento de 5 ufc en el CVC tiene valor, y debe ser considerado, sobre todo si se acompaña de síntomas clínicos. Sin embargo, en los pacientes en hemodiálisis y con CVCT, la retirada del catéter no siempre es posible y es necesario utilizar métodos alternativos de diagnóstico. Actualmente, los hay que demuestran la infección del catéter sin la obligatoriedad a priori de su retirada: 1) cultivos y tinciones superficiales que combinan la tinción de Gram y el cultivo de un frotis de la piel que rodea el punto de inserción del catéter con la tinción de Gram y el cultivo del interior de las conexiones tienen un elevado valor predictivo negativo (93-99%); 2) hemocultivos cuantitativos que se basan en que el número de ufc/ml de la sangre obtenida a través de un catéter infectado es mayor que el número de ufc/ml en la sangre extraída de una vena periférica. Una proporción superior o igual a 5:1 en las muestras extraídas a través de catéter respecto a las obtenidas por venopunción es muy indicativo de BRC. Y 3) velocidad de positivización de hemocultivos (una diferencia de la positivización de 2 h al menos de los hemocultivos extraídos del catéter y de los extraídos de sangre periférica también es muy sugestivo de BRCbb0155, bb0165).
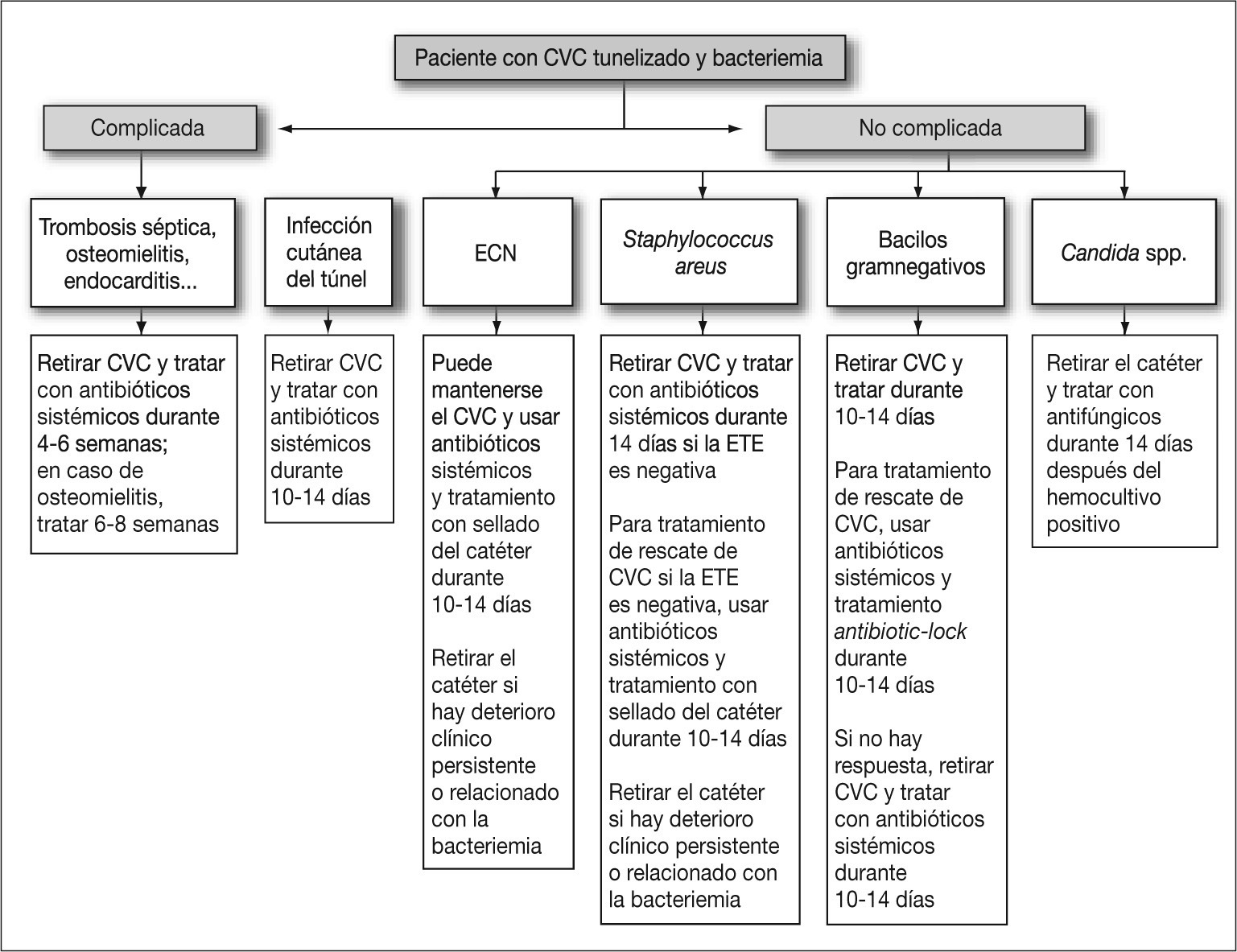
TratamientoEl tratamiento de las infecciones de catéter en pacientes en hemodiálisis y la utilización de agentes antimicrobianos son similares a las infecciones de otros CVC (Tabla 3, Figura 1)bb0130, bb0150, bb0160 con algunas recomendaciones:
1. No se debe utilizar vancomicina para el tratamiento de S. aureus sensible a meticilina por el riesgo de seleccionar microorganismos resistentes a vancomicina y por la menor penetración que las penicilinas antiestafilocócicas.
2. Si existen signos de sepsis grave y/o shock séptico, infección supurada del punto de entrada o del túnel subcutáneo, tromboflebitis séptica y/o complicaciones infecciosas a distancia es preciso retirar del catéter.
3. Si se conserva el catéter se recomienda realizar además del tratamiento sistémico el tratamiento local del catéter o sellado del catéter (antibiotic-lock). Esta técnica consiste en la adición de antibióticos a la solución anticoagulante que se aplica tras el uso del catéter hasta su próxima utilización, consiguiéndose una concentración de antibiótico 50-100 veces la concentración inhibitoria mínima (CIM) del microorganismo potencialmente responsable de la infección del catéter.
4. En el caso de que la bacteriemia sea por ECN y no existan complicaciones, puede tratarse la bacteriemia sin la retirada del catéter, pero además del tratamiento sistémico durante 7 días, se realizará tratamiento con sellado del catéter durante 14 días.
5. Cuando la infección del catéter sea por S. aureus, además del tratamiento antibiótico intravenoso y la retirada del catéter deberá realizarse siempre el cultivo de las fosas nasales, y si el paciente es portador de S. aureus se tratará con mupirocina nasal al 2% durante 7 días.
Tabla 3. Tratamiento antibiótico en pacientes con bacteriemia relacionada con el catéter en pacientes en hemodiálisis
| Microorganismo | Tratamiento sistémico | Sellado de catéter |
| Tratamiento empírico | Vancomicina 1 g/4-7 díaso teicoplanina 6 mg/kg/72 h +Betalactámico i.v. | Vancomicina 5-10 mg/mlo teicoplanina 5-10 mg/ml |
Staphylococcus aureus o ECN
| Cloxacilina 2 g/4 h i.v.Vancomicina 1 g/4-7 díaso teicoplanina 6 mg/kg/72 ho daptomicina 6 mg/kg/48 ho linezolid 600 mg/12 h | Vancomicina 5-10 mg/mlo teicoplanina 5-10 mg/mlVancomicina 5-10 mg/mlo teicoplanina 5-10 mg/mlo linezolido daptomicina |
Enterococcus spp.
| Ampicilina 2 g/12-24 h i.v. (dosis tras diálisis) +gentamicina 2 mg/kg/72 h (dosis tras diálisis)Vancomicina 1 g/4-7 días o teicoplanina 6 mg/kg/72 h +gentamicina 2 mg/kg/72 h (dosis tras diálisis) | Teicoplanina 5-10 mg/mlo vancomicina 5-10 mg/mlVancomicina 5-10 mg/mlo teicoplanina 5-10 mg/ml |
| Pseudomonas aeruginosa | Piperacilina-tazobactam 2 g/8 h (1 g tras diálisis)o ceftazidima 2g/48 h (1 g tras diálisis)o cefepima 1 g/24 h (1 g tras diálisis)o imipenem 125-250 mg/12 h (dosis tras diálisis)o meropenem 500 mg/24 h (dosis tras diálisis)o ciprofloxacino 400 mg/12 h i.v. +tobramicina 2 mg/kg/72 h (dosis tras diálisis)o amikacina 3 mg/kg/72 h (dosis tras diálisis) | Amikacina 10 mg/mlo ceftazidima 5-10 mg/mlo cefepima 5-10 mg/ml |
| Enterobacter spp. | Imipenem 125-250 mg/12 h (dosis tras diálisis)o meropenem 500 mg/24 h (dosis tras diálisis)o levofloxacino 1.a dosis de 500 mg/día i.v. y después 250 mg/48 h i.v.o ciprofloxacino 200 mg/12 h i.v. | Amikacina 5-10 mg/mlo ciprofloxacino 5-10 mg/ml |
| Candida spp. | Fluconazol 100-200 mg/día (100% de dosis recomendada tras diálisis)o caspofunginao anfotericina B liposomal según sensibilidad | Anfotericina B desoxicolato 2,5 mg/ml |
ECN: Estafilococos coagulasa negativos; i.v.: intravenoso.
Figura 1. Aproximación al tratamiento de un paciente con bacteriemia y portador de catéter venoso central tunelizado.CVC: catéter venoso central; ECN: estafilococos coagulasa negativos; ETE: ecografía transesofágica.
La vancomicina es el tratamiento empírico de elección en pacientes en hemodiálisis y con sospecha de BRC, si la situación clínica es estable. En caso de sepsis grave o shock séptico, se debe asociar antibioterapia para gramnegativos dada la prevalencia de infecciones por P. aeruginosa en estos pacientes31. En todos los pacientes con infección debida a Candida spp. debe retirarse el catéter y administrar tratamiento antifúngico durante 14 días después de que la funguemia haya sido aclarada. Las infecciones complicadas requieren tratamiento antimicrobiano más prolongado y la retirada del CVC dependiendo del lugar de la metástasis séptica31.
PrevenciónLas estrategias de prevención se basan de forma general en el correcto cumplimiento de las medidas de asepsia durante la inserción y el mantenimiento de las vías vasculares: lavado de manos, barrera completa en inserción del catéter y lavado cutáneo con clorhexidina33. Varias medidas se han asociado con una disminución en las infecciones asociadas a catéter en pacientes en hemodiálisis: a) mejora de las condiciones higiénicas en las unidades de hemodiálisis; b) utilizar la técnica del sellado del catéter; c) tratamiento regular del lugar de salida de los CVC, y d) tratar a los portadores nasales de S. aureusbb0130, bb0175, bb0180, bb0185.
En la actualidad, se está ensayando el empleo de catéteres impregnados con plata, antibióticos o antisépticos con distintos resultados y sin conclusiones definitivas en la prevención de la infección del catéter en este tipo de pacientes25.
Infecciones asociadas a catéteres de diálisis peritonealEntre el 5 y el 30% de los pacientes con insuficiencia renal terminal que precisan tratamiento sustitutivo renal lo hacen mediante DP. El catéter peritoneal es un cuerpo extraño que facilita la aparición de infecciones y sirve como reservorio para las bacterias. Puede aparecer infección tanto en el orificio de salida como en el túnel (trayecto tunelizado del catéter) o en el peritoneo (peritonitis). La peritonitis continúa siendo una complicación importante de la DP, ya que contribuye al fracaso de la técnica, a la hospitalización e incluso a la muerte. Además, una peritonitis grave y prolongada contribuye al propio fracaso de la membrana peritoneal37. Se calcula que estas infecciones causan el 10-25% de las peritonitis y son responsables del 8-39% de cambios o retiradas de catéter y pueden ser la causa de salida de la técnica en el 2-37% de casos38. La asociación entre las infecciones del orificio de salida o del trayecto subcutáneo y la peritonitis está bien establecida.
Los avances y mejoras en los sistemas de DP, incluyendo especialmente en los sistemas de conexión ("conectología") han disminuido la incidencia de peritonitis en pacientes en DP y, proporcionalmente, han aumentado las infecciones del catéter que constituyen así una causa principal de morbilidad y contribuyen a la derivación a hemodiálisis de estos pacientes39.
El riesgo global para una infección en el punto de inserción del catéter (sin peritonitis) en la diálisis peritoneal continua ambulatoria (DPCA) se aproxima a 0,2-1,42 episodios pacientes-año. Sin embargo, la mitad de los pacientes en DPCA no desarrollarán infección del orificio de salida en los primeros 2 años tras la colocación del catéterbb0190, bb0205, bb0210.
Los portadores nasales de S. aureus y la diabetes mellitus son factores claramente relacionados con la infección del catéter de DP. Otros factores como la falta de asepsia, la baja motivación del paciente, la falta de soporte social, el poco entrenamiento y un bajo nivel socioeconómico son factores que contribuyen a la infección. A su vez, los factores de riesgo de desarrollar una peritonitis están relacionados con los sistemas de conexión, la infección del túnel y del orificio de salida del catéter, el estado de portador nasal de S. aureus y hasta con el estado de ánimo de los pacientes (depresión) y el climabb0190, bb0200.
No se ha encontrado asociación entre la técnica de inserción y colocación del catéter o el tipo del mismo con la aparición de la infección del catéter o con la peritonitis. Algunos estudios, sin embargo, han mostrado que los catéteres con doble manguito de dacrón, o distintos tipos de conexión, disminuyen las tasas de infección peritonealbb0215, bb0220. Por otra parte, la mupirocina nasal reduce significativamente la tasa de infección del orificio de salida y del túnel, pero no así la tasa de peritonitis. Los antibióticos intravenosos preparatorios disminuyen significativamente el riesgo de peritonitis temprana, pero no las infecciones del sitio de salida o del túnel del catéter43.
La infección del catéter, tanto en su porción tunelizada como en el orificio de salida, casi siempre tiene origen en una infección periluminal, relacionada con la flora del paciente, la manipulación del personal sanitario, desinfectantes contaminados o incluso de la contaminación ambiental. En algunas ocasiones la coexistencia de peritonitis puede contaminar el manguito de lo más profundo del catéter con la consiguiente infección del túnel e incluso la formación de abscesos37.
S. aureus y Pseudomonas spp. causan la mayoría de las infecciones relacionadas con el catéter peritoneal. Más del 50% son producidas por S. aureus, sobre todo en los portadores nasales (Tabla 4)bb0190, bb0195, bb0210, bb0225.
Tabla 4. Microbiología de las infecciones asociadas a catéter peritoneal 37,38,41,44
| Infecciones del catéter (%) | Peritonitis (%) | |
| Bacterias grampositivas | ||
| ECN | 10-35 | 40-65 |
| S. aureus | 25-50 | 10-25 |
| Estreptococos | 2-5 | 8-15 |
| Enterococos | 2-5 | 3-7 |
| Corynebacterias | 2-9 | 1-4 |
| Bacterias gramnegativas | ||
| Escherichia coli | 5-30 | 7-12 |
| Klebsiella spp. | 2-5 | 2-4 |
| Otras enterobacterias | 1-5 | 1-7 |
| Pseudomonas spp. | 10-28 | 5-9 |
| Miscelánea | 1-5 | 1-5 |
| Polimicrobiana | 25-35 | 2-6 |
| Anaerobios | 1 | 1-5 |
| Hongos (Candida spp.) | 4-6 | 4-8 |
ECN: estafilococos coagulasa negativos.
Desde el punto de vista clínico, la infección del orificio de salida del catéter se define como la presencia de exudado purulento con o sin eritema de la piel en la unión entre el catéter y la misma. El eritema sin drenaje puede ser signo de infección, pero también de una simple dermatitis (sobre todo en catéteres colocados de forma "traumática").
El espectro de presentación puede abarcar desde la colonización asintomática a la infección leve, con eritema rodeando el orificio de salida y formación de costras, hasta un franco drenaje purulento con formación de abscesos e infección del trayecto tunelizadobb0230, bb0235. La infección del túnel se caracteriza por eritema, edema y dolor sobre el recorrido subcutáneo. En muchas ocasiones no es evidente y es preciso detectarla mediante técnicas de imagen, como la ecografía. Aunque, puede ocurrir aisladamente, la mayor parte de las veces se asocia a la infección del orificio de salida. Cuando está producida por S. aureus y Pseudomonas spp. suele resultar en peritonitis45.
DiagnósticoEn cuanto al diagnóstico, se han desarrollado escalas para definir la infección del orificio de salida o del túnel, pero se requiere un buen diagnóstico clínico y un estrecho seguimiento antes de tomar la decisión de iniciar terapia para evitar tratar "simples" colonizaciones. El sistema de gradación del infección de Twardowski clasifica el tipo de infección según el estado del orificio de salida en "perfecto-bueno-equívoco-infección crónica-inflamación aguda-infección del manguito externo sin infección del sitio de salida" de acuerdo con la presencia de edema, escaras, eritema, dolor, exudado o tejido de granulación47. El diagnóstico comienza por un examen cuidadoso del sitio con búsqueda de los signos que indiquen infección. En algunos casos se requiere una técnica de imagen (una ecografía suele ser suficiente) para confirmar la infección del túnel o la formación de abscesos.
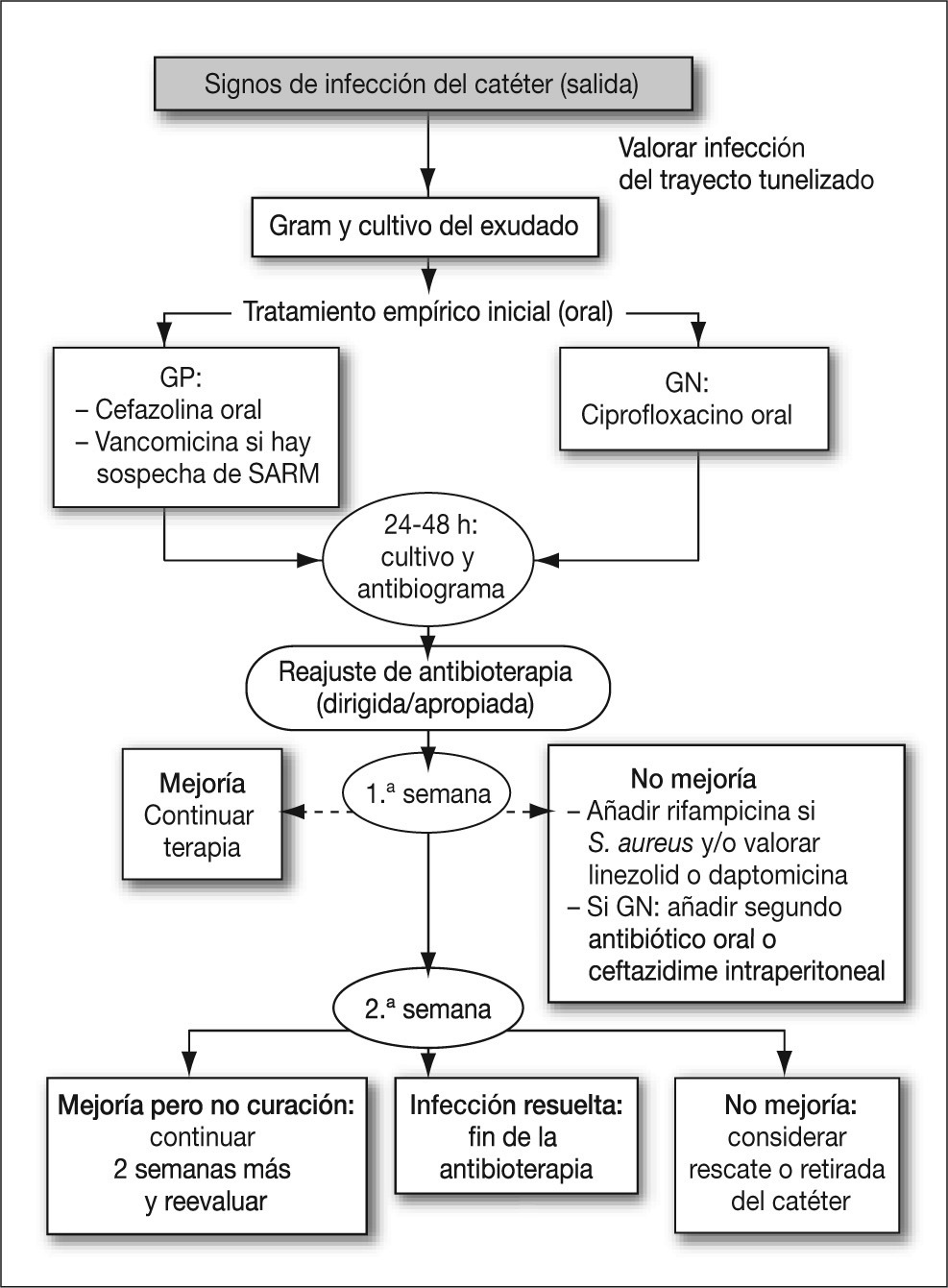
TratamientoEl tratamiento antibiótico varía según las distintas situaciones (Tabla 5):
1. En los casos en que exista un eritema sin signos de infección que puede deberse tanto a una infección inicial como a un origen traumático; como el trauma puede asociarse con el desarrollo de infección, estaría indicada la prescripción de antibioterapia durante varios días.
2. La infección leve (mínimo eritema sin exudado) puede tratarse con agentes antimicrobianos tópicos (clorhexidina, povidona yodada, peróxido de hidrógeno) y monitorización diaria cuidadosa.
3. En una infección moderada o grave estaría indicado realizar la toma de muestras (Gram y cultivo) y el inicio empírico de antibioterapia. Se puede utilizar una cefalosporina (excepto si se sospecha S. aureus resistente a meticilina (SARM) o fluoroquinolona vía oral para grampositivos. Si se trata de S. aureus, se recomienda añadir rifampicina oral y/o valorar otras opciones en el caso de SARM (linezolid, daptomicina, vancomicina). Si lo que se aísla es una P. aeruginosa, se debería asociar un segundo antibiótico oral o instaurar tratamiento con ceftazidima intraperitoneal, según el patrón local de sensibilidad. El tratamiento se mantendrá un mínimo de 2 semanas, aunque en ocasiones puede ser preciso prolongarlo 4-6 semanas. Si durante el tratamiento se valora profilaxis antifúngica, por el riesgo de selección de hongos, ésta podría realizarse con nistatina oral o fluconazol oral (Figura 2).
Figura 2. Aproximación al tratamiento de un paciente con infección de catéter peritoneal.
4. La infección fúngica (habitualmente Candida spp.) debe confirmarse descartando contaminación. Habitualmente, además del correspondiente tratamiento antifúngico, es necesaria la retirada del catéter para prevenir la progresión a una peritonitisbb0230, bb0235, bb0245.
5. Si permanecen los signos de infección durante 2 semanas, se deberá reevaluar y descartar la infección del tú nel. Si el manguito externo está expuesto, se realizará desbridamiento y se retirará. Se debe descartar la presencia de abscesos mediante ecografía, tomografía computarizada (TC) o con una gammagrafía con 67Ga-citrato. Si se descarta la infección del túnel, del manguito o la existencia de abscesos, se prolongará la antibioterapia 2 semanas más.
Tabla 5. Tratamiento oral de las infecciones del catéter de diálisis peritoneal 37,45
| Antibiótico | |
| Amoxicilina | 250-500 mg b.i.d. |
| Cefalexina | 500 mg b.i.d. |
| Ciprofloxacino | 250-500 mg b.i.d. |
| Claritromicina | 250-500 mg b.i.d. |
| Fluconazol | 200 mg q.d. |
| Flucloxacilina | 500 mg b.i.d. |
| Flucitosina | 2 g carga, después 1 g v.o., q.d. |
| Isoniazida | 300 mg q.d. |
| Linezolid | 600 mg b.i.d. |
| Metronidazol | 400 mg b.i.d. para < 50 kg |
| 400-500 mg t.i.d. para > 50 kg | |
| Ofloxacino | 400 mg 1.er día, luego 200 mg q.d. |
| Pirazinamida | 35 mg/kg q.d. (dado como b.i.d. o una vez al día) |
| Rifampicina | 450 mg q.d. < 50 kg |
| 600 mg q.d. > 50 kg | |
| Cotrimoxazol | 80/400 mg q.d. |
b.i.d.: dos veces al día; q.d.: cada día; t.i.d: tres veces al día; v.o.: por vía oral.
Se han descrito diversas técnicas para intentar rescatar el catéter infectado con resultados variados. Se utiliza el desbridamiento (quirúrgico) del tejido alrededor del catéter y manguito, y se considera la reimplantación parcial (retirar la porción del catéter infectada y reimplantar una nueva porción a veces con un extensor de titanio)49.
Si no se logra el control de la infección, es necesario retirar el catéter. Las indicaciones de retirada del catéter más frecuentes de describen en la Tabla 6bb0230, bb0245.
Tabla 6. Indicaciones de retirada del catéter de diálisis peritoneal 45,46
Infecciones del catéter
|
La reinserción del catéter debe plantearse mientras no existan datos clínicos de la curación del proceso. En los casos en los que el catéter se ha retirado con signos de inflamación peritoneal es recomendable hacer una evaluación previa del paciente para descartar la existencia de adherencias o compartimentalización de la cavidad abdominal.
Si se decide colocar un nuevo catéter, es aconsejable hacerlo mediante laparoscopia o cirugía para evitar posibles complicaciones durante su inserción y siempre descartando la presencia de peritonitis48.
En la infección recurrente debe confirmarse que se ha recibido un tratamiento adecuado y descartar una infección del túnel. Para su prevención se ha preconizado la utilización de mupirocina en el orificio de salida, rifampicina oral (5 días al mes cada 3 meses) u otros tratamientos tópicos como ciprofloxacina en solución ótica o solución de gentamicina (si la infección ha sido por bacilos gramnegativos)45.
PrevenciónLa prevención de la infección del catéter comienza desde la técnica de inserción y colocación del catéter con la debida asepsia, los procedimientos tras la colocación del catéter hasta que el orificio de salida esté bien curado (hay que evitar baño o ducha hasta 2 semanas después, lavado diario con jabón bacteriano antiséptico, etc.), aplicación de pomadas o crema de mupirocina en el orificio de salida, cremas de gentamicina, solución ótica de ciprofloxacino e incluso pautas de rifampicina oralbb0200, bb0235, bb0245.
Es importante saber si el paciente es portador nasal de S. aureus, y en ese caso, debemos tratarlo con mupirocina nasal, y repetir el tratamiento si fuera necesario hasta su desaparición. El tratamiento debe hacerse igualmente a los cuidadores que son portadores nasales. Actualmente, hay suficientes estudios que avalan la disminución de la incidencia de peritonitis por S. aureus al tratar a los portadores. No obstante, la existencia de S. aureus resistentes a mupirocina se está describiendo con mayor frecuencia. Otras pautas profilácticas dirigidas a P. aeruginosa y otras bacterias gramnegativas se han descrito en algunos trabajos recientes39.
Según algunos estudios, el tratamiento de la colonización del orificio de salida con diversos antibióticos (solución de gentamicina, diversas pomadas o gotas óticas de ciprofloxacino) disminuye el riesgo de infección del catéter peritoneal y de peritonitis. Sin embargo, otros no observan eficacia de protocolos terapéuticos en la prevención de la peritonitis. Además, el uso continuado de antibióticos a largo plazo puede inducir a la aparición de gérmenes resistentes e incluso la aparición de otros microorganismos menos frecuentes como Corynebacterium, recientemente considerados patógenos emergentes48. Schiffl et al50 han descrito una serie de 8 casos con 12 episodios de infección por Corynebacterium no difteroides en la que el 9% de todas las infecciones alcanzaron el orificio del catéter peritoneal.
En la actualidad, aunque se han conseguido importantes avances en la prevención de las infecciones del catéter peritoneal y de peritonitis, aún falta por determinar la profilaxis para el cuidado crónico del catéter41.
Recibido 17 Julio 2008
Aceptado 22 Julio 2008
Correspondencia: Dra. M.C. Fariñas. Unidad de Enfermedades Infecciosas. Hospital Universitario Marqués de Valdecilla. Avda. de Valdecilla, s/n. 39008 Santander. Cantabria. España. mirfac@humv.es