Introducción
El trasplante de progenitores hematopoyéticos (TPH), en sus dos modalidades alogénico (alo-TPH) y autólogo (TAPH), es una terapéutica ampliamente utilizada para el tratamiento de diversas hemopatías y tumores sólidos1. En España se realizan anualmente más de 2.000 TPH. Las complicaciones más graves de este procedimiento son la enfermedad injerto contra huésped (EICH), el rechazo del injerto y las infecciones. Con la finalidad de disminuir el riesgo de EICH, y con ello la morbilidad y mortalidad de los alo-TPH, se emplean potentes inmunosupresores y diversos métodos de depleción linfoide T (DLT) del inóculo2. Con el uso de progenitores hematopoyéticos en vez de médula ósea se ha conseguido una recuperación hematopoyética más rápida y los excelentes resultados obtenidos han permitido la realización de TPH en pacientes de mayor riesgo por su edad y fase de la enfermedad. Este hecho junto con el uso de agentes inmunosupresores cada vez más potentes y/o la depleción linfoide del inóculo, ha incrementado notablemente la ya de por sí elevada incidencia de complicaciones infecciosas que constituyen, hoy en día, la causa más importante de muerte en el TPH de donante no emparentado y de mortalidad precoz postrasplante en el auto-TPH3-4.
Factores predisponentes y patrones de infección
Pretrasplante
La mayor parte de los receptores ya están inmunodeprimidos antes de un TPH debido a la enfermedad de base y a los tratamientos recibidos. Por ello es de suma importancia la búsqueda exhaustiva de un foco infeccioso asintomático y la búsqueda de virus respiratorios en presencia de sintomatología de vías respiratorias altas y si se detecta dicho proceso, debe aplazarse el TPH hasta su resolución. La determinación de test serológicos previos al trasplante ayudará en la elección de la profilaxis que hay que seguir.
Postrasplante
El período de reconstitución inmunológica tras el TPH es muy variable y depende del tipo de trasplante, de la fuente de progenitores (sangre periférica o médula ósea), del régimen de acondicionamiento, del grado de histocompatibilidad entre donante y receptor, de la presencia de EICH y de su tratamiento5. Por ello, la incidencia de infecciones en el TAPH será mucho menor que en el alo-TPH. Mientras no esté reconstituida la función inmunitaria, el paciente se halla en un estado de inmunodeficiencia tanto celular (linfocitos T) como humoral (linfocitos B). Otros factores comunes a ambos tipos de trasplante como son la intensidad del régimen de acondicionamiento, la duración de la neutropenia, el grado de lesión de las barreras anatómicas, el estado serológico pre-TPH y el tipo de enfermedad de base aumentan también el riesgo de contraer infecciones.
La alteración en el número y función de los linfocitos T predispone a las infecciones virales. Esta alteración persiste durante 6 meses tras el alo-TPH y hasta 18 meses si se trata de un alo-TPH con DLT. En el TAPH la inmunidad celular se recupera a los 4-12 meses. Los niveles de inmunoglobulinas después de un TPH son también anormales. En el alo-TPH, la inmunoglobulina G (IgG) está disminuida durante 9 meses (18 meses si es un alo-TPH con DLT) si existe EICH crónica esta inmunodeficiencia se mantiene mientras persiste dicha complicación estando el paciente predispuesto a presentar infecciones por gérmenes encapsulados. El déficit persistente de inmunoglobulina A (IgA) aumenta la susceptibilidad a infecciones de las barreras mucosas (p. ej., sinusitis e infecciones intestinales). En el TAPH la hipogammaglobulinemia persiste durante 3-4 meses.
A partir del día del TPH (día 0), en función de los factores de riesgo antes mencionados, y de la recuperación inmunitaria se distinguen tres fases evolutivas en las que predominan determinados tipos de infección6 (tabla 1).
Período neutropénico. Días 0-30
La neutropenia es el principal factor de riesgo durante este período. El riesgo de infección aumenta con la severidad de la neutropenia (mayor si < 100 μl), la rapidez con que se produce y la duración de la misma. La duración media de la neutropenia (< 500 μl) después del TPH es de 2-3 semanas. Los patógenos más frecuentes en esta fase son las bacterias, Candida spp. y el virus del herpes simple (VHS). En pacientes con inmunodeficiencias previas (p. ej., anemia aplástica, inmunodeficiencia severa combinada) pueden observarse infecciones por Aspergillus spp. en los primeros 30 días post-TPH.
Período intermedio. Días 30-100
Es el período que sigue al implante medular, incluye el segundo y tercer mes post-TPH. La inmunodepresión y la EICH aguda son las responsables de las infecciones virales y fúngicas en esta etapa. Destacan por su frecuencia la infección por citomegalovirus (CMV), cistitis hemorrágica por adenovirus o virus BK, neumonía por Pneumocystis jiroveci y, finalmente, candidiasis diseminada y aspergilosis que aumentan de forma alarmante si el período de neutropenia ha sido prolongado.
Período tardío (>100 días post-TPH)
Después de los primeros 100 días, el riesgo de infección depende de la rapidez en completar la recuperación del sistema inmunitario, de la coexistencia o no de EICH crónica y de la intensidad de su tratamiento. Las infecciones tardías suelen ser secundarias a bacterias encapsuladas (Streptococcus pneumoniae y Haemophilus influenzae), Aspergillus, Pneumocystis jiroveci y virus varicela-zóster (VVZ).
Microorganismos responsables y manifestaciones clínicas
Bacterias
Patógenos bacterianos más comunes
Las infecciones bacterianas se presentan en el período inmediato postrasplante, suponen más del 90% de las infecciones observadas en la fase de neutropenia y en un 30% de los casos cursan con bacteriemia. Los gérmenes implicados son los mismos que se observan en pacientes neutropénicos por otras causas7,8. Al igual que en éstos, a lo largo de los últimos años se ha asistido a una disminución de las infecciones causadas por gramnegativos, y a un aumento de las originadas por grampositivos (68% de los casos)9; en particular estafilococos coagulasa-negativos cuyo origen se encuentra en el catéter y en el tracto digestivo de los pacientes. Estas infecciones presentan una escasa mortalidad (< 5%). Este cambio en la epidemiología de la infección se ha relacionado con las mucositis y aplasias más severas secundarias a protocolos de quimioterapia más agresivos, el empleo de sistemas de acceso venoso permanente y al uso de profilaxis antibiótica con fluorquinolonas. Las infecciones por Streptococcus viridans, muy frecuentes en muchos centros, cursan en un 10% de los casos con complicaciones graves asociándose a una elevada mortalidad10,11.
En los pacientes con neumonía, tanto en el período inicial como en fases tardías y sobre todo en aquéllos con EICH, debe pensarse en S. pneumoniae como una de las etiologías más frecuentes. En un reciente estudio12 la incidencia de enfermedad invasora en la fase precoz y tardía era 2,03 y 8,63/1.000, respectivamente.
Recientemente, sin embargo, se está observando de nuevo un incremento de infecciones producidas por gramnegativos que podría estar en relación con un cese en la profilaxis universal con quinolonas o por un aumento en la resistencia a las mismas13.
Las infecciones por gramnegativos (Escherichia coli, Klebsiella pneumoniae y Pseudomonas aeruginosa) más virulentos en su mayoría, sean bacteriémicas o no, son con mayor frecuencia graves y es por ello que la terapia antibiótica empírica debe siempre contemplarlas. Además, en algunas instituciones se ha constatado la emergencia de patógenos resistentes como gramnegativos productores de betalactamasas de espectro ampliado, infecciones por Stenotrophomonas maltophilia, etc., debido al uso de antibióticos de amplio espectro que producen la selección de cepas resistentes7. Este hecho hace que sean necesarios controles epidemiológicos que detecten la presencia de brotes en los diferentes centros y la adopción de métodos de control y política antibiótica. En ocasiones la presencia de lesiones cutáneas de ectima gangrenoso orienta hacia el diagnóstico precoz de la infección. En fases tardías del trasplante se observan infecciones por H. influenzae.
La tuberculosis, en España, es poco frecuente en el TPH (0,3%), la incidencia en el TAPH es la misma que en la población general y en el alo-TPH es de unas 3 a 10 veces más frecuente que en la población general (refs. 14, 15 y datos no publicados GETH).
Otras infecciones como las producidas por Listeria monocytogenes son menos frecuentes debido al papel profiláctico combinado que ejerce cotrimoxazol al ser utilizado para evitar la infección por P. jiroveci. Sin embargo debe ser considerada en el diagnóstico diferencial de una meningitis en el paciente sometido a un TPH. La infección producida por Nocardia spp. es también poco frecuente (0,3%) y aparece en postrasplante tardío predominando la afectación pulmonar en forma de nódulos, o infiltrados con o sin cavitación, para desde aquí diseminarse a cerebro o piel.
Hongos
La prevalencia de infección fúngica invasora demostrada en autopsias durante las últimas 2 décadas en estos enfermos oscila en torno al 25%7,16. Son factores predisponentes la inmunodepresión, la administración de antibióticos de amplio espectro, el uso de catéter venoso central (CVC) durante largos períodos de tiempo, la administración de nutrición parenteral, la desnutrición, la alteración de las barreras anatómicas (piel y mucosas), la neutropenia prolongada, la EICH y el alo-TPH17,18. Por todo ello, estas infecciones pueden suceder en cualquier período post-TPH. En el período precoz, la neutropenia es el principal factor de riesgo, en los otros períodos la infección fúngica está relacionada con la presencia de la EICH y su tratamiento. Los hongos aislados con mayor frecuencia son Candida spp.19,20 y Aspergillus spp.21,22. Otros hongos que aparecen con menos frecuencia son Fusarium, Scedosporium, mucorales y otros hongos emergentes en relación probablemente a la selección de especies producida con el uso de los nuevos antifúngicos23,24.
Candida spp.
Las infecciones por Candida spp., han disminuido como resultado del uso de antifúngicos en profilaxis en pacientes de alto riesgo17,20. Por otra parte, estas profilaxis y particularmente fluconazol, han originado un cambio en la epidemiología y cuando aparece una infección candidiásica es más frecuente que este producida por una Candida no albicans. Este hecho se constata también en España. RESITRA evaluó 1.318 TPH de forma prospectiva en 2 años (493 alogénicos y 825 autólogos) y se registraron 88 episodios de infección fúngica invasiva (IFI) (6,71%), 21 (23,8%) eran candidiasis siendo C. parapsilosis la especie más frecuentemente aislada (7 casos), seguida de C. krusei (5 casos), C. albicans (5 casos), C. glabrata y C. tropicalis (2 casos cada una) (datos pendientes de publicar-Abstract). El 71.4% de los pacientes habían recibido fluconazol como profilaxis y en el 75% de los casos la clínica fue de candidemia, relacionada con el catéter en un 45% de los pacientes. La mortalidad global fue de un 28,5% (6/21). Estos datos reflejan de forma precisa la realidad de esta infección en España (datos no publicados).
Aspergillus spp.
La infección por Aspergillus spp. tiene una incidencia en España del 8,3% en el alo-TPH y de un 1,2% en el TAPH (datos RESITRA) y se correlacionaba hasta hace muy poco con una mortalidad cercana al 100%, hecho que está empezando a cambiar debido a un diagnóstico más precoz de la enfermedad y al uso de los nuevos antifúngicos. La aparición de la infección sigue una distribución bimodal con un primer pico durante la fase de neutropenia y un segundo, cada vez más frecuente alrededor del día +100 en aquellos pacientes con EICH sometidos a tratamiento inmunosupresor19. En el estudio de RESITRA el 41% de los casos se presentaban en la fase neutropénica, un 46% en la fase postimplante hasta el día +180 y un 12% después de los 6 meses del trasplante. Además de los factores de riesgo antes descritos y comunes a todos los hongos, hay que añadir la exposición ambiental, ya que se trata de un organismo ubicuo en el medio (suelo, polvo). La mayoría de infecciones están producidas por A. fumigatus y A. flavus. La aspergilosis invasora con afectación pulmonar es la más frecuente pudiendo diseminarse al sistema nervioso central o a cualquier otro órgano en estos pacientes. Aunque un 25% de los pacientes están relativamente asintomáticos en el momento del diagnóstico, la clínica que presentan acostumbra a ser fiebre que no responde a los antibióticos de amplio espectro, dolor torácico, tos y expectoración hemoptoica ocasional. La disnea sugiere enfermedad difusa. La afectación sinusal se objetiva en un 15% de los casos.
Otros
Su incidencia es más baja (< 4% en RESITRA) y son casi exclusivos del alo-TPH. En la literatura médica, se están comunicando casos de infecciones por hongos emergentes (Zigomicetos, Fusarium, Scedosporium, etc.) que se atribuyen al uso de los nuevos azoles en profilaxis y a la selección de especies que éstos producen23,24. Clínicamente estas infecciones son difíciles de diferenciar de la infección aspergilar y es necesario el diagnóstico microbiológico para establecer, si es posible, el tratamiento correcto.
La neumonía por P. jiroveci es infrecuente debido a la profilaxis con cotrimoxazol pero puede aparecer en cualquier período postrasplante25,26.
Parásitos
La infección por parásitos es poco frecuente en el TPH, la incidencia de la infección por Toxoplasma gondii es muy baja debido a la profilaxis con cotrimoxazol, predomina en la fase postrasplante tardía y se asocia con una elevada mortalidad27.
Virus
Los virus, y en especial los herpesvirus, con frecuencia complican los TPH favorecidos por la fase de inmunodepresión postrasplante28,29.
Herpes virus
Como virus latente, su genoma viral permanece en la célula infectada durante toda la vida del individuo, con posibilidad de reactivarse y expresarse durante períodos de inmunodepresión. En los pacientes sometidos a TPH, puede producirse una proliferación celular incontrolada cuando los mecanismos de vigilancia inmunitaria normales están alterados. Dada la inefectividad de la inmunidad humoral en los virus asociados a células, el mecanismo de defensa más importante frente a estos agentes es la inmunidad celular, en concreto las células T citotóxicas específicas.
Virus herpes simple (VHS). Alrededor del 80% de los pacientes que reciben un TPH son seropositivos para el VHS pre-TPH. Las reinfecciones se observan en la segunda-tercera semanas post-TPH aunque también pueden observarse más tarde en períodos de intensa inmunodepresión. Antes de la introducción del aciclovir, como profilaxis, el 70% de los pacientes desarrollaban infección. La manifestación más frecuente es la gingivoestomatitis, la esofagitis ha desaparecido prácticamente con el uso de la profilaxis y la neumonitis y encefalitis son raras30.
Citomegalovirus (CMV). Aparece en el 70-80% de los receptores, aunque con una incidencia variable dependiendo de los factores de riesgo asociados. Su infección ocurre entre el implante y el día +120. En el trasplante alogénico la infección puede producirse por la transmisión del virus de un inóculo de un donante seropositivo a un receptor seronegativo, por productos sanguíneos y, en la mayoría de los casos, por reactivación de un virus latente en el receptor. Otro factor de gran importancia para la infección por CMV es el tipo de inmunodepresión31. Los esteroides tienen un efecto mínimo en la reactivación viral. La ciclosporina A y el FK506 aunque con papel escaso en la reactivación viral, pueden perpetuar la replicación después de que se haya producido reactivación. Tanto la globulina antitimocítica como el OKT3 inducen la reactivación viral debido a la marcada disminución de la inmunidad celular al eliminar los linfocitos T circulantes. Finalmente, la irradiación corporal total y la presencia de EICH aguda pueden favorecer la reactivación del CMV.
Las consecuencias de una primoinfección o reactivación pueden ir desde una infección asintomática a una afectación multiorgánica muy severa asociada a una elevada mortalidad. Además, el CMV es un virus inmunomodulador y provoca una inversión del cociente CD4/CD8 y, en segundo lugar, puede producir leucopenia. Todo ello condiciona la superinfección por bacterias oportunistas y hongos. Excepcionalmente el CMV puede provocar el rechazo del injerto30.
Virus varicela-zóster (VVZ). Sin profilaxis afecta al 40% de los TPH y, si no se trata, cuando existe afectación orgánica, presenta una elevada mortalidad. Más del 85% aparecen durante el primer año (entre los 2 y 10 meses). Los factores de riesgo más importantes son la EICH aguda y crónica32.
Virus herpes humano 6 (VHH-6). Se ha asociado a varias complicaciones (exantema, EICH, neumonitis, sinusitis, encefalitis, fiebre, retraso o supresión del injerto medular). La coincidencia de actividad viral sin otra causa etiológica sugiere el papel etiológico del VHH-6 en estos pacientes30. Alrededor del 30-40% desarrollan viremia en entre la segunda y cuarta semanas del trasplante considerándose que predomina la reactivación asintomática. Este virus presenta un gran neurotropismo y podría ser la causa más importante de meningoencefalitis en el alo-TPH33,34.
Enterovirus
Adenovirus. Su incidencia oscila entre el 5-40% de los TPH, siendo más frecuente en niños y conlleva una mortalidad del 60%. Habitualmente aparece a los 2-3 meses del TPH pero puede ocurrir más tarde, sobre todo si existe EICH crónica. En el 20% de los pacientes infectados se presenta como una enfermedad diseminada.
Coxsackie y rotavirus. Ambos causan diarrea y pueden contribuir a la mortalidad en estos pacientes. El virus coxsackie puede transmitirse por vía respiratoria o fecal/oral y puede causar erupción, síntomas respiratorios y diarrea.
Virus respiratorios (virus respiratorio sincitial [VRS], parainfluenza e influenza)
Estos virus pueden afectar a los pacientes sometidos a TPH con una frecuencia y período de aparición que coincide con el mismo patrón observado en la comunidad y que puede variar de año en año. Los síntomas más comunes son los debidos a una afección de vías respiratorias altas aunque también pueden causar neumonías y presentan entonces una elevada mortalidad35,36.
Virus de Epstein-Barr (VEB)
Es un virus extremadamente común, el 90% de la población adulta ha estado en contacto con él37. El virus latente en los linfocitos B se reactiva durante los períodos de inmunodepresión. En estos pacientes, los linfocitos T citotóxicos específicos contra el VEB no son capaces de controlar al virus, produciéndose una proliferación linfoide B policlonal y con menos frecuencia monoclonal. Los linfocitos afectados pueden ser tanto del donante como del receptor. Los síndromes linfoproliferativos asociados al VEB ocurren en el 0,5% de los TPH alogénicos. Son factores de riesgo para su aparición la depleción linfoide T, el uso de ATG o anticuerpos anti-CD3 y la disparidad HLA. La mayor parte de los casos se desarrollan alrededor del día 70 post-TPH aunque no son infrecuentes formas agresivas precoces (45 días post-TPH) o muy tardíos (años después del TPH) con un curso más indolente con febrícula y adenopatías30,37.
Diagnóstico
El diagnóstico de infección en el TPH no es siempre fácil. En primer lugar, la complejidad y estado crítico del paciente dificulta la realización de pruebas diagnósticas invasivas. En segundo lugar, muchas infecciones están causadas por microorganismos de difícil diagnóstico y finalmente, en un porcentaje no desdeñable de casos (30-40%) el episodio febril no se debe a una infección. Por todo ello, el diagnóstico de infección en estos pacientes exige un elevado índice de sospecha, ya que su evolución puede ser rápidamente fatal si no se instaura un tratamiento adecuado38,39.
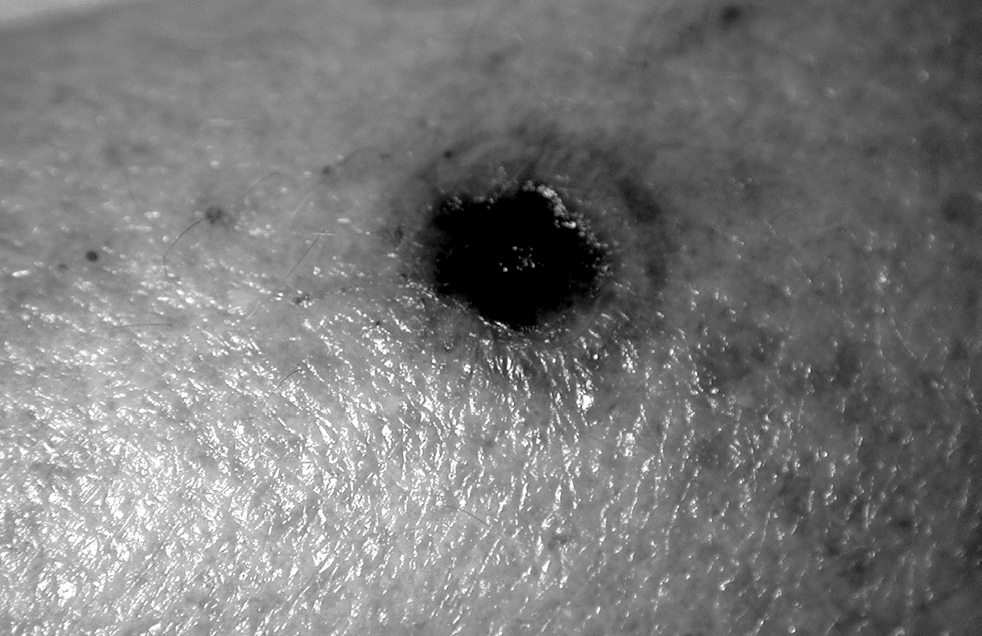
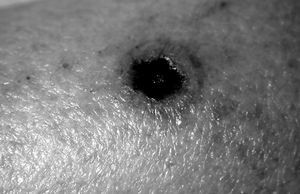
Así pues, la aparición de fiebre es el síntoma más precoz y a menudo el único indicador de infección. El dolor es el síntoma de inflamación más constante. La aparición de lesiones cutáneas (fig. 1), el dolor, la hipotensión, la hipoperfusión tisular, la hiperventilación o la alcalosis metabólica deben sugerir la existencia de una infección. En la práctica, ante cualquier empeoramiento clínico del estado de un paciente, sin etiología que lo justifique, debe descartarse la posibilidad de una infección.
Figura 1. Lesión cutánea perteneciente a un paciente neutropénico con una infección diseminada por Fusarium spp.
En la exploración física es importante examinar las zonas corporales subsidiarias de infectarse con frecuencia como piel y uñas, cavidad oral, orofaringe y senos paranasales, pulmón, abdomen, región perianal, salidas de vías venosas y catéteres, heridas quirúrgicas y áreas de biopsia, exploración neurológica.
La evaluación inicial debe incluir al menos dos tandas de hemocultivos así como muestras para tinción de Gram y cultivo si existe inflamación o supuración de los orificios de entrada de los catéteres. La práctica de cultivos cuantitativos de las luces del catéter y de una vena periférica ayuda a distinguir el origen de la infección. Si en la luz del catéter existen cinco veces más unidades formadoras de colonias que en la luz periférica, el origen de la infección reside en el catéter. Las zonas de celulitis y las lesiones cutáneas sospechosas de infección deben ser aspiradas o biopsiadas. Se cultivarán secreciones siempre que exista focalidad: esputo, coprocultivo y toxina de Clostridium difficile si diarreas, orina si disuria, líquido cefalorraquídeo (LCR) si afectación del sistema nervioso central (SNC), etc. En muchas ocasiones, el lavado broncoalveolar (LBA) o la biopsia transbronquial, constituyen el mejor método diagnóstico en las infecciones pulmonares. En la tabla 2 se indican las infecciones más frecuentes de acuerdo con la localización y el método diagnóstico más eficaz para su diagnóstico.
No está demostrada la utilidad de los cultivos de vigilancia post-TPH por lo que su práctica no es aconsejada.
El diagnóstico de infección fúngica puede obtenerse a partir del aislamiento del organismo, la detección serológica del anticuerpo (anticuerpos antimicelio para Candida spp.) o antígeno (galactomanano para Aspergillus spp.) o la evidencia histopatológica de invasión. En la actualidad, la determinación de galactomanano de forma bisemanal constituye una herramienta útil en el diagnóstico de esta infección40 aunque debe considerarse que con la utilización de los nuevos azoles en profilaxis puede disminuir la sensibilidad de la técnica41. Existen nuevas técnicas en marcha (β -glucano, reacción en cadena de la polimerasa [PCR] a tiempo real), algunas de ellas en fase de validación, que sin duda ayudarán a establecer un diagnóstico más precoz de la infección.
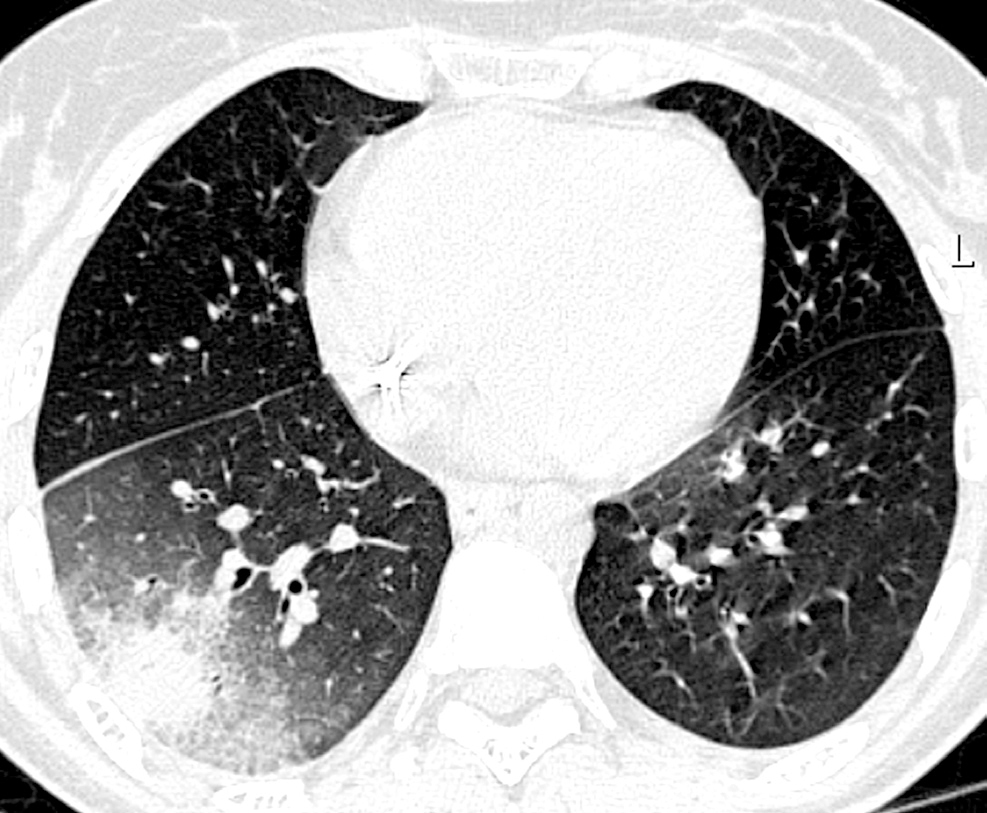
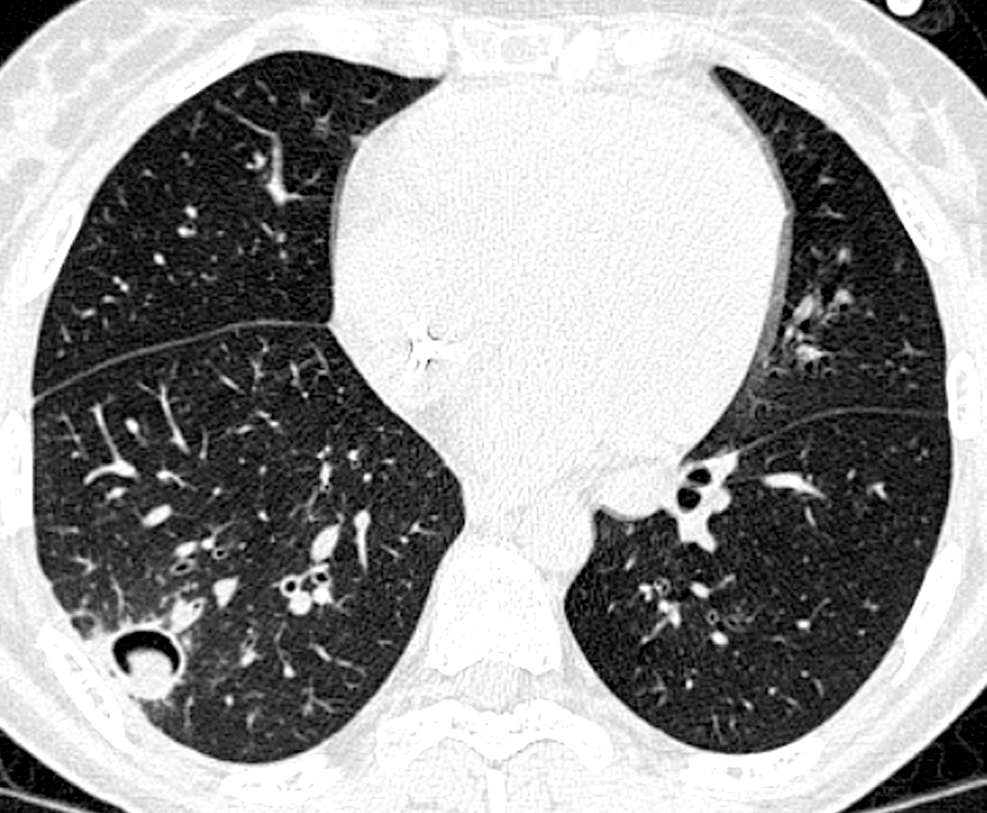
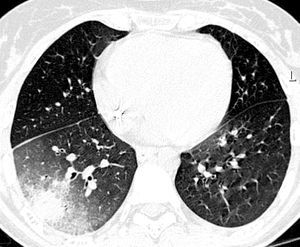
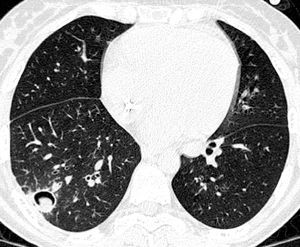
Dentro de las pruebas no invasivas, la tomografía computarizada de alta resolución (TCAR) se ha convertido en un elemento indispensable para establecer un diagnóstico precoz de IFI42-44. Ésta presenta una cinética característica a lo largo del proceso. En el momento del diagnóstico, fase precoz de la infección, el "signo del halo" es el hallazgo más frecuente y se corresponde con una zona de edema o hemorragia de baja atenuación alrededor de una masa o nódulo (figs. 2 y 3). Más adelante, las lesiones se cavitan, aparece aire en su interior y toman aspecto de semiluna42,43.
Figura 2. Signo del halo en aspergilosis invasora.
Figura 3. Signo de la semiluna.
Las aproximaciones diagnósticas para las infecciones virales incluyen tests serológicos, cultivos, y examen histológico de tejidos. Las técnicas más útiles para la detección precoz de la viremia por CMV son la monitorización seriada de la infección postrasplante mediante la detección del antígeno pp65 del CMV en neutrófilos (antigenemia) o detección del ARN o ADN viral en sangre de forma bisemanal hasta la reconstitución inmunitaria y posteriormente semanal o quincenal30,39.
Medidas preventivas
Profilaxis antibacteriana
La mejor medida preventiva es el lavado de las manos, la piel y la higiene oral. La profilaxis de las infecciones exógenas se consigue con dietas de bajo contenido bacteriano. La profilaxis con quinolonas ha demostrado beneficio en las neutropenias prolongadas45. Otra posibilidad, es además, administrar metronidazol a dosis de 250 mg/8 h46 al haberse observado una disminución en la incidencia de EICH. La profilaxis con trimetoprima-sulfametoxazol (2 días a la semana) o con pentamidina inhalada en la fase de pancitopenia o en caso de intolerancia durante todo el período de inmunodepresión, evita la infección por P. jiroveci. La presencia de granulomas en la radiografía de tórax o un derivado proteico purificado (PPD) positivo pre-TPH aconseja el empleo de isoniazida durante el período de inmunodepresión.
Profilaxis antifúngica
En cuanto a las medidas ambientales estos pacientes deben estar en habitaciones con filtros de alta eficacia de partículas aéreas (HEPA) que dejan pasar menos de 3 por 10.000 partículas atmosféricas de 0,3 micras de diámetro. Ello es suficiente para que no existan bacterias ni esporas de hongos en el aire constituyendo el método más eficaz de prevención de la infección por Aspergillus spp.
En los pacientes sometidos a un trasplante autólogo no se aconseja la profilaxis antifúngica sistémica de forma universal y en el trasplante alogénico los fármacos con aprobación para su uso con fluconazol e itraconazol. Recientemente posaconazol ha sido aprobado para profilaxis en los pacientes con EICH en tratamiento inmunosupresor47.
Profilaxis antiviral
En pacientes seropositivos para VHS, debe administrarse aciclovir hasta el momento del implante o la recuperación de la mucositis. En lo referente a CMV, en los pacientes seronegativos todo el soporte transfusional debe ser filtrado con filtros de alta eficacia con la finalidad de desleucocitar y deben tomarse medidas para evitar el contagio tales como no compartir vasos, platos ni cubiertos, utilizar preservativos, etc. Si el paciente es seropositivo para CMV, debe escogerse entre hacer profilaxis con ganciclovir o una estrategia de vigilancia de reactivación con la práctica de antigenemia o PCR en sangre, y en caso de positividad iniciar un tratamiento anticipado de la infección con ganciclovir o foscarnet. Esta última estrategia está mucho más extendida.
Inmunoglobulinas
Únicamente está indicada su administración en casos de hipogammaglobulinemia con infecciones de repetición.
Inmunización activa
Se recomienda la reinmunización de todos los pacientes siguiendo el calendario vacunacional establecido (tabla 3)48.
Tratamiento
Período neutropénico
El tratamiento inicial de un paciente neutropénico (neutrófilos < 500/l) con fiebre (> 38 °C) o con sospecha clínica de infección sin focalidad infecciosa, consiste en una cobertura empírica con antibióticos de amplio espectro39,49,50. En la actualidad se opta por la monoterapia con un betalactámico con actividad antipseudomónica (cefepima, piperacilina-tazobactam) o carbapenem (imipenem o meropenem). Se asociará un aminoglucósido si el paciente presenta un shock séptico con trastorno hemodinámico, o si hay antecedentes de infecciones previas por P. aeruginosa o Acinetobacter baumanii o microorganismos multirresistentes, y en pacientes que han recibido betalactámicos los días previos al trasplante. El uso de glicopéptidos puede retrasase hasta documentar una infección por grampositivos a no ser que exista focalidad clínica sugestiva de infección estafilocócica, signos inflamatorios en puerta de entrada del catéter, y/o shock con infiltrados pulmonares.
Si la fiebre persiste tras 5 días de tratamiento antibacteriano y los cultivos son negativos se inicia tratamiento antifúngico empírico con caspofungina o anfotericina B liposomal. Sin embargo y con las nuevas técnicas diagnósticas se tiende a abandonar el empirismo y a hacer un tratamiento más dirigido a anticipado de la infección. En caso de infección fúngica demostrada se añadirá el antifúngico indicado en cada caso.
Los antibióticos deben suspenderse cuando el paciente alcance más de 500 neutrófilos o bien si el paciente está afebril y estable durante 5-7 días de tratamiento aunque persista la neutropenia. En pacientes con infecciones graves durante este período, el empleo de factores estimulantes de colonias granulocitarias (G-CSF) puede ayudar al control de la infección.
Período intermedio
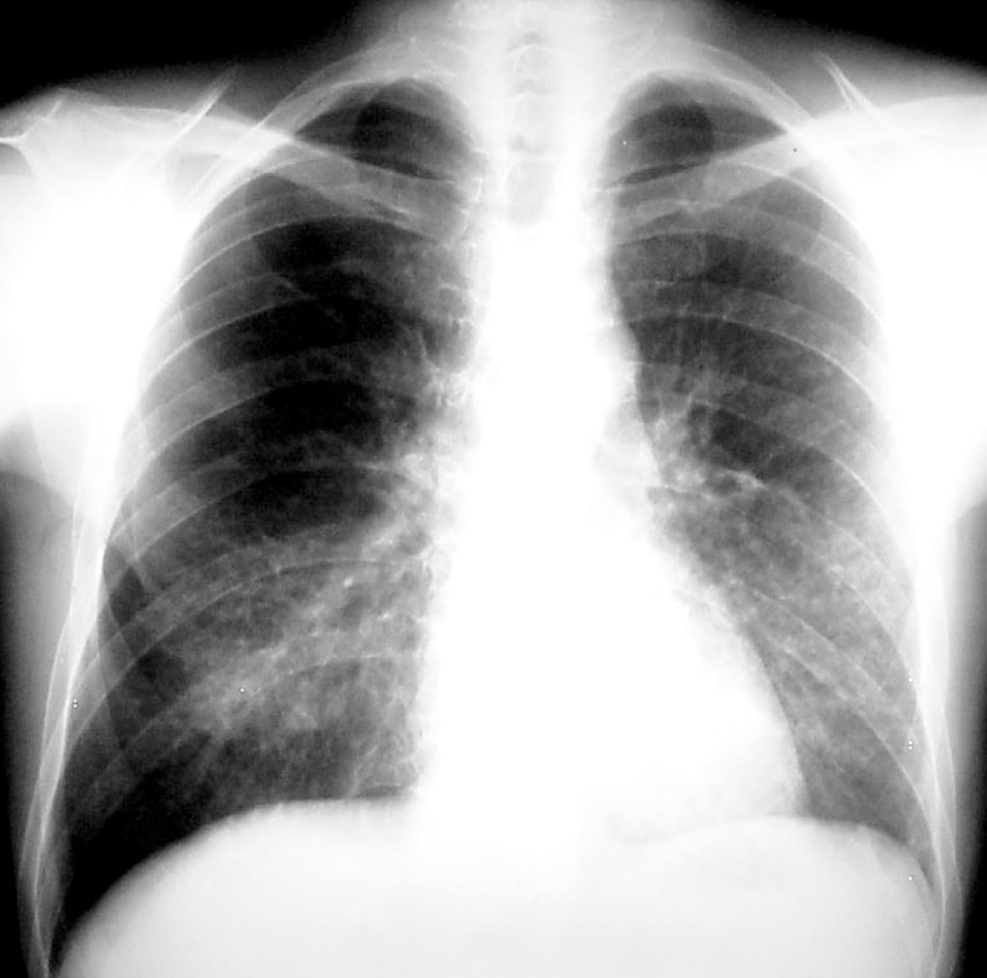
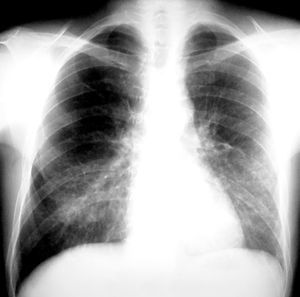
En este período el microorganismo más importante es el CMV. Por ello debe hacerse énfasis en las medidas profilácticas anteriormente descritas. El tratamiento preventivo ha sido uno de los grandes avances en este campo y consiste en el tratamiento de la infección, detectada por antigenemia o PCR en sangre o en LBA, con ganciclovir o foscarnet antes de que aparezca enfermedad. Si se desarrolla una neumonía intersticial por CMV (fig. 4) el tratamiento con ganciclovir asociado a inmunoglobulinas permitirá su control en el 30-50% de los casos. También en este período aparecen infecciones fúngicas. Aunque no es objetivo de esta monografía el extenderse en el tratamiento de estas infecciones, únicamente señalar que el tratamiento inicial de la aspergilosis invasora es voriconazol y el de la candidiasis puede ser caspofungina o anfotericina B (o sus formulaciones) y una vez conocida la especie, si es sensible a fluconazol se puede continuar con dicho agente.
Figura 4. Neumonía intersticial por CMV.
Período tardío
La terapia antibiótica supresiva crónica con cotrimoxazol y/o penicilina oral, de dudosa eficacia no controlada, facilita la emergencia de bacterias resistentes. No obstante, esta estrategia puede considerarse en algún enfermo de alto riesgo con infecciones recurrentes. Los pacientes que están esplenectomizados y con infecciones de repetición son los que más pueden beneficiarse de esta profilaxis.
Correspondencia: Dra. I. Ruiz Camps.
Servicio de Enfermedades Infecciosas. Hospital Vall d'Hebron.
P.º Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: iruiz@vhebron.net
Artículo recibido el 4-5-2007; aceptado el 16-5-2007.