Introducción
La correcta evaluación pretrasplante de los donantes potenciales es esencial en el trasplante de órgano sólido. Los objetivos del cribado en enfermedades infecciosas son varios; por un lado, identificar la presencia de microorganismos transmisibles que desaconsejen el uso de órganos; por otro, diagnosticar y tratar las infecciones activas pretrasplante y, finalmente, definir los niveles de riesgo para determinadas patologías infecciosas con el fin de poder determinar las mejores estrategias preventivas en el período postrasplante. A pesar del consenso que existe para proceder al cribado de determinadas infecciones, el tipo de pruebas realizadas y la repercusión de las mismas sobre la estrategia que hay que seguir en el período postrasplante varía en cada centro. Diferentes sociedades e instituciones han elaborado guías referentes al cribado pretrasplante y a las actuaciones derivadas del mismo 1-5.
En este capítulo revisaremos la información relacionada con las medidas de cribado encaminadas a minimizar la transmisión de la infección del donante al receptor de un trasplante de órgano sólido. Así mismo realizaremos unas consideraciones iniciales diferenciales entre el donante vivo y el de cadáver y el donante inmigrante o procedente de viajes de zonas con procesos infecciosos autóctonos.
Donante vivo frente al donante cadáver
La diferencia principal radica en el período de tiempo que disponemos para actuar en el caso de detectar una infección. En el donante vivo se puede tratar la infección activa y diferir el trasplante hasta su resolución. El cribado de la infección se realiza en el mismo centro y se procede al seguimiento clínico desde la inclusión en el programa de trasplante hasta la realización del mismo. El cribado debe incluir la historia clínica detallada y la exploración física minuciosa, así como los estudios serológicos (tabla 1) y radiológicos necesarios. La historia clínica incluirá datos sobre las infecciones pasadas, vacunas administradas, viajes realizados y la práctica de conductas de riesgo (adicción a drogas por vía parenteral [ADVP], relaciones sexuales).
Sin embargo, en el donante cadáver sólo dispondremos de horas para la evaluación pretrasplante. En ese período el laboratorio debe generar la información suficiente para determinar la idoneidad del potencial donante. Dado este corto espacio de tiempo, existe la posibilidad de que ciertas infecciones se hallen en un estadio precoz o período ventana, previo a la generación de anticuerpos 6; ello convierte en esencial la identificación, a través de la historia clínica, de los posibles riesgos que no se reflejen en los estudios serológicos. Además, algunas infecciones como, por ejemplo, la bacteriemia, se diagnosticarán con posterioridad al trasplante 7. En el futuro, las técnicas de diagnóstico molecular tendrán la capacidad de detectar en un breve período de tiempo ciertas infecciones. Pero, actualmente y excepto en los casos que se comentarán más adelante, no debe recomendarse la toma de decisiones basadas en los resultados obtenidos con las actuales técnicas en biología molecular.
Ello se fundamenta en su falta de homologación para el uso diagnóstico, el desconocimiento de su rendimiento sobre muestras de donantes de órganos en términos tanto de sensibilidad como de especificidad y en la complejidad intrínseca de las mismas que las hace difícilmente adaptables a las situaciones de urgencia y no permite asegurar un adecuado y uniforme nivel de calidad.Donante inmigrante o procedente de viajes tropicales
El fenómeno de la inmigración ha presentado un importante auge en nuestro país en los últimos años. Actualmente las personas inmigrantes constituyen alrededor del 5% de la población si bien en determinadas zonas pueden llegar a ser el 15 o 20%. Este grupo de población puede presentar una serie de enfermedades no incluidas en el cribado habitual de las enfermedades infecciosas transmisibles. Como concepto, ante todo donante extranjero o autóctono pero que haya viajado al extranjero en los últimos 5 años se deberá realizar la evaluación de las infecciones endémicas en la región de procedencia (tabla 1). En los apartados correspondientes de este artículo se revisan las infecciones transmisibles prevalentes en otras zonas geográficas.
Infecciones bacterianas
En el donante vivo las infecciones del tracto respiratorio, urinario o de otras localizaciones deben ser tratadas correctamente y su resolución debe ser documentada antes de proceder al trasplante. Es obligado tener una precaución especial en los donantes renales potenciales con la infección del tracto urinario para asegurarse que la misma no es representativa de una infección oculta parenquimatosa. La sífilis puede estar latente o ser asintomática y precisa de tratamiento si el intervalo al trasplante lo permite. Sin embargo, su transmisión al receptor es muy rara y no significa una contraindicación para la donación si el receptor recibe tratamiento con penicilina benzatina 8.
El donante cadáver suele estar ubicado en unidades de cuidados intensivos o similares donde si la estancia se prolonga la incidencia de infección puede llegar a ser del 40% (predominantemente pulmonar o relacionada con los catéteres). Por ello debe ser cuidadosamente evaluado mediante una revisión de la historia clínica y una exploración física exhaustiva, radiología y cultivos. Los donantes que presenten una probable infección bacteriana con inestabilidad hemodinámica, disfunción multiorgánica o mala respuesta al tratamiento antibiótico durante 48 h no se seleccionaron para el trasplante. En caso contrario, los órganos que no se consideren directamente infectados podrán ser utilizados con la condición de completar en el receptor el tratamiento antibiótico iniciado en el donante.
Sería deseable obtener siempre hemocultivos de los donantes potenciales ya que la incidencia de bacteriemia oculta se cifra en un 5%, independientemente de la clínica que presenten 9. En estos casos existe el riesgo de que el receptor sufra una sepsis si la profilaxis antibiótica del procedimiento quirúrgico no se ajusta a la sensibilidad del microorganismo implicado. Además cabe la posibilidad, documentada en la literatura especializada, de desarrollar aneurismas micóticos en las anastomosis vasculares, especialmente por microorganismos virulentos como Staphylococcus aureus o Pseudomonas aeruginosa 10. Si bien se han publicado estudios que demuestran ausencia de transmisión de la infección en casos de bacteriemia en el donante cuando el receptor recibe tratamiento antibiótico adecuado por una media de 3,8 días tras el trasplante 9, quizá sería prudente alargar el tratamiento al menos durante una semana.
Por lo general, no existe suficiente evidencia para recomendar la realización de tratamiento antibiótico al receptor de un órgano proveniente de un donante cadáver con una infección no bacteriémica, localizada, que no afecta el órgano que hay que trasplantar, con la excepción de la meningitis. De donantes con meningitis bacteriana se han realizado trasplantes sin complicaciones siempre que han recibido tratamiento antibiótico adecuado tanto el donante como el receptor 11.
La colonización pulmonar del donante de trasplante de pulmón merece una atención especial. Este es un hecho muy frecuente ya que los órganos están en contacto directo con el entorno. Un estudio realizado en el Hospital Vall d'Hebron cifró la tasa de infección del donante en el 52% 12. La broncoscopia al donante, en el momento del trasplante, nos permitirá conocer la flora implicada en caso de colonización y así poder dirigir la terapia antibiótica de forma selectiva frente a los microorganismos aislados. Con ello conseguiremos prevenir la infección invasora en el receptor 12. A pesar de ello se aconseja no utilizar los pulmones colonizados por bacterias multirresistentes como P. aeruginosa, Alcalygenes spp., S. aureus meticilín resistente u hongos filamentosos como Aspergillus spp.
Finalmente se puede producir la contaminación del órgano durante el procedimiento de extracción y manipulación. Algunos autores recomiendan la administración de antibióticos al receptor si se aíslan microorganismos en el líquido de perfusión dado el riesgo previamente descrito de aneurismas micóticos. La duración sería de 14 días para los microorganismos más virulentos como S. aureus, bacilos gramnegativos o Candida spp. Para otros microorganismos el tratamiento podría ser de menor duración. Sin embargo existe un estudio que no pudo relacionar la positividad de los cultivos de aurícula izquierda o del líquido de preservación y la infección posterior en el trasplante de corazón, aunque algunos pacientes recibieron terapia antibiótica específicamente dirigida 13.
Recientemente (años 2004-2005) se realizó un estudio en el seno de RESITRA (Red Estudio Infección en el Trasplante) con el objetivo de conocer la epidemiología de la transmisión de la infección del donante al receptor. El 10% de los 3.300 trasplantes de órgano sólido realizados procedían de un donante infectado: neumonía, meningitis, bacteriemia, pielonefritis o infección del líquido de preservación fueron los diagnósticos más comunes. Sin embargo, la tasa de transmisión fue únicamente del 1,7%. Como conclusión, probablemente cualquier paciente con una infección tratable debe ser considerado como un donante potencial 14.
Infecciones micobacterianas
La transmisión de Mycobacterium tuberculosis en el trasplante de órgano sólido está bien documentada; la enfermedad se inicia en el órgano trasplantado desde donde se disemina posteriormente. De hecho en una revisión de 511 pacientes con tuberculosis postrasplante el 4% se consideraron de transmisión a través del donante 15. En el potencial donante vivo se debe practicar una intradermorreacción de Mantoux (derivado proteico purificado [PPD]), y en caso de ser positiva, debe descartarse la existencia de enfermedad activa. Una radiografía de tórax o la presencia de síntomas sugestivos de enfermedad activa deben conllevar la realización de cultivos de esputo. En el caso de donante vivo renal se deben practicar urocultivos para micobacterias. En la actualidad el diagnóstico por técnicas moleculares podría ser de gran ayuda para identificar los donantes potenciales con enfermedad activa ya que si bien, en el donante cadáver la realización de la intradermorreacción de Mantoux no llega a ofrecernos información, el mero hecho de sospechar infección activa por M. tuberculosis imposibilita la donación.
Los donantes con un PPD positivo pero que no han recibido profilaxis ni tratamiento y sin evidencia de enfermedad activa se consideran adecuados. Sin embargo, algunos autores lo considerarían indicación para la realización de profilaxis con isoniazida en el receptor. Esta decisión viene apoyada por el bajo de riesgo de hepatotoxicidad de la isoniazida especialmente en los trasplantes no hepáticos 15.
El paciente con tuberculosis localizada (pulmonar) que haya recibido más de 3 meses de tratamiento (documentado y correcto), puede ser donante de órganos (excepto el pulmón) y continuar con el tratamiento antituberculoso en el receptor. Ahora bien, la tuberculosis miliar es una contraindicación absoluta para la utilización de cualquier órgano. A pesar de ello, en el estudio ya mencionado de RESITRA, se recogió la realización de dos implantes renales procedentes de un donante en el que el estudio autópsico demostró la existencia de tuberculosis miliar. En ambos se procedió a la realización de tratamiento antituberculoso sin observarse infección activa ni disfunción del injerto en el seguimiento 14.
Infecciones fúngicas
Cualquier tipo de enfermedad fúngica invasora en el donante es una contraindicación formal para el trasplante. En este contexto se incluyen, por ejemplo, el donante fallecido por meningitis criptocócica (Cryptococccus neoformans), a pesar de no haberse comunicado ningún caso de transmisión, la candidemia o las infecciones por hongos filamentosos como Aspergillus spp. o la mucormicosis.
Por otra parte, se debe tener en cuenta que algunas micosis endémicas (p. ej., las causadas por hongos dimórficos) pueden presentarse de forma silente. Así, la transmisión de Histoplasma capsulatum, endémico en Estados Unidos (valle del Missisippi) y Latinoamérica (México, Panamá, Guatemala, Venezuela) está referida en la literatura médica 16, si bien la mayoría de los casos obedece a la reactivación de la enfermedad silente en el receptor. También existen casos descritos de transmisión de Coccidioides immitis 17, que se distribuye por el sur de Estados Unidos, México, Centroamérica (Guatemala, Honduras, Nicaragua) y América del Sur (Argentina, Paraguay, Venezuela y Colombia).
El cribado de las micosis en los donantes nacidos o residentes en zonas endémicas se puede realizar de forma diferida ya que la positividad del mismo no contraindicaría el trasplante. Sin embargo, los receptores de un órgano procedente de un donante seropositivo deben someterse a un seguimiento clínico estrecho por la posibilidad de reactivación. En el caso de trasplante pulmonar de donante positivo para C. immitis se debe valorar la administración de azoles, posterior al procedimiento, con una duración de 7 a 10 días.
Infecciones parasitarias
Los receptores de un trasplante cardíaco seronegativos para Toxoplasma spp. se consideran de alto riesgo para el desarrollo de miocarditis (> 50%) si reciben el órgano de un donante seropositivo 18 debido a la predilección del parásito por el tejido muscular. El curso clínico de la primoinfección puede ser fulminante con una elevada mortalidad sin el tratamiento adecuado. También se ha comunicado la transmisión ocasional en sujetos trasplantados hepáticos y renales 19. Por lo tanto el conocimiento de la serología previa al trasplante cardíaco, si bien no contraindica el mismo, permite la adopción de las medidas preventivas oportunas que, en este caso, sería la administración de trimetoprima-sulfametoxazol. Sin embargo, este cribado no se realiza de forma rutinaria en los otros tipos de trasplante de órgano sólido en los que la administración de cotrimoxazol es una constante 20.
Aunque se desconoce el riesgo real de transmisión de Echinococcus granulosus, ante un donante potencial con historia clínica previa sugestiva de hidatidosis o una imagen hepática radiológica sugestiva se debe realizar una tomografía computarizada (TC) toracoabdominal con la finalidad de descartar imágenes quísticas compatibles en localizaciones extrahepáticas. En este caso los órganos afectados no pueden ser utilizados.
La transmisión de la enfermedad de Chagas (Trypanosoma cruzi) es un problema importante en las zonas donde la enfermedad es endémica (norte de México, América central y cono sur: Brasil, Bolivia, Paraguay, Argentina, Chile, Uruguay). Aproximadamente el 30% de los pacientes infectados desarrollan la enfermedad bien en forma de miocarditis o de meningoencefalitis. Su transmisión al receptor está bien documentada en la literatura médica 21. El cribado es obligado a todo donante nacido o residente en una zona endémica ya que la infección aguda contraindica cualquier tipo de donación. El diagnóstico se realiza mediante la visión del parásito en un frotis de sangre periférica o la positividad de un hemocultivo. La infección crónica contraindica el trasplante de corazón. Una serología por inmunofluorescencia a título superior a 1/40 se debe considerar significativa. En los casos de trasplante renal en los que se han utilizado donantes con infección crónica en receptores seronegativos, se ha observado una tasa de transmisión del 35% y la aparición de enfermedad aguda hasta 14 meses tras el procedimiento. La mayoría se curaron tras la administración de benznidazol 22.
El paludismo (Plasmodium spp.) también se puede transmitir al receptor 23. Su distribución geográfica depende de la especie. Así P. falciparum es endémico en África subsahariana, sureste asiático, subcontinente indio, Sudamérica, Haití, República Dominicana y Oceanía, P. malariae y P. ovale lo son de África subsahariana y P. vivax del sudeste asiático y subcontinente indio. Todo posible donante inmigrante o viajero de zona endémica en los últimos 5 años se deberá someter a cribado mediante frotis y gota gruesa de sangre periférica. También se puede emplear la detección de antígeno por inmunocromatografía. La parasitación del donante no desestima el trasplante aunque obliga a iniciar tratamiento precoz tanto en el donante como en el receptor. De todas formas se debe asumir que la toxicidad renal, hematológica o hepática del tratamiento antipalúdico puede incrementar el riesgo de una mala evolución del injerto aunque se consiga controlar la infección. Finalmente, el paciente fallecido en relación a la parasitación se rechazará para la donación.
Los casos diagnosticados de enfermedad de Kala-Azar en receptores de trasplante de órgano sólido se deben a reactivaciones o primoinfecciones. No se han comunicado casos de transmisión desde el donante. Leishmania spp. es endémica del sur de Europa, subcontinente indio, cuenca del Amazonas, Etiopía y Sudán. Se procederá a determinar la serología en residentes de zonas endémicas y en caso positivo se seguirá de forma estrecha al receptor dada la posibilidad de reactivación.
No se ha comunicado transmisión de Entamoeba histolytica de donante a receptor. De todas formas en el trasplante hepático y, especialmente, en el intestinal se recomienda examen de heces y serología en caso de donante residente en zona endémica (América Central y del Sur, África y subcontinente indio).
Strongyloides spp. es endémico del sudeste de Asia, África subsahariana, Brasil y sur de Estados Unidos. En España se encuentra en la comarca de La Sabor en Valencia. Es un nematodo con capacidad de transmisión al receptor. Por lo tanto se debe realizar examen de heces y serología a todo donante procedente de área endémica.
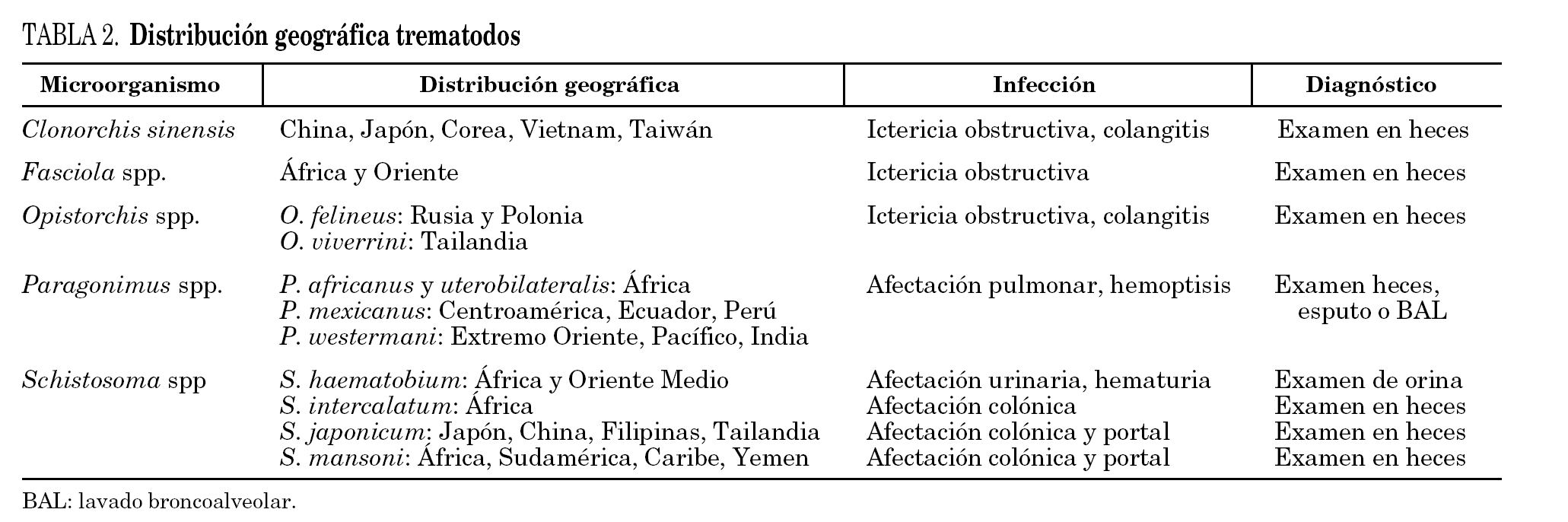
Finalmente, los trematodos (Clonorchis spp., Fasciola spp., Opistorchis spp., Paragonimus spp., Schistosoma spp.) también deben ser estudiados en los donantes procedentes de área endémica (tabla 2) mediante búsqueda de huevos en heces, orina y esputo, especialmente si se constata eosinofilia en sangre periférica. La evidencia de parasitación no contraindicaría la donación pero obligaría a realizar tratamiento específico y seguimiento.
Citomegalovirus
El estado serológico discordante frente a citomegalovirus (CMV), donante seropositivo y receptor seronegativo (D+/R), es un predictor importante de acontecimientos postrasplante: favorece la aparición de rechazo y de otras infecciones oportunistas y además, representa la población con un mayor riesgo de desarrollar una enfermedad órgano-específica, CMV recurrente y CMV resistente a ganciclovir. Si bien la situación de D+/R no contraindica el trasplante, constituye una indicación para realizar profilaxis en el período posterior al procedimiento dado que la seroconversión es del 83% en el trasplante hepático y del 58% en el de corazón o riñón, con tasas de primoinfección sintomática grave de hasta el 77% en el caso del trasplante intestinal. Actualmente la profilaxis se realiza con valganciclovir oral en todos los trasplantes de pulmón, independientemente del estado serológico previo al trasplante, y en las situaciones D+/R para el resto de órganos 24.
Virus de Epstein-Barr
La transmisión del virus de Epstein-Barr (VEB) puede conducir al desarrollo de un síndrome mononucleósico, habitualmente moderado, o a una de las complicaciones más temidas del período postrasplante: la enfermedad linfoproliferativa (PTLD). Su mayor incidencia se da en la situación D+/R, predominantemente en el trasplante pediátrico y, muy ocasionalmente, en el adulto 25 ya que el 90% de la población es seropositiva. El conocimiento de esta situación conducirá a una monitorización estrecha de la replicación de VEB, a ser posible mediante cuantificación de la carga viral por reacción en cadena de la polimerasa (PCR), para plantear el tratamiento anticipado en los casos indicados 26 junto a la reducción en la intensidad de la inmunosupresión 27. Por lo tanto, los centros que realizan trasplante pediátrico deben incorporar este cribado para donante y receptor.
Otros virus de la familia Herpesviridae
Otros virus herpes con importancia clínica en el trasplante incluyen a los virus del herpes simple (VHS-1 y VHS-2), virus de la varicela-zóster (VVZ), virus del herpes humano (VHH) 6, 7 y 8.
Las lesiones causadas por VHS son muy frecuentes tras el trasplante y en el 95% de los casos se debe a una reactivación de la infección latente. El cribado para VHS-1 y VHS-2 se realiza en algunos centros, mientras que en otros se ha decidido el uso de profilaxis a todos los trasplantes durante al menos el primer mes tras el procedimiento.
El cribado para VVZ implicaría la administración de la vacuna al receptor en la situación D+/R. Idealmente debería realizarse previamente al trasplante para prevenir la enfermedad diseminada por varicela 28.
Recientemente se ha sugerido que VHH-6 y VHH-7 desempeñan un papel en las alteraciones producidas por CMV, las infecciones fúngicas y la disfunción del injerto 29. Dado que la mayoría de adultos son seropositivos para estos virus, el cribado en el trasplante no se recomendaba hasta la actualidad. Su utilidad en el trasplante pediátrico está por dilucidar.
El VHH-8, agente causal del sarcoma de Kaposi, se puede reactivar tras el trasplante y, ocasionalmente, se puede transmitir por el donante 30. Sin embargo, la estrategia óptima para su prevención no está definida y, por lo tanto, la recomendación respecto al cribado no está establecida.
Infección por el virus de la hepatitis B
El cribado serológico del antígeno de superficie del virus de la hepatitis B (antígeno de superficie de la hepatitis B [HBsAg]) condiciona que la transmisión del mismo sea muy escasa. Según datos de la ONT (Organización Nacional de Trasplante) la prevalencia de donantes HBsAg positivo es aproximadamente del 1%. En estos casos el riesgo de infección es cercano al 100%. A pesar de ello la infección primaria adquirida desde el donante no comporta obligatoriamente el desarrollo de hepatitis grave e, incluso, el estado de portador crónico 31. De todas formas, la positividad para HBsAg o de los anticuerpos IgM (inmunoglobulina M) frente al core (HBcAc-IgM) del virus de la hepatitis B (VHB) indica infección activa y los órganos de este donante no deben ser trasplantados.
La positividad aislada de los anticuerpos frente al antígeno de superficie (HBsAc) indica el haber sido vacunado previamente o haber resuelto la infección y no se considera un riesgo para la transmisión de VHB dado que no existe replicación viral.
La situación más compleja es la utilización de donantes con HBsAg negativo y HBcAc-IgG positivo. Según datos de la ONT la prevalencia de donantes en esta situación es del 5 al 15%. En este caso se trata de un resultado falso positivo o bien de una infección previa latente. Esta última se considera una situación de riesgo alto para la transmisión de la infección por VHB en el trasplante hepático (del 50 al 78%) debido a la presencia de genoma completo en estado de latencia en los hepatocitos 32 y de riesgo bajo en el receptor de un trasplante no hepático, un 2% en el trasplante renal e inferior en el cardíaco 33. Existe controversia respecto a la utilización de estos donantes. Algunos centros restringen el uso de estos órganos a situaciones de urgencia 0 y/o receptores vacunados. Otra opción es administrar a los receptores no inmunizados frente al VHB en el período postrasplante inmunoglobulina antihepatitis B más lamivudina 34. Por lo tanto y, ante la posibilidad de recibir uno de estos órganos, se recomienda que todos los candidatos seronegativos para VHB sean vacunados frente al VHB, a pesar de que la respuesta en poblaciones con enfermedades en estadio terminal pueda ser subóptima. La determinación de niveles de ADN del VHB en el donante, ayudaría en el diseño de estrategias preventivas en el receptor, aún cuando el resultado llegase en el período postrasplante.
Infección por el virus de la hepatitis C
El riesgo de transmisión desde el donante con infección por el VHC es muy elevado sea cual sea el órgano trasplantado 35. La prevalencia de donantes seropositivos para VHC es cercana al 2% según datos de la ONT de 2001. Se ha comprobado que la positividad de la determinación de ARN del VHC, indicativa de replicación viral activa, se correlaciona con el riesgo de transmisión de la misma. Sin embargo es muy difícil poder disponer de esta información antes del procedimiento. Actualmente se debe realizar una prueba serológica con capacidad para detectar todos los genotipos circulantes. La determinación del antígeno del core-VHC reduce parcialmente el período ventana.
A pesar de todo, se ha observado que no se produce un aumento en la morbimortalidad de los receptores del VHC positivos sometidos a trasplante hepático o renal a los 5 años si se utilizan órganos provenientes de donantes VHC positivos frente a negativos 36. En estos casos sería recomendable que el genotipo del virus fuera el mismo para evitar la superinfección aunque puede resultar difícil de determinar en la práctica. En todo caso el uso de este tipo de donantes implica el consentimiento informado por parte del receptor.
Infección por el virus
de la inmunodeficiencia humana (VIH)
Los donantes seropositivos son rechazados ya que se asume que la posibilidad de transmisión es cercana al 100%. Por dicho motivo, las serologías mediante técnica de análisis de inmunoabsorción ligada a enzimas (ELISA) para el VIH-1 y VIH-2 se realizan a todo potencial donante, si bien no se conocen casos descritos de transmisión de VIH-2. Cualquier resultado positivo se confirma mediante técnica de Western blot. En los donantes vivos seronegativos, si existe la duda de exposición, se debe realizar una determinación de carga viral dado que su resultado antecede a la positividad de la determinación de anticuerpos. Esta exposición se sospechará en varones que mantienen relaciones homosexuales, en los ADVP, en la prostitución, en ingresos penitenciarios recientes o en las personas a las que se les ha realizado tatuajes o piercing en condiciones de escasa o nula esterilidad.
Respecto a las pruebas para determinar la infección por VIH cabe tener en cuenta el denominado período ventana en el cual el resultado puede ser falsamente negativo a pesar de la existencia de infección. Este período varía entre 2 a 6 semanas para la determinación de anticuerpos, 14 días para la determinación de antígeno p24 y de 4 a 5 días para la determinación de la carga viral. Esta última prueba presenta una serie de inconvenientes como son el 4% de falsos positivos, su falta de validez en donantes cadáver donde los falsos negativos se podrían deber a degradación de ácidos nucleicos y los falsos positivos a la presencia de productos de degradación tisular y la falta de detección de la infección por VIH-2, grupo O de VIH-1 y problemas para subtipos no B del VIH-1.
Infección por el virus linfotrópico humano (HTLV-I)
Es un retrovirus endémico en ciertas regiones geográficas (sudeste de Japón, Caribe, norte de América del Sur y sudeste de Estados Unidos, áreas de África Central y del oeste, Melanesia, Oriente Medio e India). Su mecanismo de transmisión es similar al del VIH. La persona infectada se convierte en portadora de por vida ya que el genoma viral se integra en los linfocitos T. Si bien la primoinfección puede cursar de forma asintomática, con el paso de los años se pueden desarrollar enfermedades como la tetraparesia espástica tropical o la leucemia/linfoma de células T. Esta progresión se observa en el 2 al 4% de los infectados 37.
HTLV-II es un virus difícil de distinguir serológicamente de HTLV-I aunque su implicación en patología es menos conocida 38. Su distinción puede llevarse a cabo mediante técnicas de PCR. Se distribuye principalmente en población ADVP y sus parejas sexuales de Estados Unidos, Europa, América del sur (Brasil) y sudeste asiático (Vietnam).
Se han descrito casos de transmisión a través de órganos procedentes de donantes asintomáticos infectados por HTLV-1 con aparición de mielopatía subaguda en el receptor a los 2 años del trasplante 39.
El cribado serológico se debe practicar a los potenciales donantes inmigrantes nacidos o hijos de madres o residentes en zonas endémicas y a viajeros procedentes de estas zonas. En caso de serología positiva mediante ELISA se debe desestimar el donante. Si se obtiene un resultado positivo débil hay que realizar una segunda determinación mediante ELISA con un reactivo diferente. Todos los casos positivos se confirmarán mediante Western blot. A pesar de ello en una serie de 16 trasplantes renales procedentes de donantes seropositivos para HTLV-I no se observaron casos de leucemia de célula T 40. Por dicho motivo un donante con esta infección se podría considerar para una situación de urgencia 0, especialmente en receptores de mayor edad, siempre tras la obtención del consentimiento informado.
Infección por virus del Nilo Occidental y síndrome respiratorio agudo grave
El virus del Nilo Occidental es un flavivirus que causa meningoencefalitis. Suele cursar en brotes epidémicos, generalmente a finales de verano. Los primeros casos detectados ocurrieron en Estados Unidos. Tiene una amplia área de distribución: África, Asia, Oriente Medio, Europa y Estados Unidos. La transmisión de la infección al receptor es un hecho ya observado 41. La detección del virus ya sea por serología o por PCR requiere de tiempo, por lo tanto aunque aplicable al donante vivo, no es útil para el donante cadáver. En todo caso se debe valorar la realización de la serología únicamente si el donante procede de una zona en situación de brote epidémico las 2 semanas previas. Finalmente, y aunque no se conoce la magnitud real del riesgo de transmisión, parece prudente evitar como donante a un paciente afectado de una meningoencefalitis de características virales no diagnosticada etiológicamente. Sirva como ejemplo la comunicación de la transmisión del virus de la coriomeningitis linfocitaria desde 2 donantes en contacto con roedores a 8 receptores con el resultado de 7 fallecimientos 42.
El síndrome respiratorio agudo grave (SRAG) está causado por un coronavirus. Su transmisión por el donante es teóricamente posible por lo que los pacientes con clínica sugestiva de enfermedad aguda con criterios de SRAG deben ser excluidos como donantes. En este caso es importante conocer los síntomas, los viajes y la historia de contactos del donante.
Infección por priones
La enfermedad de Creutzfeldt-Jakob está causada por proteínas con capacidad de transmisión (priones). Tras una fase asintomática de varios años producen una degeneración del sistema nervioso central. No existen pruebas serológicas ni biológicas que permitan detectar a los individuos infectados. El cribado de los donantes se realizará mediante la historia clínica: tratamiento previo con hormona de crecimiento obtenida de cadáver, clínica de encefalopatía subaguda con trastorno de conducta o motor de origen no filiado o casos de familiares con encefalopatía subaguda espongiforme. Los donantes con sospecha de padecer un proceso nosológico relacionado con priones siempre serán desestimados.
Vacunaciones pretrasplante
En la actualidad, a los pacientes que han sido o que van a ser trasplantados, se les recomienda la administración de una serie de vacunas. El período ideal de vacunación es el anterior al trasplante, ya que con la medicación inmunosupresora la respuesta postrasplante puede ser defectuosa 43. Esta misma medicación puede favorecer la aparición de enfermedad si se usan vacunas basadas en virus vivos atenuados por lo que no están indicadas.
La vacuna de la gripe se debe administrar a todos los candidatos y, anualmente, a todos los trasplantados. Además es fundamental la inmunización de las personas del entorno del paciente, lo que incluye al personal sanitario.
La vacuna frente al VHB se debe administrar a todos los candidatos seronegativos. En algunos casos se ha propuesto una pauta de administración acelerada frente a la clásica de 3 dosis a 0, 1 y 6 meses. En todo caso la respuesta a la vacuna es superior a menor grado de alteración del órgano que hay que trasplantar.
Finalmente, y de forma ideal, la vacuna antineumocócica polisacárida 23-valente se debe administrar a los candidatos mayores de 2 años de edad y a todos los adultos que no la hayan recibido en los últimos 5 años.
Conclusiones
En el contexto del trasplante, la evaluación previa del donante representa una actuación muy importante que se debe efectuar con sumo rigor, para minimizar al máximo el riesgo de transmisión de ciertos procesos infecciosos. Los profesionales que se dedican a esta función deben conocer muy bien las posibles patologías implicadas así como el conjunto de infecciones emergentes, que como consecuencia de la globalización, adquieren día a día un creciente protagonismo.
Agradecimientos
Financiado por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III, Red de Estudio de Infección en el Trasplante (RESITRA G03/075) y Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Correspondencia:
Dr. O. Len.
Servicio Enfermedades Infecciosas. Hospital Vall d'Hebron.
P.º Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: olen@ir.vhebron.netapahissa@vhebron.net
Manuscrito recibido el 18-12-2006; aceptado el 19-12-2006.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.