Varón de 37años, natural de Oporto, que residía en España desde hacía 8años. Ex-ADVP (heroína) hacía unos 17años. Fumador de 20cigarrillos/día y consumidor esporádico de cannabis. Negaba consumo de alcohol. Diagnosticado de infección por el virus de la inmunodeficiencia humana (VIH) hacía unos 10años, sin seguimiento. Dos meses antes ingresó en otro hospital por neumonía bibasal grave -citomegalovirus (CMV), micobacterias, Pnemocystis jirovecii negativos- que requirió ingreso en unidad de cuidados intensivos (UCI) y ventilación mecánica invasiva. En dicho momento su situación viroinmunológica era de: CD4 12céls/ul, CD8 188céls/ul; y la carga viral (CV) para VIH de 31.704copias/ml. Fue dado de alta con profilaxis con cotrimoxazol y pendiente de comenzar tratamiento antirretroviral.
Acudió al servicio de urgencias de nuestro centro por presentar cuadro febril de una semana de evolución, mialgias, deterioro del estado general, y disnea progresiva hasta hacerse de reposo; sin otra semiología acompañante, salvo una erupción cutánea urticariforme que apareció unos 15días antes y que mejoró con tratamiento esteroideo (deflazacort 60mg en pauta descendente durante 9días). A su llegada, se observó una tensión arterial de 90/60mmHg, temperatura de 38°C, SatO2 93% con FiO2 del 100%. A la exploración física presentaba mal estado general y obnubilación. Su frecuencia respiratoria era de 30rpm, con trabajo respiratorio. Erupción cutánea generalizada eritematodescamativa. En la auscultación cardiorrespiratoria presentaba hipofonesis generalizada con algunos crepitantes finos bibasales. El resto de la exploración fue normal.
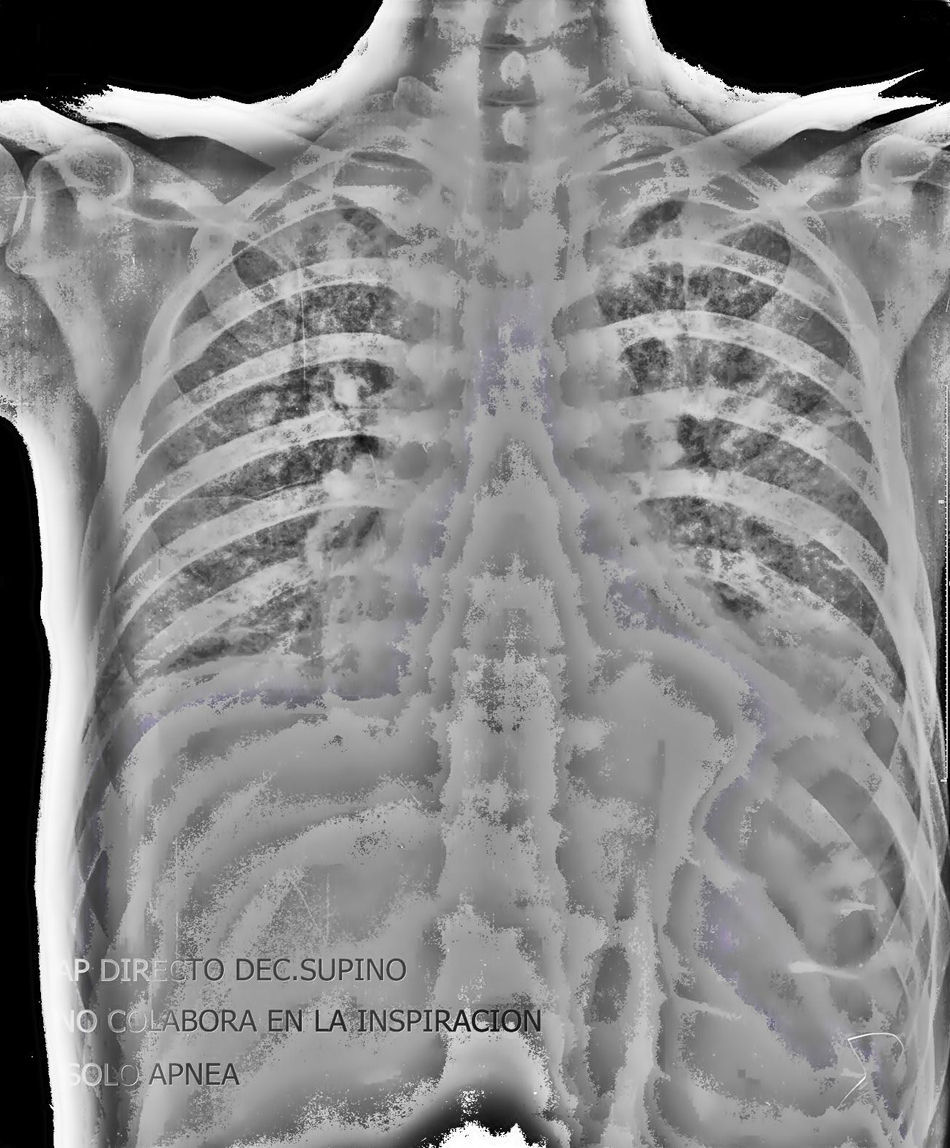
En la analítica de urgencias destacaba 14.270leucocitos (65%N, 13,7%L, 16,8%M, 3%E,1,5B), Hb 9,5g/dl, hcto 28,6%, VCM 90,2fl, HCM 30pg, siendo el resto normal. La Rx tórax (fig. 1), mostraba un patrón intersticial retículo-nodular bilateral, sin otros hallazgos. El TAC craneal fue normal, y la ecografía de abdomen presentaba hepatomegalia difusa. Se instauró antibioterapia empírica en urgencias con ceftriaxona 2g intravenoso al día (1día) y cotrimoxazol 800/160mg intravenoso al día (4días), extrayendo previamente hemocultivos, urocultivo y cultivo de esputos. Ante la ausencia de mejoría, el paciente ingresó en la UCI.
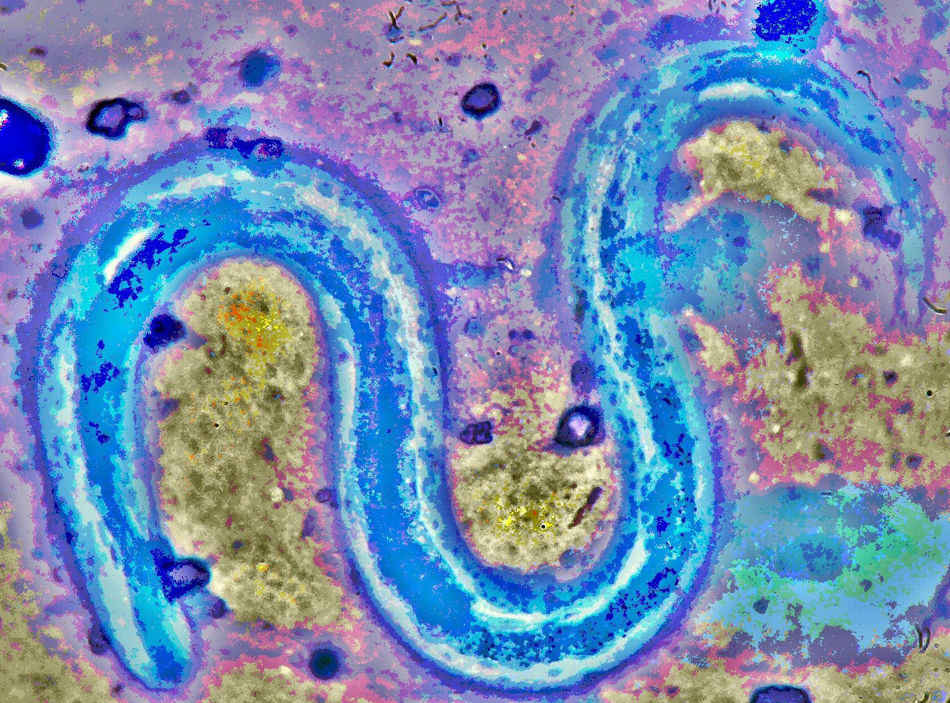
EvoluciónPresentó insuficiencia respiratoria severa que precisó ventilación mecánica invasiva. Se modificó la antibioterapia empírica, prescribiéndose piperacilina/tazobactam 4g/500mg intravenoso cada 8horas (7días), cotrimoxazol 800/160mg intravenoso al día (4días), fluconazol 400mg intravenoso al día (7 días) y vancomicina 1g intravenoso cada 12horas (5días). En todo momento el paciente se mantuvo febril, con una temperatura en torno a 39°C. La serología bacteriana para neumonías atípicas (Coxiella burnetti, Chlamydia pneumoniae y Mycoplasma pneumoniae), VHB, VHC, sífilis, toxoplasma, CMV y virus de Epstein-Barr, fueron negativas. Antigenuria para neumococco y Legionella negativas. En varias muestras de esputo se observaba flora habitual, siendo negativa la presencia de BAAR. Su situación inmunológica en dicho momento era de CD4 57céls/ul, CD8 768céls/ul, CD4/CD8 0,07; la CV para VIH de 1.103.646copias/ml, y dada la mala situación clínica se decidió comenzar tratamiento antirretroviral con lopinavir/ritonavir 400/100mg (solución oral 5ml por SNG) cada 12horas, 3TC 300mg (solución oral 30ml por SNG) y ddI 400mg (solución oral 24ml por sonda nasogástrica) (3días). Los hemocultivos fueron negativos. Al 5.° día de estancia en UCI, se informó desde microbiología de la presencia en el broncoaspirado (BAS) de abundantes larvas compatibles morfológicamente con Strongyloides stercoralis (S. stercoralis) (fig. 2), comenzando tratamiento con albendazol 400mg cada 12horas por sonda nasogástrica (2días). La tecnología empleada para la identificación incluyó tinciones de gram y azul de metileno sobre muestra directa de BAS. Posteriormente se comprobó por PCR doble (NESTED) que amplifica primers de la región Internal Transcribed Spacer (IST) y confirmación mediante secuenciación (IVAMI, Valencia, España).
Durante toda su evolución presentó anemia persistente y progresiva, con necesidad de hemoterapia (hasta 16concentrados de hematíes) sin evidencia de sangrado, ni parámetros de hemólisis. Finalmente presentó repercusión hemodinámica precisando medicaciones vasoactivas y fallo multiorgánico, produciéndose el éxitus al 8.° día de estancia en el hospital. No fue realizado el estudio necrópsico por negativa de la familia. Respecto a resultados posteriores, los cultivos de esputo y broncoaspirado fueron negativos para micobacterias y P. jirovecii.
DiagnósticoSíndrome de hiperinfectación a nivel pulmonar por Strongyloides stercoralis en paciente con infección por VIH.
ComentarioEl S. stercoralis es un nematodo localizado en el intestino delgado humano. Posee la capacidad de producir larvas infecciosas dentro del organismo, lo que facilita la producción de ciclos de autoinfección. Es endémica en regiones tropicales y subtropicales. Focos endémicos han sido descritos en países industrializados como EE. UU., Japón, Italia, Francia y Portugal. En España, hay casos descritos en la Costa Mediterránea. Aunque nuestro paciente era natural de Portugal, desde hacía 8años residía en el sur de España, y no había viajado desde entonces. Como probable vía de infección del paciente, refería baños en arroyos de agua estancada en la zona de Manilva. El bajo nivel socioeconómico, alcoholismo, raza blanca, sexo masculino, contacto con suelo contaminado, así como personas institucionalizadas (centros penitenciarios o psiquiátricos) se han asociado a un mayor riesgo de esta infección1.
Las larvas rabditiformes eliminadas por las heces se transforman en larvas filariformes infecciosas, que penetran la piel intacta o mucosa, alcanzando los pulmones a través de la circulación y posteriormente el intestino delgado con la deglución. A este nivel, maduran a hembra partenogénica (capaz de desarrollar huevos embrionados por sí misma sin la participación del macho) que coloca los huevos en la mucosa intestinal, los cuales eclosionan liberando larvas rabditiformes que se eliminan con las heces. Otra posibilidad es que las larvas rabditiformes se transformen en filariformes, atravesando la mucosa y comenzando un nuevo ciclo de autoinfección1.
Clínicamente se puede manifestar como estrongiloidiasis aguda, en forma de reacción cutánea local en el lugar de entrada de la larva, síntomas pulmonares con tos e irritación traqueal simulando una bronquitis (síndrome de Loeffler) y síntomas gastrointestinales (diarrea, estreñimiento, dolor abdominal). La infección crónica, en la mayoría de los casos cursa de forma asintomática o manifestarse por síntomas cutáneos, gastrointestinales o pulmonares, pudiendo llevar al «síndrome de hiperinfección», que se describe como una autoinfección acelerada con un incremento notable de parásitos fuera del tracto digestivo. Por último, la forma diseminada es aquella en la que hay afectación de otros órganos, más allá del ciclo de autoinfección pulmonar.
Entre las diferentes situaciones que pueden favorecer el síndrome de hiperinfección o las formas diseminadas, destacan el uso de fármacos inmunosupresores principalmente los corticoides, que son los que más específicamente se asocian a una transformación de estrongiloidiasis crónica a síndrome de hiperinfección. Otro factor de riesgo importante para esta situación es la infección por HTLV-1. En nuestro caso, a pesar de que el paciente era ex-ADVP y procedía de un país con elevada inmigración subsahariana (donde la prevalencia de este virus es elevada), no se solicitó la serología para HTLV-1, dado el antecedente del consumo previo de corticoides y a la rápida evolución fatal que presentó el caso, no permitiendo ampliar el estudio. Otros factores de riesgo descritos son la presencia de neoplasias hematológicas, trasplante renal y de médula ósea, VIH, hipogammaglobulinemia y la malnutrición1.
A pesar de que la infección por VIH se considera un factor de riesgo, es sorprendente los pocos casos de hiperinfección descritos en la literatura, incluso en zonas endémicas; hasta 2004 unos 30casos descritos1. Aunque determinadas formas de inmunosupresión como el consumo de inmunosupresores (principalmente corticoides) aumentan el desarrollo del síndrome de hiperinfección o de formas diseminadas; no ocurre lo mismo con la situación de inmunosupresión que produce el VIH. Esto es debido a que la infección diseminada requiere el desarrollo directo de las larvas rabditiformes en larvas filariformes; para lo cual probablemente es necesario un adecuado nivel de CD4; ya que se ha observado que un nivel bajo de CD4 se asocia a un aumento de las larvas rabditiformes y una menor proporción de larvas filariformes2. Sin embargo, se ha observado una mayor proporción de parásitos a nivel intestinal en pacientes con infección por VIH, fundamentalmente Cryptosporidium, I. Belli y S. stercoralis; igualmente esto se relaciona con los niveles de CD4 de forma inversamente proporcional3. Se ha observado que el patrón de citoquinas también puede contribuir a la menor asociación del síndrome de hiperinfección y la infección por VIH. En las infecciones por helmintos (S. stercoralis u otros helmintos) se ha descrito una mayor respuesta Th24; de igual forma ocurre en la infección por VIH, en la que también existe un predominio de la respuesta Th2 sobre la Th1. Se postula que la respuesta Th2 aumenta la replicación del VIH, además de contribuir a un menor desarrollo al síndrome de hipeinfección5. Concretamente en la infección por HTLV-1 y S. stercoralis existe una mayor respuesta Th1, y como se mencionó previamente estos pacientes tienen mayor riesgo de síndrome de hiperinfección6.
La afectación pulmonar se puede manifestar con tos, disnea, asma y hemoptisis7. Aunque no se pudo confirmar, en nuestro paciente la sospecha de hemorragia pulmonar era bastante alta, dada la anemia persistente que presentó, acompañada del fallo respiratorio progresivo. En pacientes con mayor riesgo puede evolucionar a síndrome de distrés respiratorio agudo (SDRA) precisando ventilación mecánica invasiva7. Radiológicamente puede aparecer con un patrón mal definido, condensaciones difusas y migratorias, neumonía extensa, hemorragia alveolar, SDRA, y más raro es el patrón miliar, derrame pleural, o cavitación como consecuencia de sobreinfección bacteriana.
La eosinofilia periférica suele estar ausente durante el síndrome de hiperinfección; tanto la presencia de eosinopenia, como leucopenia, se asocian a un peor pronóstico1. Nuestro paciente no presentó eosinofilia. El diagnóstico se basa principalmente en buscar las larvas filariformes en heces, esputo, lavado broncoalveolar, o cualquier otra muestra en la que exista posible migración de larvas.
La estrongiloidiasis siempre debe ser tratada, aunque el paciente no tenga síntomas, con el fin de evitar complicaciones posteriores. La ivermectina (dosis 200μg/kg/día vía oral durante 2días) es el fármaco de elección, ya que se ha observado que es superior a tiabendazol respecto a la eficacia, además presenta menos efectos secundarios8. Otras alternativas terapéuticas son el tiabendazol (dosis 25mg/kg vía oral 2veces al día, durante 3días) que hasta hace pocos años era considerado el régimen de elección; y el albendazol (dosis 400mg vía oral cada 12horas). En cuanto al tratamiento de la estrongiloidiasis diseminada y el síndrome de hiperinfección es necesario prolongarlo durante una semana9. Referente a la vía de administración, mencionar que frecuentemente la estrongiloidiasis se asocia a ílio paralítico, además son pacientes que pueden llegar a estar gravemente enfermos, por lo que la vía de administración se puede ver comprometida. Aunque existe poca experiencia en el campo de la medicina de la administración de antihelmínticos por vía parenteral, hay estudios que sugieren la eficacia de la administración de ivermectina por vía subcutánea10. Por último mencionar, que debido a que la bacteriemia de origen intestinal frecuentemente aparece en el síndrome de hiperinfección (probablemente por las úlceras intestinales ocasionadas por las larvas filariformes)1, también va a ser necesaria la asociación de un antibiótico al tratamiento antiparasitario. El aislamiento de contacto, mediante el uso de guantes, mascarilla y batas es necesario para el manejo de estos pacientes en el ámbito hospitalario para evitar la transmisión de las larvas1.
Finalmente, haciendo una visión retrospectiva de nuestro caso, debemos mencionar que se trataba de un paciente inmunodeprimido, no solo por la infección por VIH, si no por el consumo de esteroides en las semanas previas por la erupción urticariforme. Probablemente las lesiones cutáneas formaban parten del inicio del síndrome de hiperinfección por S. stercoralis. En ningún momento se sospechó el cuadro, dada la ausencia de eosinofilia y antecedentes epidemiológicos típicos, por lo que el diagnóstico nos lo aportó la presencia de larvas filariformes en el lavado broncoalveolar. Dado que el tratamiento antirretroviral se inició menos de 24horas antes del diagnóstico del síndrome de hiperinfección, nos parece poco probable que un posible cuadro de restauración inmune haya sido el causante de la mala evolución del paciente, más que el propio síndrome de hiperinfección; aunque dicha posibilidad no queda del todo descartada. Hay que destacar la ausencia de guías de práctica clínica al respecto. A partir de nuestra experiencia nos gustaría transmitir la necesidad de aumentar el grado de sospecha de esta patología en pacientes sin antecedentes epidemiológicos típicos, con diferentes situaciones de inmunosupresión, y que estas pueden alterar algunas características típicas de estas enfermedades.