La infección fúngica invasora es causa de una elevada morbi-mortalidad. El desarrollo de una infección fúngica invasora depende de muchos factores, tales como la colonización o la capacidad de ofrecer una óptima respuesta inmunitaria. En esta revisión tenemos por objetivo repasar la patogénesis de la candidiasis y la aspergilosis invasora. Para ello describimos características de estos hongos, detallamos la interacción entre el hongo y el huésped, básicamente mediada por la respuesta del sistema inmunitario del hospedador, y analizamos aquellas situaciones en las cuales el huésped no es capaz de ofrecer una respuesta frente a la infección fúngica.
Invasive fungal infections remain a life-threatening disease. The development of invasive fungal disease is dependent on multiple factors, such us colonization and efficient host immune response. We aimed to review the pathogenesis of invasive fungal infections, in particular, those caused by Candida and Aspergillus. For this we propose, to describe the fungal characteristics, to detail the host defence mechanisms against fungus and to analyse the host risk factors for invasive fungal infection.
Las infecciones fúngicas invasoras son frecuentes en los pacientes inmunodeprimidos y en aquellos ingresados en áreas de críticos1–5. Estas infecciones causan una elevada morbilidad y mortalidad1,6, así como un consumo elevado de recursos para su prevención, diagnóstico y tratamiento. El conocimiento de la patogenia del hongo, así como de la respuesta inmunitaria del huésped frente a la agresión, se postula como una herramienta imprescindible para optimizar el manejo de estas infecciones
Los hongos son un grupo heterogéneo de microorganismos eucariotas que existen desde hace más de un billón de años y que interaccionan de manera constante con el ser humano. Como resultado de esta interacción, se pueden producir un amplio espectro de situaciones que oscilan desde la eliminación del hongo por el ser humano sin causar patología a diferentes infecciones graves que conducen al fallecimiento de las personas. Para entender este abanico de potenciales situaciones la clave es conocer la biología del hongo y la capacidad de respuesta del huésped.
Solo una mínima proporción de hongos tienen capacidad para ser patógenos del ser humano. En la actualidad las infecciones fúngicas invasoras más frecuentes son aquellas causadas por las especies de Candida y de Aspergillus1,3, que pueden presentar diferentes factores de virulencia que potencien su capacidad invasora. Frente a la infección fúngica, el ser humano se defiende utilizando diferentes estrategias entre las que destacan las barreras cutáneas y epiteliales y la activación del sistema inmunitario. En diferentes situaciones en la que estos mecanismos de defensa se ven comprometidos, el huésped es más susceptible a padecer una infección fúngica invasora.
En esta revisión repasaremos la capacidad patogénica de los hongos y la respuesta frente a la infección del huésped en las micosis más frecuentes (Candida y Aspergillus). A su vez, analizaremos con detalle cómo favorecen la patogenia o alteran la respuesta inmunitaria del huésped los factores que clásicamente se asocian a un mayor riesgo de padecer estas infecciones.
Candida spp.El hongoLos hongos del género Candida se distribuyen de una manera universal y entre otros escenarios se pueden aislar en tierra, alimentos, vegetación, animales y comida. Aunque hay más de 150 especies de Candida, pocas son patógenas para el ser humano. Las especies más frecuentes en las infecciones invasoras son Candida albicans, Candida glabrata, Candida parapsilosis, Candida tropicalis y Candida krusei1,2. La mayoría de las especies crecen únicamente en forma de levadura, células ovales que se dividen por gemación. Sin embargo, algunas especies pueden formar pseudohifas, que se corresponden con cadenas de levaduras alargadas que se forman al no producirse una correcta separación de las células tras la gemación.
Candida posee la capacidad de producir diferentes factores de virulencia que favorecen su acción invasora. Entre estos factores destacan las proteinasas aspárticas secretadas (PAS), que dañan el tejido de las mucosas y facilitan la invasión del hongo7,8. Existen diferentes genes que codifican más de 10 tipos diferentes de PAS que se expresarán en mayor o menor medida dependiendo de las características del medio, como el pH. Las PAS son muy importantes en la patogenia de Candida spp. y son claves en la activación de los diferentes receptores de respuesta inmunitaria del huésped. Otro factor importante son las adesinas que tienen una gran capacidad de adaptación y facilitan la unión del hongo con los epitelios. También puede favorecer la virulencia de Candida su capacidad de formar biofilms en algunas superficies, de cambiar su morfología, o de alterar las propiedades de la superficie celular y/o bioquímicas7. Hoy en día, existe mucha controversia sobre la influencia que puede tener en la virulencia de la Candida su capacidad de variar su morfología de levadura a pseudohifa.
Interacción entre Candida y huéspedContacto entre Candida y huéspedLas especies de Candida colonizan las mucosas gastrointestinal, genitourinaria y respiratoria, así como la piel. El aislamiento de Candida en estas localizaciones no implica siempre la presencia de infección. La transición entre la colonización y la invasión de mucosas o la diseminación de la infección depende mayoritariamente de la respuesta que sea capaz de ofrecer el huésped frente al hongo. La infección por Candida spp. se divide en dos grandes grupos: la infección mucocutánea y la invasora.
La primera línea de defensa del huésped frente a la Candida se encuentra en diferentes mecanismos locales a nivel de las mucosas. Entre estos mecanismos se incluyen un conjunto importante de proteínas salivares, tales como la lactoferrina, lisozimas, lactoperoxidasas, mucinas, transferrina e inmunoglobulina A. Estas proteínas dificultan la adhesión y crecimiento de la Candida en la cavidad orofaríngea. La mucosa de la cavidad oral desarrolla un papel imprescindible en la defensa el huésped frente a la Candida y se ha demostrado que alteraciones en esta mucosa se relacionan con una mayor posibilidad de padecer candidiasis orofaríngea9.
Las células epiteliales también secretan IL-8 y factores estimulantes de colonias granulocíticas como respuesta de un aumento de las colonias de Candida en la mucosa. Recientemente se ha descrito que los pacientes con el síndrome de hiper-IgE y aquellos con candidiasis mucocutánea crónica presentaban una mutación en un importante factor de transcripción (STAT3) clave para enlazar con la respuesta inmune innata mediada por los linfocitos Th1710–12. Estos linfocitos secretan IL-17, IL-21 y IL-22 que son importantes para el desarrollo de defensinas epiteliales y el reclutamiento de los neutrófilos. Es curioso destacar que este subgrupo de pacientes, con alta incidencia de infección mucocutánea por Candida, raramente desarrolla infección invasora. Esto refuerza el concepto que la Ig-E y los linfocitos Th17 son básicos en la defensa local de la mucosa mientras otros pasos nos protegen de las infecciones invasoras.
Respuesta de la inmunidad innata del huéspedTras superar el epitelio empieza la infección invasora por Candida. Como primera respuesta del huésped, el endotelio vascular secreta mediadores proinflamatorios y péptidos antimicrobianos, como las defensinas, que estimulan el reclutamiento y la activación de los leucocitos. Una vez atravesadas las barreras mucocutáneas, los neutrófilos y monocitos son las células claves en los estadios iniciales de la respuesta del huésped frente a la infección. Al igual que ocurre en la infección por Aspergillus, el tamaño de la Candida puede dificultar la fagocitosis del hongo por estas células de defensa. En estos casos, se necesitará de la ayuda de componentes extracelulares para marcar al patógeno y favorecer su ingestión y destrucción. Este proceso se denomina opsonización.
Para que los macrófagos, neutrófilos y células dendríticas se puedan unir al hongo necesitan reconocer al patógeno. Ello es posible gracias a la acción de los receptores reconocedores de patrones (RRP). Estos receptores reconocen una serie de patrones moleculares comunes y constantes presentes en los microorganismos patógenos conocidos con el nombre de patrón molecular asociado a patógenos (PMAP). Los PMAP presentan una serie de propiedades muy características: son específicos de los microorganismos patógenos y no se encuentran presentes en las células del huésped, son invariables entre diferentes especies, lo que permite que con un número limitado de RRP se detecte la presencia de cualquier patógeno y, por último, son esenciales para la supervivencia o patogenicidad del microorganismo por lo que permanecen invariables pudiendo ser reconocidos por los RRP. La activación de los RRP conlleva una doble función, activa distintos procesos característicos del sistema inmune innato, como pueden ser la fagocitosis o la opsonización y establece una conexión entre la inmunidad innata y adquirida.
Los RRP más importantes en el reconocimiento de la Candida spp. por neutrófilos y monocitos son los Toll like receptors (TLR, ‘receptores tipo toll’), los receptores de manosa y la dectina-1. Los TLR son un conjunto de proteínas transmembrana tipo I que presentan un domino extracelular que se une al patógeno y un dominio citoplasmático que será el encargado de detonar la respuesta de activación del receptor. Estos receptores interaccionan con diferentes proteínas, entre las que destaca por su papel regulador la MyD88, y activan una serie de factores de trascripción que lideran la producción de citoquinas pro o antiinflamatorias y consecuentemente, la activación de una u otra respuesta inmune adaptativa. Hasta el momento se conocen diez tipos diferentes de TLR, los TLR más importantes en la respuesta frente a Candida spp. son el TLR2 y el TLR4 que reconocen dos PMAP diferentes. El PMAP que reconoce el TLR2 es el fosfolipomanano de la pared del hongo y se asocia con la activación de la respuesta Th2. El TLR4 se une al manano y facilita respuesta mediada por las células Th1. Otro TLR implicado en la respuesta del huésped frente a la infección por Candida spp. es el TLR9, que puede reconocer el DNA del hongo. En algunos estudios experimentales, el déficit de TLR9 o la inhibición de este se ha asociado a una disminución de la producción de citoquinas, en especial de la IL-1013. En la respuesta frente a Candida spp. mediada por la activación de los TLR, la proteína MyD88 juega un papel imprescindible para la activación de los macrófagos. Por otro lado, los receptores de manosa permiten el reconocimiento y fagocitosis de Candida spp. que no ha sido opsonizada previamente. Este receptor tiene especial importancia en la epidermis humana jugando un papel clave en la defensa frente a las infecciones mucocutáneas. La dectina-1 se une a los beta-glucanos y actúa favoreciendo la maduración de las células dendríticas, monocitos y macrófagos así como en la activación de diferentes citoquinas, en especial la IL-2 y la IL-10. También se ha observado que la unión de Candida spp. a estas proteínas induce una respuesta mediada por linfocitos Th17. La importancia de la dectina-1 queda recientemente contrastada al observarse que un déficit de esta lectina se asocia a un mayor riesgo de infección fúngica mucocutánea14.
La activación simultánea de múltiples RRP por Candida spp. dibuja un amplio espectro de posibilidades en la respuesta del huésped. Los diferentes receptores interaccionan entre si formando un entramado muy difícil de seguir. Para una óptima respuesta será necesario un buen equilibrio entre los diferentes componentes. Así pues, la dectina-1 según su activación puede estimular la respuesta del TLR2 o la mediada por el TLR4. Algunos receptores de manosa pueden activar el TLR2 y el propio TLR2 inhibe el TLR4. Y así sucesivamente. Como consecuencia final de todos estos procesos, se activará una u otra respuesta inmunitaria adaptativa y una serie de procesos dirigidos a producir la muerte de la Candida spp. Entre estos procesos destacan los procesos oxidativos, que incluyen la generación de radicales libres de oxígeno y nitrógeno, y los procesos no-oxidativos.
Los factores humorales también participan en la defensa del huésped frente a la infección por Candida spp. Este hongo activa el complemento por su vía clásica y alternativa. Esta activación del complemento facilita el reclutamiento de células fagocíticas y facilitan su activación aumentando su efecto anti-Candida.
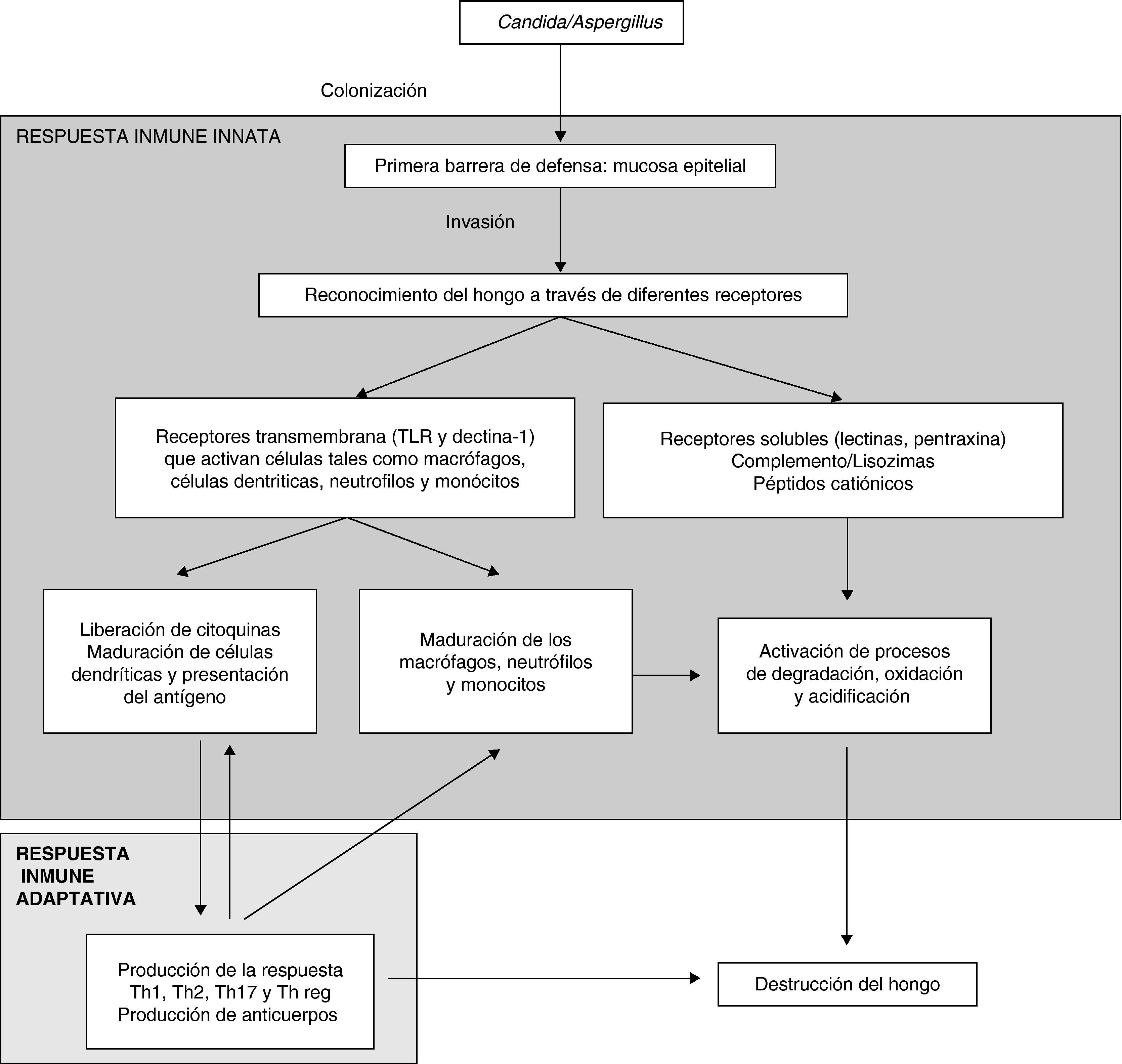
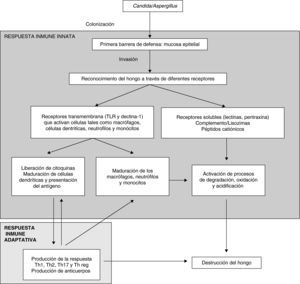
La figura 1 muestra de una manera esquemática la respuesta inmunitaria del huésped frente a la infección fúngica invasora.
Respuesta de la inmunidad adaptativa del huéspedLas células dendríticas juegan un papel muy importante para unir la inmunidad innata y la adaptativa. El tipo de respuesta de estas células depende mucho de la morfología de la Candida spp. Según su forma de levadura o pseudohifa las células dendríticas utilizaran diferentes receptores para interaccionar con la Candida spp., y por tanto, ofrecerán respuestas dispares. Las células dendríticas que hayan fagocitado Candida spp. en forma de levadura inducirán una diferenciación de las células CD4+ a células Th1, mientras que por el contrario, las células dendríticas que captan las formas de pseudohifa inducen una respuesta Th2. La respuesta mediada por las células Th1 se asocia a una protección del huésped frente a la infección fúngica. Por el contrario, la respuesta Th2 se relacionará con la capacidad del microorganismo de evadir o inhibir la respuesta inmunitaria del huésped. El resultado final de la producción de una u otra respuesta Th influirá en activación de los linfocitos B y en la maduración del resto de células fagocíticas.
La inmunidad celular juega un papel clave en la prevención de la candidiasis en el tracto digestivo. De hecho, en los pacientes con sida, el desarrollo de candidiasis orofaringea y/o esofágica se correlaciona directamente con los valores de linfocitos CD4. Los linfocitos reguladores (Treg), que disminuyen la inmunidad celular y favorecen los procesos de alergia y los Th 17, también tienen su importancia en la respuesta del huésped frente a la infección por Candida15.
El papel de la formación de anticuerpos en la respuesta del huésped frente a la infección por Candida es aún poco conocido. Clínicamente, un déficit en la inmunidad de las células B no se asocia a un aumento en la susceptibilidad de la infección. Sin embargo, se ha observado que existen algunos anticuerpos que son capaces de potenciar de manera considerable la respuesta de las células fagocíticas frente a la infección fúngica e incluso de activar por sí mismos acciones beneficiosas del complemento.
El huéspedLas características del huésped pueden favorecer la infección invasora por Candida (tabla 1). Existen dos grandes grupos de pacientes con elevado riesgo de padecer candidiasis invasora: los pacientes ingresados en unidades de críticos y los pacientes con hemopatías malignas. Aunque ambos grupos de pacientes tengan riesgo de candidemia o candidiasis diseminada, no siempre el manejo y pronóstico de estas infecciones puede ser comparable. De hecho, conocer las diferencias en la patogenia de la candidiasis invasora en ambos grupos de pacientes nos ayuda a entender que los objetivos para prevenir esta infección deben ser diferentes para los pacientes críticos y los hematológicos.
Factores predisponentes de infección fúngica invasora en el huésped inmunodeprimido y su asociación con la fisiopatogenia de la infección
| Factores de riesgo de IFI | Factor favorecedor de la fisiopatogenia de la infección |
| Candidiasis invasora | |
| Colonización | Aumento del inóculo |
| Uso previo de antibióticos | Alteración en la flora digestiva con aumento del inóculo fúngico |
| Aspergilosis invasora | |
| Edad avanzada | Sustitución progresiva con la edad de la respuesta Th1 por Th2 |
| Enfermedad de base | Diferente cinética de reconstitución de la respuesta inmunitaria ante un mismo procedimiento de trasplante según la enfermedad de base del paciente |
| Características del trasplante | Mayor compatibilidad entre donante y receptor se asociará a menor alteración inmunológica |
| Infección por virus respiratorios | Alteración de la mucosa respiratoria favoreciendo la invasiónInmunomodulación: producción de IL-10 por el virus |
| Número de transfusiones | Aumento de la respuesta Th2 |
| Candidiasis y aspergilosis invasora | |
| Citopenia | Disminución de las células de defensa |
| Enfermedad de injerto contra el huésped | Alteración de la mucosa digestiva favoreciendo la invasiónAlteración en el balance Th1 y Th2 |
| Infección por citomegalovirus | Alteración funcional de linfocitos y monocitosInmunomodulación: producción de IL-10 por el virus |
| Corticoterapia | Múltiples efectos a diferentes niveles del sistema inmunitario |
En pacientes críticos no inmunodeprimidos los factores del huésped que predisponen a padecer candidiasis invasora son el estar colonizado por Candida, padecer una estancia hospitalaria prolongada, la presencia de catéter vascular o sondas vesicales, la nutrición parenteral, el antecedente de cirugía del tubo digestivo y el uso previo de antibióticos o antiácidos gástricos5. Todos estos factores tienen una estrecha relación con diferentes actitudes de la práctica médica que favorecen la colonización por Candida, el aumento de inóculo del hongo o la ruptura de las barreras protectoras. Así pues, al ingreso hospitalario solo un 5-15% de pacientes están colonizados por Candida. Este porcentaje aumenta hasta un 50-85% en pacientes ingresados en unidades de críticos y con estancias medias prolongadas5. Además, las estancias medias prolongadas se asocian a un mayor número de complicaciones, uso de catéteres y/o sondas vesicales y uso de antibióticos. Aquellos pacientes con catéter vascular, sondas vesicales, nutrición parenteral y/o cirugía del tubo digestivo presentan una disrupción de piel y mucosas favoreciendo el proceso de invasión del hongo. Por último, el uso de antibióticos y antiácidos gástricos previos se correlaciona con un cambio en la flora fecal que favorece el crecimiento de Candida spp.4. Todos estos factores nos muestran una serie de actitudes a corregir por parte del clínico para disminuir la incidencia de candidiasis invasora en los pacientes ingresados en unidades de críticos.
Entre los factores de riesgo de la candidiasis invasora en pacientes inmunodeprimidos, además de la colonización o el uso previo de antibióticos, hallamos una serie de factores que nos dibujan un escenario en el cual el huésped es incapaz de ofrecer una respuesta ante la invasión del hogo (tabla 1)2. La neutropenia severa, el uso de corticoesteroides, la enfermedad de injerto contra el huésped y la infección por CMV se han relacionado con un mayor riesgo de padecer candidiasis invasora. Es fácil de entender que la ausencia de neutrófilos se relacione con una importante disminución de la capacidad del huésped para oponer resistencia a las infecciones, ya que los neutrófilos son la célula efectora básica de los mecanismos de defensa. El efecto de los corticoides sobre la respuesta inmunológica del huésped afecta a múltiples niveles alterando la función de linfocitos, neutrófilos, monocitos, macrófagos y células dendríticas. Entre sus muchas funciones, los corticoides disminuyen la capacidad para crear una respuesta inmunológica mediada por linfocitos Th1 y aumentan la producción de citoquinas relacionadas con los linfocitos Th2. Además, alteran la capacidad de fagocitosis y los procesos oxidativos de las células de defensa. Por último, algunos autores han descrito que los corticoides tienen también un efecto sobre el propio hongo favoreciendo la capacidad de adherencia a las mucosas y los procesos de translocación de Candida del tubo digestivo a la sangre. La enfermedad por CMV y la enfermedad de injerto contra el huésped frecuentemente cursan con una disrupción de la mucosa intestinal favoreciendo la invasión de la Candida. Ambas entidades se han relacionado con diferentes alteraciones inmunitarias, predominantemente a nivel citoquínico, que se explican con más detalle en el apartado dedicado a la aspergilosis invasora.
Aspergillus spp.El hongoEl género Aspergillus incluye unas 200 especies, de las que más de 20 pueden causar infecciones en humanos16,17. Aspergillus es un hongo filamentoso ubicuo en la naturaleza. Aunque su principal nicho ecológico es la tierra, el agua o la vegetación, las esporas de Aspergillus se pueden dispersar fácilmente en el aire y sobrevivir en diferentes condiciones ambientales. Este hongo tiene un ciclo biológico muy simple en el cual se forman esporas para su reproducción y tras la germinación de estas esporas se forman las hifas que serán las formas invasivas del hongo. La simplicidad del ciclo biológico favorece una alta capacidad del hongo para la esporulación y, como consecuencia, la presencia de concentraciones altas de esporas en el aire.
Entre las especies patógenas, la más frecuente es Aspergillus fumigatus y con menor frecuencia Aspergillus flavus, Aspergillus niger y Aspergillus terreus3,16,17. Comparado con otras especies, A. fumigatus presenta unas características especiales que optimizan su capacidad para producir infecciones en humanos. Entre estas características destaca que el tamaño de las esporas (de 2 a 3μm) es ideal para profundizar en los alvéolos pulmonares, mientras que el mayor tamaño de las esporas del resto de especies facilita su eliminación por parte de los cilios de la mucosa del epitelio respiratorio. Además, A. fumigatus es más termotolerante que otras especies y puede crecer en temperaturas que oscilan de los 37° a los 50°C, lo que le permite el crecimiento en determinadas condiciones medioambientales muy extremas. De hecho, se ha especulado que el desarrollo a altas temperaturas de A. fumigatus puede inducir la expresión de genes que confieren especial virulencia a las cepas. De todas maneras, a día de hoy, no hay una clara evidencia científica que sustente esta teoría. Otra característica de A. fumigatus que le confiere una mayor capacidad de producir infección invasora comparado con otras especies de Aspergillus es la capacidad de germinación del hongo. Esta capacidad de germinación es similar a 30°C en las diferentes especies de Aspergillus, pero entre 37° y 40°C es mucho mayor en la especie de A. fumigatus18.
Existen otros factores de virulencia comunes del género Aspergillus que facilitan la invasión del hongo en el huésped. Aspergillus puede secretar toxinas (gliotoxina) que son capaces de actuar en el momento crucial de la patogénesis, cuando el hongo coloniza el epitelio mucoso e interacciona con el huésped19. Estas toxinas tienen la capacidad de ralentizar el movimiento ciliar y lesionar el epitelio del tracto respiratorio. Otros factores de virulencia, tales como las elastasas, catalasas, hemolisinas o proteasas, actúan en etapas posteriores de la interacción entre microorganismo y huésped, interfiriendo en la capacidad de defensa del sistema inmune del huésped17.
Interacción entre Aspergillus y huéspedContacto entre Aspergillus y huéspedLa inhalación de las esporas de Aspergillus es la etapa inicial de la patogenia de la aspergilosis invasora17. Aunque la inhalación de estas esporas por el ser humano es muy frecuente, se calcula que inhalamos más de 200 esporas diarias, habitualmente, no producen ninguna enfermedad al ser eliminadas eficientemente por el sistema inmunitario. Sin embargo, en algunos huéspedes, la espora tiene mayor facilidad para alcanzar el tracto respiratorio inferior y entonces, su tamaño reducido permite que se deposite en el alvéolo. Una vez depositado y, de nuevo, dependiendo de la respuesta del huésped, se pueden producir un amplio espectro de enfermedades tales como manifestaciones alérgicas (aspergilosis broncopulmonar alérgica), más frecuentes en el huésped inmunocompetente, la formación de masas fúngicas (aspergilomas), que veremos en pacientes con cavidades pulmonares pre-existentes y la enfermedad invasora, característica del huésped inmunodeprimido16.
El primer paso para disminuir la incidencia de infección por Aspergillus spp. consistirá siempre en mantener un buen control ambiental que disminuya en lo posible la concentración de esporas. En el medio hospitalario, los pacientes con riesgo de sufrir una aspergilosis deberán evitar el contacto con productos vegetales (plantas, semillas o especias) y estar alejados de cualquier trabajo de construcción o reforma, ya que en un ambiente en el cual se remueve el hábitat del Aspergillus, se elevará considerablemente el número de esporas por metro cúbico en el aire. Los pacientes con inmunosupresión severa deberán ser albergados en habitaciones especialmente diseñadas, con aislamiento adecuado de puertas y ventanas, aire filtrado a través de HEPA, flujo laminar, presión diferencial positiva y un elevado número de renovaciones de aire20.
Aunque la patogenia de Aspergillus sigue habitualmente el esquema dibujado hasta el momento, en ocasiones la infección aspergilar puede tener un origen iatrogénico con la inoculación directa del hongo. Esta vía de infección puede producir casos de aspergilosis posquirúrgica o incluso de fungemias, por contaminación de catéteres, sin precisar una alteración del sistema inmune del hospedador21. En estas situaciones el manejo de la infección puede diferir del habitual precisando de medidas tales como la cirugía o la retirada de material contaminado.
Respuesta de la inmunidad innata del huéspedTras la barrera anatómica que constituyen el epitelio respiratorio y las defensas mucociliares, los macrófagos alveolares son la primera línea de defensa fagocítica frente a las esporas inhaladas. En un segundo estadio, las diferentes células del sistema inmune de la sangre periférica, en concreto las células dendríticas, los monocitos y los neutrófilos, llegan al sitio de la infección. Todas estas células juegan un papel primordial tanto en la destrucción inicial del hongo como en la activación de las posteriores etapas de la respuesta inmunitaria. Los macrófagos y monocitos tienen una acción esencial en la fagocitación y la muerte de las esporas, impidiendo así su transición a las formas invasivas de las hifas. Los neutrófilos son imprescindibles en la respuesta del huésped frente a aquellas formas del moho que ya han iniciado el proceso de germinación y frente a las hifas.
Los RRP más importantes en la respuesta del huésped frente a la infección por Aspergillus son los TLR y la dectina-122–24. Entre los TLR existen dos que presentan un papel imprescindible en la respuesta del huésped frente a la infección por Aspergillus, el TLR2 y el TLR422. La activación de cada receptor mediará respuestas totalmente diferentes, aunque por ahora no queda muy claro que PMAP de Aspergillus son los reconocidas por cada tipo de TLR. Cuando Aspergillus se une al TLR4, se genera una respuesta de citoquinas pro-inflamatorias (TNF-alpha, interleuquina [IL] IL-1, IL12, IL-15, interferón-gamma) que se asocia a un efecto de protección frente la infección. De esta respuesta citoquínica se generará una respuesta adaptativa mediada por los linfocitos Th1. Por el contrario, la activación del TLR2 favorece una respuesta citoquínica antiinflammatoria, mediada por la IL-10 y la IL-4, y como consecuencia, promueve una respuesta del sistema inmune adaptativo mediado por los linfocitos Th2, relacionados con una mayor susceptibilidad a padecer infección fúngica invasora. Ya hace años, diferentes estudios en modelos animales sugerían que las alteraciones en estos receptores se asociaban a un mayor riesgo de padecer infección fúngica invasora. Recientemente, se ha demostrado en un estudio clínico que los diferentes polimorfismos de TLR4 de las células de los donantes se asocian con un mayor o menor riesgo de padecer aspergilosis invasora en los pacientes con trasplante de progenitores hematopoyéticos22.
La dectina-1 es un tipo de lectina. Las lectinas son proteínas que unen a mono- y oligosacáridos específicamente y de manera reversible y que juegan un papel imprescindible en el reconocimiento y comunicación celular. En concreto, la dectina-1 es específica para los beta-glucanos, presentes en la pared celular de los hongos. Este receptor aumenta de manera considerable su expresión cuando el huésped está continuamente expuesto al patógeno25. La activación de la dectina-1 favorece la fagocitosis del hongo por la célula del sistema inmune, inicia la cascada inflamatoria de citoquinas y activa procesos oxidativos, como por ejemplo los mediados por la NADPH-oxidasa25,26.
Una vez reconocido el Aspergillus por los diferentes receptores se producen 2 fenómenos importantes. El primero es la producción de citoquinas para activar la respuesta inmune adaptativa. El segundo es el inicio de diferentes procesos que tienen como objetivo la muerte del hongo. En este escenario, las células de defensa fagocitan las diferentes formas fúngicas y, según se trate de una espora o de una hifa, se activan diferentes procesos27. Los macrófagos matarán las esporas mayoritariamente mediante procesos de oxidación o de acidificación28,29. En los neutrófilos, los procesos de oxidación son los que tienen mayor relevancia.
Dentro de los procesos oxidativos destacan, por la importancia que tienen frente a la infección por Aspergillus, aquellos mediados por la NADPH-oxidasa30. Con la activación de este enzima se forman diferentes reacciones en cadena que finalizan en la formación de radicales libres con capacidad antimicrobiana. De hecho, un déficit de este enzima, como el déficit congénito que presentan los pacientes con enfermedad granulomatosa crónica, se asocia a un elevado riesgo de padecer aspergilosis invasora. La acción de la NADPH-oxidasa acontece sobre todo en los neutrófilos y frente a las hifas. La NADPH-oxidasa tiene también otras funciones periféricas como la inhibición de la respuesta inflamatoria inducida por los componentes de la pared celular del hongo31. Además de la acción de la NADPH-oxidasa, los neutrófilos utilizan otros mecanismos oxidativos para eliminar las partículas fúngicas. Estos procesos están mediados por substancias que se generan en los gránulos de los neutrófilos (proteasas, lisoenzimas, lactoferrina, pentraxina-3,...).
Algunos factores humorales también participan en la respuesta inmune innata del huésped frente a la infección por Aspergillus. El sistema del complemento actúa frente a las diferentes formas del hongo, ya sea por su vía alternativa (que reconoce y elimina esporas) o por la clásica (que reconoce las formas en germinación y las hifas). En el fluido alveolar, existen algunas proteínas (lectinas tipo C) que favorecen la fagocitosis y aglutinan las esporas de Aspergillus, inmovilizando al patógeno y favoreciendo la acción del sistema inmunitario. En ocasiones, el tamaño de las hifas es demasiado grande para ser fagocitado y estas pueden ser dañadas a través de mecanismos extracelulares tales como lisozimas (que favorecen la fagocitación) o péptidos catiónicos (que formaran canales en la pared del hongo produciendo su lisis). A pesar de la importancia de estos factores humorales, los factores predisponentes de aspergilosis invasora suelen estar en relación con una disfunción del sistema inmunitario de fagocitosis y no en relación a defectos de la inmunidad humoral.
Respuesta de la inmunidad adaptativa del huéspedEl sistema inmune adaptativo permite una respuesta inmunitaria más contundente y el establecimiento de la denominada memoria inmunológica. Las células del sistema inmune adaptativo son los linfocitos T, que generan la respuesta inmunitaria mediada por células, y las células B, encargadas de la respuesta inmune humoral mediada por anticuerpos. En la aspergilosis invasora, la inmunidad celular es clave mientras que el papel de la inmunidad humoral es menor32.
La respuesta inmune adaptativa requiere el reconocimiento de antígenos que pertenecen al microorganismo invasor durante un proceso llamado presentación de los antígenos. Estudios recientes destacan la importancia de las células dendríticas en este proceso y, por tanto, la importancia de estas células para entrelazar la respuesta inmune innata y la adaptativa33. Las células dendríticas procesan el antígeno y lo presentan a los linfocitos a través del complejo mayor de histocompatibilidad (CMH). Los linfocitos CD4+, también denominados linfocitos T helper (Th, ‘T cooperadores’), se encargan de regular y amplificar la respuesta del huésped frente Aspergillus. Los linfocitos CD4+ se subdividen a su vez en linfocitos de la subpoblación Th1 y Th2. A través de la secreción de citoquinas, estos linfocitos son los responsables de coordinar la respuesta inmune celular. Como se ha comentado anteriormente, la respuesta mediada por las células Th1 se asocia con la producción de citoquinas pro-inflamatorias. Como consecuencia de esta estimulación se activan los macrófagos, se generan más linfocitos T CD4+, se favorece la producción de anticuerpos y se retrasa las reacciones de hipersensibilidad. Como ya se ha comentado previamente, esta respuesta se asocia a una protección del huésped frente a la infección fúngica16,17. La respuesta Th2 se asocia a la secreción de citoquinas antiinflamatorias, entre las que destaca la IL-10, que regulan la inflamación causada por las citoquinas dependientes de la respuesta Th1. La respuesta Th2 también se asocia a diferentes mecanismos de las reacciones alérgicas. Solo de un óptimo balance entre la respuesta Th1 y Th2 se obtendrá una respuesta inmunitaria que permita hacer frente a la infección por Aspergillus. Esta respuesta Th influirá en activación de linfocitos B y en la maduración del resto de células fagocíticas. Es importante recordar que aunque los macrófagos en reposo tienen capacidad de lisis del hongo, sus capacidades microbicidas mejoran por medio de su activación. Recientemente se ha visto que la activación del macrófago es algo más complejo de lo que se creía, pero que la producción de citoquinas secretadas por los linfocitos Th juegan un papel clave potenciando sus actividades antimicrobianas, antitumorales y de secreción de más citoquinas.
Además de los linfocitos Th1 y Th2, en los últimos años se ha descubierto la importancia de los linfocitos reguladores (Treg), que disminuyen la inmunidad celular y favorecen los procesos de alergia16 y de los Th 17, que favorecen la expresión de mediadores para reclutar neutrófilos, pero que paradójicamente dificultan la respuesta de defensa del huésped en modelos animales de aspergilosis invasora15,16.
El huéspedExisten determinadas situaciones en las cuales el huésped no es capaz de ofrecer una respuesta adecuada frente a la infección por Aspergillus (tabla 1)3. El paradigma de esta situación se da en los pacientes con trasplante de progenitor hematopoyético. Este tipo de trasplante supone un complejo proceso para el organismo con una alteración muy importante del sistema inmunitario que se verá más o menos afectado según las características del huésped, del tipo de trasplante y de las complicaciones y tratamientos pos-trasplantes.
La edad avanzada y determinadas hemopatías de base se han relacionado con un mayor riesgo de padecer aspergilosis invasora. Una potencial explicación de este hecho es que la evolución del sistema inmunitario relacionada con el proceso de envejecimiento implica una substitución progresiva de la repuesta inmunitaria mediada por los linfocitos Th1 a respuesta mediada por los Th234, de manera que con el paso de los años se dificulta la creación de la respuesta Th1 y se favorece la respuesta Th2. En la misma línea, se conoce que la cinética de reconstitución del sistema inmunitario después de un trasplante de progenitores hemotopoyéticos será diferente dependiendo de la enfermedad de base del paciente35. Aquellas enfermedades de base que comporten una alteración más prolongada del sistema inmunitario se relacionarán con un mayor riesgo de infección fúngica invasora. Además las enfermedades de base más agresivas o con peor pronóstico se asociarán a mayor complejidad y número de complicaciones pos-trasplante, que actuarán a su vez como factores predisponentes adicionales de infección fúngica.
Las características del trasplante tienen también un impacto en el riesgo de padecer aspergilosis invasora en un período precoz pos-trasplante. El grado de compatibilidad entre el donante y el receptor está directamente relacionado con la alteración inmunitaria del receptor. A mayor disparidad del HLA entre el donante y el receptor, mayor será el grado de rechazo del injerto, lo que implicará una mayor reacción de las células T y una mayor necesidad de inmunosupresión. Las técnicas de trasplante más agresivas también producirán una mayor alteración del sistema inmunitario condicionando un mayor riesgo de micosis invasora36.
Las citopenias, la enfermedad por citomegalovirus (CMV), la enfermedad de injerto contra el huésped y el uso de corticoesteroides son factores de riesgo relacionados con el tratamiento o con complicaciones pos-trasplante tanto para aspergilosis como para candidiasis invasora. Como ya se ha comentado previamente, una disminución de neutrófilos, linfocitos y monocitos se relaciona con una menor capacidad del huésped de hacer frente a la infección fúngica, ya que todas estas células son esenciales para construir una respuesta inmunitaria. La relación entre la enfermedad por CMV y la aspergilosis invasora es bien conocida3. Esta asociación se había atribuido a la neutropenia relacionada con el ganciclovir, el uso de corticoesteroides en la mayoría de pacientes con CMV o a la incapacidad para seleccionar un modelo que permitiera diferenciar entre los factores de riesgo de infección fúngica invasora y CMV. Sin embargo, en los últimos años se ha descubierto que CMV posee algunos efectos moduladores del sistema inmune que de per se facilitan la infección fúngica. Entre estos factores destaca que CMV altera la habilidad de los linfocitos y monocitos para producir una respuesta inmunitaria mediada por citoquinas que dependen de la respuesta linfocitaria Th137. Además CMV es capaz de producir por sí mismo IL-10 idéntica a la IL-10 humana38,39. La enfermedad de injerto contra el huésped está mediada por una alteración en la respuesta inmunológica con una importante alteración en el balance de la respuesta mediada por linfocitos T, alterando la capacidad de respuesta del sistema inmune frente a la infección. El último factor predisponente de ambas infecciones fúngicas es el uso de corticoides40. Previamente hemos descrito los múltiples efectos de los corticoides sobre la respuesta inmunológica del huésped. Nos gustaría añadir que el uso de corticoides se ha asociado a un mayor crecimiento de especies de Aspergillus in vitro y a un aumento en la capacidad de adherencia a las mucosas.
Otros factores favorecedores de la infección por Aspergillus son los virus respiratorios y un número elevado de transfusiones sanguíneas. Los virus respiratorios producen una ruptura de la mucosa respiratoria que favorece la invasión por Aspergillus cuando el paciente está colonizado. Además, estos virus tienen la capacidad de modular de la respuesta inmunológica, que al igual que CMV, produciendo de per se IL-1041. Muy recientemente se han descrito casos de aspergilosis invasora como complicación de una infección del virus pandémico de influenza A(H1N1)42,43. Este virus, comparado con otros virus influenza, posee una mayor capacidad de destrucción del epitelio pulmonar44 y produce una alteración en los niveles de citoquinas pulmonares y sistémicos, en especial, una elevación persistente de IL-1044,45. El virus pandémico influenza A(H1N1) también altera la función de los macrófagos dificultando la acción del sistema inmunitario45.
Por último, un elevado número de trasfusiones sanguíneas se ha relacionado también con una respuesta inmunitaria que consiste en una estimulación de la respuesta Th2 y como consecuencia en una producción de IL-10, dificultando la respuesta del huésped frente a la infección46,47.
Comentarios finalesEl conocimiento de la patogenia de los hongos y de la respuesta inmunológica del huésped es imprescindible para optimizar el manejo de estas infecciones. El huésped juega un papel fundamental en la protección frente a las micosis invasoras. La capacidad del hongo de producir infección dependerá en muchas ocasiones de la aptitud del huésped para crear una buena respuesta inmunológica. Algunos factores intrínsecos al huésped, como los diferentes polimorfismos de los RRP, se asocian a un mayor riesgo de micosis invasora. Esta información deberá incorporarse progresivamente para establecer los grupos de pacientes de mayor riesgo de padecer estas infecciones y que, por tanto, son tributarios a medidas tales como la profilaxis antifúngica. Los factores de riesgo clásicos de infección fúngica invasora están a menudo en relación con una disfunción del sistema inmunológico. Restaurar en lo posible la inmunidad del paciente es un factor clave para la prevención y el tratamiento de estas infecciones.
Esta revisión ha sido realizado en parte gracias a las ayudas de la Red de Investigación de Enfermedades Infecciosas (REIPI RD06/0008) y de las becas del Fondo de Investigación Sanitaria (FIS 10/01318) del Instituto de Salud Carlos III (Madrid).
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.