Las quinolonas actúan inhibiendo enzimas (topoisomerasas) indispensables en la síntesis del ADN y probablemente por fragmentación del ADN cromosómico. Tienen una actividad bactericida que depende de la concentración. Su espectro se ha ido ampliando, sobre todo desde la introducción de un átomo de flúor en la posición 6 (fluoroquinolonas).
Se usan en una gran variedad de infecciones como tratamiento de elección o alternativo, tanto en el ámbito hospitalario como extrahospitalario. Según el compuesto, se emplean en infecciones del tracto urinario, enfermedades de transmisión sexual, osteomielitis crónica, infecciones del tracto respiratorio e infecciones sistémicas graves, entre otras.
El surgimiento y la extensión de resistencia a quinolonas han limitado su uso en algunos casos y puede condicionarlo en el futuro en otros. Existen estrategias para minimizar la extensión de la resistencia.
Son bien toleradas y seguras; los efectos adversos más frecuentes se dan a nivel gastrointestinal y del sistema nervioso central.
Quinolones act by inhibiting enzymes (topoisomerases) that are essential for DNA synthesis, and probably by fragmentation of chromosomal DNA. The bactericidal activity of these drugs depends on their concentration. Their spectrum has been broadened, particularly since the introduction of a fluorine atom at position 6 (fluorquinolones).
Quinolones are used in a large variety of in-hospital and community infections, as the treatment of choice or as alternative therapy. Depending on the specific compound, they are used in urinary tract infections, sexually transmitted diseases, chronic osteomyelitis, respiratory tract infections, and severe systemic infections, among others.
The emergence and spread of resistance to quinolones has limited their use in some conditions and may affect their application in the future. Strategies currently exist to minimize the spread of resistance.
Quinolones are well tolerated and safe. The most common adverse effects involve the gastrointestinal tract and central nervous system.
En los años sesenta del siglo pasado se introdujo en clínica el ácido nalidíxico, la primera quinolona usada como antiinfeccioso. Sin embargo, la importancia de este grupo radica en las modificaciones estructurales que, a partir de finales de los años setenta, se introdujeron en el núcleo de la molécula de la 4-quinolona y que han dado lugar a un gran número de agentes antibacterianos. Aunque se pretende hacer una revisión general de las quinolonas, me referiré sobre todo a las fluoroquinolonas más usadas en España.
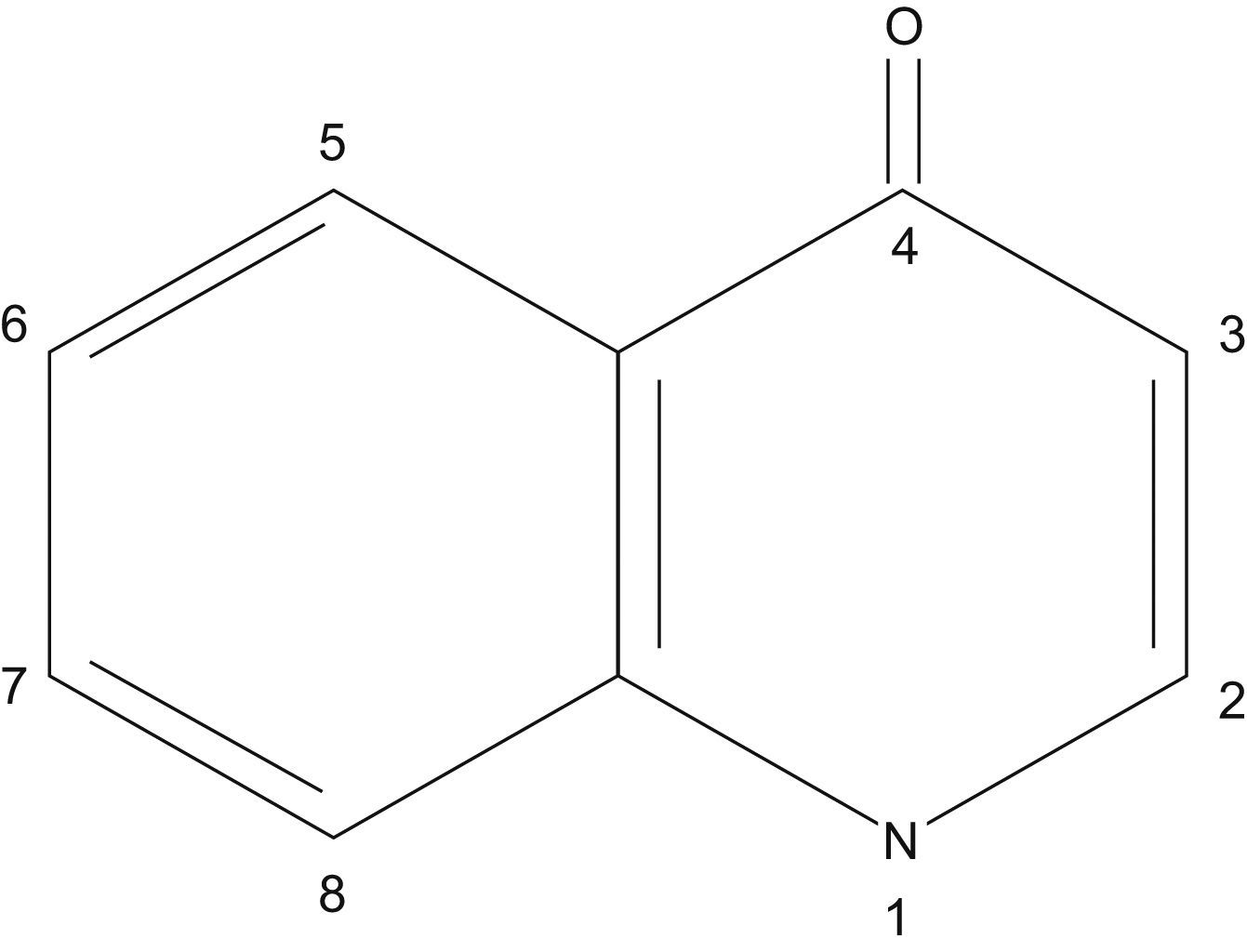
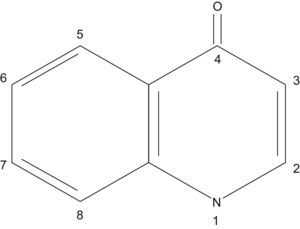
Estructura química y clasificaciónLas quinolonas de uso clínico tienen una estructura formada por dos anillos, con un nitrógeno en la posición 1, un grupo carbonilo en la posición 4 y un grupo carboxilo en la posición 3 (fig. 1). La potencia y el espectro aumentan de manera significativa cuando llevan un átomo de flúor en la posición 6, posiblemente porque mejora la penetración en tejidos y la unión a las topoisomerasas bacterianas. Frente a bacterias gramnegativas también aumenta la potencia si en la posición 7 hay un grupo piperacínico (norfloxacino, ciprofloxacino) o un grupo metil-piperacínico (ofloxacino, levofloxacino, gatifloxacino). Además, sustituyentes metilo en el grupo piperacínico mejoran la biodisponibilidad oral. Los compuestos que llevan en la posición 7 un doble anillo derivado del anillo pirrolidónico aumentan su actividad sobre bacterias grampositivas (moxifloxacino). Un grupo metoxi en la posición 8 mejora la actividad frente a anaerobios (moxifloxacino, gatifloxacino)1,2.
Al igual que las cefalosporinas, las quinolonas pueden clasificarse por su espectro de actividad en generaciones3. Las de primera generación (ácido nalidíxico, ácido pipemídico), poco usadas actualmente, tienen actividad frente a enterobacterias y algún otro gramnegativo y son prácticamente inactivas frente a grampositivos, patógenos atípicos y anaerobios. Alcanzan valores bajos en suero, su distribución sistémica es baja y sólo se pueden usar para tratamiento de algunas infecciones urinarias. A partir de aquí ya incorporan un átomo de flúor en la posición 6 y se llaman fluoroquinolonas. Las de segunda generación (norfloxacino) presentan una mucho mayor actividad frente a gramnegativos, incluida Pseudomonas aeruginosa, son activas frente a algunos patógenos atípicos, pero tienen moderada actividad frente a grampositivos y prácticamente nula frente a anaerobios. Las concentraciones en suero y muchos tejidos son bajas, por lo que no se suelen usar en infecciones sistémicas. Las de tercera generación (ciprofloxacino, ofloxacino, levofloxacino) mantienen las características de las de segunda pero además tienen una mejor absorción por vía oral y mejor actividad frente a P. aeruginosa, grampositivos y patógenos atípicos. Por sus propiedades farmacocinéticas éstas y las de la siguiente generación pueden usarse para el tratamiento de infecciones sistémicas. Las de cuarta generación (moxifloxacino) aportan una mejora en la actividad frente a grampositivos y además una actividad buena frente a anaerobios, aunque disminuye su actividad frente a P. aeruginosa.
Levofloxacino, incluido entre las de tercera generación, es más activo que otras de su grupo frente a grampositivos y su pico sérico, principalmente con dosis diarias de 750–1.000mg, es lo suficientemente alto como para obtener un buen índice terapéutico frente a estos microorganismos.
Farmacocinética y farmacodinámicaSe absorben rápido y bien tras administración oral, su biodisponibilidad es de buena a excelente, en casi todos los casos superior al 50% y en algunos cercana al 100%. En las de administración por vía oral e intravenosa los valores en suero tras la administración oral son parecidos a los que se alcanzan tras la administración por vía intravenosa, lo que tiene como ventaja la posibilidad de uso en terapia secuencial.
Alcanzan sus valores máximos en 1–2h. Las concentraciones máximas en suero son bajas en el caso del ácido pipemídico y norfloxacino, y de 2–7mg/l para las de tercera y cuarta generación.
La unión a proteínas plasmáticas es baja, en general entre un 20–50%, y se unen principalmente a albúmina.
La vida media plasmática varía de 1,5 a 17h.
Las fluoroquinolonas se distribuyen ampliamente por el organismo. El volumen de distribución es alto, de 1 a más de 4l/kg, en muchos casos superior al volumen total de agua del cuerpo, lo que supone que alcanzan concentraciones intracelulares altas. Su concentración en tejido prostático, bilis, pulmón, neutrófilos y macrófagos es superior a la sérica. Sus valores en saliva, secreciones bronquiales y fluido prostático son menores que en suero. La concentración en el líquido cefalorraquídeo (LCR) es, en general, inferior a la mitad de la concentración sérica.
Varias se eliminan mayoritariamente por vía renal (ácido pipemídico, ofloxacino, levofloxacino), otras por vías no renales (moxifloxacino) y otras por ambas vías (norfloxacino, ciprofloxacino). Las fluoroquinolonas se excretan en parte por la pared intestinal, lo que explica su eficacia en procesos diarreicos.
Dependiendo del porcentaje de eliminación renal de cada compuesto, deberá o no ajustarse la dosis en caso de insuficiencia renal. Cuando el filtrado glomerular está por debajo de 50 se recomienda reducir la dosis de ofloxacino y levofloxacino, y cuando está por debajo de 30, de norfloxacino y ciprofloxacino.
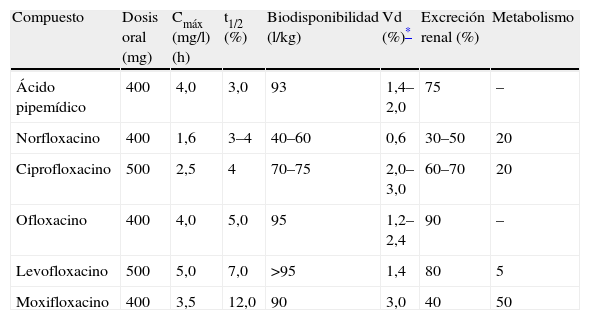
En la tabla 1 pueden observarse algunos parámetros farmacocinéticos de las quinolonas más usadas en España4.
Algunos parámetros farmacocinéticos de las quinolonas más usadas en España
| Compuesto | Dosis oral (mg) | Cmáx (mg/l) (h) | t1/2 (%) | Biodisponibilidad (l/kg) | Vd (%)* | Excreción renal (%) | Metabolismo |
| Ácido pipemídico | 400 | 4,0 | 3,0 | 93 | 1,4–2,0 | 75 | – |
| Norfloxacino | 400 | 1,6 | 3–4 | 40–60 | 0,6 | 30–50 | 20 |
| Ciprofloxacino | 500 | 2,5 | 4 | 70–75 | 2,0–3,0 | 60–70 | 20 |
| Ofloxacino | 400 | 4,0 | 5,0 | 95 | 1,2–2,4 | 90 | – |
| Levofloxacino | 500 | 5,0 | 7,0 | >95 | 1,4 | 80 | 5 |
| Moxifloxacino | 400 | 3,5 | 12,0 | 90 | 3,0 | 40 | 50 |
Cmáx: concentración máxima en suero; t1/2: semivida plasmática; Vd: volumen de distribución.
Las quinolonas tienen una actividad bactericida rápida que depende de la concentración. En los antibióticos cuya actividad depende de la concentración se consideran parámetros importantes para predecir la respuesta antimicrobiana y en último caso el éxito clínico, y posiblemente también la capacidad de selección de resistencias, el cociente de la concentración máxima en suero (Cmáx) y la concentración inhibitoria mínima (CIM). La eficacia frente a gramnegativos es óptima si el cociente Cmáx/CIM es al menos 125. Otro parámetro farmacodinámico usado es el cociente del área bajo la curva de concentración sérica-tiempo y la CIM (AUC/CIM), que debe ser mayor de 125 para gramnegativos, aunque para neumococo se han propuesto valores >306,7. Por tanto, deben dosificarse para optimizar los parámetros Cmáx/CIM y AUC/CIM, ambos ligados a eficacia clínica8.
En general, en las fluoroquinolonas la concentración mínima bactericida (CMB) es similar a la CIM y hay pocas diferencias de CIM al aumentar el inóculo, con la excepción de Pseudomonas.
Las fluoroquinolonas tienen un efecto postantibiótico (EPA) de 3-6h en estafilococos, algunas enterobacterias y P. aeruginosa. En microorganismos a los que matan muy rápidamente, como las especies de Haemophilus o E. coli, prácticamente no tienen EPA.
Interacciones con otros fármacosLas quinolonas presentan interacciones con otros fármacos9. Cuando entre las 2–4h de su administración oral se ingieren productos que contienen cationes del tipo de calcio, aluminio, magnesio, hierro o zinc, como pueden ser antiácidos, suplementos nutricionales, suplementos minerales o multivitamínicos o sucralfato, la concentración sérica de las quinolonas puede reducirse entre un 25–90%.
Las quinolonas pueden incrementar el efecto anticoagulante de la warfarina y los valores de cafeína, ciclosporina y teofilina. También pueden aumentar el riesgo de convulsiones y de estimulación del sistema nervioso central al usarse concomitantemente con antiinflamatorios no esteroideos. Además, pueden provocar hipoglucemia o hiperglucemia al usarse con antidiabéticos orales o con insulina.
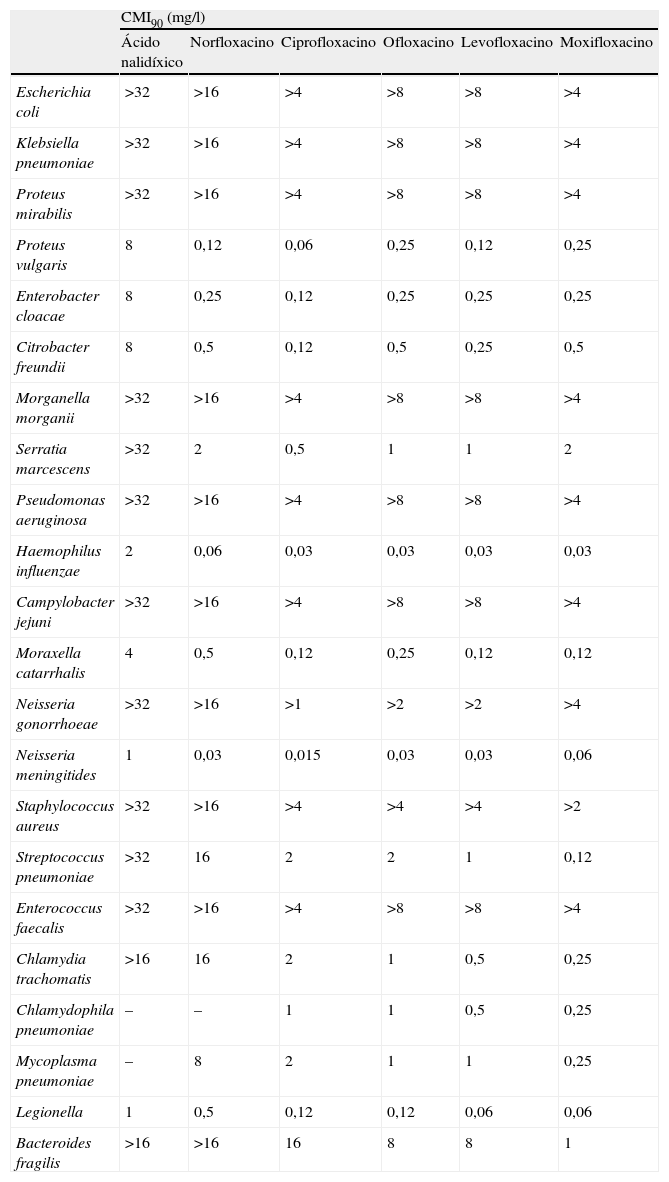
Espectro de actividadEn la tabla 2 se puede observar una recopilación sobre la actividad antibacteriana de las quinolonas más frecuentemente usadas en nuestro país. Se han tomado datos propios y de varias referencias, por lo que los aislados representan una población heterogénea y en algún caso puede haber diferencias metodológicas entre los estudios.
Actividad in vitro de las principales quinolonas usadas en España frente a varios de los patógenos más importantes en la clínica
| CMI90 (mg/l) | ||||||
| Ácido nalidíxico | Norfloxacino | Ciprofloxacino | Ofloxacino | Levofloxacino | Moxifloxacino | |
| Escherichia coli | >32 | >16 | >4 | >8 | >8 | >4 |
| Klebsiella pneumoniae | >32 | >16 | >4 | >8 | >8 | >4 |
| Proteus mirabilis | >32 | >16 | >4 | >8 | >8 | >4 |
| Proteus vulgaris | 8 | 0,12 | 0,06 | 0,25 | 0,12 | 0,25 |
| Enterobacter cloacae | 8 | 0,25 | 0,12 | 0,25 | 0,25 | 0,25 |
| Citrobacter freundii | 8 | 0,5 | 0,12 | 0,5 | 0,25 | 0,5 |
| Morganella morganii | >32 | >16 | >4 | >8 | >8 | >4 |
| Serratia marcescens | >32 | 2 | 0,5 | 1 | 1 | 2 |
| Pseudomonas aeruginosa | >32 | >16 | >4 | >8 | >8 | >4 |
| Haemophilus influenzae | 2 | 0,06 | 0,03 | 0,03 | 0,03 | 0,03 |
| Campylobacter jejuni | >32 | >16 | >4 | >8 | >8 | >4 |
| Moraxella catarrhalis | 4 | 0,5 | 0,12 | 0,25 | 0,12 | 0,12 |
| Neisseria gonorrhoeae | >32 | >16 | >1 | >2 | >2 | >4 |
| Neisseria meningitides | 1 | 0,03 | 0,015 | 0,03 | 0,03 | 0,06 |
| Staphylococcus aureus | >32 | >16 | >4 | >4 | >4 | >2 |
| Streptococcus pneumoniae | >32 | 16 | 2 | 2 | 1 | 0,12 |
| Enterococcus faecalis | >32 | >16 | >4 | >8 | >8 | >4 |
| Chlamydia trachomatis | >16 | 16 | 2 | 1 | 0,5 | 0,25 |
| Chlamydophila pneumoniae | – | – | 1 | 1 | 0,5 | 0,25 |
| Mycoplasma pneumoniae | – | 8 | 2 | 1 | 1 | 0,25 |
| Legionella | 1 | 0,5 | 0,12 | 0,12 | 0,06 | 0,06 |
| Bacteroides fragilis | >16 | >16 | 16 | 8 | 8 | 1 |
Las fluoroquinolonas son claramente más activas frente a bacterias gramnegativas (enterobacterias, Haemophilus influenzae, Neisseria spp. y Moraxella catarrhalis) que las primeras quinolonas, como el ácido nalidíxico o el ácido pipemídico. Además, presentan actividad frente a P. aeruginosa y frente a bacterias grampositivas, aunque en diferentes grados (tabla 2). Frente a gramnegativos, la más potente, en general, es ciprofloxacino. Frente a P. aeruginosa las más activas son ciprofloxacino y levofloxacino, que son las que se deben emplear en esta especie.
Algunas fluoroquinolonas son activas in vitro frente a Stenotrophomonas maltophilia. Las más activas son levofloxacino y moxifloxacino. Frente a especies de Acinetobacter su actividad es mediocre, aproximadamente son activas frente a la mitad de las cepas, con tendencia a incrementarse la resistencia en el tiempo, sobre todo en cepas multirresistentes. Tienen una actividad marginal, con CMI altas, frente a Burkholderia cepacia.
Las de tercera generación, como ciprofloxacino y ofloxacino, tienen una actividad regular frente a grampositivos. No se recomiendan en monoterapia para las infecciones causadas por estos gérmenes, por la posibilidad de un rápido surgimiento de resistencia. Levofloxacino y, sobre todo, moxifloxacino tienen claramente aumentada su actividad frente a grampositivos (estafilococos, estreptococos y otros). Los estafilococos resistentes a la meticilina suelen ser resistentes a todas las quinolonas, e incluso si alguno es sensible la utilidad clínica de estos compuestos es más que dudosa. Frente a neumococo la más activa es moxifloxacino. Moxifloxacino es además activo frente a anaerobios, mientras que otras quinolonas tienen una limitada actividad.
La actividad de las fluoroquinolonas frente a enterococos es regular o pobre, con mayores porcentajes de sensibilidad en Enterococcus faecalis que en Enterococcus faecium.
Frente a Listeria monocytogenes levofloxacino y moxifloxacino son más activos que ciprofloxacino.
Existen fluoroquinolonas activas frente a algunas micobacterias, entre las que se incluye Mycobacterium tuberculosis. Frente a esta especie, moxifloxacino es más activo que levofloxacino y ciprofloxacino.
Las fluoroquinolonas no son activas frente a Treponema pallidum, pero sí frente a Legionella pneumophila (similar actividad de ciprofloxacino, levofloxacino y moxifloxacino), Chlamydophila pneumoniae y Mycoplasma pneumoniae (moxifloxacino algo más activo que ciprofloxacino y levofloxacino)10.
Mecanismos de acción y resistenciaComo en otros antibióticos, el mecanismo de acción es complejo. Actúan en el ADN cromosómico bacteriano, uniéndose a algunas de las topoisomerasas e inhibiendo su acción11,12. Las topoisomerasas son enzimas que participan en el proceso de síntesis del ADN, por desenrollamientos y enrollamientos del ADN cromosómico. En gramnegativos la topoisomerasa que inhiben principalmente es la ADN-girasa, que tiene una subunidad A y una subunidad B. La función más importante de la ADN-girasa es mantener un nivel de enrollamiento del ADN que facilite el movimiento hacia los complejos que se forman en la replicación y la transcripción. También libera enrollamientos negativos en un proceso dependiente de ATP. En la girasa las quinolonas interaccionan con aminoácidos de las alfa-hélices cercanas a la tirosina del centro activo, que está implicado en la rotura del ADN. En grampositivos la principal diana es la topoisomerasa IV, que tiene 2 subunidades: ParC y ParE. La topoisomerasa IV separa las hebras de ADN tras cada replicación. También tiene una actividad relajante sobre la cadena de ADN.
Un paso importante en el mecanismo de acción de las quinolonas es la formación de un complejo quinolona-enzima-ADN que contiene ADN roto. La unión de una quinolona a la ADN-girasa provoca un cambio conformacional en el complejo girasa-ADN causante de la inhibición del enzima. La topoisomerasa IV formaría complejos similares a los que se forman con la girasa.
Su acción sobre las topoisomerasas, aunque necesaria, no explica por sí sola su acción bactericida rápida. Deben tener lugar acontecimientos posteriores, pero su mecanismo íntimo se desconoce. Recientemente se ha propuesto la fragmentación del cromosoma como responsable de su acción letal rápida12.
El mecanismo más importante de resistencia es por alteración de su diana13. Alteraciones en alguna de las subunidades de la ADN-girasa o de la topoisomerasa IV son los mecanismos más prevalentes. Mutaciones en gyrA, el gen que codifica la subunidad A de la ADN girasa, es el mecanismo más común en gramnegativos, mientras que mutaciones en parC, el gen que codifica la subunidad C de la topoisomerasa IV, es el mecanismo más frecuente en grampositivos. Sin embargo, en el caso específico de algunas quinolonas (gemifloxacino, por ejemplo) mutaciones en gyrA de grampositivos parecen ser el principal mecanismo de resistencia. Mutaciones que afectan a la subunidad B de la ADN girasa y a la subunidad E de la topoisomerasa IV también se han observado, pero mucho menos, y con frecuencia secundarias a mutaciones en las otras 2 subunidades. Las mutaciones suelen darse en una región concreta de esos genes que se denomina QRDR (región determinante de la resistencia a quinolonas, del inglés quinolone resistance-determining region) y que en GyrA está entre los aminoácidos 67 y 106. Cambios en los aminoácidos en la QRDR alteran la estructura del sitio al que se unen las quinolonas en el complejo girasa-ADN y la resistencia se debe a disminución de la afinidad de la quinolona por dicho complejo14.
Recientemente, se han descrito mecanismos de resistencia mediados por plásmidos15,16, como las proteínas Qnr, pertenecientes a la familia de los pentapéptidos repetidos, que se caracterizan por la presencia de repeticiones en tándem de una serie semiconservada de 5 aminoácidos. Hasta la fecha se han descrito varios tipos de Qnr codificados por genes de origen plasmídico: qnrA, qnrB, qnrC y qnrS. Su mecanismo de acción, basado en la protección de la ADN-girasa y de la topoisomerasa IV, se ha estudiado con mucho detalle en cepas que poseen el gen qnrA1, y aunque se presume un modo de acción similar para el resto de las proteínas Qnr, aún se requieren estudios que expliquen con detalle esta acción17. Otro mecanismo plasmídico es la enzima AAC(6’)-Ib-cr, variante de una acetil-transferasa, capaz de modificar al ciprofloxacino y otras quinolonas con un sustituyente piperacinilo, reduciendo su actividad. Ambos mecanismos mediados por plásmidos proporcionan un bajo nivel de resistencia que facilita el surgimiento y selección de niveles mayores de resistencia en presencia de quinolonas16,18.
En grampositivos la resistencia se produce por pasos. En general, una primera mutación ocurre en el gen de la topoisomerasa IV produciéndose como consecuencia ligeros aumentos de las CIM. Una segunda mutación, preferentemente en gyrA, resultará en un mayor aumento de las CIM, que haría que la bacteria fuese resistente a todas las quinolonas. El uso de fluoroquinolonas que actúan en ambas topoisomerasas, la II y la IV, tales como moxifloxacino, puede tener ventajas sobre otras en la prevención de la resistencia por disminuir la posibilidad de selección de mutantes con algún grado de resistencia11.
Se ha descrito en bacterias gramnegativas resistencia de bajo nivel por alteraciones en la permeabilidad, en concreto debido a pérdidas o alteraciones de porinas que hay en la membrana externa19. Se ha constatado que la sobreexpresión de bombas de expulsión activa puede llevar a resistencia a quinolonas, tanto en grampositivos como en gramnegativos20. La magnitud de los aumentos de CIM que resultan de la sobreexpresión de genes que codifican proteínas de bombas de expulsión depende de cada quinolona y de cada sistema de expulsión.
Varios mecanismos pueden coexistir en la misma cepa.
Indicaciones clínicas y dosificaciónPor su espectro de actividad y potencia, las fluoroquinolonas se usan para el tratamiento de una gran variedad de infecciones, tanto en el medio hospitalario como en el ámbito extrahospitalario. A continuación, se exponen las principales.
La terapia por vía intravenosa se prefiere para pacientes con infecciones graves o malabsorción intestinal. Fuera de estos casos, se prefiere la vía oral por la facilidad de administración, el menor riesgo de efectos adversos y el menor coste.
Infecciones del tracto urinarioPor su actividad frente a enterobacterias, las principales causantes de infecciones urinarias, y porque varias se eliminan de forma significativa por vía renal, norfloxacino, ciprofloxacino, ofloxacino y levofloxacino se han usado y mostrado eficaces en estas infecciones21. En pacientes con infecciones agudas no complicada o complicadas se han mostrado al menos tan eficaces como cotrimoxazol y más eficaces que algunos betalactámicos22,23.
En España, hace años que las quinolonas se han usado con profusión para tratar infecciones urinarias, observándose un aumento de la resistencia con el tiempo (véase apartado «Problemas de resistencia»). Por los problemas de resistencia, se debería, a mi juicio, dejar de usarse en la mayoría de las cistitis no complicadas y reservarse para infecciones complicadas.
En mujeres con pielonefritis no complicada, tratamientos de 7 a 10 días con fluoroquinolonas han demostrado eficacia similar a la de cotrimoxazol.
También se han usado en profilaxis de infecciones recurrentes y han sido muy eficaces.
En infecciones urinarias complicadas, con frecuencia causadas por bacilos gramnegativos resistentes a antibióticos, incluida P. aeruginosa, se consideran uno de los tratamientos de primera elección, especialmente ciprofloxacino. En este ámbito, el problema ha sido el surgimiento de resistencias24.
Son muy útiles en pacientes hospitalizados por infecciones urinarias por la posibilidad de reemplazar la terapia por vía intravenosa por la oral (reducción de hospitalización y de costes).
Las fluoroquinolonas penetran bien y se concentran en tejido prostático, con valores inferiores en líquido prostático. La prostatitis es una infección difícil de tratar, ya que muchos antibióticos no penetran bien en tejido prostático. Con las quinolonas usadas durante 4–6 semanas se han obtenido porcentajes de curación del 65–90%, iguales o superiores a los obtenidos con otros compuestos. Los fracasos del tratamiento se han asociado sobre todo al aislamiento de bacterias como P. aeruginosa o enterococo.
Infecciones de transmisión sexualEl tratamiento de estas infecciones suele ser empírico y ambulatorio. La mayoría de la fluoroquinolonas son activas frente a gonococo, C. trachomatis y micoplasmas y ureaplasmas genitales.
Dosis única de varias fluoroquinolonas (ciprofloxacino, ofloxacino y otras) son muy eficaces para tratar uretritis y cervicitis gonocócica no complicada y como tal se han usado como uno de los tratamientos de elección, otros son ceftriaxona y cefixima25. También se han mostrado eficaces en infecciones gonocócicas rectales y algo menos (<90%) en faringitis gonocócica. El surgimiento y la extensión de resistencia a fluoroquinolonas del gonococo han limitado su uso en algunas áreas, de hecho los Centers for Disease Control (CDC) desde 2007 ya no recomienda en EE. UU. su uso empírico para el tratamiento de la gonorrea26. La alta prevalencia de resistencia en España desaconseja también su uso para tratamiento empírico de gonorrea.
Ofloxacino o levofloxacino durante 7 días se consideran el tratamiento alternativo de uretritis no gonocócica25.
En infecciones por C. trachomatis, las dosis únicas han fracasado y se han usado tratamientos a las dosis estándar durante 7 días con ofloxacino o levofloxacino, con resultados semejantes a los antibióticos con que se comparaban. Se consideran un tratamiento alternativo25.
También se han usado para tratamiento de la enfermedad inflamatoria pélvica, un síndrome producido por microorganismos entre los que pueden incluirse algunos patógenos de transmisión sexual, como gonococo o clamidia. Los CDC recomiendan actualmente como tratamiento parenteral alternativo y oral de elección la combinación de levofloxacino u ofloxacino con metronidazol25, aunque debería revisarse esta indicación por la resistencia del gonococo.
Infecciones gastrointestinalesEn principio, tenían una excelente actividad in vitro frente a los principales patógenos causantes de gastroenteritis (Salmonella, Shigella, E. coli, Campylobacter y otros) por lo que se han usado profusamente en esta afección. Algunas quinolonas alcanzan en el intestino concentraciones muy superiores a los séricos y una parte se elimina por bilis. Por las anteriores razones, se han usado con eficacia para tratar la minoría de casos de gastroenteritis que requieren tratamiento antibiótico, así como para eliminar portadores de Salmonella. Sin embargo, han surgido problemas de resistencia, sobre todo en Campylobacter27.
Se han usado en prevención de diarrea del viajero con buenos resultados; aunque esta práctica no se recomienda, se prefiere tratar al comienzo de la diarrea28.
Infecciones intraabdominalesInfecciones hepatobiliares e intraabdominales se han tratado con ciprofloxacino u ofloxacino, generalmente en asociación con un anaerobicida como metronidazol o clindamicina. La terapia secuencial (por vía intravenosa u oral) de ciprofloxacino y metronidazol es una alternativa equivalente y más barata que piperacilina/tazobactam por vía intravenosa para el tratamiento de infecciones intraabdominales complicadas29.
Una de las recomendaciones de la Sociedad Americana de Enfermedades Infecciosas para tratar infecciones intraabdominales leves a moderadas incluye ciprofloxacino, levofloxacino o moxifloxacino en combinación con metronidazol, mientras que sólo ciprofloxacino combinado con metronidazol está recomendado para las infecciones graves30.
En pacientes con cirrosis, el uso de norfloxacino o de ciprofloxacino se ha mostrado eficaz para prevenir la peritonitis bacteriana espontánea31.
Infecciones óseas y de prótesis osteoarticularesLas fluoroquinolonas, por su amplio espectro de acción y sus propiedades farmacocinéticas, permiten realizar terapias extrahospitalarias que conllevan la reducción de costes y mejoran la calidad de vida de los pacientes.
La experiencia clínica acumulada, sobre todo con ciprofloxacino, y su seguridad las convierte en uno de los mejores antibióticos para tratamiento de osteomielitis crónica. En las producidas por enterobacterias hay quien las considera de primera elección, mientras que son alternativa en las producidas por P. aeruginosa y Staphylococcus aureus, por los problemas de surgimiento de resistencia durante el tratamiento que implican persistencia de la infección32,33.
Combinadas con rifampicina se han usado para el tratamiento de prótesis osteoarticulares infectadas34.
Infecciones de piel y tejidos blandosAunque empleadas en varios tipos de estas infecciones, en muchos casos con resultados aceptables, actualmente no son el tratamiento de elección en la mayoría, ni siquiera alternativa en el caso de infecciones producidas por estafilococos resistentes a meticilina, por resistencia o surgimiento de resistencia durante el tratamiento35.
En general, la monoterapia con uno de estos agentes no es adecuada, pero pueden ser útiles en combinación con otros antibióticos.
En infecciones en el pie del diabético, las fluoroquinolonas figuran entre las alternativas, solas o en combinación36.
Infecciones del tracto respiratorioEn el tratamiento de la neumonía nosocomial, causada frecuentemente por bacilos gramnegativos, se han obtenido buenos resultados clínicos, mejores en las producidas por enterobacterias que en las causadas por P. aeruginosa37. Ante la sospecha de P. aeruginosa se recomiendan a dosis altas y asociadas a otro antibiótico antipseudomónico. Por su activad frente a P. aeruginosa, ciprofloxacino ha sido la más usada en neumonía nosocomial, así como en las complicaciones infecciosas de la fibrosis quística, pero levofoxacino a dosis de 750mg también se ha mostrado eficaz38.
Ciprofloxacino, ofloxacino y otras quinolonas de tercera generación presentan una moderada actividad intrínseca frente a neumococo. Aunque se han usado en el tratamiento de infecciones respiratorias extrahospitalarias, no se deberían aconsejar por la posibilidad de surgimiento de resistencias o de sobreinfecciones. Sin embargo, existen actualmente quinolonas como levofloxacino, y sobre todo moxifloxacino, que cubren la gran mayoría de los posibles causantes de neumonía adquirida en la comunidad (NAC) (neumococo, tanto sensible como resistente a betalactámicos y macrólidos, H. influenzae, M. catarrhalis y microorganismos atípicos, como especies de Legionella, M. pneumoniae y C. pneumoniae). Tienen una excelente penetración en tejidos del aparato respiratorio y alcanzan concentraciones altas tanto en el líquido de revestimiento epitelial como en macrófagos alveolares39. Ambos lugares son importantes para tratar patógenos extracelulares e intracelulares. Por ello, se han usado en tratamiento de NAC y de exacerbación aguda de enfermedad pulmonar obstructiva crónica (EPOC), entre otras infecciones respiratorias.
Se han obtenido buenos resultados en NAC, similares a antibióticos clásicos en estudios clínicos comparativos40. Actualmente se incluyen como uno de los antibióticos de elección en algunos supuestos de NAC en varias guías41,42. En general, se usan de 7–10 días en el tratamiento de la NAC pero en un estudio reciente levofloxacino 750mg/24h durante 5 días se mostró tan eficaz como levofloxacino 500mg/24h durante 10 días para tratar NAC de leve a grave43.
Para Legionella las fluoroquinolonas serían el tratamiento dirigido de elección, mejor que eritromicina o claritromicina44.
En las exacerbaciones de la EPOC, con las de mayor actividad frente a neumococo (levofloxacino y moxifloxacino) se han obtenido en ensayos clínicos al menos tan buenos resultados como con los antibióticos con que se comparaban. En España, en una guía reciente de consenso figuran como tratamiento de elección en pacientes con exacerbación leve-moderada con comorbilidad y sin factores de riesgo de P. aeruginosa (moxifloxacino y levofloxacino) y en exacerbación grave o muy grave con sospecha de P. aeruginosa (levofloxacino y ciprofloxacino)45.
En rinosinusitis aguda bacteriana las nuevas fluoroquinolonas con actividad superior frente a neumococo también han demostrado ser eficaces, aunque sin aportar importantes ventajas a los antibióticos betalactámicos46. En un reciente consenso español figuran como tratamiento de elección (moxifloxacino y levofloxacino) en la rinosinusitis moderada, así como en la leve tratada previamente con antibióticos47.
En otitis externa maligna, causada por P. aeruginosa, ciprofloxacino es uno de los tratamientos de elección.
Infecciones por micobacteriasVarias fluoroquinolonas presentan buena actividad frente a M. tuberculosis, sobre todo levofloxacino y moxifloxacino. Los resultados de tratamiento con ellas han sido buenos. Se consideran fármacos de segunda línea. Cuando se han administrado en monoterapia se han dado casos de resistencia.
También se han empleado con éxito en infecciones producidas por algunas micobacterias no tuberculosas.
Portadores nasales de meningococoEn la mucosa nasal ciprofloxacino alcanza concentraciones muy por encima de la CIM frente a meningococo. Dosis única de 750mg o dosis de 500mg 2 veces en un único día son muy eficaces en la erradicación del estado de portador.
Infecciones ocularesVarias fluoroquinolonas en soluciones oftálmicas de alta concentración se han usado con éxito en el tratamiento de conjuntivitis y queratitis causadas por bacterias sensibles.
Infecciones sistémicas graves. Fiebre en pacientes neutropénicosCiprofloxacino y ofloxacino son tratamiento de elección en la fiebre tifoidea, donde se han mostrado al menos tan eficaces como otros tratamientos estándar, aunque se han informado aislados de Salmonella typhi resistentes al ácido nalidíxico y a fluoroquinolonas. En esta especie y, en general, en el género Salmonella en el caso de resistencia al ácido nalidíxico, se deben informar como resistentes a todas las fluoroquinolonas por la alta probabilidad de fracaso terapéutico cuando se usan estos agentes.
En pacientes con bacteriemia, el tratamiento con ciprofloxacino y ofloxacino ha sido eficaz, sobre todo en las causadas por enterobacterias y menos en las causadas por P. aeruginosa. No se considera actualmente un tratamiento empírico recomendado de la bacteriemia48, entre otros, por problemas de resistencia.
Las fluoroquinolonas más antiguas (ciprofloxacino, norfloxacino y ofloxacino), por su excelente actividad frente a gramnegativos y su pobre acción frente a anaerobios, son eficaces en eliminar los gramnegativos facultativos de la flora intestinal sin eliminar las bacterias anaerobias que previene de la colonización por bacterias nuevas. Se han usado con éxito en la profilaxis de infección en pacientes neutropénicos. En estos pacientes la profilaxis antibiótica reduce la mortalidad, los episodios febriles y las infecciones bacterianas49.
Indicaciones pediátricasPor sus posibles efectos adversos sobre huesos y cartílagos, las fluoroquinolonas no se han usado en niños. Sin embargo, por su actividad frente a P. aeruginosa y S. maltophilia, se usan cada vez más, sobre todo ciprofloxacino, en infecciones respiratorias en pacientes con fibrosis quística.
Ciprofloxacino fue aprobado hace poco por la Food and Drug Administration para uso en pacientes de 1–18 años de edad para tratamiento de infecciones urinarias complicadas por E. coli.
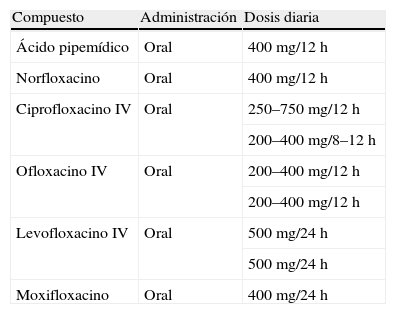
La dosificación habitual de algunas de las quinolonas de uso frecuente en nuestro país puede observarse en la tabla 34.
Dosificación habitual de algunas quinolonas de uso frecuente en España
| Compuesto | Administración | Dosis diaria |
| Ácido pipemídico | Oral | 400mg/12h |
| Norfloxacino | Oral | 400mg/12h |
| Ciprofloxacino IV | Oral | 250–750mg/12h |
| 200–400mg/8–12h | ||
| Ofloxacino IV | Oral | 200–400mg/12h |
| 200–400mg/12h | ||
| Levofloxacino IV | Oral | 500mg/24h |
| 500mg/24h | ||
| Moxifloxacino | Oral | 400mg/24h |
IV: vía intravenosa.
El surgimiento y la extensión de resistencia a las quinolonas dependerán del patógeno (que sea más o menos sensible de principio), del antibiótico (que sea más o menos activo), del lugar de la infección y la carga bacteriana (a mayor carga bacteriana, mayor probabilidad de surgimiento y posterior selección de mutantes resistentes), de la integridad de los mecanismos de defensa del hospedador y de la dosis usada (adecuada o baja), entre otros factores.
Hay una relación inversa entre concentración de quinolona y selección de mutantes resistentes, por lo que no se deberían infradosificar para evitar la selección de mutantes resistentes50. En general, cuanto más actividad tiene una quinolona más tarda en aparecer la resistencia clínica.
La resistencia se da por pasos, y esto es importante. La primera mutación espontánea ocurre a una frecuencia baja, aunque depende de cada especie. Por tanto, puede predecirse que las resistencias surgirán en tratamiento de infecciones por bacterias que no sean al principio muy sensibles a la quinolona usada (S. aureus, P. aeruginosa, por ejemplo) o que se den en lugares de más difícil acceso del antibiótico. Esto se confirma en un estudio multicéntrico de sensibilidad de P. aeruginosa de toda España, donde el 23% de los aislados eran resistentes a ciprofloxacino51. Otro estudio de casi 12.000 aislados clínicos de P. aeruginosa informaba del 27 y el 29% de cepas no sensibles a ciprofloxacino y levofloxacino, respectivamente52. Si sigue aumentando la resistencia, disminuirá su papel en la terapia empírica de infecciones potencialmente causadas por P. aeruginosa.
En E. coli aislados de orina de pacientes extrahospitalarios de España la resistencia global a ácido nalidíxico es del 20-30% y a las fluoroquinolonas del 10-20%, y se ha incrementado significativamente en los últimos años. Sin embargo, es muy probable que estos datos estén sesgados, ya que los laboratorios de microbiología no reciben muchas muestras de orina de infecciones urinarias no complicadas (se tratan de forma empírica y, en general, evolucionan bien), pero sí reciben un porcentaje importante de muestras de orina de recurrencias y de infecciones complicadas, en las que se aíslan las bacterias más resistentes53.
En aislados de E. coli de sangre y otras muestras invasivas, la resistencia a fluoroquinolonas en España en 2007 fue del 30,9%54, por lo que las fluoroquinolonas no estarían indicadas en el tratamiento empírico de bacteriemias en las que pueda estar implicado este patógeno.
Para evitar la extensión de la resistencia en E. coli sería aconsejable no utilizar, en general, quinolonas en aquellas cepas resistentes al ácido nalidíxico (ya tienen la primera mutación) para evitar que se seleccione más fácilmente una segunda mutación que las haría resistentes a todas las quinolonas55.
En otras enterobacterias aisladas frecuentemente en muestras clínicas, como Klebsiella pneumoniae o Proteus mirabilis, la prevalencia de resistencia supera el 10%.
Actualmente, más de la mitad de las cepas de Campylobacter que se aíslan en España son resistentes a quinolonas.
Su uso en animales por motivos terapéuticos o profilácticos, o como promotores del crecimiento, causa una presión selectiva en bacterias de origen animal que posteriormente pueden afectar a los humanos, bien por transmisión directa, bien a través de los alimentos56.
Efectos adversosLos efectos adversos más frecuentes que se dan en pacientes tratados con quinolonas son náuseas, trastornos del tracto gastrointestinal superior y efectos sobre el sistema nervioso central, tales como dolor de cabeza, insomnio y mareos. Estos efectos son leves, autolimitados y sólo raramente requieren la suspensión del tratamiento57.
Cada quinolona tiende a producir un perfil característico de efectos adversos.
Varias quinolonas (ciprofloxacino, norfloxacino, levofloxacino) se han asociado a daños en tendones, principalmente en el tendón de Aquiles, por un mecanismo no bien conocido58. Se pueden manifestar como tendinitis o rotura del tendón. La duración media de la terapia previa al comienzo de los síntomas era de 6 días58.
Otra manifestación de toxicidad al tejido conectivo es su acción sobre los cartílagos de conjunción, por lo que están contraindicadas en niños y embarazadas, salvo raras excepciones (infecciones pulmonares en niños con fibrosis quística, infecciones complicadas del tracto urinario o exposición a Bacillus anthracis)59,60.
Efectos neurotóxicos graves como alucinaciones, depresión y reacciones psicóticas son infrecuentes, pero se han informado en la terapia con varias quinolonas.
Hay datos sugerentes pero no concluyentes de que las fluoroquinolonas predisponen a los pacientes que las toman a enfermedad asociada a Clostridium difficile61.
Otros efectos adversos son alargamiento del intervalo QTc en el electrocardiograma, que puede precipitar arritmias ventriculares fatales, y rotura de tendones.
Se han retirado del mercado, o ni siquiera han llegado, algunas quinolonas a causa de problemas de fototoxicidad (clinafloxacino), toxicidad hepática (trovafloxacino) o cardíaca (grapafloxacino).
Esta revisión es una actualización de una previa realizada por el autor y publicada en Enferm Infecc Microbiol Clin. 2003;21:261–7.