Caso clínico
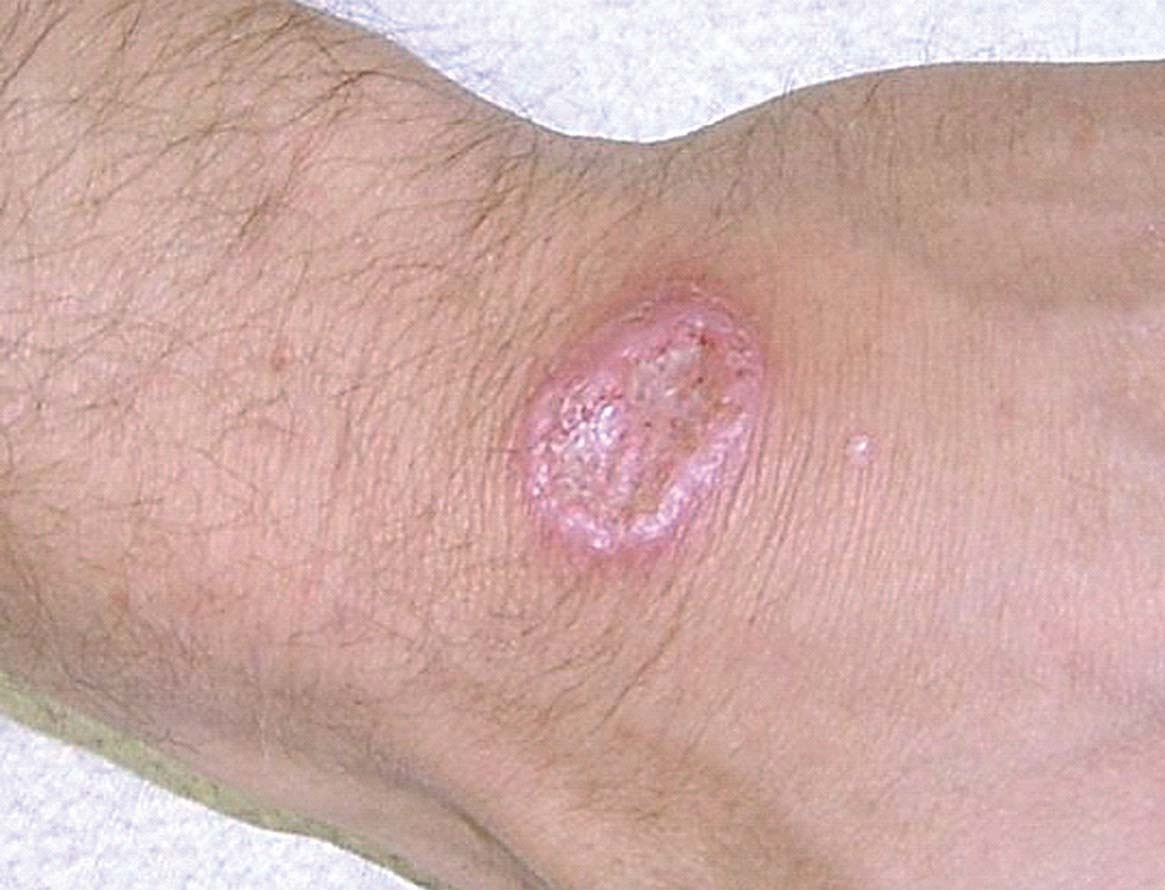
Varón de 30 años, español, sin antecedentes médicos de interés, que se desplazó a Costa Rica (provincia de Limón), donde residió en una zona forestal durante 3 meses por motivos profesionales. Como factores de riesgo epidemiológico ante un viaje a zona tropical refería un consumo esporádico de ceviche e ingesta de agua no siempre embotellada. No recibió ninguna vacuna previa al viaje ni profilaxis frente a la malaria e hizo un uso irregular de repelentes de insectos, motivo por el cual durante su estancia recibió numerosas picaduras de insectos en áreas expuestas, sobre todo en la cara y los brazos. Aproximadamente al mes de su estancia en Costa Rica notó la aparición de tres lesiones cutáneas sobre el dorso de ambas manos y en puente nasal que habían evolucionado a fase de pápula y finalmente úlcera, con bordes sobreelevados y eritematosos y fondo costroso (fig. 1). Fueron tratadas con antisépticos locales, pomadas con antibiótico y, por último, con cloxacilina oral durante una semana, sin presentar una evolución satisfactoria.
Figura 1. Úlcera central con bordes sobreelevados y fondo costroso.
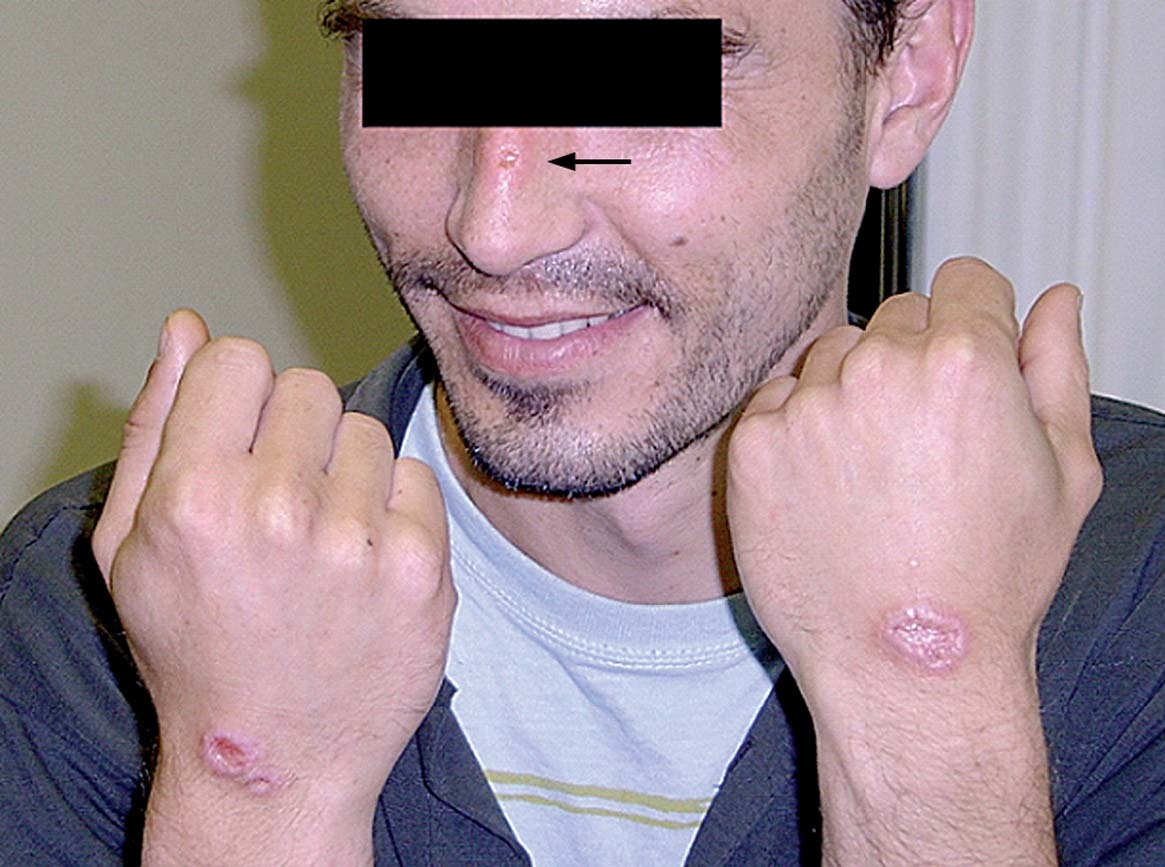
Dos meses después de regresar a España acudió a la consulta de Medicina Tropical para valoración de las tres lesiones ulceradas, de aproximadamente 3 cm de diámetro y no dolorosas (fig. 2). El paciente se encontraba asintomático, con buen estado general, sin adenopatías locorregionales y sin otro hallazgo a la exploración física.
Figura 2. Localización de las tres lesiones que presentaba el paciente.
Se realizaron las siguientes pruebas: biopsia de la lesión, para valoración anatomopatológica, estudio de reacción en cadena de la polimerasa (PCR) y cultivo de la muestra, y serología específica (inmunofluorescencia y técnica de inmunoabsorción ligada a enzimas [ELISA]).
Evolución
Ante la sospecha de leishmaniasis cutánea del Nuevo Mundo y hasta la confirmación diagnóstica se pautó tratamiento intralesional con antimoniales pentavalentes. El estudio anatomopatológico de la biopsia únicamente demostró un infiltrado crónico mínimamente granulomatoso. El cultivo de la muestra en medio NNN y la serología a Leishmania y a hongos regionales resultaron negativos; sin embargo, la PCR, con la secuenciación del fragmento obtenido tras amplificar parte del gen que codifica el SSU ARNr del material de biopsia fue determinante para la confirmación del diagnóstico de sospecha pero, sobre todo, para la confirmación de la especie con fines pronósticos, resultando ser Leishmania braziliensis. Este resultado se confirmó con otras dos técnicas de PCR dirigidas a amplificar secuencias diferentes (ITS y miniexón).
Ante la posibilidad de recidiva del cuadro o evolución a leishmaniasis mucocutánea se instauró tratamiento con antimoniales pentavalentes (Glucantime) por vía intravenosa en dosis de 20 mg Sb+5/kg y día durante 4 semanas, tras las cuales se obtuvo la curación y cicatrización de las lesiones.
Comentario
En Centroamérica las especies de Leishmania más frecuentes son L. mexicana, L. panamensis y L. braziliensis, teniendo interés pronóstico el diagnóstico de especie. La leishmaniasis mucocutánea es una de las formas de expresión que puede adquirir la parasitación por L. braziliensis, aunque ocasionalmente también se ha descrito en la parasitación por L. panamensis1.
Las presentaciones clínicas de las lesiones cutáneas son variables, dependiendo tanto de las especies parasitarias como del estado inmunológico del paciente. La lesión típica, similar a la de la fotografía, se describe como una úlcera central con bordes sobreelevados, que asemeja al cráter de un volcán, con fondo costroso por el exudado producido. A veces puede presentarse como una pápula más o menos escamosa, rodeada de pequeñas pápulas satélites, o como una lesión papulonodular con presentación esporotricoide por diseminación linfática (descrita tanto en las lesiones por L. braziliensis, como en las causadas por L. guyanensis y L. panamensis)2.
Aunque el diagnóstico de presunción de visu es fundamental, la variabilidad de las formas de presentación obligan a un diagnóstico diferencial con otras lesiones ulceradas del trópico, como infecciones micóticas (blastomicosis, paracoccidiomicosis, histoplasmosis), lesiones por micobacterias (tuberculosis, M. marinum o lepra), bacterianas (sobreinfecciones tras picaduras de artrópodos, carbunco), miasis u otras afecciones no infecciosas: neoplasias, granulomatosis de Wegener, sarcoidosis, lupus discoide eritematoso, entre otras3,4.
Las pruebas clásicas de demostración de la presencia del amastigote en la impronta de la lesión teñida con Giemsa o el cultivo en el medio NNN tienen una baja sensibilidad, especialmente en lesiones de varios meses de evolución5,6 y, en concreto, algunas especies como L. braziliensis o L. venezuelensis, presentan mayores dificultades para su cultivo in vitro2. El procedimiento actual con mayor sensibilidad es la PCR7, con la secuenciación del ADN de la subunidad pequeña ribosómica y dado que además aporta la determinación de especie, resulta el más adecuado, puesto que este dato es esencial para la elección de la pauta de tratamiento y su vía de administración.