El estándar de diagnóstico para SARS-CoV-2 es la reacción en cadena de la polimerasa (PCR). La Organización Mundial de la Salud recomendó el protocolo de Charité-Berlín para el diagnóstico de COVID-19; esta metodología implica tres PCR, limitando la capacidad de procesamiento y retrasando los resultados. Con el fin de reducir estas limitaciones, se validó una PCR dúplex para la detección del gen E y RNasa P.
MétodosSe comparó el límite de detección, sensibilidad y especificidad de la técnica de PCR dúplex (gen E más RNasa P), comparada contra el estándar monoplex (gen E), en muestras de ARN de un aislado de SARS-CoV-2 y de 88 especímenes clínicos, con resultados previamente conocidos. Se determinó la repetibilidad y reproducibilidad de los valores de ciclos umbrales (cycle threshold [Ct]), en dos laboratorios independientes de la Facultad de Medicina de la Universidad de Antioquia, usando reactivos y equipos diferentes.
ResultadosNo hay diferencias significativas (p = 0,84) en los resultados de Ct entre ambas estrategias. Al utilizar como referencia el gen E amplificado en monoplex, el análisis de concordancia demostró fuerte similitud entre las dos estrategias, con un coeficiente kappa de Cohen de 0,89, una sensibilidad del 90%, y una especificidad del 87%.
ConclusiónLa PCR dúplex no afecta la sensibilidad y especificidad informadas por el protocolo Charité, Berlín, siendo una herramienta útil para el cribado de SARS-CoV-2 en muestras clínicas.
Reverse transcriptase - polymerase chain reaction (RT-PCR) is the standard technique for SARS-CoV-2 diagnosis. The World Health Organization recommends the Charité-Berlin protocol for COVID-19 diagnosis, which requires triple PCR, limiting the process capability of laboratories and delaying the results. In order to reduce these limitations, a duplex PCR is validated for the detection of the E and RNase P genes.
MethodsWe compared the limit of detection, sensitivity and specificity of the duplex PCR technique (E gene and RNase P) against the monoplex standard (E gene) in RNA samples from a SARS-CoV-2 isolate and 88 clinical specimens with previously known results. The repeatability and reproducibility of the threshold cycle values (Ct) were determined in two independent laboratories of the Faculty of Medicine of the Universidad de Antioquia, using different reagents and real time instruments.
ResultsThere were no significant differences in the Ct results between both techniques (p = 0.84). Using the monoplex PCR of E gene as a reference, the interrater reliability analysis showed similarity between the two techniques, with a kappa coefficient of 0.89, the sensitivity and the specificity of duplex PCR were 90% and 87%, respectively.
ConclusionsDuplex PCR does not affect the sensitivity and specificity reported by the Charité, Berlin protocol, being a useful tool for SARS-CoV-2 screening in clinical samples.
A finales de diciembre del 2019, en la ciudad de Wuhan en la provincia de Hubei, China, se generó una alerta por el diagnóstico de pacientes con síntomas de neumonía de origen desconocido en diferentes entidades hospitalarias, los cuales estaban epidemiológicamente relacionados con frecuentar y consumir comida de un mercado mayorista de mariscos1. Para finales de 2019 e inicios de 2020, el Centro de Control y Prevención de Enfermedades de China (China CDC) identificó la causa de la enfermedad como un nuevo coronavirus que fue nombrado por el Comité Internacional de Taxonomía de los Virus en febrero del 2020 como severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) y desde el 11 de febrero de 2020 la enfermedad fue llamada coronavirus disease 2019 (COVID-19)2.
En la actualidad se encuentran publicadas cerca de 40.000 secuencias del SARS-CoV-2 en la base de datos de GenBank (hasta 10 de noviembre de 2020), incluyendo la secuencia genómica completa de este nuevo agente, lo que ha permitido el desarrollo de diferentes protocolos diagnósticos, entre ellos la reacción en cadena de la polimerasa (PCR) en tiempo real, con sondas y cebadores de conocimiento general para la detección de SARS-CoV-2.
El 17 de enero de 2020, la Organización Mundial de la Salud (OMS) publicó una actualización de los protocolos aprobados para realizar pruebas de laboratorio3 y el 01 de febrero del mismo año, la Organización Panamericana de Salud (PAHO) adoptó el protocolo desarrollado por el Hospital Charité, Berlín, Alemania, como el método de diagnóstico utilizado para la detección de SARS-CoV-24, directriz que fue acogida por el Instituto Nacional de Salud de Colombia.
El protocolo Charité, Berlín, Alemania, realiza el diagnóstico de SARS-CoV-2 mediante la amplificación y detección de una región de la envoltura viral (gen E), compartida por diferentes betacoronavirus del subgénero Sarbecovirus como prueba de cribado, y en aquellas muestras detectadas como positivas se debe realizar una PCR confirmatoria que detecta una región específica del SARS-CoV-2 ubicada en el gen RNA-dependent RNA polymerase (RdRp)5. Además, siguiendo las buenas prácticas de laboratorio, debe incluirse la amplificación de un gen control humano que identifique la viabilidad de la muestra, inhibidores de PCR y evalúe la eficiencia de extracción de ARN; el gen más usado para este fin es el de la ribonucleasa P (RNasa P).
De acuerdo con lo anterior, para realizar el diagnóstico de SARS-CoV-2 se deben realizar tres PCR independientes, lo que retrasa el tiempo de diagnóstico, disminuye la oportunidad de entrega de los resultados y genera un mayor consumo de reactivos, aumentando los costos de la prueba.
Debido a la alta demanda de reactivos en el mundo; a que las importaciones de estos elementos demoran más de 30 días en Colombia; sumado al aumento de nuevos casos en las últimas semanas, es necesario realizar un uso racional de las pruebas y desarrollar metodologías que permitan optimizar los recursos disponibles.
La implementación de una PCR dúplex entre los genes E y RNasa P podría disminuir el tiempo para obtener resultados de las pruebas y aumentar la capacidad de procesamiento de los laboratorios.
El objetivo de este estudio es validar una técnica de PCR dúplex para el diagnóstico de SARS-CoV-2 basada en la detección del gen E y RNasa P.
MétodosCultivo celular de SARS-CoV-2 y especímenes clínicos. Se realizó extracción de ARN a partir de la cepa del SARS-CoV-2 aislado y cultivado en el grupo Inmunovirología de la Universidad de Antioquia6, el cual sirvió como control positivo para estandarizar y evaluar el funcionamiento de la PCR dúplex.
Se seleccionaron 88 muestras de ARN de especímenes clínicos procedentes de muestras de aspirado e hisopado nasofaríngeo de pacientes con sospecha de COVID-19, las cuales tenían resultado previo para SARS-CoV-2. Se realizó la PCR dúplex para las muestras en el Laboratorio Integrado de Medicina Especializada (LIME) y en el Grupo Inmunovirología (IMV), ambos de la Facultad de Medicina de la Universidad de Antioquia, con el objetivo de evaluar la repetibilidad y reproducibilidad de la técnica usando reactivos y equipos diferentes.
Extracción de ARN. Para el aislado viral, se realizó la extracción a partir de sobrenadantes de cultivo usando el sistema automatizado de extracción SaMag-12 y el estuche comercial SaMag™ Viral Nucleic Acid Extraction Kit (Sacace biotechnologies, Italia), siguiendo las instrucciones de la casa comercial, con un volumen de elución de 30 μL.
La extracción de ARN de especímenes clínicos se realizó a partir de muestras de aspirado nasofaríngeo o hisopado nasofaríngeo de pacientes con sospecha de COVID-19, utilizando dos sistemas automatizados con tecnología de magnetos para la extracción de ARN Magmax (Thermo Fisher Scientific Inc, EE. UU.) y SaMag™ (Sacace Biotechnologies, Italia) en LIME e IMV, respectivamente; además, se realizaron extracciones manuales con el Quick-RNA Viral Kit (Zymo Research, EE. UU.), de acuerdo con las instrucciones del fabricante. El volumen de elución para los kits automatizados fue de 30-50 μL y para el kit manual de 15 μL. Es de aclarar que se realizó extracción por diferentes metodologías, con el objetivo de ampliar la capacidad diagnóstica del laboratorio y de acuerdo con la disponibilidad de reactivos en Colombia.
El ARN se almacenó a -80°C hasta su uso y se utilizó el mismo producto extraído de cada muestra para todas las reacciones de RT-PCR que se analizarán en este artículo.
Primersy sondas. Se utilizaron los cebadores y sondas para los genes E_Sarbeco y RdRp publicados por Corman et al. en el protocolo Charité, Berlín5. El gen RNasa P fue empleado como control interno de reacción y se amplificó utilizando dos pares de oligonucleótidos cebadores: 68 muestras se amplificaron con los oligonucleótidos y sonda publicados por la CDC para detección de SARS-CoV-27 y 20 muestras fueron amplificadas usando la sonda de CDC, pero con un par de cebadores diseñados en la unión exones 1 y 2 del gen RNasa P (RNasa-P-Fw: 3’-ATGGCGGTGTTTGCAGATTTG-5’ y RNasa-P-Rv: 3’-CAACTGAATAGCCAAGGTGAGC-5’) para asegurar la amplificación del ARN extraído, excluyendo el ADN genómico.
Las sondas E y RdRp se marcaron con el fluoróforo FAM y para RNasa P se utilizó VIC o HEX, de acuerdo con la compatibilidad de los equipos de PCR en tiempo real utilizados.
Ensayos de qRT-PCR para la detección de SARS-CoV-2. Se realizó la retrotranscripción y posterior amplificación del genoma viral de SARS-CoV-2 en tiempo real (qRT-PCR) utilizando la enzima SuperScript™ III One-Step RT-PCR System (Invitrogen™, EE. UU.) y la Luna® Universal One-Step RT-qPCR Kit (New England Biolabs, EE. UU.). El gen E se amplificó de manera individual (monoplex) y en dúplex con RNasa P; el gen RdRp solo se amplificó en monoplex.
Las amplificaciones por PCR para los genes virales RdRp y E (tanto en monoplex como dúplex), se realizaron siguiendo las recomendaciones de concentraciones de oligonucleótidos (cebadores y sondas), publicadas en el protocolo Charité, Berlín5, la RNasa P se amplificó en la PCR dúplex con una concentración de oligos de 0,15 μM y sonda a 0,2 μM.
Las condiciones de termociclaje para la enzima SuperScript™ III One-Step RT-PCR System fueron las publicadas en el protocolo Charité, Berlín5 y cuando se usó la enzima Luna® Universal One-Step RT-qPCR Kit, se modificó la retrotranscripción a 55°C por 18 min y el alineamiento/extensión a 60°C por 30 s, siguiendo las recomendaciones del fabricante.
Las muestras fueron consideradas positivas cuando la fluorescencia sobrepasa umbral de detección en un Ct menor a 38 y aumenta gradualmente a lo largo de los ciclos generando una curva de amplificación sigmoidal. Las muestras con Ct mayor a 38 fueron consideradas negativas.
Comparación del límite de detección entre PCR monoplex del gen E, monoplex de RdRp y dúplex (gen E y RNasa P)Para la comparación en el desempeño entre el ensayo dúplex y el monoplex, se utilizó ARN extraído a partir de la cepa SARS-CoV-2 aislada en el Grupo Inmunovirología. Se realizaron diluciones decimales seriadas del ARN viral, utilizando como diluyente ARN extraído a partir de una muestra negativa para SARS-CoV-2, finalizando en la dilución 1x10-8. Se realizaron cinco réplicas de las amplificaciones de los genes E y dúplex E más RNasa P: tres de ellas en LIME y dos en el grupo Inmunovirología. Por su parte, la PCR del gen RdRp se realizó por triplicado en LIME.
La reproducibilidad de los resultados, entre laboratorios, se evaluó al comparar dos extracciones de ARN del cultivo viral, las cuales se diluyeron de forma independiente desde 1x10-1 hasta 1x10-8; posteriormente, se realizó PCR por duplicado de los genes E y dúplex E más RNasa P en cada serie de dilución.
Finalmente, para evaluar el funcionamiento de la PCR dúplex en muestras clínicas, se seleccionaron 88 muestras de ARN de pacientes con sospecha de COVID-19 (39 positivas y 49 negativas para SARS-CoV-2), las cuales fueron analizadas en los termocicladores 7500 Fast (Applied Biosystems, EE. UU.) y CFX-96 (Biorad) usados en LIME e IMV, respectivamente.
Cálculos estadísticos. Los ciclos umbrales (Ct) de las muestras identificadas como positivos para SARS-CoV-2 de las amplificaciones en monoplex y dúplex fueron comparados utilizando la prueba t pareada en el software Statistics Kingdom (https://www.statskingdom.com). Un valor p < 0,05 fue considerado como significativo.
Los resultados de SARS-CoV-2 de las muestras clínicas obtenidos en monoplex y dúplex fueron comparados utilizando el coeficiente de concordancia kappa de Cohen. Un valor kappa entre 0,81 y 1 es considerado como una concordancia «casi perfecta»8.
Los valores de sensibilidad y especificidad se obtuvieron utilizando el software Medcalc (https://www.medcalc.org/).
ResultadosComparación de desempeño entre PCR monoplex y PCR dúplexSe realizaron tres PCR independientes: gen E y RdRp en monoplex, y E más RNasa P en dúplex, de las diluciones seriadas del ARN viral procedente de cultivo celular utilizando como diluyente ARN extraído a partir de una muestra negativa para SARS-CoV-2.
La concentración del cultivo viral al momento de la extracción era de 4,2x106 UFP/mL, que de acuerdo con la cuantificación de otros aislados de SARS-CoV-29 corresponde a una concentración aproximada de RNA de 4x109 equivalentes genómicos/mL, y fue diluido de forma decimal hasta 1x10-9; posteriormente, se realizaron las tres PCR de forma simultánea, con cinco réplicas de cada dilución para el gen E y la dúplex E más RNasa P (tres réplicas realizadas en el laboratorio LIME y dos réplicas en inmunovirología), mientras que el gen RdRp se amplificó por triplicado en LIME.
No hubo diferencias significativas en los resultados de Ct (valor de p = 0,7662), entre la monoplex del gen E y su combinación con RNasa P (tabla 1), de hecho, los promedios y desviaciones estándar de los Ct fueron similares entre grupos en todas las diluciones y se identificó la detección en las cinco réplicas de la dilución 1x10-7, correspondiente a 0,42 equivalentes genómicos/μL. Esto demuestra la repetibilidad y reproducibilidad de los resultados.
Valores de Ct de las diluciones seriadas del ARN viral procedente de cultivo celular diluido en ARN humano negativo para SARS-CoV-2
| Técnica | Monoplex | Dúplex | Monoplex | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dilución | Gen E | Gen E | RNasa P | Gen RdRp | ||||||||
| Ct | Promedio | DE | Ct | Promedio | DE | Ct | Promedio | DE | Ct | Promedio | DE | |
| 1x10-1 | 13,2 | 12,9 | 0,5 | 12,6 | 12,8 | 0,4 | 0 | 28,4 | 0,1 | 14,3 | 14,7 | 0,3 |
| 13,6 | 13,4 | 0 | 14,9 | |||||||||
| 12,9 | 12,7 | 0 | 14,9 | |||||||||
| 12,4 | 12,4 | 28,3 | ||||||||||
| 12,3 | 12,7 | 28,4 | ||||||||||
| 1x10-2 | 15,0 | 16,0 | 0,8 | 16,7 | 15,7 | 0,8 | 33 | 29,4 | 2,2 | 18,9 | 18,8 | 0,1 |
| 16,9 | 14,5 | 28,8 | 18,8 | |||||||||
| 16,9 | 15,9 | 30,1 | 18,7 | |||||||||
| 15,6 | 15,8 | 27,9 | ||||||||||
| 15,7 | 15,7 | 27,5 | ||||||||||
| 1x10-3 | 16,9 | 17,9 | 1,0 | 19,6 | 19,4 | 0,6 | 28,6 | 27,9 | 0,7 | 22,1 | 22,2 | 0,2 |
| 16,9 | 20,2 | 28,1 | 22,4 | |||||||||
| 17,9 | 18,7 | 28,5 | 22,2 | |||||||||
| 19,0 | 19,2 | 27,1 | ||||||||||
| 18,9 | 19,1 | 27,3 | ||||||||||
| 1x10-4 | 24,2 | 22,6 | 1,4 | 23,4 | 23,2 | 0,8 | 27,4 | 27,6 | 0,2 | 25,8 | 25,9 | 0,1 |
| 23,7 | 23,8 | 27,8 | 25,9 | |||||||||
| 20,6 | 24,0 | 27,9 | 25,9 | |||||||||
| 22,3 | 22,5 | 27,6 | ||||||||||
| 22,2 | 22,3 | 27,5 | ||||||||||
| 1x10-5 | 27,0 | 26,0 | 1,1 | 26,8 | 26,6 | 0,8 | 27,5 | 28,0 | 0,3 | 29,5 | 29,5 | 0,2 |
| 27,2 | 27,4 | 27,9 | 29,7 | |||||||||
| 24,8 | 27,2 | 28,1 | 29,4 | |||||||||
| 25,3 | 26,0 | 28,2 | ||||||||||
| 25,4 | 25,5 | 28,0 | ||||||||||
| 1x10-6 | 30,7 | 30,3 | 1,0 | 30,6 | 29,9 | 1,1 | 27,7 | 27,9 | 0,4 | 33,71 | 33,4 | 1,1 |
| 31,5 | 31,3 | 27,3 | 34,24 | |||||||||
| 30,8 | 29,7 | 28,2 | 32,13 | |||||||||
| 29,1 | 29,8 | 28,1 | ||||||||||
| 29,4 | 28,3 | 28,1 | ||||||||||
| 1x10-7 | 31,8 | 33,2 | 1,6 | 33,7 | 33,9 | 3,2 | 26,7 | 27,6 | 0,7 | 40,9 | 39,4 | 2,1 |
| 35,8 | 31,9 | 26,9 | 37,9 | |||||||||
| 32,2 | 38,3 | 28 | 0 | |||||||||
| 32,3 | 35,6 | 28,1 | ||||||||||
| 33,6 | 30,3 | 28,1 | ||||||||||
| 1x10-8 | 34,9 | 35,1 | 1,1 | 0 | 38,24 | 2,1 | 27,2 | 27,6 | 0,4 | 0 | 0 | 0 |
| 0,0 | 38,5 | 27,6 | 0 | |||||||||
| 36,3 | 0 | 27,5 | 0 | |||||||||
| 34,2 | 36,1 | 0 | ||||||||||
| 0 | 40,2 | 28,2 | ||||||||||
| 1x10-9 | 0 | 0 | 0 | 0 | 0 | 0 | 27,5 | 27,8 | 0,4 | 0 | 0 | 0 |
| 0 | 0 | 27,3 | 0 | |||||||||
| 0 | 0 | 28,0 | 0 | |||||||||
| 0 | 0 | 0 | ||||||||||
| 0 | 0 | 28,2 | ||||||||||
La dilución 1x10-8 amplificó en tres de las cinco réplicas, donde se observan los efectos estocásticos producidos por la baja carga viral de las diluciones y la amplificación por debajo del límite de detección reportado por el protocolo Charité, Berlín, de 5,2 copias5. Cabe mencionar que el gen RdRp presenta una menor sensibilidad (dilución 1x10-7), comparada con el gen E (dilución 1x10-8), por lo tanto, para las muestras débiles positivas es recomendable utilizar un gen específico que presente mayor sensibilidad (tabla 1).
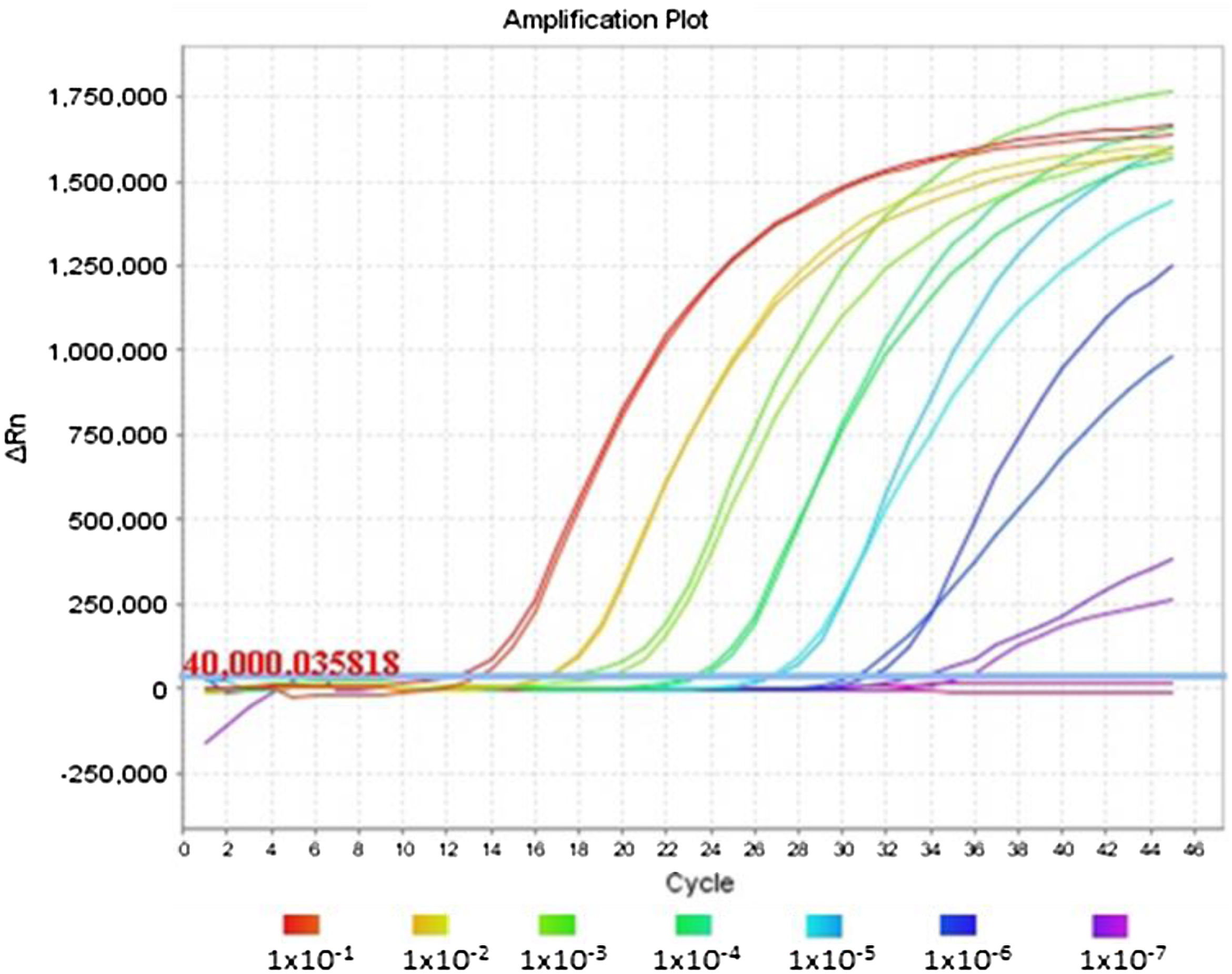
La figura 1 muestra una óptima amplificación del gen E en la PCR dúplex, logrando una sensibilidad indistinguible de la obtenida con la PCR monoplex del gen E al comparar los valores de Ct. El análisis de las curvas de amplificación de las diferentes diluciones evaluadas demuestra la característica sigmoidal en presencia de altas concentraciones de ARN viral; sin embargo, cuando la RNasa P tiene una concentración mucho mayor que el gen E, como sucede en las diluciones iguales o mayores a 1x10-7, se observa un aplanamiento de la curva de amplificación del gen E debido al agotamiento de los reactivos en los ciclos finales de la reacción de PCR.
Efecto de altas concentraciones de ARN humano en la amplificación del gen E por técnica de PCR dúplex (gen E/ más RNasa P). Se observan dos curvas de amplificación correspondientes al marcador E en PCR monoplex y en dúplex para las diferentes diluciones del ARN viral proveniente de cultivo.
Este mismo efecto de aplanamiento de la curva puede observarse para las curvas de la RNasa P en reacciones en las que el gen E tiene alta concentración de ARN, incluso puede ser inhibida su amplificación como se evidencia en la primera serie de dilución de la PCR dúplex en la tabla 1.
En la tabla 2 se presenta el ensayo final de reproducibilidad entre laboratorios, para el cual se realizaron dos extracciones del aislado viral con concentración de 4,2x106 UFP/mL, obteniendo resultados concordantes en la PCR dúplex E más RNasa P (valor de p = 0,27).
Valores de Ct de ensayo de reproducibilidad a partir de dos diluciones independientes del ARN procedente del virus aislado
| Extracción 1: Dúplex | Extracción 2: Dúplex | |||||||
|---|---|---|---|---|---|---|---|---|
| E | RNasaP | E | RNasaP | |||||
| DILUCIÓN | Ct | Promedio | Ct | Promedio | Ct | Promedio | Ct | Promedio |
| 1x10-1 | 12,4 | 12,6 | 28,3 | 28,4 | 12,6 | 12,6 | 28,3 | 28,3 |
| 12,7 | 28,4 | 12,6 | 28,2 | |||||
| 1x10-2 | 15,8 | 15,7 | 27,9 | 27,7 | 15,8 | 15,8 | 27,6 | 27,7 |
| 15,7 | 27,5 | 15,8 | 27,9 | |||||
| 1x10-3 | 19,2 | 19,2 | 27,1 | 27,2 | 19,1 | 19,1 | 27,4 | 27,4 |
| 19,1 | 27,3 | 19,2 | 27,4 | |||||
| 1x10-4 | 22,5 | 22,4 | 27,6 | 27,5 | 22,5 | 22,6 | 27,8 | 27,7 |
| 22,3 | 27,5 | 22,6 | 27,6 | |||||
| 1x10-5 | 26,0 | 25,8 | 28,2 | 28,1 | 25,8 | 25,7 | 28,2 | 28,1 |
| 25,5 | 28,0 | 25,6 | 28,0 | |||||
| 1x10-6 | 29,8 | 29,1 | 28,1 | 28,1 | 28,4 | 28,5 | 28,2 | 28,2 |
| 28,3 | 28,1 | 28,6 | 28,1 | |||||
| 1x10-7 | 35,6 | 32,9 | 28,1 | 28,1 | 33,6 | 32,4 | 28,1 | 28,1 |
| 30,3 | 28,1 | 31,2 | 28,2 | |||||
| 1x10-8 | 36,1 | 38,1 | No dato | 28,2 | 0 | 0 | 28,2 | 28,2 |
| 40,2 | 28,2 | 0 | 28,1 | |||||
| NTC | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Especificidad y sensibilidad del monoplex y dúplex del marcadorE_Sarbecoen muestras clínicas. Para demostrar el adecuado funcionamiento de la técnica dúplex en especímenes clínicos, se seleccionaron 88 muestras de ARN con resultado previo para COVID-19 (39 positivas y 49 negativas para SARS-CoV-2 (tabla 3).
Comparación de los valores de Ct obtenidos de la PCR monoplex y dúplex para muestras clínicas
| Monoplex | Dúplex | Monoplex | ||
|---|---|---|---|---|
| Código | E Sarbeco | E | (RNasa P) | RdRp |
| 1 | 21 | 23 | 22 | 25 |
| 2 | 0 | 0 | 29,8 | 0 |
| 3 | 30 | 30 | 30 | 32 |
| 4 | 0 | 0 | 30 | 0 |
| 5 | 0 | 0 | 31 | 0 |
| 6 | 0 | 0 | 31 | 0 |
| 7 | 0 | 0 | 33 | 0 |
| 8 | 0 | 0 | 26 | 0 |
| 9 | 0 | 0 | 23 | 0 |
| 10 | 0 | 0 | 31 | 0 |
| 11 | 23 | 23 | 0 | 24,8 |
| 12 | 26,7 | 26,4 | 27,6 | 28,5 |
| 13 | 23,7 | 23,8 | 33,2 | 25,1 |
| 14 | 19,5 | 19,4 | 26,8 | 21,5 |
| 15 | 0 | 0 | 29,1 | 0 |
| 16 | 0 | 0 | 31 | 0 |
| 17 | 0 | 0 | 32,8 | 0 |
| 18 | 0 | 0 | 30,5 | 0 |
| 19 | 0 | 0 | 22,6 | 0 |
| 20 | 0 | 0 | 27,5 | 0 |
| 21 | 0 | 0 | 26,6 | 0 |
| 22 | 0 | 0 | 25 | 0 |
| 23 | 0 | 0 | 27,8 | 0 |
| 24 | 0 | 0 | 25,5 | 0 |
| 25 | 0 | 0 | 26,7 | 0 |
| 26 | 18,2 | 18,7 | 27 | 25,6 |
| 27 | 25,8 | 25,4 | 26,7 | 29 |
| 28 | 26,5 | 26,8 | 31,3 | 31,4 |
| 29 | 20,2 | 20,7 | 31,9 | 23,4 |
| 30 | 23,8 | 23,5 | 33,9 | 26,5 |
| 31 | 27,8 | 28,1 | 32,5 | 31,2 |
| 32 | 21,8 | 21,8 | 0 | 24,9 |
| 33 | 17,7 | 17 | 33,1 | 17,6 |
| 34 | 20,5 | 20,8 | 26 | 24,3 |
| 35 | 20,2 | 20,2 | 0 | 24,3 |
| 36 | 25,6 | 26 | 32,5 | 29,8 |
| 37 | 17,2 | 17,3 | 24,6 | 17,6 |
| 38 | 25,2 | 31 | 23,6 | 30,4 |
| 39 | 0 | 0 | 25,6 | 0 |
| 40 | 0 | 0 | 26,5 | 0 |
| 41 | 0 | 0 | 27,1 | 0 |
| 42 | 21,1 | 21,3 | 24,3 | 22,3 |
| 43 | 26,2 | 28,7 | 25,7 | 28,8 |
| 44 | 26,2 | 27 | 26,7 | 28,5 |
| 45 | 26 | 25,9 | 27,8 | 25,8 |
| 46 | 27,6 | 27,9 | 28,4 | 26,8 |
| 47 | 31,5 | 35 | 29,9 | 0 |
| 48 | 0 | 36 | 29,9 | 0 |
| 49 | 0 | 36,2 | 29,4 | 0 |
| 50 | 24,2 | 24,7 | 27 | 24,8 |
| 51 | 21 | 21,6 | 26,4 | 22,2 |
| 52 | 0 | 0 | 27,4 | 0 |
| 53 | 0 | 36,2 | 25,7 | 0 |
| 54 | 33 | 32 | 25,8 | 0 |
| 55 | 0 | 0 | 28,3 | 0 |
| 56 | 31,1 | 30,6 | 28,6 | 34,4 |
| 57 | 32 | 32,6 | 31,3 | 34,4 |
| 58 | 31 | 32,4 | 25,2 | 33,2 |
| 59 | 31,9 | 33,9 | 27,3 | 34,7 |
| 60 | 31,4 | 36,3 | 26 | 33,8 |
| 61 | 32,3 | 33,7 | 31,6 | 33,9 |
| 62 | 30 | 32,4 | 26,3 | 32,7 |
| 63 | 33,2 | 33,6 | 27,1 | 34 |
| 64 | 36,7 | 27,9 | 28,4 | 0 |
| 65 | 0 | 35,2 | 29,9 | 0 |
| 66 | 34,1 | 0 | 25,9 | 0 |
| 67 | 37,8 | 36,2 | 30,6 | 0 |
| 68 | 0 | 34,1 | 31,7 | 0 |
| 69 | 0 | 0 | 30,6 | 0 |
| 70 | 0 | 0 | 32,6 | 0 |
| 71 | 20,8 | 21 | 32,2 | 26,8 |
| 72 | 34,7 | 0 | 36 | 0 |
| 73 | 14,2 | 14,4 | 29,1 | 20,5 |
| 74 | 0 | 0 | 26,5 | 0 |
| 75 | 36,3 | 0 | 28,3 | 0 |
| 76 | 0 | 0 | 30,6 | 0 |
| 77 | 0 | 0 | 32,3 | 0 |
| 78 | 37,6 | 0 | 30,7 | 0 |
| 79 | 0 | 0 | 30,2 | 0 |
| 80 | 35,4 | 35 | 30,4 | 0 |
| 81 | 37,1 | 0 | 32 | 0 |
| 82 | 37,3 | 37,8 | 25,3 | 0 |
| 83 | 0 | 0 | 30,1 | 0 |
| 84 | 0 | 0 | 29,8 | 0 |
| 85 | 0 | 0 | 30,6 | 0 |
| 86 | 32,4 | 32,3 | 32,6 | 37,5 |
| 87 | 23,5 | 23,5 | 31,2 | 29,1 |
| 88 | 22,3 | 22,3 | 29,1 | 28,2 |
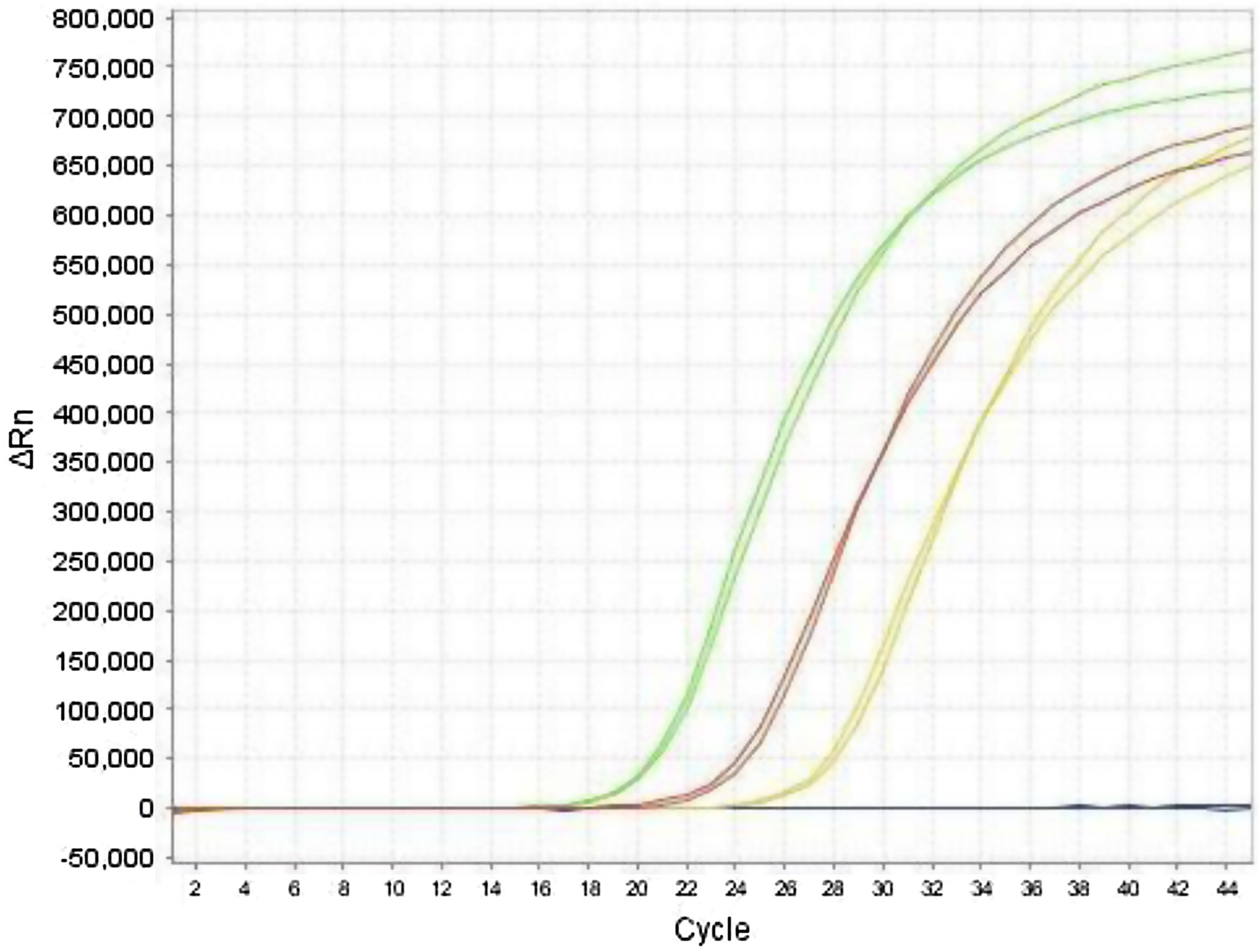
Los valores de Ct del gen E obtenidos por la PCR monoplex y dúplex (E más RNasa P), no mostraron diferencias significativas en la prueba t pareada (p = 0,84). Se observó una concordancia adecuada entre los resultados obtenidos para el gen E, tanto en dúplex como monoplex (fig. 2) en especímenes clínicos, demostrando que la técnica dúplex es una buena prueba de cribado, con alta sensibilidad en la detección de muestras positivas, las cuales fueron posteriormente confirmadas con el gen específico RdRp.
Comparación de las curvas de amplificación del gen E por la estrategia de PCR monoplex y dúplex. Las curvas del mismo color representan los resultados obtenidos por las dos metodologías. Se presentan como ejemplo, tres pacientes positivos (curvas verde, roja, amarilla) y un paciente negativo (azul).
El análisis de concordancia entre los resultados de la PCR monoplex E y dúplex (E más RNAsa P) demostró similitud entre las dos técnicas, con un coeficiente kappa de Cohen de 0,89, el cual permite afirmar que la fuerza de concordancia de ambas técnicas es excelente8, con un porcentaje de acuerdo de resultados entre los métodos del 89%.
Así mismo, se calculó la sensibilidad y especificidad de la PCR dúplex (E más RNAsa P), teniendo como patrón la PCR monoplex E, obteniendo valores de sensibilidad del 90% y especificidad del 87%. La divergencia observada entre ambas estrategias se evidenció con muestras con Ct > 34, correspondientes a muestras con baja cantidad de virus.
DiscusiónLa amplificación en PCR dúplex del gen E_Sarbeco publicado en el protocolo Charité, Berlín, en conjunto con el gen RNasa P, como se demuestra en este artículo, es una herramienta de gran utilidad para el cribado de SARS-CoV-2 en muestras clínicas porque optimiza el consumo de reactivos, el tiempo en la obtención de resultados, mejora la capacidad instalada necesaria para el diagnóstico, y a su vez disminuye el costo de la evaluación.
Nuestros resultados demuestran que la PCR dúplex no afecta la sensibilidad y especificidad informadas por el protocolo Charité, Berlín, y confirman que muestras con carga viral alta (Ct para el gen E menores a 34), presentan concordancia del 100% entre el gen E y RdRp.
En el análisis de las curvas de amplificación de muestras con baja carga viral, se evidencia una disminución en la intensidad de fluorescencia de la curva del gen viral específico, siendo más marcado cuando existen altas concentraciones de ARN humano. Lo anterior puede deberse a que existe una menor probabilidad de apareamiento entre secuencias complementarias (primers y sondas) con el ARN viral en concentraciones menores o incluso presencia de inhibidores en las muestras que afecten la eficiencia de la PCR. En el caso puntual de la técnica PCR dúplex, este fenómeno se acentúa por la amplificación temprana del control interno de reacción y aumento de los fragmentos de RNasa P disponibles en la reacción, lo que suponemos, indujo el aplanamiento observado en la curva de amplificación del gen E y modificó la apariencia sigmoidal de la misma, generando amplificaciones lineales, aunque sin modificar los valores de Ct.
De hecho, las muestras con baja carga viral (Ct > 34), como las muestras 48, 49, 66, 75, informadas en la tabla 3, coinciden con el Ct obtenido del aislado viral a diluciones mayores de 1x10-8 (4.2x10-2 UFP/mL) en la tabla 1, donde se observa menor reproducibilidad en los resultados de la PCR de las cinco réplicas, tanto para el gen E en monoplex, como para la PCR dúplex. Es importante resaltar que las muestras con Ct > 34 son las que afectan la concordancia entre la PCR monoplex y dúplex, lo cual puede deberse a estar cerca al límite de detección del protocolo Berlín utilizando el primer E_Sarbeco, sugiriendo que los resultados discordantes de estas muestras se deben a la sensibilidad del protocolo Berlín y no a la estrategia de PCR dúplex.
Contrario a lo informado por el protocolo Charité, Berlín, nuestros resultados muestran una mejor sensibilidad para el marcador E_Sarbeco, en comparación al RdRp. Esto concuerda con lo informado por otros autores9-11 y demuestra la necesidad de emplear otro marcador confirmatorio más sensible y estable, que presente una baja tasa de mutaciones que puedan afectar la eficiencia de la PCR. Aunque se ha demostrado que la contagiosidad de los individuos con baja cantidad de virus (Ct > 33) es cercana a cero12,13, el Ct puede variar dependiendo de la calidad de la muestra; sin embargo, desde el punto de vista epidemiológico, es relevante conocer el número real de individuos con la infección en nuestro medio. Por lo tanto, en el diagnóstico de SARS-CoV-2 es necesario realizar un análisis minucioso de las curvas de amplificación y en los casos en que se presente un levantamiento sutil con valores de Ct mayores a 34 del gen E, es conveniente realizar una PCR confirmatoria, idealmente dirigida hacia un gen viral diferente al RdRp, que es menos sensible, con el fin de poder verificar la presencia de SARS-CoV-2.
En la tabla 3 se observan muestras que amplificaron con la PCR monoplex y dúplex, pero fueron negativas con el marcador RdRp. La moderada especificidad del monoplex y el dúplex frente al RdRp puede ser explicada por la detección inespecífica del gen E_Sarbeco, pero también por la baja sensibilidad del marcador RdRp, resultado que puede deberse a errores de diseño de los primers10 y/o nuevas mutaciones del virus en la población colombiana11.
Finalmente, la recomendación es que los laboratorios de diagnóstico de SARS-CoV-2 tengan disponibles e implementados diferentes protocolos para el diagnóstico del virus, que eventualmente sirvan como un apoyo para la confirmación de pacientes con baja carga viral o con mutaciones en el genoma, que en ocasiones generan resultados inconclusos por una sola metodología. En los casos en que no haya concordancia entre los resultados de las diferentes metodologías, sugerimos reportar la presencia de SARS-CoV-2 como «indeterminado» y sugerir la repetición de la prueba en una nueva muestra tomada 48 horas después de la primera.
Fuentes de financiaciónEl presente trabajo fue financiado con recursos del sistema general de regalías de Colombia (BPIN 2020000100152, BPIN 2020000100131) y de la Universidad de Antioquia (2020-36870 y sostenibilidad).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.