Presentamos el caso de una mujer de 62 años diagnosticada de una enfermedad hematológica en 2006 de gammapatía monoclonal, que evolucionó a mieloma múltiple quiescente en 2009 y a mieloma sintomático (IgG kappa, ISS 1) en 2011. Se sometió a un trasplante autólogo de progenitores hematopoyéticos de sangre periférica (TASPE), del cual sufrió una recaída en octubre de 2014, con una médula ósea discretamente hipocelular, con el 7% de células plasmáticas de maduración intermedia. Tras recibir 10 sesiones de radioterapia y 4 ciclos de VTD (bortezomib+talidomida+dexametasona), la paciente ingresó en abril de 2015 en el servicio de Hematología del Hospital Universitario Central de Asturias para recibir un trasplante alogénico de precursores hematopoyéticos de hermano HLA idéntico, acondicionado con fludarabina. Además, en el momento del ingreso presentaba un cuadro catarral persistente con tos, sin expectoración, fiebre, ni disnea, por lo que se le pautó levofloxacino (500mg iv/24h).
El procedimiento se realizó sin incidencias y se inició profilaxis para enfermedad injerto contra huésped con metotrexato y ciclosporina. En la anamnesis realizada los días posteriores, la paciente refería dolor bucal, objetivándose una mucositis de grado 3 de la OMS que precisó nutrición parenteral. En el sexto día postrasplante comenzó con fiebre de 39°C, observándose en la analítica una profunda aplasia medular (leucocitos 0.00 x 103/μl, hematíes 2,76×106/μl, hemoglobina 8,7g/dl, plaquetas 13.000/μl), con valores en las pruebas de función hepática y renal dentro de la normalidad. Se tomaron hemocultivos (BD BACTEC® Plus Aerobic/Anaerobic F), y se inició tratamiento con piperacilina-tazobactam (4g iv/6h), siguiendo el protocolo terapéutico antibiótico para la neutropenia febril aplicado en el hospital.
A las 32h, las botellas anaerobias fueron positivas, mientras que las botellas aerobias lo fueron a las 57h, observándose en la tinción de Gram bacilos gram-negativos de aspecto fusiforme. En los subcultivos en agar sangre, chocolate y Brucella crecieron a las 18h unas colonias grisáceas de aspecto seco. La identificación se realizó mediante MALDI-TOF, obteniendo una puntuación de 2,1 para Leptotrichia trevisanii. Este resultado se confirmó mediante la secuenciación del ARNr 16S, comparando la secuencia obtenida con la base de datos GenBank® y utilizando el programa BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi).
La sensibilidad antibiótica se realizó mediante microdilución en caldo, siguiendo el método de referencia para microorganismos anaerobios y los puntos de corte indicados en el Clinical and Laboratory Standards Institute (CLSI). El microorganismo fue sensible a los siguientes antibióticos: penicilina (CIM=0,12mg/l), amoxicilina (CIM=1mg/l), piperacilina (CIM≤16mg/l), amoxicilina-clavulánico (CIM=0,5/0,25mg/l), piperacilina-tazobactam (CIM=16/4mg/l), cefoxitina (CIM=1mg/l), imipenem (CIM=0,12mg/l), cloranfenicol (CIM=8mg/l), clindamicina (CIM≤0,5mg/l), tetraciclina (CIM≤2mg/l) y metronidazol (CIM≤0,5mg/l). El moxifloxacino (CIM=8mg/l) se catalogó como resistente. No hay puntos de corte en el CLSI para eritromicina, pero la CIM obtenida (64mg/l) fue alta.
El primer caso de bacteriemia por Leptotrichia trevisanii fue descrito por Tee et al. en un varón con leucemia mieloide aguda en 20011, y desde entonces se han publicado menos de 12 casos2–8. Los pacientes implicados padecían alguna enfermedad hematológica excepto uno, con cáncer esofágico con metástasis en hígado, pulmón y nódulos linfáticos2, lo que evidencia el carácter oportunista de este microorganismo. En todos ellos se describió como factor predisponente de la sepsis una situación de neutropenia febril, acompañada de la aparición de lesiones en la mucosa orofaríngea. Estas constituyen una ruta para la translocación bacteriana2,3, que puede desencadenar en bacteriemia en situaciones de aplasia medular.
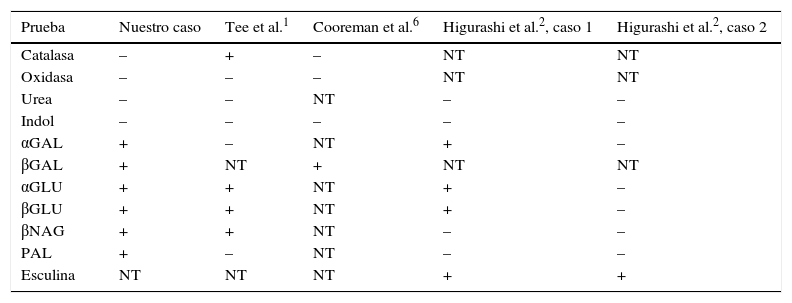
Las baterías fenotípicas no son capaces de identificar Leptotrichia spp., ya que presenta una baja reactividad bioquímica3,4. Además, la comparación entre las distintas cepas descritas pone de manifiesto la dificultad para identificar el microorganismo basándose únicamente en las pruebas bioquímicas, debido a la variabilidad en los resultados (tabla 1). En nuestro caso, se empleó el sistema API® Rapid/ID 32 A (bioMérieux®). El perfil numérico obtenido (0411400000) daba como resultado Clostridium acetobutylicum (87,2%), que no puede correlacionarse con los bacilos fusiformes gram-negativos observados al microscopio.
Comparación de los resultados de las pruebas bioquímicas entre distintas cepas de Leptotrichia trevisanii
| Prueba | Nuestro caso | Tee et al.1 | Cooreman et al.6 | Higurashi et al.2, caso 1 | Higurashi et al.2, caso 2 |
|---|---|---|---|---|---|
| Catalasa | – | + | – | NT | NT |
| Oxidasa | – | – | – | NT | NT |
| Urea | – | – | NT | – | – |
| Indol | – | – | – | – | – |
| αGAL | + | – | NT | + | – |
| βGAL | + | NT | + | NT | NT |
| αGLU | + | + | NT | + | – |
| βGLU | + | + | NT | + | – |
| βNAG | + | + | NT | – | – |
| PAL | + | – | NT | – | – |
| Esculina | NT | NT | NT | + | + |
+: positivo; −: negativo; NT: no testado.
La espectrometría de masas MALDI-TOF ha demostrado ser una herramienta costo-efectiva y rápida en la identificación final de microorganismos para los que los métodos convencionales resultan no concluyentes. Martín-Gutiérrez et al. consiguieron una correcta identificación a nivel de especie de Leptotrichia trevisanii tan solo 2h después de que el hemocultivo fuera positivo3, al igual que Schmitt et al., que lo hicieron en un periodo de 48h5. En nuestro caso, nos permitió establecer la etiología de la bacteriemia en 18h tras el pase de los hemocultivos positivos a medios de cultivo sólidos.
Los patrones de sensibilidad para Leptotrichia spp. no están definidos, aunque se ha descrito como sensible a la mayor parte de los antimicrobianos1,2,6,7. No hay experiencia suficiente para establecer un tratamiento de elección. En la bibliografía revisada se implantaron diversos regímenes terapéuticos en función del estudio de sensibilidad, con resolución del cuadro clínico en todos los casos. Nuestra paciente fue tratada con piperacilina-tazobactam, siendo los hemocultivos negativos al décimo día postratamiento y con resolución de la mucositis el día 15. Sin embargo, Martín-Gutiérrez et al. no observaron mejoría clínica empleando piperacilina-tazobactam, cambiando el tratamiento a meropenem3.
El empleo de levofloxacino resulta inadecuado en estos casos, ya que Leptotrichia trevisanii muestra resistencia in vitro a fluorquinolonas2,6. Schrimsher et al. describieron 3 casos clínicos en los que levofloxacino se implantó como tratamiento empírico en neutropenia febril, lo que no evitó el desarrollo de una bacteriemia por Leptotrichia8. Por ello, es importante que en pacientes con neutropenia febril y mucositis, más proclives a infecciones por microorganismos anaerobios, sean tratados con antimicrobianos anaerobicidas7,8.