Aunque el tratamiento antirretroviral (TAR) del VIH/sida se introdujo en 1987, la mejora en la progresión de la enfermedad y reducción de la mortalidad poblacional no se observó sino hasta 1996, con la combinación de tres o más fármacos. El objetivo fue estimar el beneficio clínico y económico del TAR en España en el periodo de 32 años, comprendido entre 1987 y 2018.
MétodosSe realizó un análisis de coste-beneficio mediante la simulación de Monte Carlo de segundo orden, desde las perspectivas de la sociedad (caso base) y el Sistema Nacional de Salud (SNS). Los nuevos casos de VIH, sida y muertes relacionadas se obtuvieron de los registros SINIVIH y ONUSIDA, con proyecciones poblacionales sin TAR mediante suavizamiento exponencial triple. El gasto en TAR se obtuvo de informes del Plan Nacional del SIDA y estudios de mercado.
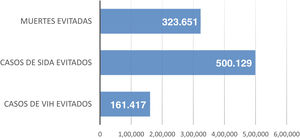
ResultadosEl SNS invirtió 6.185 millones de euros en 32 años. Durante este periodo se evitaron 323.651 muertes por sida, 500.129 casos de sida y 161.417 casos de VIH, con un ahorro total de 41.997 millones de euros. El beneficio neto (ahorros netos) se estima en 35.812 millones de euros (sociedad) y 1.032 millones de euros (SNS). Por cada euro invertido en TAR, se obtuvo un retorno de la inversión de 6,79 € y 1,16 €, respectivamente.
ConclusiónLa utilización de TAR durante 32 años ha evitado gran número de muertes y casos de sida y VIH, generando significativos ahorros económicos para el SNS. El TAR es una intervención eficiente para el SNS.
Although antiretroviral therapy (ART) for HIV / AIDS was introduced in 1987, improvement in disease progression and reduction in mortality at a population level was not observed until 1996, with the combination of three or more drugs. The objective was to estimate the clinical and economic benefit of ART in Spain in the 32-year period between 1987 and 2018.
MethodsA cost-benefit analysis was performed, using a second-order Monte Carlo simulation, from the societal (base case) and the National Health System (NHS) perspectives. New cases of HIV, AIDS and related deaths were obtained from the SINIVIH and UNAIDS registries, with population projections without ART using triple exponential smoothing. Expenditure on ART was obtained from the National AIDS Plan reports and market studies.
ResultsThe NHS invested 6,185 million euros in 32 years. In that period, 323,651 AIDS-related deaths, 500,129 AIDS cases and 161,417 HIV cases were averted, with total savings of 41,997 million euros. The net benefit (net savings) is estimated at 35,812 million euros (societal) and 1,032 million euros (NHS). For every euro invested in ART, a return on investment of € 6.79 and € 1.16 was obtained, respectively.
ConclusionThe use of ART over 32 years prevented a large number of deaths and cases of AIDS and HIV, providing significant economic savings for the NHS. ART is an efficient intervention for the NHS.
La introducción de la zidovudina (AZT) en 1987, el primer tratamiento antirretroviral (TAR), proporcionó un modesto control de la infección por el virus de la inmunodeficiencia humana (VIH) y del síndrome de la inmunodeficiencia adquirida (sida)1; sin embargo, el VIH desarrolló una rápida resistencia a este fármaco2. De hecho, en España no se observó un impacto relevante del TAR en la progresión de la enfermedad y la reducción de la mortalidad hasta el año de 1996, con la combinación de tres o más fármacos3,4. Desde entonces, el TAR ha dado lugar a una constante reducción en España de los casos de sida4 y de la mortalidad asociada3. Se estima que en España viven actualmente 151.400 personas con VIH, que el 87% de éstas (131.775) conocen su infección, que el 97,3% de ellas están en tratamiento (128.216) y, finalmente, que el 90,4% de estas (115.900) tienen supresión viral del VIH5,6 con la consiguiente reducción en la trasmisión de la enfermedad.
Según un reciente estudio de coste-beneficio7, a nivel mundial el TAR habría evitado 9,5 millones de muertes en el periodo comprendido entre los años de 1995 y 2015. El coste neto mundial del TAR en ese periodo se estima en 301.000 millones de dólares estadounidenses (US$), mientras que los beneficios del TAR (a consecuencia de los casos de VIH, sida y muertes por sida evitadas) ascenderían a 1.053.000 millones de US$. En consecuencia, el beneficio neto del impacto sanitario derivado del TAR ascendería a 752.000 millones de US$7. En España, sin embargo, no se ha evaluado la rentabilidad (coste-beneficio) del TAR, conforme a una revisión sistemática realizada por nosotros. El objetivo de este estudio es estimar el impacto clínico y económico del TAR en España durante un período de 32 años (1987-2018).
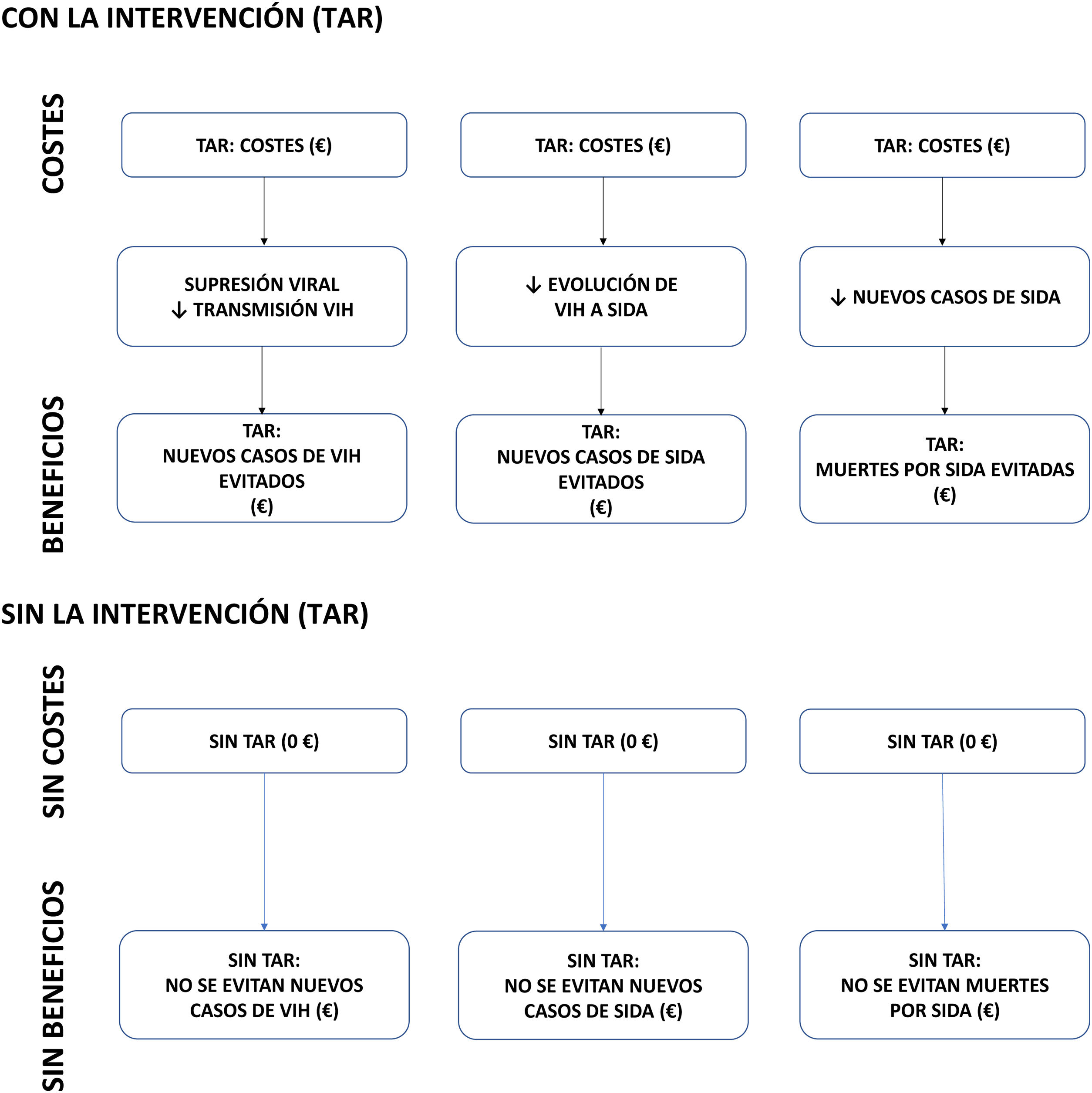
MétodosModelo de coste-beneficioSe realizó un análisis de coste-beneficio. En este tipo de análisis se miden en unidades monetarias tanto los costes como los resultados sanitarios (beneficios). En el presente estudio, los costes (euros [€] de 2020) son los derivados de adquisición del TAR y los beneficios son los costes evitados (es decir, los ahorros) derivados de los resultados clínicos del TAR, en comparación con un escenario hipotético en el que no se hubiera dispuesto del TAR: (i) nuevos casos de infección por VIH evitados; (ii) nuevos casos de sida evitados; y (iii) muertes por sida evitadas (fig. 1). Estos resultados clínicos se asumieron conforme a las premisas siguientes: (i) la supresión viral por el TAR elimina la transmisibilidad del VIH y, por ende, la aparición de nuevos casos de VIH8,9; (ii) evitar la progresión de los pacientes con VIH a sida reduciría los nuevos casos de sida10,11; y (iii) la reducción de nuevos casos de sida reduciría las muertes asociadas al sida7.
El análisis de coste-beneficio se modelizó mediante un análisis probabilístico, utilizando simulaciones de Monte Carlo de segundo orden, con 1.000 simulaciones. Esta metodología hizo posible el análisis de la incertidumbre de las variables del modelo12–14, principalmente las siguientes: (i) el coste anual del TAR en España; (ii) la esperanza de vida en el paciente con VIH, según el periodo analizado; (iii) las muertes evitadas por sida; (iv) los casos evitados de sida, y (v) los casos nuevos de VIH evitados. Las variables continuas (costes, número de casos) se ajustaron a distribuciones gamma12,13, a partir de los valores mínimos y máximos disponibles o, en su defecto, de una variabilidad de±20% del valor medio o disponible de la variable.
Características generales del modeloEl análisis se realizó conforme a un caso base definido, consensuado y validado por un panel de cuatro expertos en el manejo del VIH, incluyendo los valores medios o más plausibles (clínica o epidemiológicamente hablando) de las variables. El caso base definido estableció las siguientes premisas: descuento anual de costes y beneficios del 3%, perspectiva de la sociedad (incluyendo tanto los costes directos sanitarios de los casos de VIH y sida como los costes indirectos –principalmente los laborales– asociados a la muerte prematura de los pacientes con sida), valor económico de las muertes evitadas con base al producto interior bruto (PIB) per cápita7,15–17 y considerando una esperanza adicional de vida a partir del estudio de Gueler et al.18. También se realizaron varios análisis de sensibilidad, modificando algunas de las variables del modelo para evaluar la robustez del caso base. En concreto, se analizaron las siguientes variables: (i) descuento anual de costes y beneficios: 0% y 6%; (ii) valor económico de las muertes evitadas: mediante el valor monetario de la vida estadística (se denomina valor monetario de una vida estadística al valor medido en unidades monetarias que la sociedad en su conjunto atribuye a evitar que uno cualquiera de sus miembros muera; puede calcularse mediante el método de las preferencias declaradas)19; y (iii) análisis de sensibilidad desde la perspectiva del Sistema Nacional de Salud (SNS), considerando únicamente los costes directos sanitarios y sin realizar descuentos anuales, debido a que los decisores sanitarios están interesados en el impacto presupuestario real sin aplicar descuentos20, tanto de los costes del TAR como de los beneficios, entendiendo que al decisor del SNS (responsable del presupuesto) le interesan especialmente los gastos reales para el sistema sanitario en cada momento, no descontados21. Por último, se efectuaron dos subanálisis: (i) la estimación del coste-beneficio para el SNS atribuible a los fármacos para el TAR comercializados por Gilead Sciences en el periodo comprendido entre los años 2002 y 2018, estimándose el porcentaje de la población total a partir de los pacientes tratados anualmente según los datos de ventas; y (ii) el análisis de tres periodos (años 1987-1996, 1997-2007 y 2008-2018) para analizar la evolución del coste-beneficio del TAR a lo largo del periodo de 32 años.
Asunciones y fuentes del modelo económicoLas principales asunciones y fuentes del modelo económico se resumen en la Tabla S1 (apéndice suplementario). Se asumió que en un escenario hipotético en el que no se hubiera dispuesto del TAR, se hubieran producido más casos de infección por VIH, más casos de sida y más muertes por sida. La proyección de nuevos casos de VIH, nuevos casos de sida y muertes por sida en España en un escenario sin TAR, se estimó a partir de los casos descritos entre los años 1981 y 1995, publicados por el Programa de las Naciones Unidas sobre VIH y Sida (ONUSIDA) y el programa Spectrum22,23(tabla 1). La estimación de las proyecciones se realizó mediante el método del suavizamiento exponencial triple24. Los nuevos diagnósticos de VIH registrados en España en el periodo 1987-2012 se obtuvieron de ONUSIDA/Spectrum22,23 y los registrados en el periodo 2013-2018 del Sistema de Información sobre Nuevos Diagnósticos de VIH (SINIVIH) de España25 (tabla 1).
Muertes por sida, casos de sida y casos de VIH proyectados (esperados) sin TAR (valores medios) y observados con TAR
| Años | Muertes por sida | Casos de sida | Casos de VIH | |||
|---|---|---|---|---|---|---|
| Esperados* | Observados | Esperados* | Observados | Esperados* | Observados | |
| 1987 | 433 | 433 | 1.095 | 1.095 | 5.726 | 3.615 |
| 1988 | 800 | 800 | 2.279 | 2.279 | 6.717 | 4.184 |
| 1989 | 1.378 | 1.378 | 3.173 | 3.173 | 7.716 | 4.720 |
| 1990 | 2.033 | 2.033 | 3.937 | 3.937 | 8.560 | 5.149 |
| 1991 | 2.657 | 2.657 | 4.579 | 4.579 | 9.269 | 5.408 |
| 1992 | 3.477 | 3.477 | 5.103 | 5.103 | 9.630 | 5.460 |
| 1993 | 4.227 | 4.227 | 5.527 | 5.527 | 9.745 | 5.324 |
| 1994 | 5.058 | 5.058 | 7.511 | 7.511 | 9.642 | 5.056 |
| 1995 | 5.857 | 5.857 | 8.760 | 7.205 | 9.465 | 4.722 |
| 1996 | 6.656 | 5.749 | 10.013 | 6.773 | 9.257 | 4.374 |
| 1997 | 7.455 | 3.019 | 11.265 | 4.983 | 9.087 | 4.037 |
| 1998 | 8.254 | 1.878 | 12.517 | 3.758 | 9.007 | 3.714 |
| 1999 | 9.053 | 1.844 | 13.769 | 3.173 | 9.017 | 3.399 |
| 2000 | 9.852 | 1.717 | 15.022 | 2.941 | 7.667 | 2.595 |
| 2001 | 10.651 | 1.635 | 16.274 | 2.536 | 7.336 | 2.171 |
| 2002 | 11.450 | 1.614 | 17.526 | 2.387 | 7.569 | 1.925 |
| 2003 | 12.249 | 1.635 | 18.778 | 2.334 | 7.954 | 2.018 |
| 2004 | 13.048 | 1.554 | 20.031 | 2.107 | 8.427 | 2.140 |
| 2005 | 13.847 | 1.450 | 21.283 | 1.889 | 8.870 | 2.257 |
| 2006 | 14.646 | 1.315 | 22.535 | 1.771 | 9.283 | 2.363 |
| 2007 | 15.445 | 1.313 | 23.788 | 1.660 | 9.836 | 2.456 |
| 2008 | 16.244 | 1.215 | 25.040 | 1.577 | 10.141 | 2.528 |
| 2009 | 17.043 | 1.079 | 26.292 | 1.437 | 7.655 | 74 |
| 2010 | 17.842 | 1.020 | 27.544 | 1.458 | 6.334 | 539 |
| 2011 | 18.641 | 953 | 28.797 | 1.293 | 6.712 | 499 |
| 2012 | 19.440 | 880 | 30.049 | 1.175 | 6.375 | 273 |
| 2013 | 20.239 | 750 | 31.301 | 858 | 4.914 | 139 |
| 2014 | 21.038 | 700 | 32.553 | 688 | 4.970 | 81 |
| 2015 | 21.837 | 633 | 33.806 | 611 | 4.704 | 0 |
| 2016 | 22.636 | 498 | 35.058 | 549 | 4.702 | 887 |
| 2017 | 23.435 | 445 | 36.310 | 514 | 4.414 | 807 |
| 2018 | 24.234 | 397 | 37.562 | 415 | 4.408 | 780 |
| Total | 381.444 | 59.502 | 589.078 | 87.296 | 245.111 | 83.694 |
Sida: síndrome de inmunodeficiencia adquirida; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.
Fórmulas del suavizamiento exponencial triple. Ecuación general:
St=αytIt−L+(1−α)(St−1+bt−1)
Suavizado de tendencias:
bt=γ(St−St−1)+(1−γ)bt−1
Suavizado estacional:
It=βytSt+(1−β)It−L
Previsión:
Ft+m=(St+mbt)It−L+m
siendo, α, β, γ las constantes que toman un valor del intervalo [0; 1]; y es el valor de observación; S es el valor de observación suavizado; b es la tasa de tendencia; I es el índice de estacionalidad; F es el pronóstico para m períodos futuros; t es un índice que denota un período de tiempo.
La estimación de la supresión viral del VIH en España (90,4% [87,5%-92,8%]) se obtuvo de informes de la Unidad de Vigilancia de VIH y conductas de riesgo del Centro Nacional de Epidemiología3,5. Las tasas anuales de transmisión (hombres que tienen sexo con hombres [16,6%; 12,2%-22,3%], por uso de drogas intravenosas [7,6%; 4,9%-11,0%], heterosexual [1,0%; 0,7%-1,3%], de madre a hijo [22,6%; 17,0%-29,0%], por hemoderivados o transfusiones [92,5%; 80,9%-96,1%]) se estimaron a partir los datos de la revisión sistemática de Patel et al.26
El coste anual del TAR en España en el periodo 1987-1996, se obtuvo mediante el número de pacientes con VIH/sida recogido por ONUSIDA/Spectrum23 y el coste anual por paciente de los TAR comercializados cada año27. El coste anual del TAR en España (considerando también el coste de los medicamentos genéricos) en los periodos 1997-2012 y 2013-2016 se obtuvo de informes del Plan Nacional sobre el Sida4,28. El coste anual por el TAR en el periodo 2017-2018, se obtuvo de los datos de ventas anuales en España29.
El coste anual por paciente con VIH (1987-2018), en el supuesto de que no hubiera sido tratado con TAR, se estimó a partir del coste en el año 1995, según el estudio de Antoñanzas et al.30, ajustado conforme al IPC interanual y considerando una población de 29.062 pacientes prevalentes con VIH en 1995, según los datos de ONUSIDA/Spectrum23. El coste anual de un paciente con sida, sin TAR, en el mismo periodo (1987-2018) se estimó mediante el mismo estudio, realizando los ajustes interanuales según el IPC23.
En el caso base del análisis, se estimó el valor monetario de una vida como el PIB anual per cápita en el periodo 1987-2018, al igual que en un estudio publicado previamente7,16,17.
Para estimar el beneficio del TAR comercializado por Gilead Sciences, se partió de una asunción conservadora, ya que sólo se capturó el 100% del beneficio en caso de ser el tratamiento completo y el 50% del beneficio cuando fuera un tratamiento en combinación con otros fármacos que no son de Gilead.
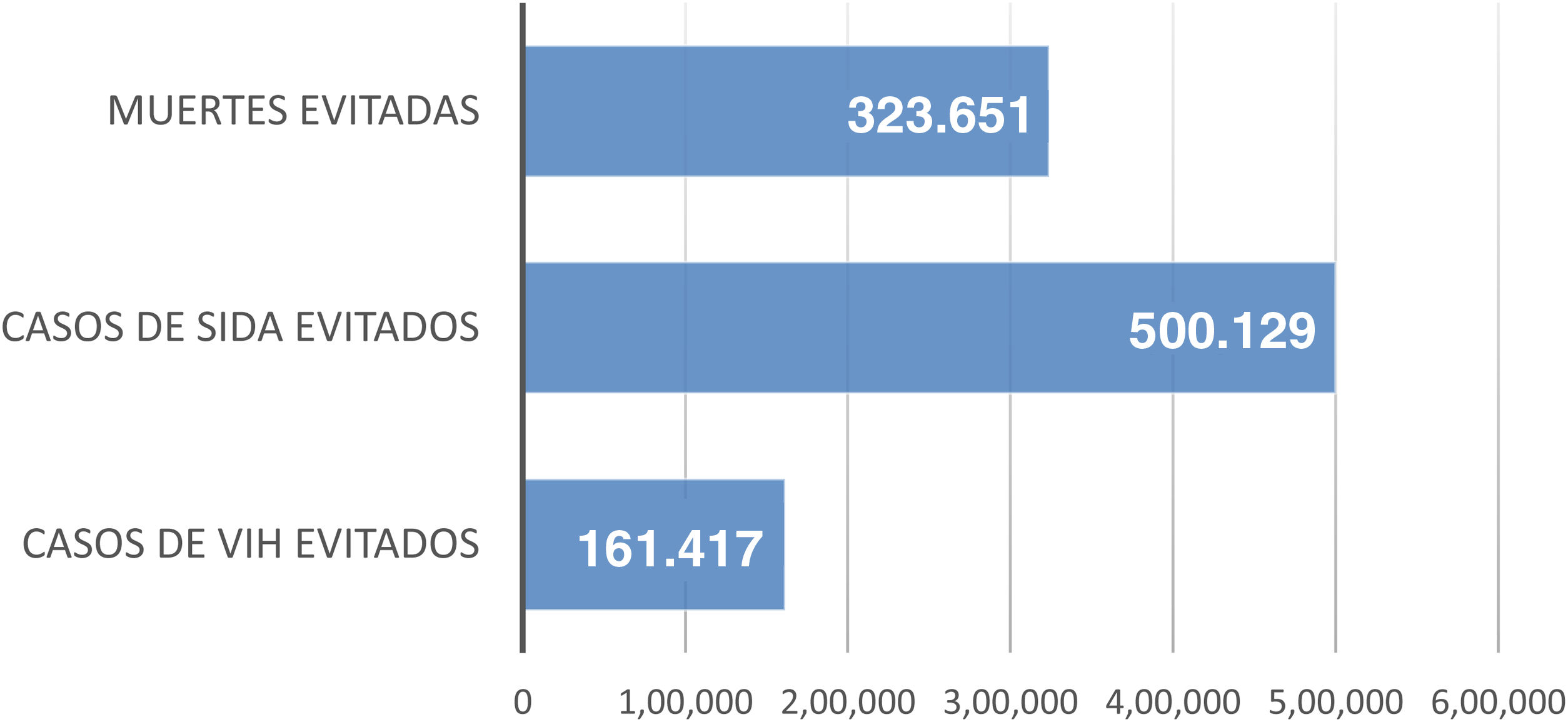
ResultadosCaso baseBeneficio clínicoSe estima que, en el periodo analizado de 32 años (1987-2018), el TAR habría evitado 323.651 muertes por sida (Figura S1-apéndice suplementario; fig. 2), 500.129 casos de sida (Figura S2-apéndice suplementario; fig. 2) y 161.417 casos de VIH (Figura S3-apéndice suplementario; fig. 2).
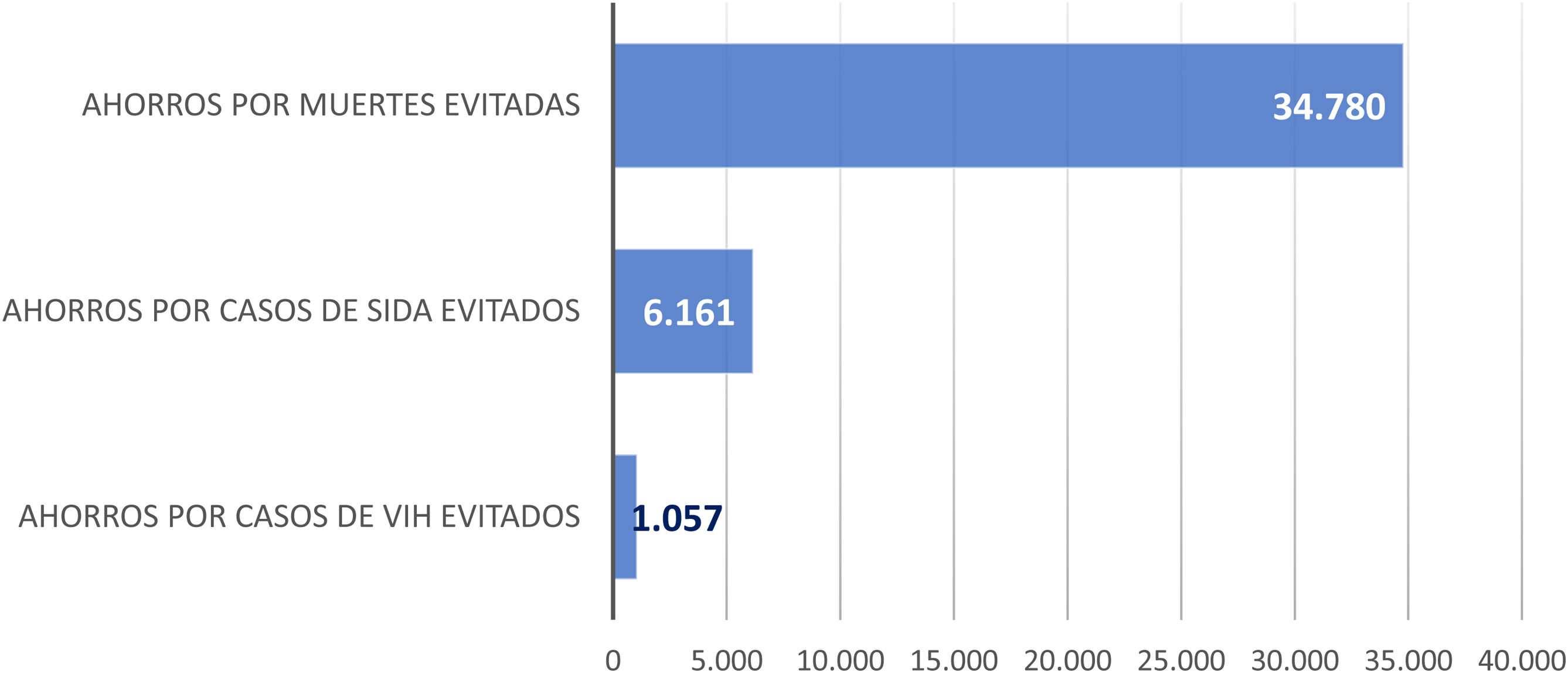
Impacto económicoEl impacto económico se muestra en la figura 3 y en la tabla 2. El coste del TAR en el periodo de 32 años ascendería a 6.185 (IC95%; 5.545; 6.821) millones de euros. El beneficio (ahorro) por las muertes evitadas ascendería a 34.780 (IC95%; 23.346; 49.034) millones de euros; por los casos de sida evitados a 6.161 (IC95%; 5.511; 6.844) millones de euros; y por los casos de VIH evitados a 1.057 (IC95%; 1,041; 1.073) millones de euros. Los beneficios (ahorros) totales asociados al TAR ascenderían, en el periodo analizado, a 35.812 (IC95%; 24.353; 50.131) millones de euros (tabla 2).
Resultados del análisis de coste-efectividad de TAR en España en el período de 32 años (1987-2018) (millones de euros [€]). Caso base. Perspectiva de la sociedad (3% de descuento anual)
| Media | IC 95% | |
|---|---|---|
| Costes de la TAR | 6.185 | 5.545; 6.821 |
| Beneficios de la TAR | ||
| Por muertes evitadas | 34.780 | 23.346; 49.034 |
| Por casos de sida evitados | 6.161 | 5.511; 6.844 |
| Por casos de VIH evitados | 1.057 | 1.041; 1.073 |
| Beneficios totales | 41.997** | 29.898; 56.952 |
| Beneficio neto de la TAR | 35.812 | 24.353; 50.131 |
| Índice Beneficio / Coste* | 6,79 | 5,39; 8,35 |
El TAR en el periodo de 32 años tuvo un índice beneficio/coste de 6,79 (IC95%; 5,39; 8,35). Por tanto, el TAR fue rentable (con un índice mayor que 1) en España en el periodo analizado (tabla 2).
Análisis de sensibilidadComo puede verse en la Tabla 3 y Tabla S2-apéndice suplementario, el TAR fue igualmente rentable cuando el análisis se realizó desde la perspectiva del SNS, sin descuento anual de costes y beneficios o con descuentos del 6%. En concreto, desde la perspectiva del SNS y sin considerar descuentos, el coste del TAR ascendería a 11.809 millones de euros en los 32 años analizados, y los beneficios ascenderían a 14.015 millones de euros, obteniéndose por tanto un beneficio neto de 2.206 millones de euros (tabla 3). Cuando se consideró el valor monetario de la vida estadística, el beneficio neto del TAR ascendería a 1.961.943 millones de euros en el periodo de 32 años (Tabla S2-apéndice suplementario).
Resultados del análisis de coste-efectividad de TAR en España en el periodo de 32 años (1987-2018) (millones de euros [€]). Perspectiva del SNS (0% de descuento anual)
| Media | IC 95% | |
|---|---|---|
| Costes de la TAR | 11.809 | 10.749; 13.067 |
| Beneficios de la TAR | ||
| Por muertes evitadas | 12.243 | 10.922; 13.603 |
| Por casos de sida evitados | 1.772 | 1.746; 1.796 |
| Por casos de VIH evitados | 14.015 | 12.668; 15.399 |
| Beneficios totales | 2.206 | 1.919; 2.332 |
| Beneficio neto de la TAR | 1,19 | 1,18; 1,19 |
* Un índice beneficio/coste mayor que 1 indica que la TAR ha sido rentable en España en el periodo analizado. IC: intervalo de confianza; sida: síndrome de inmunodeficiencia adquirida; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.
Los resultados de los dos subanálisis realizados pueden verse en el apéndice suplementario.
DiscusiónSegún el presente estudio, el TAR de los pacientes VIH-positivos españoles ha sido altamente coste-efectivo, tanto en muertes y casos de sida y VIH evitados, como en términos económicos. Según los resultados obtenidos en nuestro estudio, el TAR produjo un índice beneficio/coste de 6,79, lo que equivaldría a decir que por cada euro invertido en TAR se obtuvo un retorno social de la inversión de 6,79 €. Este retorno social de la inversión es más favorable que el observado con otras intervenciones analizadas en nuestro entorno sanitario, concretamente de 1,83 € en la esclerosis múltiple31, de 3,25 € en la insuficiencia cardíaca32 y de 5,04 € en la psoriasis33.
Entre las fortalezas del presente estudio, deben destacarse las siguientes: (i) los datos epidemiológicos reales con TAR (muertes, nuevos casos) se obtuvieron de fuentes y registros oficiales (ONUSIDA, Spectrum, SINIVIH)22,23,25; (ii) todas las asunciones del modelo fueron validadas por expertos españoles en epidemiología y manejo de los pacientes con VIH/sida, y (iii) todas las variables del estudio fueron analizadas mediante un modelo probabilístico con una metodología contrastada, lo que ha permitido analizar la incertidumbre de las variables del modelo y obtener los resultados medios del beneficio neto y del índice beneficio/coste con sus intervalos de confianza del 95%14,34. El presente análisis de coste-beneficio se realizó conforme a las guías y recomendaciones publicadas en España35,36.
Al igual que en el estudio a nivel mundial de Forsythe et al.7, en nuestro estudio a nivel nacional, se confirma que en las series históricas el TAR ha sido una intervención sanitaria rentable, superando ampliamente los beneficios (tanto sanitarios como económicos) a los costes de adquisición del TAR. Esa rentabilidad ha sido mayor a partir de la utilización del TAR de gran actividad (TARGA).
Aunque sobradamente compensado, según el presente análisis, el gasto en TAR en España debe ponerse en contexto. El estimado en nuestro estudio asciende a 6.185 millones de euros aplicando el descuento recomendado por las guías de evaluación económica, y a 11.809 millones de euros sin descontar en 32 años. A modo de ejemplo, en el año 2019 fue de 677 millones de euros. El gasto del SNS de España en productos farmacéuticos y sanitarios en el año 2019 fue de 23.638 millones de euros37. Por tanto, el gasto anual atribuible al TAR constituyó un 2,86% del gasto total del SNS en productos farmacéuticos y sanitarios.
No obstante, el aspecto más importante del TAR es su impacto sanitario, reduciendo la incidencia/mortalidad de VIH/sida y maximizando la salud del paciente38. Según este estudio, en el periodo entre 1987 y 2018, el TAR evitó 323.651 muertes por sida, 500.129 nuevos casos de sida y 161.417 nuevos casos de VIH.
Respecto a las posibles limitaciones del estudio, en primer lugar, debe tenerse en cuenta que se ha utilizado un modelo teórico que es, por definición, una simulación simplificada de la realidad. En segundo lugar, en el modelo fue necesario (como es habitual en este tipo de análisis) realizar algunas asunciones por falta de datos. La principal asunción fue la proyección de la mortalidad y de los nuevos casos de VIH o sida en el supuesto hipotético de que no se hubiera dispuesto de TAR en el periodo 1987-2018. Estas proyecciones de muertes y casos esperados se realizaron mediante un método contrastado, como es el suavizamiento exponencial triple24,39. Este método de proyección es conservador en comparación con el método de regresión lineal de mínimos cuadrados, que hubiera arrojado resultados de mayor rentabilidad del TAR. La proyección de muertes por sida y casos de sida esperados desde el año 1996, se calculó a partir de la tendencia observada entre los años 1987-1995. Por tanto, para realizar la proyección se tuvieron en cuenta todos los factores y medidas de prevención que determinaron los casos observados en el periodo 1987-1995; sin embargo, podría ser una limitación del modelo el hecho de que en las proyecciones sin TAR no se consideró explícitamente el posible efecto del reforzamiento de las medidas preventivas que se hubiera producido en el caso supuesto de que el TAR no se hubiera establecido en el periodo analizado. No obstante, se ha tratado de compensar esta posible limitación mediante una aproximación conservadora del cálculo, basado en el triple suavizamiento exponencial. Por otra parte, las predicciones realizadas se contrastaron con el comportamiento del VIH en países con un acceso limitado al TAR, así como mediante el modelo predictivo Spectrum de ONUSIDA.
El TAR ha cambiado radicalmente el impacto de la infección por VIH, que ha pasado de ser una enfermedad letal a una enfermedad crónica manejable40. El objetivo de ONUSIDA para el año 2030, es conseguir que el 95% de las personas que viven con el VIH conozcan su estado serológico respecto al VIH; que el 95% de las personas diagnosticadas con el VIH reciba TAR continuado y que el 95% de éstas alcancen la supresión viral6,41. Este objetivo lo fijó ONUSIDA considerando que el tratamiento del VIH es fundamental para acabar con la epidemia de SIDA y conseguir que la transmisión del VIH sea un hecho excepcional, que el tratamiento evita las muertes relacionadas con el sida, previene nuevas infecciones y supone un ahorro económico41. Estos supuestos han sido analizados y confirmados en el presente estudio.
ConclusionesLa inversión en TAR durante más de 32 años en España ha limitado el número de muertes por sida, así como los nuevos casos de VIH y sida, al tiempo que ha proporcionado importantes ahorros económicos para el SNS gracias al retorno maximizado de la inversión. La rentabilidad del TAR se ha incrementado progresivamente a lo largo del periodo analizado de 32 años, debido principalmente a la mayor eficiencia y efectividad del TAR.
Contribuciones de los autoresTodos los autores contribuyeron al diseño del estudio, la interpretación de los datos, la revisión crítica de la publicación y aprobaron la versión final del manuscrito para su publicación. Carlos Rubio Terrés y Darío Rubio Rodríguez realizaron el modelo económico.
FinanciaciónEl estudio fue financiado, sin ningún tipo de restricción, por Gilead Sciences, SL. Gilead Sciences, SL no ha tenido ningún papel en el análisis de los datos ni en la preparación del manuscrito.
Conflictos de interesesMJPE ha efectuado labores de consultoría, disfrutado de becas para investigación, percibido financiación por sesiones y ha desarrollado materiales educacionales, actualmente o en los últimos tres años, para AbbVie, Gilead Sciences, Janssen, Merck y ViiV Healthcare. DPP ha recibido fondos para investigación y/o honorarios por asesorías y/o conferencias por parte de Viiv, Gilead, Janssen y MSD. PV ha percibido honorarios por asesorías y/o conferencias por parte de Abbvie, ViiV Healthcare, Gilead Sciences, Janssen y MSD. IJ ha percibido honorarios por impartir formación de ViiV Healthcare y honorarios de asesoría de Gilead. AC es empleado de Gilead Sciences, SL. DRR y CRT son consultores de Health Value, compañía que recibió pagos en relación con el estudio.
Este estudio no hubiera sido posible sin el apoyo documental proporcionado por SIDA STUDI (Víctor León, Responsable del Centro de Documentación y Recursos Pedagógicos).
Resultados preliminares de este estudio fueron presentado como póster en los siguientes congresos: 65 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria, 20-22 de octubre de 2020; Virtual ISPOR Europe 2020, 16-19 November 2020.






![Impacto económico de la TAR (1987-2018) en España (millones de euros [€]). Perspectiva de la sociedad. Sida: síndrome de inmunodeficiencia adquirida; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana. Impacto económico de la TAR (1987-2018) en España (millones de euros [€]). Perspectiva de la sociedad. Sida: síndrome de inmunodeficiencia adquirida; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.](https://static.elsevier.es/multimedia/0213005X/0000004000000010/v1_202212020757/S0213005X21001907/v1_202212020757/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

