Describir la experiencia clínica con dalbavancina en el tratamiento de la infección de pie diabético en una unidad multidisciplinar de un hospital de segundo nivel.
MétodosEstudio descriptivo retrospectivo de pacientes con infección de pie diabético tratados con dalbavancina en la Unidad de Pie Diabético del Hospital Universitario Fundación Alcorcón de septiembre de 2016 a diciembre de 2019. Se recogieron parámetros demográficos y comorbilidades, características de la infección y del tratamiento con dalbavancina. Se estimó la tasa de curación a los 90 días tras finalizar el tratamiento.
ResultadosUn total de 23 pacientes con infección de pie diabético (osteomielitis) fueron tratados con dalbavancina; 19 eran hombres con una edad media de 65 años. Los microorganismos más frecuentemente aislados fueron Staphylococcus aureus (11) y Corynebacterium striatum (7). En 22 casos se usó dalbavancina como terapia de segunda elección, en 11 debido a toxicidad de otros antibióticos. La mediana de duración del tratamiento fue de 5 (4-7) semanas; la dosis más frecuente de dalbavancina (8 pacientes) fue de 1.000mg seguido de 500mg semanales durante 5 semanas. Tres pacientes presentaron efectos secundarios leves (náuseas y molestias gastrointestinales). A los 90 días de finalizar el tratamiento, el 87% (20) de los pacientes se curaron (IC95%: 65,2-94,52%).
ConclusiónLos pacientes con osteomielitis por microorganismos grampositivos que recibieron como parte del tratamiento multidisciplinar antibioterapia con dalbavancina tuvieron una elevada tasa de curación, con una adecuada tolerancia y escasos efectos secundarios. Dalbavancina ofrece una alternativa segura en el tratamiento de la infección profunda de pie diabético.
To describe the clinical experience with dalbavancin in the treatment of diabetic foot infection in a multidisciplinary unit of a second level hospital.
MethodsA retrospective, descriptive study was made with all patients with diabetic foot infection treated with dalbavancin in the Diabetic Foot Unit of Hospital Universitario Fundación Alcorcón, covering the period from September 2016 to December 2019. Demographic parameters and comorbidities, characteristics of the infection and treatment with dalbavancin were recorded. The cure rate was estimated at 90 days after finishing the treatment.
ResultsA total of 23 patients with diabetic foot infection (osteomyelitis) started treatment with dalbavancin, 19 were men and the mean age was 65 years. The microorganisms most frequently isolated for the indication of treatment with dalbavancin were Staphylococcus aureus (11) and Corynebacterium striatum (7). Dalbavancin was used as a second choice therapy in 22 cases, in 11 due to toxicity from other antibiotics. The median duration of treatment was 5 (4-7) weeks; the most frequent dose of dalbavancin (8 patients) was 1000mg followed by 500mg weekly for 5 weeks. 3 patients presented mild side effects (nausea and gastrointestinal discomfort). At 90 days after completion of dalbavancin therapy, 87% (20) of the patients were cured (95% CI: 65.2%-94.52%).
ConclusionPatients with osteomyelitis due to gram-positive microorganisms who received as part of the multidisciplinary antibiotic treatment with dalbavancin, had a high rate of cure with adequate tolerance and few side effects. Dalbavancin offers a safe alternative in treating deep diabetic foot infection.
La infección de pie diabético es una complicación que sufren hasta un 15% de los pacientes diabéticos a lo largo de su vida1. Cuando se asocia a isquemia, supone la causa más frecuente de amputación no traumática de extremidad inferior, de ingreso hospitalario y de disminución de la calidad de vida en estos pacientes2. Esta infección es de gran complejidad debido a que son múltiples factores (presencia de osteomielitis, grado de isquemia, comorbilidad asociada) los que condicionan su evolución, requiriendo equipos multidisciplinares para su adecuado manejo. En las infecciones agudas, se ha descrito una incidencia en torno al 43% de Staphylococcus aureus3 con una elevada prevalencia de resistencia a meticilina4. En la infección crónica, a menudo, está implicada flora polimicrobiana incluyendo microorganismos anaerobios, enterococos y bacilos gramnegativos3. Dalbavancina es un glicopéptido de reciente incorporación en el tratamiento de infecciones por microorganismos grampositivos con características farmacocinéticas únicas. Los ensayos clínicos han demostrado su eficacia y seguridad en el tratamiento de infecciones de piel y partes blandas5, así como en infección osteoarticular6. Aunque no existen estudios sobre eficacia de dalbavancina en la infección de pie diabético, sí hay publicaciones que comparan su eficacia en el tratamiento de osteomielitis frente al tratamiento habitual con una curación del 97%7 y publicaciones sobre la experiencia en la práctica clínica en el tratamiento de osteomielitis con porcentajes de curación del 65%8. El objetivo de nuestro estudio es mostrar la experiencia clínica y seguridad del tratamiento con dalbavancina en pacientes con infección profunda de pie diabético (osteomielitis).
Material y métodosSe trata de un estudio retrospectivo y descriptivo llevado a cabo en la Unidad de Pie Diabético del Hospital Fundación Alcorcón, un hospital de segundo nivel que cuenta con 400 camas planificadas de hospitalización. En este centro la Unidad de Pie Diabético es multidisciplinar, formada por cirugía vascular, podología, enfermedades infecciosas y enfermería especializada. Los pacientes son seguidos de forma ambulatoria haciéndose recomendaciones sobre cuidados de la piel, se realizan descargas para evitar úlceras y la sobreinfección de las mismas y se valora la necesidad y posibilidad de revascularización en los pacientes isquémicos. Cuando el paciente presenta infección se contacta con el especialista en enfermedades infecciosas para el inicio de tratamiento antibiótico. Se atienden en torno a 1.000 pacientes al año de forma ambulatoria, de los cuales el 17,5% tienen infección.
Entre septiembre de 2016 y diciembre de 2019 se atendieron un total 353 pacientes con infección de pie diabético. Se incluyeron en el estudio todos aquellos con diagnóstico de osteomielitis que habían recibido dalbavancina en este periodo.
Se consideraron candidatos a recibir dalbavancina aquellos pacientes que tenían signos de infección según los criterios de la Sociedad Americana de Enfermedades Infecciosas (IDSA)4 por microorganismos grampositivos y una o varias de las siguientes características: fracaso terapéutico, toxicidad e interacciones farmacológicas de antibióticos usados previamente (cotrimoxazol, quinolonas, oxazolidinonas y tetraciclinas). La decisión de iniciar tratamiento con dalbavancina, así como la dosis utilizada, fue tomada por el especialista en enfermedades infecciosas que forma parte de la Unidad de Pie Diabético. La dosis utilizada varió a lo largo del periodo de estudio según experiencia y evidencia científica. La administración del fármaco se realizó en general en hospital de día médico.
La curación se confirmó cuando la lesión se mantuvo cicatrizada tras 90 días del cierre primario, o si el cultivo intraoperatorio resultó negativo tras al menos una dosis de dalbavancina en aquellos pacientes que requirieron amputación posterior. Consideramos fracaso terapéutico de los antibióticos previos la persistencia de signos de infección según los criterios de la Sociedad Americana de Enfermedades Infecciosas (IDSA)4 y/o persistencia de probe-to-bone (PTB)9,10 positivo y/o no cicatrización de la lesión. El diagnóstico de osteomielitis en nuestra unidad se realiza con la combinación de PTB positivo y radiografía con o sin cultivo óseo11 (recogido según las recomendaciones de la guía IGWF)12.
En relación con los pacientes, se recogieron variables demográficas (edad y sexo) y de comorbilidad necesarias para calcular el índice de Charlson13 y el índice McCabe14, así como el número de fármacos de su tratamiento habitual para definir si existían polifarmacia (≥5 fármacos)15 o tratamiento con fármacos incluidos en la «Lista de medicamentos de alto riesgo en pacientes crónicos» (Ministerio de Sanidad, Servicios Sociales e Igualdad)16, con el objetivo de evitar o predecir posibles efectos secundarios por interacciones.
En relación con la infección, se registraron el grado de infección (leve, moderada o grave) según la clasificación de la IDSA4, el tipo de afectación (neuropática, isquémica o mixta), el método diagnóstico de osteomielitis (cultivo óseo, PTB, radiografía simple), si la infección era monomicrobiana o polimicrobiana, aislamiento microbiológico en cultivo óseo (en infecciones polimicrobianas se recogieron los microorganismos sensibles a dalbavancina). También se recogieron la localización de la lesión, la necesidad y tipo de amputación, la realización o no de revascularización y de qué tipo, y la necesidad de utilización de terapia de presión negativa (TPN), como indicadores de la complejidad de la infección. Por último, se recogió la antibioterapia utilizada previa al inicio de dalbavancina, así como el motivo de indicación, la dosis y duración del tratamiento, y las reacciones adversas e incidencias durante su administración.
El estudio se realizó de acuerdo con los criterios de buena práctica clínica y la Declaración de Helsinki17 y fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario Fundación Alcorcón (18/68), y clasificado por la Agencia Española de Medicamento (GNJ-DAL-2020-01).
Los resultados se expresan como media±desviación estándar (DE) o mediana y rango intercuartílico para las variables continuas, y como porcentajes para las variables cualitativas. Los intervalos de confianza se han calculado mediante el método de Wilson.
ResultadosDatos demográficos y clínicosUn total de 23 pacientes con infección de pie diabético iniciaron tratamiento con dalbavancina. Las variables demográficas, comorbilidad, el tipo y la gravedad de la infección, así como otras características basales, se muestran en la tabla 1.
Características demográficas y clínicas de la cohorte
| Variable | Número (%)a(n=23) |
|---|---|
| Datos demográficos | |
| Edad (media±DE) | 65±12 |
| Género, varón | 19 (82,6) |
| Comorbilidades | |
| HTA | 19 (82,6) |
| Dislipemia | 17 (74) |
| Cardiopatía isquémica (IAM) | 8 (34,8) |
| ERC (filtrado glomerular <60ml/min) | 6 (26) |
| Ictus | 4 (17) |
| Tabaquismo activo | 4 (17) |
| Insuficiencia cardiaca | 3 (13) |
| Arritmia | 3 (13) |
| Hemodiálisis | 3 (13) |
| Índice de Charlson, mediana (q1-q3) | 6 (4-9) |
| Índice McCabe | |
| Enfermedad tardíamente fatal | 16 (69,5) |
| Enfermedad no fatal | 7 (30,4) |
| Polifarmacia (>5 fármacos) sí | 15 (74) |
| Fármacos de alto riesgobsí | 22 (95,6) |
| Grado de infecciónc | |
| Moderada | 18 (78,2) |
| Grave | 5 (21,7) |
| Tipo de pie diabético | |
| Isquémico | 12 (52) |
| Mixto | 7 (30) |
| Neuropático | 4 (17,3) |
| Diagnóstico de osteomielitis | |
| PTB+ | 22 (95,6) |
| Cultivo óseo | 22 (95,6) |
| Radiografía simple | 10 (43,5) |
| Criterios diagnósticos | |
| PTB+cultivo | 13 (56,5) |
| PTB+cultivo+radiografía | 8 (34,7) |
| Cultivo+radiografía | 1 (4,3) |
| PTB+radiografía | 1 (4,3) |
| Infección monomicrobiana | 12 (52,2) |
| Microorganismosd | |
| Staphylococcus aureus | 11 (47,8) |
| Corynebacterium striatum | 7 (30,4) |
| Estafilococos negativos para la coagulasa | 3 (8,6) |
| Enterococcus faecium | 1 (4,3) |
DE: desviación estándar; ERC: enfermedad renal crónica; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; PTB: probe-to-bone.
Fármacos que, cuando se utilizan incorrectamente, presentan una mayor probabilidad de causar daños graves o incluso mortales a los pacientes16.
La dalbavancina se utilizó en 22 casos (95,6%) como tratamiento de segunda elección; en 11 (47,8%) de los casos por toxicidad de otros antibióticos y en 8 (34,8%) por fracaso del tratamiento antibiótico previo. En 2 pacientes (8,6%) se debió a una situación de desabastecimiento de tedizolid cuando no habían tolerado linezolid, otros 2 casos (8%) para evitar interacciones y en un caso (4,3%) para adelantar el alta a domicilio.
En cuanto a la toxicidad ocasionada por antibióticos previos, lo más frecuente fue la toxicidad gastrointestinal causada bien por linezolid en 5 pacientes (21,7%) o por clindamicina en 3 pacientes (13%), seguido de toxicidad hematológica por linezolid en 4 pacientes (17,4%).
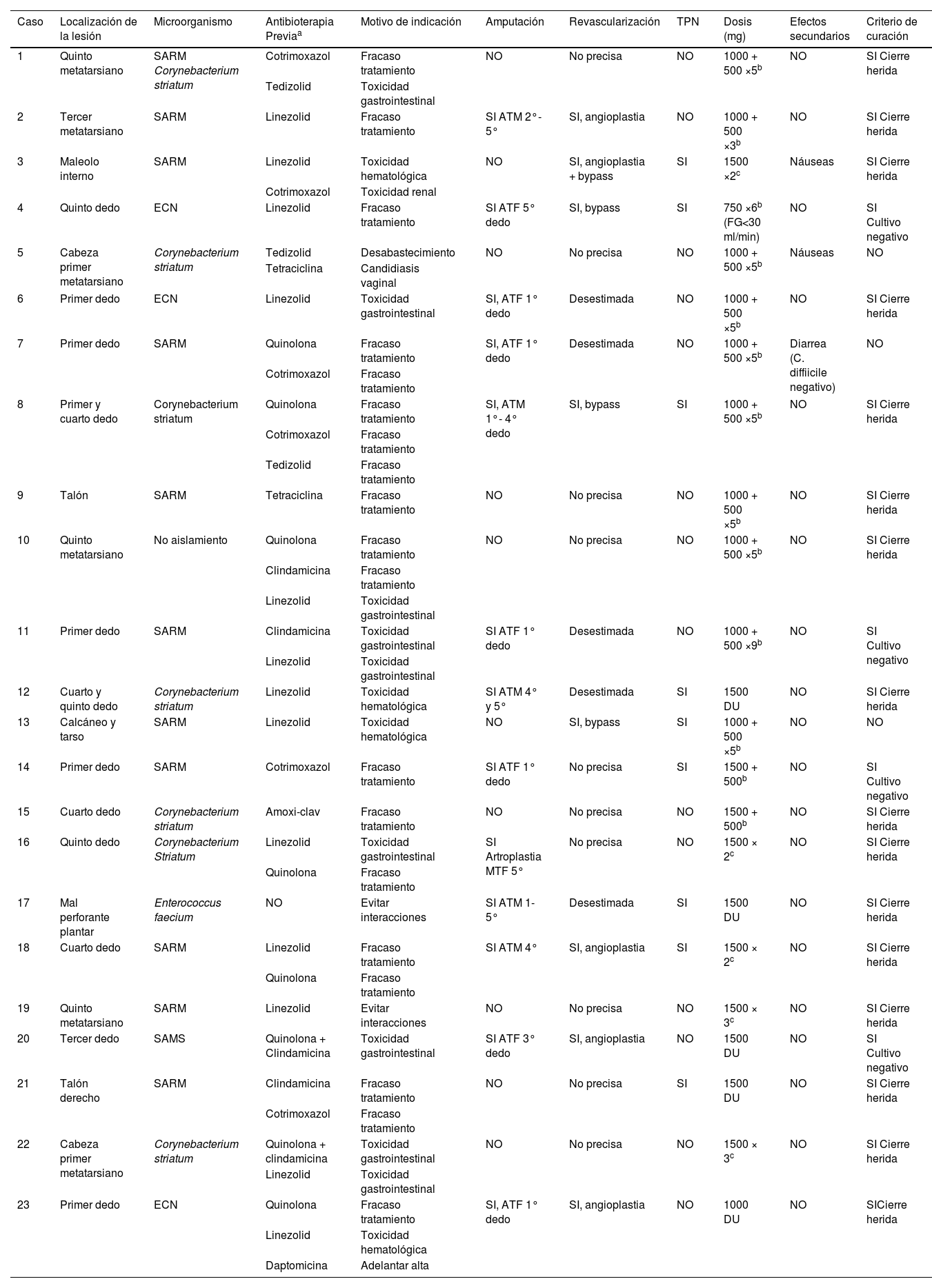
La mediana de duración del tratamiento con dalbavancina fue de 5 (4-7) semanas; en 8 (34,8%) de los pacientes la dosis de dalbavancina administrada fue de 1.000mg seguido de 500mg semanales durante 5 semanas, seguida en 5 (21,7%) de los casos de 2 dosis de 1.500mg separadas 15 días. En todos los casos menos uno, la administración de dalbavancina se realizó de forma ambulatoria. En 13 (56,5%) de los pacientes además del tratamiento antibiótico se realizó amputación, que fue menor en todos los casos (por debajo del tobillo). Trece pacientes (56,5%) tenían indicación de revascularización, pero en 5 (38,4%) se desestimó su realización. Todos estos datos aparecen detallados por paciente en la tabla 2.
Datos específicos por paciente y resultados del tratamiento con dalbavancina
| Caso | Localización de la lesión | Microorganismo | Antibioterapia Previaa | Motivo de indicación | Amputación | Revascularización | TPN | Dosis (mg) | Efectos secundarios | Criterio de curación |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Quinto metatarsiano | SARM Corynebacterium striatum | Cotrimoxazol | Fracaso tratamiento | NO | No precisa | NO | 1000 + 500 ×5b | NO | SI Cierre herida |
| Tedizolid | Toxicidad gastrointestinal | |||||||||
| 2 | Tercer metatarsiano | SARM | Linezolid | Fracaso tratamiento | SI ATM 2°- 5° | SI, angioplastia | NO | 1000 + 500 ×3b | NO | SI Cierre herida |
| 3 | Maleolo interno | SARM | Linezolid | Toxicidad hematológica | NO | SI, angioplastia + bypass | SI | 1500 ×2c | Náuseas | SI Cierre herida |
| Cotrimoxazol | Toxicidad renal | |||||||||
| 4 | Quinto dedo | ECN | Linezolid | Fracaso tratamiento | SI ATF 5° dedo | SI, bypass | SI | 750 ×6b (FG<30 ml/min) | NO | SI Cultivo negativo |
| 5 | Cabeza primer metatarsiano | Corynebacterium striatum | Tedizolid | Desabastecimiento | NO | No precisa | NO | 1000 + 500 ×5b | Náuseas | NO |
| Tetraciclina | Candidiasis vaginal | |||||||||
| 6 | Primer dedo | ECN | Linezolid | Toxicidad gastrointestinal | SI, ATF 1° dedo | Desestimada | NO | 1000 + 500 ×5b | NO | SI Cierre herida |
| 7 | Primer dedo | SARM | Quinolona | Fracaso tratamiento | SI, ATF 1° dedo | Desestimada | NO | 1000 + 500 ×5b | Diarrea (C. diffiicile negativo) | NO |
| Cotrimoxazol | Fracaso tratamiento | |||||||||
| 8 | Primer y cuarto dedo | Corynebacterium striatum | Quinolona | Fracaso tratamiento | SI, ATM 1°- 4° dedo | SI, bypass | SI | 1000 + 500 ×5b | NO | SI Cierre herida |
| Cotrimoxazol | Fracaso tratamiento | |||||||||
| Tedizolid | Fracaso tratamiento | |||||||||
| 9 | Talón | SARM | Tetraciclina | Fracaso tratamiento | NO | No precisa | NO | 1000 + 500 ×5b | NO | SI Cierre herida |
| 10 | Quinto metatarsiano | No aislamiento | Quinolona | Fracaso tratamiento | NO | No precisa | NO | 1000 + 500 ×5b | NO | SI Cierre herida |
| Clindamicina | Fracaso tratamiento | |||||||||
| Linezolid | Toxicidad gastrointestinal | |||||||||
| 11 | Primer dedo | SARM | Clindamicina | Toxicidad gastrointestinal | SI ATF 1° dedo | Desestimada | NO | 1000 + 500 ×9b | NO | SI Cultivo negativo |
| Linezolid | Toxicidad gastrointestinal | |||||||||
| 12 | Cuarto y quinto dedo | Corynebacterium striatum | Linezolid | Toxicidad hematológica | SI ATM 4° y 5° | Desestimada | SI | 1500 DU | NO | SI Cierre herida |
| 13 | Calcáneo y tarso | SARM | Linezolid | Toxicidad hematológica | NO | SI, bypass | SI | 1000 + 500 ×5b | NO | NO |
| 14 | Primer dedo | SARM | Cotrimoxazol | Fracaso tratamiento | SI ATF 1° dedo | No precisa | SI | 1500 + 500b | NO | SI Cultivo negativo |
| 15 | Cuarto dedo | Corynebacterium striatum | Amoxi-clav | Fracaso tratamiento | NO | No precisa | NO | 1500 + 500b | NO | SI Cierre herida |
| 16 | Quinto dedo | Corynebacterium Striatum | Linezolid | Toxicidad gastrointestinal | SI Artroplastia MTF 5° | No precisa | NO | 1500 × 2c | NO | SI Cierre herida |
| Quinolona | Fracaso tratamiento | |||||||||
| 17 | Mal perforante plantar | Enterococcus faecium | NO | Evitar interacciones | SI ATM 1-5° | Desestimada | SI | 1500 DU | NO | SI Cierre herida |
| 18 | Cuarto dedo | SARM | Linezolid | Fracaso tratamiento | SI ATM 4° | SI, angioplastia | SI | 1500 × 2c | NO | SI Cierre herida |
| Quinolona | Fracaso tratamiento | |||||||||
| 19 | Quinto metatarsiano | SARM | Linezolid | Evitar interacciones | NO | No precisa | NO | 1500 × 3c | NO | SI Cierre herida |
| 20 | Tercer dedo | SAMS | Quinolona + Clindamicina | Toxicidad gastrointestinal | SI ATF 3° dedo | SI, angioplastia | NO | 1500 DU | NO | SI Cultivo negativo |
| 21 | Talón derecho | SARM | Clindamicina | Fracaso tratamiento | NO | No precisa | SI | 1500 DU | NO | SI Cierre herida |
| Cotrimoxazol | Fracaso tratamiento | |||||||||
| 22 | Cabeza primer metatarsiano | Corynebacterium striatum | Quinolona + clindamicina | Toxicidad gastrointestinal | NO | No precisa | NO | 1500 × 3c | NO | SI Cierre herida |
| Linezolid | Toxicidad gastrointestinal | |||||||||
| 23 | Primer dedo | ECN | Quinolona | Fracaso tratamiento | SI, ATF 1° dedo | SI, angioplastia | NO | 1000 DU | NO | SICierre herida |
| Linezolid | Toxicidad hematológica | |||||||||
| Daptomicina | Adelantar alta |
ATF: amputación transfalángica; ATM: amputación transmetatarsiana; DU: dosis única; ECN: estafilococos negativos para la coagulasa; ERC: enfermedad renal crónica; FG: filtrado glomerular; MTF: metatarsofalángica; SAMS: Staphylococcus aureus sensible a meticilina; SARM: Staphylococcus aureus resistente a meticilina; TPN: terapia de presión negativa.
A los 90 días de finalizar el tratamiento con dalbavancina, 20 pacientes (87%) se curaron (IC95%: 65,2-94,52%).
Un paciente presentó hiperglucemia simple durante la administración de dalbavancina al ser el diluyente utilizado suero glucosado. Tres pacientes (13%) presentaron efectos secundarios leves en forma de náuseas y molestias gastrointestinales que no requirieron la retirada del fármaco.
DiscusiónEste estudio representa la primera comunicación científica sobre la experiencia clínica en el uso de dalbavancina en infección de pie diabético con osteomielitis. En nuestro estudio, dalbavancina se utilizó en pacientes con un alto índice de comorbilidad, polimedicados y con alto riesgo de interacciones farmacológicas. La mayoría de pacientes, el 78,2%, tenían un grado de infección moderado, que requirió la combinación de tratamiento médico y quirúrgico (en el 56,5% se realizó amputación menor como parte del tratamiento) y habían recibido antibioterapia previamente con mala evolución o toxicidad de la misma. Dalbavancina fue bien tolerada y, combinada con el manejo quirúrgico habitual, presentó una elevada tasa de curación, del 87% (IC95%: 64,15-93,32%) a los 90 días de finalizar el tratamiento.
La infección de pie diabético es una infección compleja con múltiples factores que condicionan su evolución. Estos pacientes presentan varias peculiaridades que nos hacen pensar que se pueden beneficiar del tratamiento con dalbavancina.
Cabe destacar que los pacientes con infección de pie diabético suelen ser pluripatológicos y polimedicados (nuestra cohorte tenía una mediana de índice de Charlson de 6 puntos, el 74% eran polimedicados, y el 95,6% tomaba fármacos considerados de alto riesgo). Esta circunstancia puede condicionar interacciones farmacológicas18, disminuir los niveles séricos de antibióticos, empeorar la adherencia al tratamiento19 con el consiguiente fracaso terapéutico, y potenciar la toxicidad de los antibióticos. En nuestro estudio, este último fue el motivo para el cambio a dalbavancina en el 47,8% de los casos, observando una buena tolerancia, con escasos y leves efectos secundarios, y una adherencia al tratamiento del 100%. En este sentido, el tratamiento con dalbavancina, por su peculiar farmacocinética y posología, permite una administración semanal o quincenal que favorece el cumplimiento terapéutico. La pauta más frecuente de administración de dalbavancina que hemos utilizado ha sido de 1.000mg seguida de 500mg semanales hasta completar 6 semanas. El uso de diferentes pautas de administración durante el estudio hace difícil que se puedan extraer conclusiones sobre una posología más recomendable, si bien es cierto que, en nuestra experiencia, la administración de 1.500mg de forma quincenal basada en estudios de farmacocinética en los que se mantiene una alta concentración en hueso a los 14 días de su administración20 nos parece una buena opción para este grupo de pacientes.
Parte de la complejidad de este tipo de infecciones viene condicionada porque son crónicas y presentan reinfecciones frecuentes que precisan ciclos repetidos (y largos) de antibioterapia, lo que contribuye a una alta prevalencia de microorganismos multirresistentes21. En la infección de pie diabético el patógeno más importante es S. aureus, con una prevalencia de resistencia a meticilina de hasta el 38% según las series22 (47,8% en nuestro estudio). Mención aparte merece Corynebacterium striatum, pues durante mucho tiempo se ha considerado un microorganismo colonizador de infecciones crónicas, pero actualmente se postula como un patógeno multirresistente emergente en pacientes inmunosuprimidos, y relacionado con factores de riesgo como la diabetes23 y la toma previa de antibióticos24. Debe ser considerado como patógeno cuando existen signos de infección y mala evolución clínica de la lesión25. Siguiendo estos criterios, nuestra cohorte presenta una alta prevalencia de infección por C. striatum (30,4%). Dalbavancina ha demostrado ventajas en osteomielitis causada por S. aureus resistente a meticilina26; sin embargo, la experiencia de la actividad de dalbavancina frente a C. striatum es escasa. En nuestro estudio, 6 de los 7 pacientes que presentaban osteomielitis por C. striatum y que recibieron dalbavancina como parte del tratamiento médico-quirúrgico cumplieron criterios de curación.
Es importante destacar que hablamos de dalbavancina como una alternativa de tratamiento antibiótico en pacientes que, por diferentes motivos ya comentados, no tienen otras opciones de antibioterapia oral, lo que nos permite continuar con un manejo ambulatorio de osteomielitis que, de otro modo, requerirían ingreso hospitalario o visitas diarias al hospital durante 6 semanas. En nuestro estudio, la mayoría de pacientes (n=18) presentaron una infección moderada que requirió combinación de tratamiento médico y quirúrgico: 13 pacientes precisaron amputación (que fue menor en todos los casos) y 8 revascularización. Esta combinación presentó una elevada tasa de curación a los 90 días (87% [IC95%: 65,2-94,52%]).
Nuestro estudio presenta las limitaciones propias de un estudio retrospectivo, observacional y con un tamaño muestral pequeño. Sin embargo, dado que la tolerancia fue buena en todos los casos y la elevada tasa de curación, creemos que dalbavancina, en combinación con el manejo quirúrgico habitual, es una opción terapéutica adecuada en pacientes pluripatológicos, polimedicados con osteomielitis de pie diabético producida por microorganismos grampositivos multirresistentes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no ha habido conflictos de interés.