Hay pocos estudios publicados acerca de los factores predictivos de respuesta al tratamiento de la hepatitis C con sofosbuvir y simeprevir.
ObjetivoConocer qué factores influyen en la respuesta a simeprevir (SIM) y sofosbuvir (SOF) en pacientes infectados por los genotipos 1 o 4 de la hepatitis C.
Pacientes y métodosEstudio prospectivo observacional de cohortes en 12 hospitales. La efectividad se evaluó con respuesta virológica sostenida (RVS12).
ResultadosSe incluyeron 204 pacientes (62,3% varones, edad media 55 años). Ciento ochenta y seis (91,2%) genotipo 1 (60,3% 1b, 25% 1a) y 18 (8,8%) genotipo 4. Ciento treinta y dos (64,7%) cirróticos (87,9% Child A), 33 (16,2%) F3, 31 (15,2%) F2, 8 (3,9%) F0-1. Un 80,8% MELD<10. Noventa y tres (45,6%) naive. Se asoció ribavirina en 68 (33,3%). Carga viral basal media 2.151.549 UI/ML (DE: 2.391.840). Duración tratamiento 12 semanas en 93,1%. Cuatro suspendieron tratamiento: suicidio, brote psicótico, hiperbilirrubinemia y recurrencia hepatocarcinoma. Ciento noventa (93,1%) alcanzaron RVS12. No hubo diferencias RVS12 en función del genotipo, duración tratamiento, empleo de ribavirina, tratamiento previo, CV y plaquetas basales. En análisis univariante, negatividad carga viral a las 4 semanas (p=0,042), ausencia de cirrosis (p=0,021), albúmina basal ≥4g/dl (p:0,001) y MELD<10 (p<0,0001) se asociaron con mayor RVS12. En estudio multivariante solo hubo relación significativa entre puntuación MELD basal <10 y mayor RVS12 (p<0,001).
ConclusionesLa combinación de simeprevir y sofosbuvir es muy eficaz en pacientes infectados por los genotipos 1 y 4 de la hepatitis C. Es un tratamiento seguro, especialmente en pacientes sin ribavirina. Esta combinación es más efectiva en pacientes con puntuación MELD inferior a 10.
There are few published studies on predictors of response to treatment with sofosbuvir and simeprevir in HCV patients.
ObjectiveThe objective of the study was to analyse possible predictors of response to simeprevir (SMV) and sofosbuvir (SOF) in patients infected with hepatitis C genotypes 1 or 4.
Patients and methodsProspective observational cohort study in 12 hospitals. The primary efficacy endpoint was SVR rate 12 weeks after end of treatment (SVR12).
Results204 patients (62.3% male, mean age 55 years) were included: 186 (91.2%) genotype 1 (60.3% 1b 25% 1a) and 18 (8.8%) genotype 4. 132 (64.7%) cirrhotic (87.9% Child A), 33 (16.2%) F3, 31 (15.2%) F2, 8 (3.9%) F0-1. 80.8% MELD<10. 93 (45.6%) naive. Ribavirin was added in 68 (33.3%). Mean baseline viral load 2,151,549 IU/ml (SD: 2,391,840). Treatment duration 12 weeks in 93.1%. 4 discontinued therapy: suicide, psychotic attack, hyperbilirubinaemia and liver cancer recurrence. 190 (93.1%) achieved SVR12. There were no differences in SVR12 depending on the genotype, treatment duration, ribavirin use, prior therapy, viral load (VL) or baseline platelets. In univariate analysis, undetectable VL at 4 weeks (p=0.042), absence of cirrhosis (p=0.021), baseline albumin ≥ 4g/dl (p=0.001) and MELD<10 (p<0.0001) were associated with higher SVR12. In multivariate analysis, only baseline MELD score <10 patients had higher SVR12 (p<0.001).
ConclusionsThe combination of simeprevir and sofosbuvir in patients infected with genotype 1 and 4 hepatitis C is highly effective. It is a safe therapy, especially in patients without ribavirin. This combination was more effective in patients with a MELD score below 10.
La infección por el virus de la hepatitis C (VHC) es una de las causas más importantes de enfermedad hepática a nivel mundial1–5. Las combinaciones de antivirales orales de acción directa contra proteínas específicas del genoma del virus de la hepatitis C se asocian con una elevada eficacia, una posología más cómoda, una menor duración del tratamiento y pocos efectos secundarios6–10, por lo que actualmente constituyen el tratamiento de elección de estos pacientes1,11,12.
La combinación de simeprevir (SMV) y sofosbuvir (SOF) es útil para el tratamiento de pacientes infectados por los genotipos 1 y 4 del VHC. SMV corresponde a la segunda generación de inhibidores de la proteasa NS3-4A, activos contra los genotipos 1 y 413. Presenta buena tolerabilidad, pero su umbral de resistencias es bajo. SOF es un profármaco análogo de nucleótidos que actúa como inhibidor de la polimerasa NS5B dependiente del ARN viral, siendo un antiviral muy potente, con actividad pangenotípica, excelente tolerabilidad y perfil de seguridad y una alta barrera de resistencias14.
La combinación de SOF y SMV fue inicialmente empleada en el estudio COSMOS15, con tasas de RVS12 mayores del 90%, con buena tolerancia. Estudios en fase III han confirmado su eficacia y seguridad en pacientes con y sin cirrosis hepática16–18.
El objetivo del estudio fue analizar la efectividad y seguridad, y los factores predictivos de respuesta a la terapia con SMV y SOF en nuestro medio.
Pacientes y métodosSe realizó un estudio prospectivo observacional de cohortes en el que se incluyeron aquellos enfermos que iniciaron tratamiento del VHC con SOF y SMV entre el 1 de diciembre de 2014 y el 1 de diciembre de 2015 en doce hospitales de la Comunidad Autónoma de Castilla La Mancha. Esta combinación de antivirales orales de acción directa fue la primera de la que pudimos disponer en nuestra Comunidad Autónoma, y posteriormente fue priorizada frente a otras opciones por su coste.
Se incluyeron todos aquellos pacientes adultos con hepatitis crónica VHC genotipos 1 o 4 tratados con SOF 400mg y SMV 150mg diarios durante 12 o 24 semanas y añadiendo o no ribavirina (RBV) (1.000-1.200mg/día, si <75kg o ≥75kg, respectivamente) a juicio de sus médicos.
El seguimiento se realizó en consulta al inicio y en semanas 4, 8, 12 y 24 de tratamiento y 12 semanas postratamiento. Se analizaron quinientas variables que incluían edad, sexo, IMC, comorbilidades, hábitos tóxicos, trasplante y tratamientos previos. Se evaluó la gravedad de la hepatopatía con índices de fibrosis (APRI, FORNS y FIB-4), elastografía, MELD y Child-Pugh. Los valores de corte de la elastografía fueron los siguientes: F0-1 hasta 6,9kPa; F2 entre 7 y 9,4kPa; F3 entre 9,5 y 12,4kPa.; F4 a partir de 12,5kPa.
Se recogió la duración de la terapia y la asociación o no de RBV. Durante las visitas de seguimiento se realizaron hemograma, bioquímica, coagulación y carga viral VHC.
Para evaluar la eficacia terapéutica se consideró curación de la infección la presencia de una carga viral del VHC indetectable a las 12 semanas de su conclusión (RVS12). Se analizó también la respuesta virológica al final del tratamiento, entendida como la presencia de una carga viral negativa en el momento de la finalización de aquel. Los fallecimientos se consideraron como fracasos del tratamiento. La carga viral se cuantificó por medio de COBAS TaqMan HCV assay (versión 2.0; Roche), con un límite inferior de cuantificación de 15 UI/mL y un límite inferior de detección de 10 UI/mL.
Para evaluar la seguridad del tratamiento, los efectos adversos y la adherencia al tratamiento se recogieron en las semanas 4, 8, 12 y 24. Los efectos adversos se catalogaron como leves (no modifican la actividad diaria), moderados (modifican la actividad diaria o requieren ingreso hospitalario, sin poner en riesgo la vida del paciente), graves (ponen en peligro la vida del paciente). Se consideró anemia la presencia de una cifra de hemoglobina por debajo de 12g/dl. Se consideró como leve entre 10 y 12g/dl, moderada entre 8 y 10g/dl, y grave por debajo de 8g/dl.
El análisis estadístico se realizó con el programa SPSS versión 22 calculando las asociaciones de muestras relacionadas y los estadísticos descriptivos. Las variables cuantitativas se midieron con media, mediana y rango. Para el estudio univariante se empleó chi-cuadrado para las variables categóricas y t de student para las cuantitativas. La significación estadística fue definida con un valor de p<0,05. Se realizó regresión logística para aquellas variables que en el estudio univariante alcanzaron una p al menos <0,1.
Se calculó la RVS12 global y en distintos subgrupos de pacientes (asociación de RBV, tratamiento previo, cirrosis, genotipo, plaquetas superiores o no a 100.000/mm3, duración del tratamiento, albúmina<4 o ≥4mg/dl, y MELD<9 o ≥ 10). Posteriormente se realizó un análisis de regresión logística por pasos hacia atrás con el estadístico Ward para conocer las variables predictoras de RVS. El modelo se consideró significativo con un valor de p<0,001.
El estudio se realizó de acuerdo con la Declaración de Helsinki y las guías de práctica clínica adecuadas. Fue aprobado por un Comité de Ética Central. Los pacientes dieron su consentimiento para participar en el estudio.
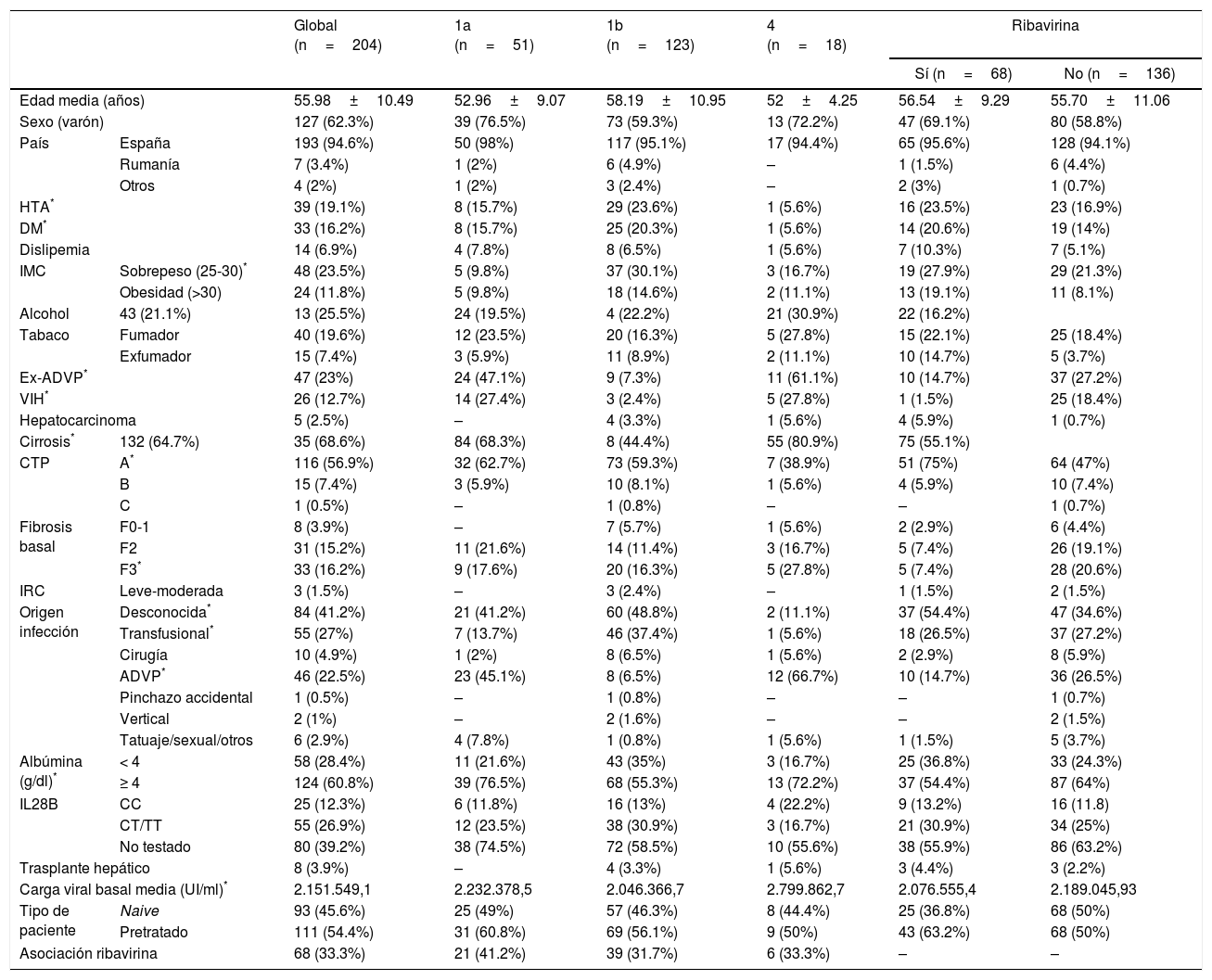
ResultadosCaracterísticas demográficas de los pacientesSe incluyeron en el estudio 204 pacientes tratados con SMV y SOF, asociándose RBV en 68 (33,3%) casos. La tabla 1 resume las características clínicas y demográficas de los pacientes.
Características demográficas y clínicas globales, por subtipo y por asociación de ribavirina de los pacientes
| Global (n=204) | 1a (n=51) | 1b (n=123) | 4 (n=18) | Ribavirina | |||
|---|---|---|---|---|---|---|---|
| Sí (n=68) | No (n=136) | ||||||
| Edad media (años) | 55.98±10.49 | 52.96±9.07 | 58.19±10.95 | 52±4.25 | 56.54±9.29 | 55.70±11.06 | |
| Sexo (varón) | 127 (62.3%) | 39 (76.5%) | 73 (59.3%) | 13 (72.2%) | 47 (69.1%) | 80 (58.8%) | |
| País | España | 193 (94.6%) | 50 (98%) | 117 (95.1%) | 17 (94.4%) | 65 (95.6%) | 128 (94.1%) |
| Rumanía | 7 (3.4%) | 1 (2%) | 6 (4.9%) | – | 1 (1.5%) | 6 (4.4%) | |
| Otros | 4 (2%) | 1 (2%) | 3 (2.4%) | – | 2 (3%) | 1 (0.7%) | |
| HTA* | 39 (19.1%) | 8 (15.7%) | 29 (23.6%) | 1 (5.6%) | 16 (23.5%) | 23 (16.9%) | |
| DM* | 33 (16.2%) | 8 (15.7%) | 25 (20.3%) | 1 (5.6%) | 14 (20.6%) | 19 (14%) | |
| Dislipemia | 14 (6.9%) | 4 (7.8%) | 8 (6.5%) | 1 (5.6%) | 7 (10.3%) | 7 (5.1%) | |
| IMC | Sobrepeso (25-30)* | 48 (23.5%) | 5 (9.8%) | 37 (30.1%) | 3 (16.7%) | 19 (27.9%) | 29 (21.3%) |
| Obesidad (>30) | 24 (11.8%) | 5 (9.8%) | 18 (14.6%) | 2 (11.1%) | 13 (19.1%) | 11 (8.1%) | |
| Alcohol | 43 (21.1%) | 13 (25.5%) | 24 (19.5%) | 4 (22.2%) | 21 (30.9%) | 22 (16.2%) | |
| Tabaco | Fumador | 40 (19.6%) | 12 (23.5%) | 20 (16.3%) | 5 (27.8%) | 15 (22.1%) | 25 (18.4%) |
| Exfumador | 15 (7.4%) | 3 (5.9%) | 11 (8.9%) | 2 (11.1%) | 10 (14.7%) | 5 (3.7%) | |
| Ex-ADVP* | 47 (23%) | 24 (47.1%) | 9 (7.3%) | 11 (61.1%) | 10 (14.7%) | 37 (27.2%) | |
| VIH* | 26 (12.7%) | 14 (27.4%) | 3 (2.4%) | 5 (27.8%) | 1 (1.5%) | 25 (18.4%) | |
| Hepatocarcinoma | 5 (2.5%) | – | 4 (3.3%) | 1 (5.6%) | 4 (5.9%) | 1 (0.7%) | |
| Cirrosis* | 132 (64.7%) | 35 (68.6%) | 84 (68.3%) | 8 (44.4%) | 55 (80.9%) | 75 (55.1%) | |
| CTP | A* | 116 (56.9%) | 32 (62.7%) | 73 (59.3%) | 7 (38.9%) | 51 (75%) | 64 (47%) |
| B | 15 (7.4%) | 3 (5.9%) | 10 (8.1%) | 1 (5.6%) | 4 (5.9%) | 10 (7.4%) | |
| C | 1 (0.5%) | – | 1 (0.8%) | – | – | 1 (0.7%) | |
| Fibrosis basal | F0-1 | 8 (3.9%) | – | 7 (5.7%) | 1 (5.6%) | 2 (2.9%) | 6 (4.4%) |
| F2 | 31 (15.2%) | 11 (21.6%) | 14 (11.4%) | 3 (16.7%) | 5 (7.4%) | 26 (19.1%) | |
| F3* | 33 (16.2%) | 9 (17.6%) | 20 (16.3%) | 5 (27.8%) | 5 (7.4%) | 28 (20.6%) | |
| IRC | Leve-moderada | 3 (1.5%) | – | 3 (2.4%) | – | 1 (1.5%) | 2 (1.5%) |
| Origen infección | Desconocida* | 84 (41.2%) | 21 (41.2%) | 60 (48.8%) | 2 (11.1%) | 37 (54.4%) | 47 (34.6%) |
| Transfusional* | 55 (27%) | 7 (13.7%) | 46 (37.4%) | 1 (5.6%) | 18 (26.5%) | 37 (27.2%) | |
| Cirugía | 10 (4.9%) | 1 (2%) | 8 (6.5%) | 1 (5.6%) | 2 (2.9%) | 8 (5.9%) | |
| ADVP* | 46 (22.5%) | 23 (45.1%) | 8 (6.5%) | 12 (66.7%) | 10 (14.7%) | 36 (26.5%) | |
| Pinchazo accidental | 1 (0.5%) | – | 1 (0.8%) | – | – | 1 (0.7%) | |
| Vertical | 2 (1%) | – | 2 (1.6%) | – | – | 2 (1.5%) | |
| Tatuaje/sexual/otros | 6 (2.9%) | 4 (7.8%) | 1 (0.8%) | 1 (5.6%) | 1 (1.5%) | 5 (3.7%) | |
| Albúmina (g/dl)* | < 4 | 58 (28.4%) | 11 (21.6%) | 43 (35%) | 3 (16.7%) | 25 (36.8%) | 33 (24.3%) |
| ≥ 4 | 124 (60.8%) | 39 (76.5%) | 68 (55.3%) | 13 (72.2%) | 37 (54.4%) | 87 (64%) | |
| IL28B | CC | 25 (12.3%) | 6 (11.8%) | 16 (13%) | 4 (22.2%) | 9 (13.2%) | 16 (11.8) |
| CT/TT | 55 (26.9%) | 12 (23.5%) | 38 (30.9%) | 3 (16.7%) | 21 (30.9%) | 34 (25%) | |
| No testado | 80 (39.2%) | 38 (74.5%) | 72 (58.5%) | 10 (55.6%) | 38 (55.9%) | 86 (63.2%) | |
| Trasplante hepático | 8 (3.9%) | – | 4 (3.3%) | 1 (5.6%) | 3 (4.4%) | 3 (2.2%) | |
| Carga viral basal media (UI/ml)* | 2.151.549,1 | 2.232.378,5 | 2.046.366,7 | 2.799.862,7 | 2.076.555,4 | 2.189.045,93 | |
| Tipo de paciente | Naive | 93 (45.6%) | 25 (49%) | 57 (46.3%) | 8 (44.4%) | 25 (36.8%) | 68 (50%) |
| Pretratado | 111 (54.4%) | 31 (60.8%) | 69 (56.1%) | 9 (50%) | 43 (63.2%) | 68 (50%) | |
| Asociación ribavirina | 68 (33.3%) | 21 (41.2%) | 39 (31.7%) | 6 (33.3%) | – | – | |
ADVP: adicto a drogas por vía parenteral; albúmina: basal; CTP: Child-Turcotte-Pugh; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; IRC: insuficiencia renal crónica; RU: Reino Unido; Uc: Ucrania; VIH: virus de la inmunodeficiencia humana.
El 62,3% (n=127) eran varones. La edad media al inicio del tratamiento era 55 años (mediana: 55; rango 27-83). La mayoría eran españoles (94,6%). Ciento ochenta y seis (91,2%) estaban infectados por el genotipo 1, 123 (60,3%) por 1b y 51 (25%) por 1a. En 7 casos no pudo subtiparse el genotipo 1; en cuatro había una infección mixta 1a y 1b, y en otro 1a y 4e. Dieciocho pacientes (8,8%) estaban infectados por el genotipo 4. El 57,5% presentaban un genotipo de la interleucina IL28B C/T, 31,2% CC y 11,3% TT.
Veintiséis (12,7%) tenían coinfección VIH, nueve (4,4%) eran receptores de un trasplante de órgano sólido (8 de hígado), y tres tenían coinfección VHB.
La causa de la infección no logró filiarse en 84 pacientes (41,2%). La vía transfusional fue la más común (27%), seguida del uso de drogas por vía parenteral (22,5%).
Ciento treinta y dos pacientes (64,7%) eran cirróticos. De ellos 116 eran Child-Pugh A, 15 estadio B y uno estadio C. Diecisiete estaban o habían estado descompensados. El MELD medio en pacientes cirróticos fue de 8,2 (mediana: 7; rango: 6-15). La albúmina inicial era<4 en 58 pacientes y ≥ 4 en 124.
Noventa y tres (45,6%) eran naive y 111 (54,4%) habían sido previamente tratados. La carga viral basal media fue de 2.151.549 UI/ml (mediana: 1.304.979; DE: 2.391.8490; rango: 5.390-11.900.000 UI/ml).
Eficacia del tratamientoLa duración prevista del tratamiento fue de 12 semanas en 190 (93,1%) pacientes y 24 semanas en 14 (6,9%). A excepción de un paciente que se suicidó a las 11 semanas del tratamiento y tres que suspendieron el tratamiento en la semana 8 (1,5%), por brote psicótico, hiperbilirrubinemia y recurrencia avanzada de hepatocarcinoma, el resto (200; 98%) lograron completar la duración prevista.
La mayoría de los pacientes (156/204; 76,5%) normalizaron las transaminasas. La respuesta virológica global en el momento de concluir el tratamiento (respuesta virológica al final del tratamiento) fue del 99,5% (203 de los 204 pacientes; tan solo un paciente no aclaró la carga viral durante el tratamiento; IC95%: 98-100%). Ciento noventa pacientes (93,1%; IC95%: 80-93%) alcanzaron una RVS12. Aparte del paciente que se suicidó, otra mujer falleció por fallo hepático con RVS4; once pacientes tuvieron una recidiva virológica en las primeras 12 semanas tras la conclusión del tratamiento.
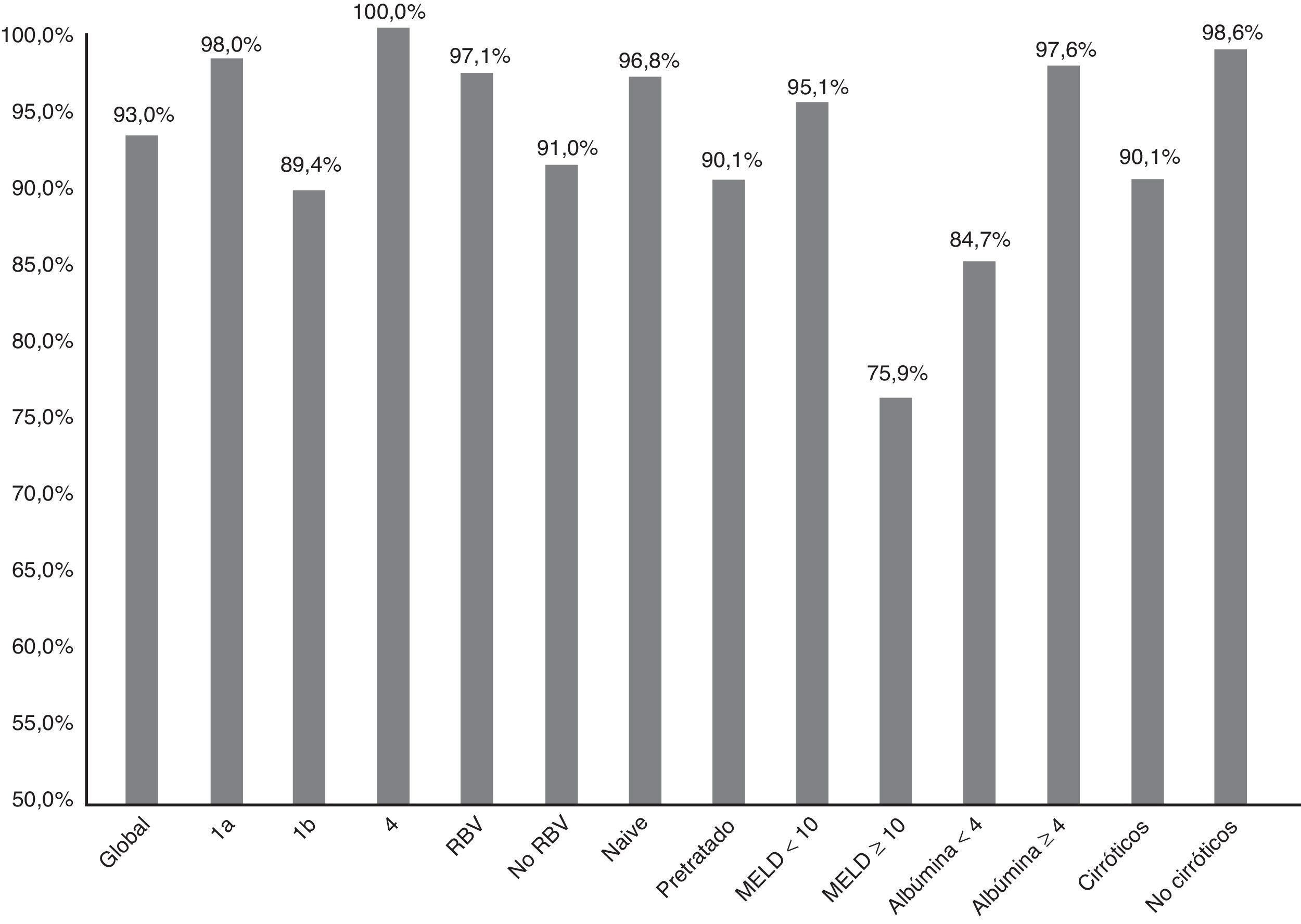
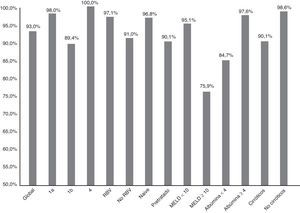
La figura 1 resume la RVS12 de forma global, por subtipos, según la asociación o no de RBV, tipo de paciente (naive o pretratado), puntación MELD (< 10 o ≥ 10) y nivel de albúmina basal (<4 o ≥4).
Eficacia (RVS12) global, por subtipos (1a, 1b y 4; p: 0,247), asociación o no de ribavirina (RBV; p:0,147), tipo de paciente (naive o pretratado; p: 0,06), puntuación MELD (< o ≥ 10; p<0,001), niveles de albúmina basal (< 4 o ≥ 4; p: 0,001) y presencia o no de cirrosis hepática (p: 0,021).
La RVS12 fue más alta en el genotipo 1a (98%; IC95%: 94-100%) que en el 1b (89,4%, IC95%: 84-95%). En los pacientes con genotipo 4 se alcanzó una RVS12 del 100% (fig. 1). Sin embargo, no hubo diferencias significativas (p: 0,247). Con respecto al genotipo del IL28B, la RVS12 fue 96% (IC 95%: 88-100%) (24/25) en C/C, 93,5% (IC 95% 86-100%) (43/46) en C/T y 77,8% (IC 95%: 44-100%),en T/T (p: 0,190). Los pacientes T/T tuvieron una tendencia no significativa a una peor respuesta (p: 0,075).
La efectividad global de los pacientes con un tratamiento de 12 semanas fue 93,2% (IC 95%: 90-97%) frente a 92,9% (IC 95%: 77-100%) de los pacientes de 24 semanas (p=0,966).
Sesenta y ocho pacientes (33,8%) tomaron RBV. La RVS12 se logró en 65 (97,1%, IC 95%: 93-100%) de los que recibieron RBV y en 123 (91,1%, IC 95%: 86-96%) de los que no la recibieron (fig. 1). No hubo significación estadística (p=0,147).
Hubo una tendencia no significativa a una peor respuesta en los pacientes pretratados (RVS12: 90,1% (IC 95%: 84-96%),–100/111– vs. 96,8% (IC 95%: 93-100%), –90/93–; p: 0,06) en naive (fig. 1). Los 16 pacientes que no habían respondido previamente a triple terapia con un inhibidor de proteasa se curaron de la infección (100 vs. 92,6% del resto; p: 0,608).
La RVS12 fue 94,1% (IC 95%: 90-98%) (128/136) en individuos con una carga viral basal del VHC superior a 800.000 UI/mL frente a 91,2% (IC 95%: 84-98%) (62/68) de aquellos con una carga inferior (p: 0,558). En función de la negatividad de la carga viral del VHC a las 4 semanas del inicio del tratamiento, la RVS12 fue del 96%(IC 95%: 93-99%) (120/125) en los que la consiguieron y del 87,7% (IC 95%: 80-95%) en los que no lo hicieron (64/73) (p=0,042).
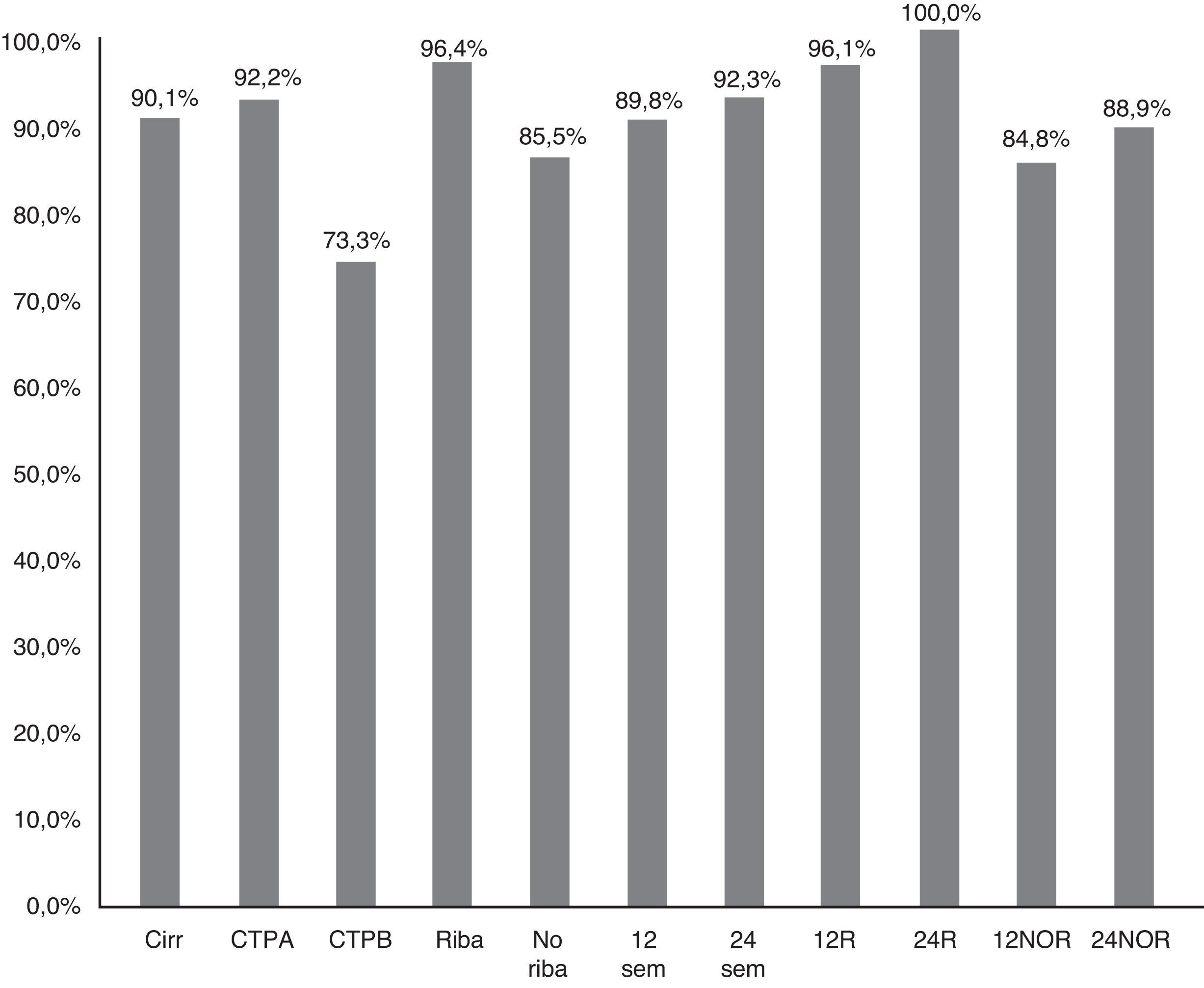
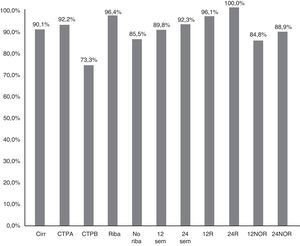
La RVS12 en pacientes sin cirrosis fue 98,6% (IC 95%: 96-100%), frente a 90,1% (IC 95%: 85-95%) en cirróticos (p=0,021) (fig. 2). En pacientes Child-A fue del 92,2% (IC 95%: 85-96%) (106/115), del 73,3% (IC 95%: 48-99%) (11/15) en CTP-B y 100% en CTP-C (1/1) (p:0,068). La RVS en los pacientes cirróticos tratados con RBV fue del 96,4% (54/56) (IC 95%: 93-99%), y sin RBV del 85,5% (65/76) (IC 95%: 80-95%); p: 0,038. La RVS12 en los pacientes cirróticos tratados 12 y 24 semanas fue 89,8% (IC 95%:77-94%) (106/118) vs. 92,3% (IC 95%: 91-100%) (12/13), respectivamente, sin diferencias significativas (p=0,777) (fig. 2).
La RVS12 fue 84,7% (IC 95%: 75-94%) (50/59) en pacientes con albúmina basal≤4g/dl vs. 97,6% (IC 95%: 95-100%) (120/123) si >4 (p:0,001) (fig. 1). La RVS12 en aquellos pacientes con más de 100.000 plaquetas/mm3 fue 93,6% (IC 95%: 90-98%) (132/141) vs. 91,5% (IC 95%: 84-99%) (54/59) de los que tenían cifras inferiores (p: 0,559).
La RVS12 en los pacientes coinfectados VIH fue del 96,2% (25/26), frente al 92,7% (165/178) (p: 0,515). Los 9 enfermos trasplantados (hígado o riñón) obtuvieron la RVS12 frente al 92,8% (181/195) de los no trasplantados (p: 0,405).
Finalmente, la RVS12 en los pacientes cirróticos con un MELD <10 fue de 95,1% (IC 95%: 90-99%) (99/103) y en los pacientes con MELD ≥10 del 75,8% (IC 95%: 58-92%) (22/29) (p: 0,002) (fig. 1).
Al realizar el estadístico de Ward con método hacia atrás en el subgrupo de pacientes cirróticos solo hubo una relación significativa entre puntuación MELD basal inferior a 10 y mayor RVS12. Los pacientes con MELD basal <10 tienen una OR de 6 (IC 95%: 1,8-24) sobre los MELD ≥10 de alcanzar una RVS12 (p=0,003). El estatus paciente naive frente a pretratado estuvo cerca de alcanzar significación estadística (OR: 3,3 [IC95%:0 8-13 7]; p=0 097).
Seguridad del tratamientoDe los 204 pacientes incluidos en el estudio, al final del seguimiento cuatro (2%) habían fallecido por causas no consideradas relacionadas con la medicación: un suicidio durante el tratamiento, una recidiva avanzada de un hepatocarcinoma (8 semanas tras suspenderlo), un linfoma en un paciente que se había curado de la infección (24 semanas tras concluirlo) y una sepsis en una paciente cirrótica (6 semanas tras concluirlo).
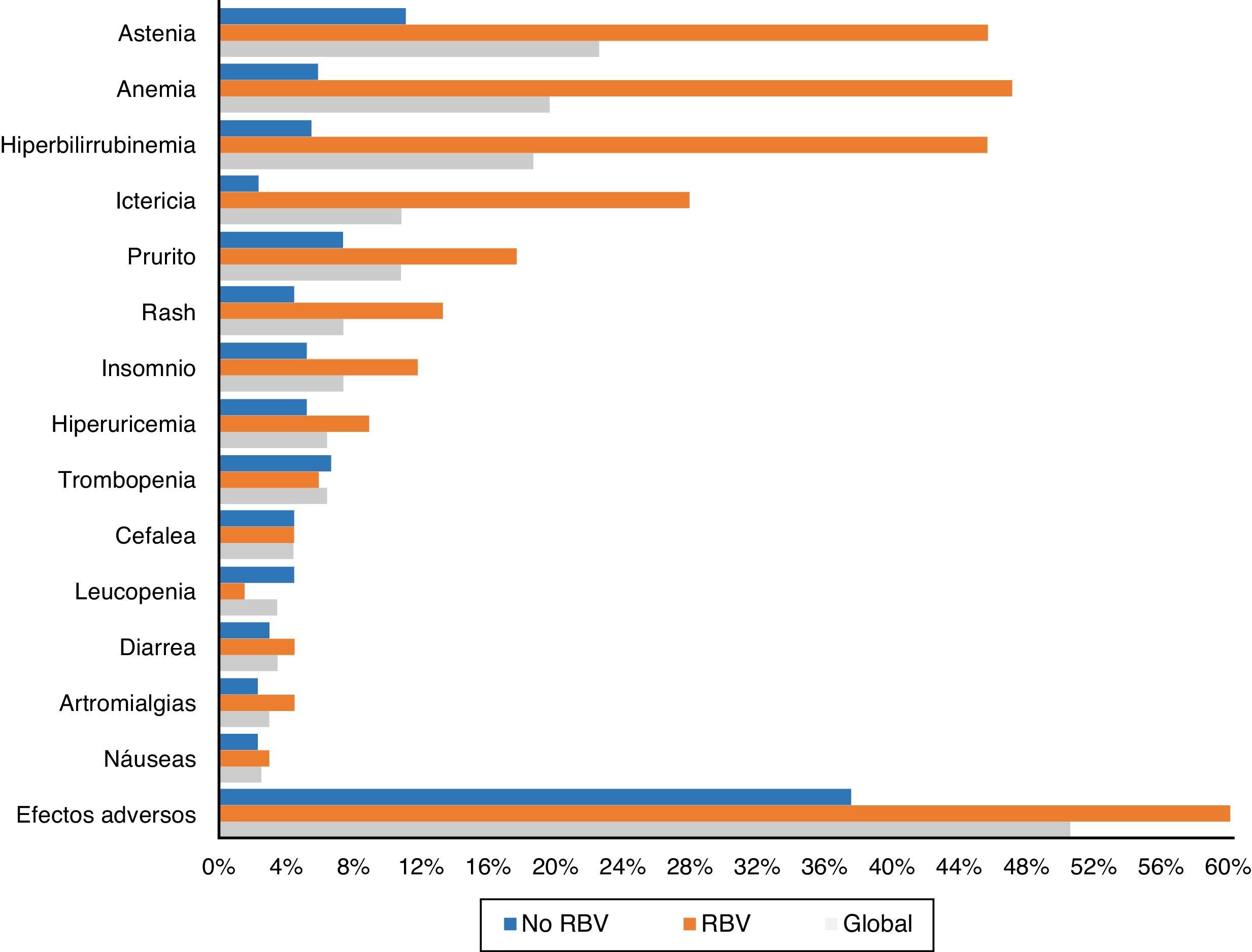
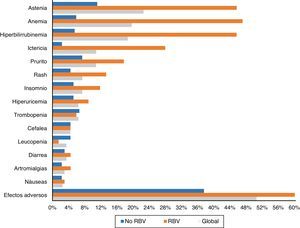
Ciento tres pacientes (50,5%) tuvieron efectos adversos durante el tratamiento. Aparecieron con mayor frecuencia en aquellos pacientes que recibieron RBV (76,5% -52/68-) que en aquellos que no la tomaron (37,5% –51/136–) (p<0,0001). También fueron más comunes en cirróticos (56,1% –74/132– vs. 40,3% –29/72–) (p: 0,023). Los efectos secundarios más frecuentes de forma global y en función del empleo de RBV se exponen en la figura 3.
Los efectos adversos fueron de intensidad leve en 79 pacientes (38,7%), moderada en 17 (8,3%) y graves en siete (3,4%), precisando la interrupción completa del tratamiento tan solo cuatro enfermos (2%). Las causas que motivaron la suspensión del tratamiento fueron suicidio, brote psicótico, hiperbilirrubinemia severa (10mg/dl) y recidiva avanzada de un hepatocarcinoma con ascitis refractaria. Hubo un total de 5 descompensaciones de la hepatopatía (3,8% de los cirróticos). Aparte de la ascitis referida, tres pacientes presentaron encefalopatía hepática y otro hemorragia digestiva por varices esofágicas.
La astenia fue el efecto adverso más común, refiriéndola 46 pacientes (22,5%). En 38 fue leve, 7 moderada y uno severa. Veintidós (10,8%) presentaron ictericia, y otros 22 (10,8%) prurito, tan solo en cuatro grave. Quince (7,4%) presentaron exantema, 13 localizado y dos extenso, y otros 15 (7,4%) insomnio.
Cuarenta pacientes (19,6%) tuvieron anemia, aunque tan solo seis (2,9%) precisaron transfusiones. La anemia se catalogó como leve en 30 pacientes (14,7%), moderada, con ajuste de dosis de RBV en 16 (7,8%) –4 suspensiones y 12 descensos de dosis hasta un máximo del 50% de la dosis inicial en 3 pacientes–.
Treinta y ocho enfermos (18,6%) presentaron una elevación de las cifras de bilirrubina. Treinta y uno de los 68 pacientes (45,6%) habían sido tratados con RBV, frente a tan solo 7 de los 136 que no la tomaron (5,1%; p<0,0001). En un paciente se decidió suspender el tratamiento por este motivo, con mejoría posterior. Treinta y cuatro de los enfermos con elevación de bilirrubina eran cirróticos (34/132: 25,8%) y tan solo 4 (4/72: 5,6%) no lo eran (p: 0,001).
DiscusiónEn este estudio de vida real se ha evaluado la efectividad y seguridad del régimen que combina el inhibidor de la proteasa SMV con el inhibidor de polimerasa SOF, en pacientes infectados por los genotipos 1 y 4 de la hepatitis C, habiendo obtenido una RVS12 de 93%, siendo bien tolerada por la mayoría de ellos.
En nuestra serie, como ocurre en nuestro país en pacientes sin coinfección VIH, la mayor parte de los enfermos están infectados por el genotipo 1 (91,2%), sobre todo el subtipo 1b (61,8%). Como en otros estudios, la mayoría son varones, con una edad media en torno a los 50 años19. Dado que nuestra área geográfica es una zona de baja población inmigrante, la mayoría de los tratados son españoles. En nuestro sistema sanitario han sido priorizados los pacientes tratados en función de la severidad de la hepatopatía, por ello dos tercios de nuestros pacientes son cirróticos.
Esta combinación terapéutica logró altas tasas curación de la infección en pacientes con genotipo 1 (1a: 98% vs. 1b: 89,4%). En todos los infectados por el genotipo 4 se curó la infección. Aunque no hubo significación estadística, en nuestra serie, en contraste con algunos estudios15,18,20, los pacientes infectados por el genotipo 1a obtuvieron mayores tasas de respuesta que los infectados por el 1b. En el estudio OPTIMIST-217 los pacientes con ambos subtipos respondieron igual, pero aquellos con el genotipo 1a sin el polimorfismo Q80k respondieron mejor que los 1b. Probablemente el motivo por el que nuestros pacientes infectados por el genotipo 1a responden mejor es por la baja presencia de dicho polimorfismo en la población española (7%). Como en el nuestro, en otros estudios16,21 la respuesta en ambos subtipos fue similar. Aunque son pocos enfermos, la respuesta obtenida en los pacientes infectados por el genotipo 4 fue excelente.
En nuestro trabajo, los pacientes T/T tuvieron una tendencia no significativa a una peor respuesta (p: 0,075). Aunque el número de pacientes es bajo, estos resultados concuerdan con el estudio OPTIMIST-217.
Nuestro estudio incluye pacientes tratados en casi todos los centros hospitalarios de nuestra comunidad autónoma. La indicación de RBV la establecía el médico responsable. Tan solo un tercio de nuestros pacientes recibieron dicho fármaco, y aunque dicha asociación podría conseguir mejores tasas de curación (97,1 vs. 91,1%), no hubo significación estadística. Sin embargo, en nuestra serie sí aumentó la tasa de respuesta en pacientes con cirrosis hepática (96,4 vs. 85,5%). Continúa existiendo controversia respecto al empleo de dicho fármaco, que empeora de forma notable la tolerancia a la terapia8,15. En algunos estudios15,18,21 su adición aumentó la tasa de RVS.
A pesar de que la mayoría de nuestros pacientes se trataron 12 semanas, en nuestro trabajo, al igual que en el estudio COSMOS15 el alargar la terapia a 24 semanas no mejoró la RVS. Sin embargo, al ser un estudio de vida real no aleatorizado es probable que algunos médicos tratasen aquellos pacientes con un mayor riesgo de fracaso terapéutico durante 24 semanas en lugar de 12.
Aunque en el nuestro no hubo significación estadística, al igual que en otros estudios15,17,18 nuestros sujetos naive obtuvieron tasas de curación más altas que los pretratados (96,8 vs. 90,1%; NS). Sin embargo, hay otros trabajos21 donde los enfermos tratados por primera vez no alcanzaron una mayor tasa de RVS12.
En nuestro estudio, al igual que en el de Aquel et al.21, la carga viral basal no se asoció con una diferente respuesta al tratamiento. Aunque no llegó a confirmarse en el análisis multivariante, en el univariante la obtención de una respuesta virológica rápida (CV negativa a las 4 semanas) se asoció con una mayor RVS12, datos que contrastan con el estudio COSMOS15.
Casi dos tercios de nuestros pacientes son cirróticos, si bien la mayoría presentan un estadio precoz de Child-Pugh. La efectividad en pacientes cirróticos disminuyó del 98,6 al 90,1% (p=0,021). Estos resultados son similares a los de Sulkowski et al.18. La RVS12 en pacientes con cirrosis CTP-A fue 92,2%, y 73,3% en CTP-B. En el estudio de Aqel et al.21 también hubo una RVS12 menor en los pacientes con enfermedad avanzada (CTP-B), comparado con aquellos con cirrosis compensada (CTP-A).
La respuesta al tratamiento fue inferior en los pacientes con una albúmina basal menor de 4 (84,7 vs. 97,6%, –p:0,001–). Estos resultados no se confirmaron en el estudio multivariante. También se analizó la RVS12 en función de la cifra basal de plaquetas, sin encontrar diferencias. En el estudio OPTIMIST-217 hubo una menor RVS12 en aquellos pacientes con una albúmina inferior a 4 y con una cifra de plaquetas inferior a 90.000/mm3.
Finalmente, la severidad de la hepatopatía, evaluada por el score MELD, tuvo un impacto importante en la RVS12. Los pacientes con MELD basal inferior a 9 tienen una OR de 15 sobre los MELD≥10 de alcanzar una RVS12 (p<0,001). En el estudio de Aqel21 una puntuación MELD≤10 fue un predictor muy importante de RVS12.
Como es lógico, la tolerancia de los regímenes con antivirales orales es mejor que los antiguos regímenes con interferón y la mayoría de los efectos secundarios de nuestra serie fueron de intensidad leve, requiriendo solo tratamiento sintomático. La mitad de los enfermos tuvieron algún tipo de efecto adverso durante el tratamiento, si bien la mayoría fueron leves. Aparecieron con el doble de frecuencia en aquellos pacientes que recibieron RBV (76,5%) que en los que no la tomaron (38,1%). También fueron más comunes en los pacientes cirróticos (56,9 vs. 40,3%). Estos datos concuerdan con lo publicado previamente15,18,21.
Como en otros estudios15,18,21, la astenia y la anemia, en general leves y relacionadas con el empleo de RBV, fueron los efectos adversos más comúnmente registrados. Efectos secundarios menos comunes fueron hiperbilirrubinemia e ictericia, prurito, rash, cefalea e insomnio.
En definitiva, la combinación de SMV y SOF es muy efectiva en pacientes infectados por los genotipos 1 y 4 de la hepatitis C. Los mejores candidatos a recibir esta combinación son aquellos pacientes con una puntuación MELD inferior a 10. Asimismo, es una combinación segura; la adición de RBVcondiciona una peor tolerancia al tratamiento, aunque podría aumentar la tasa de respuesta en los pacientes con cirrosis hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro sincero agradecimiento a los colaboradores que han participado en este estudio:
Ponciano Martínez-Rodenas (Servicio de Aparato Digestivo, Hospital de Almansa, Albacete).
María Montealegre Barrejón (Servicio de Aparato Digestivo, Hospital de Villarrobledo, Albacete).
Eduardo Sánz de Villalobos (Servicio de Aparato Digestivo, Hospital Universitario de Guadalajara).
Tomás Artaza Varasa (Servicio de Aparato Digestivo, Complejo Hospitalario de Toledo).
Ricardo Pérez-Flores (Servicio de Aparato Digestivo, Complejo Hospitalario Universitario de Albacete; Universidad de Castilla La Mancha).
Sami Aoufi (Servicio de Aparato Digestivo, Hospital de Alcázar de San Juan, Ciudad Real).
Ignacio Marañés Antonanzas (Servicio de Medicina Interna, Hospital de Hellín, Albacete).