Se describe la distribución de serotipos de Streptococcus pneumoniae aislados en líquido cefalorraquídeo (LCR) entre los años 2007-2018 en la Comunidad de Madrid (CM) identificando aquellos con mayor tropismo meníngeo.
MétodosSe estudiaron las cepas de episodios de enfermedad neumocócica invasora enviadas al Laboratorio Regional de Salud Pública por los servicios de microbiología de hospitales públicos y privados de la CM. La frecuencia de serotipos procedentes de LCR se comparó con la observada en otras muestras.
ResultadosSe procesaron 6.115 cepas. El 5% (n=304) se aislaron en LCR. Siete serotipos (11A, 19F, 23B, 10A, 24F, 23A y 35F) mostraron una frecuencia en LCR significativamente mayor que en otras muestras habitualmente estériles. Los serotipos 24F, 11A y 23B mostraron alta resistencia a la penicilina.
ConclusiónLa frecuencia y la resistencia de determinados serotipos de neumococo con elevado tropismo meníngeo podría comprometer el tratamiento de las infecciones del sistema nervioso central.
To describe the distribution of Streptococcus pneumoniae serotypes isolated in cerebrospinal fluid (CSF) between 2007-2018 in the Community of Madrid (CM) and to identify those with higher meningeal tropism.
MethodsStrains isolated from invasive pneumococcal disease were sent to the Regional Laboratory of Public Health by Microbiology laboratories of public and private hospitals of the CM. The frequency of serotypes from CSF was compared with that observed in other samples.
ResultsA total of 6,115 strains were processed and 5% (n=304) were isolated from CSF. Seven serotypes (11A, 19F, 23B, 10A, 24F, 23A and 35F) showed a frequency significantly higher in CSF than in other usually sterile samples. Serotypes 24F, 11A and 23B showed high penicillin-resistance.
ConclusionThe frequency and resistance of certain pneumococcal serotypes with high meningeal tropism could compromise the treatment of central nervous system infections.
La meningitis es una forma grave de presentación de la enfermedad neumocócica invasora (ENI)1. El aislamiento de Streptococcus pneumoniae en muestras de líquido cefalorraquídeo (LCR) es el método microbiológico más específico para el diagnóstico de esta infección2. El tratamiento de la meningitis neumocócica generalmente incluye penicilina o cefalosporinas de tercera generación (cefotaxima o ceftriaxona) asociadas, en ocasiones, con vancomicina3. La cápsula polisacarídica de Streptococcus pneumoniae se considera esencial para causar meningitis y el tipo capsular parece tener un efecto directo en la gravedad del cuadro4. El objetivo de este estudio es describir la distribución de serotipos en cepas aisladas en muestras de LCR entre los años 2007-2018 en la Comunidad de Madrid (CM) e identificar aquellas con mayor tropismo meníngeo.
Material y métodosSe estudiaron las cepas de episodios de ENI enviadas al Laboratorio Regional de Salud Pública por los servicios de microbiología de hospitales públicos y privados de la CM durante el período estudiado. El serotipado de los aislamientos se realizó mediante aglutinación por látex (Pneumotest-Latex) y test de referencia de Quellung5 usando antisueros de tipo y factor (Statens Serum Institut, Copenhagen, Dinamarca). La determinación de sensibilidad a antibiótica frente a penicilina, cefotaxima y vancomicina se determinó mediante el método de gradiente de difusión Etest® (bioMerieux, France) siguiendo los criterios de interpretación del European Committee for Antimicrobial Susceptibility Testing (EUCAST)6 (concentración mínima inhibitoria de penicilina ≤0,06mg/l sensible y >0,06mg/l resistente [punto de corte para meningitis], cefotaxima ≤0,5mg/l sensible y >2mg/l resistente y vancomicina ≤2mg/l sensible y >2mg/l resistente). La frecuencia de serotipos procedentes de muestras de LCR se comparó con la observada en muestras de otras localizaciones mediante el odds ratio (OR), con un nivel de confianza del 95%. La evolución a lo largo del tiempo (cuatrienios 2007-2010, 2011-2014 y 2015-2018) se analizó mediante el cálculo de la Chi-cuadrado de tendencia lineal.
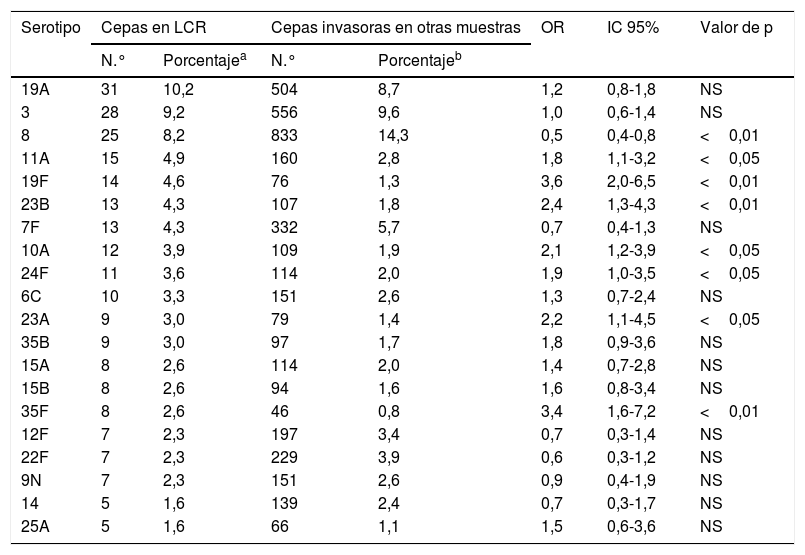
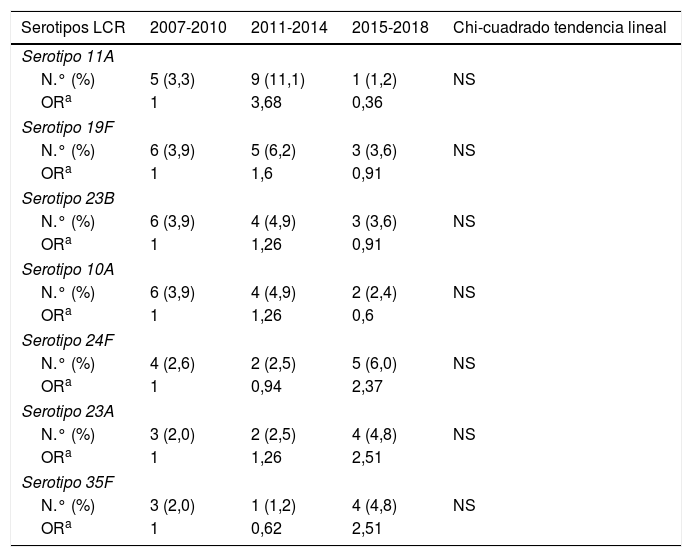
ResultadosSe procesaron 6.115 cepas invasoras de neumococo. El 5% (n=304) se aislaron en muestras de LCR. El 94,7% de estas se identificaron a nivel de serotipo (total 41 serotipos distintos), el 3,9% se identificaron a nivel de serogrupo (6 serogrupos distintos) y el 1,3% no llegaron a ser serotipadas. Se aislaron 20 serotipos distintos en el 80,4% de las muestras de LCR, de los cuales, los serotipos 19F, 23B, 35F, 11A, 24F, 10A y 23A, mostraron una frecuencia de aparición en LCR mayor que en otras localizaciones (p<0,05) (tabla 1). La variación en la frecuencia de aislamiento de estos 7 serotipos a lo largo del tiempo no alcanzó significación estadística para ninguno de ellos (tabla 2), sin embargo, el total de cepas aisladas en LCR disminuyó de manera estadísticamente significativa (p<0,01) pasando de 140 (5,7%; OR: 1) en el periodo 2007-2010 a 81 (5,2%; OR: 0,91) en 2011-2014 y a 83 (4,0%; OR: 0,68) en 2015-2018. En conjunto, del total de 304 cepas aisladas en LCR 102 (33,6%) fueron resistentes a penicilina, 43 (14,1%) mostraron sensibilidad intermedia a cefotaxima y 2 (0,7%) fueron resistentes a este antibiótico. Todas las cepas fueron sensibles a la vancomicina. En cuanto a la sensibilidad a antimicrobianos de los diferentes serotipos, 9 (60,0%) de las 15 cepas del serotipo 11A aisladas en LCR fueron resistentes a penicilina y 7 (46,7%) mostraron sensibilidad intermedia a cefotaxima; 5 (35,7%) de las 14 cepas del serotipo 19F fueron resistentes a penicilina y una (7,1%) mostró sensibilidad intermedia a cefotaxima; 7 (53,8%) de las 13 cepas del serotipo 23B fueron resistentes a penicilina y todas fueron sensibles a cefotaxima; las 12 cepas del serotipo 10A resultaron sensibles tanto a penicilina como a cefotaxima; 7 (63,6%) de las 11 cepas del serotipo 24F fueron resistentes a penicilina y una (9,1%) presentó sensibilidad intermedia a cefotaxima; una (11,1%) de las 9 cepas del serotipo 23A fue resistente a penicilina y todas sensibles a cefotaxima y las 8 cepas del serotipo 35F fueron sensibles a ambos antibióticos.
Serotipos de Streptococcus pneumoniae más frecuentemente aislados en LCR. Comunidad de Madrid, 2007-2018
| Serotipo | Cepas en LCR | Cepas invasoras en otras muestras | OR | IC 95% | Valor de p | ||
|---|---|---|---|---|---|---|---|
| N.° | Porcentajea | N.° | Porcentajeb | ||||
| 19A | 31 | 10,2 | 504 | 8,7 | 1,2 | 0,8-1,8 | NS |
| 3 | 28 | 9,2 | 556 | 9,6 | 1,0 | 0,6-1,4 | NS |
| 8 | 25 | 8,2 | 833 | 14,3 | 0,5 | 0,4-0,8 | <0,01 |
| 11A | 15 | 4,9 | 160 | 2,8 | 1,8 | 1,1-3,2 | <0,05 |
| 19F | 14 | 4,6 | 76 | 1,3 | 3,6 | 2,0-6,5 | <0,01 |
| 23B | 13 | 4,3 | 107 | 1,8 | 2,4 | 1,3-4,3 | <0,01 |
| 7F | 13 | 4,3 | 332 | 5,7 | 0,7 | 0,4-1,3 | NS |
| 10A | 12 | 3,9 | 109 | 1,9 | 2,1 | 1,2-3,9 | <0,05 |
| 24F | 11 | 3,6 | 114 | 2,0 | 1,9 | 1,0-3,5 | <0,05 |
| 6C | 10 | 3,3 | 151 | 2,6 | 1,3 | 0,7-2,4 | NS |
| 23A | 9 | 3,0 | 79 | 1,4 | 2,2 | 1,1-4,5 | <0,05 |
| 35B | 9 | 3,0 | 97 | 1,7 | 1,8 | 0,9-3,6 | NS |
| 15A | 8 | 2,6 | 114 | 2,0 | 1,4 | 0,7-2,8 | NS |
| 15B | 8 | 2,6 | 94 | 1,6 | 1,6 | 0,8-3,4 | NS |
| 35F | 8 | 2,6 | 46 | 0,8 | 3,4 | 1,6-7,2 | <0,01 |
| 12F | 7 | 2,3 | 197 | 3,4 | 0,7 | 0,3-1,4 | NS |
| 22F | 7 | 2,3 | 229 | 3,9 | 0,6 | 0,3-1,2 | NS |
| 9N | 7 | 2,3 | 151 | 2,6 | 0,9 | 0,4-1,9 | NS |
| 14 | 5 | 1,6 | 139 | 2,4 | 0,7 | 0,3-1,7 | NS |
| 25A | 5 | 1,6 | 66 | 1,1 | 1,5 | 0,6-3,6 | NS |
IC 95%: intervalo de confianza al 95%; LCR: líquido cefalorraquídeo; NS: no significativo; OR: odds ratio.
Evolución de los principales serotipos de Streptococcus pneumoniae aislados en LCR con una frecuencia mayor que en otras muestras habitualmente estériles durante los periodos 2007-2010, 2011-2014 y 2015-2018
| Serotipos LCR | 2007-2010 | 2011-2014 | 2015-2018 | Chi-cuadrado tendencia lineal |
|---|---|---|---|---|
| Serotipo 11A | ||||
| N.° (%) | 5 (3,3) | 9 (11,1) | 1 (1,2) | NS |
| ORa | 1 | 3,68 | 0,36 | |
| Serotipo 19F | ||||
| N.° (%) | 6 (3,9) | 5 (6,2) | 3 (3,6) | NS |
| ORa | 1 | 1,6 | 0,91 | |
| Serotipo 23B | ||||
| N.° (%) | 6 (3,9) | 4 (4,9) | 3 (3,6) | NS |
| ORa | 1 | 1,26 | 0,91 | |
| Serotipo 10A | ||||
| N.° (%) | 6 (3,9) | 4 (4,9) | 2 (2,4) | NS |
| ORa | 1 | 1,26 | 0,6 | |
| Serotipo 24F | ||||
| N.° (%) | 4 (2,6) | 2 (2,5) | 5 (6,0) | NS |
| ORa | 1 | 0,94 | 2,37 | |
| Serotipo 23A | ||||
| N.° (%) | 3 (2,0) | 2 (2,5) | 4 (4,8) | NS |
| ORa | 1 | 1,26 | 2,51 | |
| Serotipo 35F | ||||
| N.° (%) | 3 (2,0) | 1 (1,2) | 4 (4,8) | NS |
| ORa | 1 | 0,62 | 2,51 | |
LCR: líquido cefalorraquídeo; NS: no significativo; OR: odds ratio.
Actualmente no se dispone de mucha información sobre el tropismo meníngeo de Streptococcus pneumoniae, y es controvertido el papel del polisacárido capsular, determinante del serotipo. Aunque otros elementos ajenos a la cápsula (neuraminidasa A) parecen favorecer la penetración a través de la barrera hematoencefálica7, se ha postulado que el tránsito a través del endotelio vascular mediante migración transcelular8 y la gravedad de los cuadros de meningitis tienen relación con el espesor de la cápsula4. La prevalencia de serotipos de neumococo varía en función de la localización geográfica y de la política de vacunación. En la Comunidad de Madrid (CM), el programa de inmunizaciones infantiles incluyó en 2006 la vacuna conjugada heptavalente VCN7, que fue reemplazada por la 13-valente (VCN13) en 2010. En 2012 fue retirada del programa, en 2015 se volvió a incluir, y entre 2012 y 2015 siguió administrándose por recomendación individual de los pediatras9. En este sentido, la distribución de serotipos de neumococo en LCR en la CM presenta ciertas diferencias respecto a la de otros países. En Brasil donde desde 2010 se emplea la vacuna conjugada 10-valente (VCN10), los serotipos más frecuentes aislados entre 1996 y 2012 en LCR fueron 14, 3, 6B, 19F, 23F, 18C, 4, 6A, 10A y 810. En Irán, sin vacunación sistemática frente a neumococo los principales serotipos en LCR fueron 18C, 14, 19A, 6A, 7F, 4, 3, 9V, 8, 23F y 511. En Holanda, con coberturas vacunales para la vacuna VCN7, la VCN10 y la VCN13 de 40, 53 y 68%, respectivamente los serotipos más comunes en LCR fueron 3, 7F, 23F, 14, 6B y 19F12. En Francia durante 2012, los serotipos no incluidos en la VCN13 representaron el 67,6% de los casos de meningitis en niños siendo los principales el 12F, 24F, 22F y 15B/C13. Ciertos serotipos frecuentemente detectados entre los casos de ENI en la CM a lo largo de todo el periodo tales como el 19A (que ha ido disminuyendo desde 2008-2010 a 2013-2015), el 3 (también en descenso, pero en menor medida)9 muestran también una alta frecuencia de aislamiento en LCR. El serotipo 8 muy frecuente en casos de ENI en la CM9 fue el tercero en ser identificado en LCR, sin embargo, fue aislado significativamente con más frecuencia en otras muestras clínicas procedentes de infecciones invasivas. Por otra parte, los serotipos 11A, 19F, 23B, 10A, 24F, 23A y 35F, hasta ahora poco frecuentes entre los casos de ENI en la CM, presentan un claro tropismo meníngeo. Es de destacar que ninguno, salvo el 19F, está cubierto por las vacunas conjugadas actualmente disponibles, si bien, dos de ellos, el 10A y el 11A están actualmente incluidos en la ya patentada vacuna conjugada 20-valente (VCN20)14 y, pese a que existe el riesgo de reemplazo de serotipos15, según nuestros resultados, por el momento no se ha producido un incremento de estos serotipos no vacunales en casos de meningitis. La sensibilidad a antimicrobianos de los serotipos que muestran mayor tropismo por el sistema nervioso central varió en función del serotipo. Hay que destacar la alta resistencia a penicilina (punto de corte para meningitis) de los serotipos 24F, 11A, 23B, y en menor medida del 19F. En conclusión, la mayor frecuencia y resistencia de estos serotipos de neumococo con elevado tropismo meníngeo podría comprometer el tratamiento de las infecciones del sistema nervioso central.
Conflicto de interesesJ.C. Sanz ha asistido a congresos financiados por Pfizer. El resto de los autores declara no tener ningún conflicto de intereses.