El objetivo de este trabajo fue analizar la susceptibilidad de Mycoplasma genitalium a macrólidos y fluoroquinolonas mediante técnicas moleculares.
MétodosLa susceptibilidad a macrólidos se analizó (Gipuzkoa, 2014-2017) mediante PCR en tiempo real con sondas (gen 23S ARNr) y a fluoroquinolonas mediante secuenciación tras PCR convencionales (genes parC/gyrA).
ResultadosSe detectaron mutaciones asociadas con resistencia a macrólidos en 43/263 (16,3%) casos y con posible resistencia a fluoroquinolonas en 21/267 (7,9%). La resistencia a macrólidos fue más frecuente tras tratamiento previo con azitromicina (76,5 vs. 7,4%; p<0,001) y con la pauta única de 1g (31,3 vs. 7% pauta ampliada, p<0,001). Se detectaron 5/245 (2%) casos con mutaciones de posible resistencia para ambos antibióticos.
ConclusionesLa técnica empleada para el estudio de la susceptibilidad de Mycoplasma genitalium a la azitromicina permitió una respuesta rápida con un tratamiento antibiótico dirigido. Moxifloxacino puede ser una buena alternativa en casos con resistencia a macrólidos.
The objective of this study was to analyse the susceptibility of Mycoplasma genitalium to macrolides and fluoroquinolones using molecular techniques.
MethodsSusceptibility to macrolides was tested (Gipuzkoa, 2014-2017) by a rapid probe-based real-time polymerase chain reaction assay (23S rRNA gene) and to fluoroquinolones by sequencing the parC and gyrA genes.
ResultsMutations associated with macrolide resistance were detected in 43/263 (16.3%) cases and potential fluoroquinolone resistance in 21/267 (7.9%). Macrolide resistance was more frequent in patients previously treated with azithromycin (76.5% vs 7.4%, P<.001) as well as in those treated with a single 1g dose (31.3%) vs the extended regimen (7%, P<.001). There were 5/245 (2%) cases with mutations probably associated with resistance to both antibiotics.
ConclusionsThe technique used for testing Mycoplasma genitalium susceptibility to azithromycin allowed the rapid implementation of resistance-guided antibiotic therapy. Moxifloxacin could be a good option in cases of macrolide resistance.
Mycoplasma genitalium (M. genitalium) es una causa importante de infecciones de transmisión sexual (ITS), frecuentemente persistentes y/o recurrentes1. Las características de esta bacteria, sin pared celular y pequeño genoma, influyen en la dificultad y lentitud (semanas) de su aislamiento en medios de cultivo. El reciente desarrollo de técnicas moleculares ha permitido implementar el diagnóstico de este microorganismo en los laboratorios clínicos. La pauta de tratamiento actualmente indicada es azitromicina vo 500mg el primer día ampliada con 250mg/día 4 días, empleándose moxifloxacino vo 400mg 7-14 días como alternativa o en casos de recidiva o infección complicada2.
La monitorización de la resistencia a macrólidos en M. genitalium está cobrando especial interés, describiéndose en algunos países tasas variables y crecientes (∼15-70%)3,4. Ello ha cuestionado su empleo como tratamiento empírico en las uretritis y otras ITS no gonocócicas, recomendando algunos autores en su lugar doxiciclina vo 200mg/día 7 días5. Sin embargo, las tasas de curación referidas con doxiciclina son bajas (30-40%)1,2.
En esta situación, y siendo la susceptibilidad antibiótica de M. genitalium aún poco conocida en España6,7, los objetivos de este trabajo han sido (1) analizar la susceptibilidad a macrólidos de esta bacteria en Gipuzkoa, empleando técnicas moleculares que faciliten la rápida elección del tratamiento más adecuado y (2) conocer su susceptibilidad a fluoroquinolonas.
MétodosEl estudio se realizó entre 2014 y 2017 en el Hospital Universitario Donostia, Gipuzkoa (población atendida ∼600.000 habitantes). Las muestras recibidas para diagnóstico microbiológico de pacientes con sospecha de ITS (uretritis, cervicitis, contactos asintomáticos, cribado gestacional…) se analizaron diariamente empleando una técnica de reacción en cadena de la polimerasa en tiempo real (PCR-TR) que detecta simultáneamente ADN de M. genitalium y otros 6 microorganismos (Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, Ureaplasma urealyticum, Ureaplasma parvum y Mychoplasma hominis) relacionados con ITS (AllplexTM STI Essential Assay, Seegene). Las muestras en las que se detectó M. genitalium fueron analizadas en menos de 24h con una segunda PCR-TR casera (termociclador LightCycler, Roche) que amplifica un fragmento del gen 23S ARNr y diferencia mediante el empleo de sondas entre cepas salvajes (T.a melting ∼59°C) y cepas con mutaciones (posiciones 2058 y 2059) asociadas a resistencia a macrólidos (T.a melting ∼50-55°C, figura suplementaria)3. Los pacientes recibieron tratamiento dirigido (azitromicina o moxifloxacino), consejo de control a sus contactos sexuales y fueron citados para realizar un test de cura a las 4-6 semanas.
Con posterioridad, y para conocer la mutación específica en el gen 23S ARNr de las cepas resistentes, se realizó otra PCR convencional empleando los mismos cebadores sin sondas (Thermal Cycler, Applied Biosystems), seguida de secuenciación (3130XL Genetic Analyzer, Applied Biosystems) y comparación de las secuencias obtenidas con la de la cepa patrón MG37 (BLAST, http://www.ncbi.nlm.nih.gov/blast/Blast.cgi); la duración de estos procesos es≥3-4 días. Finalmente, el estudio de susceptibilidad a fluoroquinolonas se realizó mediante PCR convencionales que amplifican un fragmento del gen parC y otro del gen gyrA8,9, comparando posteriormente las secuencias obtenidas con la de la cepa MG37.
ResultadosSe analizaron 14.167 muestras de distintas localizaciones y episodios de infección en 8.388 pacientes, detectándose ADN de M. genitalium en 437 muestras de 330 pacientes (3,9% [IC 95% 3,5-4,3%]) de 16-67 años de edad (mediana 30 años). Se dispuso de muestra o ADN sobrante para análisis de resistencias a antimicrobianos en 313 pacientes (202 hombres, 111 mujeres) que procedían de atención primaria (65%, derivados y atendidos en Microbiología), Ginecología (21%, 1/3 para cribado gestacional de ITS), centro de ITS (9%), Urología (2%), y Urgencias (3%).
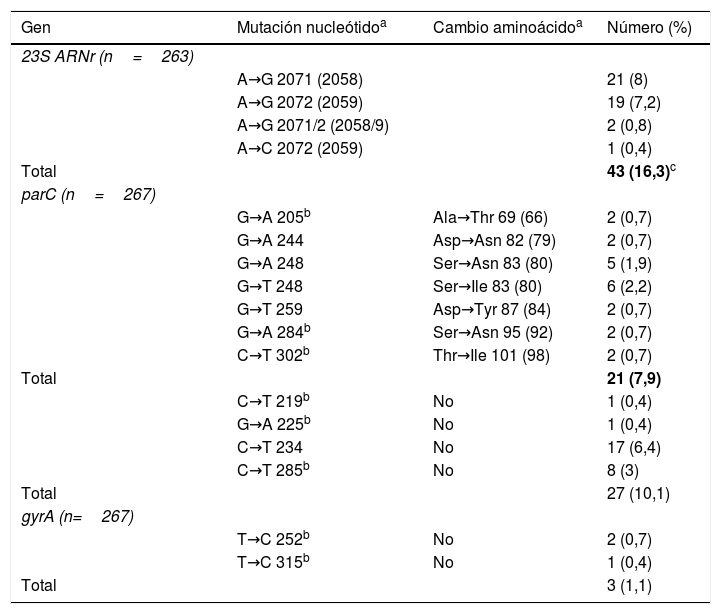
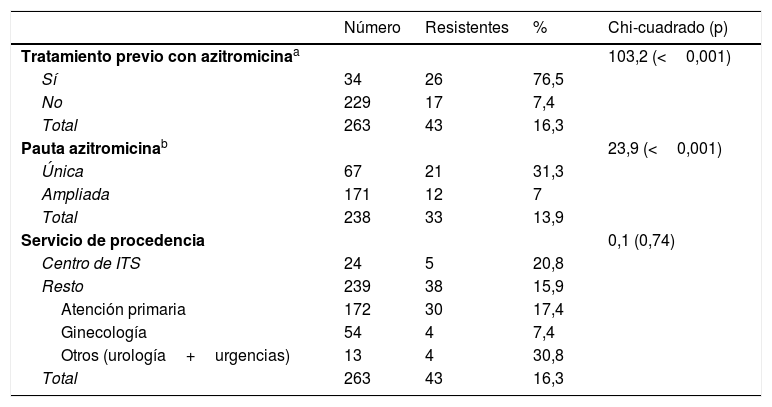
El gen 23S ARNr se pudo amplificar en 263/313 pacientes (84%, 96,1% en las muestras con Ct≤35), detectándose cepas resistentes a macrólidos en 43 (16,3% [IC 95% 12,4-21,3%]) (tabla 1). La resistencia fue mayor en hombres que en mujeres (22,2 vs. 4,6%; p<0,001) y en hombres que tienen sexo con hombres que en hombres heterosexuales (32,5 vs. 17,6%; p=0,045) (tabla 2). Se detectaron cepas resistentes en 17/229 pacientes (7,4% [IC 95% 4,7-11,6%]) que no habían recibido tratamiento previo recientemente con azitromicina, si bien estos valores fueron de 26/34 (76,5% [IC 95% 59,8-87,5%]) entre los pacientes con infección persistente o recurrente tras el tratamiento de episodios en los que se detectaron cepas inicialmente sensibles (p<0,001) (tabla 2). Estas cepas resistentes detectadas tras un tratamiento previo con azitromicina representaron el 60,5% (26/43) del total de cepas resistentes. El desarrollo de resistencia también fue mayor en los 21/67 (31,3% [IC 95% 21,5-43,2%]) pacientes en los que se había empleado la pauta única de 1g de azitromicina, que en los 12/171 (7% [IC 95% 4,1-11,9%]) que habían recibido la pauta ampliada (p<0,001).
Posición y frecuencia de las mutaciones detectadas en los genes 23S ARNr, parC y gyrA de Mycoplasma genitalium
| Gen | Mutación nucleótidoa | Cambio aminoácidoa | Número (%) |
|---|---|---|---|
| 23S ARNr (n=263) | |||
| A→G 2071 (2058) | 21 (8) | ||
| A→G 2072 (2059) | 19 (7,2) | ||
| A→G 2071/2 (2058/9) | 2 (0,8) | ||
| A→C 2072 (2059) | 1 (0,4) | ||
| Total | 43 (16,3)c | ||
| parC (n=267) | |||
| G→A 205b | Ala→Thr 69 (66) | 2 (0,7) | |
| G→A 244 | Asp→Asn 82 (79) | 2 (0,7) | |
| G→A 248 | Ser→Asn 83 (80) | 5 (1,9) | |
| G→T 248 | Ser→Ile 83 (80) | 6 (2,2) | |
| G→T 259 | Asp→Tyr 87 (84) | 2 (0,7) | |
| G→A 284b | Ser→Asn 95 (92) | 2 (0,7) | |
| C→T 302b | Thr→Ile 101 (98) | 2 (0,7) | |
| Total | 21 (7,9) | ||
| C→T 219b | No | 1 (0,4) | |
| G→A 225b | No | 1 (0,4) | |
| C→T 234 | No | 17 (6,4) | |
| C→T 285b | No | 8 (3) | |
| Total | 27 (10,1) | ||
| gyrA (n=267) | |||
| T→C 252b | No | 2 (0,7) | |
| T→C 315b | No | 1 (0,4) | |
| Total | 3 (1,1) |
Diferencias observadas en las tasas de resistencia a macrólidos en función del tratamiento previo con azitromicina, la pauta empleada o el servicio de procedencia de los pacientes
| Número | Resistentes | % | Chi-cuadrado (p) | |
|---|---|---|---|---|
| Tratamiento previo con azitromicinaa | 103,2 (<0,001) | |||
| Sí | 34 | 26 | 76,5 | |
| No | 229 | 17 | 7,4 | |
| Total | 263 | 43 | 16,3 | |
| Pauta azitromicinab | 23,9 (<0,001) | |||
| Única | 67 | 21 | 31,3 | |
| Ampliada | 171 | 12 | 7 | |
| Total | 238 | 33 | 13,9 | |
| Servicio de procedencia | 0,1 (0,74) | |||
| Centro de ITS | 24 | 5 | 20,8 | |
| Resto | 239 | 38 | 15,9 | |
| Atención primaria | 172 | 30 | 17,4 | |
| Ginecología | 54 | 4 | 7,4 | |
| Otros (urología+urgencias) | 13 | 4 | 30,8 | |
| Total | 263 | 43 | 16,3 |
Los genes parC/gyrA se pudieron amplificar en 267/313 pacientes, detectándose mutaciones con posible asociación a resistencia en 21 (7,9% [IC 95% 5,2-11,7%]), solo en el gen parC (tabla 1). De estos 21 pacientes, 16 fueron tratados exitosamente con azitromicina, pero se detectaron 5/245 (2%) casos con mutaciones de resistencia para macrólidos y fluoroquinolonas. Estos 5 pacientes fueron tratados con moxifloxacino (en el momento de indicar este tratamiento se desconocía el resultado de las mutaciones a fluoroquinolonas): en 2 casos la infección se resolvió, 2 casos no acudieron a control y en el quinto caso se volvió a detectar M. genitalium en el test de cura. Este paciente fue tratado con doxiciclina, tras considerar improbable una reinfección en el estudio de contactos, resolviéndose finalmente.
DiscusiónEn este trabajo, en menos de 24h tras la detección de M. genitalium con una PCR-TR comercial, se utilizó una PCR-TR casera adicional indicada para la diferenciación entre cepas salvajes (sensibles) y cepas con las mutaciones más frecuentemente asociadas con resistencia a macrólidos3. Esta rapidez permitió realizar un tratamiento dirigido o modificar la pauta empírica en caso necesario. Recientemente se han desarrollado PCR-TR comerciales que detectan las principales mutaciones asociadas a resistencia10,11.
La tasa de resistencia global a macrólidos en M. genitalium detectada en Gipuzkoa fue del 16,3%. Esta cifra está en el rango de las referidas en otros trabajos realizados en población general (14-38%)3,12,13, pero es inferior a la descrita en pacientes que acuden a centros de ITS (35-72%)4,6,9–11,14 (tabla suplementaria). Esta diferencia puede ser debida a la mayor presión antibiótica con macrólidos por el mayor número de ITS tratadas con azitromicina en pacientes atendidos en centros de ITS, especialmente hombres que tienen sexo con hombres (tabla 2 y tabla suplementaria). La resistencia observada en el presente estudio refleja mejor la tasa en población general, ya que un 65% de los pacientes procedían de atención primaria y <10% de un centro de ITS.
La resistencia primaria a macrólidos (sin tratamiento reciente) fue solo del 7,4%, mientras que la resistencia secundaria en pacientes con tratamiento previo con azitromicina en cepas inicialmente sensibles fue del 76,5% (60% de las resistencias detectadas). Esto indica que durante el tratamiento se induce la mutación responsable de la resistencia y/o que se seleccionan cepas resistentes inicialmente minoritarias (en 3/43 pacientes se detectaron cepas sensibles y resistentes en la misma muestra)3,11,15, aunque no podemos descartar que en algún caso se produzca una reinfección por una cepa resistente. Por otra parte, ha sido descrito y los resultados de este estudio claramente apoyan, que las tasas de resistencia a macrólidos en infecciones por M. genitalium tratadas tras pauta única de un gramo son superiores a las detectadas tras la pauta ampliada (0,5 o 1g día 1, 250mg/día días 2-5)2. Dada esta diferencia y la baja respuesta clínica referida con doxiciclina1,2, los resultados del presente estudio apoyan el tratamiento dirigido (<24h) tras un análisis de susceptibilidad a macrólidos en estas infecciones.
El tratamiento alternativo a los macrólidos recomendado en las ITS por M. genitalium es fluoroquinolonas2. En el presente estudio se detectaron mutaciones con posible asociación a resistencia en el gen parC en el 7,9% de los pacientes, habiéndose descrito en otros trabajos cifras de 3-29% (tabla suplementaria)6,8–10,12,14. A diferencia de las mutaciones en el gen 23S ARNr y la resistencia a macrólidos15, las mutaciones descritas en la región codificante de resistencia a quinolonas (QRDR) de los genes parC y gyrA en M. genitalium, no siempre tienen una adecuada concordancia con la respuesta clínica, habiéndose referido algunas diferencias en función de la mutación implicada y con la carga bacteriana14. En este estudio solo 5/245 (2%) pacientes presentaron mutaciones de resistencia a macrólidos y quinolonas, habiéndose resuelto clínicamente con el tratamiento con moxifloxacino 2/3 y posiblemente también los 2 que no acudieron al control.
En conclusión, los resultados de este trabajo ponen de manifiesto la importancia de la detección de M. genitalium en las ITS y la conveniencia del análisis de su susceptibilidad a macrólidos con técnicas rápidas. La tasa de resistencia a macrólidos (16%, 7% en pacientes sin tratamiento previo) en población general fue inferior a la referida en estudios realizados en pacientes atendidos en centros de ITS. En esta ITS es importante realizar un control de cura, dada la frecuente detección de mutaciones durante el tratamiento en casos de recidiva. Moxifloxacino en esos casos es una buena alternativa, con una tasa de mutaciones con posibles resistencias detectadas inferior al 10%, permitiendo esta estrategia reservar el tratamiento con doxiciclina para los pocos casos con resistencia a macrólidos y fallo clínico a fluoroquinolonas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.