Las infecciones por bacilos gramnegativos anaerobios (BGNA) son frecuentes y pueden llegar a comprometer la vida del paciente. En los últimos años se ha reportado un aumento de la incidencia, fundamentalmente debido al incremento de pacientes con enfermedades cada vez más complejas y al aumento de la esperanza de vida1,2. Adicionalmente, diversos estudios han detectado un incremento de las resistencias de estas bacterias a los antimicrobianos, lo que puede dar lugar a tratamientos empíricos inadecuados1,3. En base a este hecho, algunos autores justifican la importancia no solo de realizar sistemáticamente pruebas de sensibilidad antibiótica, sino también la necesidad de disponer de sistemas de vigilancia de resistencias antimicrobianas4. El objetivo del estudio ha sido analizar la evolución de los perfiles de sensibilidad a antibióticos de los BGNA más prevalentes en la Comunidad Valenciana (CV) en los 7 últimos años.
Como fuente de información se utilizaron los datos procedentes de la Red de Vigilancia Microbiológica de la Comunidad Valenciana (RedMiVa). Se trata de una pionera aplicación informática integrada en la Dirección General de Salud Pública (Conselleria de Sanitat) que recoge y almacena diariamente los resultados microbiológicos de todos los Servicios de Microbiología públicos de la CV, lo que permite analizar un gran número de casos y supone un paso importante en la mejora de la vigilancia epidemiológica. Se realizó una búsqueda de los aislamientos de Bacteroides spp., Prevotella spp., Fusobacterium spp. y Porphyromonas spp. registrados en el período 2010-16. Los procedimientos de aislamiento e identificación bacteriana, así como los estudios de sensibilidad antimicrobiana, fueron los propios de cada laboratorio. Se consideró «caso» a aquellos pacientes que presentaron alguna de estas bacterias anaerobias en muestras de sangre, aparatos digestivo, genitourinario, respiratorio o piel y tejidos blandos. Los aislamientos duplicados no se consideraron. Se analizaron variables de tiempo y lugar, variables de la persona y variables microbiológicas (especies detectadas y sensibilidad antimicrobiana). La comparación de la distribución de frecuencias de sensibilidad antibiótica en los años estudiados se llevó a cabo mediante el test Chi cuadrado de Pearson; se consideró estadísticamente significativo un valor de p<0,05.
Se detectaron un total de 10.835 pacientes con algún aislamiento de BGNA: 7.139 (66%) con Bacteroides spp., 2.842 (26%) con Prevotella spp., 685 (6%) con Fusobacterium spp. y 169 (2%) con Porphyromonas spp. Solo se apreciaron diferencias significativas en el estudio comparativo por años en Prevotella spp. y Fusobacterium spp., donde el número total de casos observados sufrió un incremento progresivo a lo largo del período. No se observaron diferencias significativas en el estudio por sexos. La mediana de edad de los pacientes fue de 67años para Bacteroides, 55años para Prevotella, 53años para Fusobacterium y 57años para Porphyromonas spp. La mayoría de los aislamientos se registraron en muestras de piel y tejidos blandos (5.049; 47%), seguido de muestras del aparato digestivo (3.360; 31%). Las principales especies bacterianas detectadas fueron: Bacteroides grupo fragilis (3.180; 44%), Prevotella bivia (652; 23%), Fusobacterium nucleatum (247; 36%) y Porphyromonas asaccharolytica (121; 72%).
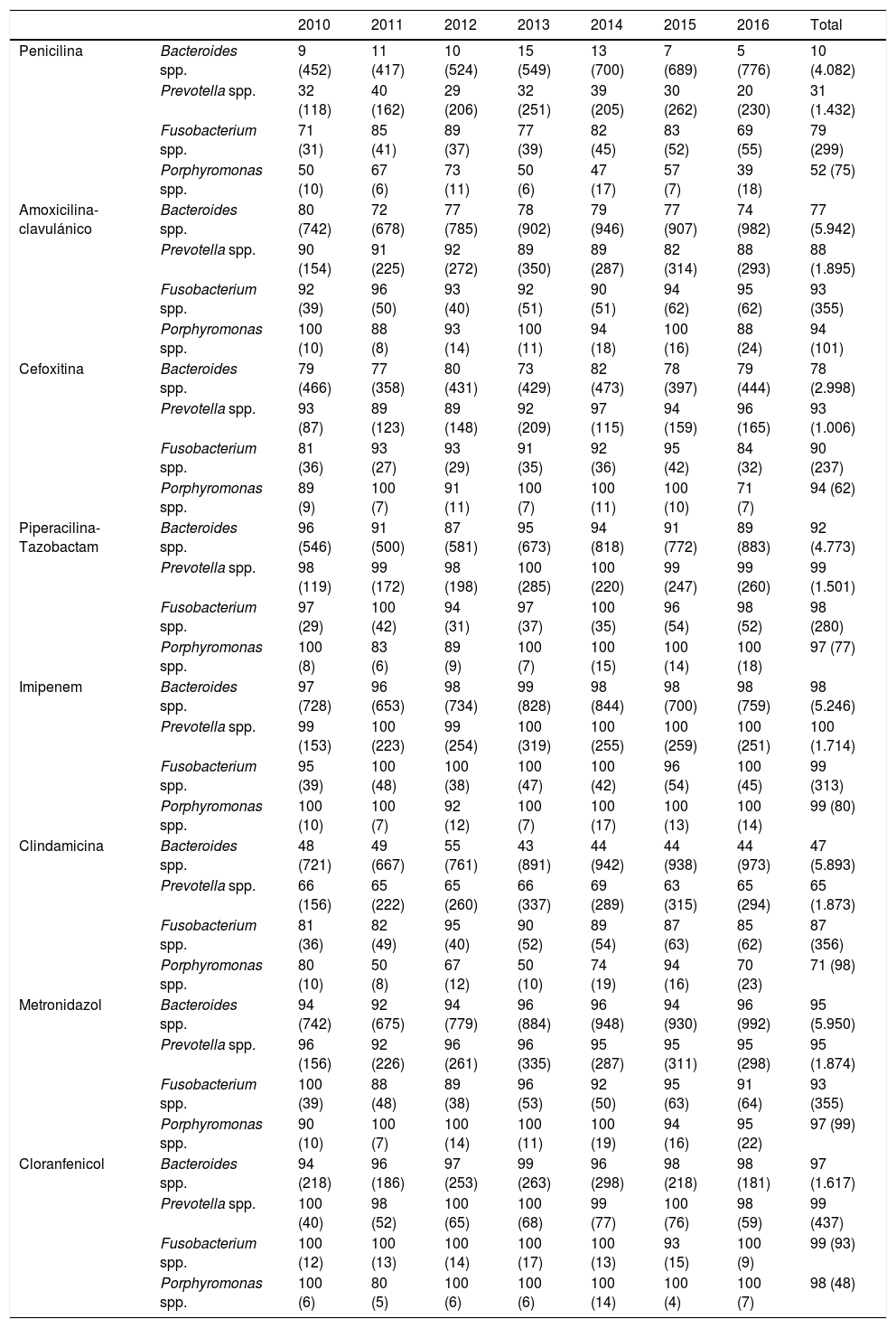
A nivel de género, la evolución de los porcentajes de sensibilidad a antibióticos a lo largo del período de estudio se muestra en la tabla 1. Las tasas de sensibilidad a penicilina no variaron significativamente durante el período 2010-14, sufriendo un descenso (p<0,05) en los dos últimos años de estudio (2015-16), en consonancia con los resultados de otras series4-6; por el contrario, la sensibilidad a amoxicilina-ácido clavulánico y cefoxitina permaneció constante a lo largo de todo el período.
Porcentaje de sensibilidad y número de aislamientos (entre paréntesis) de Bacteroides, Prevotella, Fusobacterium y Porphyromonas spp. detectados en la Comunidad Valenciana (2010-2016)
| 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | Total | ||
|---|---|---|---|---|---|---|---|---|---|
| Penicilina | Bacteroides spp. | 9 (452) | 11 (417) | 10 (524) | 15 (549) | 13 (700) | 7 (689) | 5 (776) | 10 (4.082) |
| Prevotella spp. | 32 (118) | 40 (162) | 29 (206) | 32 (251) | 39 (205) | 30 (262) | 20 (230) | 31 (1.432) | |
| Fusobacterium spp. | 71 (31) | 85 (41) | 89 (37) | 77 (39) | 82 (45) | 83 (52) | 69 (55) | 79 (299) | |
| Porphyromonas spp. | 50 (10) | 67 (6) | 73 (11) | 50 (6) | 47 (17) | 57 (7) | 39 (18) | 52 (75) | |
| Amoxicilina-clavulánico | Bacteroides spp. | 80 (742) | 72 (678) | 77 (785) | 78 (902) | 79 (946) | 77 (907) | 74 (982) | 77 (5.942) |
| Prevotella spp. | 90 (154) | 91 (225) | 92 (272) | 89 (350) | 89 (287) | 82 (314) | 88 (293) | 88 (1.895) | |
| Fusobacterium spp. | 92 (39) | 96 (50) | 93 (40) | 92 (51) | 90 (51) | 94 (62) | 95 (62) | 93 (355) | |
| Porphyromonas spp. | 100 (10) | 88 (8) | 93 (14) | 100 (11) | 94 (18) | 100 (16) | 88 (24) | 94 (101) | |
| Cefoxitina | Bacteroides spp. | 79 (466) | 77 (358) | 80 (431) | 73 (429) | 82 (473) | 78 (397) | 79 (444) | 78 (2.998) |
| Prevotella spp. | 93 (87) | 89 (123) | 89 (148) | 92 (209) | 97 (115) | 94 (159) | 96 (165) | 93 (1.006) | |
| Fusobacterium spp. | 81 (36) | 93 (27) | 93 (29) | 91 (35) | 92 (36) | 95 (42) | 84 (32) | 90 (237) | |
| Porphyromonas spp. | 89 (9) | 100 (7) | 91 (11) | 100 (7) | 100 (11) | 100 (10) | 71 (7) | 94 (62) | |
| Piperacilina-Tazobactam | Bacteroides spp. | 96 (546) | 91 (500) | 87 (581) | 95 (673) | 94 (818) | 91 (772) | 89 (883) | 92 (4.773) |
| Prevotella spp. | 98 (119) | 99 (172) | 98 (198) | 100 (285) | 100 (220) | 99 (247) | 99 (260) | 99 (1.501) | |
| Fusobacterium spp. | 97 (29) | 100 (42) | 94 (31) | 97 (37) | 100 (35) | 96 (54) | 98 (52) | 98 (280) | |
| Porphyromonas spp. | 100 (8) | 83 (6) | 89 (9) | 100 (7) | 100 (15) | 100 (14) | 100 (18) | 97 (77) | |
| Imipenem | Bacteroides spp. | 97 (728) | 96 (653) | 98 (734) | 99 (828) | 98 (844) | 98 (700) | 98 (759) | 98 (5.246) |
| Prevotella spp. | 99 (153) | 100 (223) | 99 (254) | 100 (319) | 100 (255) | 100 (259) | 100 (251) | 100 (1.714) | |
| Fusobacterium spp. | 95 (39) | 100 (48) | 100 (38) | 100 (47) | 100 (42) | 96 (54) | 100 (45) | 99 (313) | |
| Porphyromonas spp. | 100 (10) | 100 (7) | 92 (12) | 100 (7) | 100 (17) | 100 (13) | 100 (14) | 99 (80) | |
| Clindamicina | Bacteroides spp. | 48 (721) | 49 (667) | 55 (761) | 43 (891) | 44 (942) | 44 (938) | 44 (973) | 47 (5.893) |
| Prevotella spp. | 66 (156) | 65 (222) | 65 (260) | 66 (337) | 69 (289) | 63 (315) | 65 (294) | 65 (1.873) | |
| Fusobacterium spp. | 81 (36) | 82 (49) | 95 (40) | 90 (52) | 89 (54) | 87 (63) | 85 (62) | 87 (356) | |
| Porphyromonas spp. | 80 (10) | 50 (8) | 67 (12) | 50 (10) | 74 (19) | 94 (16) | 70 (23) | 71 (98) | |
| Metronidazol | Bacteroides spp. | 94 (742) | 92 (675) | 94 (779) | 96 (884) | 96 (948) | 94 (930) | 96 (992) | 95 (5.950) |
| Prevotella spp. | 96 (156) | 92 (226) | 96 (261) | 96 (335) | 95 (287) | 95 (311) | 95 (298) | 95 (1.874) | |
| Fusobacterium spp. | 100 (39) | 88 (48) | 89 (38) | 96 (53) | 92 (50) | 95 (63) | 91 (64) | 93 (355) | |
| Porphyromonas spp. | 90 (10) | 100 (7) | 100 (14) | 100 (11) | 100 (19) | 94 (16) | 95 (22) | 97 (99) | |
| Cloranfenicol | Bacteroides spp. | 94 (218) | 96 (186) | 97 (253) | 99 (263) | 96 (298) | 98 (218) | 98 (181) | 97 (1.617) |
| Prevotella spp. | 100 (40) | 98 (52) | 100 (65) | 100 (68) | 99 (77) | 100 (76) | 98 (59) | 99 (437) | |
| Fusobacterium spp. | 100 (12) | 100 (13) | 100 (14) | 100 (17) | 100 (13) | 93 (15) | 100 (9) | 99 (93) | |
| Porphyromonas spp. | 100 (6) | 80 (5) | 100 (6) | 100 (6) | 100 (14) | 100 (4) | 100 (7) | 98 (48) |
La resistencia a piperacilina-tazobactam (la más elevada se detectó en Bacteroides spp., 8%), imipenem (la mayor, en Bacteroides spp.; 2%), metronidazol (la más elevada fue de un 7% para Fusobacterium spp.) y cloranfenicol (la mayor, en Bacteroides spp.; 3%) fue muy baja o incluso nula, coincidiendo con otros estudios4,6-10.
Excepto en Fusobacterium spp., la baja sensibilidad a clindamicina se mantuvo constante durante el período, a diferencia de lo detectado por otros autores6,8,9.
Una de las limitaciones de este estudio es el pequeño tamaño muestral encontrado anualmente en el caso de Porphyromonas spp., aunque, globalmente, los casos analizados no son despreciables.
La sensibilidad a antibióticos de los BGNA más prevalentes en la CV no ha experimentado cambios destacables en los últimos años, por lo que no se aconseja informar de forma sistemática los resultados de los estudios de sensibilidad, salvo en el caso de infecciones graves. Además, de acuerdo con los resultados obtenidos en el estudio, no se recomiendan utilizar empíricamente penicilina y clindamicina ni, en el caso de Bacteroides spp., amoxicilina-ácido clavulánico y cefoxitina. Aun así, la monitorización de los patrones de resistencia antibiótica sería conveniente para predecir futuros cambios en la sensibilidad a los antimicrobianos más frecuentemente utilizados en las infecciones provocadas por estas bacterias y poder establecer terapias empíricas apropiadas.