Reportamos un caso de neoplasia de células de Leydig en un paciente varón de 25 años, sin factores de riesgo clásicos con evolución tórpida. Se analizó la histopatología de la masa tumoral y se encontró malignidad por lo que se decide realizar orquiectomía derecha, seguida de quimioterapia. Luego del tratamiento se halla metástasis pulmonar, adenopatías perihepáticas e hidronefrosis, falleciendo 2 meses después de su último ingreso hospitalario.
Hipótesis del casoEl tumor de células de Leydig representa entre el 1-3% de todos los tumores testiculares. Se presentan a cualquier edad; sobre todo en la infancia y en la 3.a-6.a década de la vida. Aproximadamente el 90% son de curso benigno y el 10% son malignos, presentándose sobre todo entre la 5.a y la 6.a década de la vida, y están asociados con un tamaño>5cm y ginecomastia. Finalmente, es difícil predecir el comportamiento en términos histológicos.
Repercusiones a futuroA pesar que los tumores de células no germinales son poco frecuentes, es importante considerarlos como diagnóstico para brindar el tratamiento óptimo y evitar resultados desafortunados.
A case is presented of a Leydig cell neoplasm in a 25 year-old male patient with no classic risk factors with an atypical outcome. The tumour mass was histologically analysed and was found to have features compatible with a germ cell neoplasm. A right orchiectomy was performed, followed by chemotherapy. After treatment, pulmonary metastasis, lymph nodes, and peri-hepatic hydronephrosis were found. The patient died two months after his last hospital admission.
Case hypothesisLeydig cell tumours account for 1% to 3% of all testicular tumours. They occur at any age, especially in children, and between the third and sixth decade of life. Around 90% are benign, and 10% are malignant; these latter usually occurring between 50 and 60 years old, and are associated with sizes larger than 5cm and gynecomastia. Finally, it is difficult to predict the development of the disease based on histopathological observations.
Promising future implicationsAlthough non-germ cell tumours are rare, it is important to consider them in the differential diagnosis of testicular tumours, particularly in those of non-seminoma origin. Immunohistochemistry is useful for the differentiation of testicular tumours in those cases when conventional histology shows no conclusive findings.
El cáncer testicular es de rara aparición y representa menos del 1% de todos los tipos de cáncer en varones1. De estos, más del 90% son tumores derivados de células germinales, y el resto, tumores estromales provenientes de los cordones sexuales u otros, dentro de los cuales se encuentra el tumor de células de Leydig. Este tumor representa el 1-4% de los tumores testiculares, siendo el 90% de curso benigno y de buen pronóstico2,3. Clásicamente, los pacientes se presentan con dolor y masa testicular, desarrollo precoz físico y sexual en niños, feminización y ginecomastia en adultos, marcadores tumorales negativos y niveles de estrógeno y progesterona elevados en la mayoría de los casos4. Describimos el caso de un paciente con tumor maligno de células de Leydig y pobre evolución, previamente diagnosticado como tumor de células germinales.
Presentación del casoPaciente varón de 25 años con antecedente de aumento de volumen testicular derecho desde los 15 años. Acude a consulta médica por presentar ginecomastia y crecimiento acelerado del tumor testicular en un periodo de 2 meses, sin sintomatología adicional, por lo que se indica una ecografía que evidencia tumor testicular. Se agregó dolor y coloración violácea en zona escrotal, por lo que se indica su traslado a un hospital general con diagnóstico presuntivo de seminoma. Se observa paciente en regular estado general, regular estado de hidratación y nutrición, lúcido, orientado, en tiempo espacio y persona. Al examen físico, se encuentra PA: 100/70mmHg, FC: 80lpm y FR: 18rpm. Presencia de ginecomastia. El examen pulmonar y cardiovascular se encontró sin alteraciones. El examen gastrointestinal reveló abdomen distendido con ruidos hidroaéreos presentes. Se palpa masa dolorosa de bordes irregulares que abarca epigastrio y mesogastrio. A nivel genitourinario se observó bolsa escrotal aumentada de tamaño, de coloración violácea, con tumoración testicular dolorosa de 12×9cm de consistencia mixta. Resto del examen no contributorio. Por lo antes mencionado se decide su hospitalización en el Servicio de Urología de dicho hospital.
Se realizó hemograma que reportó hemoglobina: 14.5g/dl (VN: 13.5-17.5g/dl), leucocitos: 7.470×mm3 (VN: 5,000-10,500), plaquetas: 395,000mm3 (VN: 150,000-450,000mm3). El perfil hepático reveló niveles de fosfatasa alcalina: 255U/L (VN: 38-126U/L), bilirrubina total: 1.20mg % (VN: 0.2-1.3mg %), gammaglutamiltranspeptidasa: 63U/l (VN: 15-73U/L), aspartato aminotransaminasa: 82U/L (VN: 17-59U/L) y alanina aminotransaminasa: 180U/L (VN: 21-70U/L). Se realizaron ecografía y tomografía axial computarizada, evidenciándose tumor testicular de 10×7cm, hepatomegalia moderada y masas captadoras de contraste, con centro necrótico, de 5cm de diámetro delante de la vena cava inferior, intercavo aórticas y paraaórtica izquierda. Se solicitaron marcadores tumorales: deshidrogenasa láctica: 415U/L (VN: 313-618U/L), α-fetoproteína: 2.17ng/ml (VN: 0-8ng/mL) y HCG-β<0.100mIU/ml (VN: 0-4mIU/ml). Se decidió realizar orquiectomía radical de testículo derecho donde se reportó testículo y conducto deferente de 120g, el cual presentó tumoración de consistencia dura de 7×6cm, de aspecto nodular, pardo-blanquecino, adherida a la pared escrotal con compromiso de cordón espermático; además, a nivel del conducto deferente se observan nódulos tumorales. Retetestis y epidídimo no comprometidos. La anatomía patológica reveló compromiso de túnica albugínea, vaginalis y cordón espermático; embolia tumoral vascular e invasión perineural presente, y ausencia de embolia linfática. Por lo tanto, se concluye como tumor testicular de células germinales no seminomatoso, por lo que se clasifica la enfermedad en estadio clínico IIC, Pt3N3M0 S0. Se le hospitalizó para recibir 2 cursos de quimioterapia adyuvante, con bleomicina, etopósido y cisplatino, que transcurrieron sin complicaciones.
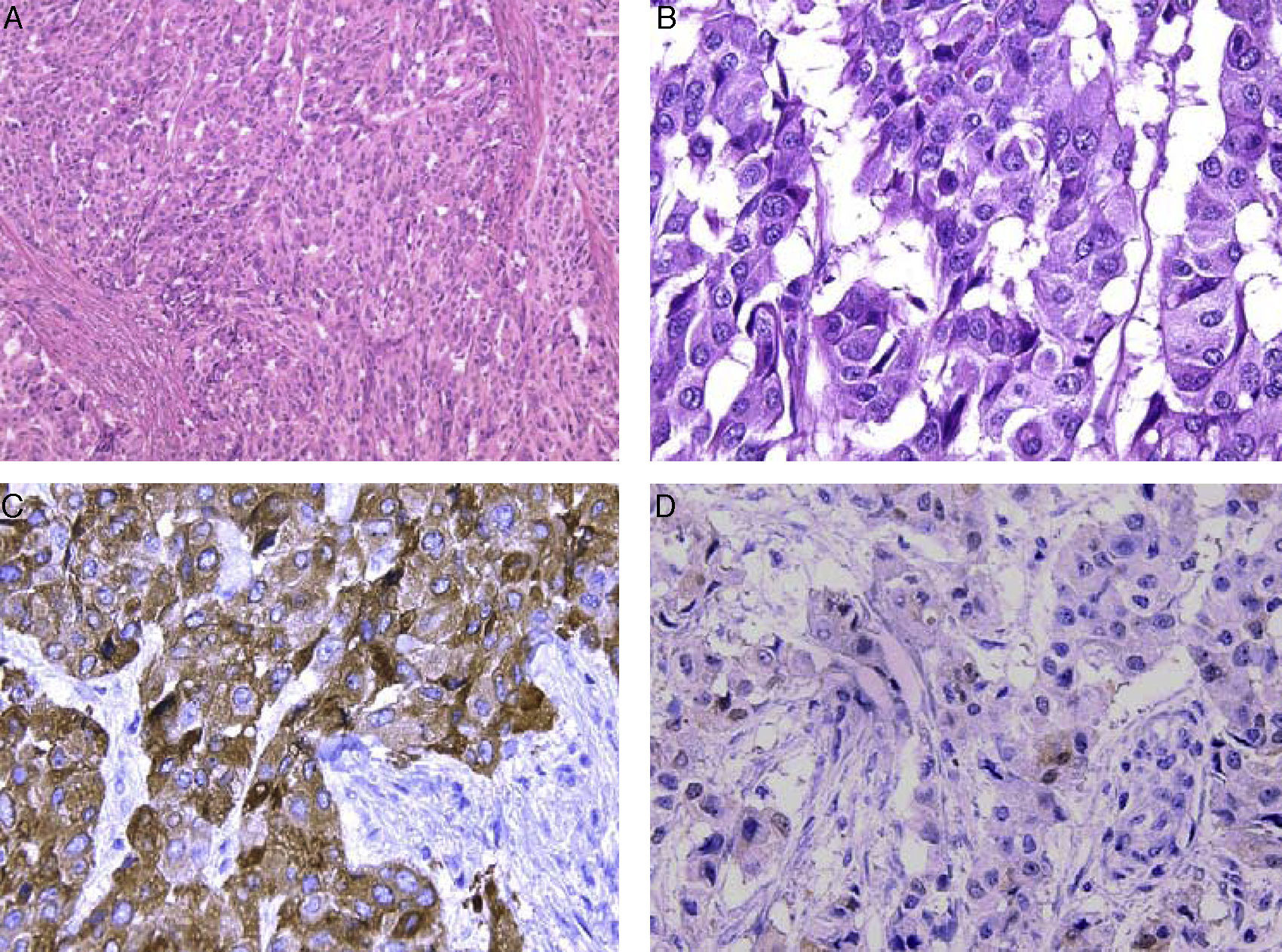
Tras concluir quimioterapia, el paciente es dado de alta. Reingresa luego de 5 meses por persistencia de ginecomastia y masa abdominal de crecimiento progresivo por lo que es referido al Instituto Nacional de Enfermedades Neoplásicas, donde se realiza control tomográfico que evidencia múltiples metástasis pulmonares, adenopatías perihepáticas e hidronefrosis derecha. Se realizó biopsia de tumor intraabdominal y se solicitaron las láminas histopatológicas realizadas en el hospital de origen. Tras nueva revisión de estas, se observa tumor testicular con bordes expansivos e infiltrativos, necrosis del 5%; intersticio, retetestis, túnica albugínea, vaginalis y grasa del hilio vascular testicular comprometidos, embolia vascular y linfática presente. Atipia celular moderada, alto índice mitótico (13 mitosis en 10 campos de alta potencia). Los análisis inmunohistoquímicos resultaron positivos para marcadores α-inhibina y de manera aislada para calretinina y S100 (fig. 1), por lo que se estableció el diagnóstico final de cáncer testicular maligno de células de Leydig. Con este diagnóstico, el paciente inició nuevo esquema de quimioterapia con carboplatino (6 AUG: 765mg día 1) y paclitaxel (80mg/m2 160mg días 1, 8 y 15). En hospitalización se evidenció dificultad respiratoria, por lo que se solicitó radiografía de tórax que reportó derrame pleural en hemitórax derecho e imágenes nodulares en ambos campos pulmonares de densidad de partes blandas, la mayor de ellas de 3cm, proyectada a región parahiliar derecha. El paciente es estabilizado y, luego de concluir esquema de quimioterapia, es dado de alta con indicaciones y próxima cita. Sin embargo decide no acudir a control, falleciendo 2 meses después.
A. Lámina histológica con tinción hematoxicilina-eosina a 10X: histología trabecular y zonas sólidas, células de distintos tamaños, citoplasma amplio, núcleos grandes, de bordes lobulares, mitosis atípicas. B. Lámina histológica con tinción hematoxicilina-eosina a 40X: núcleos binucleados con cromatina clara, dispersa y pegada a la periferia, con acúmulos irregulares de la misma; nucléolo grande, mitosis atípicas. C. Inmunohistoquímica con α-inhibina a 40X: las zonas de color pardo indican positividad, confirmando que el tejido alberga abundantes células de Leydig. D. Inmunohistoquímica con calretinina a 40X: zonas de color pardo mínimas, lo que indica positividad en una subpoblación celular tumoral.
Los cánceres testiculares se encuentran entre las neoplasias más curables con una tasa de supervivencia mayor del 95% a los 5 años de remisión5,6. Estos se clasifican en tumores de células germinales, que representan el 95% del total de tumores testiculares, y tumores de células estromales de cordones sexuales (tumor de células de Sertoli y Leydig). Los tumores de células germinales se presentan usualmente como un nódulo o inflamación dolorosa del testículo. El 5% de los pacientes muestra ginecomastia, la cual está frecuentemente relacionada con la producción de HCG-β por las células neoplásicas. La producción de esta hormona también está relacionada con hipertiroidismo como síndrome paraneoplásico. Por otro lado, el tumor de células de Leydig es uno de los menos frecuentes representando el 1-3% de todos los cánceres testiculares7. Esta neoplasia se presenta principalmente en niños entre los 6 y 10 años y en adultos entre los 26 y 35 años8. Los tumores de células de Leydig suelen tener un curso benigno y buen pronóstico con tratamiento quirúrgico. Sin embargo, el 10% cursan con un cuadro maligno, siendo estos reportados solo en adultos9. Este tumor es fuente de producción de andrógenos y estrógenos, por lo que el paciente puede cursar con virilización o feminización. A diferencia del tumor germinal, la ginecomastia se manifiesta en el 20-30% de los casos. También se reporta disfunción eréctil, disminución de la libido, impotencia e infertilidad.
Como parte del diagnóstico se requiere realizar pruebas de imágenes; sin embargo, estas no distinguen la estirpe celular del tumor, por lo que las pruebas de inmunohistoquímica son necesarias. Una de estas tinciones se realiza con α-inhibina, la cual es positiva en tumores de células germinales y en cerca del 100% en aquellos de tipo estromal10. Para confirmar que el tumor testicular sea de células de Leydig, se requiere efectuar una tinción con calretinina, la cual es frecuentemente positiva en este tipo de neoplasia. Además se requiere dosar marcadores tumorales como α-fetoproteína, lactato deshidrogenasa y HCG-β, los cuales son negativos en casos de tumores de células de Leydig11. En este caso, el paciente presentó positividad para ambas tinciones, lactato deshidrogenasa y HCG-β negativos, lo que finalmente llevó a identificar el correcto origen celular de la tumoración.
Los tumores de células de Leydig de naturaleza maligna se caracterizan por presentar un diámetro mayor de 5cm, márgenes infiltrados por el tumor, áreas de necrosis y hemorragias, invasión angiolinfática, aneuploidía del ADN en citometría de flujo, atipia nuclear, alto índice mitótico y marcadores proliferativos elevados como el Ki-67, p53 y bcl-210. Estos marcadores no son pedidos de rutina en los hospitales peruanos, por lo que no se obtuvieron del paciente. En casos de neoplasias de células germinales en estadio IIC, diagnóstico otorgado en primera instancia al paciente del caso, se recomienda 3 ciclos de bleomocina, etopósido y cisplatino. Sin embargo, este régimen es de pobre respuesta en tumores de células de Leydig12,13. En general, dependiendo del tamaño de la masa tumoral y del compromiso clínico del paciente, el tratamiento de elección para casos de tumores testiculares de células de Leydig es la orquiectomía parcial o radical con linfadenectomía retroperitoneal. Este tipo de neoplasias presentan mala respuesta a quimioterapia y radioterapia; por tal motivo, cuando el paciente presenta metástasis limitada, la metastasectomía debe ser considerada. Sin embargo, cuando la metástasis es generalizada, se indica quimioterapia y/o radioterapia paliativa14. Como seguimiento, se requiere evaluación con tomografía computarizada de tórax, abdomen y pelvis, así como dosaje de niveles de andrógenos, estrógenos y progesterona para evaluar el compromiso del eje hipotálamo-hipófisis-gónada debido al alto porcentaje de incidencia de hipogonadismo postorquiectomía15. A pesar del tratamiento brindado en los pacientes con metástasis, el pronóstico es pobre, presentando una supervivencia de 1-2 años10, lo cual explicaría la progresión de la enfermedad en este caso.
En conclusión, a pesar de que el tumor de células de Leydig es una rara entidad, debe ser considerado como parte del diagnóstico diferencial en caso de tumores testiculares, especialmente en aquellos que son de origen no seminomatoso. La inmunohistoquímica es una herramienta valiosa para la adecuada clasificación de estos tumores. Finalmente, se requieren futuros estudios, especialmente ensayos clínicos de nuevos agentes para mejorar el pronóstico de este tipo de neoplasia.
Conflicto de interesesLos autores niegan conflicto de intereses.