La infección por Helicobacter pylori (H. pylori) es muy prevalente en nuestro medio, y se asocia a enfermedad gástrica muy relevante, tanto benigna como maligna. El patrón oro para su diagnóstico sigue siendo, a día de hoy, la confirmación histológica por biopsia. Sin embargo, cada vez hay más evidencia de que el diagnóstico endoscópico óptico podría tener un papel fundamental que permitiría ahorrar biopsias innecesarias en casos determinados. Concretamente, la distribución regular de las vénulas colectoras (patrón RAC) parece tener un alto valor predictivo negativo (VPN) para descartar dicha infección. En la presente revisión se describen los hallazgos endoscópicos más destacados y con mejor potencial diagnóstico para la infección por H. pylori tras una búsqueda exhaustiva comparando los estudios más relevantes que se han llevado a cabo en Europa y Oriente.
Helicobacter pylori (H. pylori) infection is highly prevalent in our environment and is associated with highly relevant gastric disease, both benign and malignant. The gold standard for diagnosis is histological confirmation by biopsy. However, there is increasing evidence that optical endoscopic diagnosis could have a fundamental role in avoiding unnecessary biopsies in certain cases. Specifically, the regular distribution of the collecting venules (RAC pattern) seems to have a high negative predictive value (NPV) to rule out infection. This review describes the most outstanding endoscopic findings with the best diagnostic potential for H. pylori infection after an exhaustive search comparing the most relevant studies that have been carried out in Europe and the East.
La infección por Helicobacter pylori (H. pylori) es una de las más frecuentes en el mundo, afectando desde el 10% hasta más del 80% de la población según las regiones, siendo la prevalencia de alrededor del 50% en la población española1. La gastritis inducida por H. pylori se considera actualmente uno de los factores de riesgo más relevantes de la enfermedad ulcerosa gástrica y duodenal, el adenocarcinoma gástrico (CG) y sus lesiones precursoras (atrofia, metaplasia y displasia), y el linfoma del tejido linfoide asociado a la mucosa gástrica (MALT).
En pacientes sintomáticos, la gastroscopia con biopsias es la prueba de elección para el diagnóstico de la infección por H. pylori, ya que permite la caracterización del patrón mucoso gástrico y el estudio anatomopatológico la identificación de los bacilos gramnegativos resistentes al pH ácido. La gastroscopia, también nos ofrece una oportunidad para mejorar en la prevención del CG al permitir identificar las lesiones premalignas. En los últimos años se ha avanzado en el diagnóstico a tiempo real (diagnóstico óptico) de las lesiones precursoras del CG, que casi siempre están relacionadas con una infección por H. pylori subyacente. Utilizando técnicas como la cromoendoscopia o la magnificación se puede visualizar mejor el patrón de la mucosa gástrica, y esto permite la realización de biopsias dirigidas a áreas sospechosas de atrofia, metaplasia intestinal o displasia. Estas gastroscopias de alta calidad requieren de endoscopistas expertos y de un tiempo medio de exploración significativamente mayor que el resto.
El diagnóstico de la infección por H. pylori basado en los cambios en el patrón mucoso observados durante la realización de la gastroscopia supone una serie de ventajas, y ha sido objeto de numerosos estudios en países orientales. Por un lado, la identificación de signos endoscópicos que determinen la normalidad de la mucosa permitiría discriminar aquellos pacientes sin infección por H. pylori y, por lo tanto, con bajo riesgo de desarrollo de lesiones precursoras de CG. En estos pacientes se podría adaptar la técnica endoscópica in situ, no solo reduciendo el tiempo total de exploración sino también obviando la toma de biopsias con la consiguiente reducción de costes sobreañadidos. Contrariamente, en los pacientes con cambios mucosos sospechosos de infección por H. pylori, estaría justificado la utilización de técnicas de imagen avanzadas, así como la aplicación de protocolos exhaustivos de toma de fotografías y biopsias dirigidas y aleatorias.
El objetivo de esta revisión es describir los signos endoscópicos que se relacionan con la infección por H. pylori, por lo que en primer lugar es fundamental conocer cuál es el aspecto de una mucosa gástrica normal.
Aspecto endoscópico de la mucosa gástrica normalLa mucosa gástrica normal se caracteriza por la presencia de glándulas fúndicas o pilóricas, en función de la localización más proximal o distal, respectivamente, y por las vénulas colectoras gástricas2. En el cuerpo gástrico, las glándulas se disponen verticalmente y las aberturas de las criptas en el epitelio superficial son redondas y se encuentran rodeadas por el epitelio marginal y los capilares subepiteliales. La disposición vertical facilita la interpretación de la imagen endoscópica observada con la magnificación (fig. 1). En el antro, las glándulas se encuentran inclinadas por lo que los capilares subepiteliales se visualizan en el centro y el epitelio críptico marginal de forma periférica dando una imagen de cresta.
Por otro lado, las vénulas colectoras pueden observarse en la mucosa del cuerpo y fundus, adoptando una apariencia de «estrella de mar» (fig. 2). La distribución regular de las vénulas colectoras (RAC, acrónimo del inglés regular arregement of collecting venules) se ha reportado como indicador de normalidad de la mucosa.
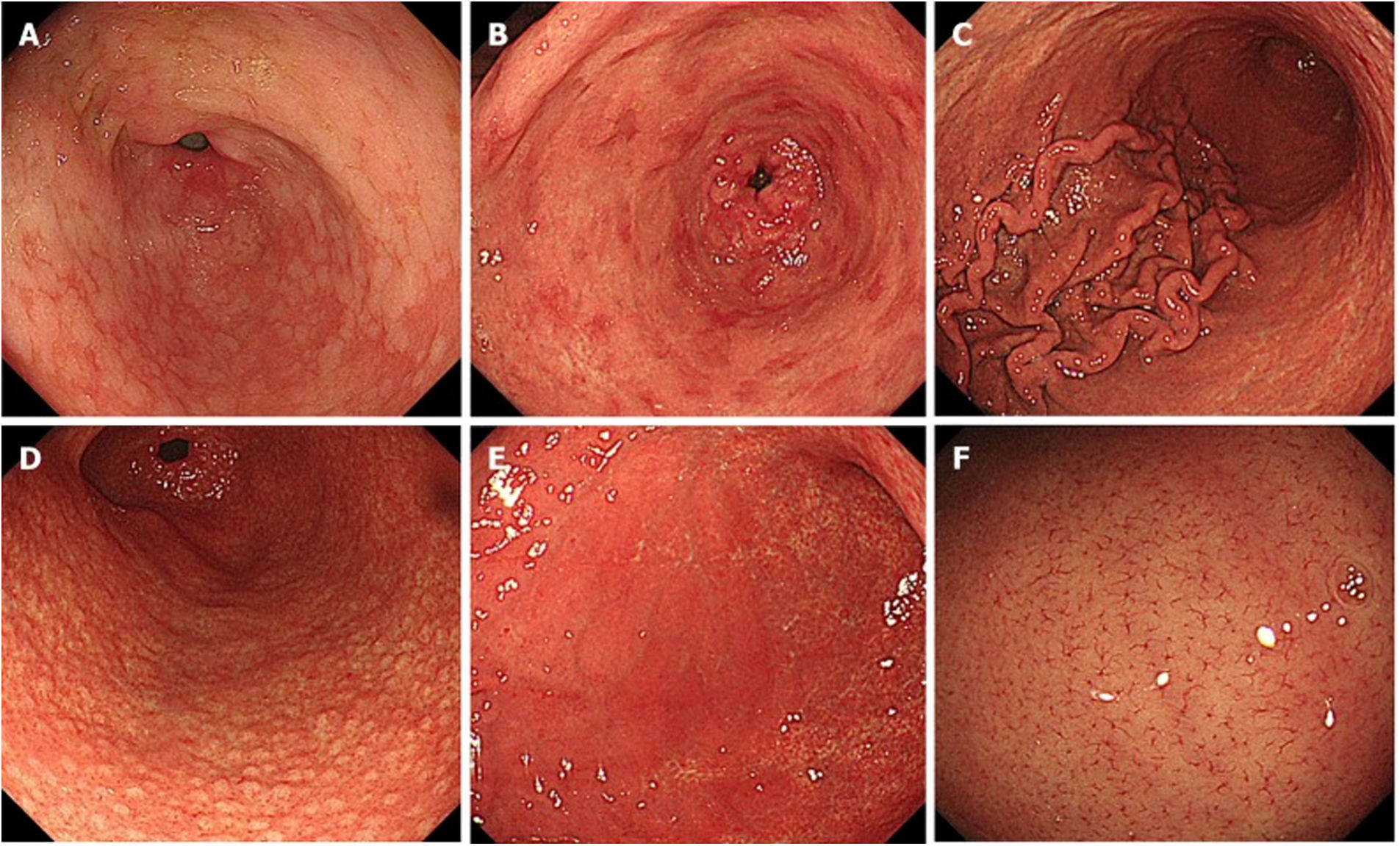
En 2013, la Sociedad Japonesa de Endoscopia Digestiva recopiló una serie de hallazgos endoscópicos de riesgo de desarrollo de CG, denominándola clasificación de Kyoto3. En esta clasificación, se incluyen 19 hallazgos relacionados con la gastritis crónica y que incluyen la atrofia, la metaplasia intestinal, los pliegues engrosados, la nodularidad, el eritema difuso, el RAC, el eritema geográfico, los pólipos hiperplásicos, los xantomas, el edema de la mucosa, el eritema parcheado, las erosiones deprimidas, el moco, la hematina, las líneas rojas, el eritema en punteado, las lesiones blancas y planas elevadas, los pólipos de glándulas fúndicas y las erosiones elevadas (fig. 3).
Hallazgos endoscópicos, clasificación de Kyoto: A) metaplasia intestinal; B) eritema parcheado; C) pliegues engrosados; D) nodularidad; E) eritema difuso; F) distribución regular de las vénulas colectoras. Permiso concedido por Toyoshima et al., 20205.
De todos los criterios de la clasificación de Kyoto, el que presentó un mayor grado de asociación con la ausencia de infección por H. pylori fue el patrón RAC. Por otro lado, el eritema difuso fue el criterio que combinó mejor sensibilidad y especificidad para la determinación de mucosa gástrica con infección por H. pylori4 (tabla 1).
Sensibilidad y especificidad de los signos endoscópicos de mucosa gástrica sin infección por H. pylori con luz blanca
| Signo endoscópico | Sensibilidad (%) | Especificidad (%) |
|---|---|---|
| RAC | 86,7-93,6 | 48-97,9 |
| Pólipos de glándulas fúndicas | 12,9-30,6 | 93,4-98,5 |
| Hematina | 12,8 | 93,8 |
| Líneas rojas | 12,6-28,9 | 90,9-97,8 |
| Erosiones elevadas | 2,8 | 99,1 |
La escala de Kyoto publicada por Toyoshima et al. en 20205 (tabla 2) selecciona los hallazgos más específicos y sensibles para determinar el riesgo de CG (atrofia, metaplasia intestinal, pliegues engrosados y nodularidad) y de infección por H. pylori (eritema difuso y RAC) y les asigna una puntuación. Una puntuación de 0 indica que no hay infección por H. pylori, una puntuación de 2 o más indica riesgo de infección por H. pylori y una puntuación de 4 o más podría indicar riesgo de CG precoz.
Escala de Kyoto
| Criterios de la clasificación de Kyoto | Escala de Kyoto |
|---|---|
| Atrofia | |
| Ausente, C1 | 0 |
| C2 y C3 | 1 |
| O1-O3 | 2 |
| Metaplasia intestinal | |
| Ausente | 0 |
| Antro | 1 |
| Cuerpo y antro | 2 |
| Pliegues engrosados | |
| Ausentes | 0 |
| Presentes | 1 |
| Nodularidad | |
| Ausente | 0 |
| Presente | 1 |
| Eritema difuso | |
| Ausente | 0 |
| Moderado (con RAC) | 1 |
| Intenso | 2 |
| Escala de Kyoto total | 0-8 |
RAC: distribución regular de las vénulas colectoras.
Se suman los puntos entre 0 y 2 obtenidos en los 5 hallazgos descritos en la gastroscopia para establecer una puntuación final.
Fuente: Toyoshima et al., 20205.
Estos resultados han sido confirmados por Yoshii et al.6. Estos autores encontraron que el RAC era el signo endoscópico que mejor se correlacionaba con la ausencia de infección por H. pylori con un odds radio (OR) de 32. En el caso de los pacientes con infección por H. pylori, el signo endoscópico más significativo fue el eritema difuso (OR=26,8). La tasa de precisión diagnóstica global de gastritis por H. pylori de la escala de Kyoto fue del 82,9%.
Distribución regular de las vénulas colectorasLa RAC fue un hallazgo de la mucosa del cuerpo gástrico determinado por primera vez en 2002 en Japón por Yagi et al.7, siendo la localización idónea para su detección a nivel de la parte inferior de la curvatura menor gástrica (fig. 4).
Hasta la fecha, la mayoría de estudios publicados han evaluado el patrón RAC en distintas combinaciones con otros criterios de la clasificación de Kyoto. Hasta 2019, solamente 4 estudios habían estudiado el papel de la RAC como hallazgo único y 3 de ellos se habían realizado en Japón con endoscopios con magnificación8–11. En todos ellos se confirmó la utilidad de la RAC para descartar la infección por H. pylori, con una eficacia del 95,5% y un valor predictivo negativo (VPN) del 99%. En 2019, Garcés-Duran et al.12 realizaron uno de los primeros estudios en una cohorte europea de 140 pacientes sin utilizar magnificación y obtuvieron un VPN de la RAC del 100% para descartar la infección por H. pylori después de realizar un entrenamiento muy sencillo. Desde entonces, varios estudios realizados en China, Brasil, Alemania y Gran Bretaña han confirmado estos hallazgos13–15. No se han observado diferencias significativas en el patrón RAC según el género. Con respecto a la edad, se han realizado estudios principalmente en la población adulta que incluyen amplios rangos de edad desde la adolescencia hasta las últimas décadas de la vida8,16. Alaboudy et al.16 observaron diferencias significativas entre mayores y menores de 60 años, siendo la sensibilidad de la RAC inferior en los primeros (80 vs. 94,7%; p=<0,001).
Al igual que en el grupo de Alaboudy et al., en nuestro grupo12 observamos una disminución de la RAC y más hallazgos endoscópicos (lesiones erosivas o signos de atrofia) en los pacientes mayores de 50 años de manera significativa. No obstante, nuestros valores de especificidad y precisión del patrón RAC fueron menores en comparación con otros estudios17, siendo estos valores especialmente bajos en los pacientes de 60 años o más. Como la prevalencia de la infección por H. pylori fue similar entre los diferentes grupos de edad, esto indicaría que la desaparición o irregularidad del patrón de vénulas colectoras podría estar asociada también con otros factores inflamatorios de la mucosa gástrica relacionados con el envejecimiento. Así pues, tal y como se ha mencionado previamente, la eficacia del diagnóstico endoscópico de H. pylori mediante el patrón de vénulas colectoras gástricas parece verse afectada por la edad del paciente16,18. Sin embargo, estas diferencias no han sido confirmadas en otros estudios14,19.
También en la población pediátrica se confirmaron excelentes resultados del patrón RAC con sensibilidades superiores al 95%20.
Papel de los inhibidores de la bomba de protones en la evaluación de la distribución regular de las vénulas colectorasEn todos los estudios publicados sobre el diagnóstico endoscópico de H. pylori por patrón RAC se utilizó la histología como «patrón oro» para el diagnóstico de H. pylori, asociado en muchos casos a otros métodos diagnósticos complementarios como el test de ureasa14,18,20, el cultivo7,21,22, la serología3,20,24, el test del aliento3,14 o incluso la IHQ16. Es bien conocido el impacto que tiene la toma de inhibidores de la bomba de protones (IBP) sobre el resultado de estas pruebas, ya que pueden producirse falsos negativos debido a la disminución de la densidad y a la migración proximal del H. pylori. Por este motivo, la mayoría de estudios excluyeron a los pacientes en tratamiento activo con IBP. Solamente 3 estos estudios incluyeron pacientes tratados con IBP. El primero de ellos fue el estudio de Nakayama et al.18, en el que no se especifica en la metodología cuál fue la aproximación diagnóstica en estos pacientes para evitar el riesgo de falsos negativos para H. pylori. El segundo fue el estudio de Alaboudy et al.16 en el que se realizó una tinción por IHQ sistemática como método diagnóstico complementario para la detección de H. pylori en los pacientes con serologías positivas para H. pylori. Sin embargo, en ninguno de ellos se analizaron las posibles diferencias del significado del patrón RAC según la toma o no de IBP. En el estudio de Garcés-Durán et al.23 se demostró que la detección del patrón RAC tiene una prevalencia similar en pacientes bajo tratamiento con IBPs y en la población general. Sin embargo, en estos pacientes el rendimiento diagnóstico de la infección por H. pylori mediante el estudio histológico es significativamente menor, por lo que la evaluación del patrón RAC podría tener un papel fundamental en su aproximación diagnóstica.
Hasta el momento, ningún estudio ha evaluado el efecto de los fármacos gastroerosivos sobre la RAC.
Reproducibilidad del patrón de la distribución regular de las vénulas colectorasTres estudios realizados en países orientales han evaluado la variabilidad intra e inter- observador del patrón RAC, obteniéndose en todos buenos resultados. En el primero de ellos15, se compararon 2 endoscopistas utilizando magnificación y se obtuvieron valores elevados de concordancia tanto intra- como interobservador (kappa 0,848 y 0,737, respectivamente). Watanabe et al.19 observaron una buena eficacia diagnóstica del patrón RAC tanto en endoscopistas principiantes como en los de mayor experiencia, con un rendimiento diagnóstico global del 88,9% para los no infectados por H. pylori. Aunque la tasa de concordancia interobservador fue inferior en los principiantes (kappa=0,46), se observó una clara mejoría en la reevaluación al cabo de 2 años de formación (kappa>0,6). Por último, Cho et al.24 en Corea, confirman la excelente reproducibilidad intra- e interobservador mediante endoscopia de alta definición (kappa=0,87 y 0,89, respectivamente).
Garcés-Durán et al.23 evaluaron la concordancia intra e interobservador en un país occidental (España). En este estudio se incluyeron 174 pacientes y 85 (48,9%) tomaban IBP. Los valores kappa para los acuerdos interobservador e intraobservador fueron sustanciales (0,786) y excelentes (0,906), respectivamente. Todos los pacientes estaban libres de infección por H. pylori, con una sensibilidad y un valor predictivo negativo del 100%, independientemente de la toma de IBP.
Por último, la aplicación de la inteligencia artificial en el diagnóstico endoscópico por H. pylori podría mejorar la concordancia interobservador además de reducir el tiempo de la exploración. Así lo demuestra un estudio realizado en Japón en el que se incluyeron 222 pacientes y se compararó la gastroscopia con luz blanca con el «blue laser imaging» (BLI) y «linked color imaging» (LCI). Se obtuvieron áreas bajo la curva en el diagnóstico de H. pylori de 0,66 para la luz blanca versus de 0,96 y 0,95 para BLI y LCI, respectivamente (p<0,01)25.
ConclusiónConsideramos que la evaluación endoscópica del patrón de distribución de las vénulas colectoras gástricas es un método fácil y reproducible para el diagnóstico in vivo de H. pylori en la práctica occidental. De esta forma, la presencia de un patrón RAC evitaría la realización de otras pruebas diagnósticas para H. pylori, además de mejorar la calidad de la gastroscopia adaptando el tiempo de la exploración, el uso de técnicas de imagen avanzadas para la búsqueda de lesiones asociadas, y el requerimiento de biopsias sistemáticas aleatorias para los casos con sospecha de infección. Son necesarios más estudios que evalúen la validez de la RAC en los pacientes en tratamiento con IBP y fármacos gastrolesivos como los antiagregantes o los antiinflamatorios no esteroideos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al programa Centres de Recerca de Catalunya (CERCA) de la Generalitat de Catalunya.









![Patrón normal de la mucosa de cuerpo gástrico con endoscopia sin magnificación (Fujifilm «blue laser imaging» [BLI]) observando las glándulas que se disponen verticalmente y las aberturas de las criptas redondeadas. Patrón normal de la mucosa de cuerpo gástrico con endoscopia sin magnificación (Fujifilm «blue laser imaging» [BLI]) observando las glándulas que se disponen verticalmente y las aberturas de las criptas redondeadas.](https://static.elsevier.es/multimedia/02105705/0000004600000006/v2_202306121247/S0210570522002266/v2_202306121247/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)




