La rectorragia es un problema de salud frecuente. Se estima que entre el 9 y el 20% de la población refiere episodios de rectorragia en el último año y ésta aparece como motivo de consulta en 6 de las 1.000 visitas realizadas al médico de atención primaria (AP)1–4.
En la mayoría de los casos, la rectorragia no es un problema de salud grave y suele estar causada por una afección anorrectal benigna y autolimitada. No obstante, la rectorragia puede ser la primera manifestación de un cáncer colorrectal2. Los médicos de AP han de enfrentarse con situaciones y/o preguntas a veces difíciles sobre el tratamiento óptimo de este problema de salud5. El manejo adecuado del paciente con rectorragia requiere una valoración inicial que contemple el equilibrio entre la necesidad de conocer la etiología de la hemorragia y la realización de pruebas diagnósticas complementarias y/o derivaciones al especialista. Algunos médicos son partidarios de realizar una evaluación completa, mientras que otros proponen inicialmente estrategias más conservadoras5.
1.2La necesidad de una guíaLa elaboración de una guía de práctica clínica (GPC) se justifica por la elevada frecuencia de la rectorragia en la población general, junto con el consumo de recursos que puede representar su abordaje inicial. Por otro lado, un mismo paciente con rectorragia puede ser diagnosticado y tratado de distinta forma (anamnesis, exploración física, pruebas complementarias, criterios de derivación al especialista de digestivo, etc.), según el centro o el médico al que haya acudido.
Todo ello puede producir distintos resultados clínicos, un consumo de recursos desigual y cierto desconcierto en los pacientes que consulten a distintos profesionales para obtener una segunda opinión.
Una GPC para el manejo de la rectorragia basada en la mejor evidencia disponible tiene la ventaja de beneficiar tanto a médicos como a pacientes. A los médicos porque les orienta en el manejo óptimo de esta afección, y también en la utilización adecuada de los recursos sanitarios disponibles; a los pacientes, porque se benefician de una atención homogénea y de calidad contrastada.
Las características de este problema de salud conllevan la necesidad de una adecuada coordinación entre niveles asistenciales, médicos de AP y médicos especialistas del aparato digestivo y cirujanos, dado que según la gravedad de la rectorragia y las enfermedades que la originan, los pacientes pueden ser tratados y seguidos en su evolución por cualquiera de los profesionales antes citados. La GPC pretende homogeneizar los criterios de actuación entre los diferentes profesionales y crear un clima fluido de comunicación y de entendimiento entre ellos. Asimismo, la GPC aborda el tratamiento de dos de las causas más frecuentes de rectorragia en AP: las hemorroides y la fisura anal.
También se realiza un proceso de selección inicial de estos pacientes, tanto en las consultas de AP como en las de atención especializada (AE). Es fundamental que las guías dirigidas a mejorar este proceso de selección sean rigurosas y de calidad, y consigan que los médicos encargados de asistir a estos pacientes diferencien de forma adecuada los casos graves de los leves. La valoración adecuada de los pacientes con rectorragia puede repercutir potencial- mente en un manejo más ágil de los pacientes con mayores probabilidades de presentar cáncer colorrectal5. Asimismo, se evitarán derivaciones innecesarias y la potencial angustia e yatrogenia en los que finalmente no lo presentan.
Una GPC sobre el manejo del paciente con rectorragia también se justifica por la ausencia de guías sobre el abordaje de este signo; hay una gran cantidad de publicaciones y materiales de desigual calidad. La elaboración y posterior actualización de esta GPC de rectorragia proporcionan el marco para presentar una síntesis de la mejor evidencia disponible y unas recomendaciones adaptadas a nuestro propio entorno.
1.3ObjetivosLa finalidad de esta GPC es generar unas recomendaciones acerca del manejo óptimo de la rectorragia en el ámbito de la AP y AE ambulatoria. La guía está dirigida a los pacientes adultos (mayores de 18 años) con rectorragia no grave (hemodinámicamente estable).
La guía no aborda otros posibles signos de hemorragia intestinal (melena, hematoquecia, diarrea sanguinolenta, sangre oculta en heces) ni el estudio de una anemia ferropénica de probable origen gastrointestinal. No obstante, sí aborda el tratamiento de las hemorroides y las fisuras anales, que son las causas más frecuentemente relacionadas con la rectorragia en la consulta de AP.
1.4Actualización de la guía de práctica clínicaPara establecer los niveles de evidencia y el grado de recomendación de las diferentes intervenciones evaluadas se ha utilizado la metodología basada en la propuesta del Centro de Medicina Basada en la Evidencia de Oxford. Su última versión se realizó en mayo de 2001 y se puede consultar en: http://www.cebm.net/levels_of_evidence.asp#levels.
En la primera versión de esta guía comentamos que nuestro grupo de trabajo se adaptaría a las nuevas clasificaciones propuestas.
Con la experiencia ya adquirida, nos parece importante introducir algunos de los criterios propuestos en el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation Working Group)6. El sistema GRADE es una novedosa propuesta para la formulación de recomendaciones, que tiene como objetivo superar las limitaciones de sistemas previos y proponer un sistema homogéneo en el ámbito internacional (http://www.gradeworkinggroup.org/). Este sistema se puede aplicar a una amplia variedad de intervenciones y contextos, y equilibra la necesidad de sencillez con la de considerar de forma global y transparente todos los aspectos importantes a la hora de formular recomendaciones. En este sentido, en esta actualización de la guía, en el momento de llevar a cabo los juicios acerca de la fuerza de las recomendaciones, se ha tenido en cuenta, además de la calidad de la evidencia, el balance entre beneficios y riesgos, la aplicabilidad y el riesgo basal de la población de interés. Asimismo, no se han formulado recomendaciones en los apartados donde no era necesario (p. ej., en la etiología), y en estos casos se describe únicamente la calidad de la evidencia disponible.
1.5Niveles de evidencia y grados de recomendaciónEn esta nueva versión de la guía se ha revisado la literatura médica publicada entre el año 2002 y diciembre de 2006. Las preguntas, siempre que ha sido posible, se han reformulado de forma explícita, siguiendo el modelo PICO (Paciente, Intervención, Comparación y Resultado [Outcome]) y se incluyen al comienzo del capítulo correspondiente. La actualización ha mantenido la estructura original de la guía y se ha profundizado en los diferentes capítulos. Asimismo, se han elaborado dos nuevos algoritmos, uno sobre el paciente con síntomas hemorroidales y otro sobre el paciente con una fisura anal.
Esta GPC será revisada en el año 2010, o antes si se produjera una nueva evidencia científica relevante. Cualquier modificación durante este período quedará reflejada en el formato electrónico disponible en las respectivas páginas web de las instituciones participantes o en las del proyecto.
2EPIDEMIOLOGÍA DE LA RECTORRAGIALas preguntas que se van a responder en el presente capítulo son las siguientes:
- –
¿Qué entendemos por rectorragia y cuál es la magnitud del problema?
- –
En pacientes adultos con rectorragia, ¿cuáles son las enfermedades asociadas de mayor prevalencia, tanto en AP como en AE?
La rectorragia es un signo que se define como la emisión de sangre roja por el ano de forma aislada o junto con las heces. La sangre emitida de forma aislada puede aparecer tanto en el papel higiénico al limpiarse como directamente en el inodoro. La sangre junto con las heces puede aparecer recubriendo la superficie de las deposiciones o mezclada con ellas.
2.2Magnitud del problemaLos diversos estudios que han estimado la magnitud de la rectorragia se han realizado con diferentes diseños (prospectivo, transversal) y metodologías (entrevista oral, cuestionario autoadministrado, etc.), poblaciones (general, de cribado, en diversos grupos de edad, consultas de AP o de ámbito hospitalario) y con una definición de rectorragia no siempre homogénea (tipos de sangrado, acompañamiento de otros signos o síntomas). Asimismo, los términos prevalencia e incidencia, referidos para un período determinado (último mes, últimos 6 meses, último año, etc.), no siempre se han utilizado de manera adecuada.
Una reciente revisión sistemática llevada a cabo dentro de una rigurosa GPC elaborada por el National Institute of Clinical Excellence (NICE) muestra que la incidencia de la rectorragia en la población general es del 9-20% durante el último año3,4. Estos datos confirman los resultados de una exhaustiva revisión previa (del 20%, en los últimos 6 meses del 7-16% y en las últimas 2 semanas del 2%)1. No obstante, la verdadera frecuencia de la rectorragia probablemente sea más elevada, ya que las personas no siempre examinan sus heces, o el papel higiénico7,8 (estudios de prevalencia de síntomas [2a]).
La incidencia de rectorragia en las consultas de AP en Europa se estima en un 4-6/1.000 anual y un 0,8/1.000 pacientes en las consultas de los médicos especialistas1,3,4. A pesar de la elevada frecuencia de la rectorragia, los diferentes estudios estiman que sólo el 13-45% de los pacientes con rectorragia consultan al médico9,10. Entre los motivos más frecuentes de no consulta destacan el pensar que el sangrado «no era nada serio», que «desaparecería con el tiempo»11, no querer sobrecargar a su médico12 o haber tenido un sangrado de características similares previamente (estudios de prevalencia de síntomas [2a]).
Los diferentes estudios coinciden en que las personas más jóvenes son las que más consultan9,8,13, posiblemente porque la rectorragia es más prevalente a esta edad. Por otro lado, la duración del sangrado no está relacionada con la probabilidad de que los pacientes acudan a la consulta de AP14,15.
2.3Etiología de la rectorragiaEn AP las causas más frecuentes de rectorragia son las hemorroides, la fisura anal y la inexistencia de causa aparente1,7,11,16 y, con menor frecuencia, la enfermedad inflamatoria intestinal (EII), la diverticulosis, los pólipos y el cáncer colorrectal. Sin embargo, la distribución de las causas de rectorragia está condicionada por la edad. En los estudios de pacientes mayores de 40 años, aunque el orden de las causas más frecuentes se mantiene, se observa un aumento de los pólipos, el cáncer colorrectal, los divertículos, la colitis isquémica y la angiodisplasia18–21 (estudios de etiología [2a]).
En los estudios realizados en las consultas de AE, la magnitud de las afecciones graves aumenta y casi se triplica para el cáncer colorrectal, los pólipos y la EII. Estos estudios, en general, reflejan una selección previa de los pacientes atendidos habitualmente en las consultas de AP11,22–24. Las principales limitaciones de los estudios localizados son los diferentes diseños y poblaciones, la propia definición de la rectorragia, el tiempo de seguimiento, las pruebas complementarias realizadas y la ausencia de estándares de referencia7,11,16–20,22–25.
Resumen de la evidencia sobre la epidemiología de la rectorragia- –
La incidencia de rectorragia en las consultas de AP en Europa se estima en un 4-6/1.000 anual y el 0,8/1.000 pacientes en las consultas de AE (estudios de prevalencia de síntomas [2a]).
- –
Las causas más frecuentes de rectorragia en la consuta de AP son las hemorroides o la fisura anal (estudios de etiología [2a]).
- –
Las causas de rectorragia en las personas mayores de 40 años son el aumento de los pólipos y los divertículos y el cáncer colorrectal, pero las causas más frecuentes de rectorragia en la consulta de AP continúan siendo las hemorroides y la fisura anal (estudios de etiología [2a]).
- –
Las causas más frecuentes de rectorragia en la consulta de AE son los pólipos, el cáncer colorrectal y la enfermedad inflamatoria intestinal (estudios de etiología [2a]).
Las preguntas que se van a responder en el presente capítulo son las siguientes:
- –
¿Qué actitud inicial se debe tomar ante un paciente con rectorragia con o sin repercusión hemodinámica?
- –
¿Cuál es el valor diagnóstico de la rectorragia y de los síntomas y/o signos asociados para el diagnóstico de cáncer colorrectal?
- –
¿Qué actitud se debe tomar ante una rectorragia en función de la comorbilidad, la edad o la historia personal y familiar?
La dificultad para diagnosticar una enfermedad relacionada con la rectorragia viene determinada fundamentalmente por la falta de una información clínica objetiva sobre esta enfermedad. Entre las razones para ello destacan el amplio abanico de diagnósticos diferenciales, las distintas intensidades de sangrado, las causas de sangrado difíciles de identificar y la ausencia de un patrón de referencia para el estudio diagnóstico de la rectorragia. A continuación se describen los factores que determinan el proceso diagnóstico de la rectorragia.
Las estrategias diagnósticas que los integran están incluidas en el capítulo 5 (estrategias diagnósticas y terapéuticas).
3.1Valoración de la gravedadLa descripción de la cantidad de sangrado observada por parte del paciente no es un buen indicador de la gravedad de la rectorragia. En un sentido amplio, y a efectos prácticos, para valorar la gravedad de la rectorragia hemos de evaluar la posible repercusión hemodinámica (estudios de diagnóstico [1b]).
La palidez cutaneomucosa, en ausencia de repercusión hemodinámica, nos puede orientar acerca de la cronicidad y/o larga evolución del sangrado26,27, aunque su papel es limitado28 [estudios de pronóstico [2b]).
Una regla de predicción clínica para valorar la gravedad del sangrado rectal agudo ha sido elaborada y validada recientemente29,30. Esta regla mostró 7 factores de riesgo independientes significativos: frecuencia cardíaca (FC) mayor o superior a 100 lat/min, presión arterial sistólica (PAS) ≤ 115 mmHg, síncope, rectorragia durante las primeras 4 h de evaluación, exploración abdominal no dolorosa, ingesta de ácido acetilsalicílico, más de 2 comorbilidades (índice de Charlson). Esta regla, elaborada en un medio hospitalario, es necesario que sea validada en AP para conocer su verdadero alcance y utilidad31 (estudios de diagnóstico [2a]).
En la valoración clínica inicial de la repercusión hemodinámica se han de tener en cuenta la sintomatología observada, la PAS y la FC:
- –
Cuando hay palidez cutánea, sudoración y frialdad de manos y pies, una FC de 100-120 lat/min y una PAS de 100-120 mmHg, se estima una pérdida de volumen de sangre del 10-20%, lo que indica una gravedad moderada. Esta gravedad plantea la necesidad de una valoración temprana del paciente en un servicio de urgencias hospitalario.
- –
Cuando además el paciente presenta una gran sed, oliguria y mareo, un aumento de la FC superior a 120 lat/min y una disminución de la PAS por debajo de 100 mmHg, se estima una pérdida de volumen de sangre superior al 20%, lo que indica una mayor gravedad. Esta gravedad plantea la necesidad de una valoración inmediata del paciente en un servicio de urgencias hospitalario.
Si se detecta una repercusión hemodinámica, se debe iniciar una restauración del volumen intravascular que permita estabilizar al paciente y realizar un correcto traslado a un centro de urgencias hospitalario. En caso de no encontrarse una repercusión hemodinámica, el paciente con rectorragia puede ser valorado en AP evaluando el resto de factores que intervienen en el proceso diagnóstico de la rectorragia.
3.2Valor diagnóstico de la rectorragia y de los síntomas y/o signos asociadosLa elevada incidencia en la población general de la rectorragia y de los síntomas relacionados (p. ej., cambios de ritmo intestinal o dolor abdominal), respecto a la incidencia del cáncer colorrectal, implica que la mayoría de los pacientes con estos síntomas presenta un riesgo muy bajo de cáncer.
El valor predictivo positivo (VPP) de la rectorragia depende de la prevalencia del cáncer colorrectal. La prevalencia está relacionada con la edad, la población de interés y otros factores de riesgo2,32 (apartado 3.3). Los estudios que han estimado el valor diagnóstico33 de la rectorragia lo han hecho para tumores malignos y/o para adenomas de recto y colon. Habitualmente los estudios han utilizado el VPP y negativo (VPN) como índices de rendimiento diagnóstico. Su aplicación en poblaciones diferentes a las originales es problemática, ya que la preva- lencia de la enfermedad puede ser muy diferente a la de nuestra población34. Sin embargo, para valorar el rendimiento diagnóstico de una prueba, los coeficientes de probabilidad (CP+ y CP—) permiten transformar la probabilidad preprueba de cáncer colorrectal de un paciente con rectorragia en probabilidad posprueba (estudios de diagnóstico [2a]).
Estos índices son más útiles, pues no dependen de la prevalencia de la enfermedad.
El VPP de la rectorragia para los adenomas de recto y colon se estima que oscila entre el 3-8% en la población general, el 7-12% en las consultas de AP y el 8-32% en las consultas de AE11,18. En las consultas de AP, el VPP de la rectorragia para el cáncer colorrectal se estima que oscila entre el 2 y el 15,4%, en las consultas de AE llega a ser de hasta el 40%, y es inferior al 1% en el caso de la población general2,4–5,35–40. Los datos de nuestro entorno muestran cifras similares22,24 (estudios de diagnóstico [2a]).
La presencia de otros signos y síntomas asociados a la rectorragia modifican el valor diagnóstico de ésta2,40. Diversos estudios coinciden en que, al margen de la pérdida de peso, fatiga, astenia y/o palpación de una tumoración rectal, la sospecha diagnóstica de cáncer colorrectal aumenta con la edad, el cambio del ritmo de las deposiciones (heces blandas y mayor número de deposiciones) y la presencia de sangre mezclada con las heces (frente a sangre cubriendo las heces)2,3,39. El color oscuro de la sangre y la presencia de moco mezclado con sangre en las heces también está asociada a una mayor probabilidad de presentar cáncer21,25,38. Por el contrario, otros estudios han observado que los pacientes con una rectorragia relacionada con síntomas perianales presentan una probabilidad muy baja de neoplasia, en particular cuando no se asocia a un cambio en el ritmo deposicional, y menor aún si además se ha excluido una masa rectal10,25,38,41,42 (tabla I) (estudios de diagnóstico [2a]).
Síntomas/signos con un elevado valor diagnóstico de cáncer colorrectal
| Rectorragia con cambios del ritmo deposicional (frecuencia aumentada y/o menor consistencia) |
| Rectorragia sin síntomas anales (picor, escozor o dolor) |
| Sangre oscura y/o mezclada con las heces |
| Anemia |
| Masa abdominal o rectal palpable |
| Oclusión intestinal |
Un nuevo análisis de 2 estudios realizados en AP17,39 revela que los síntomas asociados de manera más consistente con el cáncer colorrectal fueron la rectorragia acompañada de un aumento de la frecuencia y/o una menor consistencia de las heces (CP+ de 3; intervalo de confianza [IC] del 95%, 2,6-3,6) y de rectorragia en ausencia de síntomas perianales (CP+ de 2,9; IC del 95%, 1,6-4,3)43. Estudios posteriores han confirmado estos resultados42. Estos CP+ indican que en un paciente que presenta estos síntomas, la probabilidad de tener un cáncer aumenta relativamente poco con respecto a un paciente que no los presenta (estudios de diagnóstico [2a]).
Por otro lado, se han desarrollado cuestionarios que evalúan el riesgo de presentar un cáncer colorrectal a partir de los síntomas y signos, incluida la rectorragia21. Estos cuestionarios, a pesar de presentar una adecuada predicción de esta neoplasia, no han sido validados en nuestro medio y hasta el momento únicamente se conoce su rendimiento para los pacientes valorados en AE (estudios de diagnóstico [1b]).
Recientemente se comienzan a conocer los datos sobre la relación entre los síntomas/signos de presentación y el estadio de cáncer colorrectal. Los primeros resultados apuntan a que el riesgo relativo de presentar un cáncer colorrectal en un estadio avanzado es menor en los pacientes en los que la presentación inicial es en forma de rectorragia, ya sea aislada44,45 o asociada a otros signos o síntomas44. Tampoco se ha observado relación entre la duración de los síntomas y el estadio o la mortalidad45 (estudios de pronóstico [1b]).
3.3Comorbilidad, edad e historia personal y familiarUna vez descartada la urgencia inicial de la rectorragia, hay algunos aspectos clave que se deben valorar en el proceso diagnóstico de la rectorragia, como la comorbilidad, la edad y la historia personal y familiar de cáncer colorrectal, que pueden orientarnos y hacernos sospechar inicialmente una enfermedad grave.
ComorbilidadLos pacientes con rectorragia y comorbilidad asociada (alteraciones de la coagulación, cirrosis hepática, insuficiencia renal, polimedicación o fármacos de riesgo, como los anticoagulantes y los antiinflamatorios no esteroideos [AINE]) requieren una evaluación individualizada según su enfermedad de base. Esta valoración clínica, junto con las preferencias de los pacientes, nos ha de permitir valorar las diferentes alternativas de forma individual. Las intervenciones a realizar, tanto diagnósticas como terapéuticas, dependerán de la gravedad de la enfermedad de base y de las posibilidades de su resolución en el ámbito de la AP.
EdadComo hemos descrito anteriormente, la edad es un factor que modifica de manera significativa el valor diagnóstico de la rectorragia para el diagnóstico de cáncer colorrectal. El VPP aumenta con la edad, con cifras de un 2% en el grupo de edad de 40-59 años y del 21% en el de 70-79 años17,18,35,37,38.
En el caso del paciente con rectorragia, el punto de corte para considerar la edad como un factor de riesgo de cáncer de colon varía según las instituciones. Por ejemplo, el National Health and Medical Research Council (NHMRC) de Australia propone los 40 años de edad46. El National Health Service (NHS) propone los 40 años en caso de que el sangrado se asocie a un cambio de ritmo intestinal (heces más sueltas y/o más frecuentes) y que persista durante al menos 6 semanas, y los 60 años en el caso de un sangrado que persista al menos 6 semanas sin cambio de ritmo intestinal y sin síntomas anales. La GPC del Scottish Intercollegiate Guidelines Network (SIGN)47, actualizada en 2003, ha modificado el punto de corte, y ha pasado de los 45 a los 50 años.
Diversos estudios de coste-efectividad muestran resultados no concluyentes sobre la estrategia de elección en los pacientes con rectorragia aislada y proponen en pacientes menores de 40 años estrategias alternativas a la colonoscopia, explorando de manera parcial el colon48,49 (estudios de análisis económico [1b]).
El grupo de trabajo de esta guía ha consensuado los 50 años como punto de corte para considerar la edad como un factor de riesgo que se debe tener en cuenta en el manejo del paciente con rectorragia. Este punto de corte está justificado por el bajo riesgo de cáncer colorrectal antes de los 50 años en nuestro medio50 (véase capítulo 5. «Estrategias diagnósticas y terapéuticas»).
Historia personal y familiarLa historia personal, la historia familiar y la herencia han sido identificadas como factores de riesgo en el desarrollo del cáncer colorrectal51 (tabla II) (estudios de historia natural [1a]).
Factores de riesgo de cáncer colorrectal
| Historia familiar de cáncer colorrectal o pólipos en un familiar de primer grado (padres, hermanos e hijos) menor de 60 años o en 2 familiares de primer grado de cualquier edad |
| Historia familiar de síndromes de cáncer colorrectal hereditario (poliposis adenomatosa familiar y cáncer colorrectal hereditario no polipoide) |
| Historia personal de cáncer colorrectal |
| Historia personal de pólipos adenomatosos |
| Historia personal de enfermedad intestinal inflamatoria crónica |
Respecto al riesgo de cáncer colorrectal en individuos con familiares afectados de cáncer colorrectal, la edad de diagnóstico del cáncer, el número de familiares afectados y el grado de parentesco son las principales variables asociadas al riesgo de esta neoplasia en los diferentes estudios50. Globalmente, las diferentes revisiones sistemáticas sobre esta cuestión confirman el aumento de riesgo con respecto a la población general en los individuos con uno (2-3 veces más) o más familiares de primer grado con esta neoplasia (dos familiares, 4 veces más)52–54. Otra forma de expresarlo es que el riesgo de cáncer colorrectal a la edad de 40 años en un individuo con un familiar de primer grado afectado es aproximadamente el mismo que el de la población general a la edad de 50 años55 (estudios de historia natural [1a]).
La presencia de familiares de segundo (abuelos, tíos y sobrinos) o tercer grado (bisabuelos y primos) con cáncer colorrectal también se ha visto asociada a un incremento discreto del riesgo de esta neoplasia56. Este bajo riesgo no justifica exploraciones de cribado en la familia, en ausencia de otras características que sugieran la existencia de cáncer colorrectal hereditario. Un sistema de evaluación de riesgo ha sido recientemente publicado, pero no ha sido todavía validado en nuestro medio57 (estudios de historia natural y pronóstico [2b-4]).
No se localizaron datos que muestren un patrón específico de síntomas para pacientes con historia personal y familiar de cáncer colorrectal. Un estudio retrospectivo llevado a cabo para mejorar el diagnóstico de la poliposis adenomatosa familiar no observó síntomas específicos de presentación58 (estudios de diagnóstico [2b]).
Resumen de la evidencia sobre el proceso diagnóstico de la rectorragia- –
En un paciente con rectorragia la sospecha diagnóstica de cáncer colorrectal aumenta con la edad, el cambio del ritmo deposicional (un aumento de la frecuencia y/o una menor consistencia), la presencia de sangre oscura mezclada con las heces, la ausencia de síntomas anales (quemazón, picor y/o dolor) y la anemia (estudios de diagnóstico 2a).
- –
En un paciente con rectorragia la sospecha diagnóstica de cáncer colorrectal auemnta cuando se asocian dos omás signos o síntomas relacionados (sangre mezclada con las heces, cambio de ritmo deposicional, etc.) (estudios de diagnóstico 2a).
- –
El valor predictivo de la rectorragia para los adenomas de recto y colon y para el cáncer colorrectal aumenta significativamente en la consulta de AE respecto a la de AP (estudios de diagnóstico 2a).
- –
En pacientes de cualquier edad, la historia personal o familiar de pólipos y enfermedades relacionadas es un factor de riesgo para desarrollar cáncer colorrectal (estudios de historia natural 1a).
A) Se recomienda derivar al paciente a un servicio de urgencias, previa estabilizaicón inical en AP, cuando presente palidez de piel, sudoración y frialdad de manos y pies, oliguria y mareo, una FC > 120 lat/min o una PAS < 100 mmHg, ya que ello refleja una pérdida de volumen sangíneo superior al 10%. (Grado de recomendación A.)
- –
La recotragia en pacientes con comorbilidad asociada requiere una valoración individualizada. Las intervenciones que han de realizarse, tanto diagnósticas como terapéuticas, dependerán de la gravedad de la enfermedad de base y de las posibilidades de su resolución en el ámbito de AP.
A) En los pacientes mayores de 50 años que consultan por rectorragia con una alta sospecha clínica de cáncer colorrectal se recomienda realizar una exploración completa del colon. (Grado de recomendación A.)
A) En los pacientes que consultan por rectorragia con historia familiar o personal de cáncer colorrectal, con independencia de la edad, se recomienda realizar una exploración completa del colon. (Grado de recomendación A.)
3.4Exploración física y analíticaExploración generalEs necesario llevar a cabo una exploración física en los pacientes con rectorragia para valorar su repercusión y descartar anomalías en el abdomen. Esta exploración se puede realizar aprovechando que el paciente está en la camilla y previamente a la exploración anal y el tacto rectal. La exploración física debe incluir las siguientes medidas:
- –
Inspección general. Inspeccionar la apariencia cutaneomucosa, haciendo especial hincapié en la mucosa conjuntival para valorar la posible presencia de anemia. La presencia de palidez cutaneomucosa es útil para predecir la presencia de valores de hemoglobina inferiores a 11 g/dl27,28 (estudios de diagnóstico [2b]).
- –
Inspección abdominal. Buscar signos de hepatopatía (telangiectasias, circulación colateral, etc.), asimetrías, cicatrices de intervenciones previas, etc (estudios de diagnóstico [2b]).
- –
Palpación abdominal. Buscar masas abdominales, presencia de hepatosplenomegalia y posibles signos de peritonismo o ascitis (estudios de diagnóstico [2b]).
La observación de palidez cutaneomucosa acompañada de otras manifestaciones (véase apartado 3.1. Valoración de la gravedad), se ha de tener en cuenta al derivar al paciente de forma urgente. La presencia de alteraciones en la exploración física y la presencia de otros síntomas y/o signos asociados, como astenia importante o pérdida de peso, nos pueden orientar hacia una sospecha diagnóstica más concreta.
Exploración anorrectalTodo paciente con rectorragia, una vez descartada la gravedad de ésta y la sospecha de una enfermedad grave y con independencia de la edad, debe ser evaluado mediante una cuidadosa inspección anal y un tacto rectal. Esta técnica puede orientarnos en la mayoría de los casos en la toma de decisiones del proceso diagnóstico.
Antes de llevar a cabo la inspección anal y el tacto rectal, se debe informar al paciente de la necesidad de su realización, explicándole los pasos que se siguen durante este procedimiento y adaptándose, en la medida de lo posible, a su lenguaje y nivel de comprensión.
La inspección anal permite valorar la existencia de lesiones perianales, fístulas, abscesos, fisuras, hemorroides externas y/o procesos prolapsantes a través del canal anal (hemorroides internas prolapsadas, pólipos pediculados del margen anal interno o papilas hipertróficas prolapsadas). Además, con el tacto rectal se puede valorar la presencia de masas en el recto59.
AnalíticaLa utilidad principal de un estudio analítico es confirmar y cuantificar la presencia de anemia, así como descartar o confirmar la presencia de comorbilidad asociada. Diversos estudios han mostrado que la probabilidad de cáncer colorrectal aumenta cuando la rectorragia se acompaña de anemia2,3,40 (estudios de diagnóstico [2a]).
Siempre será necesario valorar la situación clínica del paciente y la posibilidad de un acceso rápido a la analítica y a sus resultados en caso de que sea necesario (como máximo 24-72 h). En caso de no disponer de acceso rápido a esta prueba y si el contexto del paciente lo hace necesario, se debe derivar directamente a un servicio de urgencias hospitalarias. El valor de la hemoglobina, si tenemos acceso a ella de manera inmediata, puede no ser un buen indicador inicial de la cuantía del sangrado, ya que puede ser normal en las fases iniciales de la hemorragia aguda, debido al retraso con que se establece la hemodilución compensadora.
Resumen de la evidencia sobre la exploración física y la analítica- –
La presencia de palidez cutaneomucosa es útil para predecir la presencia de valores de hemoglobina inferiores a 11 g/dl (estudios de diagnóstico 2b).
- –
En un paciente con rectorragia la sospecha diagnóstica para cáncer colorrectal aumenta con la presencia de anemia (estudios de diagnóstico 2a).
B) Se recomienda valorar la existencia de palidez cutaneomucosa en la evalación del paciente con rectorragia. (Grado de recomendación B.)
- –
Una vez descartada la gravedad de la rectorragia, con independencia de la edad, se debe realizar una exploración del abdomen, la región anal y un tacto rectal.
- –
En la inspección anal se ha de valorar la existencia de lesiones perianales, fístulas, fisura, abscesos, hemorroides externas y/o procesos prolapsantes. En el tacto rectal, así como en la palpación abdominal, se debe valorar la presencia de masas.
B) Se recomienda llevar a cabo un estudio analítico en el paciente que presenta palidez de la mucosa conjuntival sin repercusión hemodinámica para confirmar y cuantificar la presencia de anemia. (Grado de recomendación B.)
4TÉCNICAS Y/O PRUEBAS DIAGNÓSTICASLa pregunta que se va a responder en el presente capítulo es la siguiente:
- –
En los pacientes con rectorragia, ¿cuál es el rendimiento diagnóstico de las técnicas y/o pruebas diagnósticas?
El rendimiento diagnóstico de las diferentes pruebas para explorar el canal anal, el recto y el colon depende de qué área se quiera visualizar y con qué finalidad: confirmar una enfermedad benigna, realizar el seguimiento de los pacientes con riesgo elevado de cáncer colorrectal, diagnosticar una sospecha o llevar a cabo un cribado de cáncer colorrectal. La mayoría de los estudios evalúan la validez de estas pruebas en referencia al cribado y el diagnóstico del cáncer colorrectal o de sus lesiones precursoras.
4.1.1AnuscopiaLa anuscopia explora fundamentalmente el canal anal, mediante un tubo rígido de 7 cm de longitud. Es una técnica sencilla, no ocasiona grandes molestias al paciente y no requiere sedación. Se puede realizar sin preparación previa, aunque si ésta se lleva a cabo, mejora la visualización y facilita la aceptación de la prueba, tanto por parte del paciente como del explorador60,61.
En algunos países, como Dinamarca62, Australia63 y Estados Unidos61, la anuscopia se realiza en la consulta de AP. La realización de la anuscopia por parte de los médicos de familia ha mostrado resultados satisfactorios, y puede restar la derivación al especialista de afecciones banales (hemorroides internas, fisuras, etc.)64. La anuscopia es una técnica sencilla de aprender y su realización requiere poco tiempo65,66. En nuestro medio la anuscopia se realiza en las consultas de AE (cirugía o gastroenterología) (estudios de diagnóstico [3b]).
4.1.2Sigmoidoscopia rígida (rectosigmoidoscopia rígida)La sigmoidoscopia rígida explora, además del canal anal y el recto, el colon sigmoide inferior, lo que representa una visualización de los 25 cm más distales. Esta técnica ha sido ampliamente desplazada desde la introducción de la sigmoidoscopia flexible, aunque en algunas ocasiones todavía se sigue utilizando como alternativa a la anuscopia (rectoscopio corto) en las consultas de AE67,68.
4.1.3Sigmoidoscopia flexible (rectosigmoidoscopia flexible)La sigmoidoscopia flexible se realiza con un fibroscopio o un videoendoscopio diseñados para examinar la superfi cie de la mucosa rectal y el colon sigmoide. Esta técnica proporciona una adecuada visualización de la mucosa y permite examinar hasta los 60 cm distales del colon. Esta exploración se realiza idealmente con la preparación previa del paciente con un enema o laxante69. No suele requerir sedación de manera sistemática, aunque un 10- 15% de los pacientes experimenta cierta incomodidad.
La sigmoidoscopia flexible es una prueba que no se lleva a cabo en nuestro entorno. Esta técnica, realizada por personal entrenado y con experiencia, incluido el personal de enfermería o los médicos no gastroenterólogos70,71, es segura y altamente sensible y específica para las lesiones situadas al alcance del sigmoidoscopio72. La sigmoidoscopia, en comparación con la colonoscopia, es una prueba más segura, aunque no exenta de riesgo71. Las perforaciones son muy infrecuentes, del orden de 1/25.000-50.000 sigmoidoscopias, y el sangrado pospolipectomía es menor del 1%73. No obstante, la realización de la sigmoidoscopia es un procedimiento complejo y requiere un entrenamiento y una experiencia adecuada para asegurar su calidad y su seguridad71 (estudios de complicaciones [2b]).
La sigmoidoscopia flexible, comparada con la rígida, es superior en la detección de adenomas y cáncer en el canal anorrectal74. Asimismo, la sigmoidoscopia rígida es peor tolerada por los pacientes y presenta, comparada con la sigmoidoscopia flexible, mayores molestias y ansiedad para los pacientes69 (estudios de diagnóstico [3b] y de complicaciones [2a]).
En pacientes asintomáticos la sigmoidoscopia se considera negativa cuando se detectan pólipos cuyo diagnóstico histológico es de hiperplasia o mucosa normal, ya que éstos no son premalignos y no requieren continuar el estudio75. Se considera positiva cuando se detecta un cáncer o un pólipo de diámetro superior a 1 cm, situación que requiere un estudio completo del colon dada la mayor incidencia de lesiones sincrónicas proximales al trayecto explorado71,72. Hay controversia sobre la necesidad de explorar todo el colon cuando se detectan adenomas tubulares de 1 cm, y sin alto grado de displasia72,73. Esto se debe a que el riesgo de presentar un adenoma avanzado o un cáncer en estos pacientes puede no ser superior al de la población general, aunque puede ser lo suficientemente alto como para llevar a cabo una colonoscopia en función de los valores y preferencias de los pacientes, su comorbilidad y los recursos disponibles71.
La sigmoidoscopia flexible, al no llegar a explorar completamente el colon proximal, deja de identificar más del 50% de las neoplasias32,77,78. Diversos estudios han mostrado que la prevalencia de adenomas avanzados proximales en pacientes sin adenomas distales se encuentra en el rango del 0,9-5%72,79 (estudios de diagnóstico [1b]).
4.1.4ColonoscopiaLa colonoscopia se realiza con un fibroscopio o una videoendoscopia, diseñados para examinar la totalidad de la superficie de la mucosa del colon. Para considerarse completa debe llegar al ciego y visualizarse la válvula ileocecal72,80. La colonoscopia requiere la preparación previa del colon. Puede realizarse con sedación profunda (con soporte del anestesista) o con sedación superficial, lo que permite al paciente colaborar durante el procedimiento72,80, aunque en algunos centros se realiza con anestesia general.
Al igual que la sigmoidoscopia flexible, la colonoscopia debe ser realizada por médicos entrenados y con experiencia70. Se estima que las complicaciones graves ocurren en 5 de cada 1.000 colonoscopias llevadas a cabo en la comunidad73. Las complicaciones son menos frecuentes en las colonoscopias sin biopsia o sin extirpación de un pólipo (menos de una complicación por cada 1.000 colonoscopias). La perforación y el sangrado son las complicaciones menos y más frecuentes, respectivamente (0,9 y 4,8 cada 1.000 colonoscopias)73 (estudios de complicaciones [2b]).
No se han encontrado ensayos clínicos aleatorizados (ECA) que comparen el rendimiento diagnóstico de la colonoscopia frente a otras pruebas. Los estudios disponibles que comparan el rendimiento diagnóstico para las enfermedades graves de las diferentes pruebas entre sí, tanto para pacientes con rectorragia49,80,81, programas de cribado de cáncer colorrectal72,78 o el seguimiento de pacientes polipectomizados76,83, concluyen que la colonoscopia es superior a la sigmoidoscopia y al enema opaco84. Los estudios de pacientes ambulatorios19,81,85,86 también muestran que el rendimiento diagnóstico de la colonoscopia, cuando se compara con la combinación de sigmoidoscopia más enema opaco de doble contraste, es superior (estudios de diagnóstico [1b]).
4.1.5Radiología con contraste (enema opaco y de doble contraste)El enema opaco es una exploración radiológica que se realiza mediante la introducción de un contraste por vía rectal a través de una sonda que permite visualizar el intestino grueso. Hay 2 variantes habituales, el procedimiento sencillo y el de doble contraste, y es necesaria para ambas la preparación previa del colon. El enema de doble contraste no se realiza en la mayor parte de los centros de nuestro país.
A pesar de la amplia utilización del enema opaco sencillo en AP, actualmente no se considera un método diagnóstico de elección para las afecciones colorrectales en caso de rectorragia19,80,81, en el seguimiento de los pacientes tras una polipectomía76 ni en el cribado del cáncer colorrectal72, ya que presenta un rendimiento sustancialmente menor que la colonoscopia y que la sigmoidoscopia. Esta menor sensibilidad se debe principalmente a su menor capacidad para detectar pólipos80, incluso cuando se combina con la realización de una sigmoidoscopia asociada frente a la colonoscopia81,86. La radiología con contraste puede detectar lesiones neoplásicas en los casos en que no ha sido posible completar la colonoscopia87 (estudios de diagnóstico [1b]).
El enema opaco presenta un mayor número de artefactos y otros hallazgos, como las heces, que a menudo se confunden con pólipos. Esta prueba tampoco permite la toma de biopsias o la resección de pólipos y los pacientes con un resultado anormal requieren la realización de una colonoscopia. En relación con los efectos adversos, las perforaciones rectales son muy infrecuentes (0,02-0,23%) aunque la mortalidad en estos casos es muy elevada88.
4.1.6Otros métodos diagnósticos4.1.6.1Radiografía simple de abdomenLa radiografía de abdomen no se considera un método diagnóstico inicial en el estudio de un paciente con rectorragia. Únicamente tiene utilidad si de manera asociada el paciente presenta signos o síntomas de obstrucción intestinal, o si se sospecha una isquemia intestinal.
4.1.6.2Colonoscopia virtual con tomografía computarizada o con resonancia magnéticaEsta nueva prueba diagnóstica radiológica se realiza generalmente a partir de una tomografía computarizada (TC, convencional o helicoidal) que obtiene imágenes en 2 o 3 dimensiones de todo el colon y el recto89. Esta técnica tiene la ventaja de ser menos invasiva que la colonoscopia, y los ancianos, los pacientes frágiles y los inmovilizados la toleran mejor que el enema opaco90. No obstante, es necesaria la limpieza del intestino grueso antes de la exploración; durante ésta es necesaria la adecuada distensión del colon y, algunas veces, la administración de contraste por vía intravenosa. Además, no permite la visualización directa de la lesión ni la realización de biopsias. Los pólipos planos son descritos frecuentemente como falsos negativos, y exponen al paciente a una dosis de radiación ionizante89. Asimismo, en nuestro entorno el acceso a esta tecnología es todavía muy limitado.
La mayoría de los estudios incluidos en las revisiones sistemáticas localizadas incluyen pacientes con un riesgo de cáncer colorrectal elevado. Tres revisiones sistemáticas mostraron que la especificidad de esta prueba fue alta, independientemente del tamaño del pólipo (alrededor del 90%), pero la sensibilidad fue variable, ya que aumenta con el tamaño del pólipo (pólipos de tamaño > 9 mm, 85-93%; pólipos < 6 mm, 48-86%)91–93 (estudios de diagnóstico [2a]).
Se localizó una revisión sistemática94 (8 ECA, 563 pacientes) que comparó el rendimiento diagnóstico de la colonoscopia virtual con resonancia magnética (RM) frente a la colonoscopia convencional en pacientes con síntomas indicativos de cáncer colorrectal y pólipos benignos. La sensibilidad global fue del 75% (IC del 95%, 47-91) y la especificidad del 96% (IC del 95%, 86-98) (estudios de diagnóstico [2a]).
4.1.6.3Otras técnicasAlgunas pruebas, como la angiografía o la enteroscopia, están reservadas principalmente para los pacientes ingre- sados en el hospital que presentan hemorragia digestiva baja con repercusión hemodinámica o de etiología no aclarada. La cápsula endoscópica en la actualidad no es útil para la exploración del colon.
Resumen de la evidencias sobre las técnicas y/o pruebas diagnósticas- –
La anuscopia es una téncia que permite el diagnóstico de las enfermedades anorrectales más frecuentes (estudios de diagnóstico 3b).
- –
La sigmoidoscopia rígida (rectoscopia rígida) puede ser útil para el diagnóstico de lesiones en el canal anorrectal (estudios de diagnóstico 3b).
- –
La sigmoidoscopia flexible, al no poder explorar completamente el colon, deja de dignosticar un porcentaje importante de lesiones (estudios de diagnóstico 1b).
- –
La colonoscopia es superior a la sigmoidoscopia y al enema opaco en la detección de lesiones en el colon (estudios de diagnóstico 1b).
- –
El enema opaco sencillo no está indicado como método diagnóstico para las afecciones colorrectales en caso de rectorragia (estudios de diagnóstico 1b).
- –
La radiografía de abdomen no está indicada en el estudio del paciente con rectorragia. No obstante, puede ser útil en caso de obstrucción y/o isquemia intestinal.
- –
Los centros de salud necesitarían ofrecer la posibilidad de realizar anuscopia diagnósticas de forma adecuada y los médicos recibir los conocimientos necesarios para realizarlas.
- –
En los pacientes que consultan por rectorragia y con una alta sospecha clínica de cáncer colorrectal se recomienda realizar una colonoscopia.
B) Una colonoscopia se considera completa cuando se llega al ciego y se visualiza la válvula ileocecal. (Grado de recomendación B.)
- –
En el paciente con rectorragia, en caso de colonoscopia incompleta, se recomienda completar la exploración mediante radiología (enema de doble contraste o colonoscopia virtual).
B) La colonoscopia virtual no se recomienda actualmente como una prueba de primera elección en los pacientes con rectorragia. (Grado de recomendación B.)
5ESTRATEGIAS DIAGNÓSTICAS Y TERAPÉUTICASLas preguntas que se van a responder en el presente capítulo son las siguientes:
- –
¿Cuándo es necesario estudiar de forma preferente o ur-gente una rectorragia?
- –
¿Cuándo es necesario derivar un paciente con rectorragia al especialista de aparato digestivo?
- –
¿Cuándo una rectorragia se puede atribuir a una lesión concreta objetivable por anamnesis, inspección y/o endoscopia?
La valoración de los pacientes con rectorragia en AP debe sopesar los posibles beneficios de una derivación rápida, en el caso de una potencial neoplasia, con los riesgos y costes asociados de la derivación de pacientes de bajo riesgo con síntomas autolimitados5. Asimismo, los retrasos moderados hasta la evaluación no tendrán una influencia significativa en la supervivencia de los que pudieran presentar una neoplasia95. Por tanto, los pacientes considerados de bajo riesgo pueden ser tratados de forma más conservadora, asumiendo que los que presenten una afección benigna tendrán síntomas transitorios, mientras que los que presentan una causa grave tendrán síntomas persistentes y/o progresivos.
5.1Estrategia propuestaLa estrategia propuesta en la guía, una vez evaluadas la repercusión hemodinámica, la comorbilidad asociada y la historia familiar, se basa en la investigación y la detección de una causa anorrectal potencial que justifique la rectorragia (habitualmente hemorroides y/o fisura anal). El grupo de trabajo de la guía ha consensuado la edad de 50 años como punto de corte para considerar esta variable como un factor de riesgo que se ha de tener en cuenta. Este punto de corte está justificado por el bajo riesgo de presentar cáncer colorrectal antes de los 50 años en nuestro entorno. Por último, en caso de no localizar la causa de sangrado se recomienda realizar siempre, independientemente de la edad del paciente, una evaluación completa del colon.
Respecto a los pacientes menores de 50 años que pudieran desarrollar un cáncer de colon, la estrategia propuesta considera que el riesgo de presentar este tipo de cáncer, en la mayoría de casos, viene determinada por la historia familiar. La evaluación de este riesgo familiar, en la primera etapa de la evaluación del paciente con rectorragia (fig. 1), detectaría inicialmente a estos pacientes.
En el caso del paciente mayor de 50 años, con independencia de que se detecte una causa anorrectal de la rectorragia, el sangrado descrito debe ser compatible con una afección benigna (sangre al limpiarse o mínimas gotas de sangre al final de la deposición con quemazón, picor y/o dolor anal). Esta doble condición previa permite reducir al mínimo el riesgo de que el paciente presente un cáncer colorrectal, esto es, significativamente superior que el de la población general de su misma edad. No obstante, en caso de sintomatología compatible con cáncer colorrectal se recomienda la realización de una colonoscopia directamente.
Las principales instituciones sanitarias tienen aproximaciones similares ante el paciente con rectorragia, con pequeñas diferencias entre ellas. Las estrategias se basan principalmente en la edad del paciente, las características asociadas a la rectorragia (síntomas o signos), el tiempo de evolución de los síntomas y el tipo de prueba diagnóstica recomendada2,3.
Los algoritmos presentados en esta guía son fruto de la revisión de la evidencia científica y del consenso entre los autores y revisores de esta GPC.
5.2Comunicación con el pacienteA pesar de que estas estrategias aumentan la seguridad para descartar un cáncer colorrectal, es importante comentar algunos aspectos con el paciente (p. ej., que el riesgo de cáncer en su caso es bajo). A continuación se detallan algunos aspectos que se deben considerar ante la decisión de esperar y valorar la evolución en pacientes con un menor riesgo5:
- –
Establecer durante la entrevista el grado de preocupación con relación a presentar una neoplasia.
- –
Transmitir al paciente que, con independencia de la rectorragia, con el fin de detectar los casos de colon asintomáticos, hay programas de cribado de esta neoplasia a partir de los 50 años.
- –
Asegurarse de que el paciente comprende los beneficios y riesgos de no ser derivado inmediatamente:
- •
Beneficios: la no realización de una prueba no exenta de riesgos (5 complicaciones graves de cada 1.000) que necesita sedación y es molesta, complicaciones relacionadas con los sedantes, sobre todo en pacientes ancianos con problemas cardiovasculares; evitar el riesgo de ocasionar angustia y la posible yatrogenia en los que realmente no tienen cáncer.
- •
Riesgos: retraso de un potencial diagnóstico de cáncer (riesgo en principio bajo, aunque podría ser ligeramente superior al de la población general).
- •
- –
Ajustar la duración del período de observación y evolución al riesgo del paciente de presentar una neoplasia.
- –
Si el paciente es de bajo riesgo, pero no desea esperar y observar la evolución, se recomienda derivarlo.
- –
Ante una situación de incertidumbre clínica debe repetirse la exploración y la anamnesis, y solicitar la prueba diagnóstica indicada.
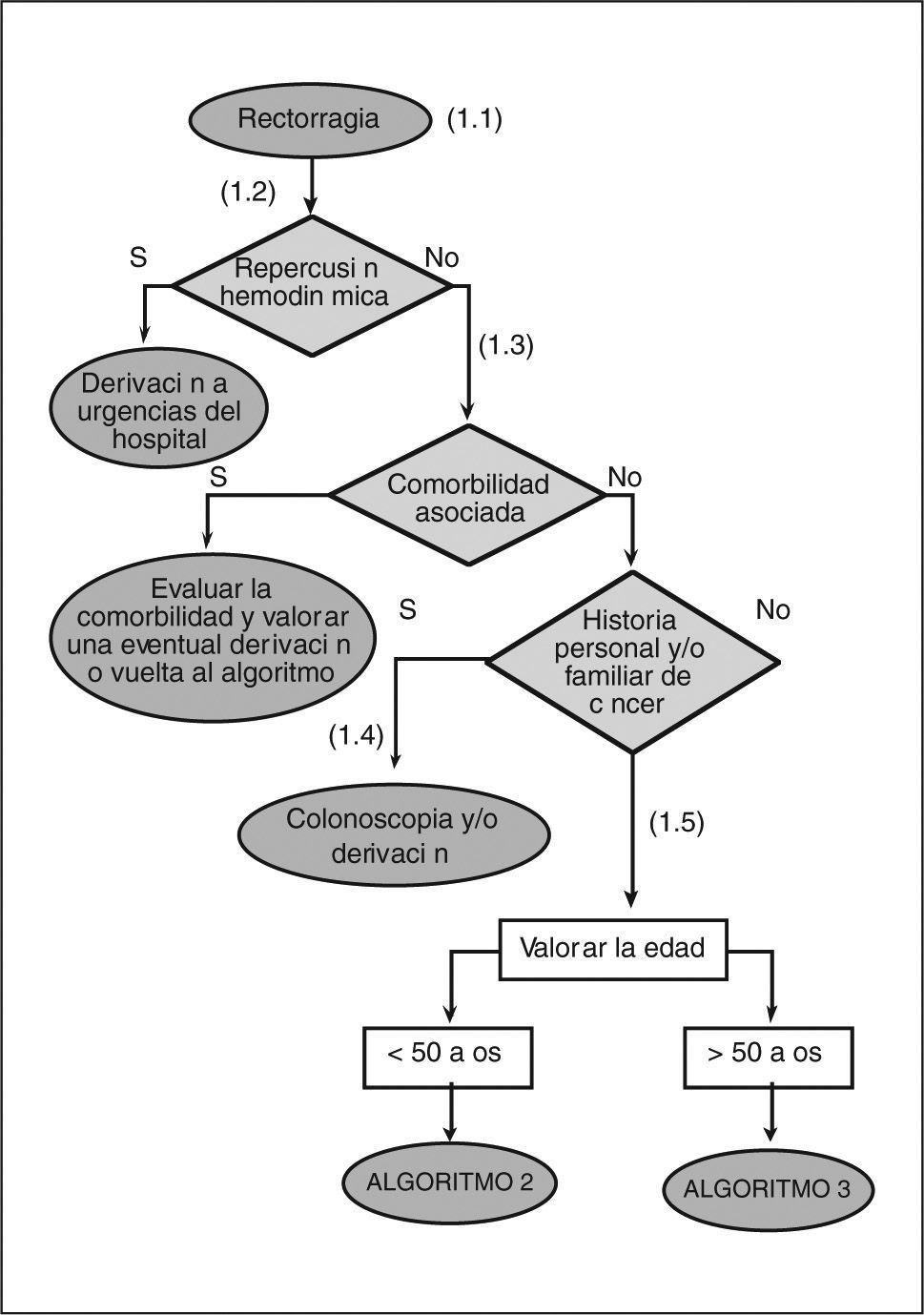
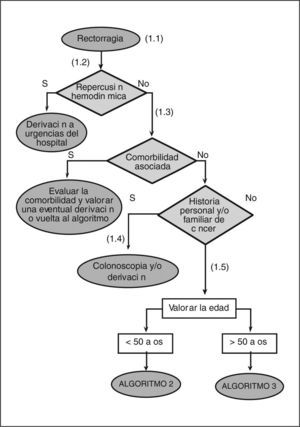
- (1.1)
Entendemos por rectorragia la emisión de sangre roja por el ano, de forma aislada o junto con las heces. Las personas que consultan por diarrea sanguinolenta no deben seguir este algoritmo.
- (1.2)
La cantidad de sangre emitida no es un buen indicador de la gravedad de la rectorragia. La repercusión hemodinámica, medida a través de la FC > 100 lat/min de forma mantenida y la PAS < 100 mmHg, informa de la gravedad de la rectorragia. La palidez cutaneomucosa ha de hacer pensar en la cronicidad y/o la larga evolución del sangrado.
- (1.3)
Los pacientes con hepatopatía, insuficiencia renal o que toman fármacos de riesgo (p. ej., antiagregantes, AINE, anticoagulantes), y que presentan una rectorragia, requieren una evaluación individualizada según su enfermedad de base. Esta valoración clínica, junto con las preferencias de los pacientes, ha de permitir sopesar/ contextualizar las diferentes alternativas de forma individual. Las intervenciones que se realicen, tanto diagnósticas como terapéuticas, dependerán de la gravedad de la enfermedad y de las posibilidades de su resolución en el ámbito de la AP.
- (1.4)
Con independencia de la edad se debe realizar una colonoscopia y/o derivar al especialista a los pacientes que presenten alguna de las siguientes características: a) historia familiar de cáncer colorrectal o pólipos en un familiar de primer grado (padres, hermanos e hijos) menor de 60 años o en dos familiares de primer grado de cualquier edad; b) historia familiar de síndromes de cáncer colorrectal hereditario (poliposis adenomatosa familiar y cáncer colorrectal hereditario no polipoide); c) historia personal de cáncer colorrectal; d) historia personal de pólipos adenomatosos, y e) historia personal de enfermedad intestinal inflamatoria crónica.
- (1.5)
En los pacientes con una edad superior a los 50 años, el valor diagnóstico de la rectorragia para el cáncer colorrectal aumenta de manera significativa.
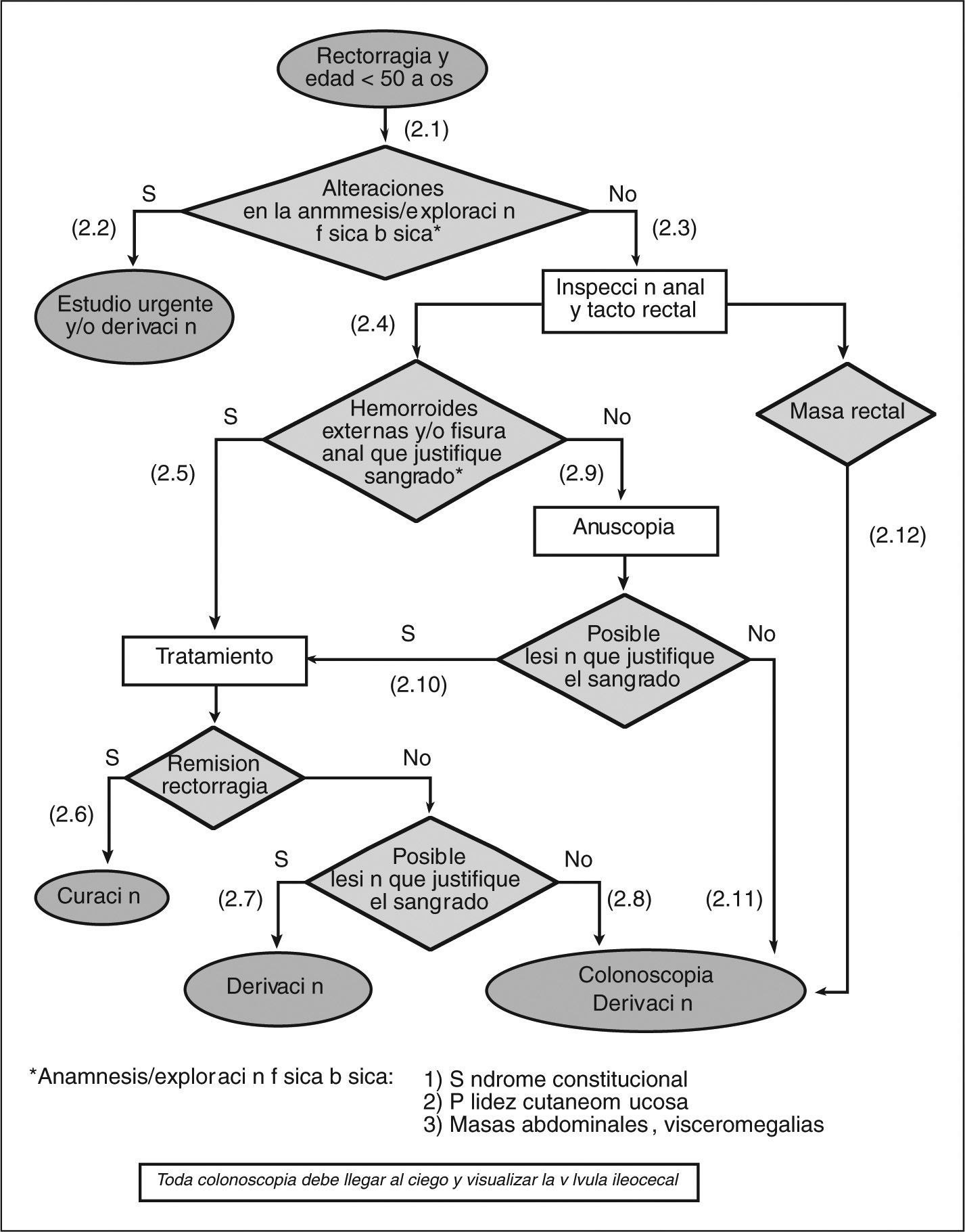
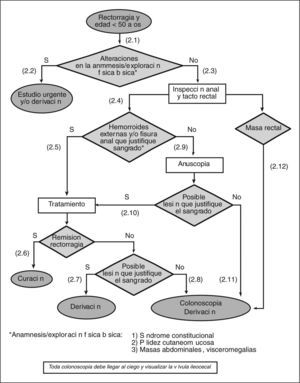
- (2.1)
Realizar una exploración física básica que incluya la valoración de palidez cutaneomucosa y la exploración del abdomen en busca de masas, visceromegalias y signos de hepatopatía.
- (2.2)
En el caso de encontrar alguna alteración en la exploración (síndrome constitucional, palidez cutaneomucosa y/o masas abdominales, visceromegalias), y según de las circunstancias clínicas, debe realizarse un estudio urgente y/o derivar al paciente al especialista.
- (2.3)
Todo paciente con rectorragia debe evaluarse mediante una cuidadosa inspección anal y un tacto rectal.
- (2.4)
En la inspección anorrectal, lo primero que debemos descartar o confirmar es la presencia de hemorroides y/o fisura anal.
- (2.5)
Si se confirma la presencia de hemorroides y/o fisura anal, se debe iniciar un tratamiento adecuado para cada una de estas afecciones (véase «Guía de práctica clínica sobre el manejo de las hemorroides y la fisura anal» [figs. 1 y 2]).
- (2.6)
Si la rectorragia cesa con el tratamiento, puede considerarse el episodio resuelto.
- (2.7)
Si a pesar del tratamiento la rectorragia no cesa (2-4 semanas) y es obvio que ésta sigue produciéndose por las hemorroides y/o una fisura anal (sangrado espontáneo o provocado por el roce del dedo, hemorroides trombosadas y/o coágulos sobre hemorroide), hay que derivar al paciente al cirujano o al especialista en coloproctología.
- (2.8)
Si hay dudas acerca de que la rectorragia persistente provenga de una lesión anal (hemorroides y/o fisura), hay que solicitar una colonoscopia y/o derivar al paciente al especialista.
- (2.9)
Si no se observa la presencia de hemorroides y/o de una fisura anal, ni de ninguna otra lesión aparente, debe realizarse una anuscopia o derivar al paciente al especialista para su realización.
- (2.10)
Para que la lesión aparente justifique la rectorragia, es necesario observar un sangrado espóntaneo o provocado por el roce del anuscopio, hemorroides trombosadas o coágulo sobre la hemorroide o la fisura. El manejo de la lesión identificada mediante la anuscopia variará en función de su naturaleza.
- (2.11)
Si no se encuentra ninguna lesión aparente en la anuscopia, se ha de solicitar la práctica de una colonoscopia o derivar al paciente al especialista para su realización. A pesar de que solicitemos la colonoscopia desde AP, y tanto si ésta es negativa como positiva, estos pacientes se deben derivar al especialista una vez llegados a este punto.
- (2.12)
Si se observa la presencia de una masa rectal, se debe solicitar la práctica de una colonoscopia o derivar al paciente al especialista para su realización.
A pesar de limitar el riesgo de retrasar la detección de un cáncer colorrectal, es importante comentar algunos aspec- tos relacionados con el paciente, así como su potencial riesgo de presentar una neoplasia (bajo o alto), antes de proceder con una de las posibles estrategias. Es necesario asegurarse de que el paciente comprende que todos vivimos con cierto riesgo bajo de cáncer de colon, ya que el tumor puede existir antes de que produzca síntomas. En concreto, a los pacientes mayores de 50 años, con una lesión que justifique el sangrado y un sangrado no compatible con enfermedad grave, es importante comentarles que el riesgo de presentar un cáncer es bajo debido a la presencia de una lesión que justifica este sangrado. Ésta es la razón de proponerles una estrategia inicial menos agresiva.
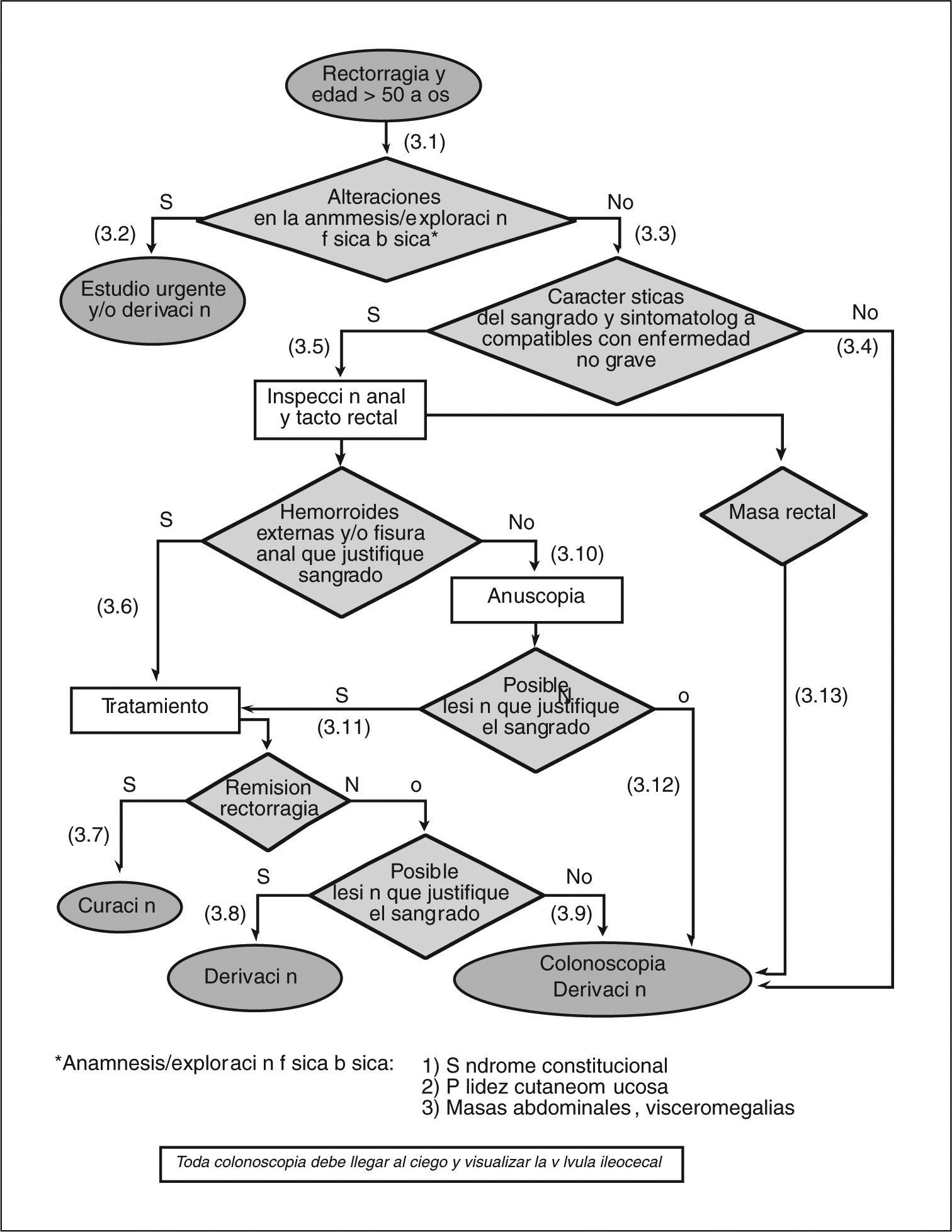
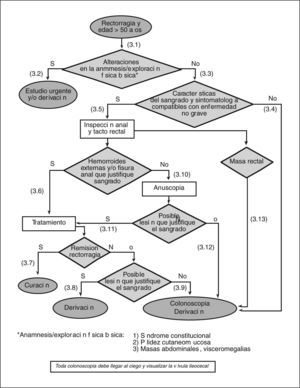
- (3.1)
Es necesario realizar una exploración física básica en los pacientes con rectorragia. Ésta consiste en valorar la existencia de palidez cutaneomucosa y explorar el abdomen en busca de masas, visceromegalias y signos de hepatopatía.
- (3.2)
En caso de encontrar alguna alteración en la exploración y en función de las circunstancias clínicas, se debe realizar un estudio urgente y/o derivar al paciente al especialista.
(3.3) Si la anamnesis y la exploración física no revelan ninguna de las alteraciones antes mencionadas, hay que interrogar al paciente con detalle acerca de las características del sangrado.
- (3.4)
Si la rectorragia no se manifiesta como sangre al limpiarse o mínimas gotas de sangre al final de la deposición con quemazón, picor y/o dolor anal, se debe solicitar una colonoscopia o derivar al paciente al especialista.
- (3.5)
Si la rectorragia se manifiesta sólo como sangre al limpiarse o mínimas gotas de sangre al final de la deposición con quemazón, picor y/o dolor anal, debe procederse con la exploración anorrectal.
- (3.6)
Si se confirma la presencia de hemorroides y/o fisura anal, hay que iniciar un tratamiento adecuado para cada una de éstas.
- (3.7)
Si después del tratamiento la rectorragia cesa, puede considerarse el episodio resuelto.
- (3.8)
Si a pesar del tratamiento la rectorragia no cesa (2-4 semanas) y es obvio que la hemorragia sigue produciéndose por las hemorroides y/o la fisura anal (sangrado espóntaneo o provocado por el roce del anuscopio, hemorroides trombosadas o coágulo sobre la hemorroide o la fisura), hay que derivar al paciente al cirujano o al especialista en coloproctología.
- (3.9)
Si hay dudas acerca de que la rectorragia persistente provenga de la lesión anal (hemorroides y/o fisura), hay que solicitar una colonoscopia y/o derivar al paciente al especialista.
- (3.10)
Si no se observa la presencia de hemorroides y/o fisura anal, ni de ninguna otra lesión aparente, se debe realizar una anuscopia o derivar al paciente al especialista para su realización.
- (3.11)
Para que la lesión aparente justifique la rectorragia, es necesario observar un sangrado espontáneo o provocado por el roce del anuscopio, hemorroides trombosadas o coágulo sobre la hemorroide o la fisura. El manejo de la lesión identificada mediante la anuscopia variará en función de su naturaleza.
- (3.12)
Si no se observa ninguna lesión aparente en la anuscopia, hay que solicitar una colonoscopia o derivar al paciente al especialista para su realización. A pesar de que solicitemos la colonoscopia desde AP, y tanto si ésta es negativa o positiva, se debe derivar a estos pacientes al especialista una vez llegados a este punto.
- (3.13)
Si en el tacto rectal se palpa una masa, hay que solicitar una colonoscopia o derivar al paciente al especialista.