Hemos leído atentamente el artículo de Cárdenas-Jaén et al.1, recientemente publicado en esta revista, en el cual se realiza un interesante estudio de las implicaciones pronósticas de los síntomas y las complicaciones digestivas en los pacientes hospitalizados por COVID-19.
Una de las complicaciones que en él se abordan es la alteración de la bioquímica hepática (ABH) o daño hepático («liver injury», según estos autores), definido como hipertransaminasemia con o sin alteración de otros parámetros de función hepática. En este estudio, la prevalencia de ABH de nueva aparición fue de 32,1%, siendo atribuible a la COVID-19 en 85% de estos pacientes. Los autores destacan que la ABH se relacionó con la COVID-19 grave, pero no con los eventos adversos ingreso en Unidad de Cuidados Intensivos, estancia hospitalaria o mortalidad.
Las implicaciones pronósticas reales de la AHB en pacientes COVID-19 han sido objeto de debate. Varios estudios con extensos tamaños muestrales, incluyendo metaanálisis y revisiones sistemáticas, sugieren que la ABH actúa como factor independiente de mal pronóstico2,3.
Para dar respuesta a esta hipótesis, nosotros realizamos un estudio retrospectivo unicéntrico con pacientes hospitalizados por afectación respiratoria por COVID-19, excluyendo aquellos con enfermedad hepática conocida. Inicialmente realizamos un análisis preliminar con 302 hospitalizados hasta el 15 de mayo del 2020, cuyos resultados fueron publicados4. Posteriormente ampliamos el periodo de inclusión hasta el 1 de marzo de 2021, obteniendo un tamaño muestral elevado (2.075 pacientes), cuyos resultados presentamos en esta carta.
Nuestra definición de ABH o daño hepático fue idéntica a la Cárdenas-Jaén et al. 1 y la de COVID-19 grave fue la presencia de insuficiencia respiratoria (SpO2 < 93% respirando a aire ambiente y/o PaO2/FiO2 < 300). Empleamos regresión logística múltiple y t-test (para estancia hospitalaria) ajustados a edad, sexo, índice normalizado de Charlson, consumo de alcohol y presencia de enfermedad por hígado graso no alcohólico no conocida (mediante índices HSI y FIB-4 calculados en los 12 meses previos al ingreso). Fue significativo p < 0,05.
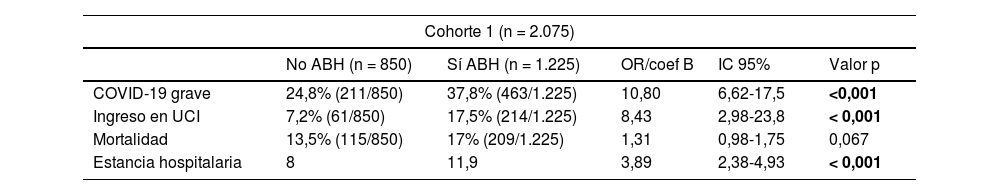
Obtuvimos una elevada prevalencia de ABH al inicio de la hospitalización: 41,6% (863/2.059) para AST y 27,4% (568/2.075) para ALT, mientras que 59,1% (1.225/2.075) presentó elevación de algún parámetro de bioquímica hepática. Las elevaciones de AST y ALT fueron leves (valores máximos promedio < 2 veces su límite superior de la normalidad), siendo resultados similares a los de Cárdenas-Jaén et al.1 Al igual que estos autores, nosotros objetivamos una asociación entre la presencia de ABH y la COVID-19 grave. Sin embargo, y a diferencia de ellos, también observamos que la ABH se relacionó significativamente con mayor probabilidad de ingreso en Unidad de Cuidados Intensivos y estancia hospitalaria y, sin alcanzar significación, de mortalidad (tabla 1). Adicionalmente, al analizar de forma independiente cada parámetro de bioquímica hepática, apreciamos que la elevación de AST incrementó significativamente la mortalidad (odds ratio [OR] 1,03; intervalo de confianza [IC] 95%: 1,01-1,04; p = 0,043).
Resultados de las dos cohortes de pacientes adultos, sin enfermedad hepática conocida, hospitalizados por afectación respiratoria por COVID-19
| Cohorte 1 (n = 2.075) | |||||
|---|---|---|---|---|---|
| No ABH (n = 850) | Sí ABH (n = 1.225) | OR/coef B | IC 95% | Valor p | |
| COVID-19 grave | 24,8% (211/850) | 37,8% (463/1.225) | 10,80 | 6,62-17,5 | <0,001 |
| Ingreso en UCI | 7,2% (61/850) | 17,5% (214/1.225) | 8,43 | 2,98-23,8 | < 0,001 |
| Mortalidad | 13,5% (115/850) | 17% (209/1.225) | 1,31 | 0,98-1,75 | 0,067 |
| Estancia hospitalaria | 8 | 11,9 | 3,89 | 2,38-4,93 | < 0,001 |
| Cohorte 2 (n = 228) | |||||
|---|---|---|---|---|---|
| No ABH (n = 94) | Sí ABH (n = 134) | OR/Coef B | IC 95% | Valor p | |
| COVID-19 grave | 6,0% (8/94) | 42,6% (57/134) | 23,50 | 2,69-205,40 | 0,004 |
| Ingreso en UCI | 2,1% (2/94) | 19,4% (26/134) | 15,40 | 2,01-10,00 | 0,011 |
| Mortalidad | 4,3% (4/94) | 10,4% (14/134) | 8,20 | 0,84-79,80 | 0,070 |
| Estancia hospitalaria | 4 | 8,5 | 4,50 | 2,34-12,50 | < 0,001 |
Asociación entre la presencia de alteración de la bioquímica hepática (ABH) y los eventos adversos COVID-19 grave (respecto a COVID-19 no grave), ingreso en Unidad de Cuidados Intensivos (UCI), mortalidad y estancia hospitalaria (días). La cohorte 1 incluye pacientes hospitalizados durante los primeros 12 meses de pandemia (hasta el 01/03/21) con tasa de vacunación para SARS-CoV-2 del 0,9%. La cohorte 2 es más tardía (del 01/10/21 al 20/01/22) e incluye únicamente pacientes vacunados para SARS-CoV-2. Resultados de regresión logística múltiple y t-test ajustados a edad, sexo, índice de Charlson, consumo alcohol y enfermedad por hígado graso no alcohólica.
Los resultados estadísticamente significativos (p < 0,05) se remarcan en negrita.
n: número pacientes; OR: odds ratio; IC: intervalo de confianza; UCI: Unidad de Cuidados Intensivos.
Además, para minimizar el impacto de los factores confusores, repetimos los análisis estadísticos excluyendo los pacientes con elevación de AST/ALT previa al ingreso (2,4%, 49/2.075) o con sospecha de hepatotoxicidad farmacológica durante la hospitalización (5,5%, 114/2.064), sin que esto modificara los resultados previamente descritos. Finalmente, valoramos el posible efecto de la vacunación para SARS-CoV-2 en estas asociaciones repitiendo el estudio en una cohorte más tardía (del 1 de octubre de 2021 al 20 de enero del 2022) de 228 pacientes vacunados, obteniendo resultados análogos a los de la cohorte anterior (tabla 1).
El desarrollo de la ABH en la COVID-19 se postula que es debido al efecto citopático directo por parte del SARS-CoV-2 y, principalmente, por la hiperactividad de la respuesta inmune desencadenada por el virus y que origina la tormenta citotóxica5. En este contexto, la presencia de ABH probablemente sea una manifestación de un estadio inflamatorio sistémico por COVID-19 más evolucionado, lo cual justificaría sus implicaciones pronósticas negativas. Tal y como mencionan Cárdenas-Jaén et al.1 en su estudio, la ausencia de estas asociaciones pronósticas podría deberse a que incluyeron marcadores inflamatorios sistémicos en el análisis estadístico multivariante.
Tampoco debemos olvidar que las limitaciones inherentes a los estudios observacionales no han permitido obtener una evidencia científica suficiente para realizar recomendaciones en firme. Sin embargo, con base en nuestros resultados y los publicados en la literatura, consideramos que la aparición de ABH es relevante y podría considerarse como un factor pronóstico precoz desfavorable en los pacientes hospitalizados por COVID-19.
FinanciaciónSe dispuso de una beca concedida por la Fundación del Consorcio Hospital General Universitario de Valencia, España, en la convocatoria «Premio al mejor proyecto de investigación en SARS-CoV-2 o COVID-19» del año 2020.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.