La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica que compromete el colon, afectando la calidad de vida de individuos de cualquier edad. Existe un amplio espectro de situaciones clínicas. Los avances realizados en fisiopatogenia de la CU han permitido desarrollar nuevos agentes terapéuticos más efectivos y seguros.
ObjetivosActualizar y ampliar la evaluación de la eficacia y seguridad de los tratamientos relevantes para la inducción de la remisión y el mantenimiento luego de un brote leve, moderado o grave de CU.
DestinatariosGastroenterólogos, coloproctólogos, médicos clínicos, médicos de familia y otros profesionales de la salud, interesados en el tratamiento de la CU.
MetodologíaLas autoridades de GADECCU obtuvieron la autorización de GETECCU para la adaptación y actualización de la «Guía GETECCU 2020 para el tratamiento de la CU. Elaborada con metodología GRADE». Se conformó un equipo que incluyó a autores, panel de expertos, enfermera y un paciente, expertos en metodología y revisores externos. Se utilizó metodología GRADE con la nueva información.
ResultadosSe elaboró un documento de 118 páginas con las 44 recomendaciones GADECCU 2022, para distintas situaciones clínicas y opciones terapéuticas, según niveles de evidencia. Se agregó un apartado con las nuevas moléculas próximas a estar disponibles.
ConclusionesEsta guía ha sido realizada con el fin de facilitar la toma de decisiones relativas al tratamiento de la CU, adaptando y actualizando la guía elaborada por GETECCU en el año 2020.
Ulcerative colitis (UC) is a chronic inflammatory disease that compromises the colon, affecting the quality of life of individuals of any age. In practice, there is a wide spectrum of clinical situations. The advances made in the physio pathogenesis of UC have allowed the development of new, more effective and safer therapeutic agents.
ObjectivesTo update and expand the evaluation of the efficacy and safety of relevant treatments for remission induction and maintenance after a mild, moderate or severe flare of UC.
RecipientsGastroenterologists, coloproctologists, general practitioners, family physicians and others health professionals, interested in the treatment of UC.
MethodologyGADECCU authorities obtained authorization from GETECCU to adapt and update the GETECCU 2020 Guide for the treatment of UC. Prepared with GRADE methodology. A team was formed that included authors, a panel of experts, a nurse and a patient, methodological experts, and external reviewers. GRADE methodology was used with the new information.
ResultsA 118-page document was prepared with the 44 GADECCU 2022 recommendations, for different clinical situations and therapeutic options, according to levels of evidence. A section was added with the new molecules that are about to be available.
ConclusionsThis guideline has been made in order to facilitate decision-making regarding the treatment of UC, adapting and updating the guide prepared by GETECCU in the year 2020.
La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica que compromete de modo predominante el colon, desde el recto hacia proximal y afecta a individuos de cualquier edad, incluso niños y ancianos. Tanto la severidad de la inflamación como la extensión en el colon varían ampliamente entre pacientes y también en un mismo paciente en diferentes momentos de su evolución. Esto genera un amplio espectro de situaciones clínicas que van desde una enfermedad sutil, que puede pasar desapercibida por años, a cuadros fulminantes capaces de comprometer en días la vida del paciente. Los síntomas intestinales de la CU suelen tener un fuerte impacto en la calidad de vida: la diarrea, el pujo, el tenesmo, la urgencia evacuatoria y el dolor abdominal interfieren con todas las actividades de la vida y constituyen, además, un motivo de vergüenza y discriminación. Por otra parte, los pacientes pueden presentar deterioro del estado general, astenia, pérdida de peso y/o manifestaciones extraintestinales eventualmente severas e invalidantes.
Se considera que la CU es consecuencia de una desregulación de la respuesta inmune de la mucosa colónica de origen multifactorial. Entre los factores se reconocen elementos genéticos, ambientales, alimentarios, modificaciones de la microbiota, alteraciones emocionales y uso de medicamentos como antiinflamatorios y antibióticos.
Si bien los mecanismos involucrados en su génesis solo se conocen parcialmente, los avances realizados en este campo en los últimos años han permitido el desarrollo de nuevos agentes terapéuticos más efectivos y seguros, sobre todo para los pacientes con enfermedad moderada o severa. Estos adelantos terapéuticos han mejorado la historia natural de la enfermedad y han reducido el requerimiento tanto de corticoides como de cirugía, pero, simultáneamente, la toma de decisiones y su manejo se ha hecho más complejo y han aumentado de forma considerable los costos del tratamiento médico.
Por otra parte, la epidemiología de la enfermedad inflamatoria intestinal (EII) en nuestro país no se conoce bien, aunque próximamente contaremos con los datos del registro nacional que el Grupo Argentino de Enfermedad de Crohn y Colitis Ulcerosa (GADECCU) está llevando a cabo. Por el momento solo disponemos de estudios regionales que muestran una prevalencia que va de 58,9 a 76,1 cada 100.000 habitantes1,2. En consonancia con lo observado en toda Latinoamérica, los expertos locales coinciden en que existe un notable aumento de la incidencia y consecuente prevalencia de la EII en los últimos años en Argentina3,4.
La correcta atención de los pacientes con CU exige un diagnóstico temprano y el conocimiento de las posibilidades terapéuticas por parte de los médicos generalistas, así como la existencia de equipos multidisciplinarios en centros de alta complejidad capaces de abarcar los requerimientos terapéuticos de los múltiples aspectos de la enfermedad. Por otra parte, la adherencia de los pacientes es clave para el éxito del tratamiento a largo plazo y depende en gran parte de la experiencia, el conocimiento y la dedicación del equipo terapéutico.
En función de estas consideraciones y con el fin de mejorar la respuesta de nuestro sistema sanitario, GADECCU abordó el desafío de desarrollar documentos locales para sostener la práctica basada en la evidencia.
Debido a la existencia de múltiples guías de alta calidad producidas en otros países, realizar una absolutamente nueva sería un esfuerzo redundante. Por este motivo, decidimos adaptar y actualizar una guía previamente confeccionada. Luego de analizar el material existente sobre el tema, elegimos la «Guía GETECCU 2020 para el tratamiento de la CU»5 porque es la que mejor se adecúa a la realidad local. Agradecemos al Grupo Español de Trabajo de Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) la confianza que han puesto en nosotros al compartir generosamente su guía. También va nuestro reconocimiento a los expertos de GADECCU y a todos los que han trabajado intensamente para concretar esta presentación.
ObjetivosActualizar y ampliar la evaluación de la eficacia y efectividad clínica de los fármacos relevantes para la inducción de la remisión y el mantenimiento luego de un brote leve, moderado o grave de CU.
Orientar la estrategia recomendada para el tratamiento farmacológico en la inducción de la remisión y el mantenimiento luego de un brote leve, moderado o grave de CU para la población argentina.
DestinatariosEsta guía está pensada tanto para gastroenterólogos, coloproctólogos, médicos clínicos, médicos de familia y otros profesionales de la salud, como para los pacientes interesados en el tratamiento de la CU.
Nota: Este documento se redactó utilizando el masculino genérico para evitar la sobrecarga gráfica en el texto. Sin embargo, cabe aclarar que promovemos la igualdad de género en todas sus manifestaciones. Asimismo, si bien usamos mayoritariamente el término persona, para referirnos a alguien con EII, en ocasiones empleamos el término paciente en referencia a sus derechos en relación con los profesionales e instituciones de la salud enmarcados en la ley 26.529/09.
Metodología y proceso de elaboraciónLas autoridades de GADECCU obtuvieron la autorización de GETECCU para la adaptación y actualización de la «Guía GETECCU 2020 para el tratamiento de la CU. Elaborada con metodología GRADE».
Se conformó un equipo que incluyó a un grupo de autores conformado por cinco médicos, un panel de expertos en el tema compuesto por nueve médicos, una enfermera y un paciente, expertos en metodología y revisores externos.
Para la adaptación y actualización de la guía se revisaron las 44 preguntas de la guía original, que se estructuraron en formato PICO (población, intervención, comparación y desenlaces). Los desenlaces se clasificaron según su importancia como críticos, importantes pero no críticos y no importantes, con base en una escala ordinal, con el consenso del panel de expertos.
La estrategia de búsqueda bibliográfica que se aplicó en esta adaptación consistió en ampliar la cantidad de estudios a incluir, abarcando también aquellos publicados en el periodo que va del 30 de noviembre de 2019 (fecha de finalización de la búsqueda de la guía GETECCU) al 30 de diciembre de 2021. También se utilizó la evidencia disponible en la guía original del GETECCU y en las principales bases de datos bibliográficas (Medline, Cochrane, DARE, NHS EED, Biblioteca Cochrane, Biblioteca Virtual de Salud y LILACS). Se priorizaron las revisiones sistemáticas, los metaanálisis, los estudios clínicos aleatorizados y controlados. Se seleccionaron estudios que hubieran evaluado como desenlaces (en el orden de importancia en el que se votaron) la remisión, el efecto adverso serio, la respuesta, la recidiva, la cirugía (tasa de colectomía), la calidad de vida, la normalización de la proteína C reactiva (PCR) y la velocidad de sedimentación globular (VSG), la normalización de la calprotectina, el efecto adverso y la remisión histológica. Se aplicó la metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE) para evaluar la calidad de la evidencia y graduar la fuerza de las recomendaciones (https://gdt.gradepro.org/app/handbook/translations/es/handbook.html). Luego de la etapa de evaluación metodológica, el panel de expertos recibió los perfiles de evidencia para la etapa de votación individual y posterior consenso de las recomendaciones, de acuerdo con la fuerza de la evidencia y el contexto de implementación. Finalmente, se pasó a la etapa de redacción de la guía, seguida de la revisión externa realizada por pares expertos en metodología y EII. En relación con el formato, se modificó la presentación original a fin de darle visibilidad a los conceptos más relevantes.
DefinicionesCriterios de gravedad: de acuerdo con la clasificación de Montreal6, se categorizan como en remisión leve, moderada y grave. Este índice no se ha validado formalmente en ningún estudio7. Existen otros índices de actividad utilizados tales como8 el índice de Mayo (DAI)9 (tabla 1), el índice de SEO10 (tabla 2), el índice de Lichtiger11 (tabla 3) y el índice de Walmsley, conocido como Simple Activity Index12 (tabla 4). Se evitaron términos confusos como colitis fulminante o muy grave. Las diferencias entre brote moderado y grave en los estudios publicados en la literatura médica, sobre todo con los fármacos biológicos, no siempre están bien establecidas.
Índice de Mayo (DAI)249,250
| Parámetro | Puntos | Subtotal |
|---|---|---|
| 1) Frecuencia de deposiciones | ||
| Normal para el paciente | 0 | = ______ |
| 1-2 más que lo habitual | 1 | |
| 3-4 más que lo habitual | 2 | |
| > 5 más de lo habitual | 3 | |
| 2) Hemorragia rectal | ||
| Ninguna | 0 | = ______ |
| Algunas trazas de sangre | 1 | |
| Sangre evidente en la mayoría de las deposiciones | 2 | |
| Sólo sangre | 3 | |
| 3) Hallazgos sigmoidoscópicos | ||
| Normal o enfermedad inactiva | 0 | = ______ |
| Eritema, leve friabilidad | 1 | |
| Eritema marcado, friabilidad evidente | 2 | |
| Hemorragia espontánea | 3 | |
| 4) Evaluación global del médico | ||
| Normal | 0 | = ______ |
| Enfermedad leve | 1 | |
| Enfermedad moderada | 2 | |
| Enfermedad grave | 3 | |
| Valoración Global Índice de Mayo | Síntomas | Endoscopía | Médico | Suma total |
|---|---|---|---|---|
| Leve | 1-3 | 1 | 1 | 3 a 5 |
| Moderado | 3-6 | 1-2 | 2 | 6 a 10 |
| Grave | > 6 | > 2 | 3 | > 10 |
Índice de Seo251
| Variable | Valoración |
|---|---|
| N° deposiciones | × 13 = |
| ≤ 4 = 1 | |
| 5-7 = 2 | |
| ≥ 8 = 3 | |
| Sangre heces | × 60 = |
| No o poca = 0 | |
| Presente = 1 | |
| VSG (mm/h) | × 0,5 = |
| TOTAL A (sumatorio previos) | = |
| Hemoglobina (g/dl) | × 4 = |
| Albúmina (g/dl) | × 15 = |
| TOTAL B (sumatorio previos) | = |
| Valoración índice de Seo | Puntuación |
| Remisión o actividad leve | < 150 |
| Moderado – grave | 150-220 |
| Grave | > 220 |
| Índice de actividad Seo: Total A – Total B + 200 = |
Índice de Lichtiger252
| Síntomas | Puntos |
|---|---|
| 1) Diarrea | |
| 0-2 | 0 |
| 3-4 | 1 |
| 5-6 | 2 |
| 7-9 | 3 |
| 10 | 4 |
| 2) Diarrea nocturna | |
| No | 0 |
| Sí | 1 |
| 3) Sangre visible en las heces (%) | |
| 0 | 0 |
| < 50% | 1 |
| > 50% | 2 |
| 100% | 3 |
| 4) Incontinencia | |
| No | 0 |
| Sí | 1 |
| 5) Dolor abdominal o retortijón | |
| Ninguno | 0 |
| Leve | 1 |
| Moderado | 2 |
| Grave | 3 |
| 5) Estado general | |
| Perfecto | 0 |
| Muy bueno | 1 |
| Bueno | 2 |
| Aceptable | 3 |
| Malo | 4 |
| Muy malo | 5 |
| 5) Reacción peritoneal | |
| Ninguna | 0 |
| Leve y localizado | 1 |
| Leve-moderado y difuso | 2 |
| Grave o rebote | 3 |
| 6) Necesidad de antidiarreico | |
| No | 0 |
| Sí | 1 |
| Valoración índice: | |
| Máxima puntuación: 21 puntos. | |
Puntuación < 10 durante 2 días consecutivos, indica respuesta clínica (en la referencia original a ciclosporina, brote grave refractario).
Índice de Walmsley, conocido como Simple Activity Index253
| Variable | Puntuación |
|---|---|
| 1) Número diario de deposiciones | |
| 1-3 | 0 |
| 4-6 | 1 |
| 7-9 | 2 |
| > 9 | 3 |
| 2) Deposiciones nocturnas | |
| 1-3 | 0 |
| 4-6 | 1 |
| 3) Urgencia deposicional | |
| No | 0 |
| Inmediatez | 1 |
| Consistencia | 2 |
| 4) Sangre en heces | |
| No | 0 |
| Ocasional | 1 |
| Franca | 2 |
| 5) Estado general | |
| Bueno | 0 |
| Regular | 1 |
| Malo | 2 |
| Muy malo | 3 |
| 6) Manifestaciones extradigestivas | |
| Cada manifestación | 1 |
| Valoración índice: | |
Índice sencillo, clínico, cuya interpretación e interrelación con índices más complejo como Power-Tuck es adecuada.
Criterios de extensión: aquellos definidos en la clasificación de Montreal6. Debemos admitir el límite fundamental de esta clasificación: la extensión puede cambiar con el tiempo y, de hecho, una parte variable de las proctitis pasará a colitis más extensas13; además, ante un brote grave, la extensión de la enfermedad pasa a un segundo plano. Sin embargo, para el análisis del efecto terapéutico, esto es de menor importancia porque se analiza la colitis en la extensión que tiene en el momento del estudio:
- •
CU extensa: afecta desde el recto hasta más allá del ángulo esplénico.
- •
CU izquierda: afección hasta el ángulo esplénico.
- •
Proctitis ulcerosa: afección limitada al recto (el límite superior de la inflamación no supera la unión rectosigmoidea).
La presencia de inflamación superficial periapendicular «patch apendicular» o «colitis en extremos» no implica un aumento de la extensión en la clasificación ni en la indicación de tratamiento.
Otras definiciones se tomaron del consenso ECCO:14
Remisión: resolución completa de los síntomas, acompañada de cicatrización mucosa. No todos los ensayos utilizan exactamente la misma definición. Cuando sea relevante, se señalará en el texto específicamente.
Respuesta: mejoría significativa de la situación clínica y/o endoscópica (de grave a moderada, de grave a leve, de moderada a leve) sin alcanzar la remisión.
Recidiva: nuevo brote en un paciente con CU tras haberse producido con anterioridad una remisión, o bien espontáneamente, o bien tras el tratamiento médico.
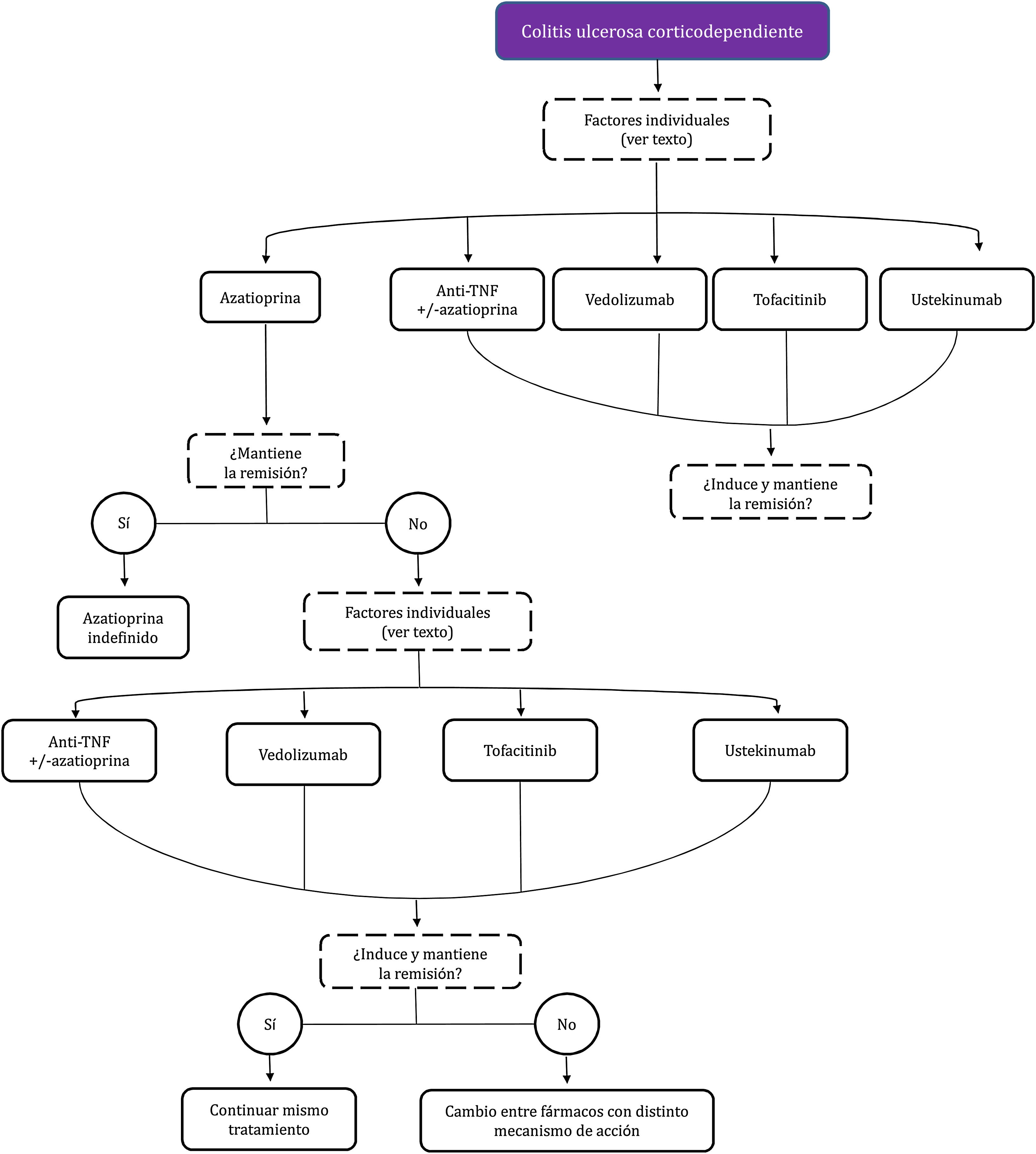
Corticodependencia: imposibilidad de disminuir la dosis de corticoides por debajo de 10 mg/día de prednisona (o equivalente) luego de tres meses del inicio del tratamiento corticoideo o la recidiva dentro de los primeros tres meses de haber suspendido los corticoides.
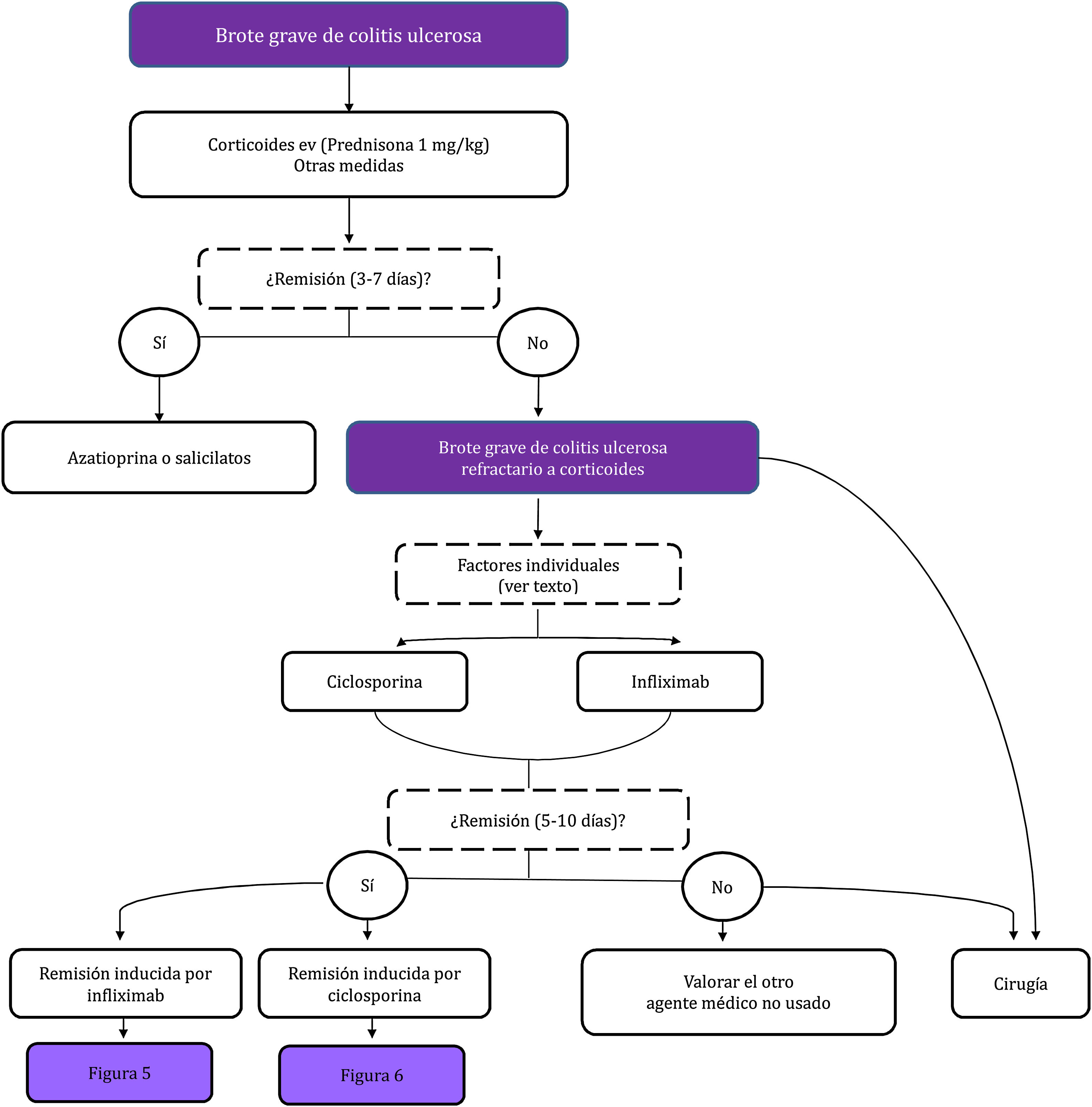
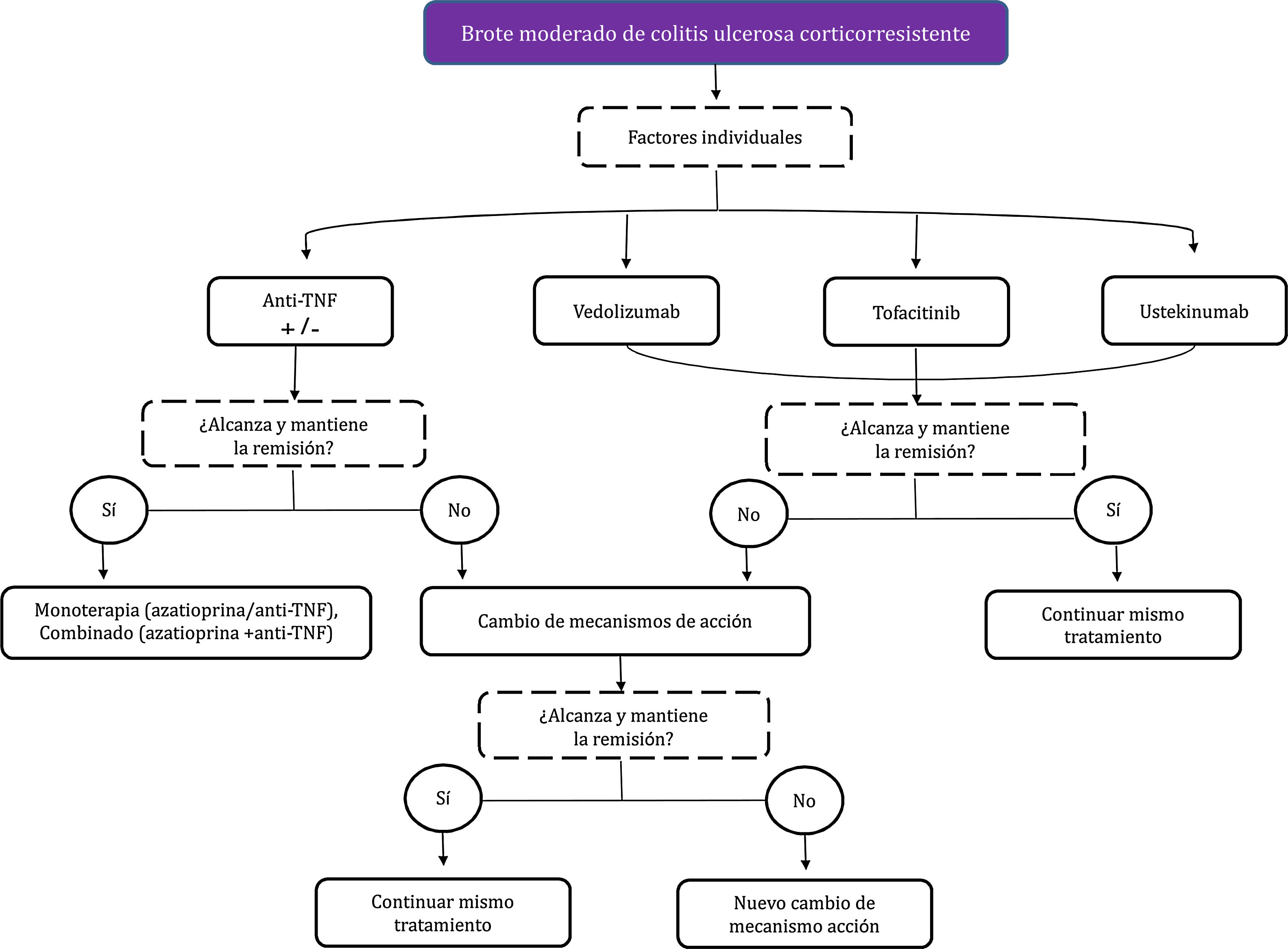
Corticorresistencia: actividad clínica del paciente a pesar de haber seguido un tratamiento durante cuatro semanas con dosis plenas (0,75 mg/kg/día de prednisolona o 1 mg/kg/día de prednisona, o equivalente). Esta definición es muy controvertida y con toda probabilidad se modificará en el futuro. De hecho, en el contexto de un brote grave, la gran mayoría de los clínicos definiría la corticorresistencia como la falta de respuesta clínica tras la administración de dosis plenas de corticoides por vía intravenosa durante siete días. Es más, hay una tendencia creciente a reducir este periodo a cinco o incluso tres días. A los efectos de esta guía de práctica clínica (GPC), consideraremos un mes para los brotes leves o moderados, y siete días para los graves5.
PoblaciónEsta guía incluye:Tratamiento médico en pacientes de 16 años o más con diagnóstico de CU de acuerdo con los criterios de Lennard-Jones (tabla 5). Estos criterios están validados tanto por la Organización Mundial de Gastroenterología (OMGE)15 como por la European Crohn's and Colitis Organisation (ECCO)14,16.
Criterios diagnósticos de Lennard-Jones254
| Criterios clínicos | • Rectorragia |
| • Diarrea crónica (aunque en un 10% de los casos puede haber estreñimiento) | |
| • Dolor abdominal | |
| • Manifestaciones extraintestinales | |
| Criterios radiológicos | • Cambios mucosos: mucosa granular, úlceras espiculares o en botón de camisa, pseudopólipos |
| • Cambios de calibre: estrechamiento de la luz (aumento del espacio recto-sacro), acortamientol del colon, pérdida de haustración | |
| Criterios endoscópicos | • Mucosa eritematosa, granular, edematosa y/o friable |
| • Exudado o ulceraciones | |
| • Hemorragia al roce o espontánea | |
| • Pseudopólipos y pólipos | |
| • Lesiones característicamente continuas y con afectación prácticamente constante de recto | |
| Criterios anatomopatológicos | • Mayores: inflamación exclusiva de la mucosa, úlceras superficiales, distorsión de la criptas, microabscesos, depleción de células calciformes |
| • Menores: infiltrado inflamatorio crónico difuso, aumento de la vascularización mucosa, metaplasia de las células de Paneth, atrofia mucosa, hiperplasia linfoide |
Esta guía excluye:
- 1.
Tratamiento médico en situaciones especiales como embarazo y lactancia.
- 2.
Tratamiento en condiciones clínicas como EC, EII indefinida, colitis indeterminada o idiopática, enfermedad mixta EII y colitis, colitis infecciosa, cuffits y reservoritis.
- 3.
Tratamiento en población pediátrica.
Esta guía incluye:
- •
Fármacos sistémicos:
- ∘
Salicilatos: sulfasalazina, mesalazina.
- •
Corticoides orales:
- ∘
Sistémicos: hidrocortisona, prednisona, metilprednisolona, deflazacort, betametasona y dexametasona.
- ∘
Acción predominantemente tópica: beclometasona dipropionato, budesonida y budesonida MMX.
- •
Fármacos inmunomoduladores (inmunosupresores):
- ∘
Tiopurínicos: azatioprina, mercaptopurina o tioguanina.
- ∘
Metotrexate.
Calcineurínicos: ciclosporina y tacrolimus.
- •
Inhibidores de Jak: tofacitinib.
- •
Fármacos biológicos y biosimilares:
- ∘
Antifactor de necrosis tumoral (anti-TNF): infliximab, adalimumab y golimumab.
- ∘
Antiintegrinas: vedolizumab.
- ∘
Anti-IL 12-IL 23: ustekinumab.
- •
Fármacos de administración rectal:
- ∘
Mesalazina.
- ∘
Tacrolimus rectal.
- ∘
Corticoides.
Consideraremos otros métodos descritos de tratamiento, como la aféresis leucocitaria, el trasplante de materia fecal (TMF) y los probióticos. Además, hacia el final de esta guía se incluye una adenda con información sobre upadacitinib y ozanimod, ya que recientemente se aprobaron estas moléculas para utilizarlas en CU en otros países y es muy posible que suceda lo mismo a corto plazo en Argentina.
Nota: Las dosis incluidas son las que se consideran eficaces o efectivas para inducir la remisión de un brote de CU o para el tratamiento de mantenimiento.
Esta guía excluye:
- •
Tratamiento quirúrgico.
- •
Comparaciones entre clases.
- •
Combinaciones de fármacos.
- •
Dosis.
- •
Placebo o tratamiento habitual.
Desenlaces (resultado/outcome)
- •
Respuesta: mejoría significativa de la situación clínica y/o endoscópica (de grave a moderada, de grave a leve, de moderada a leve) sin alcanzar la remisión.
- •
Remisión: resolución completa de los síntomas, acompañada de cicatrización mucosa.
- •
Recidiva: nuevo brote en un paciente con CU establecida tras haberse producido con anterioridad una remisión, o bien espontáneamente, o bien tras el tratamiento médico.
- •
Remisión histológica: normalización completa de la mucosa o cambios arquitecturales crónicos con ausencia de infiltrado neutrofílico.
- •
Efecto adverso (EA): cualquier situación indeseable que haya sucedido con el paciente, mientras utilizaba un medicamento y exista la sospecha de que dicho medicamento fue la causa (por ejemplo: diarrea, artralgias, cefaleas) (Administración Nacional de Medicamentos, Alimentos y Tecnología Médica [ANMAT]).
- •
Efecto adverso serio: es aquel que cumple con alguno de los siguientes criterios: produce muerte, genera riesgo de vida, requiere o prolonga una hospitalización, produce una anomalía congénita o defecto al nacer, provoca una incapacidad persistente significativa o lleva a la suspensión de la administración de la medicación (ANMAT).
- •
Calidad de vida: percepción que tiene una persona sobre su posición en la vida, dentro del contexto cultural y el sistema de valores en el que vive y con respecto a sus metas, expectativas, estándares y preocupaciones (Organización Mundial de la Salud [OMS]).
- •
Cirugía: reducción de la tasa de colectomía.
- •
Normalización de PCR/VSG (de acuerdo con el laboratorio de referencia).
- •
Calprotectina < 250 (de acuerdo con lo definido en el consenso STRIDE).
NOTA: las medidas de efecto se reportan de modo preferente como riesgo relativo (RR), odds ratio (OR) y hazard ratio (HR).
Tratamiento de la colitis ulcerosaEn la elaboración de esta guía se ha organizado a los pacientes en dos grandes grupos según el nivel de gravedad (leve-moderada y grave), dado que la mayoría de los ensayos clínicos utilizan este sistema de clasificación. Esto se refiere al grado de actividad clínica de la enfermedad en un momento dado de acuerdo con diferentes índices5.
Sin embargo, estas definiciones incluyen un sinnúmero de escenarios clínicos. La amplitud de la categoría «leve-moderado» es especialmente problemática, ya que abarca tanto al paciente que tiene síntomas leves, por ejemplo, tres deposiciones al día y un leve malestar abdominal, hasta aquel que tiene más de cinco deposiciones con sangre, algunas nocturnas, y una importante astenia ligada a una anemia. Al incluirlos en el ensayo clínico, ambos pacientes estarían en el mismo grupo, pero el médico indicaría tratamientos diferentes. No es factible recoger todas estas posibilidades con unos simples algoritmos ni caben todas las circunstancias en las tablas GRADE. Por lo tanto, la guía es una orientación o lineamiento, pero no puede ni debe sustituir el criterio clínico5.
En la práctica diaria, además de evaluar el grado de actividad del brote, se necesita información adicional para adecuar el tratamiento médico a cada paciente: la extensión de la enfermedad, la respuesta y tolerancia a los tratamientos en brotes previos, la presencia de manifestaciones extraintestinales y comorbilidades5 son algunos de los datos a considerar.
Ciertas características clínicas están asociadas a un curso de enfermedad más agresivo, con mayor riesgo de progresión y más complicaciones5. Los predictores de un curso agresivo de la enfermedad y la colectomía son: edad temprana en el momento del diagnóstico (menor de 40 años), enfermedad extensa, actividad endoscópica grave (presencia de úlceras grandes y/o profundas), infección por Clostridium difficile y citomegalovirus, necesidad temprana de corticosteroides y marcadores inflamatorios elevados17.
En este sentido, es importante diferenciar la actividad de la severidad. Si bien la primera se refiere al grado de inflamación en un momento dado, la segunda tiene en cuenta el curso y fenotipo de la enfermedad, y es útil para determinar el pronóstico y predecir complicaciones. Un paciente con un brote leve, síntomas leves y bajos marcadores inflamatorios puede tener alta severidad por la historia y/o comportamiento de su enfermedad, y deberá manejarse de manera más proactiva y agresiva18.
Es importante tener en cuenta que para la correcta toma de decisiones existen otros documentos que sugieren algoritmos de tratamientos orientados a objetivos a corto, mediano y largo plazo, que pasan del mero control sintomático a la curación endoscópica, la curación mucosa y los objetivos centrados en lo que el paciente refiere (patient reported outcomes).
La estrategia de tratar según objetivos cada vez más exigentes se profundizó con los distintos reportes que fueron surgiendo, ya que mostraron mejores resultados a largo plazo, con mejores tasas de mantenimiento y menos recaídas en los pacientes que lograron cumplir estos objetivos. Esta estrategia, llamada treat to target (T2T), se fortaleció con el consenso de STRIDE-II, que organizó estos objetivos en un cronograma desde el inicio del tratamiento e introdujo objetivos nuevos como la normalización de biomarcadores séricos y fecales, la mejora de la calidad de vida y la prevención de discapacidades.
Con respecto a la curación profunda, que incluye el Mayo 0 endoscópico sumado al criterio histológico de no actividad inflamatoria microscópica, puede ser útil para valorar la profundidad de la remisión. Sin embargo, aún no está claro si alcanzar este objetivo mejora la historia natural de la enfermedad. A medida que surjan más datos sobre la relación riesgo-beneficio de lograr una curación más profunda, los objetivos en el tratamiento de las EII podrían seguir cambiando19,20.
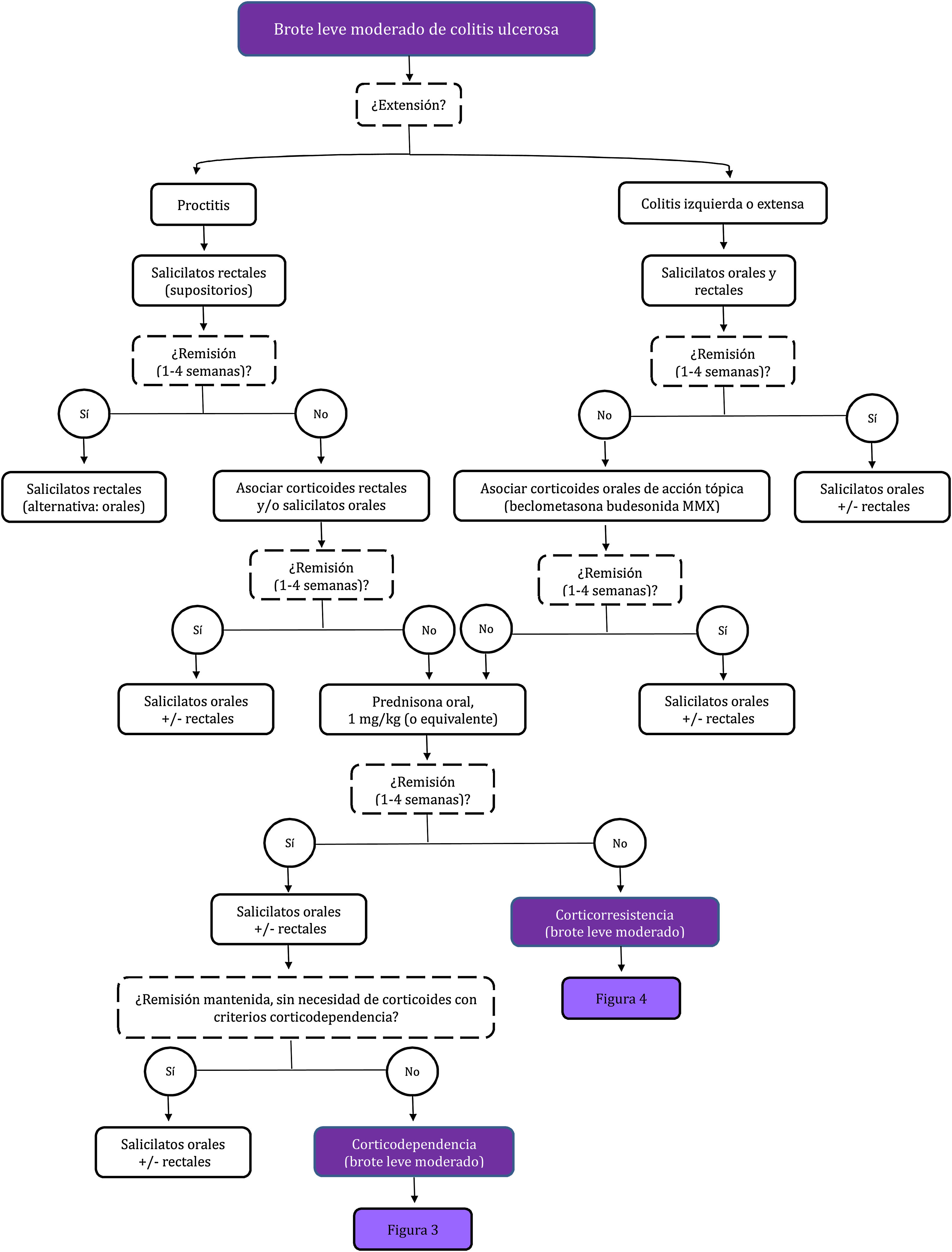
Inducción de la remisión del paciente con CU activaInducción de la remisión en el paciente con brote leve y moderado de CURecomendación 1.1.1 GADECCU.
Tratamiento CU (2022): salicilatos orales para la inducción de la remisión del brote leve-moderado de CU.
Recomendamos el uso de salicilatos orales para la inducción de la remisión del paciente con brote leve-moderado de CU a dosis mínima de 2,4 g/día y probablemente óptima ≥ 3 g/día en una dosis única diaria.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
La evidencia disponible en este escenario se evaluó en una revisión Cochrane publicada en 2016 que utilizó metodología GRADE21. Allí se incluyeron los 53 ensayos clínicos aleatorizados (ECA) publicados, realizados en 8.548 pacientes, y se evaluó la eficacia de la mesalazina en remisión y seguridad frente al placebo, así como el efecto dosis-respuesta. Dieciséis estudios se controlaron con placebo, 18 compararon mesalazina con sulfasalazina y el resto de los estudios incluidos valoró dosis-respuesta, seguridad o diferentes mesalazinas entre sí. El riesgo relativo (RR) global de fracaso en conseguir la remisión o la respuesta clínica fue de 0,86 (intervalo de confianza [IC] 95% 0,82-0,89; índice de inconsistencia [I2] = 25%; p < 0,00001).
Setenta y un por ciento de los pacientes con mesalazina no consiguió la remisión clínica, porcentaje que escala a 83% en el grupo placebo (RR 0,86; IC 95% 0,82-0,89). Se observó una tendencia dosis-respuesta de significación estadística de 2 a 2,9 g/día (RR 0,88; IC 95% 0,82-0,94; I2 = 27%; p = 0,0001) y en los grupos de más de 3 g (RR 0,83; IC 95% 0,77-0,88; I2 = 25%; p < 0,00001). Posteriormente a la publicación de la revisión sistemática, un estudio de alta calidad metodológica (ASCEND III)22 con 772 pacientes mostró que una dosis de 4,8 g/día es superior a 2,4 g/día.
En 14 ECA (2.157 pacientes) se evaluó la respuesta clínica con placebo. Hubo 42% de falta de respuesta clínica en el grupo de mesalazina frente a 65% del grupo placebo (RR 0,68; IC 95% 0,61-0,75; I2 = 47%; p < 0,00001).
En cuatro ECA se evaluó la remisión endoscópica en un total de 1.154 pacientes. Nuevamente, la mesalazina fue superior al placebo con un RR de 0,77 (IC 95% 0,67-0,89; I 2 = 42%; p = 0,0003). En este escenario, solo la dosis mayor a 3 g demostró tener significación estadística (RR 0,70; IC 95% 0,56-0,87; I2 = 51%; p = 0,001).
Al comparar el fracaso en conseguir la remisión clínica, no se observaron diferencias significativas entre la mesalazina (54%) y la sulfasalazina (58%) (RR 0,90; IC 95% 0,77-1,04), pero la mesalazina se toleró mejor (RR para un efecto adverso 0,48, IC 95% 0,36-0,63). Tampoco se encontraron diferencias cuando se compararon diferentes formulaciones de mesalazinas entre sí. Los dos ECA que utilizaron mesalazina MMX obtuvieron un RR de 0,81 (IC 95% 0,73-0,90).
Es interesante que en todos los estudios en los que se utilizó una dosis única de mesalazina en 24 h23-26, esta resultó cuanto menos tan eficaz como las dosis repartidas, tanto en la inducción de la remisión (RR 0,94; IC 95% 0,83-1,07) como en la respuesta (RR 0,74; IC 95% 0,49-1,10; p = 0,13), es decir que no se presentaron diferencias estadísticamente significativas en ninguno de los escenarios21 avalados por datos de biodisponibilidad provenientes de estudios farmacocinéticos.
En el conjunto de estudios disponibles, muy numerosos, no se observaron diferencias significativas en los efectos adversos (EA) entre los grupos placebo y los tratados con diversas dosis de mesalazina.
En esta actualización incluimos tres nuevos estudios. El primero es un metaanálisis27 publicado en 2019 donde se evaluaron ocho ECA (3.495 pacientes). El objetivo fue evaluar la eficacia y la seguridad de la mesalazina oral administrada una vez al día vs. dos veces al día en la CU de leve a moderada. El régimen de dosificación única de mesalazina para inducir la remisión clínica y endoscópica fue tan eficaz como la dosificación dos veces al día y no se encontraron diferencias significativas en los EA.
El segundo estudio es una revisión Cochrane28 publicada en 2020 que evaluó la eficacia, la respuesta a la dosis y la seguridad de la mesalazina oral en comparación con el placebo, la sulfasalazina y otras formulaciones de mesalazina para inducir la remisión en la CU activa. También se evaluó la eficacia y la seguridad de una dosis diaria de mesalazina oral vs. regímenes de dosificación convencionales (dos o tres veces al día). Se incluyeron 54 estudios con 9.612 pacientes: 71% de los pacientes con mesalazina no logró entrar en remisión clínica en comparación con 83% con placebo (RR 0,86; IC 95% 0,82-0,89; 11 estudios). También se observó una tendencia dosis-respuesta para la mesalazina. No hubo diferencia en las tasas de remisión clínica entre mesalazina y sulfasalazina ni tampoco en las tasas de remisión entre la dosificación de una vez al día y la dosificación convencional. No parece haber ninguna diferencia en la eficacia de las diversas formulaciones de mesalazina como así tampoco hubo diferencias en la incidencia de eventos adversos (EA) entre mesalazina y placebo, mesalazina una vez al día y en dosis convencionales, y las distintas formulaciones de mesalazina. Sin embargo, la sulfasalazina no se toleró tan bien como la mesalazina: 29% de los pacientes con sulfasalazina experimentaron un EA vs. 15% de los pacientes con mesalazina (RR 0,48; IC 95% 0,36-0,63).
El tercer estudio es una revisión sistemática de la literatura y metaanálisis publicado en 202129, que evaluó la eficacia y la seguridad de una marca de mesalazina oral para inducir y mantener la remisión. Los metaanálisis compararon esa marca (en tabletas, gránulos y cápsulas) con placebo y otras mesalazinas. Se identificaron 12 estudios con 3.674 pacientes tratados con esta mesalazina: 2-4 g/día fue superior al placebo en la inducción (reducción de riesgo absoluto (RRA) a las ocho semanas 14%; IC 95% 7-21%; p < 0,001) y el mantenimiento de la remisión clínica y endoscópica (RRA 6-12 meses 18%; IC 95% 4-33%; p < 0,05). Frente a otras mesalazinas no demostró presentar diferencias significativas en la inducción y el mantenimiento.
Recomendación 1.1.2 GADECCU.
Tratamiento CU (2022): salicilatos orales y rectales vs. salicilatos orales aislados para la inducción de la remisión del brote leve-moderado de CU.
Sugerimos la asociación de salicilatos orales y rectales frente a los salicilatos orales aislados para la inducción de la remisión del paciente con brote leve-moderado de CU extensa o izquierda, a dosis mínima oral de 2 g/día y tópica de 1 g/día.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: moderada.
Se dispone de tres ECA incluidos en las revisiones de Regueiro30 y Bergman31 en los que se comparó el tratamiento oral con el combinado (oral y rectal) en la CU aguda. Además, existe una revisión sistemática que incluye información observacional32. En el primer estudio33) incluyeron a 60 pacientes con CU izquierda tratados con mesalazina rectal, mesalazina oral (2,4 g/día) o su combinación. No se evaluó la remisión, pero la rectorragia desapareció a las seis semanas en 18/20 (89%) pacientes en tratamiento combinado, frente a 10/22 (46%) en tratamiento oral (p < 0,05). Además, la rectorragia cesó más rápido (p < 0,002) y los EA fueron similares. En otro estudio34 se evaluaron 130 pacientes con CU izquierda, aleatorizados a tratamiento oral (4 g de mesalazina y enema de placebo) frente a tratamiento combinado (2 g de mesalazina oral y 2 g en enema). A las seis semanas, la remisión clínica y endoscópica fue casi idéntica en ambos grupos, la velocidad de la respuesta fue similar y no hubo diferencias en los efectos secundarios. Finalmente, Marteau et al.35 compararon un tratamiento oral con 4 g de mesalazina y un enema de placebo con idéntico tratamiento oral y un enema de 1 g de mesalazina en 127 pacientes con colitis extensa. A las cuatro semanas hubo una remisión de 34% en el grupo oral y de 44% (p = 0,3) en el combinado, y a las ocho semanas hubo una remisión de 43 vs. 64% (p = 0,0256) en el combinado, sin diferencias en los EA.
Al combinar el RR de todos los estudios que comparan tratamiento combinado vs. oral, el RR es de 1,18 (0,99-1,40).
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.3 GADECCU.
Tratamiento CU (2022): salicilatos rectales para la inducción de la remisión del brote leve-moderado de CU.
Recomendamos el uso de salicilatos rectales para la inducción de la remisión del paciente con brote leve-moderado de CU izquierda a dosis mínima de 1 g/día.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Los resultados disponibles en una revisión sistemática36 muestran que hay un claro beneficio en la utilización de mesalazina tópica para inducir la remisión frente al placebo con un OR de 7,71 (4,84-12,3). Un único estudio no incluido37 confirmó que la espuma de mesalazina a dosis de 2 g/día es mejor que el placebo para obtener la remisión. Las dosis utilizadas en los estudios con supositorios variaban entre 0,5 a 1,5 g, mientras que con espuma o enemas oscilaban entre 1 y 4 g de mesalazina. No hay una evidencia clara de efecto dosis-respuesta y en un único estudio comparativo, un enema de 1 g resultó tan eficaz como el de 2 o 4 g38. No hay diferencias relevantes en cuanto a los efectos secundarios36
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.4 GADECCU.
Tratamiento CU (2022): supositorios, enemas o espumas de mesalazina para la inducción de la remisión del brote leve-moderado de CU.
Recomendamos el uso de salicilatos rectales para la inducción de la remisión del paciente con brote leve-moderado de CU izquierda a dosis mínima de 1 g/día, utilizando la forma galénica más adecuada para la extensión y el paciente.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Se dispone de tres ECA incluidos en diferentes revisiones sistemáticas30-32,36 realizados en un total de 155 pacientes, que en su conjunto demuestran que el tratamiento rectal es claramente superior al oral en la colitis izquierda más distal (proctitis). El OR global es de 4,1 (IC 95% 1,5-10,9). Los EA son similares, excepto en un estudio en el que el fármaco oral fue la sulfasalazina, que se asocia con un número relativamente importante de EA. En solo uno de los estudios se definió claramente la remisión39). El número total de pacientes incluido no es grande, pero en todos los estudios la administración rectal fue claramente más eficaz que la oral. No obstante, hay un estudio que utilizó mesalazina MMX oral y parece al menos tan eficaz como la tópica para la colitis izquierda40).
La dosis utilizada en un ECA en el que incluyeron proctitis fue de 0,4 g39 y en los otros dos ECA utilizaron enemas de 4 g, pero no se halló un claro efecto dosis-respuesta.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.5 GADECCU.
Tratamiento CU (2022): corticoides orales para la inducción de la remisión del brote leve-moderado de CU.
Recomendamos el uso de corticoides orales para la inducción de la remisión del paciente con brote leve-moderado de CU a dosis de 1 mg/kg/día.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
El único ECA disponible es el estudio de Truelove y Witts41, en el que las diferencias a favor de los corticoides (hidrocortisona en este caso) son muy claras, en cuanto a alcanzar la remisión, tanto en todo el grupo (RR 2,61, 1,58-4,31) como excluyendo a los pacientes graves (RR 2,16). Respecto a los EA, tanto la mortalidad como la morbilidad resultaron mayores en términos absolutos (aunque no alcanzaron a tener significación estadística) en el grupo placebo. La dosis utilizada por Truelove y Witts fue hidrocortisona 100 mg oral.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.6 GADECCU.
Tratamiento CU (2022): corticoides de acción tópica para la inducción de la remisión del brote leve-moderado de CU.
Sugerimos utilizar beclometasona de 5 mg/día o budesonida MMX a dosis de 9 mg/día por vía oral para la inducción de la remisión del paciente con brote leve-moderado de CU.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: moderada.
En la actualidad disponemos de dos tipos de corticoides orales de acción tópica (beclometasona y budesonida) que se analizan por separado.
En una reciente revisión sistemática que evaluó la eficacia y seguridad de la beclometasona para inducir la remisión del brote leve-moderado de CU42, se incluyeron los tres ECA revisados en la versión previa de la guía GETECCU43-45, los datos cedidos por Chiesi Farmaceutici de su ECA propio42 y un ECA más reciente publicado en 201546, que compara la beclometasona a 5 mg/día frente al corticoide sistémico (prednisona 40 mg). Estos ensayos se realizaron en un total de 888 pacientes (739 para análisis de intención de tratar) con brote leve-moderado de CU izquierda o extensa, y demostraron la eficacia de la beclometasona frente a la mesalazina tanto en la respuesta clínica (OR 1,86; IC 95% 1,23-2,82; p = 0,003) como en la remisión clínica (OR 1,55; IC 95% 1,00-2,40; p = 0,05), pero se perdió la significación estadística en la variable remisión al incluir el ECA que compara la beclometasona con la prednisona (116/370 [31,4%] vs. 109/370 [29,5%]; RR 1,30 [IC 95% 0,76-2,23]), con seguridad similar a mesalazina o prednisona.
Respecto a la budesonida, disponemos de un metaanálisis Cochrane de 201547 que incluye seis ECA que compararon la budesonida o budesonida MMX con placebo, mesalazina o corticoides clásicos. Tres ECA de moderada calidad metodológica compararon la budesonida MMX con placebo48-50 en 900 pacientes en los que la budesonida MMX fue significativamente superior al placebo para inducir la remisión clínica y endoscópica: 15 vs. 7%, respectivamente (RR 2,25; IC 95% 1,50-3,39; número necesario para tratar [NNT] de 12,5). Otro pequeño ECA51 que comparó en 32 pacientes el uso de budesonida MMX y placebo no encontró diferencias entre ambas ramas. Un ECA52 comparó budesonida clásica 10 mg/ día máximo con prednisona 40 mg y no se presentaron diferencias en la respuesta ni en la remisión endoscópica (el ensayo no evaluó la remisión clínica). Un ECA53 comparó a 343 pacientes aleatorizados a budesonida clásica (9 mg/día) con mesalazina (3 g/día). La budesonida fue significativamente inferior a la mesalazina a la hora de conseguir la remisión en ocho semanas (RR 0,72; IC 95% 0,57-0,91).
Posteriormente a este metaanálisis, se publicó otro ECA en 201754 que incluyó a 510 pacientes con CU leve-moderada no controlados a pesar de recibir dosis adecuadas de mesalazina en sus diferentes formulaciones, con un objetivo primario muy estricto (índice de actividad de la colitis ulcerosa [UCDAI] < o = a 1 con rectorragia, frecuencia de las deposiciones y apariencia mucosa 0) que nuevamente confirmó, aunque con porcentajes muy bajos, la eficacia de la budesonida MMX frente al placebo en este escenario.
Respecto a la seguridad de los corticoides de acción tópica, en 2018 se publicó una revisión sistemática que incluyó a más de 5.000 pacientes provenientes de múltiples ensayos clínicos. En esta revisión se observó que la budesonida MMX presenta significativamente menos EA relacionados con la propia utilización de corticoides en comparación con el corticoide clásico (OR 0,25; IC 95% 0,13-0,49) o la beclometasona (OR 0,35; IC 95% 0,13-1,00). No hubo diferencias al evaluar EA graves o discontinuación de los ensayos.
La evidencia agregada en esta actualización55 es un metaanálisis de moderada calidad que analizó 15 ensayos en 4083 pacientes. La budesonida MMX 9 mg/día y la mesalazina > 2,4 g/día tuvieron una eficacia similar en la inducción de la remisión clínica y endoscópica (OR 0,97; 0,59-1,60) y ambas demostraron ser superiores al placebo (OR 2,68; 1,75-4,10 y OR 2,75; 1,94-3,90, respectivamente).
Recomendación 1.1.7 GADECCU.
Tratamiento CU (2022): budesonida tópica para la inducción de la remisión del brote leve-moderado de CU.
Recomendamos la utilización de budesonida tópica a dosis mínima de 2 mg/día para la inducción de la remisión del paciente con brote leve-moderado de CU.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
La evidencia en este escenario respecto a los corticoides rectales (hidrocortisona, prednisolona, metilprednisolona y betametasona) está basada en estudios muy antiguos56,57 con un RR de 0,21 (IC 95% 0,07-0,71). Sí disponemos de nueva evidencia respecto a los corticoides de acción tópica, en concreto, respecto a la budesonida tópica. Existen dos estudios publicados en 199258 y 199859, y contamos en la actualidad con tres nuevos ensayos clínicos incluidos en una revisión sistemática60 con 711 pacientes en los que se demostró que la budesonida a dosis de 2 mg/25 mL dos veces al día durante seis semanas es más eficaz que el placebo para inducir la remisión del brote leve-moderado de CU (RR 1,83; IC 95% 1,41-2,37; p < 0,001).
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.8 GADECCU.
Tratamiento CU (2022): corticoides rectales tópicos vs. corticoides rectales sistémicos para la inducción de la remisión del brote leve-moderado de CU izquierda.
Recomendamos el uso de corticoides rectales de acción tópica antes que el de los corticoides rectales de acción sistémica para la inducción de la remisión del paciente con brote leve-moderado de CU izquierda.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
En una revisión sistemática61 se incluyeron cinco ECA en los que se compararon corticoides rectales con corticoides de acción tópica: tres ECA compararon enemas de budesonida a dosis de 2-2,5 mg con enemas de prednisolona; un ECA comparó enemas de budesonida con metilprednisolona; y un ECA comparó enemas de budesonida con enemas de hidrocortisona. El OR para la remisión clínica de estos cinco ECA fue de 0,85 (IC 95% 0,44-1,63), y no se presentaron diferencias entre ambos grupos. Tampoco fueron significativos los datos para la remisión endoscópica (OR 1,14; IC 95% 0,69-1,88) o histológica (OR 0,68; IC 95% 0,28-1,67). La supresión del eje suprarrenal (el efecto adverso más relevante en la comparación) fue menor al utilizar corticoides de acción tópica. Otros ensayos posteriores62-64 que utilizaron beclometasona, fosfato de prednisolona, budesonida e hidrocortisona confirmaron estos resultados.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.9 GADECCU.
Tratamiento CU (2022): mesalazina rectal vs. corticoides rectales para la inducción de la remisión del brote leve-moderado de CU izquierda.
Recomendamos el uso de mesalazina rectal frente a corticoides rectales para la inducción de la remisión del paciente con brote leve-moderado de CU izquierda a dosis mínima de 1 g/día.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
En un total de nueve ECA disponibles incluidos en una revisión sistemática61 en los que se compararon corticoides rectales (100-356 mg de hidrocortisona) con mesalazina rectal (1-4 g), los preparados de mesalazina resultaron más eficaces en obtener la remisión clínica, con un OR de 2,42 (IC 95% 1,72-3,41). Lo mismo se observó en las remisiones endoscópica e histológica. Hay dos ECA que compararon la mesalazina con el ácido paraaminosalicílico (4-ASA) y hubo resultados similares.
Mesalazina frente a corticoides rectales de acción tópicaEn dos ECA de alta calidad incluidos en la revisión de Marshall61 que compararon la budesonida con la mesalazina, no se encontraron diferencias (OR 0,95; IC 95% 0,43-2,10). En una revisión65 de ensayos clínicos de muy baja calidad metodológica que compararon la mesalazina con la beclometasona, no se observaron diferencias significativas, aunque la mesalazina se aproximaba a mejores resultados (RR 0,89; IC 95% 0,78-1,01).
Hay un ECA de buena calidad, pero con un número de pacientes muy limitado, que señala que la combinación de corticoides (beclometasona) y mesalazina podría tener efectos sinérgicos66.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.10 GADECCU.
Tratamiento CU (2022): tiopurinas para la inducción de la remisión del brote moderado de CU.
Sugerimos no utilizar las tiopurinas (azatioprina/6-mercaptopurina) para la inducción de la remisión del paciente con un brote moderado de CU.
Dirección de la recomendación: débil en contra. Calidad de la evidencia: baja.
En un metaanálisis67 que incluye cuatro ECA en el que se comparó la eficacia de la azatioprina/mercaptopurina frente al placebo y/o los salicilatos, no se obtuvieron diferencias significativas. Además, los estudios son heterogéneos entre sí. No obstante, existen numerosos estudios observacionales que obtuvieron tasas de remisión de 65% (IC 95% 55-75%), lo que señala una posible eficacia en esta indicación.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.11 GADECCU.
Tratamiento CU (2022): metrotrexate para la inducción de la remisión del brote moderado-grave de CU corticodependiente.
Recomendamos no utilizar metrotrexate para la inducción de la remisión del paciente con brote moderado-grave de CU corticodependiente.
Dirección de la recomendación: fuerte en contra. Calidad de la evidencia: moderada.
Se incluyó tan solo un ECA68 aleatorizado publicado por Oren69 (los otros dos ECA se excluyeron de la revisión por sus deficiencias metodológicas). En este ensayo clínico participaron 67 pacientes con CU activa (Mayo > 7), de los cuales 70% recibía corticoides a dosis variables y se los aleatorizó a metotrexate oral 12,5/semana (n = 30) o placebo (n = 37) durante nueve meses. No se encontraron diferencias en la tasa de remisión (OR 0,92; IC 95% 0,35-2,42), en el tiempo hasta obtener la remisión ni en la tasa de EA graves. En los estudios excluidos tampoco se observó una diferencia relevante.
Un ECA (Estudio METEOR)70 liderado por el Groupe d’Etude Thérapeutique des Affections Inflammatoires Digestives (GETAID) en el que aleatorizaron a 111 pacientes a metrotrexate 25 mg s.c. o i.m. frente a placebo, asociado a prednisona a dosis de 40 mg de prednisona en régimen de descenso, no se encontraron diferencias a la hora de evaluar el objetivo primario del estudio: la remisión clínica sin corticoides. En este estudio, el único objetivo estadísticamente significativo fue la remisión clínica (no endoscópica) sin corticoides, que sugiere un posible papel del metotrexate en este escenario.
Respecto a los dieciséis estudios en práctica clínica incluidos en una revisión de 201071, todos ellos con un número de pacientes participantes menor de 55, la mayoría retrospectivos y con evaluación de los resultados en 60% a más de seis meses, lo que correspondería a mantenimiento y no a inducción, los autores sugieren que el uso de metotrexate a dosis de 25 mg s.c. o i.m. puede ser una opción para el tratamiento de la CU, al igual que ocurre con los pacientes con EC. En la fase de inducción del estudio MERIT-UC72, en el que se incluyó prospectivamente a pacientes sin control con placebo asociados a 40 mg de prednisona, la mitad de los pacientes (51%) tuvo una respuesta clínica en la semana 16 sin utilizar corticoides y un tercio de ellos (29%) estaba en remisión clínica libre de corticoides.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.12 GADECCU.
Tratamiento CU (2022): tofacitinib para la inducción de la remisión del brote moderado-grave de CU.
Recomendamos el uso de tofacitinib para la inducción de la remisión del paciente con brote moderado-grave de CU a dosis de 10 mg dos veces al día durante ocho semanas.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Se han publicado tres ensayos fase 3, aleatorizados, controlados con placebo y doble ciego, con tofacitinib. Se trata de dos estudios de inducción idénticos (OCTAVE Induction trials 1 y 2)73, además de una fase abierta (OCTAVE OPEN)74. No hay estudios observacionales.
Los ensayos clínicos de inducción73 incluyeron pacientes con CU activa moderada-grave, a pesar de haber realizado un tratamiento previo convencional o anti-TNF (fallo del tratamiento previo o efectos secundarios inaceptables con al menos uno de los siguientes: corticoides orales o endovenosos, tiopurinas, infliximab o adalimumab). Ambos estudios incluyeron a pacientes con y sin fallo de la terapia convencional y anti-TNF, y muestran dichos resultados por separado, en el material suplementario. Los pacientes incluidos fueron aleatorizados a recibir como inducción tofacitinib (10 mg dos veces al día) o placebo durante ocho semanas. La variable primaria de eficacia fue la remisión en semana 8, definida de forma especialmente estricta: índice de Mayo completo ≤ a 2 sin ningún subíndice < a 1 y un índice de sangrado rectal de 0. Esto implica que se trata de una remisión clínica y endoscópica sin ningún sangrado rectal. Se evaluaron también, como variables secundarias y todas en semana 8, la respuesta y remisión clínicas, así como la eficacia endoscópica, tanto mejoría como curación mucosa (subíndice de Mayo endoscópico ≤ 1 o 0, respectivamente). Se incluyeron 598 y 541 pacientes (OCTAVE de inducción 1 y 2). La tasa de remisión (clínica y endoscópica, con subíndice de Mayo de sangrado rectal = 0) en semana 8 fue de 18,5% en los pacientes tratados con tofacitinib, frente a 8,2% en el grupo placebo (p = 0,007) en el OCTAVE 1, y de 16,6 vs. 3,6% en el grupo placebo (p < 0,001) en el OCTAVE 2. El inicio de la acción fue rápido, se observó una mejora significativa en la puntuación parcial de Mayo en la semana 2. Dos pacientes (uno en cada ensayo de inducción) fueron colectomizados. En el caso del OCTAVE 1 fue un paciente con una colitis por citomegalovirus (CMV) previa que tomaba azatioprina. La eficacia en la variable primaria y en otras secundarias no cambió en función del tratamiento –previo o no– con anti-TNF (datos en el material suplementario del artículo). En cuanto a la seguridad, en ambos estudios OCTAVE de inducción, los EA totales no fueron superiores en los pacientes tratados con tofacitinib. Sin embargo, presentaron un mayor riesgo global de infección, incluida la infección grave. Las alteraciones lipídicas fueron, en general, superiores en los pacientes tratados con tofacitinib. Es necesario mencionar que un estudio de registro en reumatología, en pacientes con riesgo vascular, ha mostrado complicaciones tromboembólicas en estos pacientes. Ante ello, la U.S. Food and Drug Administration (FDA) y la European Medicines Agency (EMA) han establecido recomendaciones específicas de uso para ese grupo de pacientes.
La nueva evidencia incluida en esta actualización75, de calidad moderada, publicada en 2019, consiste en una revisión sistemática de treinta y un metaanálisis que concluye que infliximab, adalimumab, golimumab, vedolizumab y tofacitinib fueron más eficaces que el placebo.
Recomendación 1.1.13 GADECCU.
Tratamiento CU (2022): tacrolimus rectal para la inducción de la remisión de la CU izquierda.
Sugerimos utilizar tacrolimus rectal para la inducción de la remisión del paciente con CU izquierda a dosis de 1,5 mg (3 mL de tacrolimus 0,5 mg/mL) dos veces/día durante ocho semanas.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: baja.
En las décadas de 1980 y 1990 se publicaron varios estudios abiertos no aleatorizados76-78 que describían el potencial efecto de la ciclosporina tópica en forma de enema para inducir la remisión de pacientes con CU izquierda, aunque estos resultados no se confirmaron en un ECA posterior79.
El tacrolimus (fármaco de la familia de la ciclosporina, con el mismo mecanismo de acción) ha demostrado en un ECA de elevada calidad metodológica (JADAD 5) su eficacia frente al placebo80. En este estudio se incluyó a 20 pacientes a los que se aleatorizó a tacrolimus 1,5 mg (3 mL de 0,5 mg/mL) o placebo durante ocho semanas y se obtuvo un porcentaje de 70% en la inducción de la respuesta clínica y endoscópica, y 45% en la remisión clínica, frente a 10% en la rama placebo. Esta diferencia fue estadísticamente significativa en todas las variables estudiadas. Antes de este ensayo clínico, varias series con pocos pacientes mostraron porcentajes de respuesta y remisión clínica de 70%81,82
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.14 GADECCU.
Tratamiento CU (2022): infliximab para la inducción de la remisión del brote moderado de CU.
Recomendamos el uso de infliximab para la inducción de la remisión del paciente con brote moderado de CU, a dosis de 5 mg/kg en las semanas 0, 2 y 6.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
La revisión sistemática de Gisbert et al.83, que será comentada en detalle en la inducción del brote grave, también es la base fundamental de nuestro análisis. Evaluaremos por separado las dos situaciones más comunes y problemáticas en la práctica clínica: la corticorresistencia y la corticodependencia.
Corticorresistencia: disponemos de bastantes datos que demuestran que el infliximab es eficaz para inducir la remisión y la respuesta clínica en la corticorresistencia. Así, en la revisión citada83, 52% de los 877 pacientes se clasificaron como corticorresistente. En ellos se obtuvo una tasa de respuesta al infliximab de 70% (68% en los no corticorresistentes). En los estudios Active Ulcerative Colitis Trial (ACT) en los que se utiliza una definición específica de resistencia a corticoides (falta de respuesta clínica tras 40 mg/día de prednisona oral por dos semanas, o la misma dosis intravenosa durante una semana), se observó una respuesta al infliximab en la semana 8 en 73% de los corticorresistentes frente a 63% en los no resistentes.
Corticodependencia: aunque también con algunas limitaciones (esencialmente derivadas de la dificultad de aplicar de modo estricto las diversas definiciones), en los estudios ACT se demostró un claro efecto ahorrador de corticoides. En la semana 30 del tratamiento se consiguió retirar los corticoides en 22% de los pacientes tratados con infliximab frente a 7,1% de los tratados con placebo (p < 0,05)84. Otro ECA85, aunque con muchos menos pacientes, también arrojó resultados similares. Destacamos dos estudios prospectivos del mismo grupo investigador. En el primero86 se incluyó a 126 pacientes con CU activa moderada tratados con infliximab. Se siguió a 90 de ellos prospectivamente durante 12 meses. Infliximab fue eficaz, con una tasa de remisión sin corticoides de 53 y 47% a los seis y 12 meses. Los pacientes de diagnóstico reciente con tiopurinas al inicio y tratamiento combinado mejoraron la tasa de remisión sin corticoides en el mes 12. Este mismo grupo analizó sus datos a largo plazo y los factores predictores de respuesta87. De los 126 pacientes consecutivos incluidos, en 96 se obtuvo eficacia en la inducción y se siguieron una media de 41 meses, con una respuesta clínica sostenida en 46. Se evitó la colectomía en el 77%. El tratamiento combinado aumentó la respuesta (HR 3,98; IC 95% 1,73-9,14; p < 0,0001). Predijeron colectomía tanto una mayor gravedad endoscópica basal (HR 2,77; IC 95% 1,09-7,05; p = 0,04) como no haber tomado nunca tiopurinas (HR 0,34; IC 95% 0,13-0,87; p = 0,025).
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.15 GADECCU.
Tratamiento CU (2022): adalimumab para la inducción de la remisión del brote moderado de CU.
Sugerimos utilizar adalimumab para la inducción de la remisión del paciente con brote moderado de CU a dosis de 160 mg en la semana 0 y luego 80 mg en la semana 2.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: moderada.
Los ensayos clínicos que validaron la eficacia del adalimumab en el tratamiento de los pacientes con CU moderada-grave fueron los ULTRA88,89, donde se incluyeron en total 884 pacientes, y un estudio japonés que incluyó a 274 pacientes. La remisión clínica en la semana 8 se definió como un índice de Mayo ≤ a 2 sin ningún subíndice > a 1.
En el ULTRA 1 (anti-TNF en pacientes naïve), los pacientes se aleatorizaron 1:1:1 a 160/80, 80/40 y placebo. En la semana 8 hubo remisión en 18,5% de los pacientes del subgrupo 160/80, frente a 9,2% de la rama placebo. La dosis 80/40 no fue diferente del placebo en cuanto a eficacia. En el ULTRA 2, el anti-TNF fracasó en 40% de los pacientes. Se obtuvieron tasas de remisión de 16,5% en la rama adalimumab y de 9,3% en la rama placebo (p = 0,019). Posteriormente, se publicó un tercer ensayo clínico en Japón90, realizado en pacientes naïve a anti-TNF. También se aleatorizaron en tres ramas incluyendo dosis de 80/40 y tampoco se encontraron diferencias estadísticamente significativas respecto a la remisión en semana 8 entre cualquiera de las dosis y el placebo.
Una revisión sistemática publicada en 201691 incluyó estos tres ensayos clínicos que compararon el adalimumab con placebo en este escenario y hallaron un RR a favor del adalimumab del 1,50 (IC 95% 1,08-2,09). La dosis 80/40 no fue significativamente diferente en la inducción de la remisión frente al placebo (RR 1,14; IC 95% 0,67-1,94), adalimumab vs. placebo (11,68% vs. 10,18%, p = 0,63). La tasa de colectomías no se refleja y la seguridad se evaluó después de 52 semanas en el estudio de mantenimiento.
En el escenario de la corticodependencia, 59% de los pacientes del ULTRA 2 recibía corticoides al entrar en el ensayo y 31% en la semana 16 para los pacientes en tratamiento con adalimumab, frente a 16% de los pacientes en la rama placebo (p < 0,05). En el estudio japonés90 solo se evaluó la remisión sin corticoides en la semana 52.
Respecto a los estudios en vida real, los resultados publicados son muy variables. Hay una gran heterogeneidad en los pacientes incluidos y se evaluaron los objetivos en tiempos diferentes (4, 8, 12 y 14 semanas). La primera serie, publicada en 200792, incluyó a 10 pacientes con falla a infliximab previo. Los porcentajes de respuesta y remisión a las cuatro semanas fueron de 33% (3/10) y de 10% (1/10), respectivamente. Posteriormente, la serie publicada más amplia es la española de la base de datos ENEIDA93, realizada con 263 pacientes con CU a quienes se les prescribió el tratamiento con adalimumab para este escenario de brote moderado-grave; 67% había sido tratado previamente con infliximab. Globalmente, 51% presentó respuesta clínica a las 12 semanas y no hubo diferencias estadísticamente significativas entre los pacientes que habían recibido un tratamiento previo con anti-TNF y aquellos que no (47 vs. 61%; p = 0,27). En este artículo se puede consultar una tabla que resume todos los estudios de vida real publicados hasta el año 2017, que muestran porcentajes muy variables de respuesta clínica, de entre 25 y 80%, en pacientes que no se trataron con anti-TNF antes de las semanas 8-12 y un porcentaje de remisión de entre 5 y 50%. Estos porcentajes descienden a valores de entre 30 y 60% en la respuesta clínica y de 9 y 18% para la remisión clínica en pacientes que utilizaron anti-TNF previamente. Después de 2017, solo se ha publicado un estudio italiano retrospectivo y multicéntrico (153)94 con 107 pacientes consecutivos con CU tratados con adalimumab (60% no utilizó anti-TNF previamente). Este estudio reportó un porcentaje de remisión clínica del 55% en la semana 12.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.16 GADECCU.
Tratamiento CU (2022): golimumab para la inducción de la remisión del brote moderado de CU.
Recomendamos el uso de golimumab para la inducción de la remisión del paciente con brote moderado de CU a dosis de 200 mg/100 mg en semanas 0 y 2.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Se dispone de un ECA (PURSUIT) publicado en 201495 que incluye un primer análisis fase 2 exploratorio de dosis en el que se aleatorizó a 291 pacientes en cuatro ramas: placebo, golimumab 100/50 mg, golimumab 200/100 mg, golimumab 400/200 mg en la semana 0 y 2. Se observó una tendencia dosis-respuesta por lo que se seleccionaron los dos últimos grupos para evaluar en la semana 6 la respuesta como objetivo primario. Se aleatorizó a los pacientes a recibir: 251 placebo, 253 golimumab 200/100 mg y 257 golimumab 400/200 mg en las semanas 0 y 2. Se observaron porcentajes de respuesta de 51 y 54% en las ramas de tratamiento frente a 30% en el grupo placebo.
Al evaluar los objetivos secundarios, tanto el porcentaje de remisión (de 18%), como el de la cicatrización mucosa (entre 43 y 45%) fueron estadísticamente superiores a los del grupo placebo (6,4 y 28,7%, respectivamente), y también mejoró la calidad de vida de los pacientes en los grupos de tratamiento (p = 0,001).
Se han publicado dos estudios poscomercialización fase 4 que también analizaron los porcentajes de respuesta y remisión en las semanas 6 y 14. El estudio GO-COLITIS (Reino Unido)96 incluyó a 205 pacientes naïve tratados con anti-TNF. El porcentaje de respuesta clínica fue de 68,8% y el de remisión, de 38,5%. El estudio BESMART97 incluyó a 91 pacientes (50% había utilizado previamente anti-TNF) y evaluó la cicatrización mucosa97 en la semana 14 con 40% de éxito, pero solo hay datos de 60% de los pacientes.
Dieciséis estudios prospectivos y retrospectivos de vida real con 1.471 pacientes, descritos individualmente en una reciente revisión de 201898 reportaron porcentajes similares –y no superiores– de respuesta y remisión a los del estudio PURSUIT, con la diferencia de que en estos se incluyeron pacientes en quienes había fracasado el tratamiento previo con infliximab. Así, los estudios prospectivos reportaron en las semanas 6 y 14 porcentajes de respuesta clínica y remisión de 53,8% (rango de 35 a 69,7%) y de 31,6% (rango de 14 a 51,7%), y en los retrospectivos estos porcentajes fueron de 65,7% (rango de 52 a 85,5%) y de 41% (rango de 32 a 50%).
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.17 GADECCU.
Tratamiento CU (2022): vedolizumab para la inducción de la remisión del brote moderado-grave de CU.
Recomendamos el uso de vedolizumab para la inducción de la remisión del paciente con brote moderado-grave de CU a dosis de 300 mg e.v. en las semanas 0, 2 y 6.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Un metaanálisis publicado en 201599 que incluye los tres ensayos clínicos publicados hasta el momento realizados con 901 pacientes frente a 223 pacientes tratados con placebo en este escenario concluyó que el vedolizumab es eficaz para inducir la remisión del paciente con CU grave; 41% presentó pérdida de respuesta, no respuesta o intolerancia al infliximab. Aproximadamente 50% de estos pacientes respondió al vedolizumab frente a 20 o 25% en el grupo placebo. Los porcentajes de remisión son más variables: entre 17 y 53% frente al 5 y 50% en el grupo placebo. En estos ECA se utilizaron dosis que iban desde 0,5 mg/kg hasta 10 mg/ kg y fueron eficaces globalmente para evaluar la remisión. De forma individual las dosis eficaces fueron de 2 mg/kg, 6 mg/kg (incluyendo aquí a los pacientes que se trataron con dosis fijas de 300 mg) y 10 mg/kg en la respuesta clínica. No se observaron diferencias significativas respecto a los EA entre los grupos placebo y los tratados con diversas dosis de vedolizumab. El efecto adverso más frecuente en ambos grupos fue el empeoramiento del brote de CU.
Respecto a la utilización previa de anti-TNF, un análisis post hoc del GEMINI 1100 –único ECA que permite la inclusión de estos pacientes– concluyó que los 464 pacientes sin tratamiento previo con anti-TNF presentaron diferencias absolutas mayores en eficacia en la semana 6 frente a los 367 pacientes cuyo tratamiento previo con anti-TNF había fracasado (pérdida de respuesta, no respuesta o intolerancia), aunque los riesgos relativos fueron iguales en ambos grupos. Los porcentajes de respuesta al vedolizumab y el placebo fueron de 53 vs. 26%, respectivamente, en el grupo de pacientes naïve a anti-TNF (diferencia absoluta [DA] 26,4%; IC 95% 12,4-40,4; RR 2,0; IC 95% 1,3-3,0); estos porcentajes fueron de 39 vs. 2,6%, respectivamente, en el grupo de pacientes cuyo tratamiento con anti-TNF había fracasado (DA 18,1%; IC 95% 2,8-33,5; RR 1,9; IC 95% 1,1-3,2).
Por otra parte, otro metaanálisis101 que incluye veintiséis estudios de práctica clínica en CU reportó porcentajes de remisión de 24% en la semana 6 (IC 95% 13-41%) y porcentajes de respuesta de 43% (IC 95% 38-49%). Tampoco se observaron diferencias en los EA. Al analizar a los pacientes naïve a anti-TNF, la remisión clínica en la vida real fue de 54% en la semana 14. Un estudio comparativo directo entre vedolizumab y adalimumab (VARSITY)102, en el que ambos se utilizaron según las pautas de dosis recomendadas en la ficha técnica, demostró que el vedolizumab es más eficaz que el adalimumab tanto para obtener la remisión como para la mejoría endoscópica, con EA equivalentes.
En esta actualización sumamos la evidencia derivada de dos nuevos estudios. El primero es un ECA103 de moderada calidad que incluyó solo a la población japonesa con CU moderada o severa. Un total de 246 pacientes participó en la fase de inducción: las tasas de respuesta clínica en la semana 10 fueron de 39,6 y de 32,9% en los grupos de vedolizumab y placebo, respectivamente (OR ajustado = 1,37; IC 95%: 0,78-2,40; p = 0,272). Estos datos fueron consistentes con los informados para el estudio GEMINI 1.
Otro ECA104 de alta calidad que surgió de los datos del estudio VARSITY incluyó a 769 pacientes con CU moderada o severa. Se observó que el vedolizumab inducía una remisión histológica mayor que el adalimumab en la semana 14 (Geboes: 16,7% vs. 7,3%, diferencia 9,4%; IC 95% 4,9-13,9%; p < 0,0001; Robarts Histopathology Index (RHI): 25,6 vs. 16,1%, diferencia 9,5% [IC 95%, 3,8%-15,2%], p = 0,0011) en general y también cuando se evaluó por separado a los pacientes anti-TNF naïve y fallados.
Recomendación 1.1.18 GADECCU.
Tratamiento CU (2022): ustekinumab para la inducción de la remisión del brote moderado-grave de CU.
Recomendamos el uso de ustekinumab para la inducción de la remisión del paciente con brote moderado-grave de CU, a dosis de 6 mg/kg e.v. en la semana 0, seguido de una dosis s.c. de 90 mg en la semana 8.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
En CU se ha publicado un ensayo fase 3, aleatorizado, controlado con placebo y doble ciego, con una fase de inducción, seguido de un estudio de mantenimiento en los pacientes que respondieron a la inducción. No hay publicadas revisiones sistemáticas ni estudios observacionales.
La fase de inducción105 incluyó a pacientes con CU moderada a grave (definida como un índice de Mayo total entre 6 y 12; y con un subíndice de 2 o 3 en el componente endoscópico del índice [lectura central]) que hubieran tenido una respuesta inadecuada o efectos secundarios inaceptables con el tratamiento convencional, la terapia anti-TNF o el vedolizumab. Los pacientes incluidos fueron aleatorizados a recibir como inducción (en la semana 0), en una proporción 1:1:1, una infusión única de ustekinumab a dosis fija de 130 mg o basada en el peso (aproximadamente 6 mg/kg), o placebo. Se definió la eficacia de la inducción en la semana 8. La variable primaria de eficacia fue la remisión, entendida como una Mayo completo ≤ a 2 y ningún subíndice > 1. Las variables de respuesta secundaria principales fueron, en esa misma semana 8, la mejoría endoscópica (subíndice de Mayo endoscópico de 0 o 1), la respuesta clínica y la calidad de vida. También se analizó, como variable primaria alternativa, la remisión, pero se excluyó el componente de valoración global del médico del índice de Mayo (número absoluto de deposiciones de tres o menos, con un subíndice de sangrado rectal de 0, y un subíndice endoscópico de 0 o 1). También se analizó la mejoría y la curación endoscópica y los biomarcadores en sangre y heces.
Participaron 961 pacientes en el estudio (322, 320 y 319 en los grupos ustekinumab 130 mg, ustekinumab 6 mg/kg y placebo, respectivamente). En la semana 8, la remisión alcanzada en los grupos tratados con ustekinumab fue superior a la del grupo placebo (ustekinumab 130 mg 15,6% [50 de 320 pacientes]), ustekinumab 6 mg/kg 15,5% (50 de 322), placebo 3% (17 de 319) (p < 0,001 para ambos grupos tratados con ustekinumab respecto a placebo). Cuando se excluyó de la definición la valoración global del médico, los resultados fueron muy similares: 16,6% (53 de 320 pacientes) y 18,9% (61 de 322), frente a 6,3% (20 de 319), respectivamente (nuevamente, p < 0,001 para las comparaciones con placebo). Los resultados de las variables secundarias fueron similares e incluyeron la mejoría endoscópica e histológica. En cuanto a la seguridad, en la fase de inducción no hubo diferencias con el placebo. Los porcentajes de pacientes con al menos un efecto secundario en los grupos ustekinumab 130 mg, ustekinumab 6 mg/kg y placebo fueron de 41,4, 50,6 y 48%, respectivamente. Los porcentajes de al menos un efecto adverso serio fueron de 3,7, 3,4, y 6,9%, respectivamente.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.19 GADECCU.
Tratamiento CU (2022): aféresis para la inducción de la remisión del brote moderado de CU corticodependiente.
Sugerimos no utilizar aféresis para la inducción de la remisión del paciente con brote moderado de CU corticodependiente.
Dirección de la recomendación: débil en contra. Calidad de la evidencia: baja.
Los datos proceden del único estudio aleatorizado ciego106 y no confirman la eficacia de la aféresis. En 2015, se publicó un análisis post hoc107 de este ensayo en el que solo se incluyó a los pacientes en lo que la histología indicaba actividad inflamatoria. En este nuevo análisis sí se encontraron diferencias significativas en el porcentaje de remisión de aféresis con la rama placebo en la semana 12: 23,9% (11/46) vs. 0% (0/17) en el grupo placebo (p = 0,0275).
Otros estudios no ciegos, pero aleatorizados y observacionales108, señalan que, en pacientes corticodependientes, tras la aféresis puede seguir una respuesta clínica.
Posteriormente se publicaron otros dos estudios aleatorizados: el primero es un estudio sueco109 con un método de aféresis diferente, que incluyó a 23 pacientes. No se encontraron diferencias en comparación con el placebo. El segundo ensayo clínico aleatorizado publicado es el estudio español ATTICA110, que incluyó a 125 pacientes corticodependientes y los aleatorizó a aféresis con una frecuencia de una sesión a la semana durante nueve semanas, asociada a prednisona durante dos semanas a dosis de 40 mg, vs. prednisona 40 mg durante dos semanas aislada y un descenso progresivo de corticoides a partir de la semana 2. Tampoco se encontraron diferencias en el porcentaje de remisión o en la respuesta en la semana 12.
Respecto a los resultados de los estudios de práctica clínica europeos111,112,113, se han publicado porcentajes de remisión clínica hasta en el 30 y el 50% de los pacientes y porcentajes de respuesta hasta en el 45 y el 68%.
Los dos estudios de práctica clínica japoneses, el primero publicado en 2013114 y el segundo publicado en 2014115, vuelven a tener las mismas deficiencias metodológicas que los publicados antes de 2013: definiciones laxas, inclusión de pacientes graves no ingresados, falta de definición de los tiempos de respuesta. Aun así, el registro publicado en 2014 incluyó a más de 800 pacientes con CU y registró porcentajes de remisión del 69%. La recomendación actual de dos sesiones semanales se basa en los resultados de este estudio, ya que en el análisis multivariante esta decisión fue significativamente más eficaz que la realización de una sesión semanal. De este modo, se realizaron entre cinco y diez sesiones por paciente que confirmaron los datos de 2009115.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.1.20 GADECCU.
Tratamiento CU (2022): trasplante de materia fecal para la inducción de la remisión del brote leve-moderado de CU.
Sugerimos no utilizar el trasplante fecal para la inducción de la remisión del paciente con brote leve-moderado de CU.
Dirección de la recomendación: débil en contra. Calidad de la evidencia: baja.
Se han publicado tres revisiones sistemáticas en 2016116, 2017117 y 2018118, que incluyen los cuatro ECA publicados. Aunque la última de ellas es de 2018, se tomó como base de este análisis la revisión sistemática de 2017117, ya que posee mejor calidad metodológica y debido a que la más reciente118 mezcla EC y CU en adultos y población pediátrica. Esta revisión incluye todos los ECA119 y 14 estudios de cohortes no controlados. Existen marcadas diferencias en los protocolos de los estudios, hecho que hace más difícil extraer conclusiones y recomendaciones firmes.
Los cuatro ECA incluidos en la revisión sistemática de Constello fueron controlados con placebo, incluyeron a pacientes con CU activa generalmente leve a moderada (se utilizaron diferentes índices de evaluación de la gravedad) y presentaron actividad confirmada objetivamente por endoscopía. Dos usaron heces autólogas como placebo y otros dos utilizaron agua. Los estudios fueron heterogéneos en sus criterios de inclusión (aunque siempre se realizaron en pacientes con CU activa comprobada por endoscopia, refractarios a distintos tratamientos) y diseño, empelaron diferentes rutas de administración, protocolo, evaluación de la respuesta y seguimiento (variable de 7 a 12 semanas). En todos los estudios la aleatorización fue 1:1 y se mantuvo el tratamiento previo (que a veces incluyó inmunomoduladores y/o biológicos) en dosis estables. En total en los cuatro ensayos se incluyó a 277 pacientes con CU (140 TMF y 137 placebo) y participaron entre 50 y 81 pacientes por estudio. La eficacia se evaluó mediante criterios clínicos y endoscópicos, con diferentes definiciones. En su metaanálisis se obtuvieron los siguientes resultados: a) remisión (incluye endoscopia) conseguida en 39/140 (28%) pacientes en el grupo TMF vs. 13/137 (9%) pacientes tratados con placebo (OR 3,67; IC 95% 1,82-7,39; p < 0,01]); b) respuesta clínica: 69/140 (49%) pacientes tratados con TMF vs. 38/137 (28%) de los grupos placebo (OR 2,48; IC 95% 1,18-5,21; p = 0,02) y c) remisión endoscópica (definida como un Mayo endoscópico = 0) lograda en 20/140 (14%) pacientes tratados con TMF en comparación con 7/137 (5%) de los que recibieron placebo (OR 2,69; IC 95% 1,07-6,74; p = 0,04). En cuanto a la seguridad, el EA grave más común fue el empeoramiento de la colitis, que se produjo en 3/140 pacientes en los grupos TMF (con 1 colectomía) y en 4/137 pacientes en los brazos tratados con placebo.
Además, la revisión sistemática incluye 14 estudios de cohortes con 168 pacientes, algunos con EC que se excluyeron en el análisis y algunos de edad pediátrica. En todos ellos la CU estaba activa, pero con una gravedad variable, generalmente leve, pero en ocasiones grave. El procedimiento del TMF también fue diferente en los estudios (en la forma de administración, el número, si hubo antibióticos previos o no). En general, salvo en un solo estudio, el tratamiento para la EII se mantuvo durante el TMF. El seguimiento también varió entre uno y 72 meses. La forma de evaluar los resultados no fue homogénea, pero lo habitual fue analizar la eficacia como remisión clínica, con diferentes definiciones. La remisión se obtuvo en 39 de 168 pacientes (24%; IC 95% 11-40%). También se evaluó la respuesta clínica y, en un subgrupo, la eficacia endoscópica.
Existen dos estudios observacionales prospectivos no incluidos en la revisión sistemática120,121, ambos de 2017. Uno de ellos usó TMF de dos donantes y evaluó la diversidad bacteriana; el otro se realizó en pacientes refractarios al tratamiento, con la cirugía como siguiente opción. En ambos el TMF se mostró como una opción prometedora.
La nueva evidencia agregada surge de estudios de baja calidad metodológica. Un estudio multicéntrico abierto122 de 2021 les asignó a 45 pacientes con CU activa izquierda (puntuación de Mayo de 4 a 10) enemas de TMF o de mesalazina. El criterio principal de valoración del estudio fue la remisión clínica, con un Mayo total ≤ 2 en la semana 12 sin subpuntuación > 1. Hubo 12 pacientes que recibieron TMF (57%) y ocho (38%) pacientes con mesalazina que lograron el criterio principal de valoración del estudio.
Una revisión sistemática y metaanálisis de 2019123 incluyó 60 estudios, de los cuales 36 pudieron sintetizarse en los análisis cuantitativos. Los metaanálisis de seis ensayos controlados mostraron diferencias significativas a favor del TMF en comparación con el placebo en la remisión clínica (RR 1,70; IC 95% 1,12-2,56) y la respuesta clínica (RR 1,68; IC 95% 1,04-2,72). Se encontró una remisión clínica general de 37%, una respuesta clínica general de 54% y una prevalencia de EA de 29% para los estudios de intervención. La materia fecal congelada y los donantes universales se relacionaron con mejores resultados.
Un ECA124 de 2019 incluyó a 73 pacientes con CU leve a moderada que fueron aleatorizados para recibir una mezcla de TMF de donantes o TMF autólogo. El resultado primario fue la remisión de la CU sin esteroides, definida como una puntuación Mayo total de dos con una puntuación Mayo endoscópica de uno o menos en la semana 8, que se logró en 12 de los 38 participantes (32%) que recibieron TMF de donantes en comparación con tres de los 35 (9%) que recibieron TMF autólogo (DA 23%; IC 95% 4-42%).
Una revisión sistemática y metaanálisis125 publicada en 2020 valoró el efecto de la selección de donantes, los procedimientos de heces y el pretratamiento con antibióticos en la eficacia y la seguridad de la CU tratada con TMF. Se incluyeron 37 estudios (siete ECA, cinco estudios controlados y 25 estudios de cohortes no controlados) con un total de 959 pacientes con CU. En estudios de cohortes controlados y ECA, TMF tuvo un beneficio significativamente mayor que el placebo (OR 3,4; IC 95% 2,2-5,2; p < 0,001). Además, la administración de TMF a través del tracto gastrointestinal inferior fue más eficaz para lograr remisión clínica que a través del tracto gastrointestinal superior (44,3 vs. 31,7%). La tasa de remisión también fue mayor cuando se superó la dosis total de heces de 275 g frente a menos de 275 g (51,9 vs. 29,5%). En general, la incidencia de EA graves del TMF fue de 5,9%. No hubo diferencias significativas entre donantes únicos y múltiples, muestras de heces frescas y congeladas, o respecto a si se administró o no tratamiento antibiótico antes del TMF.
Otra revisión sistemática126 y metaanálisis publicado en 2021 evaluó la eficacia y la seguridad del TMF en pacientes con CU activa. Se incluyeron cinco ECA con 292 pacientes. El TMF se asoció a una mayor remisión clínica combinada con remisión/respuesta endoscópica. No hubo diferencias estadísticamente significativas en los casos graves ni en los EA con TMF en comparación con los controles (RR 0:98, IC 95% 0,93-1,03).
Recomendación 1.1.21 GADECCU.
Tratamiento CU (2022): probióticos para la inducción de la remisión del brote leve-moderado de CU.
Recomendamos no utilizar probióticos para la inducción de la remisión del paciente con brote leve-moderado de CU.
Dirección de la recomendación: fuerte en contra. Calidad de la evidencia: baja.
Una revisión sistemática y metaanálisis publicado en 2017 en el Reino Unido127 incluyó ocho ECA de pacientes con brote leve-moderado, pero también de cualquier gravedad (siete comparados con placebo y doble ciegos y un ECA comparado con mesalazina). No se encontraron diferencias en el porcentaje de remisión evaluado en las semanas 8-12. En los ECA se utilizaron diferentes preparados de probióticos (VSL#3, E. Nissle, otras combinaciones) y diferentes vías de administración (oral, rectal), con diferente gravedad de los brotes, diferentes definiciones de remisión y también se permitieron diferentes tratamientos asociados (corticoides, inmunomoduladores, etc.). Solo cuando analizan por separado los tres ECA que utilizan VSL#3, se demuestra la superioridad de este probiótico frente al placebo en no fracaso de remisión (RR 0,74; IC 95% 0,63-0,87). No se observó heterogeneidad en los estudios con un NNT de 5 (IC 95% 4-10). En cuanto a los EA, los diferentes preparados de probióticos son seguros y no presentaron diferencias con placebo o mesalazina.
La nueva evidencia sumada en esta actualización corresponde a cuatro trabajos. Una revisión sistemática128 y metaanálisis publicado en 2019 incluye 15 estudios que evaluaron la eficacia y la seguridad de los probióticos junto con mesalazina en pacientes con CU. La mesalazina y los probióticos tuvieron una mejor eficacia clínica que la mesalazina sola (≤ 8 semanas: RR 1,12; IC 95% 1,07-1,18; p < 0,0001; > 8 semanas: RR 1,25; IC 95% 1,11-1,41; p = 0,0003). En las puntuaciones de los síntomas clínicos, el índice de actividad de la enfermedad y el puntaje endoscópico, los pacientes con CU que recibieron mesalazina y probióticos tuvieron una diferencia significativa en comparación con los pacientes que recibieron mesalazina sola (DM −2,02; IC 95% -3,28−-0,76, p = 0,002; DM −1,20; IC 95% -1,76−-0,65; p < 0,001; MD -0,42; IC 95% -0,61−-0,23; p < 0,0001, respectivamente). No hubo diferencias estadísticamente significativas entre los dos grupos respecto a los EA (RR 0,88; IC 95% 0,54-1,43; p = 0,60)
Un ECA publicado en 2020129 incluyó a 60 pacientes con CU leve a moderada y comparó Lactocare® como suplemento de la terapia estándar con placebo. A las ocho semanas se observó una disminución significativa del Simple Clinical Colitis Activity Index (SCCAI) medio en el grupo de intervención (4,56 ± 2,56) frente al grupo placebo (6,54 ± 2,47) (p < 0,05), y una respuesta al tratamiento en 64,3% del grupo de tratamiento vs. el 47% del grupo placebo (p = 0,18).
Una revisión Cochrane130 de 2020 evaluó la eficacia de los probióticos en comparación con placebo o tratamiento médico estándar (mesalazina, sulfasalazina o corticosteroides) para inducir la remisión en pacientes con CU activa. Se incluyeron 14 estudios (dos de ellos con población pediátrica), con 865 participantes con CU leve a moderada. Los estudios compararon probióticos con placebo, probióticos con mesalazina y una combinación de probióticos y mesalazina en comparación con mesalazina sola. Los probióticos mostraron inducir la remisión clínica en comparación con el placebo con un RR de 1,73 (IC 95% 1,19-2,54), pero no hubo diferencia significativa al compararlos con mesalazina (un solo estudio), con un RR: 0,92 (IC 95% 0,73-1,16). Un solo estudio con baja evidencia de certeza mostró que la combinación de probióticos con mesalazina mejoró levemente la inducción de la remisión en comparación con mesalazina sola con un RR de 1,22 (IC 95% 1,01-1,47).
Una revisión sistemática131 y metaanálisis publicado en 2021 evaluó el tratamiento con probióticos para inducir y/o mantener la remisión de la EII. Se incluyeron 10 ECA, con un total de 777 pacientes con CU y EC. En la CU, la eficacia para inducir la remisión fue mayor en el grupo que recibió probióticos vs. el grupo placebo (RR 1.47; IC 95% 1.09-1.98, p = 0,01).
La evidencia agregada sugiere que los probióticos pueden ser mejores para inducir la remisión en el brote leve a moderado comparados con placebo. Sin embargo, la baja calidad de los estudios limita las conclusiones debido al pequeño tamaño de las muestras, la variabilidad en el tipo de probiótico y las diferentes dosis estudiadas. Por lo tanto, no es posible sacar conclusiones sólidas sobre la eficacia de los probióticos como monoterapia en la inducción de la remisión en el brote leve-moderado de CU. Se necesitan estudios mejor diseñados y con más participantes.
Inducción de la remisión en el paciente con brote leve- moderado de CUComentarios GADECCUEl arsenal terapéutico que habitualmente se utiliza como punto de partida para inducir la remisión en la mayor parte de los brotes leves a moderados son los salicilatos, los corticoides de acción tópica y los corticoides sistémicos. Además, se puede elegir entre la vía rectal, la oral y una combinación de ambas.
La figura 1 sugiere un algoritmo, si partimos de un brote leve, la adopción de medidas terapéuticas se vuelve más agresivas de forma progresiva y secuencial. Sin embargo, de acuerdo con los antecedentes clínicos del paciente y la gravedad del brote, se puede comenzar el esquema terapéutico directamente en un punto mucho más avanzado.
Consideraciones respecto al uso de salicilatosEn las proctitis y probablemente en la CU izquierda, la utilización de salicilatos rectales para inducir la remisión es más eficaz que los salicilatos orales.
Existen diversas formulaciones de salicilatos rectales (supositorios, espuma, enema). La elección de una u otra formulación depende de qué presentación acepte el paciente y la extensión de su enfermedad. En general los supositorios son útiles en la afectación rectal, la espuma en caso de localización rectosigmoidea, y el enema en lesiones que abarquen hasta el ángulo esplénico.
No es posible recomendar una posología única ya que los estudios son escasos. Debe priorizarse la indicación en función de las posibilidades de que el paciente logre una buena adherencia. Se dispone de supositorios (de 500 mg y de 1 g), enemas (de 1 y 4 g) y espumas (de 1 g).
En el caso de la colitis izquierda y/o extensa, la dosis estándar de mesalazina por vía oral que se sugiere para inducir la remisión debe ser de 3 g o más/día.
Si bien no hay diferencias significativas entre la mesalazina y la sulfasalazina cuando se compara el fracaso en conseguir la remisión clínica, la mesalazina puede tolerarse mejor. Tampoco hay diferencias cuando se comparan diferentes mesalazinas entre sí.
En cuanto a la forma de administración, una dosis única diaria es al menos tan eficaz como las dosis repartidas y le facilita al paciente cumplir con el tratamiento.
Tratamiento combinado con salicilatosCon los datos revisados, creemos que se debe ofrecer al paciente el tratamiento combinado (oral y rectal), sobre todo si los síntomas rectales son intensos. Sin embargo, dada la especial incomodidad de la vía rectal y la escasa evidencia, la opinión del paciente es importante. Además, hay que tener en cuenta el costo de estos compuestos y su cobertura desigual por parte de los sistemas de salud en nuestro país.
Consideraciones sobre el uso de corticoidesEn Argentina, la meprednisona es el corticoide más utilizado y nuestros expertos recomiendan una dosis inicial de entre 40-60 mg al día. Para ajustar las dosis de otros corticoides debemos tener en cuenta las equivalencias de potencia entre ellos y la vía de administración, que puede hacer variar la biodisponibilidad muy significativamente.
La dosis inicial se mantiene habitualmente durante una a dos semanas, aunque dependiendo de la respuesta puede ser aceptable desde una semana hasta cuatro. Cuando se reduce la dosis hay diversas pautas de descenso paulatino. Lo más habitual es reducir 10 mg de la dosis diaria del corticoide cada semana hasta llegar a 20 mg al día (algunos expertos recomiendan sostener esta dosis de 20 mg al día por tres a cuatro semanas) y a partir de ahí, continuar el descenso de a 4 mg por semana hasta su suspensión. La duración total del tratamiento es de ocho a 12 semanas. No está justificado, habitualmente, mantener el tratamiento más de tres meses sin haber iniciado un tratamiento alternativo.
Considerando tanto la eficacia como los EA, cuanto más grave sea el brote, más precozmente se debe plantear el uso de corticoides. En cambio, en el extremo más leve, probablemente los salicilatos son los fármacos más convenientes y se puede esperar entre cuatro y ocho semanas para su indicación. En el extremo opuesto, en aquellos brotes moderados, el uso de corticoides puede plantearse incluso desde el principio.
Corticoides de acción tópica por vía oralLos corticoides orales de acción tópica como la beclometasona (no disponible en nuestro país) y la budesonida MMX parecen ser eficaces en un subgrupo de pacientes que, si bien no ha entrado en remisión con la mesalazina, presenta una gravedad del brote dentro del rango «moderado» que permite intentar estos corticoides antes de utilizar los sistémicos, cuya utilización conlleva un aumento de efectos secundarios. La dosis mínima eficaz de beclometasona es 5 mg al día durante un mes y de budesonida MMX 9 mg al día durante aproximadamente ocho semanas. Cabe aclarar que la budesonida oral clásica no parece tener ningún papel en el tratamiento de los pacientes con CU.
Los corticoides rectales constituyen una opción de segunda elección frente a la mesalazina rectal. Si bien existen preparados comerciales de budesonida (enemas y espumas), dado el alto costo de estas medicaciones, es posible preparar enemas en forma artesanal utilizando soluciones de budesonida, hidrocortisona o meprednisona.
Inducción de la remisión del paciente con brote moderado de CU corticodependienteDefinimos la corticodependencia como la reaparición de síntomas cuando se disminuye la dosis de corticoides por debajo de 10 mg al día de prednisona (o equivalente), luego de tres meses de iniciado el tratamiento corticoideo. También se define como la recidiva de los síntomas durante los tres meses posteriores a la suspensión de los corticoides. En este escenario, debe plantearse el reemplazo de los corticoides por inmunosupresores o biológicos con el objetivo de controlar la actividad de la enfermedad a largo plazo.
La elección del medicamento de primera línea va a depender no solo de la eficacia de cada una de las drogas, sino también de las comorbilidades, la edad, los factores predictores de mala evolución, las manifestaciones extraintestinales, los costos y las preferencias del paciente.
La elaboración del algoritmo se realizó con base en la eficacia, la disponibilidad y la persistencia de la respuesta de los diferentes fármacos a utilizar. No se tuvo en cuenta el factor económico, aunque claramente puede influir en la práctica clínica a la hora de tomar una decisión.
Consideraciones con respecto al uso de tiopurinasDada su lentitud de acción (media de tres meses), las tiopurinas no son una buena elección para la de la CU.
Consideraciones con respecto al uso tofacitinibLos estudios pivotales han demostrado que el tofacitinib es eficaz en el tratamiento de inducción de la CU en dosis de 10 mg dos veces al día. Es un fármaco oral y de rápido comienzo de acción, lo que supone una ventaja terapéutica. Podría ser especialmente eficaz en pacientes en quienes ha fallado el tratamiento biológico, dado que su eficacia es independiente de la exposición previa a anti-TNF.
En algunos pacientes puede observarse un retraso en la respuesta inicial al tofacitinib. En el estudio OCTAVE, a los pacientes que no respondieron a las ocho semanas de inducción con 10 mg/12 horas se les extendió la dosis de inducción por ocho semanas. Se observó 52,2% adicional de respuesta clínica132. En la práctica clínica, una estrategia posible es extender la utilización de la dosis de inducción (10 mg cada 12 horas) durante ocho semanas adicionales. Esto debe valorarse considerando el perfil de efectos secundarios y los costos.
Algunas precauciones con respecto a su utilización
Puede aumentar, de forma dosis dependiente, la posibilidad de tromboembolismo venoso en pacientes con factores de riesgo. Por ello, en estos pacientes se recomienda sopesar cuidadosamente los riesgos y beneficios con relación a las alternativas terapéuticas, así como utilizar las dosis de 10 mg/12 horas el menor tiempo posible.
También se asocia con un mayor riesgo de infección por virus herpes (sobre todo herpes zóster), especialmente si se usan dosis altas y en grupos concretos de pacientes (mayores de 65 años, personas con antecedentes de diabetes mellitus y otros). Para minimizar este riesgo, se recomienda la consulta con infectología, idealmente antes de iniciar el tratamiento, para definir la estrategia de inmunización.
Los resultados preliminares del estudio ORAL Surveillance133 muestran un incremento en la incidencia de eventos adversos cardiovasculares mayores y de neoplasias malignas (excluyendo el cáncer de piel no melanoma) en los pacientes tratados con tofacitinib en comparación con los tratados con un anti-TNF. Por este motivo, pacientes mayores de 65 años, fumadores o exfumadores y aquellos con factores de riesgo cardiovascular adicionales o de desarrollar neoplasias no deberían recibir tratamiento con tofacitinib a menos que no exista otra alternativa terapéutica disponible (alertas EMA y FDA).
Consideraciones con respecto al uso de drogas anti-TNFEn cuanto a la elección del anti-TNF a utilizar, infliximab y golimumab tienen un nivel de evidencia alta y recomendación fuerte a favor en este escenario específico. También puede utilizarse adalimumab, aunque con recomendación débil a favor.
Basados en las conclusiones del metaanálisis en red de Singh, el infliximab representa la mejor alternativa para inducir la remisión en pacientes que no han estado previamente expuestos a anti-TNF134. A pesar de su eficacia, se ha observado una pérdida de respuesta en el mantenimiento hasta en 50% de los pacientes que habían presentado respuesta en la inducción (falla secundaria)135. En este mismo trabajo, ustekinumab y tofacitinib fueron las opciones más eficaces para inducir la remisión clínica en los pacientes con exposición previa a anti-TNF134.
Con respecto a las moléculas biosimilares, en Argentina se dispone de infliximab y de adalimumab, y ambas han probado su eficacia y seguridad. Reconocemos la importancia de su introducción en el mercado farmacéutico argentino para aumentar el acceso de más pacientes con EII a terapias biológicas efectivas y disminuir el gasto en medicamentos del sistema de salud. Sin embargo, la sustitución automática no debe realizarse, ya que se trata de una acción tomada sin el consentimiento del médico prescriptor y el paciente. Desaconsejamos los cambios múltiples entre producto de referencia y biosimilar, y los cambios entre biosimilares de un mismo producto de referencia en pacientes con EII (https://www.gadeccu.org.ar/2020/09/23/posicionamiento-sobre-el-uso-de-biosimilares).
Consideraciones con respecto al uso de vedolizumabLa respuesta a la inducción con esta droga es claramente superior en los pacientes que no fueron tratados previamente con anti-TNF, por lo cual podría considerarse como alternativa de primera línea para el tratamiento del brote moderado a grave de CU. Además, cuenta con un excelente perfil de seguridad. Debe tenerse en cuenta, sin embargo, que el espectro de la indicación no incluye a pacientes hospitalizados refractarios al corticoide e.v. El agregado de un inmunomodulador al vedolizumab no parece mejorar los resultados en la fase de inducción.
Consideraciones con respecto al uso de ustekinumabUstekinumab es un fármaco eficaz para inducir la remisión en la CU, tiene un buen perfil de seguridad y baja inmunogenicidad, hecho que permite utilizarlo en monoterapia. Es eficaz tanto en primera como en segunda línea. En pacientes previamente expuestos a anti-TNF que han experimentado falla primaria, secundaria o intolerancia, se sugiere utilizar ustekinumab o tofacitinib para inducir la remisión en lugar de otras drogas (anti-TNF y vedolizumab).
Inducción de la remisión del paciente con brote moderado de CU corticorresistenteEn cuanto a la elección de las drogas utilizadas, caben las mismas consideraciones que se realizaron respecto a la corticodependencia. En este escenario cobra mayor importancia el tiempo de inicio de acción de cada droga de acuerdo con la severidad del brote.
Cabe resaltar que tanto en la corticorrefractariedad como en la corticodependencia se debe considerar la posibilidad de recurrir a la cirugía electiva como opción de tratamiento, sobre todo si hay dificultad para acceder a tratamientos alternativos que permitan suspender los corticoides en un tiempo prudencial.
Consideraciones sobre el TMFEs necesario contar con estudios más rigurosos y un mayor número de pacientes para dar una indicación clara con relación al TMF. La modulación de la microbiota probablemente represente en el futuro una línea de tratamiento en la CU activa. Por el momento, el TMF debe ser realizado en el contexto de protocolos de investigación.
Inducción de la remisión en el brote grave de CUInducción de la remisión en el paciente con brote grave de CURecomendación 1.2.1 GADECCU.
Tratamiento CU (2022): corticoides para la inducción de la remisión del brote grave de CU.
Recomendamos el uso de corticoides intravenosos para la inducción de la remisión del paciente con brote grave de CU a dosis equivalente a 1 mg/kg al día de prednisona.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
Disponemos de una revisión sistemática136 de alta calidad metodológica en la que se revisaron los ECA disponibles realizados en un total de 149 pacientes, junto con diversos estudios observacionales sobre un total de 1991 pacientes. Solo hemos identificado un estudio relevante posterior137, que comparó la administración en perfusión continua frente a la administración en bolo sin encontrar diferencias. Dado que los grupos de pacientes son muy heterogéneos, llama la atención que el resultado final del tratamiento con corticoides haya sido tan homogéneo. Son eficaces para inducir la remisión, con una dosis media de 68 ± 13 mg al día de prednisona o equivalente (rango 40 a 100, con solo un estudio por debajo de 60 mg al día) y una tasa de remisión próxima a 70%. Visto desde otra perspectiva, a pesar del uso de corticoides, 30% (IC 95% 23-37%) de los pacientes precisó una colectomía (44/149) en los ECA y 537/1.842 (IC 95% 27-31%) en los estudios observacionales.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.2.2 GADECCU.
Tratamiento CU (2022): ciclosporina para la inducción de la remisión del brote grave de CU.
Recomendamos el uso de ciclosporina para la inducción de la remisión del paciente con brote grave de CU resistente a corticoides, a dosis inicial de 2 mg/kg al día e.v. La dosis puede adaptarse hasta un máximo de 4 mg/kg al día e.v., en función de la respuesta, los efectos adversos y ajustando los niveles plasmáticos de fármaco entre 150 y 350 ng/mL.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
La ciclosporina es eficaz para inducir la remisión de la CU grave corticorresistente. Los ensayos controlados con placebo son escasos, pero están apoyados por estudios observacionales y controlados (comparados con infliximab y corticoides).
Hay dos revisiones sistemáticas que evaluaron el efecto de la ciclosporina en la CU. Una revisión Cochrane138 incluyó solo dos ensayos controlados, realizados en un total de tan solo 50 pacientes, uno con corticoides en pacientes no resistentes a estos fármacos139 y el otro con placebo tras el fracaso de los corticoides14. Sin embargo, la otra revisión140 incluyó además otros dos estudios controlados (el primero comparó 4 mg/kg al día vs. 2 mg/kg al día141 y el segundo comparó ciclosporina sola vs. ciclosporina y corticoides142, en un total de 153 pacientes entre los dos estudios) y un total de 27 estudios observacionales con 574 pacientes tratados con ciclosporina. Posteriormente se publicó una serie retrospectiva relevante143. Globalmente, entre 76 y 85% de los pacientes que responden a ciclosporina evitan la colectomía a corto plazo.
Los estudios son considerablemente heterogéneos tanto en la definición de los pacientes a incluir como en los objetivos primarios. No todos los parámetros definidos como claves en esta GPC (mortalidad, necesidad de colectomía) son fáciles de analizar a nivel global, y solo uno de los estudios con un número pequeño de pacientes proporcionó una comparación directa con el placebo15. Por lo tanto, calificamos la calidad de la evidencia como moderada. Sin embargo, la diferencia de riesgo absoluto con placebo fue tan grande (81%) y el resultado en el resto de los estudios tan homogéneo (se observó una respuesta clínica perfectamente definida entre 60 y 80% de los casos), que la eficacia de esta alternativa terapéutica parece clara, máxime cuando la gran mayoría de los pacientes incluidos había fracasado al tratamiento previo con corticoides. Datos recientes de dos grandes ensayos clínicos, CISYF144 y CONSTRUCT145, demuestran que la ciclosporina (seguida de alguna terapia de mantenimiento) es igual de eficaz que el infliximab a corto, medio y largo plazo, y tiene una tasa de colectomía similar, lo que representa otra prueba más, si bien indirecta, de su eficacia.
La eficacia a largo plazo de la inducción con ciclosporina ha demostrado ser variable y se ha comprobado que debe acompañarse de un tratamiento de mantenimiento posterior, que muy bien puede ser azatioprina en aquellos que no la hayan recibido antes de ser tratados con ciclosporina, de acuerdo con los resultados de varios estudios observacionales146-149.
La diversidad de protocolos también hace difícil evaluar la seguridad. No obstante, en pacientes graves con hospitalizaciones prolongadas, sometidos a inmunosupresión compleja, son comunes los EA graves que, aunque afectan a menos de 10% del total, pueden resultar en mortalidad (aproximadamente 1%), a pesar de que esta situación tiene lugar en el marco de protocolos de estudios clínicos que generalmente son un escenario más favorable para los pacientes que la práctica real150.
Respecto a la dosis, la dosis inicial de 2 mg/kg al día por vía intravenosa tuvo una efectividad similar a la de 4 mg/kg al día, pero con menos efectos secundarios. No obstante, como durante el estudio se ajustaban las dosis de acuerdo con los niveles sanguíneos, la cantidad real de ciclosporina recibida fue muy similar en ambos grupos y se mantuvieron los niveles sanguíneos terapéuticos entre 150 y 350 ng/mL para obtener la máxima eficacia terapéutica con la mínima toxicidad141.
La nueva evidencia incluida en esta actualización corresponde a un metaanálisis publicado en 2021151) y se describe en el segmento donde se compara el infliximab con la ciclosporina.
Recomendación 1.2.3. GADECCU.
Tratamiento CU (2022): tacrolimus para la inducción de la remisión del brote grave de CU.
Sugerimos el uso de tacrolimus para la inducción de la remisión del paciente con brote grave de CU resistente a corticoides para obtener niveles en sangre de 10-15 ng/mL durante las primeras dos semanas.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: baja.
Se dispone de dos ensayos clínicos controlados, publicados por el mismo grupo de investigadores. El más antiguo152 compara tacrolimus oral frente a placebo en pacientes con CU activa entre moderada y grave (sobre todo moderada), hospitalizados, corticorresistentes o corticodependientes, y aleatorizados en tres grupos: placebo (n = 20), tacrolimus oral en dosis baja (n = 22) o alta (n = 21) (concentración objetivo de 5-10 y 10-15 ng/mL en sangre, respectivamente). Se evaluó la eficacia en la semana 2, mediante el índice de Mayo (DAI)9, con el objetivo primario de inducir una mejoría (respuesta parcial o remisión). En el análisis porintención de tratar, se obtuvo respuesta clínica (respuesta parcial o remisión) en 2/20 (10%), 8/22 (36%) y 13/21 (62%), respectivamente. La OR para respuesta de tacrolimus vs. placebo fue 8,66 (IC 95% 1,79-42), con una RRA de 0,39, y una NNT de 3. Solo con dosis altas fue significativamente superior al placebo, y los datos señalan un efecto dosis-respuesta. En el segundo ensayo clínico153, se confirmó la eficacia de tacrolimus oral frente al placebo en la semana 2 en 62 pacientes aleatorizados 1:1 con los mismos criterios que se siguieron en el ensayo clínico previo, a dosis suficiente para alcanzar niveles de 10-15 ng/mL. Si nos centramos solo en analizar la remisión clínica, las diferencias entre tacrolimus y placebo no alcanzarona tener significación estadística en ninguno de los dos ensayos clínicos. No hubo colectomías, mortalidad ni tampoco EA graves. Una reciente revisión sistemática y metaanálisis154 ha combinado los resultados de los dos ensayos clínicos publicados hasta el momento y los estudios observacionales con tasas de respuesta a dos semanas significativamente superiores al placebo (RR 4,61; IC 95% 2,09-10,17; p = 0,0015), con porcentajes libres de colectomía de 86, 84, 78 y 69% a uno, tres, seis y 12 meses, respectivamente.
No hemos encontrado ningún estudio controlado que haya comparado el uso de tacrolimus con sus alternativas, la ciclosporina o el infliximab.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 1.2.4 GADECCU.
Tratamiento CU (2022): infliximab para la inducción de la remisión del brote grave de CU.
Recomendamos el uso de infliximab a dosis estándar de 5 mg/kg IV en las semanas 0, 2 y 6 para la inducción de la remisión del paciente con brote grave de CU, en especial el resistente a corticoides.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
Aunque disponemos de una revisión sistemática Cochrane155, la publicada posteriormente por Gisbert et al.83 incluye tanto los ECA (cinco con placebo y dos con corticoides en 555 pacientes en total) como los estudios no controlados (27 estudios en 341 pacientes), por lo que la usamos para nuestro análisis. La mayoría de los ECA incluyó a pacientes con brotes graves y moderados; de hecho, solo en 322 de los 896 pacientes se definió claramente la intensidad del brote: hubo 207 casos graves (64,2%). En los dos ECA con más pacientes incluidos84, ACT1 y ACT2, la mayoría de los pacientes eran ambulatorios, lo que indica que se trataba sobre todo de brotes moderados. En los ACT, la información sobre la corticorresistencia o corticodependencia también es limitada: solo se refleja el porcentaje de pacientes que recibió tratamiento con corticoides.
Hay dos ECA que incluyeron exclusivamente a pacientes con brote grave corticorresistente156,157. Sus resultados son contradictorios: el infliximab resultó muy superior al placebo156 en uno e ineficaz en el otro157, aunque este estudio incluyó a pocos pacientes y tuvo un riesgo de error beta muy elevado. El estudio escandinavo156 es el más completo e incluye un análisis de la mortalidad (ausente en ambos grupos) y de la necesidad de realizar una colectomía a corto y largo plazo. El riesgo de colectomía a los 12 meses se redujo de modo significativo (RR 0,44; IC 95% 0,22-0,87), hecho que muestra que el efecto de la intervención única en la fase aguda persiste a los 36 meses158. El análisis conjunto de los cuatro ECA sobre la eficacia demostró la superioridad del infliximab frente al placebo, tanto para inducir una respuesta (OR 3,60; 2,67-4,85) como para inducir la remisión (OR 4,56; 1,98-10,52) (solo en dos ECA tenemos el dato de remisión). La comparación de infliximab con corticoides se analizó en dos ECA abiertos85,159 con poblaciones pequeñas, pero no se encontraron diferencias estadísticamente significativas.
Aunque los EA graves son infrecuentes (< 5%), hay una mayor incidencia de infecciones especialmente oportunistas que pueden resultar en mortalidad (< 1%). Los riesgos parecen mayores si el infliximab se asocia a otros inmunomoduladores.
Disponemos, además, de la evidencia indirecta a través de los recientes ensayos CYSIF y CONSTRUCT, que compararon la eficacia de la ciclosporina con la del infliximab en este escenario de brote grave. Ambos fármacos fueron muy eficaces y con buen perfil de seguridad. No hay datos de comparación directa del infliximab con cirugía.
En resumen, el infliximab es superior al placebo para el tratamiento del brote grave de CU, con un riesgo de EA graves aceptable, pero que se asocia ocasionalmente con mortalidad. La elección terapéutica debe ponerse en contexto con relación a sus alternativas en el escenario del brote grave refractario. A pesar de contamos con un número importante de pacientes y estudios, tenemos que calificar la calidad de la evidencia como moderada debido a su heterogeneidad, la falta de definición del escenario exacto en muchos casos y el número relativamente bajo de brotes graves analizado, aunque cada vez se disponen más datos observacionales que confirman lo descrito en los estudios citados160.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia en esta recomendación.
Recomendación 1.2.5 GADECCU.
Tratamiento CU (2022): ciclosporina vs. infliximab para la inducción de la remisión del brote grave de CU.
Recomendamos el uso tanto de infliximab como de ciclosporina para la inducción de la remisión del paciente con brote grave de CU refractaria a corticoides. Su eficacia es equivalente y serán particularidades de cada caso las que nos hagan optar por una u otra alternativa. Las dosis de ambos tratamientos son las que se utilizan habitualmente.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Solo existe una revisión sistemática que evalúa el efecto de la ciclosporina frente al infliximab en la CU grave sin respuesta a corticoides161. Sin embargo, no incluye el mayor ensayo controlado, por lo que consideramos los resultados de los ensayos controlados como determinantes para nuestro análisis y recomendaciones.
El primero de los ensayos controlados (CYSIF)144 incluyó a 115 pacientes y el segundo (CONSTRUCT)145 a 242 con un seguimiento superior (hasta tres años, aunque en fase no controlada). Son dos estudios muy similares, pero con matices. Ambos compararon el infliximab frente a la ciclosporina en brotes graves de CU hospitalizados y sin respuesta a corticoides. El estudio CYSIF excluyó a pacientes cuyo tratamiento previo con tiopurinas había fallado, mientras que el CONSTRUCT no. El régimen de tratamiento usado con CyA o con infliximab fue muy similar. Las variables de respuesta fueron diferentes, pero ambos estudios muestran los datos sobre mortalidad, colectomía y remisión/respuesta clínica: en día 7 y 98 en el CYSIF, y al tercer mes (además del seguimiento abierto a uno y tres años) en el CONSTRUCT. Sus resultados fueron similares y en la misma dirección. En términos de eficacia, el CYSIF y el CONSTRUCT mostraron resultados de remisión, respuesta clínica, así como tasas de colectomía similares. Por ejemplo, en el estudio CONSTRUCT, 39 de los 134 pacientes (29%) tratados con CyA fueron colectomizados.
En cuanto a su seguridad, en el estudio CYSIF, nueve (16%) de los pacientes tratados con CyA y cuatro (25%) de los tratados con infliximab presentaron EA graves (el empeoramiento de la colitis fue el más habitual), pero no hubo muertes en ninguno de los grupos. En el estudio CONSTRUCT la seguridad también fue similar. Hubo tres muertes en el grupo infliximab (dos por neumonía en el posoperatorio y sepsis, ambos con comorbilidades graves, y uno por cáncer colorrectal diseminado, tras 20 años del diagnóstico de CU), y ninguna en el grupo ciclosporina. No es sorprendente que los EA graves sean frecuentes y con potencial mortalidad (aproximadamente de 1%), ya que se trata de pacientes muy graves, con hospitalizaciones prolongadas y sometidos a inmunosupresión150.
Además, existen al menos 16 estudios observacionales que comparan a corto o largo plazo la eficacia de CyA o infliximab en el brote grave de CU. Los primeros 13 se incluyeron en la revisión sistemática161. Dicha revisión concluyó sobre esos estudios observacionales que el infliximab se asoció con una tasa de respuesta mayor (OR 2,96; IC 95% 2,12-4,14; χ2= 6,50; I2= 0%) y una tasa de colectomía menor a 12 meses (OR 0,42; IC 95% 0,22-0,83; χ2= 30,94; I2= 71%), en comparación con la ciclosporina. En seguridad no hubo diferencias significativas. Se destaca la publicación del seguimiento solo a largo plazo de CYSIF162 que demostró resultados a corto y largo plazo muy similares del infliximab y la ciclosporina.
La nueva evidencia incluida en esta actualización corresponde a un metaanálisis publicado en 2021151, que incluye siete ECA que compararon la ciclosporina y el infliximab, entre sí o con placebo en 534 pacientes con CU refractaria a esteroides y se evaluó como punto final primario la tasa de colectomía. El riesgo de colectomía a ≤ 1 mes se redujo significativamente con ambos tratamientos en comparación con el placebo (RR de colectomía con infliximab frente al placebo = 0,37; IC 95% 0,21-0,65 y RR con ciclosporina frente al placebo = 0,40; IC 95% 0,21-0,77). En términos de colectomía entre > 1 mes y < 1 año, ambos fármacos se clasificaron por igual [P-score 0,75]. Ningún tratamiento fue más efectivo que el placebo para reducir el riesgo de colectomía en ≥ 1 año.
Recomendación 1.2.6 GADECCU.
Tratamiento CU (2022): antibióticos para la inducción de la remisión del brote grave de CU.
Dirección de la recomendación: no es posible establecer una recomendación sobre la eficacia de los antibióticos para la inducción de la remisión del paciente con brote grave de CU.
Calidad de la evidencia: muy baja.
Disponemos de una revisión sistemática en adultos163 en la que se incluyen 10 ECA que comparan el tratamiento antibiótico con el placebo en 509 pacientes con CU activa: 263 recibieron antibiótico y 267 recibieron placebo además del tratamiento habitual, pero no se detalla la gravedad de los brotes. El momento de valoración de la respuesta se realizó de modo precoz (1-14 días) en todos los estudios, excepto en uno en el que se evaluó a los 180 días. Los estudios incluidos utilizaron diferentes tipos de antibióticos a distintas dosis, por diferentes vías e incluso distintas asociaciones: vancomicina 7%, metronidazol 7%, tobramicina 31%, ciprofloxacina 38,5%, rifaximina 5,5%, metronidazol más tobramicina 7%, metronidazol más amoxicilina más tetraciclina 4%. El RR fue de 1,30 (1,14-1,49), lo que se traduce en un posible beneficio del uso de antibióticos en estos pacientes (siempre asociados a corticoides). Si analizamos solamente la respuesta precoz y excluimos el estudio a largo plazo, el OR sigue manteniéndose en 2,02 (1,36-3,00). No se evaluaron los EA.
Un ensayo clínico164 con una combinación de amoxiciclina, tetraciclina y metronidazol no mostró diferencias en la remisión a corto plazo, pero sí mejoró la respuesta y la remisión a los 12 meses. Por el tipo de estudio, la mayor parte de los pacientes incluidos sufrían un brote leve o moderado.
Un estudio abierto posterior165 evaluó la adición de amoxiciclina, tetraciclina y metronidazol durante dos semanas en pacientes con CU corticorefractaria (no todos tenían brote grave), y hubo una mejoría de la respuesta clínica en el grupo en el que se añadieron los antibióticos.
La nueva evidencia incluida en esta guía corresponde a dos trabajos publicados en 2021. El primero es un ECA166 cuyo objetivo fue evaluar el uso de una combinación de antibióticos (ceftriaxona/metronidazol) como terapia adyuvante en pacientes con CU severa. Se incluyó a 50 pacientes a quienes se les asignó al azar infusiones de placebo o antibióticos, además de la atención estándar. La respuesta completa el día 3 fue alcanzada por siete participantes (28%) en el grupo de antibióticos y por seis (24%) en el grupo placebo (p = 1,00). No se observaron diferencias significativas en el valor de la PCR, la puntuación parcial de Mayo ni en la calprotectina fecal en los grupos al día 3. Por lo tanto, en este ensayo clínico la combinación de ceftriaxona y metronidazol no demostró mejorar los resultados en la CU severa.
Una revisión sistemática y metaanálisis167 que evaluó el papel de los antibióticos en la inducción y el mantenimiento de la remisión en pacientes con CU incluyó 13 ensayos con 785 pacientes. El odds ratio combinado de la respuesta clínica fue de 1,74 (IC 95% 1,17-2,58). En este estudio no se observaron diferencias en las tasas de recaída, necesidad de terapia de segunda línea, colectomía o EA con el uso de antibióticos. El análisis de subgrupos no mostró diferencias con el uso de antibióticos únicos o combinados, y el análisis de los ECA que evaluaron el uso de antibióticos en el contexto de la CU grave no demostró ningún beneficio.
Inducción de la remisión en el paciente con brote grave de CUComentarios GADECCUPodemos definir el brote grave de CU por los criterios de Truelove y Witts (tabla 6), que establecen variables fácilmente evaluables que permiten tomar decisiones terapéuticas para el manejo inicial de los pacientes, con foco tanto en la evaluación clínica como en la identificación temprana de complicaciones. La figura 2 ilustra esta situación clínica.
Índice de Truelove-Witts original255
| Variable | Leve | Grave |
|---|---|---|
| Número de deposiciones | < 4 | > 6 |
| Sangre en las deposiciones | +/– | ++/+++ |
| Hemoglobina (g/L) | Anemia no grave | < 75% |
| Temperatura (°C) | No fiebre | > 37,8* |
| Taquicardia | Ausente | > 90 lpm |
| VSG (mm 1ª hora) | < 30 | > 30 |
En el momento de la exploración o en dos de los últimos cuatro días.
Valoración del índice:
Brote leve: cuando todas las variables se encuentran en la categoría de «leve».
Brote grave: cuando todas se encuentran en «grave».
Cuando hay variables en ambas categorías, se trata de un brote moderado.
lpm: latidos por minuto.
En el escenario de un brote grave de CU, ya sea un diagnóstico reciente o un nuevo brote en un paciente con una CU ya conocida, el tratamiento se realizará en el ámbito hospitalario. El manejo debería estar a cargo, en condiciones ideales, de un equipo interdisciplinario conformado por médicos clínicos, gastroenterólogos, coloproctólogos, nutricionistas e infectólogos.
Además del tratamiento farmacológico específico del brote grave se deben tener en cuenta una serie de medidas generales:
- -
Deberá evaluarse la necesidad de reponer volumen, el tratamiento de la anemia, la hipokalemia y la hipomagnesemia de acuerdo con las variables hemodinámicas y de laboratorio. En caso de fiebre, pueden utilizarse medios físicos y paracetamol, y evitar el uso de antiinflamatorios no esteroideos (AINE). Si bien no hay ensayos clínicos que confirmen la posibilidad de exacerbación de un brote de CU con el consumo de AINE, evitarlos es la recomendación de nuestros expertos.
- -
Radiografía de abdomen simple en el ingreso hospitalario y luego diariamente, con el objetivo de diagnosticar de modo precoz signos de íleo, megacolon o perforación. Estudios de mayor complejidad, como una tomografía o una resonancia de abdomen, se reservan para casos de los que se sospecha que pueden presentar complicaciones.
- -
La rectosigmoidoscopia (RSC) flexible, incluso sin preparación (sobre todo evitando los enemas con fosfatos) y con mínima insuflación es segura en manos experimentadas168, mientras que una colonoscopía completa, si bien se ha reportado segura, se puede asociar a una mayor tasa de complicaciones y no aporta más datos que la RSC169 en este momento. Este estudio permite confirmar el diagnóstico en quienes debutan con la enfermedad, evaluar la gravedad y tomar muestras para la búsqueda de CMV.
- -
Con relación al punto anterior, dado que el primer tratamiento específico del brote grave de CU son los corticoides, es importante descartar posibles causas de resistencia, en especial una infección colónica por CMV170. Este diagnóstico se realiza en el examen histológico de las muestras de mucosa colónica.
- -
Otras causas infecciosas como el Clostridium difficile pueden desencadenar un brote de CU, por lo tanto, es importante descartar la infección provocada por este agente. Con respecto a otras infecciones entéricas, en países latinoamericanos se encuentran altas tasas de parasitosis, que son mayores en pacientes con EII. Por lo tanto, las colitis infecciosas deben excluirse171.
- -
No es posible establecer una recomendación para el uso de antibióticos en el tratamiento del brote grave de CU. En los casos graves, con alto riesgo de perforación y en especial en los casos de megacolon, recomendamos utilizar un antibiótico dirigido a gérmenes gramnegativos y anaerobios.
- -
Fármacos como anticolinérgicos, narcóticos y antidiarreicos pueden precipitar la aparición de megacolon, por lo que debe evitarse su uso172.
- -
Realizar un check-list infectológica: solicitar serologías para HBV, HCV, HIV, VDRL, Chagas por tres métodos, anti-EBV y radiografía de tórax asociado a test de tuberculina-PPD. En condiciones ideales, se debería solicitar el test de liberación de interferón (quantiferon), aunque no se encuentra ampliamente disponible en nuestro medio. Los resultados de algunos de estos test pueden demorarse algunos días, por lo que sugerimos realizarlos durante el ingreso hospitalario.
- -
Considerar el estado de vacunación, aunque la falta de una inmunización completa no debe retrasar el inicio de la terapia específica.
- -
Prevenir fenómenos tromboembólicos: aunque no se dispone de datos controlados, una serie de pruebas indirectas sugiere fuertemente que el uso de heparina de bajo peso molecular a dosis profiláctica es recomendable en prácticamente todos los pacientes con un brote grave de CU. El riesgo basal de fenómenos tromboembólicos en esta situación clínica es muy alto y son una de las causas más importantes de mortalidad173,174. De hecho, en algunos centros, es una práctica clínica utilizar heparina durante un periodo que varía entre 15 días y un mes de forma ambulatoria tras el alta hospitalaria. El uso de heparina es seguro en estos pacientes y la presencia de sangre en deposiciones no es un impedimento para su uso, a menos que exista una hemorragia hemodinámicamente significativa.
- -
Obtener una nutrición adecuada: la desnutrición es frecuente en la EII, principalmente en la enfermedad activa. En pacientes hospitalizados, la desnutrición es un factor de riesgo independiente del tromboembolismo venoso, la cirugía no electiva, las internaciones más prolongadas y el aumento de la mortalidad. El cribado nutricional se ha adoptado como un componente obligatorio del manejo de estos pacientes y se recomienda que un nutricionista experto los evalúe a todos175. Deberá evaluarse si el paciente puede continuar con una dieta vía oral adecuada a su situación clínica o si requiere algún tipo de soporte nutricional enteral y parenteral.
El tratamiento farmacológico específico del brote grave se basará en la administración de corticoides, salvo indicación absoluta de cirugía. Esta terapia sigue siendo la primera línea en el brote grave de CU, ya que reduce claramente la mortalidad en este escenario clínico (de > 20 a < 2%). En la guía GETECCU se recomienda el uso de metilprednisolona, sin embargo, en Argentina no disponemos de esta droga y utilizamos con más frecuencia la hidrocortisona. En distintas publicaciones8,136 se equipara la dosis de metilprednisolona intravenosa de 60 mg cada 24 horas con la de hidrocortisona de 100 mg cuatro veces al día (puede considerarse utilizar una dosis menor de acuerdo con el peso del paciente). La vía de administración es la e.v. durante cinco a siete días. Es recomendable fijar un momento para evaluar la respuesta. Lo más adecuado es hacerlo entre dos y cinco días después de iniciado el tratamiento con corticoide. Si se obtiene respuesta, se pasará progresivamente al tratamiento de mantenimiento (ver «Mantenimiento de la remisión luego de un brote grave de CU?»). Pero si el paciente no responde a los corticoides e.v., se considerará como corticorrefractario. La evaluación precoz de los pacientes con un brote grave de CU siempre es indispensable para determinar la necesidad de otra terapia de rescate, cuyo objetivo es evitar la colectomía de urgencia e, idealmente, lograr la remisión. Se han desarrollado índices como los de Travis et al. (Oxford)176 y Ho et al.177 que permiten predecir la probabilidad de respuesta e identificar a aquellos pacientes que, al día 3 de tratamiento con corticoides endovenosos, presentan un mayor riesgo de que esta terapia inicial fracase (tablas 7 y 8).
| Índice de Ho177
| Variable (día 3) | Puntuación |
|---|---|
| Frecuencia media deposiciones | |
| < 4 | 0 |
| 4 = < 6 | 1 |
| 6 = < 9 | 2 |
| > 9 | 4 |
| Dilatación del colon | 4 |
| Hipoalbuminemia (albúmina 30 < g/L) | 1 |
Valoración del índice (probabilidad estimada de fallo con el tratamiento médico):
Puntuación índice: Probabilidad de no respuesta al tratamiento médico
0-1 = 11%
2-3 = 43%
≥ 4 = 85%
Si no hay respuesta a la primera línea de tratamiento, se tratará de un paciente corticorresistente, lo que constituye un nuevo escenario clínico para el que disponemos de tres opciones: la ciclosporina, el infliximab o la cirugía. En este nodo de decisión es muy importante tanto la opinión del equipo quirúrgico como la del paciente bien informado.
La ciclosporina es una droga que se utiliza de forma exclusiva en el brote resistente a corticoides y ha demostrado su eficacia en la inducción, pero debe acompañarse de una estrategia de mantenimiento, ya que no puede utilizarse por tiempos prolongados. Para el mantenimiento, una posibilidad es utilizar tiopurinas, excepto cuando el brote grave se produzca en el contexto del fracaso de las tiopurinas. Tras inducir una remisión con ciclosporina, también podría plantearse un mantenimiento con vedolizumab178,179, ustekinumab, tofacitinib o incluso anti-TNF.
La administración de ciclosporina no deberá prolongarse más de tres meses debido al riesgo de toxicidad irreversible, particularmente renal. Aunque algunos grupos médicos la utilizan por vía oral, los estudios que justifican su uso se han realizado casi todos utilizando inicialmente la vía intravenosa. Con los datos disponibles, parece prudente empezar con 2 mg/kg al día y ajustar al alza si no se produce toxicidad y no se alcanzan niveles considerados terapéuticos178. La seguridad es el condicionante más importante en el uso de la ciclosporina, por lo que es recomendable usar un protocolo de seguimiento preestablecido180. Los EA son más probables en tratamientos prolongados, por lo que se deberá considerar con cuidado la duración de la prescripción. Otro de los factores más importantes en la aparición de EA es el cotratamiento con otros inmunomoduladores, en especial los corticoides, por lo que se recomienda realizar profilaxis para Pneumocystis carinii. Antes de comenzar el tratamiento con ciclosporina, se deberá descartar que haya hipomagnesemia e hipocolesterolemia, y una vez iniciado, realizar determinaciones periódicas de la función renal, control de la presión arterial y medición de niveles del fármaco cada 24 o 48 horas.
Con respecto al infliximab, esta droga es uno de los biológicos con mayor experiencia a nivel local. La dosis de inducción de este fármaco es de 5 mg/kg en las semanas 0, 2 y 6. Numerosos estudios han intentado encontrar una correlación entre la dosis de infliximab utilizada, el nivel sanguíneo (y ocasionalmente tisular) alcanzado y la eficacia181,182. En el brote grave de CU resulta más difícil alcanzar niveles terapéuticos sostenidos porque la hipoalbuminemia, la alta carga inflamatoria y la pérdida proteica por las heces afectan los niveles terapéuticos de infliximab. Por ello, muchos autores han sugerido aumentar la dosis de infliximab utilizando, además, pautas aceleradas (p. ej., 10 mg/kg de peso en las semanas 0, 1 y 3). No se ha demostrado claramente la superioridad de esta aproximación en ensayos controlados, aunque datos recientes sugieren que, cuando se corrige por los factores de riesgo individuales, las dosis más altas sí pueden ser más eficaces183-186. La mayoría de los médicos utiliza una aproximación flexible, adaptando la dosis y los intervalos de administración a las circunstancias individuales, a veces con la determinación de niveles, y en otras ocasiones fundándose en la respuesta clínica, la albúmina y la PCR.
Hacemos especial hincapié en que las infusiones de infliximab deben ser regladas, porque las interrupciones pueden generar anticuerpos anti-infliximab, lo que aumenta la posibilidad de pérdida de respuesta y reacciones de infusión. Sin embargo, pese al porcentaje de pérdida de respuesta, el infliximab continúa siendo una droga eficaz en el escenario del brote grave de CU, donde existen pocas alternativas por el momento.
Existen dos estudios comparativos con metodología diferente donde el infliximab y la ciclosporina han mostrado una eficacia similar para el tratamiento de inducción de la remisión del brote grave de CU cuando se evalúa a corto, mediano y largo plazo. La elección de uno u otro fármaco dependerá de factores individuales y eventuales contraindicaciones, generalmente relativas. Es especialmente importante la respuesta clínica a los tratamientos utilizados con anterioridad y la estrategia terapéutica que se establece para el paciente concreto, plan que, dada la disponibilidad creciente de nuevos fármacos, puede ser muy variable. Para utilizar ciclosporina es recomendable disponer de experiencia con el fármaco y es necesario tener capacidad en el centro de salud para la determinación rápida de sus niveles en sangre. Por otro lado, el infliximab tiene la ventaja de que se puede usar para la inducción y el mantenimiento, y los controles en la inducción son de menor complejidad.
Sea cual sea la opción elegida para la inducción de la remisión en el brote grave de CU, hay que planificar un nuevo momento de evaluación. Probablemente lo más razonable sea a los siete días de iniciado el nuevo tratamiento. En este punto no hay normas fijas. Si hay un empeoramiento o una falta absoluta de mejoría, lo más razonable será, en la mayoría de los casos, la cirugía, y si hay una clara respuesta clínica, se podrá pasar al esquema de mantenimiento.
El panel de expertos de GADECCU que ha participado en la actualización de esta guía coincide en que hay poca experiencia local con el uso de ciclosporina y sus respuestas se realizaron en función de la vasta literatura consultada, pero sin una experiencia clínica real.
Si bien no es el objetivo de esta guía evaluar la opción quirúrgica, debemos comentar que la causa más frecuente de cirugía en el escenario del brote grave de CU es la falta de respuesta al tratamiento médico. Otras causas de cirugía de urgencia, mucho menos frecuentes, son el megacolon tóxico, la perforación del colon y la hemorragia masiva. Tomar la decisión de realizar la cirugía precozmente puede llevarnos a operar a un mayor número de pacientes, pero, por otro lado, demorarse en tomar la decisión quirúrgica puede conducir a operar a pacientes en peores condiciones generales, más desnutridos e inmunodeprimidos, lo que conlleva un aumento de la morbimortalidad posoperatoria164. Por lo tanto, la eficacia de la terapia médica debe evaluarse precozmente, como ya se señaló. Una vez que se ha tomado la decisión de someter al paciente a una cirugía de urgencia, la colectomía total (sin protectomía en esta instancia) con ileostomía terminal es el procedimiento de elección165,187.
En síntesis, el brote grave de CU es una emergencia médica que requiere un tratamiento adecuado en centros de salud con experiencia en esta patología. Los corticoides sistémicos, la ciclosporina y el infliximab han disminuido la morbimortalidad de este cuadro. El manejo multidisciplinario con escalamiento oportuno de la terapia médica evitando el uso prolongado de corticoides constituye el paradigma de manejo actual. La colectomía sigue siendo la opción de rescate en pacientes que no responden a la terapia médica y su indicación no debe retrasarse de forma innecesaria.
Mantenimiento del paciente con CUMantenimiento de la remisión luego de un brote leve-moderado de CURecomendación 2.1.1 GADECCU.
Tratamiento CU (2022): salicilatos orales para el mantenimiento de la remisión del brote leve-moderado de CU.
Recomendamos el uso de salicilatos orales para el mantenimiento de la remisión del paciente luego de un brote leve-moderado de CU tratado con salicilatos a dosis de al menos 2 g al día de sulfasalazina o 1,5 g al día de mesalazina.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Se dispone de una revisión Cochrane publicada en 2016188 en la que se evaluó la eficacia en el mantenimiento de la remisión de la mesalazina oral frente al placebo en siete ensayos clínicos con 1.298 pacientes. Se observó que 41% de los pacientes en tratamiento con mesalazina no logró la remisión clínica o endoscópica durante el seguimiento frente a 58% de la rama placebo. El RR para el fracaso en el mantenimiento de la remisión para todos los ECA incluidos fue de 0,69 (IC 95% 0,62-0,77; I2 = 15%; p = < 0,00001).
Respecto con las dosis recomendadas para el mantenimiento, los autores observaron una mayor eficacia con dosis más altas de mesalazina. Hubo diferencias estadísticamente significativas para los subgrupos de dosis de entre 1-1,9 g al día (RR 0,65; IC 95% 0,56-0,76) y 2 g/ día (RR 0,73; IC 95% 0,60-0,89).
Como ocurre en el escenario de la inducción, no se observaron diferencias al comparar diferentes formulaciones de mesalazina y, de nuevo, una única dosis resultó tan eficaz como dosis divididas, con el beneficio de que mejoró la adherencia de los pacientes.
Al comparar la mesalazina con la sulfasalazina, esta última fue más eficaz en mantener la remisión (clínica o endoscópica) que la mesalazina, ya que 48% de los pacientes con mesalazina presentó recidiva frente a 43% de pacientes con sulfasalazina (12 estudios, 1.655 pacientes [RR 1,14; IC 95% 1,03-1,27]).
No hubo diferencias significativas en cuanto a la seguridad, evaluada en tres ECA con un total de 774 pacientes (RR 0,94; IC 95% 0,77-1,15), ni al evaluar EA que motivaran la salida de los ECA (cinco ECA con 1.096 pacientes) (RR 0,86; IC 95% 0,46-1,63) cuando se compararon distintas dosis de mesalazina. Tampoco se observaron diferencias cuando se comparó mesalazina con sulfasalazina.
La nueva evidencia incluida en esta actualización es una revisión sistemática y metaanálisis Cochrane189 publicado en 2020 con el objetivo de evaluar la eficacia, la respuesta a la dosis y la seguridad de la mesalazina oral en comparación con placebo, sulfasalazina y diferentes formulaciones de mesalazina para el mantenimiento de la remisión de la CU. También se comparó la eficacia y la seguridad de la dosificación oral de mesalazina una vez al día con la convencional (dos o tres veces al día).
En esta revisión, se identificaron 44 ECA con un total de 9.967 pacientes y un periodo mínimo de seguimiento de seis meses. Al comparar la mesalazina con el placebo, la mesalazina fue más eficaz para mantener la remisión clínica o endoscópica (ocho estudios, 1.555 pacientes); 37% (335/907) de los pacientes con mesalazina recayó entre los seis y 12 meses en comparación con 55% (355/648) de los pacientes en el grupo placebo (RR 0,68; IC 95% 0,61-0,76). Se informaron EA serios entre el mes 6 al 12 en 1% (6/550) de los pacientes en el grupo de mesalazina en comparación con 2% (5/276) en el grupo de placebo (RR 0,60; IC 95% 0,19-1,84). No se observaron diferencias en los EA en el mismo periodo de seguimiento (RR 0,93, IC 95% 0,73-1,18). Alrededor de 48% de los pacientes que recibieron mesalazina recayeron (clínica o endoscópicamente) entre los seis y los 18 meses en comparación con 43% de los pacientes que recibieron sulfasalazina (RR 1,14; IC 95% 1,03-1,27). Esta observación sugiere una mayor efectividad de la sulfasalazina en comparación con la mesalazina para el mantenimiento de la remisión. Probablemente haya poca o ninguna diferencia en los EA entre los seis y los 12 meses de seguimiento (RR 1,07; IC 95% 0,82-1,40). Se observó poca o ninguna diferencia en la eficacia de las diferentes formulaciones de mesalazina. Las tasas de recaída (clínica o endoscópica) entre los seis y los 18 meses no fueron diferentes entre los grupos (RR 1,08; IC 95% 0,91-1,28). Con relación al régimen de dosificación, cerca de 37% de los pacientes que recibieron una dosis diaria de mesalazina recayeron (clínica o endoscópicamente) dentro de los 12 meses en comparación con 39% de los que recibieron dosis convencionales (RR 0,94; IC 95% 0,88-1,01).
Recomendación 2.1.2 GADECCU.
Tratamiento CU (2022): salicilatos tópicos para el mantenimiento de la remisión del brote leve-moderado de CU.
Recomendamos el uso de la mesalazina tópica para el mantenimiento de la remisión del paciente tras un brote leve-moderado de CU izquierda no tratada con corticoides, en dosis mínimas de 1 g dos o tres veces por semana.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
Son varios los ECA que demuestran que los salicilatos rectales son más eficaces que el placebo en el tratamiento de mantenimiento de la colitis izquierda, especialmente en la proctitis. Estos resultados se han resumido en varias revisiones sistemáticas30,32,190. En la revisión sistemática de Marshall et al.36 que incluye cuatro ECA, el OR global fue de 5,6 (IC 95% 3-10,5) y en un estudio más reciente191 se mostró un RR a favor de la mesalazina de 5,21 (IC 95% 1,99-13,6). La tasa de EA fue, además, la misma que con el placebo. En los estudios de comparación de dosis, los resultados fueron menos claros. Algunos datos indican que la dosis de 500 mg al día y la de 1 g al día192 tienen una eficacia similar, pero otros señalan que la dosis mayor193 es más efectiva.
Dos ECA compararon la combinación de mesalazina oral y tópica194 con la mesalazina oral; la combinación de fármacos resultó más eficaz que el tratamiento oral aislado para mantener la remisión al año.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Síntesis de la evidenciaUna revisión sistemática y metaanálisis del Reino Unido127 publicado en 2017 incluyó seis ECA con periodos de seguimiento de 12 meses en cuatro de ellos, y otros dos con periodos muy cortos (ocho semanas y 12 semanas). En los ECA se utilizaron diferentes preparados de probióticos (E. coli nissle, bifidobacterium y otras combinaciones) pero no se encontraron diferencias en el porcentaje de recidiva al compararlos con la mesalazina (tres ECA) o el placebo (tres ECA). En cuanto a los EA, también fueron similares a los del placebo y la mesalazina.
La nueva evidencia de esta actualización incluye una revisión Cochrane195 publicada en 2020 cuyo objetivo primario fue determinar la eficacia de los probióticos para el mantenimiento de la remisión de pacientes con CU. Se incluyeron 12 estudios con un total de 1.473 pacientes. Los estudios compararon probióticos con placebo, probióticos con mesalazina y una combinación de probióticos más mesalazina con mesalazina.
No se observaron diferencias estadísticamente significativas en la aparición de recaídas clínicas al comparar los probióticos con el placebo (RR 0,87; IC 95% 0,63-1,18). Tampoco se observó una diferencia en el número de pacientes que mantuvo la remisión clínica en ambos grupos (RR 1,16; IC 95% 0,98-1,37). Cuando se comparan los probióticos con la mesalazina, hubo poca o ninguna diferencia en la recaída clínica (RR 1,01; IC 95% 0,84-1,22) y en el mantenimiento de la remisión clínica (RR 1,06; IC 95% 0,90-1,25). Cuando se comparan los probióticos combinados con mesalazina y la mesalazina sola, tampoco hubo diferencias en la recaída clínica (RR 1,11; IC 95% 0,66–1,87). Se observaron pocas o ninguna diferencia en el mantenimiento de la remisión al comparar los probióticos combinados con mesalazina con la mesalazina sola (RR 1,05; IC 95% 0,89-1,24).
Otra revisión sistemática y metaanálisis131 publicado en 2021 evaluó el tratamiento con probióticos en la inducción y/o mantenimiento de la remisión de la EII. Se incluyeron 10 ECA, con un total de 777 pacientes con CU y EC. En el mantenimiento de la remisión, las diferencias entre el grupo que recibió probióticos y el grupo que recibió placebo no fueron significativas (RR: 1,07; IC 95% 0,80-1,42; p = 0,65).
En síntesis, la evidencia agregada no permite recomendar los probióticos como tratamiento de mantenimiento de la remisión tras un brote leve-moderado de CU.
CU corticodependiente/corticorresistenteRecomendación 2.2.1 GADECCU.
Tratamiento CU (2022): azatioprina para el mantenimiento de la remisión del brote leve-moderado de CU.
Recomendamos el uso de la azatioprina para el mantenimiento de la remisión del paciente luego de un brote leve-moderado de CU corticodependiente en una dosis única de entre 2,5 mg/kg al día y 3 mg/kg al día.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
Existen en la literatura dos metaanálisis67,196 que analizan la eficacia de los fármacos tiopurínicos para el mantenimiento de la remisión del paciente tras un brote leve-moderado de CU corticodependiente o corticorresistente. En el metaanálisis actualizado con metodología GRADE de Cochrane196, se incluyeron cuatro ECA de baja o muy baja calidad metodológica en los que participaron 232 pacientes. Estos estudios demostraron la superioridad de la azatioprina frente al placebo: en 44% (51/115) de los pacientes en la rama azatioprina se fracasó en mantener la remisión frente a 65% (76/117) en la rama placebo (RR 0,68; IC 95% 0,54-0,86). Cuando se comparó la azatioprina con la mesalazina o la sulfasalazina, no fue posible establecer el riesgo debido a la heterogeneidad de los ECA incluidos en la revisión (p = 0,03; I2 = 79%) y a su baja o muy baja calidad.
En el metaanálisis realizado por Gisbert et al.67 se incluyeron seis ECA que comparan a la azatioprina/mercaptopurina con placebo o mesalazina. Se observó un OR global de 2,56 (IC 95% 1,51-5,3), que confirma los hallazgos de un cúmulo de estudios observacionales que demostraron que la azatioprina es un fármaco eficaz a largo plazo para mantener la remisión en el paciente con CU luego de un brote grave o moderado. El porcentaje de eficacia fue de 76%. El único ensayo clínico disponible de alta calidad197, realizado en pacientes tratados con corticoides, demostró que la azatioprina es muy superior a la mesalazina en mantener la remisión durante los primeros seis meses tras el brote (OR 4,78 [1,57–14,5]). Este resultado tan claro se obtuvo a pesar de la duración limitada de la observación (seis meses, un tiempo corto teniendo en cuenta que la azatioprina tarda a menudo meses en ser efectiva) y del uso de una dosis fija de 2 mg/kg al día, muy probablemente subóptima en algunos pacientes. En este estudio se destacó, además, la escasísima eficacia de la mesalazina en este grupo de pacientes y se destacó la eficacia de la azatioprina para el mantenimiento de la remisión de los pacientes con CU. Como ocurre en la EC, cuando se retira la azatioprina en pacientes que la reciben de forma crónica, la probabilidad de recaída es muy alta198,199.
Al comparar en esta revisión Cochrane los EA de los tiopurínicos con el placebo y/o la mesalazina o sulfasalazina, 9% en la rama de azatioprina (11/127) presentó al menos un efecto adverso en comparación con 2% (3/130) en la rama placebo (RR 2,82; IC 95% 0,99-8,01), pero cabe destacar que la calidad de los estudios incluidos es muy baja. Por otra parte, se observó un mayor riesgo de eventos adversos que condicionaron la salida del ensayo en la rama azatioprina (RR 5,43; IC 95% 1,02-28,75).
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.2.2 GADECCU.
Tratamiento CU (2022): metotrexate para el mantenimiento de la remisión de la CU.
Recomendamos NO utilizar metotrexate para el mantenimiento de la remisión del paciente luego de un brote moderado-grave de CU corticodependiente.
Dirección de la recomendación: fuerte en contra. Calidad de la evidencia: baja.
Una revisión Cochrane publicada en 2015200 incluyó tres ECA (dos de ellos de baja calidad metodológica) con 165 pacientes en los que se utilizó metotrexate oral a dosis de 12-15 mg semanales. Allí se concluyó que los resultados de eficacia y EA al comparar metotrexate con placebo, metotrexate con sulfasalazina, metotrexate con 6-MP y metotrexate con mesalazina son inciertos y no hay evidencia que avale la utilización de metotrexate para el mantenimiento de la remisión de pacientes con CU.
Posteriormente, se publicaron dos ECA con resultados de mantenimiento. El estudio METEOR70 incluyó a 111 pacientes corticodependientes aleatorizados a metotrexate o placebo asociado a 40 mg de prednisona en dosis descendente. No se observaron diferencias en ambos grupos al analizar la cicatrización mucosa en la remisión o la remisión sin corticoides en semana 24. Por otro lado, el estudio MERIT-UC72 incluyó a 40 pacientes que recibieron durante 16 semanas metotrexate 25 μg s.c./semanal asociado a prednisona en régimen descendente y lograron una respuesta o remisión inicial. Los pacientes fueron aleatorizados a metotrexate 25 mg s.c./semana frente a placebo a partir de la semana 16. Este estudio no encontró diferencias en el mantenimiento de la respuesta o remisión en la semana 48 ni en ninguno de los objetivos secundarios planteados.
En un estudio retrospectivo estadounidense201 con 90 pacientes, 23 recibieron metotrexate parenteral en dosis medias de 25 mg/semanas y 68 recibieron metotrexate oral en dosis medias de 15 mg oral. Se observó que 37% del primer grupo y 30% del segundo lograron suspender los corticoides luego de un año. Otro estudio retrospectivo español202 evaluó la respuesta clínica (a criterio médico) de 40 pacientes a seis meses. Se observó un éxito de 45% con dosis de 25 mg s.c. tras la inducción con ciclosporina. Un pequeño estudio italiano203 con 23 pacientes con CU reportó una eficacia clínica del 47% a dos años.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.2.3 GADECCU.
Tratamiento CU (2022): tofacitinib para el mantenimiento de la remisión del brote moderado-grave de CU.
Recomendamos el uso de tofacitinib a dosis de 5 mg cada 12 h para el mantenimiento de la remisión del paciente tras un brote moderado-grave de CU luego de la inducción con tofacitinib.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
La evidencia procede de los estudios comentados en la pregunta de inducción, de forma que en el mantenimiento solo hay un ensayo. Se trata del estudio OCTAVE Sustain73, que incluyó a los pacientes que respondieron (descenso del Mayo total basal ≥ 3 puntos y ≥ 30%, junto con un descenso en el subíndice del sangrado rectal ≥ 1 o un subíndice ≤ a 1) en la semana 8 en cualquiera de los dos estudios de inducción (OCTAVE Induction 1 y 2). Un total de 593 pacientes fueron aleatorizados a recibir tratamiento de mantenimiento con tofacitinib 5 mg dos veces al día, 10 mg dos veces al día o placebo durante 52 semanas. La variable principal de eficacia fue la remisión clínica (Mayo total ≤2, sin sub-puntuaciones >1 y una sub-puntuación de sangrado rectal de 0) en la semana 52, y como variables secundarias de eficacia se incluyeron la curación mucosa (Mayo endoscópico ≤1) en la semana 52, la remisión sostenida (en las semanas 24 y 52) y la remisión libre de corticoides entre los pacientes en remisión al momento de la inclusión en el ensayo clínico de mantenimiento. En el estudio OCTAVE Sustain se obtuvo la remisión en 34,3% de los pacientes tratados con tofacitinib 5 mg/12 horas y en 40,6% de los tratados con 10 mg/12 horas, frente a 11,1% en el grupo placebo (p = < 0,001 para ambas comparaciones con placebo). Un 37,4% del primero grupo y 47,5% del segundo lograron la curación mucosa (p = < 0,001 para ambas comparaciones con placebo). No se dispone de datos de vida real sobre el uso del tofacitinib en CU.
En cuanto a la seguridad del tofacitinib en el mantenimiento, la tasa de EA graves fue similar entre los grupos de tratamiento. Al igual que sucedía en la fase de inducción, durante el mantenimiento las tasas de infección de cualquier gravedad fueron numéricamente más frecuentes en los pacientes tratados con tofacitinib que en los que recibieron placebo (tofacitinib 5 mg 35,9%, tofacitinib 10 mg 39,8% y placebo 24,2%), pero no fue así para las infecciones graves. Se produjeron más herpes zóster en el grupo tofacitinib —en especial a dosis de 10 mg/12 horas— que en el grupo placebo (5,1% de los pacientes tratados con tofacitinib 10 mg cada 12 horas, 1,5% en el grupo tratado con 5 mg). No obstante, la necesidad de retirar el tratamiento por EA fue superior en los pacientes tratados con placebo. En los estudios de inducción y mantenimiento, se produjeron efectos cardiovasculares en cinco pacientes del grupo tofacitinib y en ninguno del grupo placebo. El uso crónico de tofacitinib también elevó los niveles de lípidos.
La evidencia agregada en esta actualización incluye dos estudios. Por un lado, una revisión sistemática de metaanálisis75 de 2019 que recopiló datos sobre la eficacia y la seguridad de los productos biológicos y el tofacitinib en la CU de moderada a grave. Este estudio incorporó treinta y un metaanálisis: los cuatro productos biológicos y el tofacitinib fueron superiores al placebo en cuanto a eficacia.
Por otro lado, el estudio RIVETING204, que actualmente se encuentra en curso, ha publicado resultados preliminares. Se trata de un estudio que evalúa la eficacia y la seguridad de la reducción de la dosis de tofacitinib a 5 mg dos veces al día vs. continuar con 10 mg dos veces al día en pacientes con CU en remisión que reciben tofacitinib 10 mg dos veces al día como terapia de mantenimiento. Los pacientes forman parte del estudio de extensión abierto OCTAVE Open y pertenecen a la rama que recibió tofacitinib 10 mg dos veces al día durante ≥ 2 años consecutivos y estuvo en remisión durante ≥ 6 meses. El objetivo primario fue la remisión del índice de Mayo modificado al mes 6. En total, 140 pacientes fueron aleatorizados (1:1) a tofacitinib 5 o 10 mg dos veces al día; 77,1% de los pacientes que recibieron 5 mg y 90% del grupo que recibió 10 mg dos veces al día, estaba en remisión en el mes 6 (diferencia ajustada 12,9%; IC 95% 0,5-25,0). Las tasas de EA y EA graves fueron similares entre los grupos de tratamiento y no se informaron muertes.
Recomendación 2.2.4 GADECCU.
Tratamiento CU (2022): aféresis para el mantenimiento de la remisión de la CU.
Recomendamos NO utilizar aféresis para el mantenimiento de la remisión del paciente tras un brote moderado-grave de CU.
Dirección de la recomendación: fuerte en contra. Calidad de la evidencia: baja.
No disponemos de resultados de seguimiento a mediano y largo plazo del ensayo clínico aleatorizado inicial publicado en 2008106 ni del estudio sueco109. En el estudio ATTICA110 los porcentajes de mantenimiento en la semana 24 no fueron diferentes en el grupo de aféresis con prednisona comparados con el grupo de prednisona sola, aunque el porcentaje de pérdidas en el seguimiento de estos pacientes fue de 70%.
Un ensayo clínico específicamente diseñado para mantenimiento se publicó en 2012205. En este ensayo se incluyó a 21 pacientes con CU que habían alcanzado la remisión con diferentes tratamientos (ciclosporina, corticoides o aféresis) y se aleatorizaron a mercaptopurina 0,5 mg/kg semana o sesiones de aféresis (una a dos semanas). Al evaluar el porcentaje de mantenimiento de remisión en el mes 24 no se observaron diferencias entre ambos grupos y la calidad de la evidencia es baja.
Disponemos de los estudios de práctica clínica a mediano y largo plazo que mostraron que, una vez conseguida la remisión, los porcentajes al año de mantenimiento eran similares a los reportados en la semana 12, y no había necesidad de nuevas sesiones de aféresis112,114,206. En este sentido, ya en el estudio de Cabriada, que incluía a pacientes con CU corticodependiente, no había diferencias significativas en el porcentaje de mantenimiento entre los pacientes que habían entrado en remisión en la semana 12 y habían seguido con aféresis a criterio médico hasta el año (58%) y aquellos que no habían seguido con sesiones de mantenimiento (51%). Incluso en el estudio japonés114, en el que se incluyó a más de 800 pacientes, no se observaron diferencias entre los pacientes que habían mantenido las sesiones de aféresis a criterio clínico y aquellos que no.
En esta actualización se incluyó un ECA207 publicado en 2020 cuyo objetivo fue demostrar la eficacia y seguridad de la terapia de aféresis para el mantenimiento de la remisión de la CU en pacientes que habían logrado la remisión por aféresis de adsorción de granulocitos y monocitos o leucocitaféresis. Se asignaron al azar 164 pacientes en una proporción 1:1 a aféresis (dos veces al mes durante 12 meses) o control (sin tratamiento de aféresis). El criterio principal de valoración fue la tasa de remisión clínica a los 12 meses, que se observó en 46,6% del grupo de aféresis y 36,4% del grupo control. También se evaluó la tasa de remisión endoscópica a los 12 meses, que fue mayor en el grupo de aféresis que en el de control (42,5 vs. 25,9%), la tasa de remisión clínica (47,5 vs. 32,1%) y la remisión endoscópica completa (33,8 vs. 19,8%). No se observaron diferencias significativas. Tampoco se registraron eventos adversos graves en ninguno de los grupos.
Recomendación 2.2.5 GADECCU.
Tratamiento CU (2022): infliximab para el mantenimiento de la remisión de la CU.
Recomendamos el uso de infliximab a dosis de 5 mg/kg al día cada ocho semanas para el mantenimiento de la remisión del paciente luego de un brote moderado de CU corticodependiente/resistente si la remisión o respuesta se ha obtenido con infliximab.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
Los datos disponibles sobre infliximab en el tratamiento de mantenimiento de la CU están perfectamente sintetizados en una revisión sistemática83 que hemos citado previamente. De todos los pacientes incluidos en los ECA, solo los ACT84 aportan datos de seguimiento prolongado. Estos estudios incluyeron a pacientes con brotes moderados a graves ambulatorios, muchos de ellos corticodependientes o corticorresistentes. Se trataron con placebo o infliximab en la fase aguda y posteriormente se realizó mantenimiento en el subgrupo que había respondido a la inducción. Estos estudios ofrecen datos a mediano y largo plazo (resultados a 30 y 54 semanas). En ellos el infliximab resultó significativamente superior al placebo para mantener la remisión o respuesta. Así, en los pacientes en mantenimiento con infliximab la tasa de remisión superó en 20% a los tratados con placebo (OR 2,72; IC 95% 1,92-3,86). La tasa de respuesta con infliximab fue 30% superior al placebo (OR 3,4; IC 95% 2,52-4,59). Los datos sobre la eficacia del infliximab para prevenir la colectomía no se mencionan en la publicación inicial, pero sí en un subanálisis posterior208. Este subanálisis señala que el 17% de los pacientes tratados con placebo requirió colectomía frente a 10% de los tratados con infliximab (p = 0,02, reducción absoluta del riesgo de 7%). También se han publicado datos que señalan que el infliximab disminuye significativamente el uso de recursos hospitalarios y mejora la calidad de vida de los pacientes.
En cuanto a la seguridad, los datos son similares a los descritos en la EC y a lo referido en apartados anteriores de esta guía. En la revisión de Gisbert et al.83 se pone de manifiesto que analizar los EA de todas las series no es sencillo, porque en algunos de los ECA se proporcionó solo el número total de EA y no el de pacientes con EA (un mismo paciente puede tener más de un efecto adverso). En esta revisión se observó que había EA en 83% (IC 95% 80-86) de los pacientes tratados con infliximab y en 75% (IC 95% 70-81) de los tratados con placebo, con un OR de 1,52 y un NNT de 14 (IC 95% 5-25). Concretamente, en los ACT84 (ACT 1 hasta 54 semanas, ACT 2 hasta 30 semanas) el porcentaje de EA fue similar en el grupo tratado con placebo y en el de los pacientes que recibieron infliximab en las dos dosis empleadas (proporción de enfermos con EA en ACT 1: 25,6% en la rama placebo, 21,5% en la rama 5 mg/kg y 23,8% en la rama 10 mg/kg; ACT 2: 19, 10,7 y 9,2%, respectivamente). Sin embargo, se registraron algunas infecciones graves en pacientes tratados con infliximab y reacciones infusionales precoces (8-12% de los pacientes) y tardías en algunos casos. Algunos estudios observacionales posteriores y evaluaciones a más largo plazo de alguno de los ensayos incluidos en esta revisión83 corroboran completamente estas conclusiones y añaden información. Además, el estudio SUCCESS doble ciego a 16 semanas de inducción en 239 pacientes comparando tres ramas: infliximab/azatioprina, infliximab/placebo y placebo/azatioprina en pacientes con CU moderada-grave, cuyo objetivo primario fue la remisión libre de corticoides, confirmó la eficacia del infliximab en el tratamiento de la CU209.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.2.6 GADECCU.
Tratamiento CU (2022): adalimumab para el mantenimiento de la remisión de la CU.
Recomendamos el uso de adalimumab a dosis de 40 mg/2 semanas para el mantenimiento de la remisión del paciente que ha respondido al tratamiento de inducción con adalimumab.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
Disponemos de una revisión sistemática91 que incluye dos ECA (767 pacientes) con los que se evaluó la eficacia del mantenimiento con adalimumab luego de la inducción de la remisión (índice de Mayo ≥ 2 sin ningún subscore > 1) en pacientes con brote leve-moderado de CU. En esta revisión sistemática, adalimumab fue superior al placebo para el mantenimiento de la remisión clínica (RR 2,38; IC 95% 1,57-3,59; p = < 0,0001). También fueron significativamente diferentes la respuesta clínica (RR 1,69; IC 95% 1,29-2,21; p = 0,0001), la curación mucosa (RR 1,69; IC 95% 1,26-2,68; p = 0,0005) y la calidad de vida a través del Inflammatory Bowel Disease Questionnaire (IBDQ) (RR 1,73; IC 95% 1,28-2,34; p = 0,0004).
Al evaluar la remisión libre de corticoides en ambos estudios, había mucha heterogeneidad de datos, lo que disminuye claramente la evidencia. En el ULTRA 2, en la semana 52, 13,3% de los pacientes en rama adalimumab estaban libres de corticoides frente a 5,7% de la rama placebo (p = 0,035)89. En el ECA japonés, casi un tercio de los pacientes que tomaba corticoides al comienzo del estudio logró su retirada en la semana 52 frente a 20,7% de la rama placebo90.
Los resultados publicados sobre mantenimiento de los estudios de vida real también son muy variados, pero a nivel global son mejores que los de los ensayos clínicos, probablemente porque, tal como ocurre en la serie de ENEIDA93, se permitió la intensificación (que llegó a necesitar hasta en 36% de los pacientes durante el primer año), el tratamiento concomitante con corticoides sistémicos y/o el tratamiento rectal. Los porcentajes de respuesta y remisión en la semana 52 de los estudios de vida real variaron entre 38 y 50% para la respuesta clínica y 18 y 40% para la remisión clínica. En la serie con más pacientes (ENEIDA)93, en la semana 52, no hubo diferencias entre los pacientes naïve a infliximab y los no naïve. Los porcentajes de respuesta clínica fueron de 30 y 10% de remisión. Sin embargo, al evaluar la colectomía, los resultados fueron significativamente diferentes en estos dos grupos: 10% en pacientes naïve frente a 41% en pacientes no naïve (p = 0,014), es decir, fundamentalmente en los pacientes no respondedores primarios a infliximab previamente.
Al evaluar los EA y EA graves en la revisión sistemática, no se observaron diferencias significativas entre el adalimumab y el placebo. Tampoco hubo diferencias en los estudios de práctica clínica.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.2.7 GADECCU.
Tratamiento CU (2022): golimumab para el mantenimiento de la remisión de la CU.
Recomendamos el uso de golimumab para el mantenimiento de la remisión del paciente con brote moderado-grave de CU en dosis mínimas de 50 mg cada cuatro semanas y, posiblemente, dosis óptimas de 100 mg cada cuatro semanas.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: alta.
El estudio PURSUIT-M es el ECA que evaluó la terapia de mantenimiento con golimumab en pacientes con CU210. En este estudio, el objetivo primario fue la respuesta clínica mantenida a la semana 54 y se reportaron porcentajes de 49,7 y 47% (con dosis de golimumab de 100 mg y 50 mg cada cuatro semanas, respectivamente) frente a 31% en el grupo placebo (p = 0,001). Entre los objetivos secundarios, la remisión clínica en la semana 30 y 52 (27,8 vs. 16% placebo; p = 0,004) y la cicatrización mucosa en la semana 30 y 52 (42,4 vs. 26,6%) solo fueron estadísticamente diferentes con la dosis de 100 mg. Los porcentajes de remisión libre de corticoides fueron de 23% con la dosis de 100 mg/4s, 28,2% con 50 mg/4s y 18,4% con el placebo.
Con respecto a los EA, fueron similares a los del placebo excepto en los EA graves, que fueron más frecuentes estadísticamente en el grupo que recibió golimumab de 100 mg.
Además de estos resultados del ensayo clínico, en la actualidad disponemos de los resultados del seguimiento a dos años211 en el que se incluyó a los 195 pacientes del estudio PURSUIT-SC que habían recibido golimumab a cualquier dosis de mantenimiento. Esta eficacia se midió mediante la physician's global assessment (evaluación global del médico [PGA]) y se observó en la semana 104, 56,4% de los pacientes con una PGA = 0 y 85% con una PGA de 0/1 con 88,5% libre de corticoides y 62% con IBDQ > 170, con un perfil de seguridad similar al reportado en el PURSUIT-M.
En el seguimiento a tres años del PURSUIT-M212, 63% de los pacientes siguió en tratamiento con golimumab sin nuevos EA relevantes. Los porcentajes de PGA 0 mejoraron, y crecieron de 56,4% en el seguimiento a dos años a 78% en el seguimiento a tres años. También mejoraron los porcentajes de pacientes libres de corticoides (se pasó de 88,5 a 93,4%); 20% de los pacientes necesitó una intensificación de 50 a 100 mg.
Aunque se han realizado más estudios, solo se publicaron dos estudios postcomercialización que evalúan la eficacia a largo plazo del golimumab. GO-COLITIS96 (Reino Unido) incluyó a 205 pacientes y comunicó 37,1% de remisión clínica mantenida en la semana 54 y 30% de remisión clínica. En el estudio BE-SMART97, se reportó 41% de pacientes libres de corticoides en la semana 26.
Hay 10 estudios prospectivos y retrospectivos de práctica clínica real con 1.055 pacientes descritos individualmente en una revisión de 201898. Son estudios muy heterogéneos en cuanto a la inclusión y definición de endpoints, y reportaron porcentajes de mantenimiento de la respuesta y remisión clínica de 60,3 y 39,2%, respectivamente. Estos porcentajes fueron mejores en aquellos pacientes en los que no se había utilizado previamente infliximab. Los porcentajes de intensificación a largo plazo solo se detallaron en tres estudios y van de 22% en el estudio belga BE-SMART97 a 43% en el estudio retrospectivo irlandés213 y alcanzan 62% en el estudio español retrospectivo liderado por Taxonera.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.2.8 GADECCU.
Tratamiento CU (2022): vedolizumab para el mantenimiento de la remisión de la CU.
Recomendamos el uso de vedolizumab en dosis mínimas de 300 mg cada ocho semanas para el mantenimiento de la remisión del paciente con brote moderado-grave de CU luego de la inducción con vedolizumab.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
Solo se ha publicado un ECA214 que evalúa la eficacia del vedolizumab en el tratamiento de mantenimiento. En la semana 6, los pacientes que obtuvieron respuesta tras el régimen de inducción se aleatorizaron 1:1:1 (vedolizumab cada ocho semanas; vedolizumab cada cuatro semanas y placebo cada cuatro semanas). Los porcentajes de remisión clínica en la semana 52 fueron de 41,8, 44,8 y 20%, respectivamente (< 0,001), pero no se observaron diferencias entre ambos grupos de intervención de tratamiento. Los porcentajes de respuesta clínica mantenida (respuesta en la semana 6 y también en la semana 52), remisión clínica mantenida, curación mucosa y remisión clínica libre de corticoides fueron estadísticamente diferentes y mayores con el vedolizumab que con el placebo. No se observaron diferencias entre el grupo al que se le administró vedolizumab cada cuatro semanas y el que lo recibió cada ocho. La utilización previa de anti-TNF (40% de los pacientes en la inclusión ya habían utilizado anti-TNF) no afectó los porcentajes de respuesta clínica mantenida ni los de remisión clínica mantenida en la semana 52.
En el análisis post-hoc de los datos de GEMINI100 en la semana 52, las diferencias absolutas entre los pacientes que no habían utilizado anti-TNF y los pacientes en quienes fracasó el anti-TNF (pérdida de respuesta, no respuesta o intolerancia) fueron similares respecto a la remisión: 46 y 19%, respectivamente en pacientes naïve a anti-TNF (RA 28%; IC 95% 14,9- 41,1; RR 2,5; IC 95% 1,5-4,0) vs. 36,1 y 29,5% en pacientes en quienes había fracasado el tratamiento con anti-TNF (RA 29,5%; IC 95% 12,8-46,1; RR 6,6; IC 95% 1,7-26,5). No se observaron diferencias significativas en los EA entre los grupos placebo y los tratados con diversas dosis de vedolizumab.
Incluimos en esta actualización la evidencia derivada de tres nuevos estudios con relación al mantenimiento de la remisión. El primero es un ECA215 de alta calidad, publicado en 2020, que incluyó a 216 pacientes con CU grave y reportó que el vedolizumab s.c. fue más eficaz en comparación con el placebo como tratamiento de mantenimiento en aquellos pacientes que habían tenido respuesta clínica a la inducción con vedolizumab e.v. en las semanas 0 y 2. La remisión clínica en la semana 52 fue alcanzada por 46,2% de los pacientes con vedolizumab s.c., 42,6% de los pacientes tratados con vedolizumab e.v. y 14,3% del grupo placebo, r (vedolizumab s.c. frente a placebo: Δ32,3%; IC 95% 19,7-45,0%; p = < 0,001). El grupo de vedolizumab s.c. también tuvo mayor mejoría endoscópica y clínica duradera en la semana 52 en comparación con el placebo (ambos p = < 0,001).
En el segundo ECA,103de moderada calidad, que incluyó a pacientes con CU moderada o severa, de un total de 246 pacientes que participaron en la fase de inducción, 83 respondieron al vedolizumab y fueron incluidos en la fase de mantenimiento. La tasa de remisión clínica en la semana 60 fue significativamente mayor en el grupo de vedolizumab, con 56,1 (23/41) vs. 31,0% (13/42) del grupo placebo (OR 2,88; IC 95% 1,168-7,108; p = 0,0210). Estos datos fueron consistentes con los informados por el estudio GEMINI 1. La mayoría de los EA fueron de intensidad leve a moderada y no se produjeron muertes durante el periodo del estudio.
Un tercer ECA de alta calidad publicado en el 2021104 (que surge de los datos del estudio VARSITY) incluyó a 769 pacientes con CU moderada o severa y observó que el vedolizumab indujo una mayor remisión histológica que el adalimumab en la semana 52 (Geboes 29,2 vs. 8,3%/DA 20,9%; IC 95% 15,6-26,2; p = < 0,0001 /RHI 37,6% vs. 19,9%; DA 17,6%; IC 95% 11,3-23,8; p = < 0,0001). Esta observación no se modificó cuando se evaluó por separado a los pacientes anti-TNF naïve y cuyo tratamiento había fallado.
Recomendación 2.2.9 GADECCU
Tratamiento CU (2022): ustekinumab para el mantenimiento de la remisión de la CU
Recomendamos el uso de ustekinumab a dosis de 90 mg cada 8 o 12 semanas por vía subcutánea para el mantenimiento de la remisión del paciente luego de un brote moderado-grave de CU tras la inducción con ustekinumab.
Dirección de la recomendación: fuerte a favor. Calidad de la evidencia: moderada.
La evidencia sobre el uso de ustekinumab como terapia de mantenimiento en pacientes con CU moderada a severa surge del estudio pivotal (UNIFI) que contempla la inducción y el mantenimiento con este fármaco105. Los pacientes que respondieron en la fase de inducción, a las ocho semanas de la dosis de ustekinumab e.v. (respuesta definida como un descenso en el Mayo total ≥ 30% y de ≥ 3 puntos con respecto al basal, acompañado de un descenso de ≥ 1 punto en el subíndice de sangrado rectal o una puntuación de dicho sangrado rectal de 0 o 1), entraron en el ensayo de mantenimiento. También lo hicieron aquellos que no respondieron en el grupo placebo y que recibieron una dosis de ustekinumab e.v. en la semana 8 y obtuvieron una respuesta en la semana 16. Todos estos pacientes (respondedores a las ocho semanas de una dosis de ustekinumab endovenoso) nuevamente fueron aleatorizados a recibir, en la semana 0 del ensayo de mantenimiento, 90 mg de ustekinumab s.c. cada 12 semanas, ustekinumab s.c. cada ocho semanas o placebo hasta la semana 40 en proporción 1:1 según bloques estratificados, de acuerdo con el régimen de inducción recibido, la eficacia obtenida y el uso o no de corticoides. La remisión obtenida en la semana 44 tras la primera dosis de inducción fue significativamente superior en el grupo ustekinumab (cada 12 u ocho semanas) en comparación con el grupo placebo, con unas tasas, de 38,4, 43,8 y 24,0%, respectivamente (p = 0,002 y p = < 0,001, en las comparaciones cada 12 y ocho semanas con placebo). Este fue el grupo de análisis primario del estudio de mantenimiento, si bien también entraron en el ensayo de mantenimiento los pacientes que no habían respondido en la semana 8 a la dosis e.v. pero que sí lo hicieron en la semana 16, tras la primera dosis subcutánea de ustekinumab. Todos ellos recibieron mantenimiento con ustekinumab cada ocho semanas.
En cuanto a la seguridad, los efectos secundarios del ustekinumab fueron similares a los del placebo en la semana 44 de mantenimiento. Así, la tasa de de pacientes que presentó algún efecto adverso fue similar en los tres grupos (69,2, 77,3 y 78,9% en los grupos de 90 mg de ustekinumab cada 12 semanas, 90 mg de ustekinumab cada ocho semanas y placebo, respectivamente). Lo mismo sucedió para los EA graves (tasas de 7,6, 8,5 y 9,7%, respectivamente) y para las infecciones. Como EA de interés, hasta la semana 52 de todo el ensayo, entre los 825 pacientes tratados con ustekinumab hubo dos muertes (una por distrés respiratorio y otra por hemorragia por varices esofágicas), cuatro potenciales infecciones oportunistas, dos efectos cardiovasculares mayores y siete casos de cáncer. Entre los 319 pacientes tratados con placebo no hubo muertes, hubo un evento cardiovascular mayor y un caso de cáncer (testicular).
En la nueva evidencia agregada en esta actualización se incluyó un ECA216 publicado en 2020 donde evaluaron la eficacia (hasta la semana 92) y la seguridad (hasta la semana 96) del ustekinumab durante la extensión a largo plazo del estudio UNIFI. Los 399 respondedores a la inducción de ustekinumab e.v. que fueron aleatorizados a terapia de mantenimiento luego se incluyeron en la extensión a largo plazo (115 recibieron placebo s.c., 141 recibieron ustekinumab 90 mg cada 12 semanas, y 143 recibieron ustekinumab 90 mg cada ocho semanas). Entre todos los pacientes aleatorizados en mantenimiento, las tasas de remisión clínica en la semana 92 fueron de 64,5 y 67,6% en los grupos ustekinumab cada 12 y cada ocho semanas, respectivamente. Entre los pacientes aleatorizados tratados en la extensión a largo plazo, 78,7% de los que recibieron ustekinumab cada 12 semanas y 83,2% de los que lo recibieron cada ocho, alcanzaron la remisión clínica en la semana 92; > 95% de los pacientes en remisión clínica en la semana 92 estaban libres de corticosteroides. Tanto el grupo que recibía ustekinumab cada 12 semanas como el que lo recibía cada ocho mantuvieron la eficacia hasta la semana 92. Desde la semana 44 a la 96, los EA por 100 pacientes-año de seguimiento para ustekinumab combinado en comparación con el placebo fueron: 255,68 vs. 267,93; EA graves, 9,34 vs. 12,69; malignidades (incluyendo cánceres de piel no melanoma), 0,93 vs. 1,49; infecciones graves, 2,33 vs. 2,99.
Mantenimiento de la remisión obtenida tras brote grave de CURecomendación 2.3.1 GADECCU.
Tratamiento CU (2022): tiopurinas para el mantenimiento de la remisión de la CU luego del infliximab.
Dirección de la recomendación: no es posible establecer una recomendación. No disponemos de datos que nos permitan analizar la utilidad de las tiopurinas como tratamiento de mantenimiento luego de un brote grave de CU controlado con infliximab.
Calidad de la evidencia: muy baja.
No hay ensayos clínicos que analicen específicamente la eficacia de los inmunomoduladores tras un brote grave controlado con infliximab (no hay datos sobre su uso aislado o asociado a infliximab en esta situación clínica). Tampoco disponemos de suficientes datos observacionales. Sí sabemos que la azatioprina mantiene la remisión en una serie de escenarios concretos en los que se utiliza infliximab en la CU (p. ej., en la corticodependencia o en un brote moderado corticorresistente). También sabemos que el uso de los tiopurínicos junto con el tratamiento con infliximab en la EC, mantenido durante los primeros meses, parece mejorar algunos aspectos del tratamiento.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.3.2 GADECCU.
Tratamiento CU (2022): infliximab para el mantenimiento de la remisión de la CU.
Sugerimos el uso de infliximab a dosis de 5 mg/kg cada ocho semanas para el mantenimiento de la remisión del paciente con CU grave tras la inducción con infliximab.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: baja.
En este escenario clínico los datos son muy limitados (la mayoría de los pacientes incluidos en los ACT sufría brotes moderados, por lo que los resultados no tienen por qué ser aplicables al brote grave). No disponemos de ensayos controlados que analicen la eficacia del infliximab como terapia de mantenimiento tras el brote grave controlado con este agente. De los ensayos incluidos en las revisiones sistemáticas,155,83 los trabajos sobre los brotes graves no ofrecen datos acerca de la evolución a mediano plazo de los pacientes tras el control del brote, con la excepción de los resultados de la serie de Gustavsson et al.158 Las tasas de colectomía a tres años del brote grave fueron de 50 y 76% en los grupos infliximab y placebo, respectivamente (12/24 vs. 16/21 pacientes, p = 0,012). El seguimiento de los estudios ACT indica que la tasa de colectomía se reduce claramente cuando el tratamiento se mantiene209. Hay también datos retrospectivos que señalan una eficacia del tratamiento de mantenimiento, aunque son difíciles de interpretar en algunos puntos160.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.3.3 GADECCU.
Tratamiento CU (2022): tiopurinas para el mantenimiento de la remisión de la CU
Sugerimos el mantenimiento con azatioprina/6-mercaptopurina asociada o no a ciclosporina oral los primeros 3 meses tras la inducción de la remisión con ciclosporina en el paciente con un brote grave de CU resistente a corticoides.
Dirección de la recomendación: débil a favor. Calidad de la evidencia: baja.
La evidencia que analiza la eficacia de las tiopurinas en el mantenimiento de la remisión inducida por ciclosporina proviene en su totalidad de series observacionales. Hemos identificado siete series146-148,217-219, con seguimientos variables, pero a veces muy prolongados (hasta siete años). En la mayoría se informó de tasas elevadas de colectomía a mediano plazo. Al año se situaron entre 33 y 69%. En la mayoría de las series se utilizaron tiopurínicos para mantener la remisión a largo plazo y, aunque hay diferencias, en general señalan su utilidad.
Hay dos estrategias muy diferentes tras obtener la remisión con ciclosporina endovenosa: a) pasar de ciclosporina intravenosa a oral durante unos meses y comenzar simultáneamente con azatioprina para mantenerla posteriormente de forma continuada y b) al finalizar la ciclosporina intravenosa, comenzar solo con la azatioprina, sin ciclosporina oral; en ambos casos se desciende progresivamente la dosis de corticoides. Los resultados de estas series muestran en general que la azatioprina mejora la evolución en este escenario (hay una sola excepción). Incluso parece razonable evitar el uso de ciclosporina oral asociada ante los resultados equivalentes de ambas estrategias y el mayor riesgo que implica el uso de tres inmunomoduladores.
La eficacia de la azatioprina para el mantenimiento de la remisión tras un brote grave de CU en el que se utilizó ciclosporina para conseguir la remisión en los pacientes que ya estaban en tratamiento con azatioprina parece ser escasa220.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.3.4 GADECCU.
Tratamiento CU (2022): ciclosporina para el mantenimiento de la remisión de la CU.
Recomendamos NO utilizar la ciclosporina para el mantenimiento del paciente con CU grave que ha obtenido la remisión con ciclosporina.
Dirección de la recomendación: fuerte en contra. Calidad de la evidencia: muy baja.
Debido a su nefrotoxicidad (que puede ser grave e irreversible), no parece recomendable el empleo de ciclosporina a largo plazo en una enfermedad tratable quirúrgicamente. No disponemos de ningún estudio controlado en esta situación. En la mayoría de las series146,148,220 que analizan la evolución de los pacientes tras el control del brote con ciclosporina, esta se mantuvo por vía oral durante unos meses a la vez que se introdujo la azatioprina (véase apartado anterior). El sentido teórico de esta estrategia es mantener la remisión hasta que la azatioprina, fármaco de acción lenta, comience a ejercer su efecto. Por el contrario, en otras series, tras el control del brote con ciclosporina se pasó directamente a la azatioprina. Las tasas de respuesta con esta estrategia no parecen diferentes a las obtenidas con la otra. Finalmente, en algunas series aisladas se mantuvo la ciclosporina como único tratamiento durante unos meses, sin añadir azatioprina. Uno de los factores importantes en cuanto a la tasa de respuesta a largo plazo tras el control de un brote grave con ciclosporina parece ser si el paciente ya estaba tomando o no azatioprina.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Recomendación 2.3.5 GADECCU.
Tratamiento CU (2022): tacrolimus para el mantenimiento de la remisión de la CU.
Sugerimos NO utilizar el tacrolimus para el mantenimiento del paciente con CU grave que ha obtenido la remisión con tacrolimus.
Dirección de la recomendación: débil en contra. Calidad de la evidencia: muy baja.
Disponemos de una revisión sistemática154 en la que se incluyen dos ECA de alta calidad metodológica (Jadad 4,5) que no evalúan el mantenimiento y 23 estudios observacionales prospectivos y retrospectivos en los que se obtienen porcentaje libres de colectomía de 86% a un mes (IC 95% 0,64- 0,95), 84% a tres meses (IC 95% 0,76-0,90), 78% a seis meses (IC 95% 0,51-0,92) y 69% a 12 meses (IC 95% 0,50-0,83), aunque la evaluación de los estudios incluidos en el análisis indica una heterogeneidad alta.
Aunque tomados en conjunto el número de EA en la rama tacrolimus fue mayor que en la rama placebo, al analizar solo los EA graves no se encontraron diferencias con el placebo. Globalmente (considerando tanto el ensayo clínico como estudios observacionales), hubo 38 pacientes que experimentaron algún tipo de efecto adverso grave en los 11 estudios incluidos que los valoraban, que cedió al suspender el tratamiento o con un tratamiento específico. Los EA no graves de los diferentes estudios observacionales fueron bajos, de 11% (IC 95% 0,06-0,20). Nuevamente, en esta variable la heterogeneidad de los estudios incluidos fue alta, lo que disminuyó su evidencia.
La búsqueda sistematizada para la actualización de la guía no arrojó nueva evidencia sobre esta recomendación.
Mantenimiento de la remisiónComentarios GADECCUComo estamos de acuerdo con las recomendaciones del consenso STRIDE, creemos que no solo debemos intentar que nuestros pacientes se encuentren «bien» (es decir, que no tengan síntomas y disfruten de una buena calidad de vida), sino que también debemos tener un buen control de la inflamación que, idealmente, definiríamos mediante una endoscopia sin lesiones mucosas (Mayo 0). Para disminuir la frecuencia de la endoscopia, que es un estudio invasivo y costoso, utilizamos marcadores subrogados como la PCR y, sobre todo, la calprotectina fecal, y perseguimos también la normalización de estos parámetros.
Mantenimiento de la remisión luego de un brote leve-moderadoConsideraciones sobre el uso de salicilatos vía oralLa evidencia a favor del uso de salicilatos en el tratamiento de mantenimiento de la CU es indiscutible. Ninguna formulación de mesalazina ha demostrado ser superior a otra y todas ellas han demostrado ser superiores al placebo, por lo que cualquier formulación podría utilizarse en este contexto. La sulfasalazina es tanto o más eficaz que la mesalazina, sin embargo, en la práctica clínica, la sulfasalazina se asocia con frecuencia y dependiendo de la dosis con la intolerancia gastrointestinal. Se ha de considerar un efecto negativo sobre la espermatogénesis de la sulfasalazina que podría limitar su indicación en hombres. En última instancia, se debe considerar que la toxicidad es poco frecuente y con carácter general leve para ambos compuestos.
Si se utiliza sulfasalazina, la dosis total mínima es de 2 g al día, y para evitar la intolerancia es posible fragmentar la dosis en al menos dos dosis diarias. En el caso de la mesalazina, es recomendable una dosis mínima de 1,5 g al día, aunque hay muchos datos que señalan que una dosis mayor (de 2 g al día) podría ser más eficaz. En realidad, no hay argumentos sólidos para disminuir la dosis que ha sido eficaz en el tratamiento agudo. En cualquier caso, se recomienda una dosis única diaria que podría mejorar la adherencia del paciente.
Se debe considerar que la dosis administrada en el mantenimiento debe adaptarse a cada paciente. No solo hay que considerar la resolución de los síntomas, sino también la remisión bioquímica (calprotectina fecal, PCR) y endoscópica. Desde esta perspectiva, encuadrada en el marco de las estrategias treat to target (tratamiento por objetivos), algunos pacientes requerirán dosis más elevadas de mantenimiento para lograr los objetivos terapéuticos.
Se podría añadir que es posible (aunque muy discutido) que los salicilatos tengan un efecto quimiopreventivo y disminuyan la tasa de carcinoma de colon en estos pacientes. Si bien dicho efecto se ha adjudicado al logro de la remisión endoscópica, la mayor parte de los expertos recomiendan el tratamiento indefinido y la mayor controversia se da en la dosis. Otro punto de controversia es si este tratamiento debería mantenerse en pacientes que escalan a otras opciones terapéuticas como los biológicos o las nuevas moléculas debido a este efecto quimiopreventivo.
Otro aspecto a considerar es el costo de estos tratamientos. En Argentina, las diferentes formulaciones de mesalazina tienen un costo sensiblemente más elevado que la sulfasalazina. En pacientes sin cobertura médica o de bajos recursos económicos, el uso de sulfasalazina podría ser una buena elección. Se debe considerar también que, en la actualidad, solo se dispone de comprimidos de sulfasalazina de 500 mg, lo que puede comprometer la adherencia de los pacientes a quienes se les prescriben dosis mayores. Sin embargo, para el caso de la mesalazina, en Argentina existen varias formulaciones: comprimidos de 400, 500, 800 mg, 1 y 1,2 g, así como también sobres de microgránulos de 1, 1,5, 2, 3 y 4 g.
Consideraciones sobre el uso de salicilatos vía tópicaLos salicilatos tópicos son un tratamiento de elección para el mantenimiento de la CU leve a moderada, principalmente en el contexto de la proctitis. En el caso de la colitis izquierda, el tratamiento combinado con mesalazina oral y tópica debe considerarse en función de la extensión de la enfermedad.
Una de las mayores dificultades con el tratamiento tópico es que el paciente lo acepte, ya que se trata de una vía de administración que puede ser incómoda, en especial en el tratamiento de mantenimiento a largo plazo. De hecho, dada la escasa evidencia disponible en estudios a largo plazo, la mayoría de los autores recomienda mantener el tratamiento solo durante seis meses si se trata del primer episodio de proctitis y este ha sido leve, y ampliar su duración en casos de resistencia o recidivas frecuentes. Es importante llegar a un acuerdo en cada caso con el paciente, porque tanto la formulación como la frecuencia de administración pueden ser variables y es más probable que el paciente cumpla con el tratamiento si se adapta la posología a su medida. Al comienzo es recomendable la dosificación diaria, pero luego se puede pasar a una dosis cada dos días e incluso en algunos casos ados o tres dosis semanales, ya que han probado ser superiores al placebo y claramente son más aceptables para la mayoría de los pacientes.
Consideraciones sobre el uso de probióticosLa literatura médica sobre probióticos y CU es muy difícil de interpretar puesto que: a) el tipo y la formulación de los diversos probióticos utilizados en los diversos estudios es muy variable; b) escasean las comparaciones con placebo y en muchos de los estudios la rama de probióticos recibe a la vez tratamiento con otros fármacos (particularmente aminosalicilatos) y c) los resultados publicados son muy heterogéneos. Por lo tanto, en el momento actual no existe evidencia firme a favor o en contra de la utilización de probióticos en la CU con excepción de la reservoritis, que no es una entidad objetivo de esta GPC. Algunos datos recientes indican que el VSL#3 puede ser de utilidad en la CU221 en situaciones de brote leve-moderado, como tratamiento aislado o complementario de la mesalazina, pero esta información todavía debe confirmarse antes de pasar a formar parte del esquema terapéutico básico.
En tanto no exista evidencia de calidad, no puede recomendarse el uso de probióticos en este contexto. Consideramos importante desaconsejar su uso más aún como tratamiento en monoterapia.
CU corticodependiente/corticorresistenteLas figuras 3 y 4 ilustran las siguientes situaciones clínicas:
Está claro que hay muchos más ECA con tiopurinas en la EC que en la CU, lo que a menudo hace que muchas revisiones de expertos indiquen que la evidencia para el uso de tiopurinas en la CU es insuficiente. Esto puede disminuir su utilización, sin embargo, numerosos estudios observacionales de muy buena calidad, que incluyen a muchos pacientes seguidos a lo largo de periodos muy prolongados65, confirman que las tiopurinas son globalmente incluso más eficaces en la CU que en la EC. Curiosamente, las tiopurinas parecen ser más eficaces en la EC de colon que en la de intestino delgado.
En el subgrupo especial de pacientes con corticodependencia, la superioridad de las tiopurinas en comparación con la mesalazina es manifiesta, como se demuestra en el estudio de Ardizzone et al.197 donde 53% de los pacientes con azatioprina y 19% de los pacientes con mesalazina (p = 0,006) lograron el desenlace combinado de remisión clínica, endoscópica y suspensión de esteroides.
Consideramos importante reconocer que su efectividad real puede verse limitada, no obstante, por los EA. Estos obligan a retirar el tratamiento en uno de cada cinco pacientes, y es en ellos donde se deben considerar otros tratamientos como los biológicos o la cirugía, dependiendo de la gravedad, los antecedentes del caso, la duración de la enfermedad y otros factores individuales.
La eficacia de la azatioprina es comparable a la 6-mercaptopurina, metabolito directo producto del metabolismo de la azatioprina. La dosis recomendada para el tratamiento de la CU oscila entre 1 y 1,5 mg/kg en una toma diaria. En pacientes con intolerancia digestiva a la azatioprina, el cambio a 6-MP puede ser una estrategia válida para mejorar la tolerancia.
La farmacocinética de las tiopurinas presenta una amplia variabilidad interindividual que se debe en gran parte a la existencia de diversos polimorfismos genéticos de la enzima tiopurina metiltransferasa (TPMT), enzima que interviene en la conversión de 6-mercaptopurina a 6-metilmercaptopurina. Este último es un metabolito inactivo. En algunos países está disponible la medición de la actividad de la TPMT eritrocitaria. En pacientes con baja actividad de la TPMT existe una elevada probabilidad de presentar mielotoxicidad grave (aplasia medular) y precoz, por lo que debe evitarse el tratamiento con tiopurinas en estos sujetos.
No existen estudios que demuestren ventaja alguna (ni en eficacia ni en seguridad) en dosificar el fármaco según la actividad TPMT eritrocitaria, por lo que su utilidad se reduce a la prevención de la aplasia medular precoz222.
En Argentina no se dispone ampliamente de la medición de la actividad de la TPMT. La determinación de los cambios en el volumen corpuscular medio y la confirmación de la inducción de una determinada leucopenia se han sugerido como estrategias para monitorear de forma individualizada a los pacientes con riesgo de toxicidad debido a estos fármacos y a los pacientes con dosis subterapéuticas e inmunodepresión inadecuada223. Se recomienda el control estricto con hemograma y hepatograma cada 15 días durante dos meses y luego de forma trimestral. No es necesaria la determinación de amilasa o lipasa si no se sospecha pancreatitis.
Es fundamental saber que la respuesta a las tiopurinas suele ocurrir luego de dos o tres meses de tratamiento, y los niveles de sus metabolitos se estabilizan aproximadamente cuatro semanas después de iniciado el tratamiento. La medición de los metabolitos en forma sistemática no se recomienda, pero puede ser útil en situaciones como la falta de respuesta o la respuesta parcial tras entre tres y seis meses de tratamiento, o en pacientes de quienes se sospecha que no cumplen bien el tratamiento, y en casos de mielo o hepatotoxicidad222. En Argentina la disponibilidad de esta medición también es limitada.
Por último, otra ventaja evidente de las tiopurinas que nos lleva a recomendarlas es su bajo costo en comparación con otras alternativas terapéuticas (como los biológicos o la mesalazina).
Consideraciones sobre el uso de metotrexateLos datos disponibles, que proceden tanto de estudios controlados como de estudios observacionales, no muestran una clara eficacia del metotrexate en esta indicación. Independientemente de los resultados, la baja calidad metodológica de los estudios no permite formular recomendaciones en este escenario.
Consideraciones sobre el uso de tofacitinib en el mantenimiento CU moderada a severaLos estudios pivotales han demostrado que el tofacitinib es eficaz en el tratamiento de mantenimiento de CU en dosis de 5 o 10 mg dos veces al día para mantener tanto la remisión clínica como la endoscópica.
Probablemente una de las características más atractivas del tofacitinib es su administración oral, que los pacientes pueden considerar una ventaja. La vida media de esta droga es relativamente corta lo que permite suspenderla, en caso de ser necesario, con un aclaramiento rápido. Se ha demostrado que el tofacitinib no produce inmunogenicidad, hecho que se asocia a una menor pérdida de respuesta, lo cual es una ventaja considerable en comparación con los anti-TNF.
Por otro lado, en pacientes en mantenimiento con tofacitinib de 5 mg cada 12 horas que pierden la respuesta, se ha demostrado que aumentar la dosis a 10 mg cada 12 horas puede ayudar a recuperar la respuesta en 59% de los pacientes y la remisión clínica en 34% de los casos a las ocho semanas del incremento de la dosis224.
Finalmente, debe considerarse el riesgo de los EA ya detallados en el apartado de inducción.
Consideraciones sobre el uso de anti-TNF para el mantenimiento de la CU moderada a severaInfliximab fue el primer biológico aprobado para tratar la CU. Es la droga con la que se tiene más experiencia en la actualidad y los estudios demuestran claramente que es superior al placebo.
Sabemos que tanto con infliximab como con el resto de los anti-TNF hasta 50% de los pacientes pierde respuesta en el mantenimiento, tras presentar respuesta en la inducción, y esto trae como consecuencia la suspensión del tratamiento225. Las infusiones de infliximab deben reglarse, ya que, como comentamos previamente, las interrupciones pueden generar anticuerpos anti-infliximab, lo que aumenta la posibilidad de pérdida de respuesta y reacciones de infusión225,226.
Considerando que la inmunogenicidad es un factor fundamental en la pérdida de respuesta a los anti-TNF, desde hace unos años la medición de niveles de droga en el valle (previos a su aplicación/infusión) y de anticuerpos antidroga (AAD) en sangre han permitido desarrollar nuevas estrategias de optimización de dosis o intervalos en la administración de este tipo de fármaco.
Se han planteado dos estrategias para el seguimiento utilizando la medición de niveles y AAD. Por un lado, una actitud reactiva, que propone utilizar estos recursos exclusivamente ante la pérdida de respuesta clínica o endoscópica y actuar en consecuencia. Con esta estrategia, el escenario propuesto para la utilización de los niveles es la pérdida de respuesta, ya que podemos distinguir una causa inmunogénica (presencia de anticuerpos), una farmacocinética (niveles bajos de droga sin anticuerpos) o una farmacodinámica (niveles adecuados con o sin anticuerpos). Para cada caso podría considerarse una estrategia diferente: en la causa inmunogénica podría ser posible revertir la presencia de anticuerpos incorporando un inmunomodulador y/o aumentado la dosis o directamente utilizando otro anti-TNF; para la causa farmacocinética, se podría aumentar la dosis o disminuir los intervalos; para la causa farmacodinámica, sería posible utilizar un fármaco con otro mecanismo de acción. De este modo, por ejemplo, puede evitarse intensificar cuando los niveles de fármaco ya son adecuados y por consiguiente ahorrar tiempo y recursos. Esta estrategia reactiva ante la pérdida de respuesta ha demostrado ser costo-eficaz, al menos en pacientes con EC227.
Por otro lado, se propone una actitud proactiva que consiste en determinar los niveles y AAD en forma sistemática y periódica ajustando la dosis o los intervalos del anti-TNF para conseguir unos niveles considerados «terapéuticos» y evitar o disminuir la pérdida de la respuesta.
Algunos estudios de naturaleza retrospectiva han comunicado el posible beneficio de la actitud proactiva frente a la reactiva a la hora de conseguir diferentes objetivos durante el mantenimiento de nuestros pacientes, como la disminución de cirugía, menos hospitalizaciones y menor pérdida de respuesta228,229. No obstante, en el estudio TAXIT230, que incluyó a pacientes con EC y CU (único ensayo clínico aleatorizado que ha evaluado esta estrategia en pacientes en remisión con CU), las tasas de remisión clínica no fueron significativamente mayores en los pacientes en los que se ajustaron las dosis tomando como guía los niveles en comparación con aquellos pacientes con quienes se siguió la estrategia guiada por síntomas. Sin embargo, se observó que los pacientes a los que se ajustaba las dosis para mantener niveles de infliximab entre 3 y 7 mg/L tenían una mayor tasa de supervivencia libre de recidiva.
Por el momento, en Argentina no disponemos de la posibilidad de medir niveles de drogas ni de realizar dosaje de AAD, por lo cual la decisión de optimizar (en dosis o frecuencia), suspender un tratamiento o incorporar otros fármacos al tratamiento con infliximab debe basarse en la presencia de síntomas clínicos, el momento de su aparición (falla primaria o secundaria) y el juicio clínico. Contar con esta tecnología en nuestro sistema de salud nos permitiría determinar su utilidad y la relación costo-efectividad en nuestro medio.
Otra consideración con el uso de infliximab es la recomendación de utilizarlo en combinación con la azatioprina. Esta recomendación surge del estudio SUCCESS que observó una mayor remisión libre de esteroides y curación a 16 semanas en el grupo tratado en comboterapia209. Una revisión sistemática posterior incluyó a 765 pacientes de cuatro ensayos controlados (389 pacientes en monoterapia con infliximab y 376 pacientes en terapia combinada). Entre los cuatro y seis meses de la terapia, las tasas de remisión clínica fueron significativamente más altas en los pacientes que recibieron terapia combinada231. Se ha observado también que la probabilidad de desarrollo de AAD es mayor en los pacientes en monoterapia. Si bien parece clara la indicación de su uso combinado, todavía faltan datos que permitan recomendar el momento adecuado para iniciarlo, si debe dejarse indefinidamente o si puede suspenderse luego de los seis meses o al primer año de tratamiento (en el periodo de mayor inmunogenicidad), y la dosis óptima del inmunomodulador. Con respecto a esto último, algunos estudios sugieren que dosis más bajas a las consideradas terapéuticas podrían ser igual de efectivas para evitar la inmunogenicidad232,233.
Adalimumab y golimumab están aprobados para su uso en CU. Puede que los pacientes consideren una ventaja la administración subcutánea al momento de elegir el tipo de anti-TNF a utilizar. Por otro lado, la frecuencia de eventos adversos no ha demostrado ser diferente entre los distintos anti-TNF.
No se dispone, hasta el momento, de ECA que evalúen la utilidad del adalimumab en combinación con inmunomoduladores, aunque algunos estudios de cohorte sugieren que hay un posible beneficio para los pacientes con EC. En tal caso, la utilización de terapia combo en pacientes con CU moderada a severa deberá evaluarse individualmente. Por último, en la práctica clínica es muy frecuente que se utilice una dosis de adalimumab optimizada de 40 mg semanales cuando se ha producido una pérdida de respuesta parcial al fármaco. En pacientes concretos parece que los ajustes de la dosis y los intervalos de administración, para lo que puede ayudar la determinación de los niveles del fármaco, permiten mantener la respuesta en una proporción significativa de casos.
Consideraciones sobre el uso de vedolizumab para el mantenimiento de la CU moderada a severaEl vedolizumab es una opción ampliamente utilizada como mantenimiento cuando se logra la remisión durante la inducción. Su mecanismo de acción selectivo sobre el tracto digestivo y su baja tasa de EA lo hacen una opción particularmente interesante para poblaciones especiales como pacientes añosos, con infecciones graves previas o con antecedentes de neoplasias.
La administración endovenosa puede considerarse una dificultad en algunos pacientes, sin embargo, la rapidez con que se realiza su infusión (30 minutos) y la baja incidencia de reacciones infusionales lo convierten en una opción atractiva. En nuestro país ya se encuentra disponible la formulación subcutánea que demostró ser eficaz en comparación con el placebo, por lo que la inducción endovenosa y el posterior mantenimiento s.c. cada dos semanas es otra opción en estos pacientes.
En el estudio pivotal (GEMINI 1)100 se ha informado una tasa de inmunogenicidad de 4% y la presencia de anticuerpos anti-vedolizumab no tuvo correlación con la ausencia o pérdida de respuesta clínica.
Cabe mencionar que el estudio VARSITY102 evaluó la eficacia y la seguridad del vedolizumab en comparación con el adalimumab durante un periodo de un año en pacientes con CU activa de moderada a grave. En este estudio se observó que en el grupo de vedolizumab la respuesta clínica (RR 1,46; IC 95% 1,29?1,67), la remisión clínica (RR 1,39; IC 95% 1,10?1,76) y la remisión endoscópica (RR 1,43; IC 95% 1,17-1,75) fueron significativamente mayores que en el grupo de adalimumab. La remisión clínica libre de corticosteroides ocurrió en un porcentaje numéricamente menor de pacientes del grupo de vedolizumab en comparación con el grupo de adalimumab (RR 0,58; IC 95% 0,32-1,05). Las tasas de incidencia de infecciones e infecciones graves ocurrieron con frecuencias similares en ambos grupos (RR 0,80; IC 95% 0,55-1,17). Este ensayo ha sido criticado porque no permitía adaptar la dosis (algo frecuente en la práctica), pero ello afectaba por igual a ambos brazos. Asimismo, se observó una tasa de remisión sin esteroides menor en el grupo de vedolizumab, pero afectó solo a un tercio de los pacientes que iniciaron el tratamiento con corticoides, fármacos que se manejaban a discreción del investigador. Los datos objetivos endoscópicos y también histológicos confirmaron que el vedolizumab es superior al adalimumab en el tratamiento inicial de la colitis ulcerosa. No se dispone de estudios que comparen en forma directa el vedolizumab con otros anti-TNF.
Si bien algunos estudios de poca envergadura sugieren un mayor beneficio con el uso del vedolizumab combinado con la azatioprina en el estudio de Hu et al.que incluyó a 549 pacientes (236 con CU y 286 con EC) no se encontraron diferencias en la respuesta clínica, las tasas de remisión, la remisión endoscópica o la persistencia de la terapia, entre la monoterapia con vedolizumab y la terapia combinada al año de seguimiento234. Por lo tanto, no podemos realizar recomendaciones sobre el uso combinado del vedolizumab con inmunomoduladores.
Por último, consideramos importante advertir que existe un grupo de pacientes en los cuales la optimización terapéutica mediante la disminución de los intervalos interdosis a cuatro semanas puede ser una estrategia eficaz para lograr la respuesta o recuperarla.
Consideraciones sobre el uso de ustekinumab para el mantenimiento de la CU moderada a severaUstekinumab es una opción muy atractiva debido a que su inducción endovenosa (una dosis endovenosa única ajustada al peso) ofrece una respuesta inicial considerablemente rápida y un mantenimiento posterior s.c. que se realiza a intervalos relativamente amplios (ocho a 12 semanas) en comparación con el resto de los fármacos s.c. disponibles.
En Argentina, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) ha aprobado el mantenimiento con una dosis de 90 mg cada ocho o 12 semanas. La elección de uno u otro intervalo queda a criterio del médico y puede modificarse de acuerdo con la gravedad del paciente, la falta de respuesta o las recaídas. Cuando se utiliza en segunda línea, la frecuencia de aplicación recomendada es cada ocho semanas.
La tasa de inmunogenicidad con ustekinumab en pacientes con CU y EC también se ha reportado como baja. Los estudios de extensión a 156 semanas observaron 4,6% (11/237) de anticuerpos anti-ustekinumab y un porcentaje más bajo aún, de 2,4% (2/82), en el grupo de pacientes que recibió ustekinumab cada ocho semanas. Sin embargo, estos valores son independientes del uso concomitante con inmunomoduladores y la presencia de anticuerpos no se asoció a la falta o pérdida de respuesta.
Con respecto al uso concomitante de inmunomoduladores, solo hay un estudio que ha evaluado a 363 pacientes con EII (cuatro con UC y 359 con EC) con ustekinumab como terapia de mantenimiento. De ellos, 120 (33,1%) estaban en terapia combinada (57 con tiopurinas y 63 con metotrexate). Al igual que en los resultados de vedolizumab, no se observaron diferencias en la respuesta clínica, la remisión clínica, la remisión endoscópica o la persistencia de la terapia al año234.
Mantenimiento de la remisión luego de un brote grave de CULas figuras 5 y 6 ilustran esta situación clínica:
En aquellos pacientes que responden a la inducción con corticoides e.v., tal como se realiza en el escenario del brote moderado, se irán reduciendo progresivamente las dosis de los corticoides y se iniciará un tratamiento de mantenimiento con tiopurinas y/o salicilatos. Cabe destacar que, a diferencia del brote moderado, donde la indicación de las tiopurinas es la corticodependencia, en el escenario del brote grave debe considerarse la inmunosupresión precoz, dado que la necesidad de corticoides e.v., en especial cuando se trata del comienzo de la enfermedad, se considera un factor de mal pronóstico. Es importante recordar el inicio lento de acción de las tiopurinas por lo que su indicación debe ser temprana.
Consideraciones sobre el uso de tiopurínicos para el mantenimiento de la remisión del brote grave de CU inducido con infliximabAunque consideramos que los inmunomoduladores tiopurínicos podrían ser eficaces en un grupo significativo de pacientes en los que se ha inducido la remisión con infliximab (especialmente si se trata de pacientes sin tratamiento previo con inmunomoduladores), no podemos establecer una recomendación general basada en las pruebas. Si se nos permitiera extrapolar la evidencia y experiencia disponibles en la CU cuando ha sido tratada con corticoides y/o anticalcineurínicos (ciclosporina o tacrolimus) podríamos suponer que las tiopurinas son una alternativa muy razonable en estos pacientes.
Consideraciones sobre el uso de tiopurínicos para el mantenimiento de la remisión del brote grave de CU inducido con ciclosporinaEn el contexto de la inducción de la remisión con ciclosporina en el brote grave de CU, la calidad de la evidencia publicada en este escenario es baja, aunque esto se debe en gran parte a que en realidad la frecuencia de brotes graves que requieren ciclosporina o tacrolimus es relativamente baja. Si bien los datos publicados son relativamente pocos, lo cierto es que prácticamente de forma uniforme, de acuerdo con la experiencia de los grupos españoles, en el tratamiento de la CU mantienen el tratamiento con tiopurinas si se ha inducido una remisión con ciclosporina y/o tacrolimus. No obstante, la tasa de colectomía observada es muy elevada (mínimo de 33% al año), lo que indica que podría plantearse otra estrategia utilizando infliximab con o sin tiopurinas en este subgrupo específico de pacientes, o vedolizumab, a fin de reducir al máximo la tasa de colectomías. Esta aproximación podría ser válida también para los pacientes en los que falle el tratamiento con tiopurinas. También es un escenario en el que, probablemente, podría plantearse el uso de tofacitinib o ustekinumab.
Consideraciones sobre el uso de infliximab para el mantenimiento de la remisión del brote grave de CU inducido con infliximabCuando se logra la inducción de la remisión con tratamientos biológicos, la recomendación es continuar el mantenimiento con el mismo fármaco. Bajo esta perspectiva existe consenso entre los expertos para mantener el infliximab luego de haber logrado la inducción de la remisión con este fármaco más allá de la calidad de la evidencia evaluada en esta guía.
Consideraciones sobre el uso de ciclosporina para el mantenimiento de la remisión del brote grave de CU inducido con ciclosporinaFrente a la inducción de la remisión con ciclosporina en el brote grave de CU, la alternativa de utilizar de forma crónica tratamientos con el espectro de EA de los anticalcineurínicos no parece razonable, salvo casos excepcionales (ligados fundamentalmente a un riesgo quirúrgico muy alto).
Resumen de las recomendaciones con sus calidades de evidencia
| Fármaco | Evidencia | Recomendación | Para el clínico |
|---|---|---|---|
| Inducción brote grave | |||
| Corticoides iv | Moderada | Fuerte a favor | Hacerlo |
| Ciclosporina iv | Moderada | Fuerte a favor | Hacerlo |
| Tacrolimus | Baja | Débil a favor | Probablemente hacerlo |
| Infliximab | Moderada | Fuerte a favor | Hacerlo |
| Ciclosporina vs. infliximab | Alta | Fuerte a favor | Hacerlo |
| Antibióticos | Muy baja | No recomendación | |
| Inducción brote leve-moderado | |||
| Salicilatos orales | Alta | Fuerte a favor | Hacerlo |
| Salicilatos orales + rectales vs. oral | Moderada | Débil a favor | Probablemente hacerlo |
| Salicilatos orales (CU izquierda) | Alta | Fuerte a favor | Hacerlo |
| Salicilatos rectales vs. orales (CU izquierda) | Moderada | Fuerte a favor | Hacerlo |
| Corticoides orales sistémicos | Moderada | Fuerte a favor | Hacerlo |
| Corticoides orales acción tópica | Moderada | Débil a favor | Probablemente hacerlo |
| Corticoides rectales (CU izquierda) | Alta | Fuerte a favor | Hacerlo |
| Corticoides orales acción tópica vs. rectales sistémicos (CU izquierda) | Moderada | Fuerte a favor | Hacerlo |
| Salicilatos rectales vs. corticoides rectales (CU izquierda) | Moderada | Fuerte a favor | Hacerlo |
| Tiopurinas | Baja | Débil en contra | Probablemente no hacerlo |
| Metotrexato | Moderada | Fuerte en contra | No hacerlo |
| Tofacitinib | Alta | Fuerte a favor | Hacerlo |
| Tacrolimus rectal | Baja | Débil a favor | Probablemente hacerlo |
| Infliximab | Alta | Fuerte a favor | Hacerlo |
| Adalimumab | Moderada | Débil a favor | Probablemente hacerlo |
| Golimumab | Alta | Fuerte a favor | Hacerlo |
| Vedolizumab | Alta | Fuerte a favor | Hacerlo |
| Ustekinumab | Alta | Fuerte a favor | Hacerlo |
| Aféresis | Baja | Débil en contra | Probablemente no hacerlo |
| Trasplante fecal | Baja | Débil en contra | Probablemente no hacerlo |
| Probióticos | Baja | Fuerte a favor | No hacerlo |
| Inducción tras brote leve-moderado | |||
| Salicilatos orales | Alta | Fuerte a favor | Hacerlo |
| Salicilatos rectales | Moderada | Fuerte a favor | Hacerlo |
| Probióticos | Baja | Fuerte en contra | No hacerlo |
| Tiopurinas | Moderada | Fuerte a favor | Hacerlo |
| Metotrexato | Baja | Fuerte en contra | No hacerlo |
| Tofacitinib | Alta | Fuerte a favor | Hacerlo |
| Aféresis | Baja | Fuerte en contra | No hacerlo |
| Infliximab | Alta | Fuerte a favor | Hacerlo |
| Adalimumab | Moderada | Fuerte a favor | Hacerlo |
| Golimumab | Alta | Fuerte a favor | Hacerlo |
| Vedolizumab | Moderada | Fuerte a favor | Hacerlo |
| Ustekinumab | Moderada | Fuerte a favor | Hacerlo |
| Mantenimiento tras brote grave | |||
| Tiopurinas tras infliximab | Muy baja | No recomendación | |
| Infliximab tras infliximab | Baja | Débil a favor | Probablemente hacerlo |
| Tiopurinas tras ciclosporina | Baja | Débil a favor | Probablemente hacerlo |
| Ciclosporina tras ciclosporina | Muy baja | Fuerte en contra | No hacerlo |
| Tacrolimus tras tracolimus | Muy baja | Débil en contra | Probablemente no hacerlo |
Como comentamos al inicio de esta guía, no quisimos dejar fuera dos moléculas de reciente aprobación en otros países, ya que es muy probable que a corto plazo se aprueben también en Argentina para el tratamiento de la CU.
OzanimodEl ozanimod es un modulador del receptor de esfingosina 1-fosfato (S1P), que se une selectivamente a los subtipos 1 y 5 del receptor de esfingosina 1-fosfato con alta afinidad. La FDA y la EMA aprobaron este tratamiento en pacientes adultos con esclerosis múltiple remitente recurrente con enfermedad activa definida en el año 2020.
LA S1P (esfingosina 1-fosfato) es un ligando lipídico también conocido como lisosfingolípido que se comporta como un mediador lípido bioactivo. El S1P se encuentra aumentado en sus niveles dos o tres veces en los sitios donde hay inflamación235. El S1P1, un subtipo de S1P, se expresa en la superficie de los linfocitos y regula su salida desde los tejidos linfoides hacia la circulación general y los tejidos inflamados, actuando como un ligando236. El S1P tiene diversas funciones fisiológicas e inmunológicas, incluidas la regulación de la permeabilidad vascular y linfática, la salida de linfocitos, la migración marginal de células B en los órganos linfoides secundarios y la promoción de la inflamación237.
En condiciones normales, los niveles de S1P son bajos en los tejidos epiteliales intestinales, pero la S1P se encuentra en niveles elevados en los pacientes con EII, y su unión con los receptores S1P1 permite que los linfocitos salgan de los tejidos linfoides y migren al tejido inflamado. Los altos niveles de S1P en el sitio del tejido inflamado también atraen a las células inmunitarias hacia el sitio de la inflamación y conducen a la exacerbación de los procesos inflamatorios238.
El ozanimod y su metabolito activo modulan de forma selectiva los receptores S1P1 y S1P5, y no modulan los receptores S1P2, S1P3 y S1P4 que median la activación vascular, la regulación de la conducción cardíaca y la supresión inmunitaria239.
Para valorar la eficacia y seguridad del ozanimod en la inducción y el mantenimiento de la CU moderada a severa, se realizó el ensayo clínico fase III denominado True North240, que siguió al estudio fase II Touchstone de valoración de dosis y seguridad.
En el True North se realizó un ensayo clínico aleatorizado, doble ciego, de dos ramas de tratamiento contra una rama placebo, con una inducción de 10 semanas y un mantenimiento de 52 semanas más. Posteriormente, los pacientes pasaron al estudio abierto a largo plazo. En la fase de inducción de 10 semanas, los pacientes con CU activa de moderada a grave recibieron 1 mg de ozanimod o placebo al día. El criterio principal de valoración fue la remisión clínica (basada en el índice Mayo). La remisión clínica fue numéricamente superior a la del placebo, pero no alcanzó significación estadística en los pacientes expuestos a anti-TNF que recibieron ozanimod. Los resultados secundarios de las tasas de respuesta clínica, mejoría endoscópica y curación de la mucosa (tanto endoscópica como histológica) fueron significativamente mejores en el grupo total de ozanimod en comparación con el grupo placebo. La tasa notificada de bradicardia fue de 0,5% en el grupo de ozanimod.
En el ensayo de mantenimiento, 457 pacientes con CU de moderada a grave que lograron una respuesta clínica después de 10 semanas de tratamiento de inducción con ozanimod se volvieron a aleatorizar en una proporción de 1:1 para recibir 1 mg de ozanimod o placebo, y los resultados se evaluaron en la semana 52. Las tasas de remisión clínica fueron significativamente más altas en el grupo de ozanimod. Los pacientes expuestos a anti-TNF que recibieron ozanimod también tuvieron una tasa significativamente mayor de remisión clínica en comparación con el grupo de placebo. Todos los criterios de valoración secundarios del ensayo también se cumplieron en el grupo de ozanimod, incluidos la respuesta clínica, la mejoría endoscópica, la remisión sin corticosteroides, el mantenimiento de la remisión clínica, la remisión clínica duradera y la curación de la mucosa (tanto endoscópica como histológica). En este ensayo, el ozanimod también se toleró bien y los eventos adversos informados con mayor frecuencia fueron pruebas hepáticas anormales y cefalea. Se observó una elevación de 4,8% de la alanina aminotransferasa en el grupo de ozanimod en comparación con 0,4% en el grupo de placebo. Por otro lado, los datos de la extensión abierta de cuatro años del estudio Touchstone demuestran la eficacia duradera del ozanimod con dosis de 1 mg al día en la remisión clínica, endoscópica, histológica y de biomarcadores en pacientes con CU moderada a grave.
En este ensayo a largo plazo se observó una alta tasa de participación continua en el estudio: casi la mitad de los pacientes completó la extensión de cuatro años; las tasas anuales de discontinuación entre los años 2 y 4 fueron de 15 a 18%, lo que sugiere un perfil riesgo-beneficio favorable del uso a largo plazo del ozanimod de 1 mg diario.
La seguridad fue consistente con el perfil de seguridad conocido del ozanimod; no hay nuevas señales de seguridad identificadas con ≥ 4 años de seguimiento241.
Basándose en estos resultados, la FDA aprobó en 2021 el uso de ozanimod para el tratamiento de adultos con CU activa de moderada a severa.
La dosis de inducción recomendada es de 45 mg una vez al día durante ocho semanas. La dosis de mantenimiento recomendada es de 15 mg una vez al día. Se puede considerar una dosis de mantenimiento de 30 mg una vez al día para los pacientes con enfermedad refractaria, grave o extensa.
Al finalizar esta guía y esta adenda, la ANMAT se encontraba en proceso de aprobar el ozanimod para el tratamiento de la CU en Argentina.
UpadacitinibEl upadacitinib es un inhibidor oral de las Janus quinasas (JAK, del inglés Janus kinases) que tiene una alta selectividad para la inhibición de JAK 1, a diferencia del tofacitinib, que es un inhibidor de JAK 1 y JAK 3. Actualmente está aprobado en Estados Unidos y Europa para el tratamiento de la artritis reumatoide, la artritis psoriásica, la espondilitis anquilosante y la dermatitis atópica.
Las JAK juegan un papel crucial tanto en la inmunidad innata y adaptativa, como en la hematopoyesis, y están involucradas en procesos celulares como la supervivencia y el crecimiento celular en una variedad de tipos de células242,243. La expresión ubicua de JAK1, JAK2 y TYK2 (tirosin quinasa 2) se observa en todas las líneas celulares; JAK3 se expresa principalmente en células hematopoyéticas.
La vía JAK-STAT transduce señales de una amplia gama de citoquinas extracelulares y factores de crecimiento al núcleo para modular la transcripción de genes. La unión de una citoquina o factor de crecimiento con su receptor específico de la superficie celular induce la dimerización del receptor y la activación de los JAK asociados a través de la fosforilación. Los STAT se disocian del receptor para formar dímeros STAT, que se mueven desde el citoplasma hasta el núcleo, donde reconocen y se unen a secuencias específicas de ADN regulador de genes diana y son capaces de inducir o reprimir la transcripción de genes244. Muchas citoquinas que impulsan la inflamación en la EII utilizan la vía de señalización JAK-STAT, incluyendo IFNɣ, IL-2 IL-5, IL-6, IL-9, IL-19, IL-23 y otros243,245. La inhibición de JAK es un enfoque terapéutico racional en estos pacientes. Por lo tanto, la inhibición selectiva de JAK1 debe mantener un potente efecto antiinflamatorio al tiempo que minimiza los efectos secundarios asociados con la inhibición de JAK2 y JAK3246.
Para demostrar la aplicabilidad del upadacitinib en la CU, se realizaron dos ensayos simultáneos con el mismo diseño, multicéntricos, doble ciego y controlados con placebo, llamados U-Achieve y U-Accomplish247. Ambos fueron estudios globales para evaluar la eficacia y la seguridad del upadacitinib vs. un placebo para inducir la remisión clínica (por el índice de Mayo adaptado) en pacientes con CU activa moderada-grave. Se seleccionó el criterio de remisión clínica y endoscópica como objetivo primario del protocolo, sobre la base del asesoramiento reglamentario de la FDA y la EMA sobre los ensayos clínicos en la EII, donde se sugiere que la evaluación de la eficacia debe basarse en los resultados informados por los pacientes para evaluar los síntomas y signos y la endoscopia para evaluar la inflamación de la mucosa. Los estudios U-Achieve y U-Accomplish incluyeron a pacientes con y sin experiencia previa con biológicos. La dosis de upadacitinib en los estudios de inducción fue de 45 mg en una única dosis diaria a ocho semanas y para el mantenimiento, de 15 o 30 mg en una única dosis diaria a 52 semanas.
Los respondedores a la inducción y los respondedores tardíos al upadacitinib participaron en el estudio de mantenimiento doble ciego U-Achieve. A partir del ensayo de mantenimiento, los pacientes con pérdida de respuesta pasaron a la extensión abierta a largo plazo de U-Activate, que aún continúa. Los pacientes que completaron el mantenimiento de U-Achieve también se trasladaron a U-Activate en la semana 60. Los pacientes que no lograron una respuesta clínica con upadacitinib después de ocho semanas podían recibir un periodo de tratamiento de extensión de ocho semanas (45 mg diarios de upadacitinib). En la semana 16, los respondedores clínicos ingresaron al estudio de mantenimiento y los no respondedores suspendieron su participación244.
En U-Accomplish y U-Achieve, el tratamiento de inducción de 45 mg diarios de upadacitinib de ocho semanas condujo a mejoras estadísticamente significativas en los criterios de valoración clínicos, endoscópicos y endoscópico-histológicos combinados en comparación con el placebo248.
El tratamiento fue bien tolerado y el perfil de seguridad y la prevalencia de EA fue comparable con estudios previos de upadacitinib. No se identificaron nuevas señales de seguridad. En cuanto a la velocidad de acción, se observó una diferencia estadísticamente significativa en la respuesta clínica a favor del upadacitinib frente al placebo ya en la semana 2, y sostenida hacia las semanas 8 y 9. Sobre la base de estos resultados y los resultados hasta estos momentos del estudio a largo plazo, la FDA aprobó, en marzo de 2022, el uso de upadacitinib para el tratamiento de adultos con CU activa de moderada a severa que no responden de forma adecuada o no toleran la medicación con anti-TNF. La dosis de inducción recomendada es de 45 mg una vez al día durante ocho semanas. La dosis de mantenimiento recomendada es de 15 mg una vez al día. Se puede considerar una dosis de mantenimiento de 30 mg una vez al día para los pacientes con enfermedad refractaria, grave o extensa.
Al finalizar esta guía y esta adenda, la ANMAT se encontraba en proceso de aprobar el upadacitinib para el tratamiento de la CU en Argentina.
ConclusionesEsta guía ha sido realizada con el fin de facilitar la toma de decisiones relativas al tratamiento de la CU, adaptando y actualizando la guía elaborada por GETECCU en el año 2020.
Si bien las recomendaciones surgidas en este documento están basadas en la mejor evidencia disponible, las circunstancias que intervienen en cada caso en particular no siempre pueden preverse. Los profesionales de la salud deben evaluar cada caso en particular y tomar decisiones considerando las múltiples variables de la vida real.
Además, esta guía puede ser útil para los entes reguladores y los financiadores de la salud a la hora de establecer políticas sanitarias.
FinanciaciónGADECCU recibió apoyo económico que se utilizó para costear, el software, un bibliotecario, un diseñador gráfico y un corrector editorial, entre otros productos y servicios necesarios para la realización de esta guía. Sin embargo, cabe destacar que los aportantes no influyeron en el contenido. Agradecemos a Abbvie, Biotoscana, Ferring, Janssen, Pfizer y Takeda por su colaboración.
Conflicto de interesesF. Gomollón ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Janssen, Takeda, Abbvie, Norgine y MSD. Su grupo de investigación recibe apoyo económico de MSD, Abbvie, Tillots, Janssen y Takeda.
S. García-López ha recibido financiación para asistir a reuniones científicas de Abbvie, MSD, FAES-FARMA, Ferring, Shire, Takeda, Pfizer y Janssen. También ha recibido honorarios por consultoría de Abbvie y MSD.
B. Sicilia ha recibido financiación para asistir a reuniones científicas de Abbvie, MSD, FAES-FARMA, Ferring, Shire, Takeda, Pfizer, Janssen. También ha recibido honorarios por consultoría de Abbvie, MSD y Janssen.
J. Hinojosa ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de MSD, Abbvie, Ferring, Pfizer, Janssen, Takeda, Kern Pharma.
Y. Zabana ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Shire, Ferring, Abbvie, MSD, Takeda, FAES Pharma, Falk, Adacyte, Janssen, Almirall, Amgen, Tillots y Pfizer. También ha recibido honorarios por consultoría de Tillots, Janssen y Ferring.
Y. González-Lama ha recibido financiación para asistir a reuniones científicas y honorarios por consultoría y actividades docentes de Janssen, Takeda, Abbvie, Pfizer y Ferring.
J. A. De Paula ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Abbvie, Amgen, Biosidus, Ferring, Janssen, Pfizer, Roche y Takeda.
A. Novillo ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Abbvie, Pfizer, Janssen y Takeda. Su grupo de investigación recibe apoyo económico de Abbvie, Janssen, Eli Lilly, Bristol Myers y Arena.
M. E. Linares ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Abbvie, Janssen, Takeday Abbott.
R. González Sueyro ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Abbvie, Janssen, Takeda y Ferring.
C. Fuxman ha recibido financiación para asistir a reuniones científicas y honorarios por actividades docentes de Abbvie, Janssen y Takeda.
Daniel Comandé, Constanza Echevarría, Fernando Rubinstein, Luz Rodríguez y Clara Colombres.