La identificación y el tratamiento del síndrome de sobrecrecimiento bacteriano intestinal son materias sujetas a controversia. Los síntomas que han orientado la búsqueda del trastorno adolecen de falta de especificidad, especialmente en ausencia de factores predisponentes bien definidos. La precisión de los procedimientos diagnósticos ha sido cuestionada y las terapias propuestas alcanzan cifras de efectividad en general bajas, con grandes diferencias entre los estudios disponibles. También se desconoce si la normalización de los test es realmente garantía de curación.
En este marco de incertidumbre, y con la intención de contribuir a orientar y a homogeneizar la praxis médica, un grupo de expertos de la AEG y la ASENEM han formulado las preguntas fundamentales sobre el manejo de la patología y les han dado respuesta, de acuerdo a la evidencia científica disponible. Además, han elaborado declaraciones basadas en las conclusiones de la revisión realizada, y las han sometido a votación individual para reflejar el grado de consenso correspondiente a cada una de las mismas.
The recognition and treatment of intestinal bacterial overgrowth syndrome are matters of controversy. The symptoms that have guided the search for the disorder suffer from lack of specificity, especially in the absence of well-defined predisposing factors. The accuracy of diagnostic procedures has been questioned and the proposed therapies achieve generally low effectiveness figures, with large differences between available studies. It is also unknown whether the normalization of tests is really a guarantee of cure.
Within this framework of uncertainty, and in order to contribute to the guidance and homogenization of medical practice, a group of experts from the AEG and ASENEM have formulated the key questions on the management of this pathology and have provided answers to them, in accordance with the available scientific evidence. In addition, they have drawn up statements based on the conclusions of the review and have voted on them individually to reflect the degree of consensus for each statement.
La microbiota intestinal humana está conformada por más de 1.000 especies microbianas, incluyendo representantes de los dominios bacteria, arquea y eucariota. Alcanzan su mayor proliferación en el colon, con aproximadamente 1011-1012 unidades formadoras de colonias por mililitro (UFC/mL), y disminuyen su presencia en otros segmentos del tubo digestivo, en mayor medida conforme más proximal es el tramo analizado, con la excepción de la cavidad oral que puede albergar hasta 109 UFC/mL1,2.
El concepto de sobrecrecimiento bacteriano intestinal, más conocido por su acrónimo en inglés, SIBO, se refiere al aumento de la carga bacteriana que coloniza el intestino delgado y a variaciones en su composición taxonómica, con especial protagonismo de los anaerobios, capaces de causar determinados síntomas y alteraciones analíticas. Buscando una mayor concreción en su definición, se acordó de inicio establecer el diagnóstico con la detección de más de 105 UFC/mL de aspirado yeyunal3. La cifra fue calculada con base en lo encontrado en series de pacientes con alteraciones anatómicas posquirúrgicas. Posteriormente, el consenso norteamericano determinó que el punto de corte fuera modificado hasta 103 UFC/mL de aspirado duodenal o yeyunal cultivado en agar MacConkey4,5. Más recientemente, se ha añadido la condición de que una composición con predominio de coliformes (colonizadores habituales del intestino grueso) apoya el diagnóstico6–8.
Estas cifras numéricas son controvertidas porque se sabe que, por un lado, el duodeno contiene como norma general, una menor cantidad de bacterias que el yeyuno, y además la taxonomía de ambos es dinámica, adaptándose con rapidez a diferentes situaciones, como las patologías intestinales o los cambios en el tipo de dieta1. En esta línea, se ha observado que, en sujetos asintomáticos con un elevado consumo de fibra en la dieta, puede alcanzarse una proliferación bacteriana de hasta 105 UFC/mL9.
El progresivo conocimiento del microbioma intestinal, así como de sus vías metabólicas, ha provocado una evolución del paradigma, desde un primer concepto exclusivamente cuantitativo (sobrecrecimiento), hasta una visión que pone también de manifiesto los cambios cualitativos (disbiosis), aunando de esta forma las modificaciones en la densidad microbiana con otras relativas a su composición y a los productos generados durante el metabolismo. Este enfoque también permite abordar el diagnóstico del trastorno desde otras perspectivas, y plantea la posibilidad de aplicar pruebas que proporcionen medidas de los productos de la fisiología microbiana. En cualquier caso, la disbiosis intestinal no siempre traduce la aparición de síntomas y enfermedad, por lo que ambos conceptos, SIBO y disbiosis, no pueden ser considerados sinónimos10.
En la misma línea, algunas pruebas diagnósticas no invasivas han permitido detectar casos, con diferencias sintomáticas, en los que el sobrecrecimiento se sustenta fundamentalmente en la proliferación de microorganismos anaerobios estrictos del tipo arqueas metanogénicas (Methanobrevibacter smithii es la predominante). Esto ha dado lugar a una subclasificación del SIBO, que se nombra también por su acrónimo inglés IMO, correspondiendo al término sobrecrecimiento intestinal de metanógenos2. Y haciendo alusión a otro fenómeno similar, aunque excluido del concepto formal de SIBO, se ha propuesto que algunos síntomas gastrointestinales pudieran ser explicados por el sobrecimiento de hongos tipo Candida, conocido como Small Intestinal Fungal Overgrowth (SIFO); pero su diagnóstico no ha sido estandarizado y con frecuencia conduce a decisiones terapéuticas innecesarias. No en vano el hongo es un colonizador habitual del intestino y su mera presencia en heces no refleja una situación patológica.
El propósito de este documento es revisar la evidencia científica relacionada con el concepto, el diagnóstico y el tratamiento del SIBO, fijando fundamentalmente el foco en la afectación gastrointestinal. Con este material se pretende responder a las dudas más frecuentes que suscita al profesional sanitario el interés creciente en el tema, y que se une a una demanda social de atención médica elevada, a veces desacertada, relativa a este trastorno. De manera secundaria, se pretende homogeneizar las medidas que deben aplicarse en la praxis clínica para que esta se corresponda con el conocimiento actual.
MetodologíaSe seleccionó un panel de expertos en neurogastroenterología entre los miembros de las sociedades científicas Asociación Española de Gastroenterología (AEG) y Asociación Española de Neurogastroenterología y Motilidad (ASENEM). El texto base fue redactado por los tres primeros autores del documento (J. Alcedo, F. Estremera-Arévalo y J. Cobián), quienes formularon y dieron respuesta a las preguntas planteadas con base en una revisión individual de la evidencia científica. Posteriormente, un primer borrador fue remitido a todos los autores (un total de 12 facultativos especialistas), quienes realizaron una primera evaluación del mismo y plantearon las modificaciones que consideraron oportunas en cada apartado. Estas fueron añadidas al documento, siendo de nuevo remitido a todos los autores para la aprobación final de su contenido.
De acuerdo con las conclusiones obtenidas, se elaboraron 25 declaraciones que fueron distribuidas mediante correo electrónico entre el panel de autores, para que cada uno emitiera su grado de conformidad o disconformidad con las mismas, con base en una escala de Likert de cinco puntos: 1) acuerdo total, 2) acuerdo con reservas, 3) incapaz de definir acuerdo o desacuerdo, 4) desacuerdo parcial y 5) desacuerdo total. Se consideró aceptada aquella declaración en la que la suma de porcentajes de acuerdo total y acuerdo con reservas superó el 80% (puntuación 1 y 2 de la escala) y además el desacuerdo fue inferior al 10% (puntuación 4 y 5 de la escala). En el resto de los supuestos se consideró que no existía conformidad suficiente para aceptar la declaración como consensuada. Se consignaron también los porcentajes otorgados a cada puntuación de la escala en cada una de las declaraciones.
¿Cuáles son los síntomas del sobrecrecimiento bacteriano intestinal y cuándo debemos sospecharlo?La Guía Europea editada en el año 2022, para la indicación de test de aliento de hidrógeno (H2) y metano (CH4) (consenso de la European Association for Gastroenterology, Endoscopy & Nutrition [EAGEN], la European Society for Neurogastroenterology and Motility [ESNM] y la European Society for Paediatric Gastroenterology Hepatology and Nutrition [ESPGHAN]) propone que, aún en ausencia de un consenso absoluto para la interpretación de sus resultados, y hasta disponer de un verdadero patrón oro diagnóstico para el SIBO, se considere la realización de los test en pacientes con hinchazón, dolor o molestias abdominales, flatulencia y/o signos de malabsorción, una vez descartados otros diagnósticos mediante técnicas endoscópicas o de imagen, y especialmente si hay factores predisponentes11. Se establece, además, que el espectro sintomático abarca desde síntomas inespecíficos de apariencia funcional y enfermedad hepática por depósito graso asintomática, hasta situaciones de malabsorción grave que conduzcan a déficits vitamínicos (B12, D, A y E), hipocalcemia, anemia ferropénica, diarrea grave (con esteatorrea y/o creatorrea) y pérdida ponderal.
Los factores predisponentes a los que alude la guía mencionada también son múltiples y pueden condicionar a su vez el tipo de bacterias que proliferan. Se han implicado factores biológicos como el sexo femenino o la edad avanzada, pero sobre todo alteraciones anatómicas y estructurales intestinales, como cambios posquirúrgicos, asas ciegas, estenosis y fístulas o diverticulosis yeyunal; trastornos graves de la motilidad (conectivopatías graves, amiloidosis y enfermedad de Parkinson); trastornos endocrinos y metabolopatías avanzadas (aclorhidria, hipotiroidismo y diabetes mellitus); diversos fármacos; y una miscelánea constituida por condiciones como rosácea, inmunodeficiencias, enfermedad inflamatoria intestinal, enfermedad celíaca, enteritis rádica, pancreatitis crónica, hepatopatía o nefropatía graves y el síndrome del intestino irritable (SII), con mayor riesgo en la forma con predominio de diarrea11–14 (fig. 1).
Sin embargo, los síntomas que habitualmente conducen a la evaluación clínica en búsqueda de un posible SIBO tienen un valor predictivo débil o incluso nulo para el diagnóstico15. De hecho, si bien la hinchazón abdominal y/o la distensión, como su traducción objetiva, son los síntomas tradicionalmente considerados como cardinales en el SIBO, es en realidad la diarrea el que presenta una asociación más consistente6. Habría que considerar, además, que entre los dos tipos de SIBO descritos, uno de ellos constituido por bacterias de tipo colónico (coliformes) y el otro por bacterias orofaríngeas y respiratorias, existirían diferencias en su manifestación clínica16. También cabe mencionar que en aquellos pacientes con IMO, son el estreñimiento y una baja incidencia de déficit de vitamina B12 las características clínicas fundamentales17.
Otro factor que interviene en la baja correlación entre los síntomas y la presencia de SIBO es la variabilidad en el criterio diagnóstico aplicado. Por un lado, hay estudios que concluyen que el diagnóstico de SIBO realizado por cultivo no se relaciona con síntomas como diarrea, distensión y dolor abdominal. Sin embargo, los cambios en la composición del microbioma sí parecen discriminar a los sujetos sintomáticos de los asintomáticos, e incluso la reducción de la diversidad, secundaria al uso de una dieta occidental (baja en fibra, con un 50% de carbohidratos, 35% de grasas y 15% de proteínas), predice la aparición de hinchazón y dolor abdominal9. Un estudio reciente solo encuentra asociación entre cepas específicas de los géneros Escherichia y Klebsiella (ambos aumentan su abundancia relativa en el SIBO) y los síntomas de dolor abdominal, diarrea e hinchazón18. Todo ello orienta hacia que la sintomatología es un mal predictor de la presencia de SIBO, aunque podría asociarse a determinados cambios en el perfil microbiológico intestinal, en línea con lo observado en pacientes con SII o flatulencia19–22.
En el año 2020, la Guía del American College of Gastroenterology (ACG)23 sugería (con muy bajo nivel de evidencia) investigar el SIBO únicamente cuando concurran síntomas compatibles y factores predisponentes muy determinados, como las alteraciones graves de la motilidad intestinal, la cirugía abdominal luminal, SII o estreñimiento. Con respecto al consumo de inhibidores de la bomba de protones (IBP), en la literatura existen datos contradictorios. Los primeros apuntaban a un aumento moderado del riesgo de SIBO en los consumidores de estos fármacos24. Sin embargo, el metaanálisis más reciente de estudios caso-control, incluyendo diversos métodos diagnósticos, no ha podido corroborar el riesgo atribuido al uso de IBP (odds ratio [OR] 0,8; intervalo de confianza [IC] 95%: 0,5-1,5)25, de forma que la mencionada guía del ACG no considera que el consumo de IBP sea un factor que justifique la realización de tests diagnósticos. Con posterioridad a esta guía, un estudio ha concluido que el consumo de IBP induce disbiosis en el aspirado duodenal, con incremento en la abundancia relativa de las familias Campylobacteraceae (x 3,1) y Bifidobacteriaceae (x 2,9), y descenso relativo de Clostridiaceae (x 88,2), pero sin causar aumento en la frecuencia de SIBO26.
En fecha más reciente, la American Gastroenterological Association (AGA) ha publicado una revisión exhaustiva sobre el manejo de la hinchazón y la distensión abdominal, con la recomendación expresa en su algoritmo de manejo, de limitar la realización de los test de aliento de forma exclusiva a los pacientes con factores predisponentes claros y/o síntomas graves27. Atendiendo a este criterio, debe interpretarse que la mera existencia de estreñimiento, o el cumplimiento de los criterios para SII, no serían por sí solos una justificación para investigar la presencia de SIBO.
Respuesta. El SIBO es un síndrome heterogéneo en su etiopatogenia e inespecífico en su presentación. La sospecha diagnóstica puede establecerse cuando concurren los síntomas que forman parte de su espectro clínico con determinados factores patogénicos anatómicos, metabólicos o relacionados con la motilidad intestinal. La hinchazón y la distensión abdominal no son síntomas con capacidad para predecir por sí solos la existencia de SIBO, y en ausencia de factores predisponentes específicos y síntomas graves se asume que la decisión de realizar pruebas para confirmarlo o descartarlo no estaría justificada.
¿Cuál es la validez diagnóstica de los test diagnósticos del sobrecrecimiento bacteriano intestinal?El cultivo del aspirado intestinal ha sido considerado el estándar oro para el diagnóstico de SIBO. Sin embargo, como se ha mencionado en el apartado de Introducción, el punto de corte en el número de UFC considerado patológico sigue siendo controvertido. Además, se admite que el cultivo puede proporcionar falsos positivos por contaminación debida a la microbiota oral (hasta un 20%), y también falsos negativos por la falta de detección de anaerobios al insuflar aire durante la recogida de la muestra, porque solamente se obtengan muestras de segmentos proximales del intestino y porque solo el 30% de las bacterias son cultivables5.
Los métodos de secuenciación génica permiten estimar la carga bacteriana y aumentar el número de taxas analizadas con respecto a la capacidad del cultivo convencional, e investigar además directamente la presencia de microorganismos en la mucosa intestinal. Un estudio que comparó ambas técnicas, cultivo del aspirado yeyunal y secuenciación génica en aspirado y mucosa, concluyó que el cultivo no parecía reflejar adecuadamente la composición microbiana luminal. Además, los autores distinguieron entre los dos tipos de SIBO (coliforme vs. del tracto respiratorio y digestivo superior) y comprobaron un comportamiento distinto en los índices de diversidad bacteriana28. Más recientemente, los resultados de un estudio con secuenciación y cultivo de Leite et al. aportan mayor grado de certidumbre al concluir que por encima del punto de corte de 103 UFC/mL de aspirado duodenal existe una asociación significativa con la pérdida de la diversidad y conectividad microbianas y con la abundancia relativa de coliformes18.
La elección de la técnica de obtención de las muestras tisulares o de aspirado para los estudios de secuenciación también puede influir en sus resultados. Aquellas obtenidas a través de la endoscopia (biopsia o cepillado) requieren una limpieza previa del colon que altera la microbiota local y están sujetas a contaminación en su paso a través del canal de trabajo, lo que se ha tratado de minimizar con dispositivos del tipo Brisbane Aseptic Biopsy Device (MTW, Wesel, Alemania). Pero en todos los casos que obtienen biopsia, la muestra es escasa y el rendimiento no parece ser superior al que se obtiene con el aspirado del líquido intestinal. Para este último se han empleado dispositivos complejos a base de cápsulas ingeribles con presión negativa o sondas nasointestinales, que no se han impuesto al aspirado endoscópico convencional o simplemente no se han comercializado29.
La alternativa al estudio del aspirado intestinal y las pruebas de secuenciación sobre tejido, menos invasiva y más económica, es el test de aliento con detección del H2 espirado, para el que pueden utilizarse diferentes sustratos, siendo los más comunes la lactulosa y la glucosa. La prueba requiere de una preparación específica y exigente, que incluye evitar antibióticos durante un periodo superior a cuatro semanas, también procinéticos y laxantes en los días previos, seguir una dieta baja en carbohidratos, emplear un colutorio, mantener ayunas durante ocho a 12 horas, y no realizar ejercicio físico ni fumar durante la recogida de las muestras3. El cumplimiento de estos requisitos puede ser complejo en la práctica, y más si el test se realiza en un medio sin la tutorización de un profesional sanitario formado en el procedimiento, lo que sin duda puede afectar a la validez de su resultado.
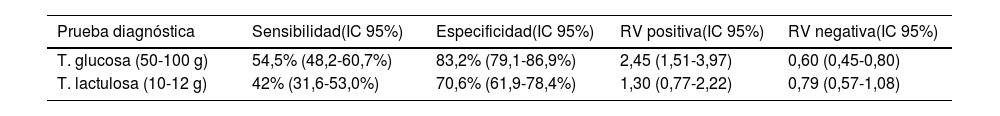
Una revisión sistemática con metaanálisis obtuvo cifras de precisión diagnóstica muy bajas para los test con lactulosa y también subóptimas para aquellos con glucosa (tabla 1)30. Por otro lado, Yu et al.31 habían realizado mediciones gammagráficas del tránsito orocecal simultáneas a la administración de lactulosa, objetivando que en el 88% de los casos en los que se producía elevación del H2 espirado más del 5% del sustrato administrado había alcanzado ya el ciego. Sigue siendo incierto, no obstante, si la llegada de esta cantidad de sustrato pueda ser responsable de un falso positivo.
Precisión de los test de aliento para el diagnóstico de SIBO*
| Prueba diagnóstica | Sensibilidad(IC 95%) | Especificidad(IC 95%) | RV positiva(IC 95%) | RV negativa(IC 95%) |
|---|---|---|---|---|
| T. glucosa (50-100 g) | 54,5% (48,2-60,7%) | 83,2% (79,1-86,9%) | 2,45 (1,51-3,97) | 0,60 (0,45-0,80) |
| T. lactulosa (10-12 g) | 42% (31,6-53,0%) | 70,6% (61,9-78,4%) | 1,30 (0,77-2,22) | 0,79 (0,57-1,08) |
A la vista de estos datos, la mayor parte de los expertos desaconsejan utilizar como sustrato la lactulosa (salvo en el caso de pacientes diabéticos) y sostienen usar en su lugar glucosa solo en aquellos escenarios con claros factores predisponentes y/o déficits nutricionales consistentes con el SIBO y no explicables por otra patología. Aún bajo estas condiciones, debe entenderse que el empleo de glucosa no está exento de falsos positivos por tránsito rápido y fermentación del sustrato en el colon. Un estudio con control gammagráfico del tránsito digestivo concluyó que los falsos positivos por este fenómeno podían alcanzar el 65% en el grupo con antecedente de una resección gastrointestinal de tracto digestivo superior, frente al 13% en no intervenidos. La dosis de glucosa empleada también influye en el resultado, y si bien no existe acuerdo entre lo más extendido en Europa (50g) y la recomendación del consenso norteamericano (75g), se ha demostrado que la utilización de dosis altas se asocia a una también alta tasa de falsos positivos. Para mejorar la precisión de estos tests se ha sugerido que los casos positivos deberían combinarse con una prueba que evalúe el tránsito intestinal (gammagrafía o resonancia magnética), especialmente si existe un antecedente de resección gastrointestinal, para descartar que el ascenso en el valor de H2 coincida con el paso a colon, si bien esta alternativa encarecería notablemente el procedimiento32,33.
Existen varios mecanismos que se asocian a resultados falsamente positivos en los test de aliento. Los más frecuentes son el mencionado tránsito intestinal acelerado, el reflejo ileo-cecal y la movilización de la materia fecal durante la prueba. Se estima que hasta en el 13% de los test de aliento con resultado positivo para SIBO este puede ser atribuido a un tránsito intestinal acelerado y a la llegada del sustrato al ciego, donde es fermentado por la microbiota cecal. Otro fenómeno asociado a falsos positivos es el paso del contenido intestinal retenido en el íleon hacia el colon, en el momento de ingerir el sustrato, como consecuencia de un reflejo gastroileal fisiológico. Por último, es importante recordar que la materia fecal contiene burbujas de gases en zonas que no siempre están en contacto con la mucosa colónica, especialmente en pacientes con estreñimiento. Durante movimientos peristálticos normales estas burbujas pueden desplazarse y contactar con la mucosa, falseando el resultado de la prueba. De hecho, algunos autores consideran que el estreñimiento debiera ser excluido de las indicaciones dictadas por el ACG23 para la realización de un test diagnóstico de SIBO33,34.
Se ha propuesto que no solo la medición del H2, sino también la de CH4, como producto metabólico propio del dominio de las arqueas, podría ser un marcador de SIBO, subclasificado como IMO, especialmente entre pacientes con estreñimiento. Un estudio reciente concluyó que la elevación de este gas en el test de aliento era superior en los pacientes con SII con estreñimiento, correlacionándose con la abundancia de arqueas metanogénicas en muestras fecales35. Incluso, una medición aislada de CH4 en ayunas por encima de 10 partes por millón (ppm) se ha asociado a estreñimiento y meteorismo, y a aumento en la carga fecal de M. smithii36. Sin embargo, debe tenerse en consideración que incorporar regularmente esta variable a la sistemática diagnóstica conlleva introducir potenciales factores de confusión. Los niveles de CH4 son muy variables en sujetos sanos, aumentan con la ingesta de sustratos no fermentables, proceden mayoritariamente de microorganismos localizados en el colon, y en personas con estreñimiento podrían obedecer al metabolismo de contenido colónico ingerido varios días antes del test de aliento33. A pesar de lo expuesto, los consensos europeo y norteamericano mantienen la recomendación de determinar los niveles de ambos gases, H2 y CH4, cuando se realice un test de aliento, entendiendo que solo de esta forma puede diagnosticarse el IMO.
La determinación en heces de la carga y diversidad microbiana ha demostrado no ser buen predictor de la existente en la mucosa intestinal37–40 y aunque existen paralelismos en la taxonomía detectada41, la investigación en muestras de heces no se considera un marcador útil en el diagnóstico de SIBO, más aún cuando se sabe que la microbiota varía muy notablemente en carga y en variedad en función del tramo intestinal que se analice8,42.
Poniendo énfasis en el diagnóstico de los cambios en la diversidad y taxonomía bacteriana más que en un aumento de su carga total, la detección por diversos medios de productos del metabolismo bacteriano, como los compuestos orgánicos volátiles (COV), podrían ser una alternativa diagnóstica prometedora. El procesado y análisis de muestras fecales, urinarias, séricas o incluso de aliento, mediante técnicas como la cromatografía de gases acoplada a espectrometría de masas, la espectrometría de movilidad iónica, los biosensores o los dispositivos de nariz electrónica, podrían reflejar, a través de la concentración y el perfil de los COV, muchos aspectos de los fenómenos metabólicos que ocurren de forma individual en el intestino. Hasta la fecha, se han obtenido resultados favorables para el objetivo de diferenciar a los pacientes con un SII con predominio de diarrea de aquellos con una enfermedad inflamatoria intestinal, con áreas bajo la curva por encima de 0,90. Sin embargo, el método aún es poco preciso cuando se quiere diferenciar entre pacientes con SII y sujetos sanos43.
Finalmente, una opción futura puede ser la detección dirigida de los gases intestinales mediante cápsulas ingeribles con control inalámbrico, cuyo tránsito y obtención de la muestra son controlados. De esta forma pueden ofrecer resultados exclusivos de tramos predeterminados del tubo digestivo. Por el momento, sus resultados han obtenido buena correlación con los observados mediante test de aliento, y aunque se espera que mejoren las prestaciones de estos últimos, aún están en fase de desarrollo44.
Respuesta. El cultivo del aspirado intestinal ofrece algunas dudas en cuanto a los valores de corte diagnóstico, y aunque los procedimientos de secuenciación añaden parámetros complementarios que podrían mejorar la validez, ambos son métodos costosos e invasivos, lo que dificulta en gran medida su aplicabilidad en la clínica. Los resultados con los test de aliento no alcanzan por sí solos una precisión suficiente para definir el diagnóstico y justificar la instauración de tratamientos, por lo que su uso debería limitarse a aquellas situaciones en las que concurren factores predisponentes bien definidos que aumentan la probabilidad preprueba. La determinación de H2 y CH4 y el empleo de sustrato glucosa (50g en Europa) es lo recomendado bajo estas circunstancias, especialmente si puede realizarse junto con una prueba de medición del tránsito intestinal. Las técnicas de análisis de los COV y las cápsulas inalámbricas dirigidas son alternativas prometedoras, pero aún no han sido validadas para el diagnóstico de SIBO.
¿Predicen los test disponibles la respuesta al tratamiento?Un estudio realizado con lactulosa comunicó que la positividad del test podría predecir la respuesta al tratamiento con rifaximina en pacientes con SII y predominio de diarrea. Además, aquellos con un test positivo mejoraban en mayor medida que el resto (59,7% de aquellos con test positivo vs. el 25,8% de los pacientes con test basal negativo), y los que negativizaban el test tras el tratamiento tenían una tasa de respuesta sintomática inmediata que alcanzaba el 75,6%, frente al 48,4% del global45. El mismo grupo había obtenido previamente resultados similares utilizando neomicina como tratamiento en pacientes con SII de cualquier fenotipo clínico. Se observó la mejoría sintomática en el 11% de los que recibieron placebo, el 36,7% de los que recibieron neomicina y tenían un test de lactulosa previo al tratamiento negativo, y el 75% de los que tomaron el antibiótico y tenían un test positivo de inicio46.
Sin embargo, el primero y más reciente de los estudios mencionados fue más tarde contestado por expertos y cuestionados algunos aspectos básicos de su metodología47. Una de las críticas principales se fundamentaba en que la obtención de las muestras se llevó a cabo por el paciente en su domicilio, sin control especializado y sin poder constatar el cumplimiento de los requerimientos formales que exige la prueba, lo que sin duda puede influir en la validez de su resultado. Otras objeciones relacionadas con las conclusiones de ambos estudios fueron que casi un 25% y un 37%, respectivamente, de los pacientes con un test negativo también se beneficiaban clínicamente del tratamiento, y que el resultado del test no era capaz de diferenciar entre los pacientes con recurrencia sintomática, de forma que la utilidad práctica de la prueba a la hora de tomar decisiones terapéuticas resultaba cuestionable.
Por otro lado, un ensayo clínico realizado en veteranos de guerra con SII sin estreñimiento no pudo demostrar que los valores pretratamiento del test de lactulosa se correlacionaran con mejoría sintomática tras el tratamiento con rifaximina48. Incluso, otros autores han comunicado que el grupo de pacientes con mejor respuesta a los antibióticos eran precisamente aquellos con una elevación de H2 y CH4 inferior a 20ppm a lo largo de toda la prueba49. Finalmente, otro estudio retrospectivo, realizado en población asiática con SII sin estreñimiento, concluyó que los valores pretratamiento del test con lactulosa no eran capaces de predecir la necesidad de prolongar el tratamiento con rifaximina50.
Valorando el mismo objetivo mediante otras técnicas diagnósticas, se dispone de los resultados de un estudio que practicó cultivo del aspirado duodenal a 1.263 pacientes consecutivos sometidos a una endoscopia digestiva alta por presentar diferentes trastornos funcionales digestivos. La indicación posterior de administrar o no tratamiento antibiótico quedó a criterio del médico responsable, siendo rifaximina, ciprofloxacino o metronidazol las opciones más utilizadas. Se realizó un análisis retrospectivo encontrando que el tratamiento era eficaz para mejorar los síntomas, pero el resultado del cultivo no predijo el éxito terapéutico51.
Con respecto al uso de probióticos (PB), no hay consenso en cuanto al papel potencial de la realización de un test diagnóstico de SIBO para predecir el resultado de la terapia. En un ensayo clínico aleatorizado el pico precoz de H2 en el test de lactulosa no predijo el efecto de un preparado probiótico con leche fermentada (Lactobacillus casei, cepa Shirota) para la normalización del test en pacientes con SII. Tampoco la tasa de positividad del test se modificó al final del periodo de tratamiento con respecto a lo observado con placebo (36% vs. 41%; p=1,00)52. Cabe destacar que en este estudio el preparado utilizado no mejoró los síntomas digestivos con respecto al placebo, por lo que los resultados podrían ser diferentes al contemplar los PB con diferente mecanismo de acción. De hecho, un estudio post-hoc de un ensayo posterior con un producto que contenía varias cepas de Bifidobacterium lactis, Lactobacillus spp y Streptococcus thermophilus, y aplicó un test de lactulosa con medición de H2 y CH4, concluyó que solo en aquellos pacientes con elevación de H2 (no de CH4), el producto era capaz de mejorar los síntomas, reducir la producción de gas intestinal y normalizar el test53.
Los datos que relacionan las dietas con los resultados de los test de aliento son escasos. Los únicos publicados provienen de un estudio retrospectivo realizado en 2004 que incluyó 93 pacientes, con test de lactulosa positivo, que aceptaron seguir una dieta elemental. El 80% de ellos negativizaron el test, y entre este grupo se observó una reducción significativa de los síntomas con respecto a aquellos en los que el test persistía positivo54. No hay información similar que haya evaluado el efecto con otras dietas y no hay estudios que hayan reproducido los mismos resultados. Además, la dieta elemental es utilizada solo marginalmente por su nula palatabilidad y la dificultad de mantenerla a largo plazo. Todo ello condiciona el valor práctico de lo que puede ofrecer esta observación.
Especialmente en pacientes con criterios de SII, puede ser útil determinar si los test de aliento utilizados para el diagnóstico de SIBO predicen el efecto de tratamientos dirigidos a modular la hipersensiblidad visceral. Onana et al.55 en un análisis prospectivo no han podido demostrar que la producción de H2 y CH4 durante el test de glucosa se asociara a mayor gravedad de los síntomas de SII (r=0,84; p=0,02 y r=0,64; p=0,05, respectivamente). Previamente, Le Nevé et al.56 habían evaluado el mismo aspecto encontrando que, si bien el resultado numérico del H2 espirado durante el test no estaba vinculado a la gravedad de los síntomas, aquellos que experimentaban una clínica más intensa tras la administración de un preparado nutricional con 25g de lactulosa, asociaban con mayor frecuencia marcadores de hipersensibilidad, especialmente el dolor abdominal por la distensión rectal con baróstato (p<0,001). Esto teóricamente podría permitir una selección de los pacientes candidatos a nuevas terapias, si bien hasta la fecha el hallazgo no ha tenido traducción práctica.
Respuesta. El resultado de los test de aliento y los cultivos no ha demostrado ser una herramienta útil para guiar la indicación del tratamiento antibiótico, ni para sustentar la modificación en la duración de la pauta farmacológica. La utilidad a la hora de predecir el efecto de un probiótico probablemente está condicionada por la efectividad y el mecanismo de acción de este, de forma que no puede emitirse una recomendación genérica. Y el papel del test para seleccionar pacientes candidatos a nuevas terapias o dietas específicas aún no ha sido totalmente definido, si bien la evidencia disponible no le augura una posición de relevancia clínica como predictor de efectividad.
¿Qué utilidad tienen las medidas dietéticas?La evidencia sobre el manejo del SIBO con medidas dietéticas es escasa y de baja calidad. Únicamente hay un estudio publicado a este respecto, que también se ha referenciado para argumentar la respuesta en el apartado anterior. Pimentel et al.54 describieron, de forma retrospectiva, una intervención con una dieta elemental durante 14 días (nutrición completa libre de aminoácidos, sin permitir otros alimentos, refrescos, chicle o cafeína) en una cohorte de pacientes diagnosticados de SII mediante criterios de Roma I y con un test de aliento con lactulosa positivo. Tras las dos semanas, el 80% de los pacientes había normalizado el test de lactulosa, y entre los no respondedores un 5% consiguieron el mismo objetivo tras prolongar siete días más la dieta. Solo el 57% de la cohorte presentó mejoría sintomática, aunque esta fue significativamente mayor entre los que habían normalizado el test (66,4% vs. 11,9%). Como se ha mencionado, la deficiente palatabilidad de la dieta elemental es claramente un factor limitante para su propuesta como solución terapéutica a medio y largo plazo.
La alimentación consciente, que consiste en comer siguiendo patrones ordenados de ayunos e ingesta, elegir y cocinar los alimentos adecuados diariamente, podría tener un efecto sobre los ciclos del complejo motor migratorio (CMM). Los pacientes diagnosticados de SIBO parecen tener una menor frecuencia de la fase III del CMM, por lo que la alimentación consciente tiene un papel potencial en SIBO57.
La ingesta de fibra parece tener efectos sobre la microbiota del intestino delgado. Se ha descrito un cultivo compatible con SIBO en hasta el 50% de los individuos con ingesta elevada de fibra; no obstante, todos ellos estaban asintomáticos. La reducción de fibra en la dieta tiene efectos tanto en los síntomas abdominales en pacientes con SII, como en los test de aliento, pero los diferentes estudios arrojan resultados discordantes9.
Otros enfoques, como la dieta baja en oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP), el tratamiento con fructo-oligosacáridos o el transplante fecal han demostrado eficacia a la hora de modificar la microbiota intestinal, aunque ninguno de ellos incluye cohortes de pacientes con SIBO, sino aquellos con SII58. La dieta baja en FODMAP es eficaz en SII. En su fase de restricción disminuye las Bifidobacterias (productoras de gas, aunque es un factor protector de carcinogénesis) sin reducir la diversidad global del microbioma intestinal, los metabolitos ni el pH fecal. Este efecto parece desaparecer en la fase de reintroducción de alimentos59. Además, se han descrito ciertos subtipos de microbiota que predicen la respuesta a la dieta baja en FODMAP60.
Las dietas restrictivas suelen ser bajas en residuo y mejoran los síntomas relacionados con el gas, lo que se atribuye a una menor fermentación. Si esta modificación se mantiene en el tiempo, los cambios que provocan en el microbioma y en sus vías metabólicas también podrían comportar perjuicio a largo plazo. No se ha establecido con precisión cuánto tiempo persisten los cambios mencionados y sus efectos tras la suspensión de la dieta.
Así, algunas intervenciones dietéticas son recursos terapéuticos potencialmente útiles para el SIBO, pero su indicación está condicionada a disponer de estudios específicos bien dirigidos que ofrezcan resultados favorables. El diseño de estos estudios debiera también incluir un seguimiento suficientemente prolongado, para determinar si los cambios adaptativos en la microbiota y en sus vías metabólicas se mantienen en el tiempo, y si este fenómeno deriva en otras complicaciones.
Respuesta. Pese a que las medidas dietéticas tienen el potencial de modificar la microbiota intestinal y su metabolismo, existe una marcada escasez de evidencia relacionada con el beneficio potencial en los casos de SIBO, y con los perjuicios que puede comportar. Además, los estudios publicados incluyen a pacientes diagnosticados exclusivamente mediante test del aliento. No existe, por tanto, base científica suficiente para elaborar recomendaciones dietéticas con el objetivo de tratar específicamente el SIBO. Por otro lado, la indicación de dietas restrictivas conlleva un riesgo elevado en el manejo de los pacientes con patología funcional digestiva, en los cuales subyace con frecuencia un trastorno de la conducta alimentaria.
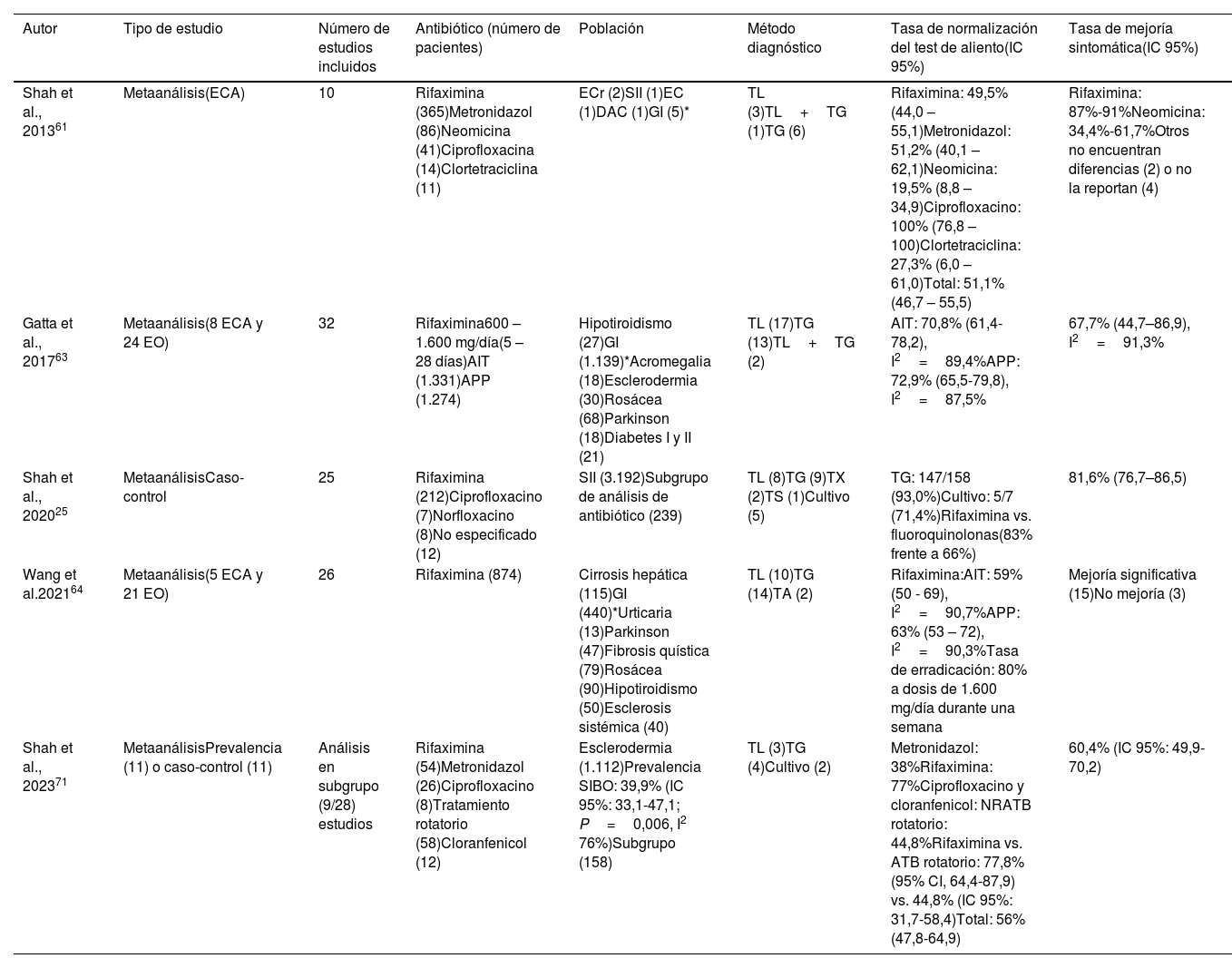
¿Cuál es el rendimiento de los antibióticos?Según el Consenso Norteamericano, los antibióticos orales desempeñan un papel central en el tratamiento del SIBO23, si bien no existen enfoques terapéuticos universalmente aceptados. Se han descrito diferentes antibióticos de amplio espectro, como rifaximina, norfloxacino, ciprofloxacino, tetraciclinas, doxiciclina, neomicina, cotrimoxazol, amoxicilina-clavulánico y metronidazol, como posibles tratamientos del SIBO (ver resultados de los metaanálisis disponibles en la tabla 2).
Eficacia de los antibióticos en el tratamiento del SIBO. Resumen de los metaanálisis disponibles
| Autor | Tipo de estudio | Número de estudios incluidos | Antibiótico (número de pacientes) | Población | Método diagnóstico | Tasa de normalización del test de aliento(IC 95%) | Tasa de mejoría sintomática(IC 95%) |
|---|---|---|---|---|---|---|---|
| Shah et al., 201361 | Metaanálisis(ECA) | 10 | Rifaximina (365)Metronidazol (86)Neomicina (41)Ciprofloxacina (14)Clortetraciclina (11) | ECr (2)SII (1)EC (1)DAC (1)GI (5)* | TL (3)TL+TG (1)TG (6) | Rifaximina: 49,5% (44,0 – 55,1)Metronidazol: 51,2% (40,1 – 62,1)Neomicina: 19,5% (8,8 – 34,9)Ciprofloxacino: 100% (76,8 – 100)Clortetraciclina: 27,3% (6,0 – 61,0)Total: 51,1% (46,7 – 55,5) | Rifaximina: 87%-91%Neomicina: 34,4%-61,7%Otros no encuentran diferencias (2) o no la reportan (4) |
| Gatta et al., 201763 | Metaanálisis(8 ECA y 24 EO) | 32 | Rifaximina600 – 1.600 mg/día(5 – 28 días)AIT (1.331)APP (1.274) | Hipotiroidismo (27)GI (1.139)*Acromegalia (18)Esclerodermia (30)Rosácea (68)Parkinson (18)Diabetes I y II (21) | TL (17)TG (13)TL+TG (2) | AIT: 70,8% (61,4-78,2), I2=89,4%APP: 72,9% (65,5-79,8), I2=87,5% | 67,7% (44,7–86,9), I2=91,3% |
| Shah et al., 202025 | MetaanálisisCaso-control | 25 | Rifaximina (212)Ciprofloxacino (7)Norfloxacino (8)No especificado (12) | SII (3.192)Subgrupo de análisis de antibiótico (239) | TL (8)TG (9)TX (2)TS (1)Cultivo (5) | TG: 147/158 (93,0%)Cultivo: 5/7 (71,4%)Rifaximina vs. fluoroquinolonas(83% frente a 66%) | 81,6% (76,7–86,5) |
| Wang et al.202164 | Metaanálisis(5 ECA y 21 EO) | 26 | Rifaximina (874) | Cirrosis hepática (115)GI (440)*Urticaria (13)Parkinson (47)Fibrosis quística (79)Rosácea (90)Hipotiroidismo (50)Esclerosis sistémica (40) | TL (10)TG (14)TA (2) | Rifaximina:AIT: 59% (50 - 69), I2=90,7%APP: 63% (53 – 72), I2=90,3%Tasa de erradicación: 80% a dosis de 1.600 mg/día durante una semana | Mejoría significativa (15)No mejoría (3) |
| Shah et al., 202371 | MetaanálisisPrevalencia (11) o caso-control (11) | Análisis en subgrupo (9/28) estudios | Rifaximina (54)Metronidazol (26)Ciprofloxacino (8)Tratamiento rotatorio (58)Cloranfenicol (12) | Esclerodermia (1.112)Prevalencia SIBO: 39,9% (IC 95%: 33,1-47,1; P=0,006, I2 76%)Subgrupo (158) | TL (3)TG (4)Cultivo (2) | Metronidazol: 38%Rifaximina: 77%Ciprofloxacino y cloranfenicol: NRATB rotatorio: 44,8%Rifaximina vs. ATB rotatorio: 77,8%(95% CI, 64,4-87,9) vs. 44,8% (IC 95%: 31,7-58,4)Total: 56% (47,8-64,9) | 60,4% (IC 95%: 49,9-70,2) |
ECA: ensayo clínico controlado aleatorizado; EO: estudios observacionales; SII: síndrome de intestino irritable; DAC: dolor abdominal crónico; ECr: enfermedad de Crohn; EC: enfermedad celíaca; AIT: análisis por intención a tratar; APP: análisis por protocolo; TL: test de aliento de lactulosa; TG: test de aliento de glucosa; TS: test de aliento con sucrosa; TX: test de aliento con xilosa; TA: test de aliento sin especificar tipo; NR: no referidas; ATB: antibiótico.
Según los resultados de un metaanálisis61, los antibióticos fueron más efectivos que el placebo, con una tasa de normalización de la prueba de aliento (glucosa o lactulosa) del 51,1% (IC 95%: 46,7-55,5%) para los antibióticos en comparación con el 9,8% (IC 95%: 4,6-17,8%) obtenido con placebo, con un OR de 2,6% (IC 95%: 1,3–5,0%). Por otro lado, para el alivio de los síntomas se ha reportado una tasa de respuesta del 49,5% de los pacientes tratados con antibióticos (rifaximina, norfloxacino o neomicina) frente al 13,7%, de los que no recibieron antibióticos, respectivamente62.
El antibiótico más frecuentemente utilizado es la rifaximina, cuya absorción sistémica es inferior al 0,4%, alcanzando altas concentraciones en la luz intestinal. En una revisión sistemática y metaanálisis63, se incluyeron 32 estudios con 1.331 pacientes con SIBO tratados con rifaximina. La dosis varió entre 600mg a 1.600mg diarios, con pautas desde cinco a 28 días de duración. Demostraron que la tasa global de erradicación (negativización del test de aliento de glucosa o lactulosa), según el análisis por intención de tratar, era del 70,8% (IC 95%: 61,4–78,2%; I2=89,4%) y por protocolo de 72,9% (IC 95%: 65,5– 79,8%; I2=87,5%). Se realizó el análisis de un subgrupo de pacientes con SII en 10 estudios. El análisis por intención a tratar presentó una tasa de erradicación de 71,6% (IC 95%: 56,7 – 84,4%; I2=86,4%) y por protocolo de 75,4% (IC 95%: 65 – 84,5%; I2=81,7%). En otro metaanálisis de casos y controles25, se evaluó la eficacia de diferentes antibióticos en 239 pacientes con SIBO: rifaximina (cuatro estudios), ciprofloxacino (un estudio), norfloxacino (un estudio) y en otro no se especificó el tipo de antibiótico. La mejoría de los síntomas se notificó en un 81,6% (IC 95%: 76,7 – 86,5%). En general, la eficacia de la rifaximina fue mejor que la de las fluoroquinolonas (83% vs. 66%), en particular en pacientes con SII con predominio de diarrea. Más recientemente, en otra revisión sistemática y metaanálisis64, se analizan un total de 21 estudios observacionales y cinco ensayos clínicos aleatorizados (n=874). La tasa global de erradicación para la rifaximina, según el análisis por intención de tratar fue del 59% (IC 95%: 50 a 69%; I2=90,7%) y según el análisis por protocolo del 63% (IC 95%: 53 a 72%; I2=90,3%). No obstante, en todos en estos estudios, los investigadores observaron una heterogeneidad significativa.
Aunque la rifaximina ha sido el antibiótico más estudiado, se han descrito otros antibióticos de acción sistémica. Sin embargo, el nivel de evidencia para recomendar su uso de forma sistemática es bajo65–69. En una cohorte de 145 pacientes con enfermedad de Crohn67, a los que se les realizó test de aliento con lactulosa, la prueba fue positiva en 30 casos (20%) y confirmada con test de glucosa en 29/30 pacientes. La prevalencia de SIBO fue mayor en los pacientes con cirugía previa frente a los no intervenidos (33% vs. 14%: p=0,007) y en los que tenían al menos una estenosis en comparación con los que no la tenían (29% vs. 14%: p=0,03). Los 29 pacientes con diagnóstico de SIBO fueron aleatorizados en dos grupos: el grupo A (15 pacientes) recibió metronidazol (250mg/8 horas) y el grupo B (14 pacientes) recibió ciprofloxacino (500mg/12 horas), ambos durante 10 días. No se apreciaron diferencias significativas en la normalización del test de aliento entre el grupo tratado con metronidazol y el tratado con ciprofloxacino (13/15 y 14/14, respectivamente). En otra cohorte de 142 pacientes con SIBO (diagnosticado mediante test de aliento con glucosa), los pacientes fueron asignados aleatoriamente a dos grupos de tratamiento de siete días: rifaximina 1.200mg/día y metronidazol 750mg/día69. La tasa de normalización de la prueba de aliento fue significativamente mayor en el grupo de rifaximina con respecto al grupo de metronidazol (63,4% vs. 43,7%; p<0,05; OR 1,50; IC 95%: 1,1-4,4).
Disponemos también de la información de un estudio retrospectivo70 que evaluó en pacientes con diagnóstico de SIBO, mediante test de glucosa, el efecto de utilizar durante periodos de 10 días al mes, tres meses consecutivos, un antibiótico fijo (quinolona o nitroimidazol) frente a la alternancia de los mismos fármacos de forma rotatoria, el mismo periodo de tiempo. El resultado fue un mayor porcentaje de remisión en el grupo con rotación (70% vs. 51%; p=0,05), pero sin diferencias significativas en la frecuencia de recurrencia (10% vs. 5%; p=0,147), ni en el tiempo hasta la recurrencia (14 vs. 36 meses; p=0,453).
En un metaanálisis71, sobre la base de 28 estudios con 1.112 pacientes con esclerodermia, la prevalencia combinada de SIBO fue del 39,9% (IC 95%: 33,1-47,1). Nueve estudios con 158 pacientes reportaron la respuesta al tratamiento con antibióticos. El 60,4% (IC 95%: 49,9-70,2) de estos pacientes informaron una mejoría significativa de los síntomas. El 56% (IC 95%: 47,8-64,9) de los pacientes normalizaron el test de aliento después del tratamiento con antibióticos. En un estudio, un paciente tratado con antibiótico rotatorio desarrolló colitis pseudomembranosa, lo que llevó a la interrupción del antibiótico72. La rifaximina fue significativamente más eficaz en comparación con el antibiótico rotatorio para erradicar el SIBO en pacientes con esclerodermia (77,8% [IC 95%: 64,4-87,9]) vs. 44,8% [IC 95%: 31,7-58,4]; p<0,05).
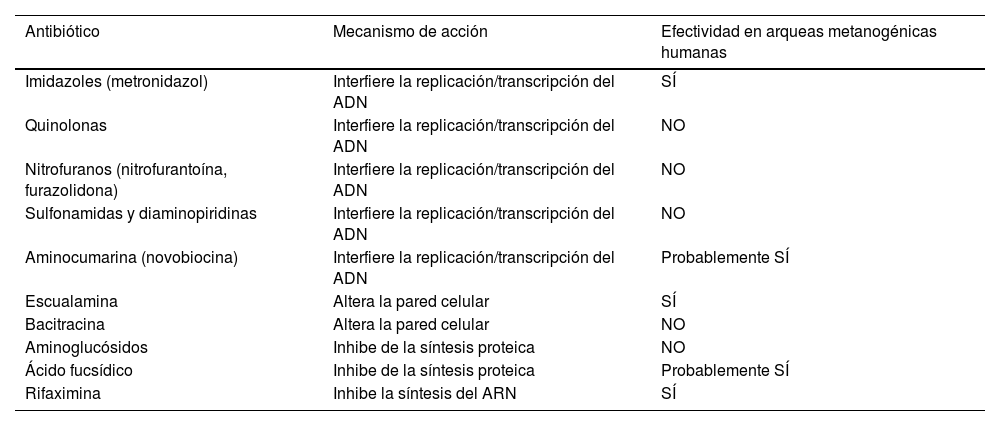
Otro subgrupo de pacientes en el que se han ensayado tratamientos antibióticos combinados es el que presenta positividad en el test de aliento para CH4 (tabla 3). Este es más prevalente en pacientes con predominio de estreñimiento25,75. La principal responsable de la formación de CH4 en el intestino es la arquea M.smithii. En un estudio prospectivo, doble ciego, randomizado de 31 pacientes76, 16 tratados con neomicina y placebo, y 15 con neomicina y rifaximina, observaron que tras el tratamiento la gravedad del estreñimiento fue significativamente menor en el grupo de neomicina y rifaximina (28,6±30,8) en comparación con la neomicina sola (61,2±24,1) (p=0,0042). En el grupo de neomicina y rifaximina, los sujetos con CH4<3ppm después del tratamiento informaron una gravedad del estreñimiento significativamente menor (30,5±21,8) que aquellos con CH4 persistente (67,2±32,1) (p=0,020). En otro estudio retrospectivo77, los pacientes con una prueba de lactulosa positiva para CH4 recibieron uno de los tres tratamientos antibióticos: 1.000mg al día durante 10 días de neomicina sola (n=8), 400mg al día durante 10 días de rifaximina sola (n=39), o una combinación de rifaximina y neomicina durante 10 días (n=27). En los pacientes que recibieron el tratamiento combinado, el 85% tuvo una respuesta clínica, en comparación con el 63% de los sujetos en el grupo de neomicina sola (p=0,15), y el 56% de los del grupo de rifaximina sola (p=0,01). El 87% de los sujetos tratados con rifaximina y neomicina erradicaron el CH4 en su prueba de aliento, comparado con el 33% de los sujetos en el grupo de neomicina (p=0,001), y el 28% en el grupo de rifaximina (p=0,001). De los pacientes que no eliminaron el CH4 y habían recibido rifaximina sola, el 66% de los que posteriormente utilizaron tratamiento con rifaximina y neomicina pudieron normalizar su prueba de aliento. No obstante, ambos estudios tienen escaso número de pacientes y no permite extraer conclusiones sólidas.
Antibióticos con actividad demostrada frente a las arqueas en humanos73,74
| Antibiótico | Mecanismo de acción | Efectividad en arqueas metanogénicas humanas |
|---|---|---|
| Imidazoles (metronidazol) | Interfiere la replicación/transcripción del ADN | SÍ |
| Quinolonas | Interfiere la replicación/transcripción del ADN | NO |
| Nitrofuranos (nitrofurantoína, furazolidona) | Interfiere la replicación/transcripción del ADN | NO |
| Sulfonamidas y diaminopiridinas | Interfiere la replicación/transcripción del ADN | NO |
| Aminocumarina (novobiocina) | Interfiere la replicación/transcripción del ADN | Probablemente SÍ |
| Escualamina | Altera la pared celular | SÍ |
| Bacitracina | Altera la pared celular | NO |
| Aminoglucósidos | Inhibe de la síntesis proteica | NO |
| Ácido fucsídico | Inhibe de la síntesis proteica | Probablemente SÍ |
| Rifaximina | Inhibe la síntesis del ARN | SÍ |
A la vista de lo expuesto, el nivel de evidencia que sustenta el uso de los tratamientos antibióticos sistémicos debe calificarse como pobre. Además, hay que considerar que la recurrencia de SIBO es alta, sobre todo en aquellos pacientes con alteraciones anatómicas o enfermedades sistémicas graves, y en este escenario la evidencia disponible es aún menor. Se ha reportado una reaparición de los síntomas de SIBO, en el 12,6%, 27,5% y 43,7% de los pacientes a los tres, seis y nueve meses después de un tratamiento exitoso (normalización del test con glucosa), respectivamente78. La necesidad de repetir el tratamiento antibiótico puede generar bacterias resistentes, reacciones adversas y aumento de infecciones oportunistas como Clostridioides difficile. Algunos autores sugieren la posibilidad de utilizar rifaximina, dada su buena tolerancia, buen perfil de seguridad, su capacidad para generar efectos «eubióticos» y su bajo riesgo de resistencia7,79,80.
Respuesta. El rendimiento antibiótico varía según el tipo de antibiótico y la dosis. No existe un enfoque terapéutico universalmente aceptado para el tratamiento inicial ni para la recurrencia del SIBO. La falta de grandes ensayos clínicos aleatorizados que evalúen los efectos de los antibióticos en el tratamiento del SIBO limita la posibilidad de extraer conclusiones sólidas sobre la eficacia. No obstante, la rifaximina es el antibiótico más ampliamente evaluado. En los estudios más recientes, el rendimiento fluctúa entre 59% y 63% de curaciones, dependiendo de la dosis y la duración del mismo; si bien hay que considerar que la tasa de recidiva es alta (43,7% a los nueve meses). El uso de otros antibióticos debiera limitarse, por el riesgo de resistencias, reacciones adversas y aumento de infecciones oportunistas, pudiendo ser una excepción a la norma algunos casos seleccionados con patologías predisponentes implicadas en el SIBO grave. En estas situaciones parece razonable ser menos restrictivos en la indicación de antibióticos, aplicando incluso pautas cíclicas cuando la recurrencia sea frecuente. Los datos sobre el tratamiento específico del IMO son muy escasos, y si bien se ha sugerido que la combinación de rifaximina con neomicina podría ser superior a la monoterapia, no se dispone de datos confirmatorios del resultado.
¿Aportan beneficio los probióticos?Algunos PB han demostrado mejorar los síntomas abdominales bajos, presentes fundamentalmente en contexto de un SII o de uso de antibióticos, así como modificar la composición del microbioma y alterar sus vías metabólicas81. El beneficio clínico descrito podría deberse no solo a su acción eubiótica directa, sino que podría apoyarse además en la reducción de los mediadores inflamatorios y daño tisular cuya aparición es atribuida a la propia disbiosis82. En los resultados de una revisión sistemática de ensayos clínicos se concluyó que determinadas cepas, a dosis concretas, podían aliviar síntomas como dolor, distensión abdominal, estreñimiento, y con menor probabilidad, también el meteorismo. Para el control de la diarrea, sin embargo, la evidencia científica no parecía sustentar la indicación de este tratamiento en pacientes con SII, pero sí la de aquellos sometidos a terapia erradicadora frente a Helicobacter pylori83. Se concluyó que el gran número de cepas analizadas, la combinación de las mismas en distintos preparados, así como las diferentes dosis utilizadas, impedían realizar recomendaciones concretas para cada escenario clínico.
Un estudio no aleatorizado posterior, que incluyó 33 pacientes, encontró una mejoría sintomática global significativamente mayor en aquellos con SII y diagnóstico de SIBO que consumieron un preparado multicepa compuesto por Saccharomyces boulardii, B. lactis BB-12, Lactobacillus acidophilus LA-5 y Lactobacillus plantarum, con respecto a los SIBO negativo (71,6% de mejoría en la escala de valoración sintomática empleada frente al 10,6% alcanzado en aquellos pacientes sin SIBO; p=0,017). Sin embargo, algunos síntomas frecuentes en el SII mejoraron de forma independiente a la presencia de este factor84. Un ensayo clínico aleatorizado, también con una muestra de pequeño tamaño (25 casos y 25 controles) con pacientes con diversos síntomas digestivos funcionales, observó que la suplementación con Bacillus subtilis y Enterococcus faecium, asociada a la realización de una colonoscopia con preparación intestinal con polietilenglicol, se vinculaba a una mejoría sintomática y a una reducción en la tasa de positividad de los test de aliento con lactulosa para SIBO, pasando de un 60% entre casos y 52% entre controles antes del tratamiento (p=0,254), a un 28 y 56%, respectivamente, tras el mismo (p<0,001)85. Otro ensayo clínico que administró Saccharomyces boulardii CNCM I-745 junto a una dieta baja en alimentos fermentables a pacientes con SII y SIBO, redujo los síntomas y la producción de H2 con respecto a la prescripción solo de dieta (p=0,044), pero no los diagnósticos de SIBO de forma significativa (59,3% en el grupo con PB+dieta y 71,4% en el grupo solo con dieta; p=0,38)86.
Un metaanálisis que incluyó 22 estudios con cualquier tipo de PB y diagnósticos con test de H2 con sustrato glucosa o lactulosa87 no pudo demostrar un efecto preventivo del uso de PB para la aparición SIBO (riesgo relativo [RR]=0,54; IC 95%: 0,19-1,52; p=0,24), pero sí se asoció a mejoría de los síntomas (RR=1,61; IC 95%: 1,19-2,17; p<0,05). Tres de los estudios incluidos habían comparado el empleo de PB frente a antibiótico para el tratamiento del SIBO. Uno de ellos fue un estudio retrospectivo, que no encontró diferencia significativa en la resolución de síntomas entre ambos grupos (38% en el grupo con antibiótico vs. 18% en el grupo con PB; p=0,091). En cambio, en el subanálisis de dos ensayos clínicos que compararon PB y metronidazol sí se alcanzó una diferencia significativa en la resolución del SIBO a favor de los primeros (RR=1,49; IC 95%: 1,07-2,08; p<0,05), habiendo sido comprobado el resultado mediante test de H2 solo en uno de ellos.
Los datos en grupos de pacientes con condiciones o patologías específicas, diferentes al SII, que poseen un riesgo aumentado de SIBO, son discordantes. En un estudio con pacientes sometidos a bypass gástrico con Y de Roux, evaluados con test de H2 con sustrato glucosa, la administración de L. acidophilus y B. lactis frente a placebo, se asoció con mejoría del síntoma hinchazón (p=0,022), pero no con la reducción en la aparición de SIBO al cabo de 12 semanas de posoperatorio (12,1% vs. 14,8%, respectivamente; p=0,938)88. En pacientes con hepatopatía crónica, una combinación de 6 PB (Bifidobacterium bifidum, B. lactis, Bifidobacterium longum, L. acidophilus, Lactobacillus rhamnosus y S. thermophilus) obtuvo una reducción de los casos de SIBO frente a placebo (24% vs. 0%; p<0,05)89; y en un ensayo que incluyó pacientes con cirrosis, después de un tratamiento con S. boulardii durante tres meses se negativizó el test de lactulosa en el 80% de los pacientes, frente al 23,1% con placebo (p=0,002), asociando también una reducción en la frecuencia de las complicaciones hepáticas90.
Sin embargo, en un estudio en mujeres gestantes con hipotiroidismo, que empleó sustrato lactulosa, se encontró una frecuencia de SIBO del 48,5% (24,8% en un grupo control de gestantes sin hipotiroidismo) y la administración de un prebiótico combinado con Bifidobacterium infantis, L. acidophilus, Enterococcus faecalis y Bacillus cereus se asoció a una reducción significativa en los casos positivos por elevación de CH4 (38,4% hasta 3,8%; p<0,001), que no se pudo corroborar para los positivos por elevación del H2 (50,9% hasta 38,4%; p=0,06)91. En pacientes con esclerosis sistémica, un ensayo randomizado comparando S. boulardii con metronidazol y con la combinación de ambos, encontró una reducción en los diagnósticos del 55% en el grupo combinado, frente al 33% con el PB solo y 25% con el antibiótico solo (p<0,01 en todos los casos), observándose también un peor control sintomático en el último grupo92.
Otra cuestión a tener en cuenta es que, si bien los PB son preparados muy seguros, no son, como se piensa comúnmente, totalmente inocuos. Hay algunas evidencias a favor de que incluso pudieran agravar en algún caso los síntomas de la patología que se busca aliviar. Más allá de descripciones de potenciales efectos adversos en casos aislados, un estudio clínico en voluntarios sanos, con administración B. infantis 35624, comúnmente empleado en pacientes con SII, mostró nula reducción en la producción de H2, y, por el contrario, se asoció a un aumento significativo en la emisión de CH4 durante el test con lactulosa (p=0,012), sin que se demostrara repercusión clínica por el fenómeno en el grupo estudiado93. Otro efecto adverso que se ha atribuido al uso de PB es el síndrome de confusión mental (o brain fogginess), que parece mediado por la aparición de acidosis D-láctica, como resultado de la fermentación de carbohidratos. Se ha propuesto que este fenómeno estaría favorecido por el consumo prolongado de PB y que se resolvería al cesar este y con el uso de antibióticos94.
Respuesta. Los PB parecen mejorar los síntomas más comúnmente atribuidos a SIBO y generan modificaciones en la composición y funcionamiento del microbioma intestinal. El beneficio de estos cambios y su seguridad para un uso indiscriminado del producto no han sido suficientemente establecidos y no todos los ensayos con PB han obtenido beneficio en la reducción de la tasa de diagnósticos de SIBO. Tampoco se cuenta con datos suficientes que permitan establecer una recomendación concreta en cuanto a cepa, duración de tratamiento y dosis ajustados a cada escenario clínico. La gran oferta de preparados PB disponibles en el mercado, así como la variabilidad de las combinaciones entre países, supone un factor de confusión más para extraer conclusiones prácticas poscomercialización.
¿Son una alternativa los remedios herbales?Algunos trabajos han estudiado tratamientos alternativos con medicina herbal. En una pequeña cohorte de 10 pacientes, cuatro de ellos con SIBO, el tratamiento con Daikenchuto (preparado herbal japonés) no consiguió negativizar el test de aliento de glucosa, aunque mejoró lo síntomas de la muestra total de pacientes95. Otro estudio con diseño abierto, con otros productos herbales (Dysbiocide combinado con FC Cidal o Candibactin AR combinado con Candibactin BR), incluyó 104 pacientes SIBO (H2 y CH4). Fueron asignados, según su preferencia, a 1.200mg diarios de rifaximina o a tratamiento herbal durante cuatro semanas. Se evidenció negativización del test de lactulosa en el 46% del grupo con terapia herbal y un 34% en el grupo de rifaximina. Del grupo de no respondedores a la rifaximina, el 57,1% normalizó el test de lactulosa tras el rescate con el tratamiento herbal. Otro grupo de no respondedores a la rifaximina recibió terapia de rescate con clindamicina 300mg, metronidazol 250mg y neomicina 500mg tres veces al día, obteniendo una negativización del 60%, sin diferencias con respecto a la respuesta al tratamiento herbal. No obstante, en este estudio no se menciona el efecto de los tratamientos sobre los síntomas digestivos de los participantes96.
Respuesta. Los remedios herbales, aun ofreciendo resultados iniciales ciertamente prometedores, carecen de un apoyo científico suficiente para su recomendación sistemática.
Conclusiones- 1.
No se dispone, hasta la fecha, de una definición precisa y universalmente aceptada del SIBO que permita establecer criterios para el diagnóstico de confirmación y de exclusión de un SIBO.
- 2.
El SIBO está ligado a factores predisponentes, más frecuentemente relacionados con alteraciones graves de la motilidad intestinal o cambios anatómicos del tubo digestivo. Su diagnóstico en contextos clínicos sin los factores predisponentes reconocidos debe ser cuestionado.
- 3.
El espectro sintomático del SIBO es muy variado, incluyendo desde síntomas leves o alteraciones analíticas subclínicas, hasta un síndrome de malabsorción y/o presencia de síntomas graves. La clínica tiene baja capacidad para predecir la presencia de SIBO. La diarrea es el síntoma más consistentemente asociado. La hinchazón y la distensión abdominal no tienen capacidad para predecir la existencia de SIBO, por lo que no parece justificado iniciar la investigación diagnóstica del síndrome con base únicamente en la presencia de estos síntomas.
- 4.
No existe un estándar de oro para el diagnóstico del SIBO. No hay un acuerdo unánime que determine de forma inequívoca y en cualquier circunstancia la cifra de microorganismos que debe considerarse patológica en un cultivo del aspirado intestinal. Esta prueba, además, es invasiva y técnicamente compleja para su instauración con regularidad en la práctica clínica.
- 5.
Los test de aliento son alternativas diagnósticas no invasivas y económicas que poseen una baja precisión, de forma que sus resultados, por sí solos, no son suficientes para establecer el diagnóstico ni justifican la instauración de un tratamiento. Tampoco han demostrado ser herramientas útiles para predecir la respuesta al tratamiento o para guiar su indicación (tipo de antibiótico, duración del tratamiento, dieta adecuada, etc.). Sus resultados deben ser interpretados por profesionales médicos, tomando en cuenta la probabilidad preprueba de cada caso en concreto.
- 6.
Aunque las dietas restrictivas tienen capacidad para modificar el microbioma intestinal y sus vías metabólicas, no se dispone de información suficiente para integrarlas entre las opciones para el tratamiento del SIBO. Deben considerarse además sus potenciales efectos perjudiciales para los pacientes.
- 7.
El antibiótico más estudiado y con mejor nivel de evidencia científica a favor de su uso como tratamiento del SIBO es la rifaximina. Salvo en situaciones clínicas concretas de refractariedad manifiesta y factores predisponentes que condicionen un SIBO grave, no parece justificado el empleo de otros antibióticos. A pesar de ello, debe considerarse que la efectividad de la rifaximina es del 60%, y que la recurrencia del síndrome se aproxima al 50% a los 12 meses. El empleo de pautas cíclicas parece razonable cuando se constata un SIBO recurrente. En casos con diagnóstico de IMO la combinación de rifaximina y neomicina podría mejorar los resultados de la monoterapia.
- 8.
Algunos PB han demostrado mejorar los síntomas comúnmente vinculados al SIBO, y también son capaces de modificar el microbioma, por lo que poseen un papel potencial en el tratamiento. Sin embargo, aún no es posible realizar una recomendación específica para su uso, ya que no se ha determinado la cepa o cepas que proporcionan mayor beneficio, ni su dosis y duración de tratamiento óptimos.
- 9.
El rendimiento terapéutico de los remedios herbales en los pacientes con SIBO es aún incierto.
- 10.
Es necesario el desarrollo de pruebas diagnósticas seguras y más precisas para el SIBO, así como de estrategias terapéuticas más efectivas. Hasta disponer de ambas, debería evitarse generalizar el empleo de las herramientas diagnósticas disponibles sin una indicación bien establecida; esto es, fuera de escenarios con factores predisponentes bien definidos. De igual forma, deberían limitarse las expectativas puestas en la erradicación del SIBO como solución universal para el alivio de síntomas digestivos comunes, como la hinchazón abdominal, ya que con una frecuencia elevada esta conducta no obtendrá una mejoría clínica significativa.
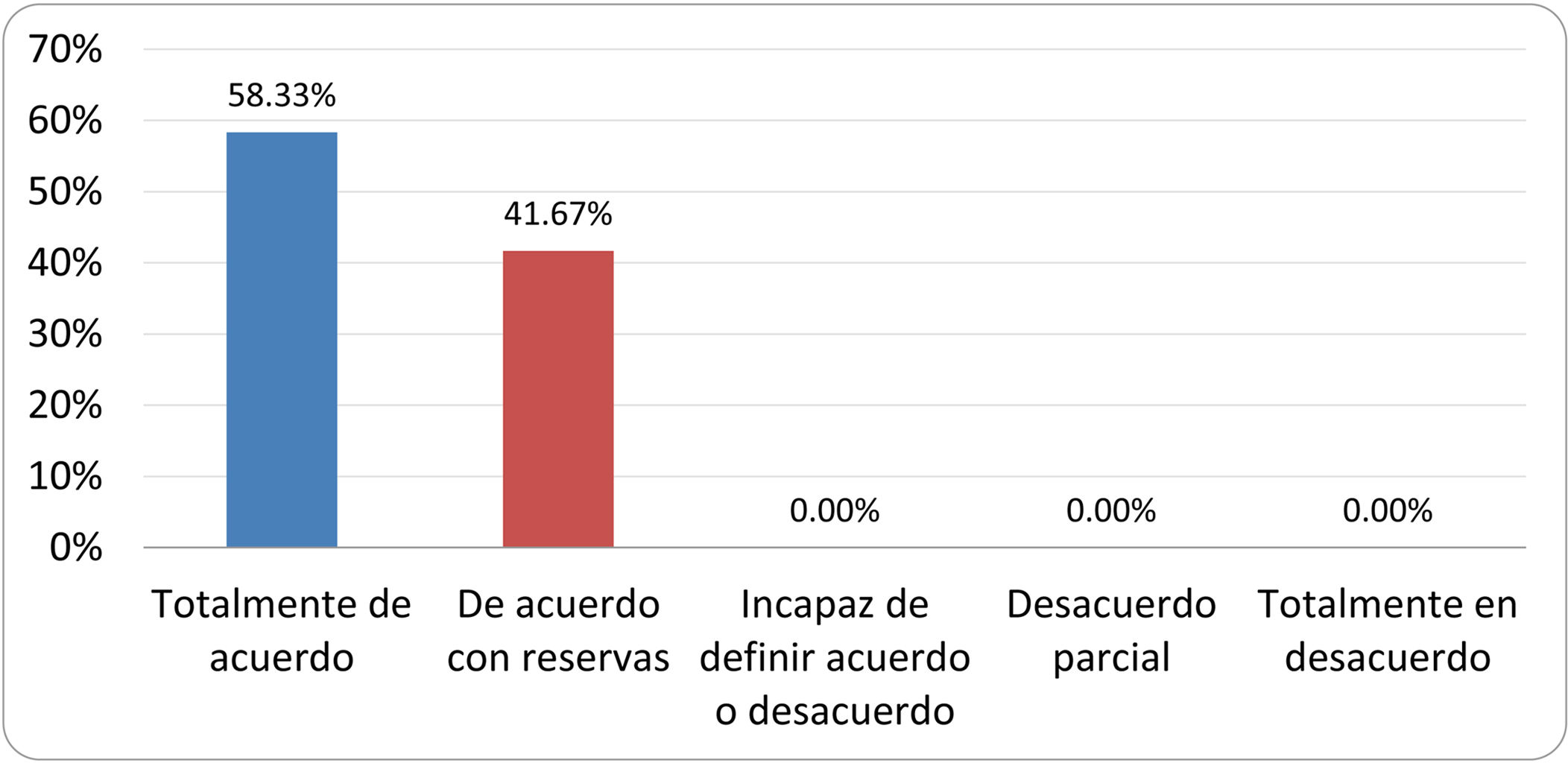
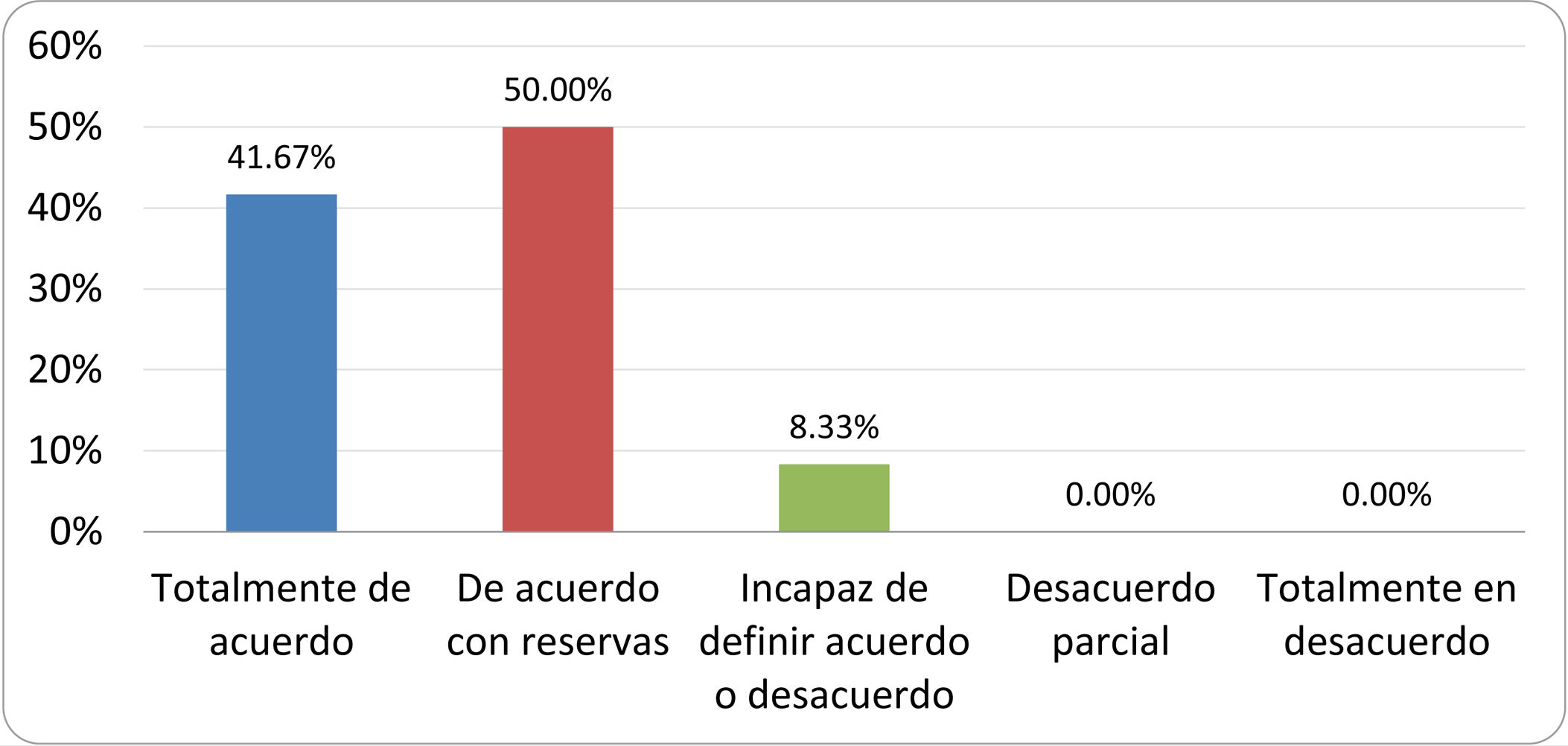
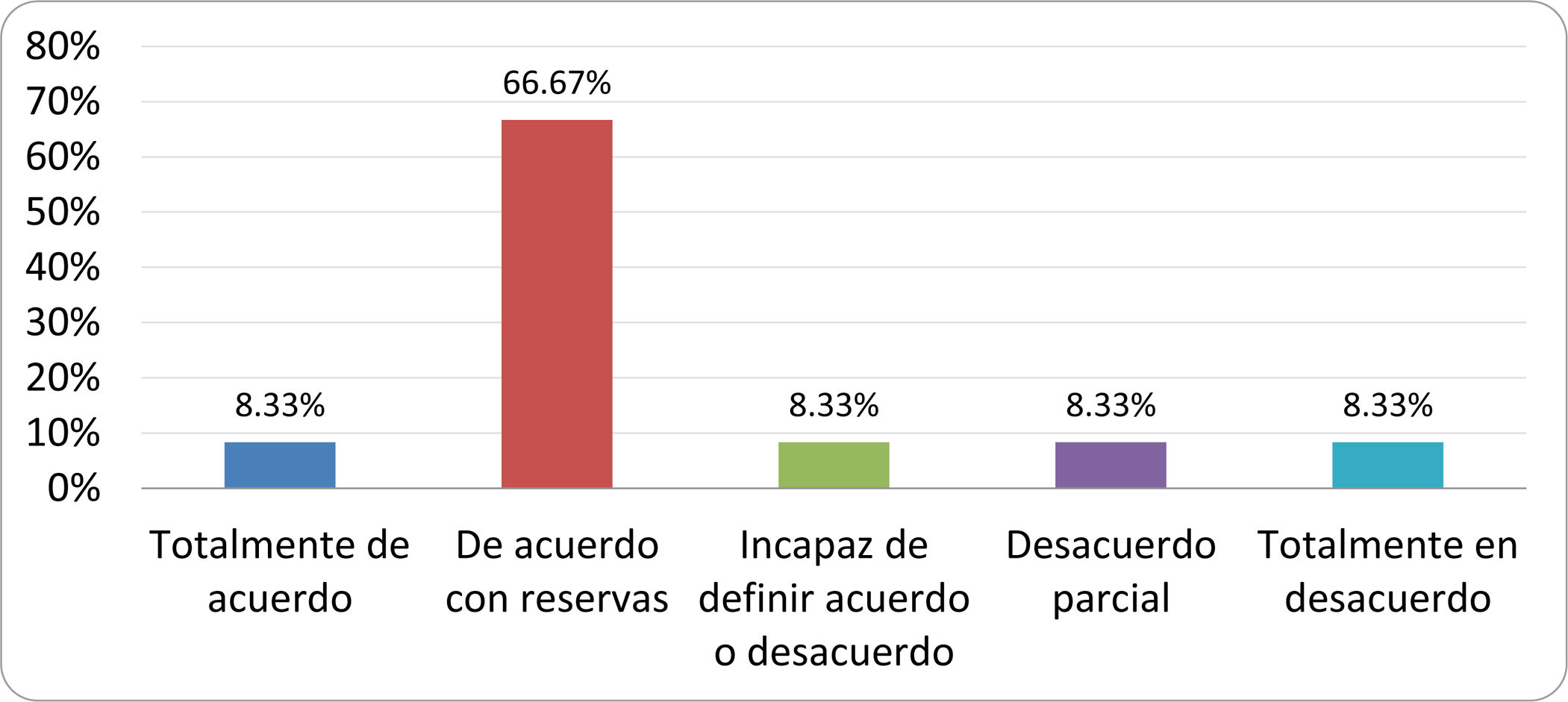
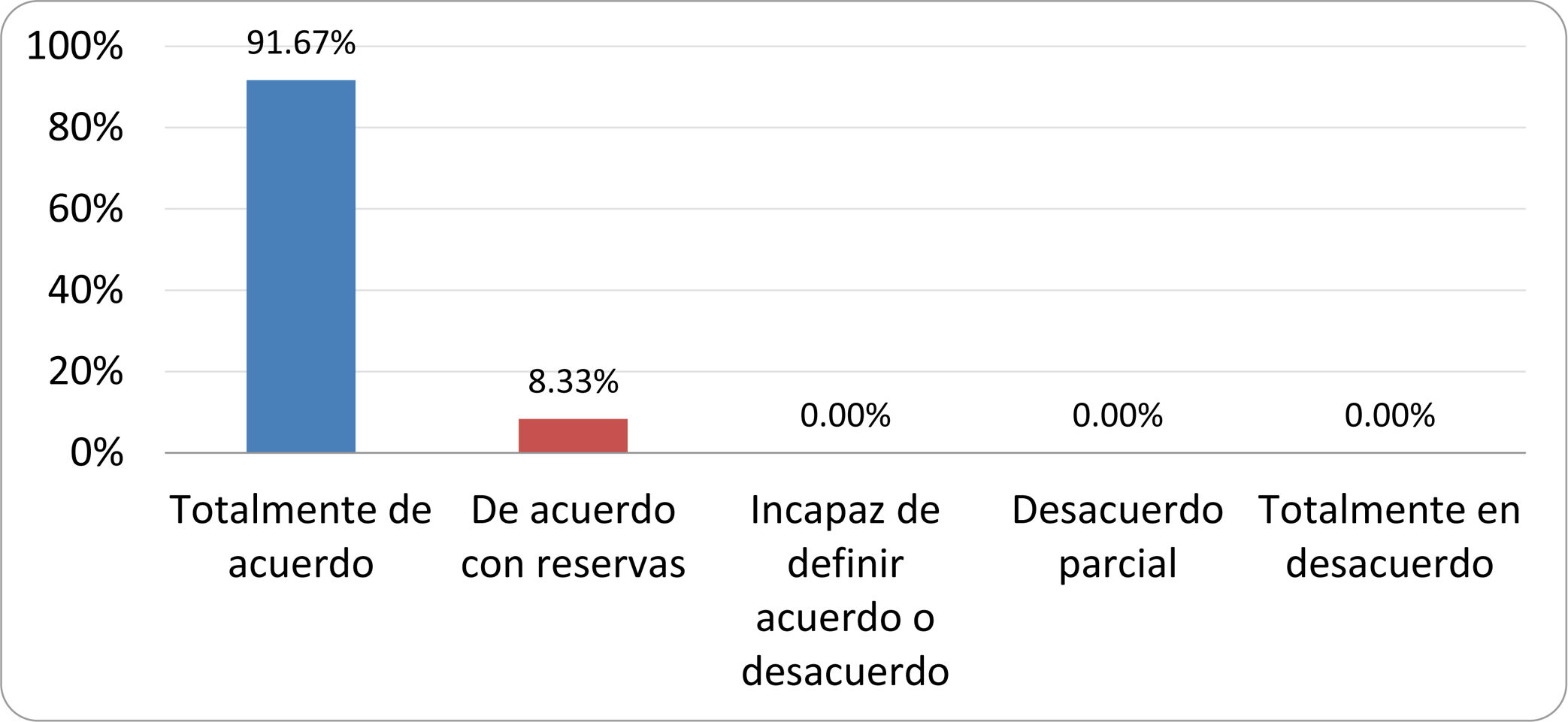
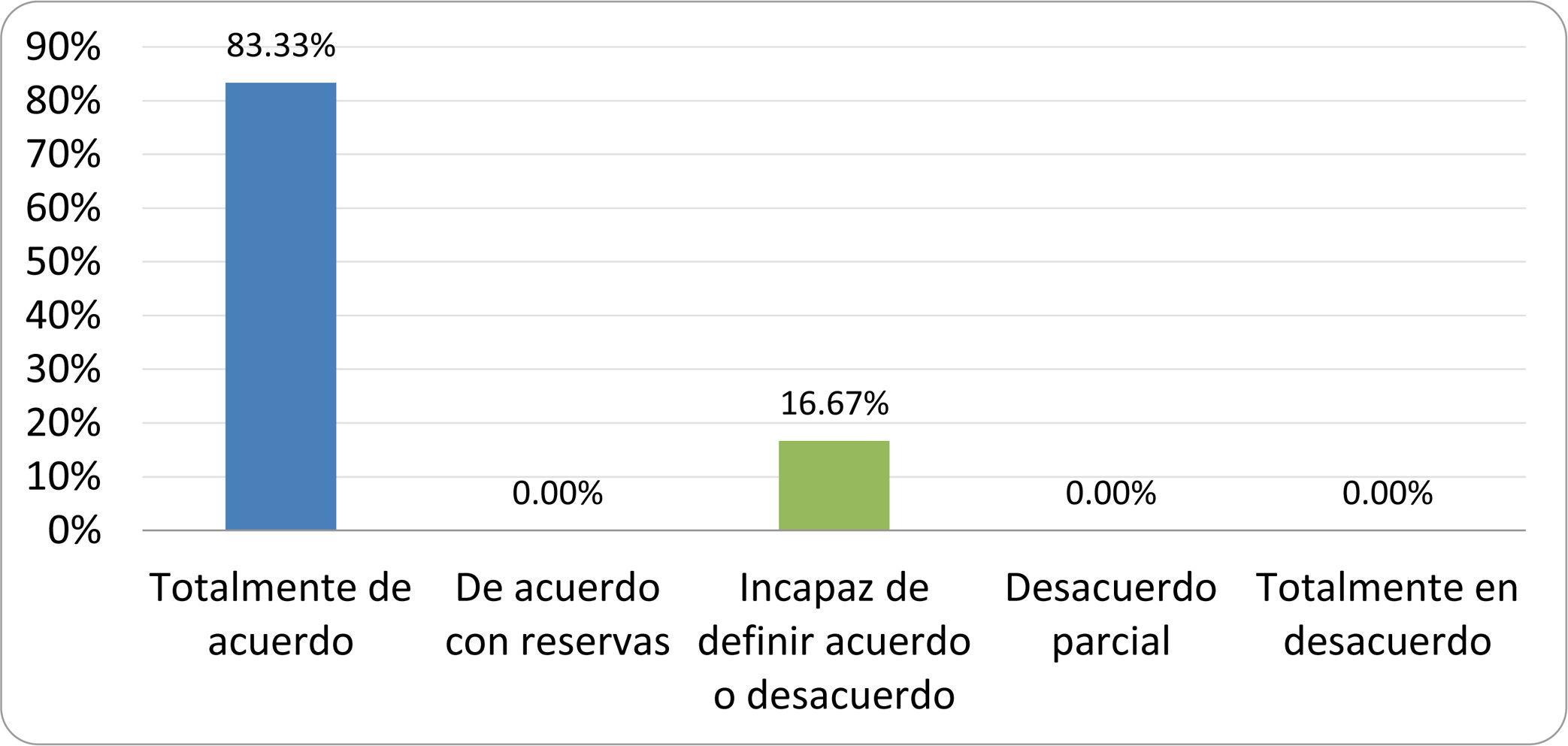
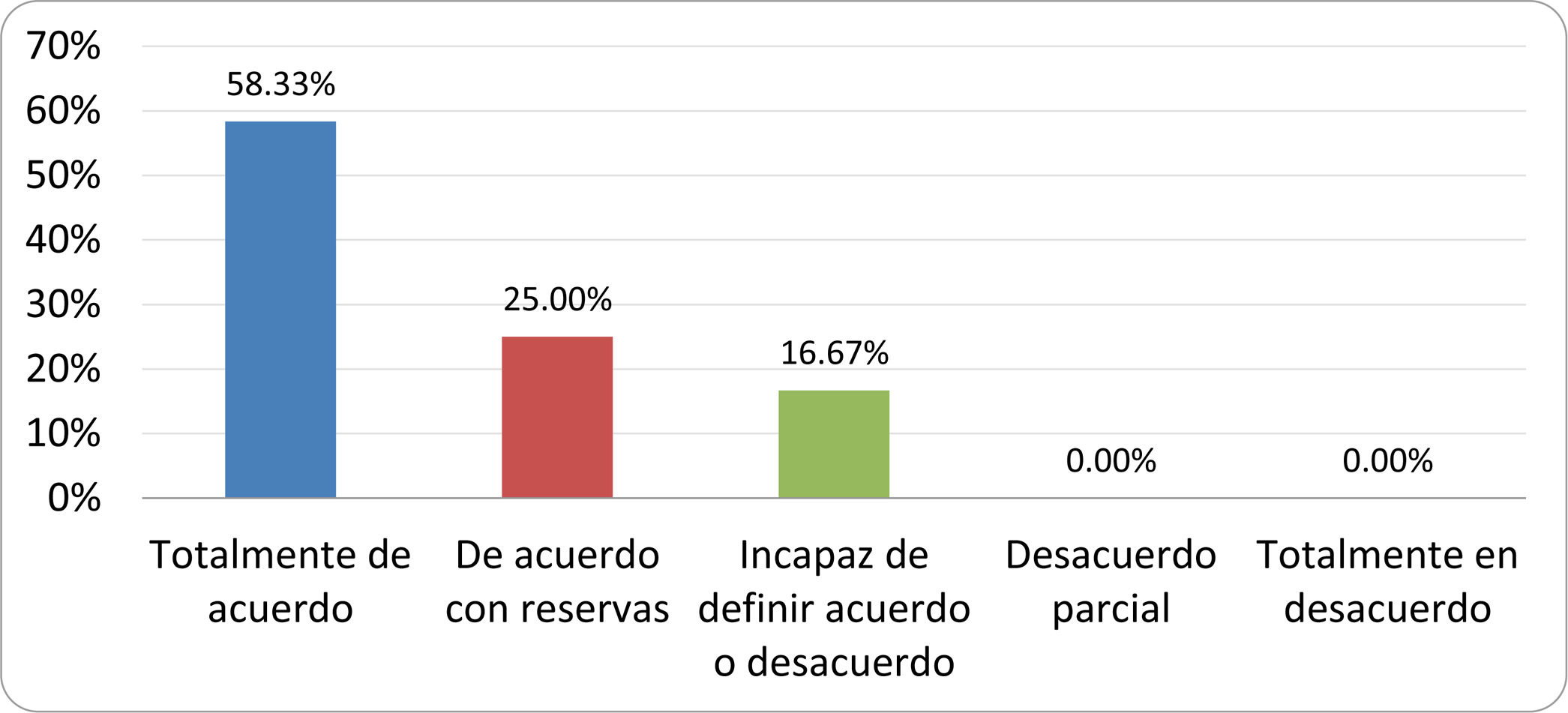
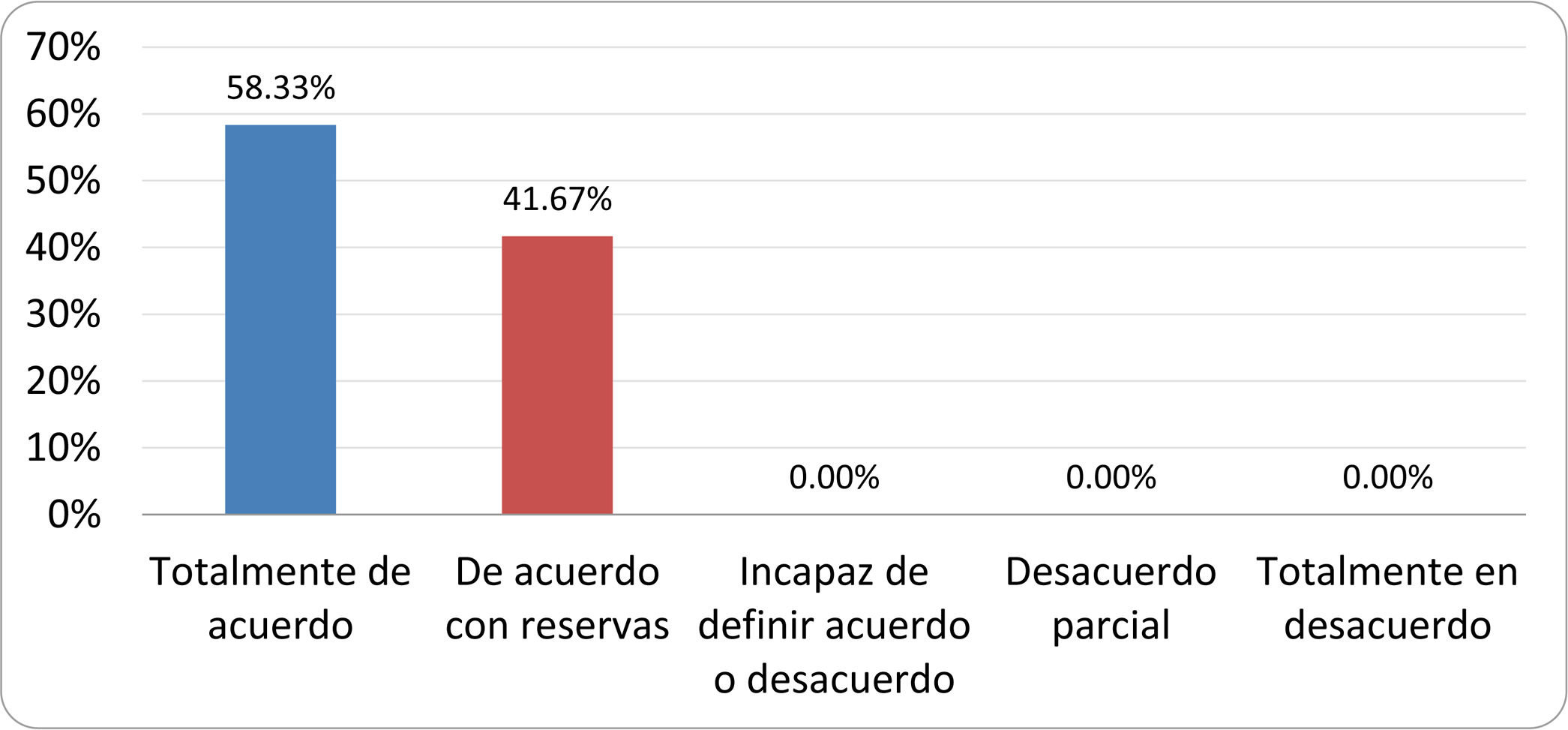
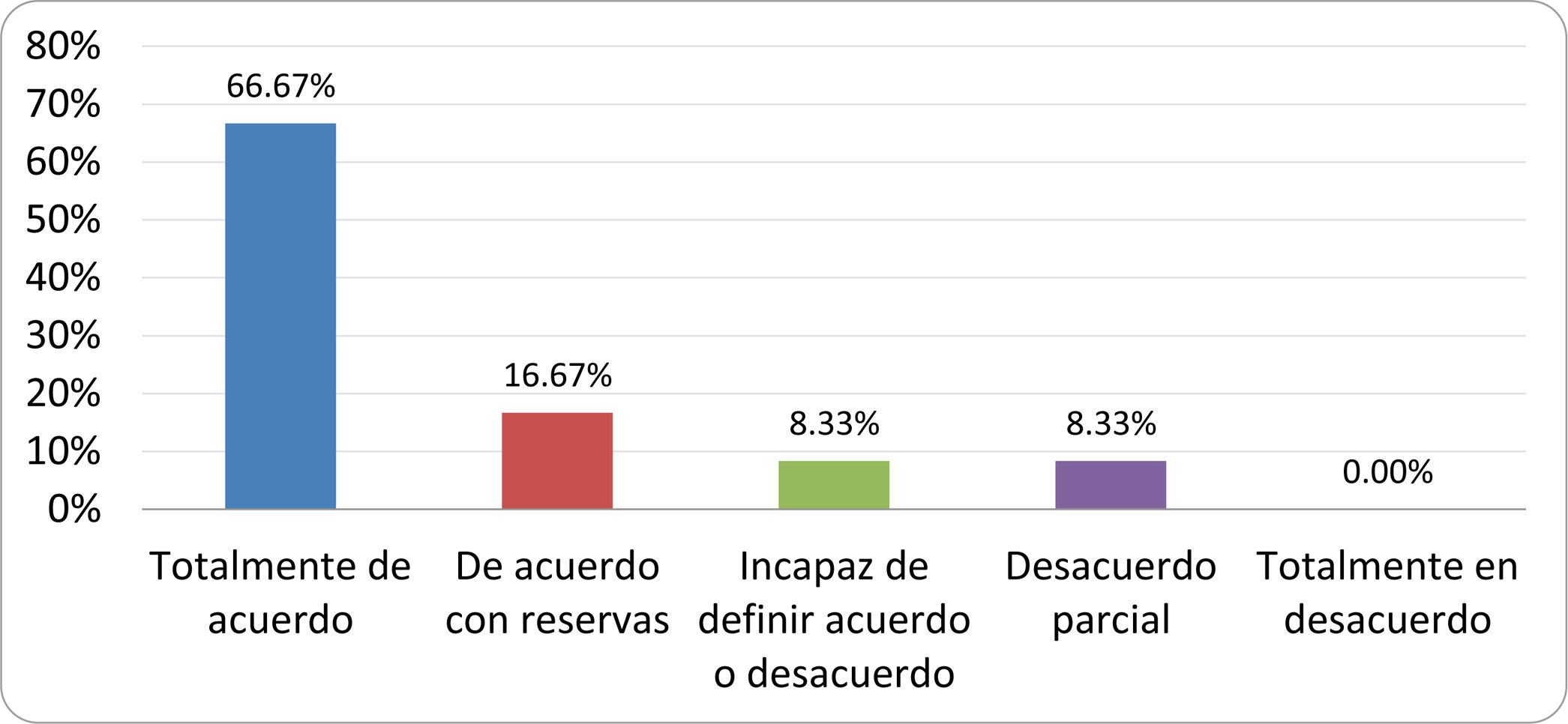
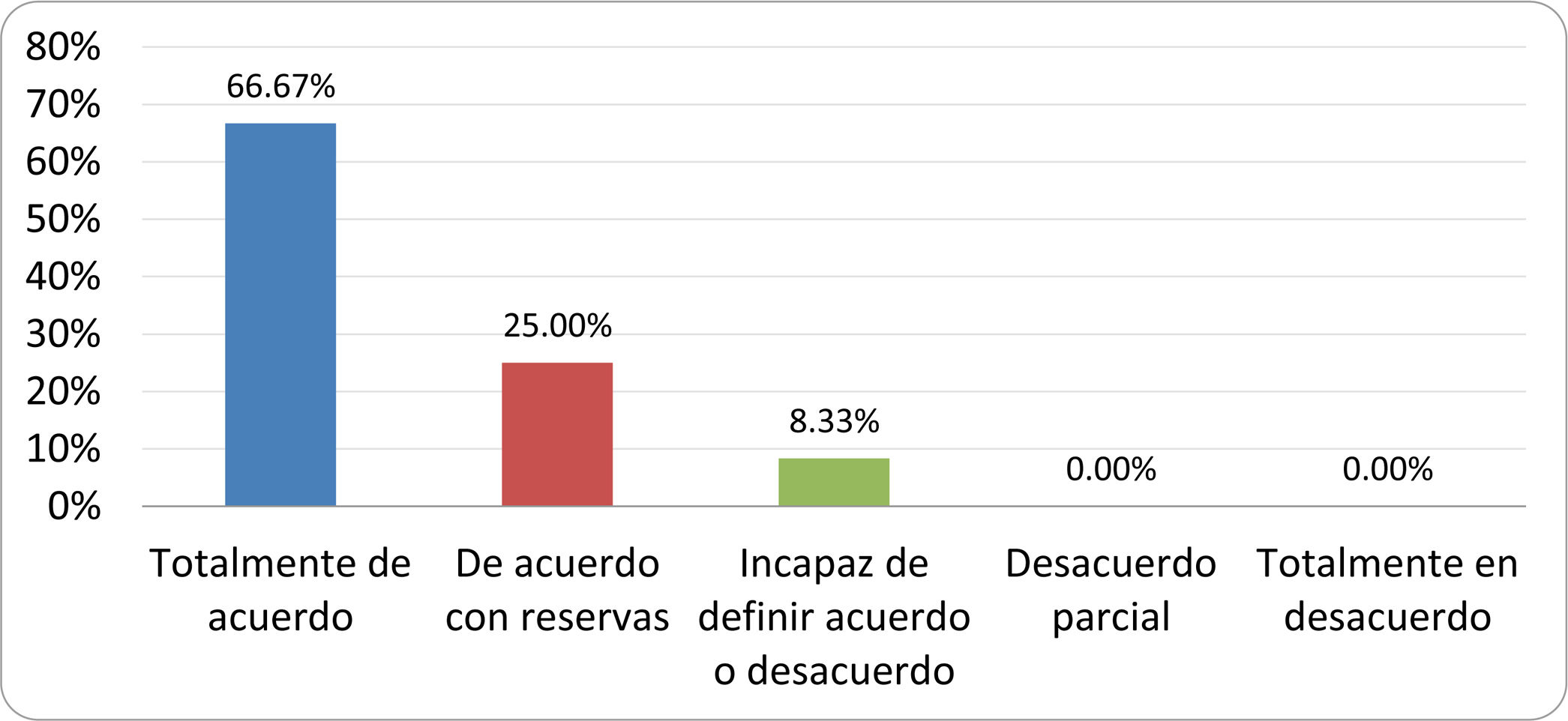
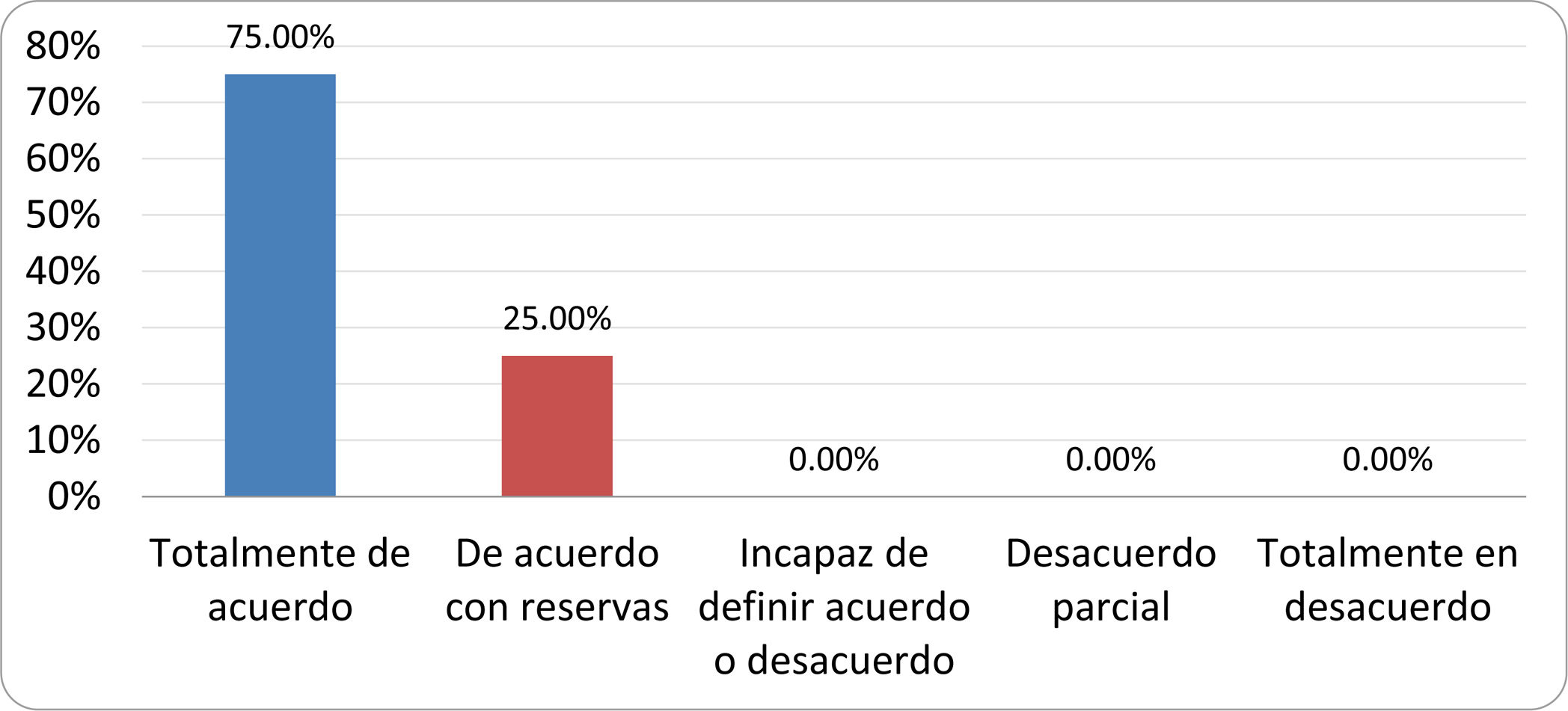
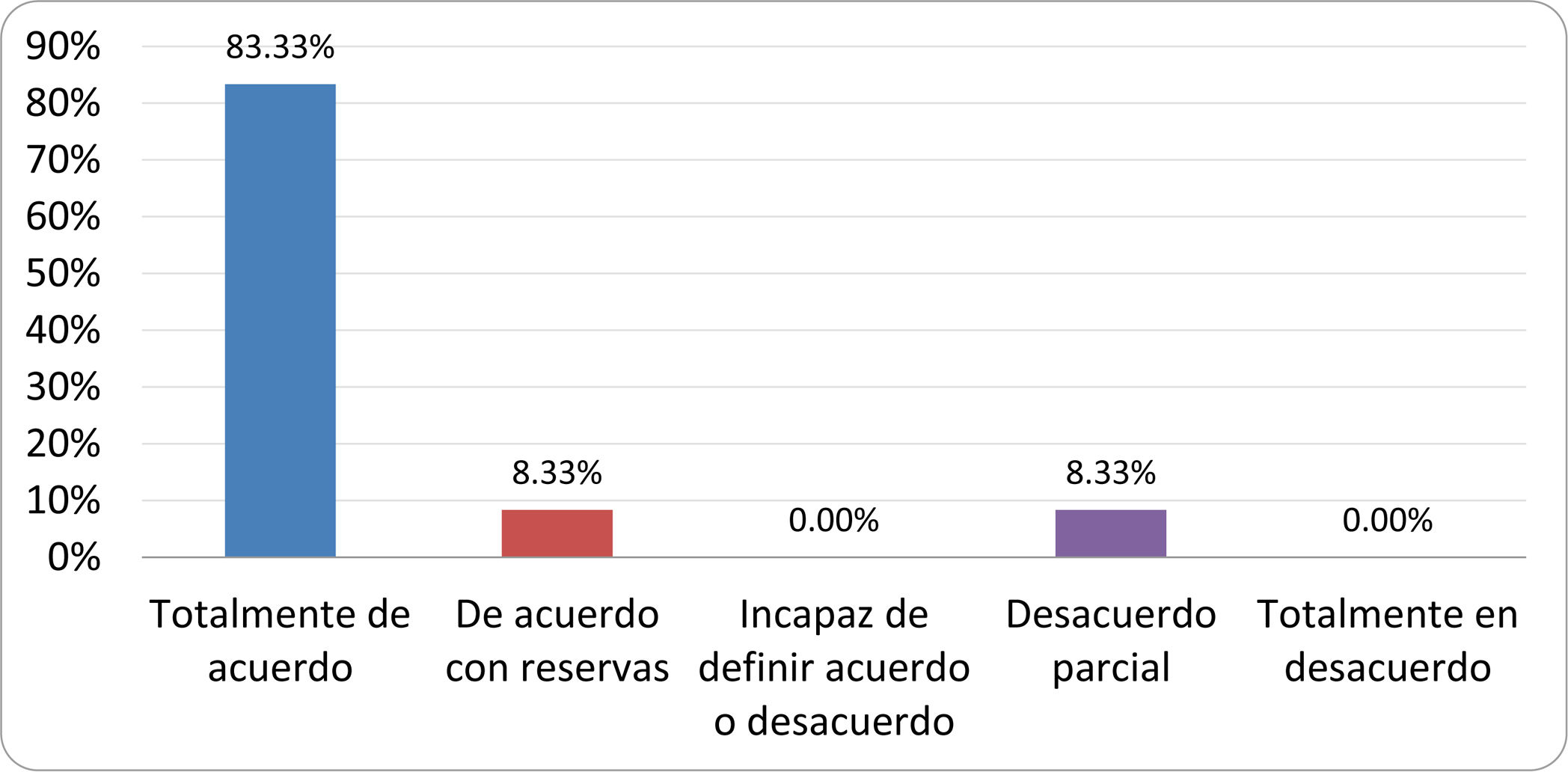
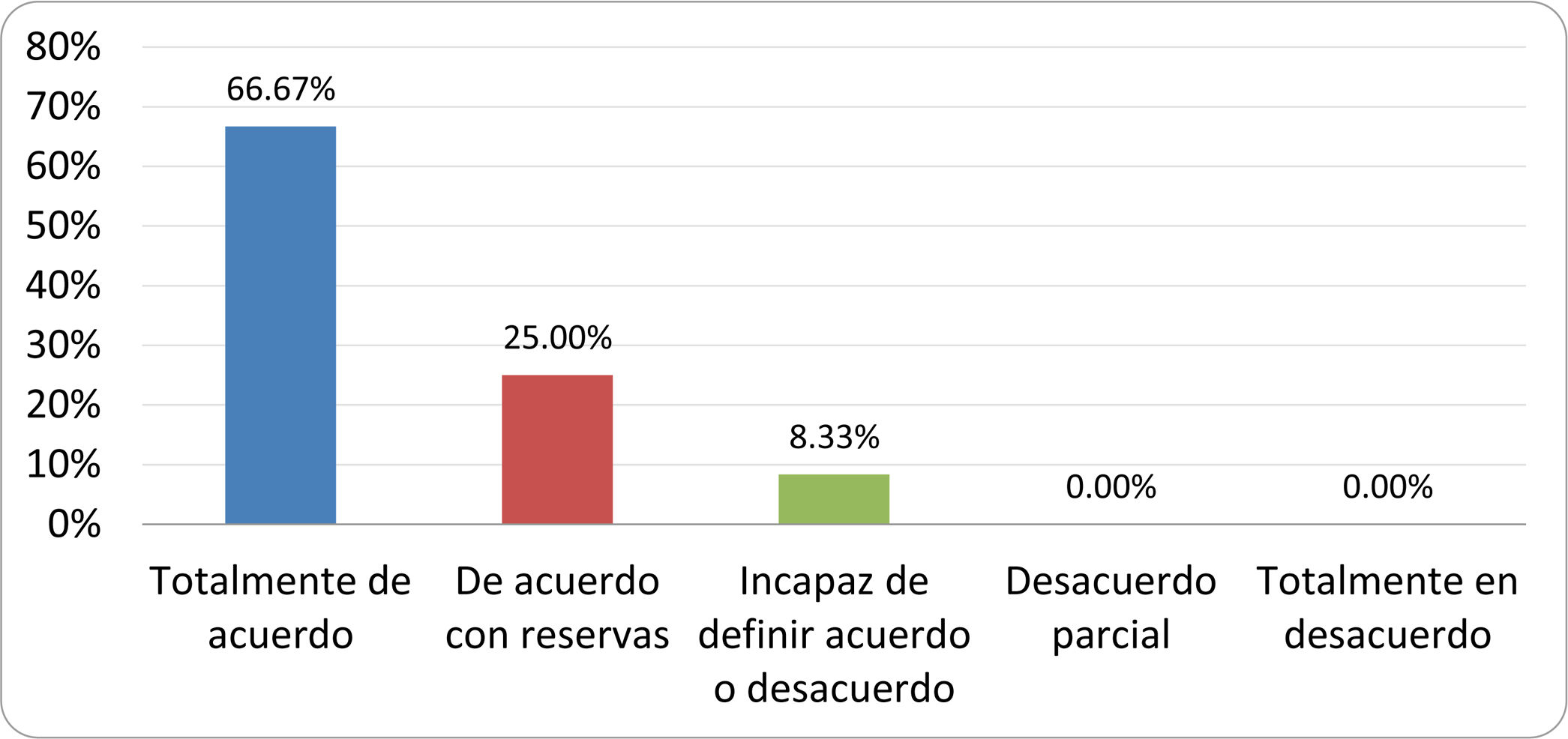
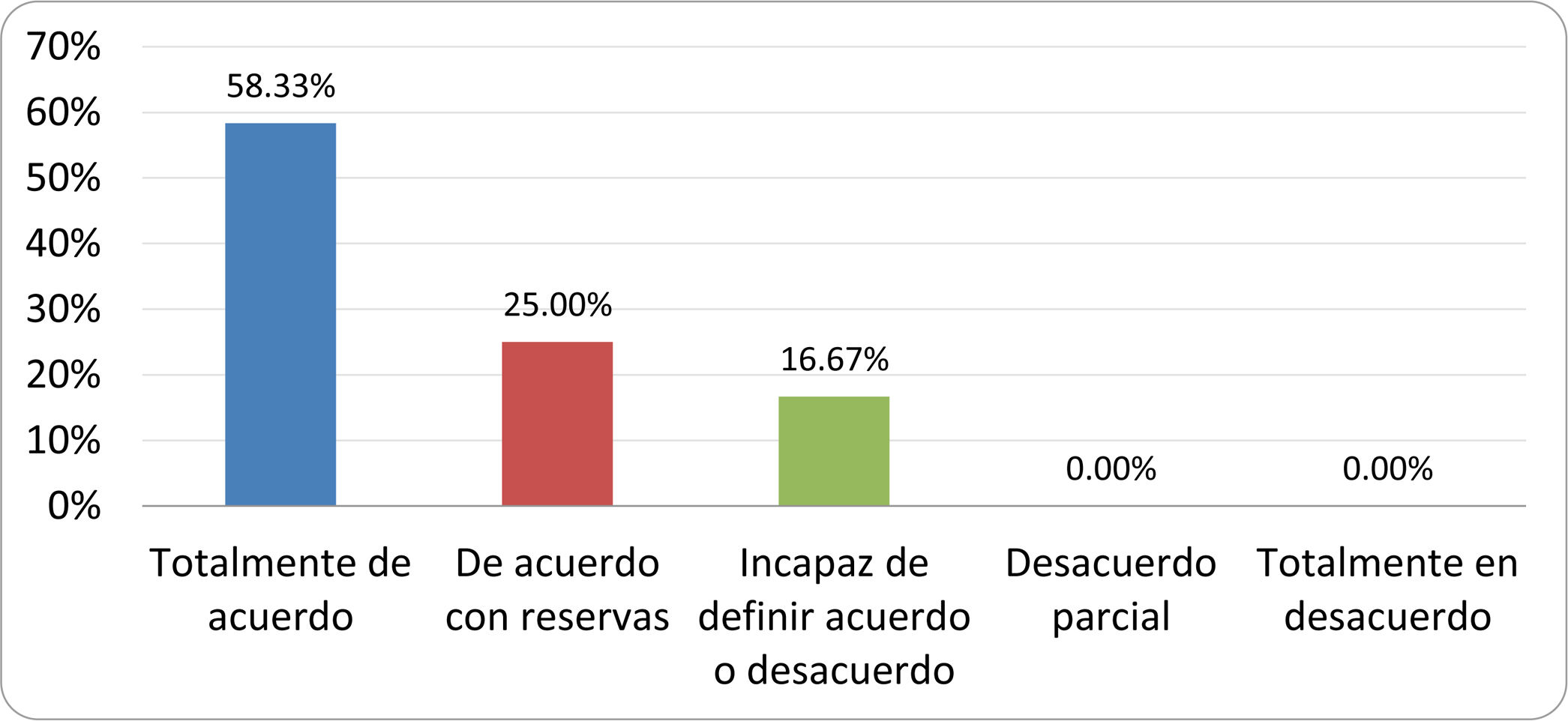
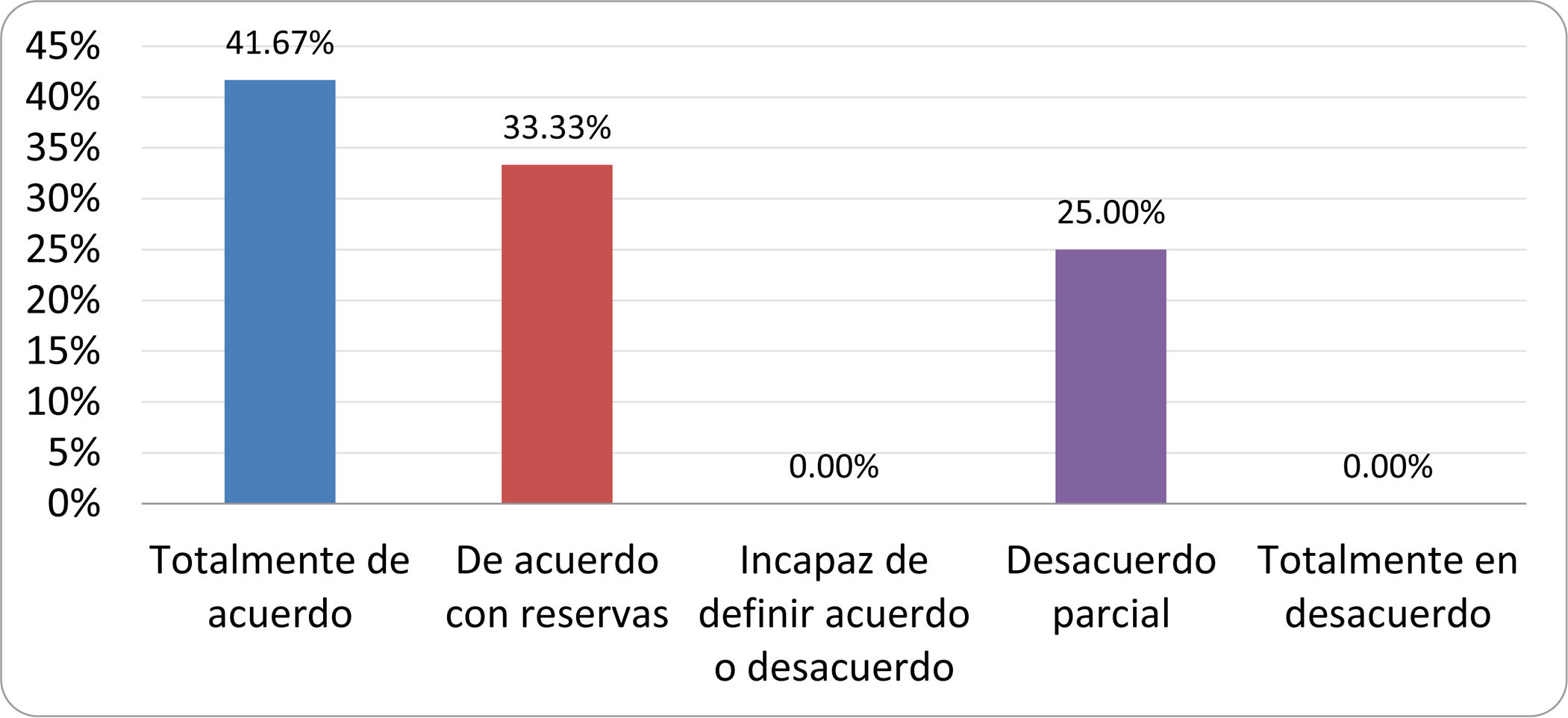
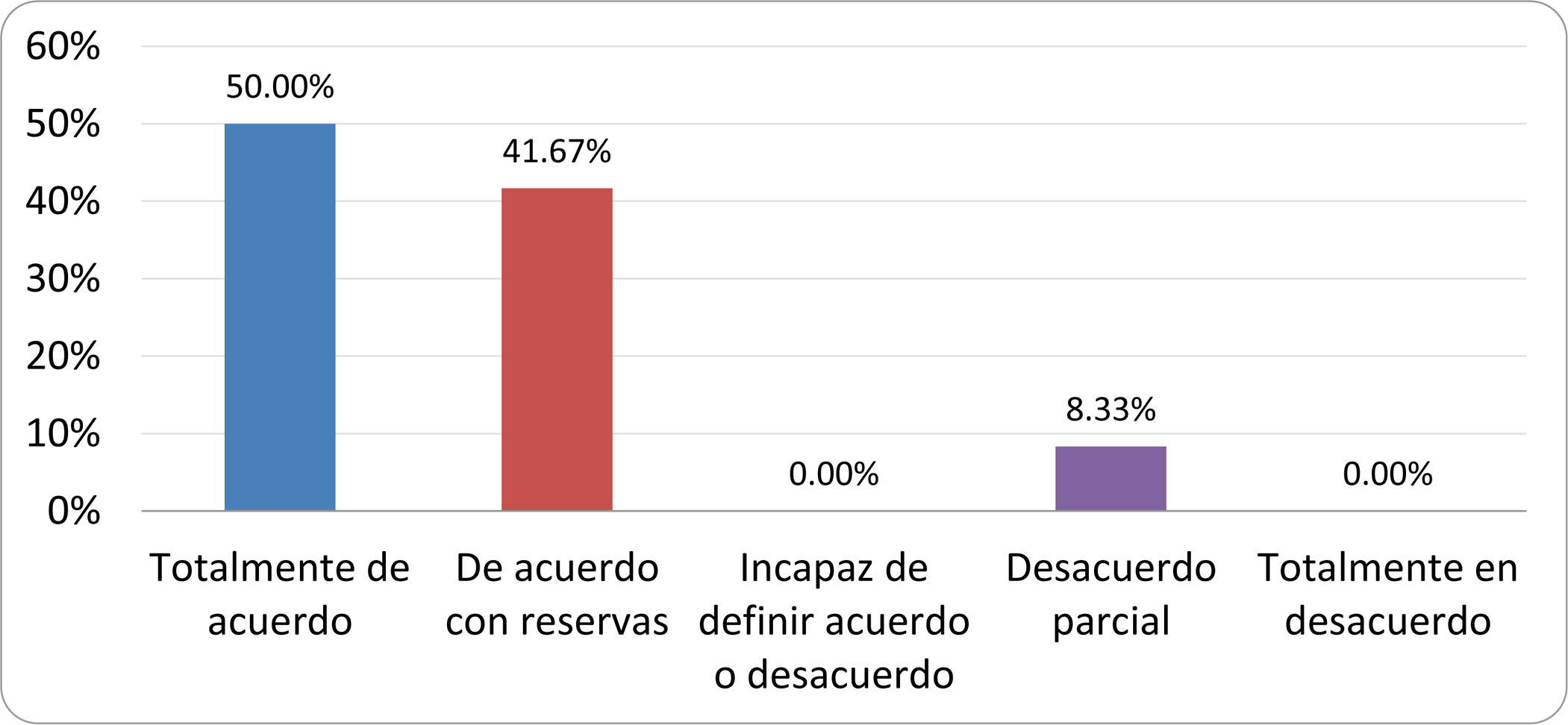
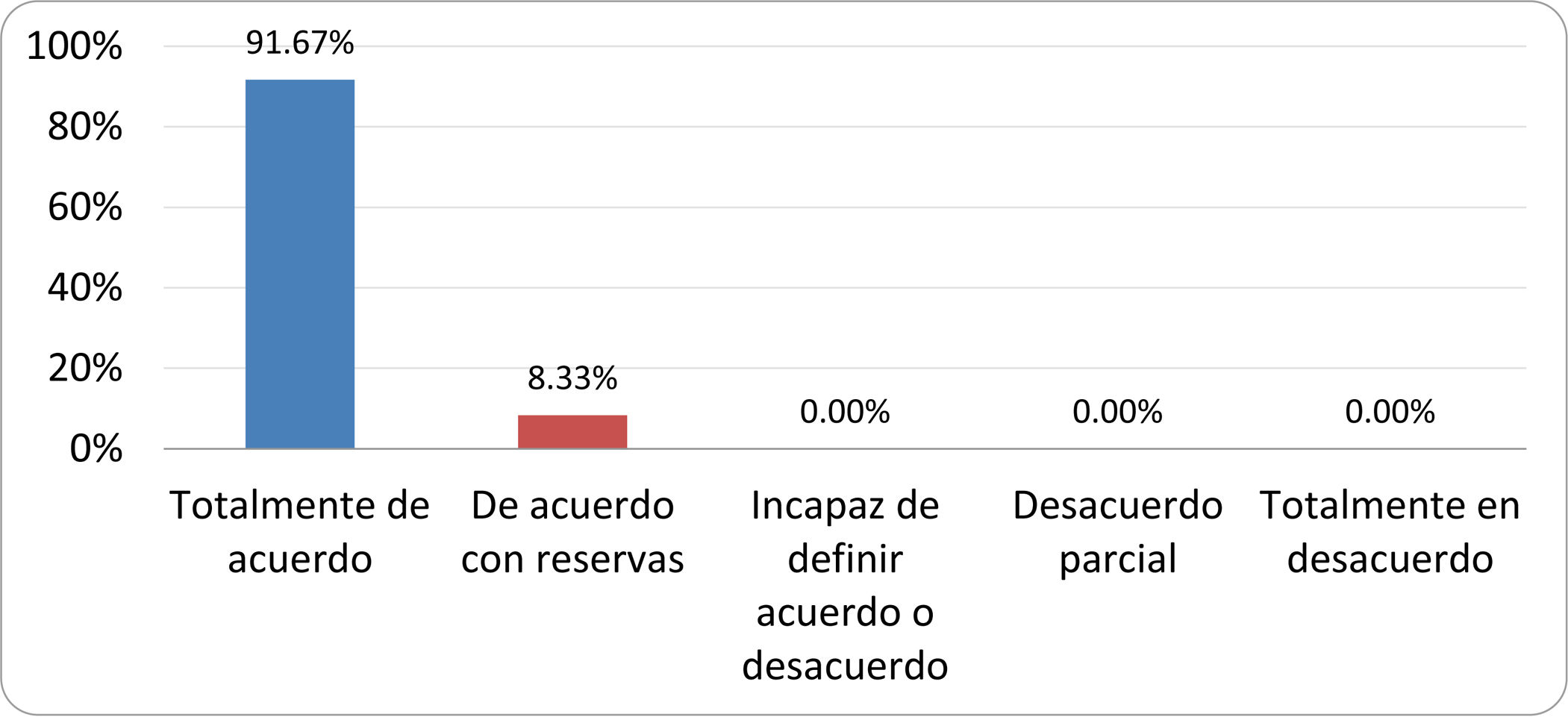
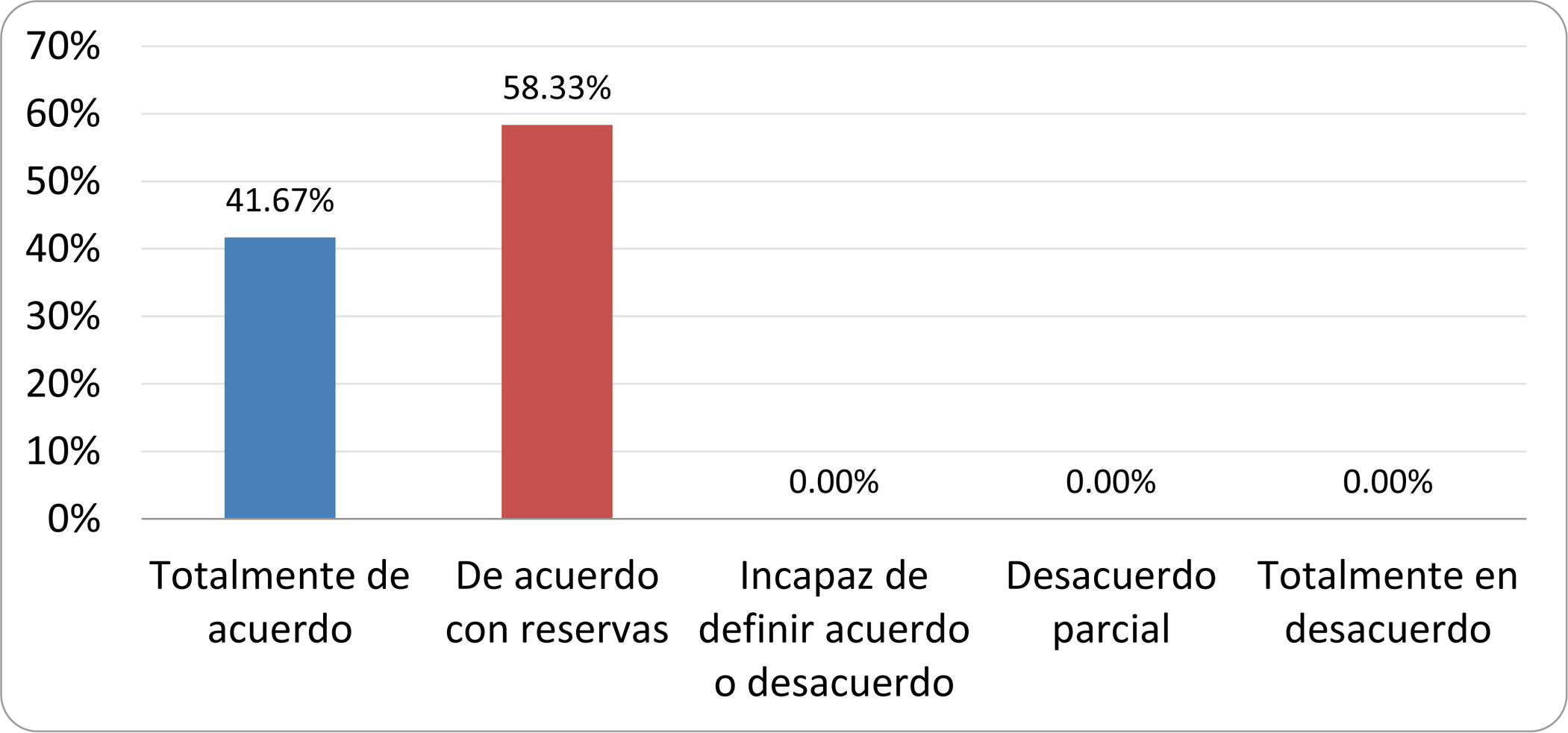
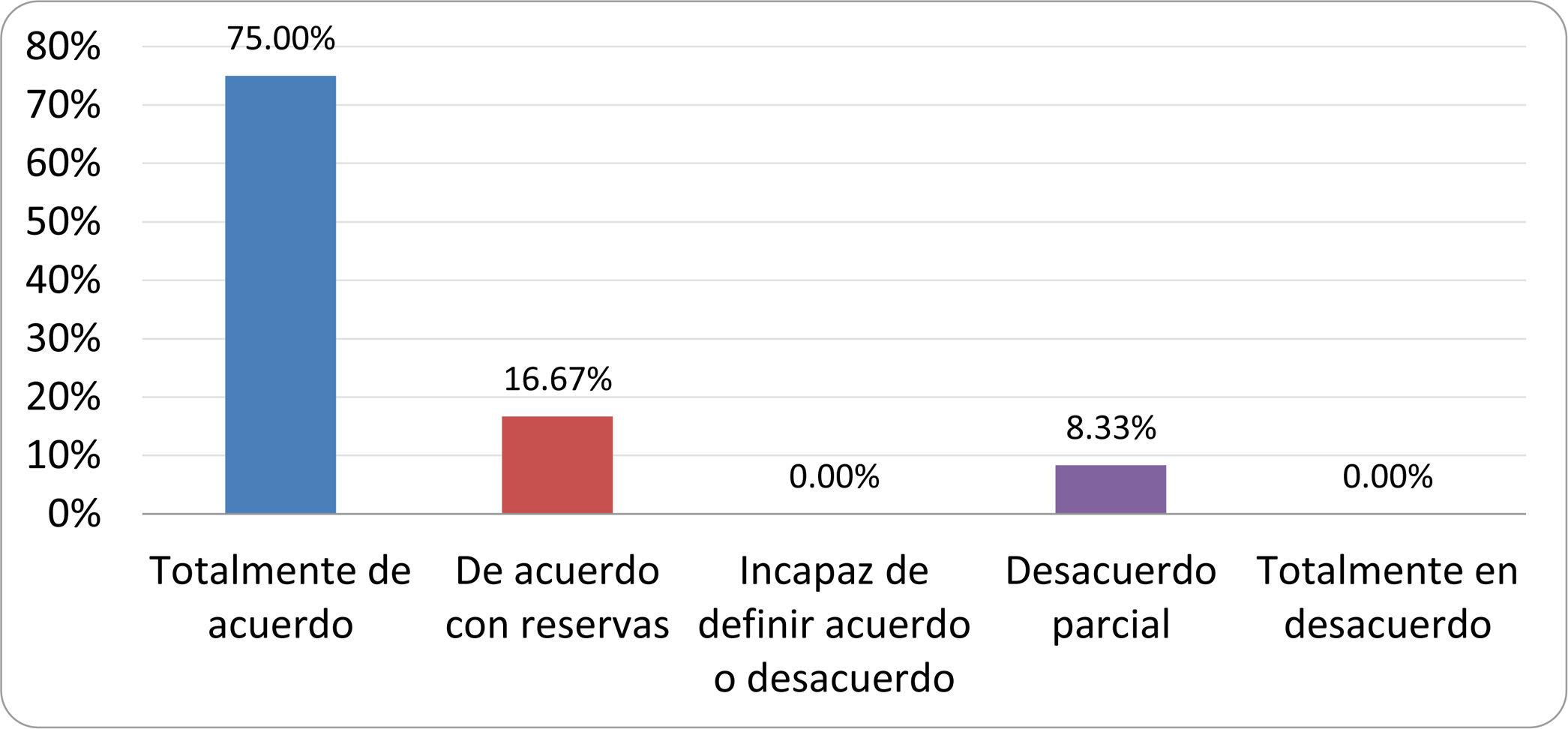
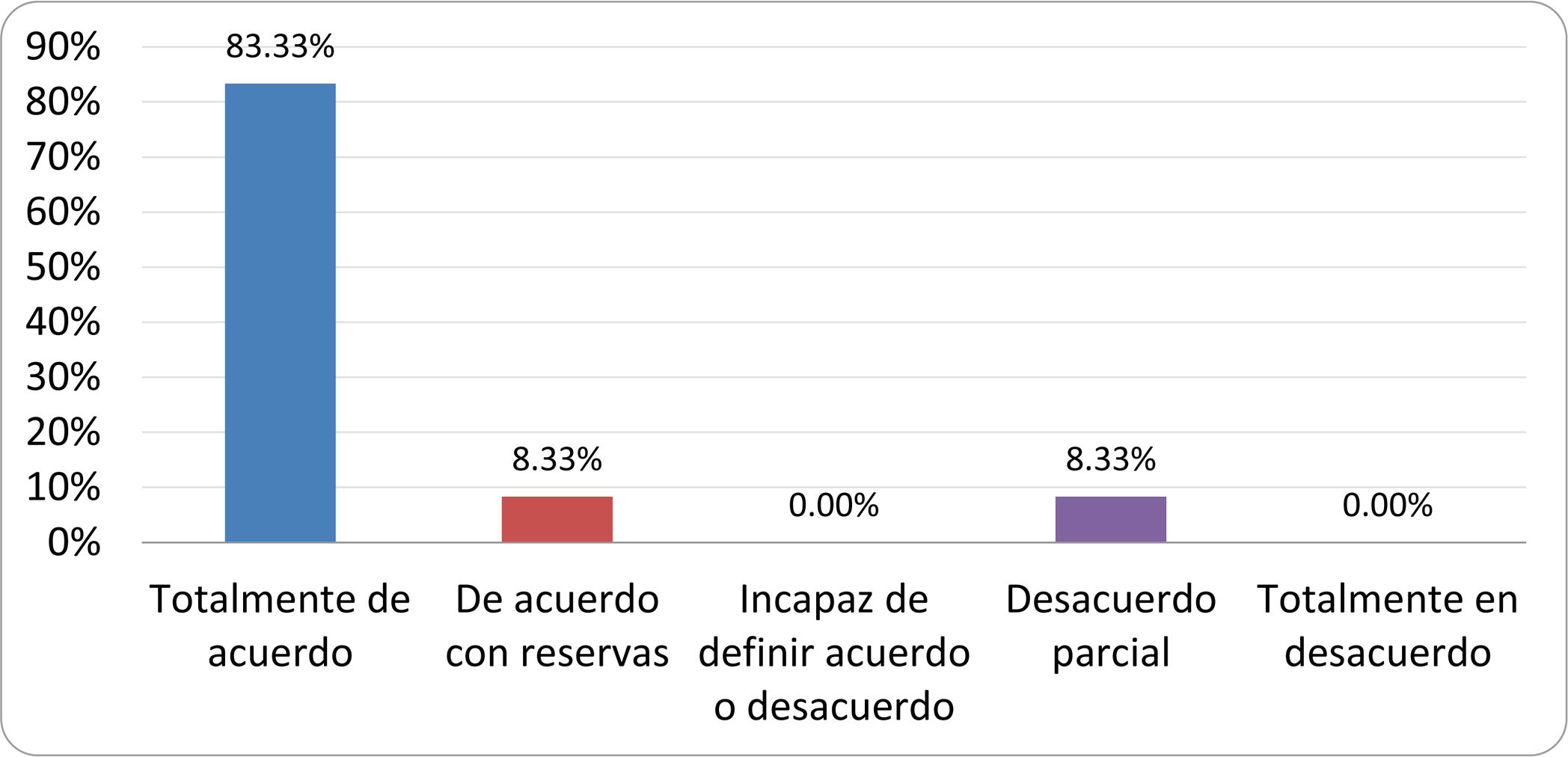
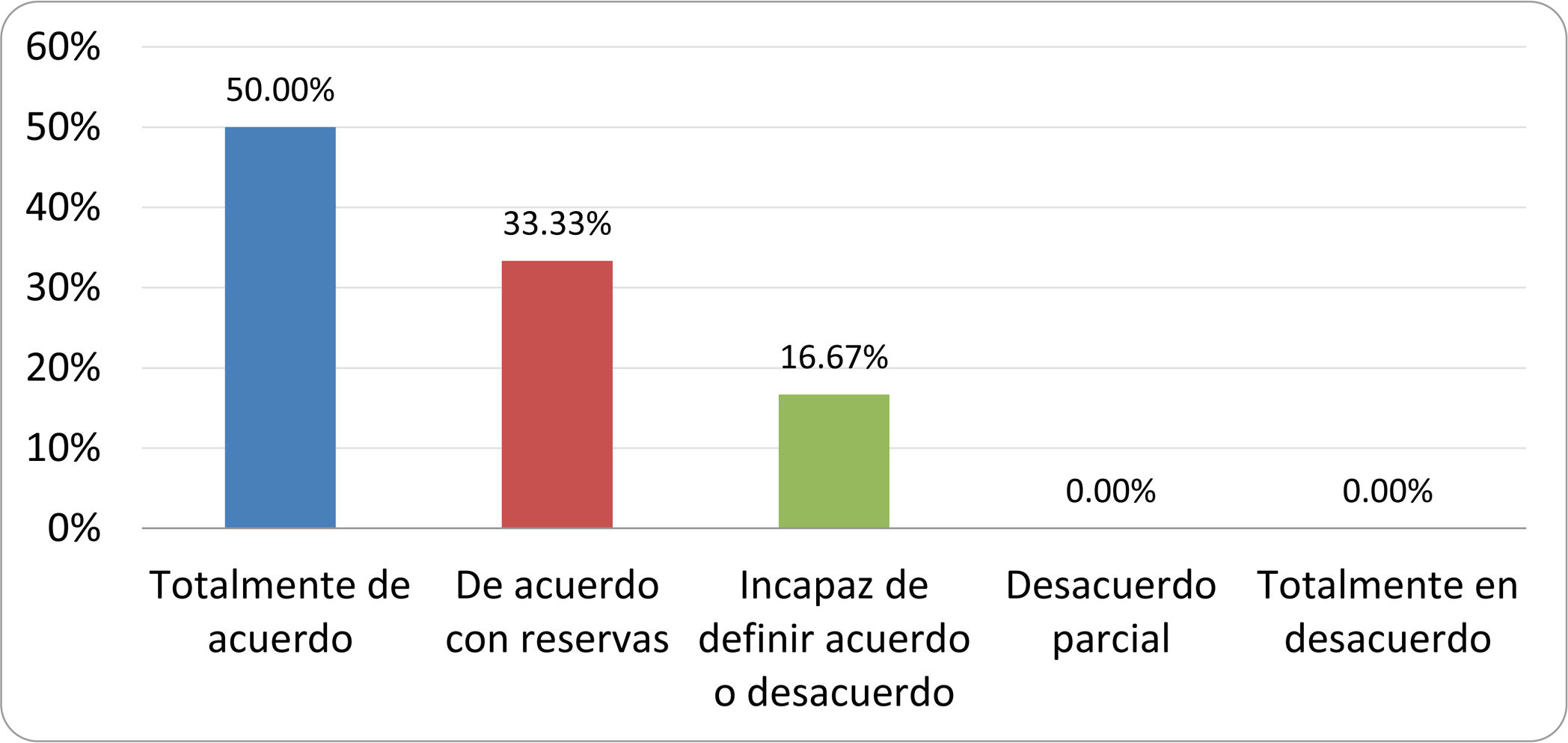
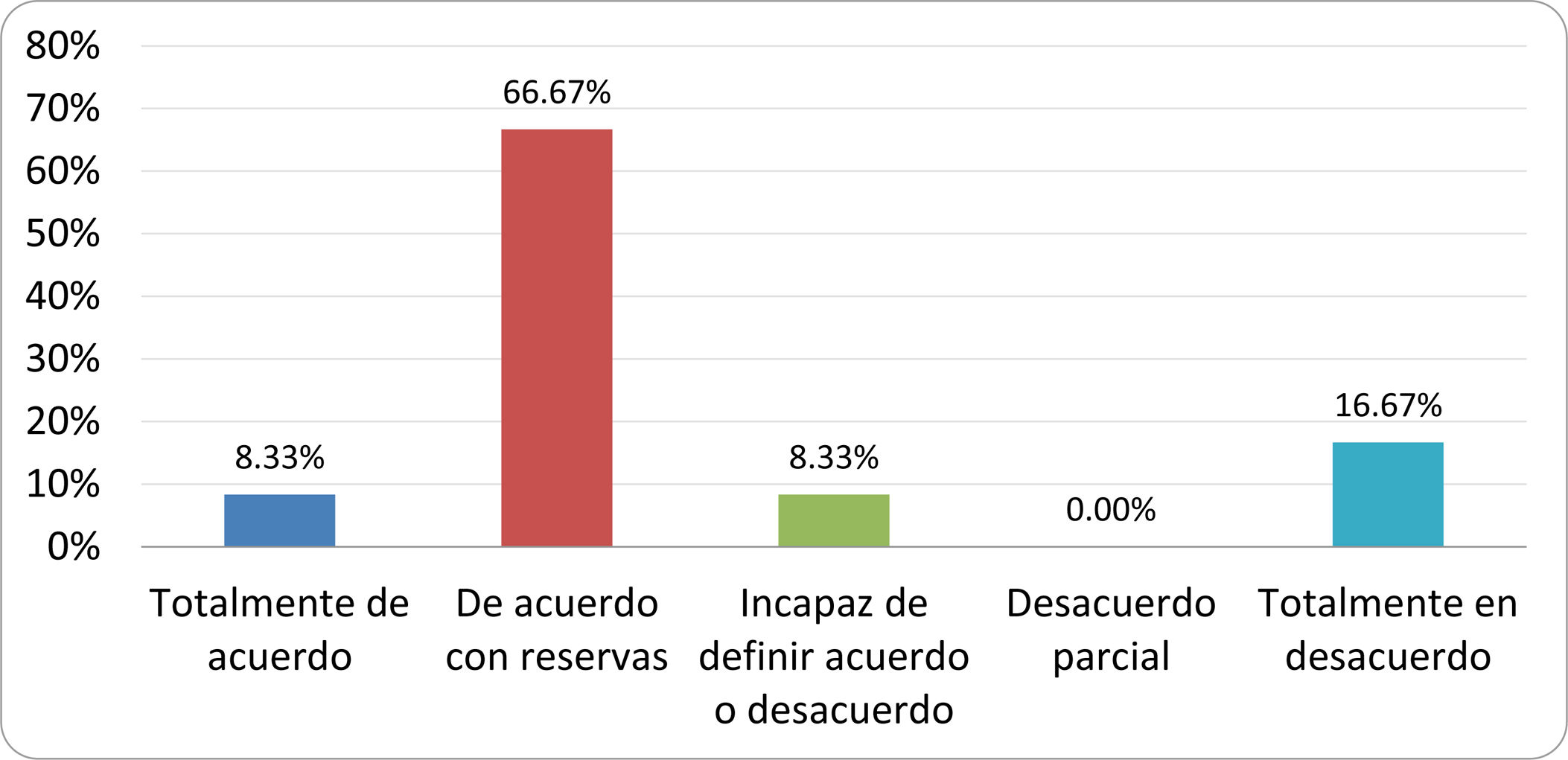
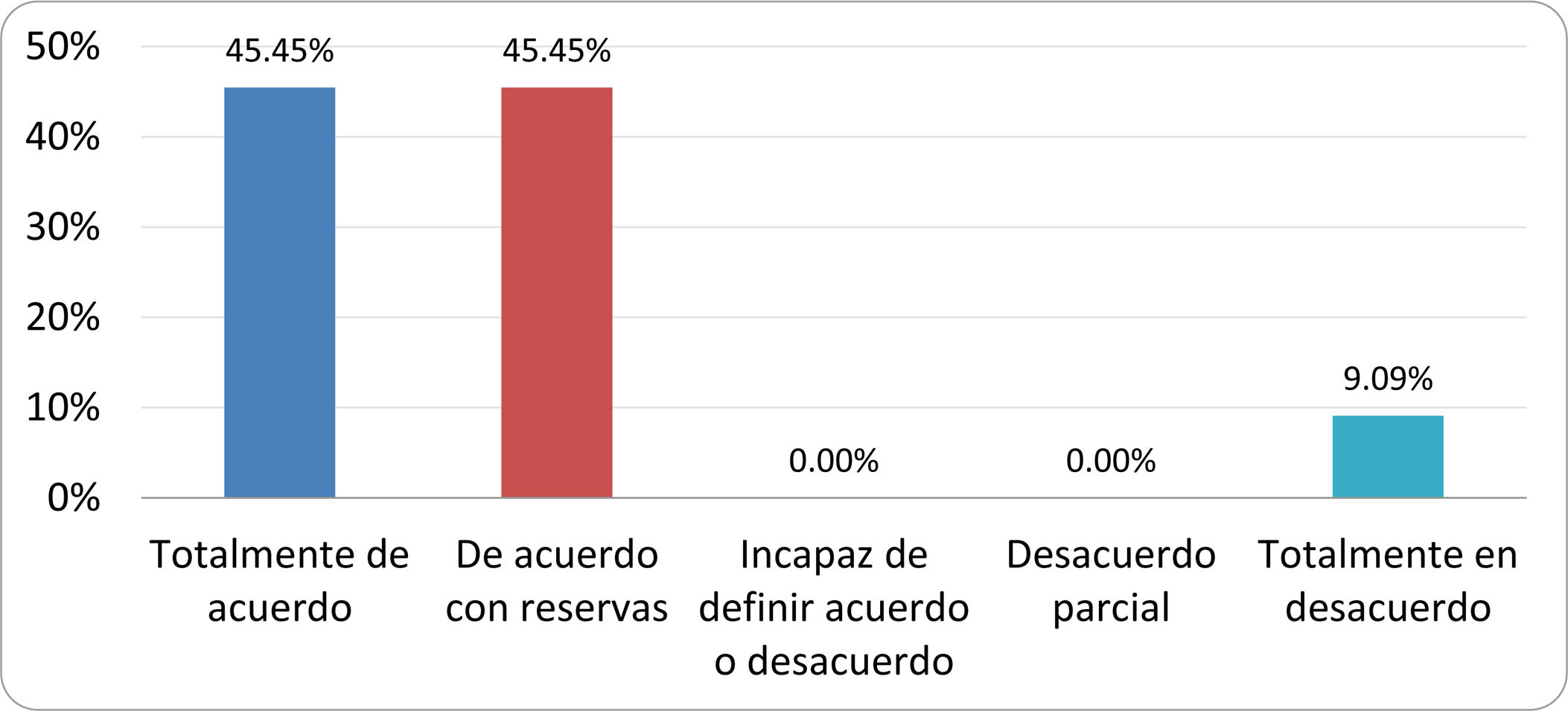
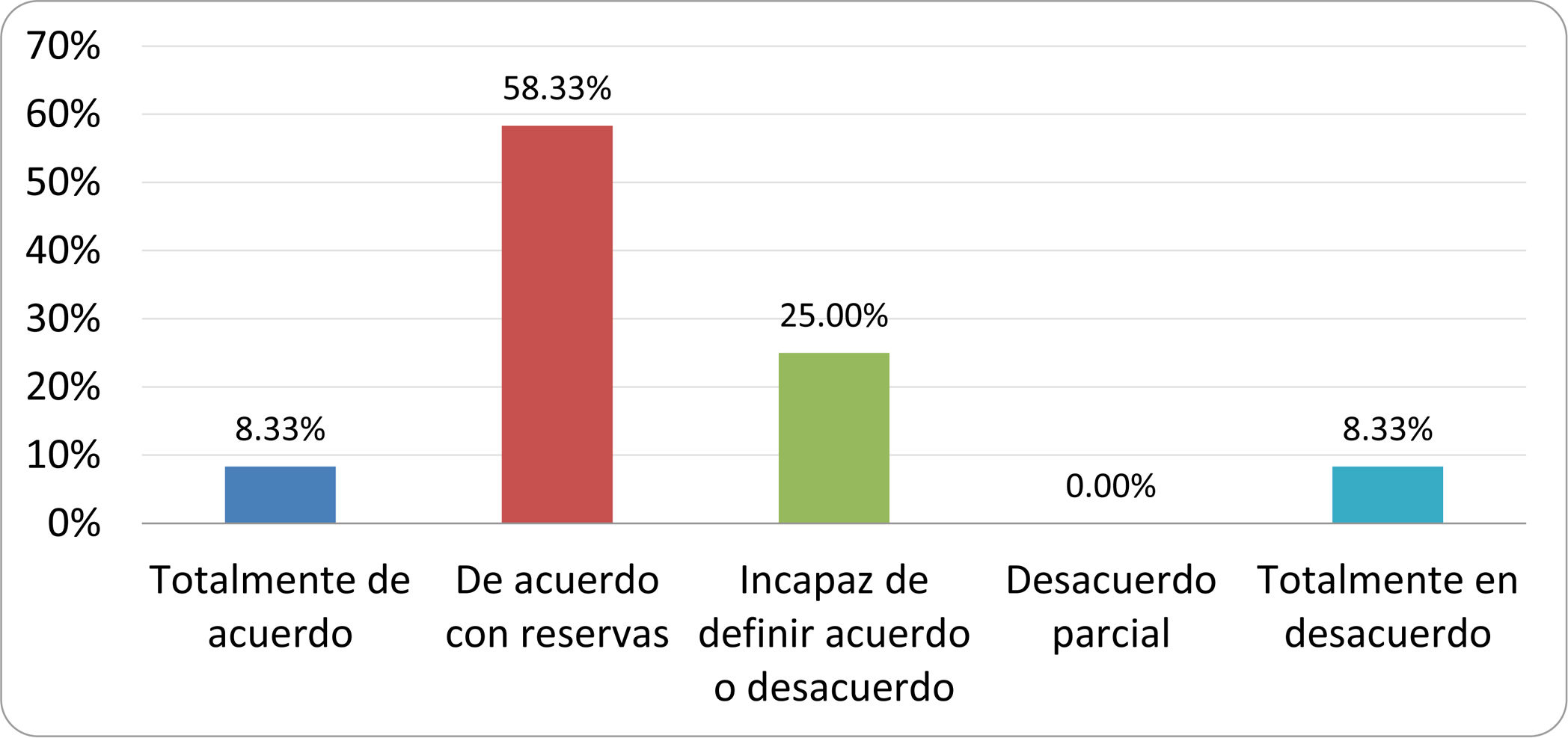
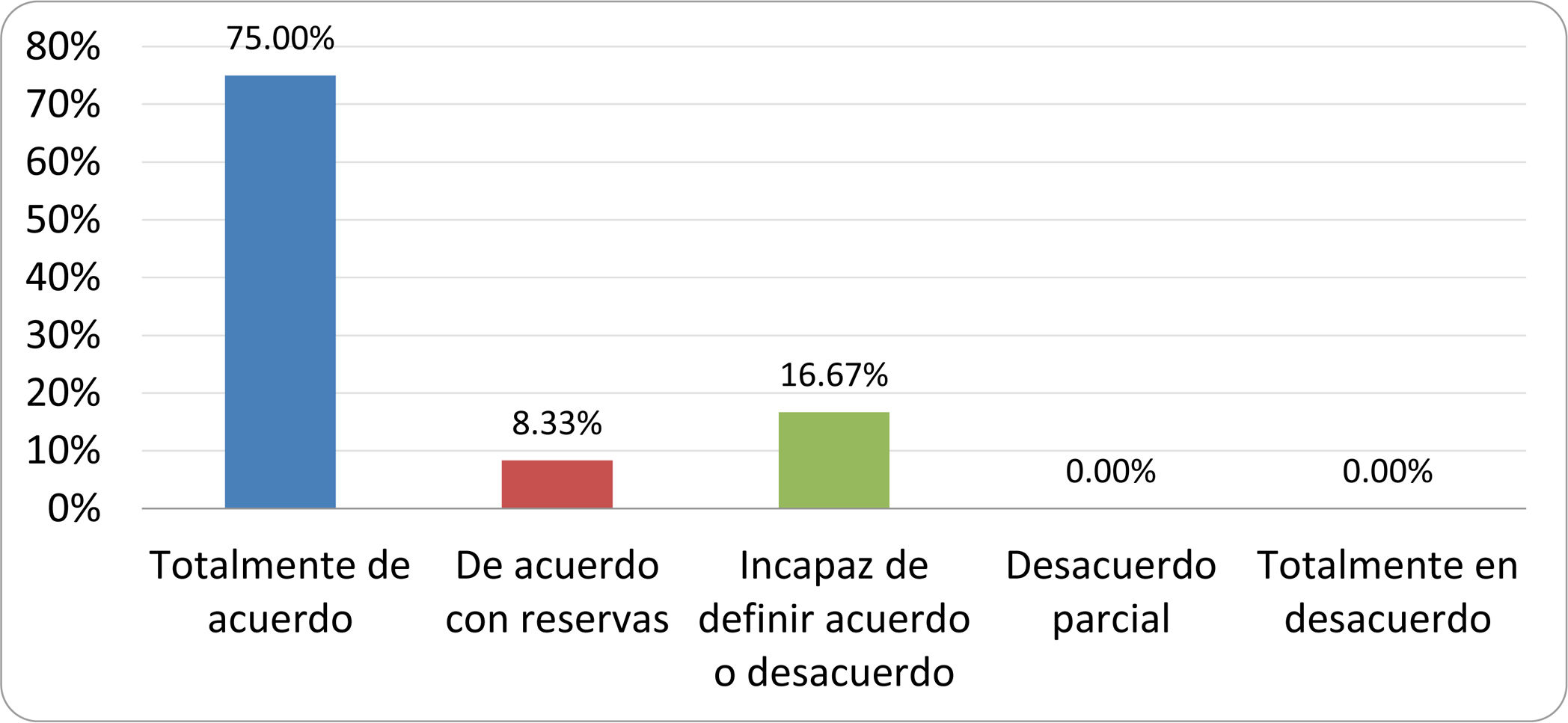
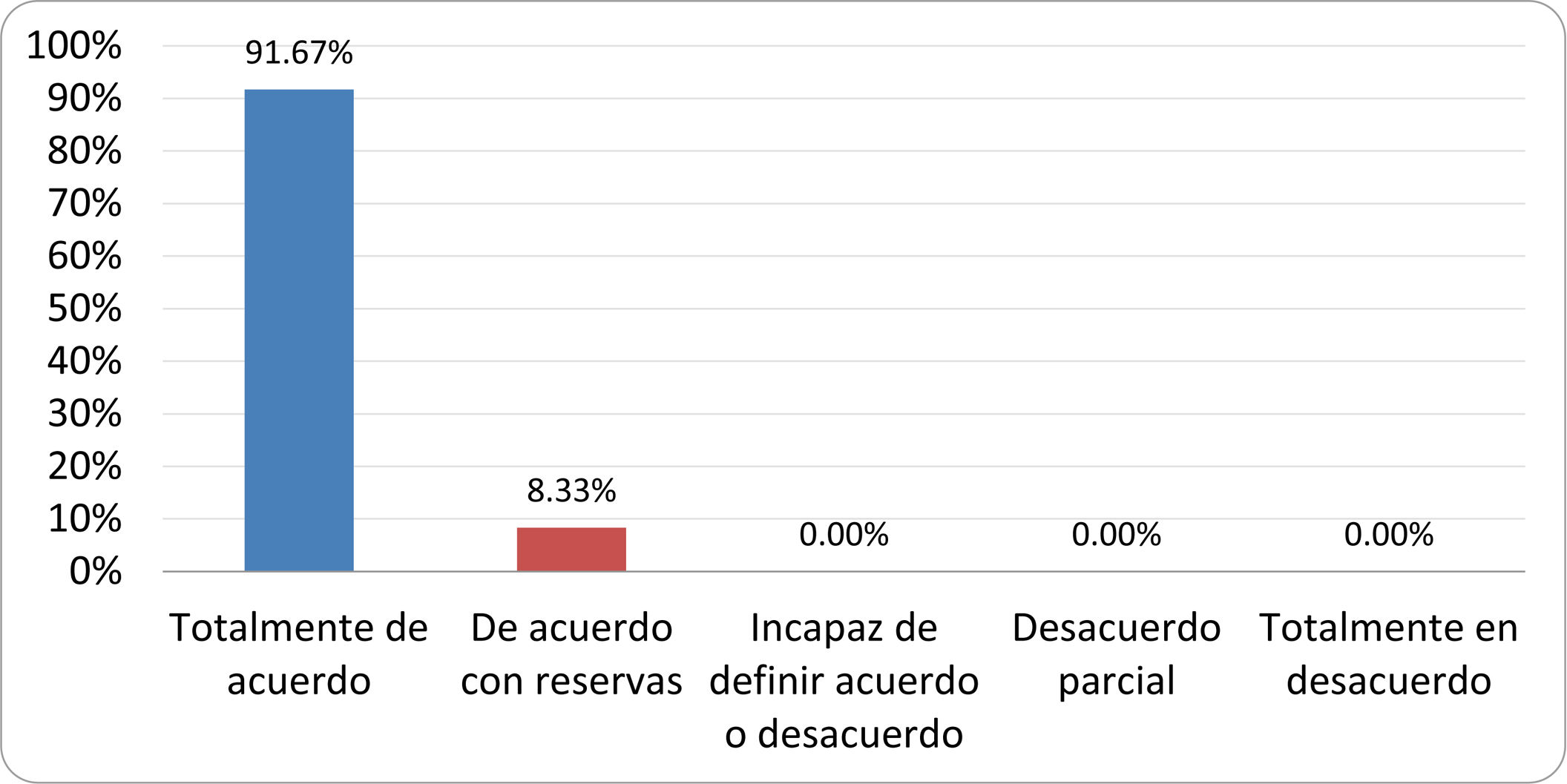
Resultados de la votación del grupo de expertos. Encuesta cumplimentada por los autores del documento sobre 25 declaraciones, con escala de Likert de cinco opciones relativas al grado de acuerdo con las mismas. Se aceptaron las declaraciones con acuerdo total y con reservas por encima del 80% y desacuerdo (total y parcial) inferior al 10%. En el resto de los supuestos se consideró que no existía conformidad suficiente para aceptar la declaración como consensuada (tabla 4).
Declaraciones y grado de Consenso del grupo de expertos
| DECLARACIONES | Consenso |
|---|---|
| 1. El síndrome del sobrecrecimiento bacteriano del intestino delgado se define por un aumento de la carga bacteriana que coloniza este tramo del tubo digestivo capaz de causar síntomas y alteraciones analíticas definidas. | Aceptada |
| 2. El punto de corte diagnóstico es de 103 UFC por mililitro de aspirado duodenal o yeyunal, cultivado en agar MacConkey. | Aceptada |
| 3. Determinados cambios taxonómicos, con predominio de coliformes, son necesarios para el diagnóstico del SIBO. | Sin consenso |
| 4. La aparición de SIBO se asocia a la presencia de determinados factores predisponentes. | Aceptada |
| 5. El espectro clínico del SIBO es muy amplio, abarcando desde formas paucisintomáticas a cuadros con malabsorción grave. | Aceptada |
| 6. El síntoma que ha demostrado mayor grado de asociación con la presencia del SIBO es la diarrea. | Aceptada |
| 7. La hinchazón o la distensión abdominal no se asocian a un aumento en el riesgo de presentar SIBO en pacientes sin factores predisponentes. | Aceptada |
| 8. En ausencia de alguno o varios de los factores predisponentes que se han definido, NO está indicado sugerir un test diagnóstico de SIBO. | Aceptada |
| 9. Los síntomas no tienen capacidad para predecir la positividad de los test diagnósticos. | Aceptada |
| 10. Los test diagnósticos no predicen la respuesta sintomática a una dieta restrictiva. | Aceptada |
| 11. Los test diagnósticos no predicen la respuesta sintomática a los tratamientos antibióticos en pacientes con síndrome del intestino irritable. | Aceptada |
| 12. Los test de H2 y CH4 con sustrato glucosa superan globalmente en sensibilidad y especificidad a los test con lactulosa. | Aceptada |
| 13. En pacientes con antecedente de resección gastrointestinal, el resultado positivo de un test de glucosa debe atribuirse con mayor probabilidad a un tránsito intestinal acelerado y considerarse un falso positivo para el SIBO. | Aceptada |
| 14. Es aconsejable asociar una prueba de evaluación del tránsito intestinal cuando se realiza un test de H2/CH4 para el diagnóstico de SIBO, para mejorar la interpretación del resultado obtenido con este último. | Sin consenso |
| 15. El cultivo del aspirado intestinal es el test diagnóstico considerado de referencia, pero NO puede ser considerado un patrón oro. | Aceptada |
| 16. La complejidad técnica para la realización del cultivo limita su empleo en la práctica clínica. | Aceptada |
| 17. Las pruebas de PCR en biopsia intestinal, heces o aspirado intestinal NO han demostrado aportar un valor diagnóstico superior al cultivo. | Aceptada |
| 18. El ensayo de dietas restrictivas para el tratamiento del SIBO NO tiene respaldo científico para su inclusión entre las medidas con efecto terapéutico. | Aceptada |
| 19. El efecto de una dieta restrictiva mantenida en el tiempo, sobre la composición y vías metabólicas del microbioma es aún incierto. Sus complicaciones potenciales a largo plazo son una razón añadida para desaconsejar su empleo en el SIBO. | Aceptada |
| 20. Rifaximina es el tratamiento de elección en el tratamiento del SIBO. | Aceptada |
| 21. No se han demostrado diferencias en la efectividad entre los diferentes antibióticos sistémicos ensayados. | Sin consenso |
| 22. La indicación de antibióticos cíclicos es aceptable en aquellos pacientes con un factor predisponente asociado a SIBO recurrente. | Aceptada |
| 23. La recurrencia del SIBO es muy frecuente y para su tratamiento se sugiere el empleo de rifaximina. | Sin consenso |
| 24. No puede recomendarse de forma genérica el empleo de probióticos para tratar el SIBO o sus síntomas. | Aceptada |
| 25. No hay suficiente evidencia que respalde el empleo de remedios herbales entre las medidas terapéuticas para el SIBO. | Aceptada |
Este documento ha sido avalado por la Asociación Española de Gastroenterología y la Asociación Española de Neurogastroenterología y Motilidad, cubriendo ambas sus gastos de publicación, sin recibir financiación externa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Documento de revisión de la evidencia científica y Consenso del Grupo de Expertos de la Asociación Española de Gastroenterología (AEG) y la Asociación Española de Neurogastroenterología y Motilidad (ASENEM).