La Sociedad Española de Patología Digestiva (SEPD), la Asociación Española para el Estudio del Hígado (AEEH), la Sociedad Española de Infecciones y Microbiología Clínica (SEIMC) y su Grupo de Estudio de Hepatitis Víricas (GEHEP), y con el aval de la Alianza para la Eliminación de las Hepatitis Víricas en España (AEHVE), han consensuado un documento para realizar un diagnóstico integral de las hepatitis virales (B, C y D), a partir de una única extracción analítica; es decir diagnóstico integral, en el centro hospitalario y/o en el punto de atención del paciente. Proponemos un algoritmo, de manera que el resultado positivo en serología frente a los virus de las hepatitis (B, C y D), así como el virus de la inmunodeficiencia humana (VIH), activaría el análisis del resto de virus, incluyendo la carga viral cuando sea preciso, a partir de la misma extracción sanguínea. Además, hacemos dos recomendaciones adicionales. Por un lado, la necesidad de descartar una infección previa por el virus de la hepatitis A (VHA), para proceder a la vacunación en los casos en que los anticuerpos de tipo IgG frente a este virus sean negativos y la vacuna esté indicada. Y, por otro lado, la determinación de la serología del VIH. En caso de un resultado positivo para cualquiera de los virus analizados se deben emitir alertas automatizadas y activar la monitorización epidemiológica.
The Spanish Society of Digestive Pathology (SEPD), the Spanish Association for the Study of the Liver (AEEH), the Spanish Society of Infections and Clinical Microbiology (SEIMC) and its Viral Hepatitis Study Group (GEHEP), and with the endorsement of the Alliance for the Elimination of Viral Hepatitis in Spain (AEHVE), have agreed on a document to carry out a comprehensive diagnosis of viral hepatitis (B, C and D), from a single blood sample; that is, a comprehensive diagnosis, in the hospital and/or at the point of care of the patient. We propose an algorithm, so that the positive result in a viral hepatitis serology (B, C and D), as well as human immunodeficiency virus (HIV), would trigger the analysis of the rest of the virus, including the viral load when necessary, in the same blood draw. In addition, we make two additional recommendations.
First, the need to rule out a previous hepatitis A virus (VHA) infection, to proceed with its vaccination in cases where IgG-type studies against this virus are negative and the vaccine is indicated. Second, the determination of the HIV serology. Finally, in case of a positive result for any of the viruses analyzed, there must be an automated alerts and initiate epidemiological monitoring.
Las hepatitis virales causadas por los virus de la hepatitis B, C y D (VHB, VHC y VHD) representan una amenaza importante para la salud pública por su elevada morbimortalidad y transmisibilidad. Se estima que hay alrededor de 354 millones de personas con hepatitis B o C crónica en el mundo (296 millones con hepatitis B y 58 millones con hepatitis C)1, y un 5% de las que presentan infección por VHB tienen infección por VHD1,2. La mortalidad global atribuible a las hepatitis virales se sitúa en 1,4 millones de muertes cada año, siendo la asociada a las hepatitis B y C crónicas las más significativas3. En España, la prevalencia del antígeno de superficie (HBsAg) (0,6%) y anticuerpos contra el antígeno core de hepatitis B (anti-HBc) (8,2%) no ha variado en los últimos años4, mientras que las últimas cifras publicadas sobre la hepatitis C presentan datos de seroprevalencia (1-1,4%) e infección virémica (0,2 - 0,3%) inferiores a años anteriores5. Estas cifras aumentan en poblaciones de riesgo o que forman parte de algún colectivo vulnerable, como las personas que consumen drogas, los internos en centros penitenciarios, los hombres que tienen sexo con hombres (HSH) y los inmigrantes procedentes de países de elevada prevalencia, puesto que es donde se concentran el mayor número de casos6,7. La morbimortalidad asociada a las hepatitis virales está ligada a la persistencia de la replicación viral con progresión de la fibrosis a cirrosis y desarrollo de complicaciones hepáticas a largo plazo. Este daño puede agravarse si existe coinfección por distintos virus, y más aún por la presencia del VHD8. Se estima que uno de cada seis casos de cirrosis que ocurren en pacientes con VHB son atribuibles a la coinfección por el VHD2.
La hepatitis B se puede prevenir mediante la vacunación, altamente eficaz, mientras que la enfermedad activa se trata con análogos de nucleós(t)idos que son efectivos para controlar la replicación viral9-11. Los antivirales de acción directa (AAD) frente al VHC alcanzan tasas de repuesta viral sostenida (RVS) elevadas que generan la curación de la infección en la mayoría de los pacientes12. El tratamiento de las hepatitis virales previene el desarrollo de cirrosis, disminuye el riesgo de carcinoma hepatocelular y de trasplante hepático y mejora la supervivencia9,13–17. Además, el tratamiento para la hepatitis C ha demostrado ser coste-efectivo, incluso reduciendo la carga social de la enfermedad18–21. Un estudio reciente muestra un descenso muy significativo de las hospitalizaciones por cirrosis por VHC desde la introducción de los AAD, pudiendo ser una causa marginal de ingresos en un futuro22. Asimismo, el tratamiento favorece el control de la transmisión del virus, lo que se ha visto reflejado en un descenso significativo en la prevalencia de la infección tras la introducción de los AAD en los últimos años.
En el caso de la hepatitis D, un fármaco aprobado condicionalmente por la Agencia Europea de Medicamentos (EMA), la bulevirtida consigue normalizar los valores de ALT y disminuir en dos log o a niveles indetectables los valores de ARN-VHD en un porcentaje significativo de casos23.
Los avances en el tratamiento motivaron que la Organización Mundial de la Salud (OMS) estableciese en el año 2016 unos objetivos centrados en reducir la incidencia de la hepatitis B y C en 90% y la mortalidad en 65%, con el fin de conseguir su eliminación en el año 20301. Durante estos últimos años, la mayoría de los países han establecido medidas dirigidas a cumplir con estos objetivos consiguiendo una disminución estimada de las infecciones en 6,8 millones con respecto al 201524. En España, gracias a los esfuerzos colectivos para implantar acciones dirigidas, entre otras, establecer estrategias de cribado y búsqueda de pacientes con infección no conocida, se ha conseguido diagnosticar y tratar a un número elevado de personas, sobre todo con hepatitis C25 y encontrándonos en el camino de su eliminación26. Pero estos esfuerzos, se han visto aminorados por la pandemia de la COVID-19, que ha afectado gravemente a los servicios sanitarios provocando que la mayor parte de los recursos sanitarios, especialmente los servicios de microbiología27, fueran destinados a mitigarla, dañando la atención de otras enfermedades como las hepatitis virales. El cierre de centros de salud y hospitalarios, junto con las restricciones de acceso ha provocado retrasos importantes en el diagnóstico y el estancamiento de los inicios de tratamiento28–31. Además, esta situación se ha agravado en colectivos vulnerables que acuden a centros comunitarios, tales como las unidades de reducción de daños32. La paralización de los programas de microeliminación ha generado un descenso brusco en los diagnósticos del 25% en los centros sanitarios y del 56% en los comunitarios33. Estos retrasos provocarán el diagnóstico tardío de la enfermedad34 con la consecuente pérdida de oportunidad de curación en fases precoces de la misma que modificarían su historia natural. Estudios recientes muestran que la ausencia de una atención adecuada en los pacientes con hepatitis C como consecuencia de la pandemia provocará incrementos significativos en la morbimortalidad asociada y su coste35,36. Por tanto, para minimizar el impacto de la pandemia por SARS-CoV-2 y seguir en línea con los objetivos de eliminación, es necesario adoptar medidas que refuercen los programas de cribado, restablezcan la cascada de atención de las hepatitis virales y permitiendo un tratamiento temprano37–40. También es necesario enfatizar y seguir promoviendo las medidas efectivas ya existentes dirigidas a la simplificación diagnóstica, como el diagnóstico en un solo paso (DUSP) y el diagnóstico en el punto de atención (point of care [PoC]), junto con sistemas de alerta de laboratorios de microbiología, y continuar con estrategias de microeliminación dirigidas a poblaciones de riesgo o colectivos vulnerables.
En este documento se presentan una serie de recomendaciones realizadas por profesionales expertos en el diagnóstico y manejo de las hepatitis virales y avaladas por sociedades científicas, que permitan el diagnóstico integral de las hepatitis virales crónicas (B, C y D) en una única extracción analítica. Asimismo, se establecen otras recomendaciones dirigidas a profesionales, servicios y programas en salud, con el fin de prevenir infecciones, facilitar el diagnóstico precoz, garantizar el seguimiento y acceso al tratamiento, así como la difusión de la información sobre las hepatitis y, finalmente, facilitar la mejora continua de los modelos de salud.
MétodosEn la elaboración del documento de consenso, se realizó una revisión sistemática de la literatura para recopilar y sintetizar la evidencia reciente sobre el diagnóstico de las hepatitis virales (B, C y D). Además, se hizo una búsqueda en la literatura gris incluyendo guías clínicas, resúmenes de congresos, información de sistemas regionales de salud y organismos oficiales. La revisión se centró en el diagnóstico de las hepatitis virales crónicas, la simplificación del diagnóstico y el diagnóstico en el PoC.
Por otro lado, se creó un comité científico formado por cinco expertos, que se encargó de elaborar un primer documento basado en la revisión bibliográfica y se estableció un panel de expertos integrado por especialistas en aparato digestivo, enfermedades infecciosas, medicina interna, hepatología y microbiología para discutir y consensuar el documento inicial. Un total de 22 expertos revisaron el documento. El panel de expertos, a partir del documento inicial, realizó una reunión de deliberación y varias revisiones posteriores, consensuó las recomendaciones a incluir en el documento final. Estas reuniones han tenido lugar durante el primer trimestre del año 2022, revisando el documento e incluyendo las recomendaciones finales en junio del 2022.
Las recomendaciones incluidas en el consenso se basaron tanto con base en la evidencia científica disponible, como en la opinión de expertos, según su experiencia, cuando no se disponía de esa información. Además, el documento de consenso ha sido avalado por las sociedades científicas implicadas en el diagnóstico y manejo de las hepatitis virales: la AEEH, la AEHVE, el GEHEP de la SEIMC y la SEPD.
Justificación para el diagnóstico integral de las hepatitis viralesEl cribado de las infecciones por el VHB y el VHC se basa principalmente en la edad y en factores de riesgo de adquisición de la infección10–12,41–43. Sin embargo, existe diversidad de criterios sobre a quién debe ir dirigido el cribado del VHD. Las guías clínicas de la AEEH y de la Asociación Europea para el Estudio del Hígado (EASL) recomiendan la detección del VHD en todos los pacientes infectados por el VHB11,41, mientras que las recomendaciones de la Asociación Americana para el Estudio de las Enfermedades Hepáticas (AASLD), a pesar de su elevada prevalencia, dirigen su detección solo a pacientes con infección crónica por VHB que pertenecen a grupos de alto riesgo (migrantes de regiones de alta endemicidad de VHD, antecedentes de consumo de drogas por vía intravenosa o comportamiento sexual de alto riesgo y coinfección por VHC y VIH o con aminotransferasas elevadas, pero ADN del VHB bajo o indetectable10. En España, al igual que en otros países europeos, la tasa de cribado del VHD en pacientes con infección crónica por VHB ha descendido en las últimas décadas, a pesar de observarse un repunte en la prevalencia de infección por VHD a expensas fundamentalmente de la población migrante y que actualmente se sitúa en torno al 5%44–47.
La evaluación de la infección por VHC y VHD se realiza inicialmente con la detección de anticuerpos frente a estos virus y, en el caso del VHB, mediante la detección del HBsAg. En los primeros, la confirmación de la infección activa precisa de técnicas moleculares para detección de su ARN. En el caso del VHB, la presencia de HBsAg es la que determina la existencia de infección activa y se completa la evaluación con los marcadores de replicación viral determinando el antígeno HBe y el ADN del VHB. Generalmente, el diagnóstico se realiza de forma independiente para cada infección, es decir, si el sujeto es positivo en alguna de ellas, el especialista solicita la repetición de la extracción para determinar otras infecciones hepáticas virales u otros virus relacionados, haciendo que el paciente acuda de nuevo a otra extracción de sangre.
El alto grado de similitud en la epidemiología que existe entre estas infecciones virales, dado que comparten grupos de riesgo y vías de transmisión, hace que el riesgo de coinfección por VHB, VHC y VHD, incluso por VIH, en sus diferentes combinaciones sea elevado. La coinfección provoca una mayor morbimortalidad hepática y, en este sentido, simplificar el diagnóstico de las hepatitis virales sería aconsejable y estaría en línea con los objetivos marcados. Realizar un diagnóstico integral de las hepatitis virales, es decir, en una única extracción analítica, tiene numerosas ventajas. Ayuda a identificar nuevas infecciones y detectar coinfecciones siendo, además, una herramienta asistencial para disminuir los costes adicionales ocasionados por repeticiones de extracciones y visitas innecesarias48,49. Algunos estudios que evalúan el diagnóstico integral para el VHB y el VHC muestran resultados positivos en la detección y en el diagnóstico temprano, además de detectar a pacientes coinfectados con otros virus como el VIH48–52. Igualmente, dado el alto riesgo de contraer infecciones virales crónicas y la baja asistencia sanitaria de la población de riesgo o colectivos vulnerables, la realización del diagnóstico integral en los centros comunitarios ha demostrado ser viable, factible y efectiva, consiguiendo minimizar las oportunidades de pruebas pérdidas, optimizar su cobertura y mostrar resultados positivos en términos de tasas de prueba48,50,51,53,54.
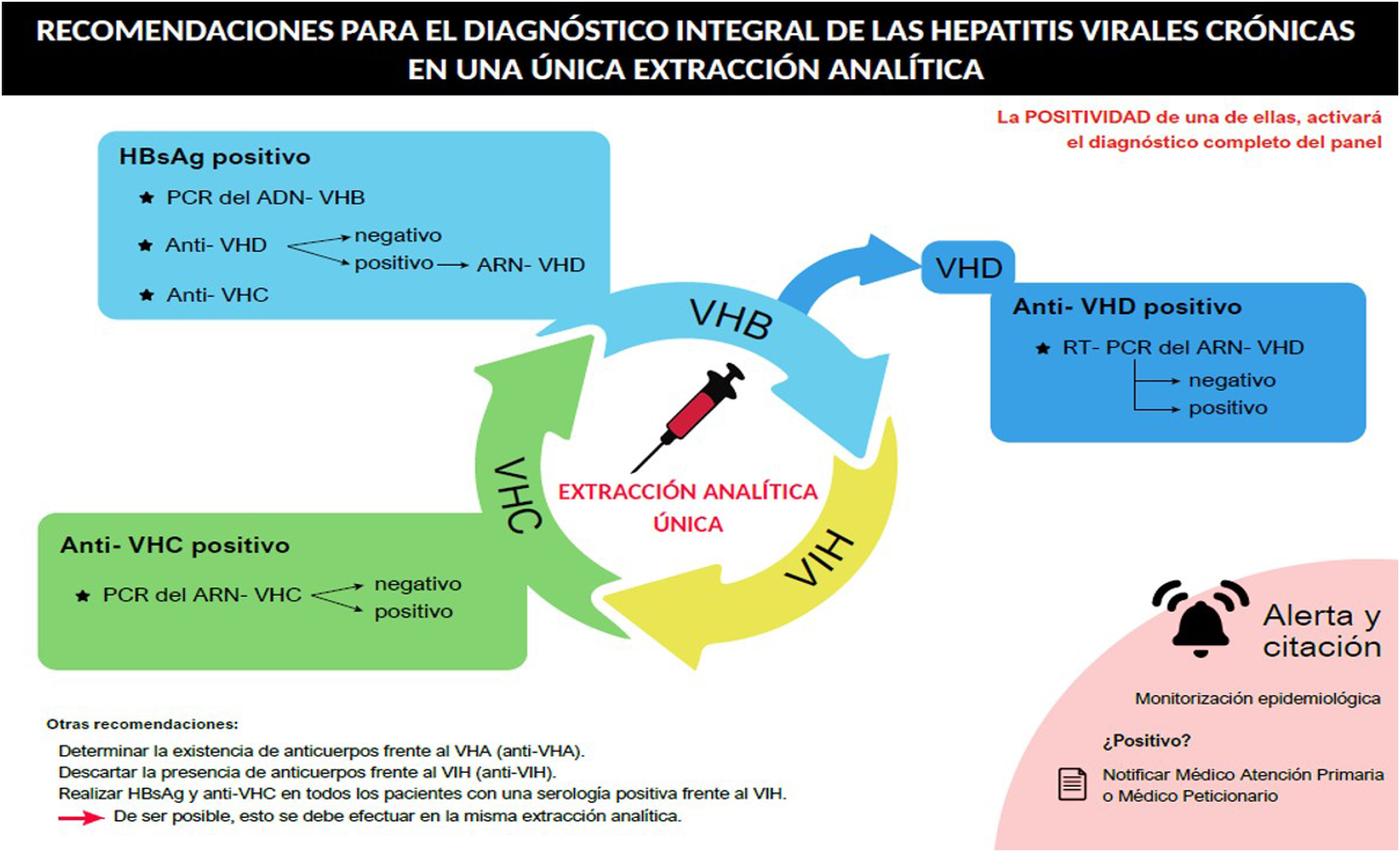
Recomendaciones para un diagnóstico integral de las hepatitis viralesEn línea con lo anterior, se realizan una serie de recomendaciones dirigidas a la realización del diagnóstico integral de las hepatitis virales crónicas (B, C y D) (tabla 1, fig. 1).
Puntos clave en el consenso para un diagnóstico integral de las hepatitis virales en una única extracción analítica
| Recomendaciones de diagnóstico integral a efectuar si es posible en la misma extracción analítica: |
| a. En todos los sujetos en los que se detecte el HBsAg, se recomienda efectuar la determinación del ADN-VHB. Además, se debe descartar las coinfecciones por VHD y b. VHC mediante la detección de anti-VHD y anti-VHC.c. En todos los pacientes en los que se detecte anti-VHD positivo, se debe determinar el ARN-VHD.d. En todos los sujetos en los que se detecte por primera vez el anti-VHC positivo se debe determinar la presencia del ARN-VHC. Además, en todos los sujetos anti-VHC positivos se debe descartar una infección por VHB mediante la determinación del HBsAg. |
| Otras recomendaciones diagnósticas: |
| a. Todos los pacientes con HBsAg positivo, independientemente de la positividad o negatividad del ADN-VHB y/o anti-VHD, así como todos los pacientes anti-VHC positivos en los que se detecte ARN-VHC, deben ser remitidos para ser evaluados por un médico experto en hepatitis virales.b. En aquellos pacientes anti-VHC positivos diagnosticados y curados con anterioridad, pero con conductas de riesgo, se debe repetir la viremia ARN-VHC de forma periódica.c. En todos los pacientes con una hepatitis viral crónica (B, C y/o D) se debe determinar la presencia de anticuerpos frente al virus de la hepatitis A de tipo IgG o totales.d. En todos los pacientes con una hepatitis viral crónica se debe descartar la existencia de una infección por el VIH.e. Y, finalmente, se debe realizar HBsAg y anti-VHC en todos los pacientes con una serología positiva frente al VIH. |
| Medidas generales: |
| a. Simplificación de la cascada del diagnóstico de los pacientes con hepatitis virales y del acceso al tratamiento.b. Se recomienda la integración de los resultados de las pruebas Point-of-Care (POC) y la supervisión por parte de los laboratorios centrales de Microbiología.c. Implementación de sistemas de alerta automatizados.d. Se recomienda la creación de sistemas de citación automatizada.a. Implementar programas de educación, prevención y difusión. |
ADN: ácido desoxirribonucleico; ARN: ácido ribonucleico; VHB: virus de la hepatitis B; VHD: virus de la hepatitis delta; VHC: virus de la hepatitis C. HBsAg: antígeno S del virus de la hepatitis B; IgG: inmunoglobulina de tipo G. VIH: virus de la inmunodeficiencia humana.
Recomendaciones para el diagnóstico integral de las hepatitis virales crónicas en una única extracción analítica.
PCR: polymerase chain reaction; RT-PCR: real-time polymerase chain reaction; HBsAg: antígeno S del virus de la hepatitis B, VHD: virus de la hepatitis delta; VHC: virus de la hepatitis C; ADN: ácido desoxirribonucleico. ARN: ácido ribonucleico. VIH: virus de la inmunodeficiencia humana.
- •
En todos los sujetos en los que se detecte por primera vez el HBsAg, se recomienda en la misma extracción analítica, el diagnóstico molecular de la infección procediendo a la determinación del ADN-VHB.
- •
Del mismo modo, se deben descartar en la misma extracción analítica, las coinfecciones por VHD y VHC, mediante la detección del anti-VHD y anti-VHC, respectivamente.
- •
Todos los pacientes con HBsAg positivo, independientemente del resultado del ADN-VHB (positivo o negativo) y/o de la presencia de algún marcador para el diagnóstico de las hepatitis C y D (anti-VHD, anti-VHC), deben ser remitidos y evaluados por un médico experto en hepatitis virales.
- •
En todos los pacientes en los que se detecte anti-VHD positivo, se debe determinar el ARN-VHD mediante técnicas moleculares.
- •
Además, en aquellos pacientes HBsAg positivos, ya diagnosticados con anterioridad y con conductas de riesgo, se debe repetir la serología anti-VHD de forma periódica.
- •
Todos los pacientes con una hepatitis D deben ser remitidos a un médico experto en hepatitis virales para su evaluación y tratamiento si procede.
- •
En todos los sujetos en los que se detecte por primera vez el anti-VHC, se debe determinar, siempre que sea posible, en la misma extracción analítica, la presencia del ARN-VHC mediante técnicas moleculares o, en caso de no ser posible, el antígeno del core del VHC (VHC-Ag).
- •
Además, en todos los sujetos anti-VHC positivos se debe descartar, en la misma extracción sanguínea, una infección por VHB mediante la determinación del HBsAg.
- •
Todos los pacientes anti-VHC positivos en los que se detecte ARN-VHC y/o antigenemia deben ser remitidos para su evaluación por un médico experto en hepatitis virales.
- •
Además, en aquellos pacientes anti-VHC positivos diagnosticados y curados con anterioridad, pero con conductas de riesgo, se debe repetir la viremia ARN-VHC de forma periódica como recomiendan las guías para detectar precozmente las reinfecciones y evitar la transmisión
Los pacientes con hepatitis virales crónicas tienen un mayor riesgo de tener otras infecciones como la infección por el virus de la hepatitis A (VHA) o por el VIH, debido a los factores de riesgo comunes de exposición1,55. La coinfección puede alterar la historia natural de cada uno de estos virus y provocar un incremento en la comorbilidad y en la mortalidad asociada55. La hepatitis A es una infección aguda y las personas que la padecen generalmente se recuperan sin necesidad de tratamiento. Aunque en España era una infección casi inexistente, a partir del 2016 ha habido brotes importantes en algunas regiones de nuestro país motivados por las prácticas sexuales de riesgo entre HSH56–59 o entre migrantes de países de la Unión Europea con baja tasa de vacunación60,61. Su diagnóstico permite identificar a las personas con inmunidad, es decir, que han padecido la infección y tienen anticuerpos, o por el contrario, que no la han sufrido y podrían ser candidatas a vacunación para evitar la infección10,62. Por otra parte, un número considerable de personas con hepatitis virales también padecen otras infecciones como el VIH. Un estudio mostró que la coinfección por VHC y VIH en pacientes con VHB crónica se produjo en 6,3 y 3,1%, respectivamente63. La coinfección es muy común, sobre todo, en personas con antecedentes de exposición o comportamientos de alto riesgo como son las personas que se inyectan drogas, los sujetos condenados a penas privativas y no privativas de libertad, los HSH y los trabajadores sexuales, dado que son virus que comparten vías de transmisión. Se estima que en el mundo alrededor de 2,3 millones de personas que padecen VIH están afectados por el VHC y 2,7 millones por el VHB64. En España, la coinfección por VIH/VHB se ha mantenido estable durante una década, situándose en 3,2% en el 2018, además, 26,3% de los coinfectados presentaban anticuerpos contra el VHD65. Por otro lado, la coinfección VIH/VHC ha ido disminuyendo en España, situándose en 2,2% en 201966. Las guías clínicas sobre el manejo de los pacientes con VIH recomiendan cribado sistemático de las infecciones por los virus de la hepatitis B y C67.
La integración del diagnóstico del VHA y VIH al realizar una prueba para cualquier otra hepatitis viral ayudaría a la detección de casos de coinfección y sería una oportunidad para realizar la prueba a los colectivos con dificultades de asistir a la atención sanitaria dada su aceptabilidad y viabilidad, sobre todo si se realiza a través de prueba rápida en los centros donde acuden, como por ejemplo, los centros de reducción de daños68.
Recomendaciones:
- -
En todos los pacientes con una hepatitis viral crónica (B, C y/o D) se debe determinar la presencia de anticuerpos frente al virus de la hepatitis A de tipo IgG o totales.
- -
Asimismo, en todos los pacientes con una hepatitis viral crónica, se debe descartar la existencia de una infección por el VIH.
- -
Y, finalmente, se debe realizar HBsAg y anti-VHC en todos los pacientes con una serología positiva frente al VIH.
- -
Estas determinaciones se deben efectuar, cuando sea posible, en la misma extracción analítica que el resto de los marcadores virales.
La prevalencia de las hepatitis virales, en concreto de la hepatitis C, ha descendido notablemente tras la adopción de acciones dirigidas a su eliminación24 pero, todavía hay poblaciones infradiagnosticadas, con prevalencia alta, como son los grupos de riesgo o los colectivos vulnerables, en las que la detección y el posterior acceso a tratamiento sigue siendo un desafío7.
El diagnóstico tradicional de las infecciones en nuestro país requiere de varias visitas al especialista. Primero se realiza una serología y si es positiva se analiza la carga viral suponiendo una espera entre pruebas que puede generar un retraso en el diagnóstico de hasta 12 semanas69. Esta estrategia conlleva ineficiencias en el manejo de las infecciones que implican pérdidas en el seguimiento de los pacientes suponiendo una importante barrera para la eliminación. Es necesario cambiar el abordaje de las hepatitis virales para conseguir mejoras en la vinculación con la atención sanitaria y reducir la demora en el acceso al tratamiento70. Estrategias enfocadas a la simplificación diagnóstica como el DUSP, es decir, determinación de anticuerpos frente al VHC y, en caso de que sean positivos, determinación del ARN-VHC en la misma muestra, son avaladas por sociedades científicas y organismos nacionales e internacionales71 y han mostrado su eficiencia en el cribado, en particular en la hepatitis C72–75. Comparado con los métodos tradicionales, el DUSP incrementa la efectividad diagnóstica reduciendo los casos de infradiagnóstico cerca de 56% (de 74,4 a 20,2%), en todos los entornos, especialmente en los centros de usuarios de drogas y en atención primaria76, evita pérdidas en la derivación ocasionadas por las demoras y permite que un mayor número de pacientes sean evaluados para recibir tratamiento70,75,76–79. Un estudio realizado en España mostró que la proporción de pacientes derivados al especialista para la evaluación de inicio de tratamiento aumentó desde de 55 a 83% al implantarse el DUSP72. Otro estudio que incluyó poblaciones de difícil acceso, como son los usuarios de drogas, la implementación del DUSP supuso un incremento en los diagnósticos de 20,8 y de 32,7% en el acceso a tratamiento77. Además, la adopción de estrategias de simplificación diagnóstica optimiza los recursos disponibles y el tiempo implicando una reducción de la sobrecarga de los servicios de atención sanitaria72.
Por otro lado, la estrategia del DUSP debería ser complementada con la posibilidad de tener acceso a los sistemas de gestión informáticos, que sirvan de conexión entre los centros externos, atención primaria y especializada y conseguir mejoras en los programas de detección y seguimiento posterior hasta el inicio de tratamiento. La comunicación entre centros mediante la introducción de una cita automática ante un caso positivo e incluso una llamada posterior después de realizar un test reflejo podría incrementar el acceso a tratamiento hasta en 45,2%78. Durante estos últimos años se han realizado grandes esfuerzos por mejorar las estrategias diagnósticas en los hospitales españoles siendo 89% los hospitales que tienen implantado el DUSP en el 2019, frente a 30% en 2017. A pesar de ello, todavía sigue habiendo un porcentaje de hospitales que utilizan el método tradicional teniendo medios y capacidad para realizarlo69,73, lo cual es un motivo para seguir insistiendo en los beneficios que supone y promover su utilización entre los profesionales sanitarios con el objetivo de que las barreras para el diagnóstico disminuyan. Por ello, se recomienda:
- -
La simplificación de la cascada del diagnóstico de los pacientes con hepatitis virales y el acceso al tratamiento.
- -
El diagnóstico y el seguimiento del paciente, en la mayor parte de los casos, se deberá reducir al menor número de consultas posibles hasta el inicio del tratamiento.
- -
El seguimiento posterior dependerá de las características del paciente y del tipo de enfermedad que padece.
Hay ciertos colectivos vulnerables con prevalencias altas donde se concentra la mayor parte de los nuevos diagnósticos de hepatitis virales que, por sus características, no acuden de forma habitual a los servicios sanitarios. En estos colectivos existe un alto riesgo de pérdida en todas las etapas de la cascada de atención80 y la realización de la prueba mediante la venopunción puede suponer un rechazo de acceso al cribado. El uso de pruebas rápidas y de sangre seca permiten un diagnóstico descentralizado81, es decir, un diagnóstico serológico y virológico de las infecciones en el PoC siendo una forma de acercar la prueba diagnóstica a las poblaciones de difícil acceso sin necesidad de que el paciente se mueva de su entorno, en lo que se llaman test diagnósticos descentralizados82. Estas pruebas han demostrado ser efectivas y eficientes para facilitar el acceso a la detección en entornos comunitarios, incrementar la notificación de casos, reducir significativamente el tiempo hasta el diagnóstico, aumentar los inicios de tratamiento y reducir costes sanitarios75,83–91, aun en la época de COVID-1935, además de mostrar una precisión diagnóstica para evaluar las hepatitis virales75,90,92,93. De igual modo, su uso es viable y factible, incluso para el VIH, fuera del sistema de atención médica habitual y tienen una excelente aceptabilidad entre los usuarios, principalmente por evitar desplazamientos y por la preferencia de ofrecer los resultados en el mismo día o en un periodo de tiempo reducido90,94–98. Este tipo de pruebas junto con estrategias «test and treat» también pueden ser utilizadas en entornos penitenciarios99, donde los tiempos en la cascada de atención llegan a reducirse en cuatro días el cribado (seis vs. dos días), 11 días la evaluación (14 vs. tres días) y 35 días el acceso a tratamiento (36 vs. un día) frente al manejo clínico habitual100.
Las pruebas en el PoC13,71 posibilitan la simplificación diagnóstica permitiendo realizar el cribado en entornos fuera del ámbito hospitalario, donde no se dispone de accesos a las pruebas de venopunción75 y avanzar hacia una atención descentralizada, reduciendo las pérdidas en los centros de conductas adictivas o reducción de daños75,87,90,101,102. Este tipo de técnicas no precisa personal sanitario, pero sí una formación previa que facilite la aceptación por el usuario51. Los resultados de estas técnicas deben incorporarse al registro de los laboratorios de microbiología y a la historia clínica electrónica.
Recomendaciones:
- -
Se recomienda la integración de los resultados de las pruebas PoC y su supervisión por parte de los laboratorios centrales de microbiología, así como la inclusión de los resultados en la historia clínica del paciente.
- -
Con el fin de acceder a pacientes que no acuden a la consulta médica de forma habitual (por ejemplo, personas en los programas de reducción de daños), es necesario la integración de programas de cribado para la detección de pacientes con infección activa, acompañada de una actuación posterior para el seguimiento y tratamiento, si fuera necesario.
Aunque el diagnóstico de la infección se ha incrementado en los últimos años, todavía existen numerosas personas infectadas y no detectadas por el sistema sanitario. Configurar sistemas de alerta incorporados en la historia clínica electrónica del paciente a partir de datos clínicos relacionados con el riesgo de infección, ayudaría a identificar y a notificar al especialista de la necesidad de realizar una serología ante cualquier posible hepatitis viral, favoreciendo así el diagnóstico precoz103. Estas alertas son útiles en atención primaria basadas en la edad como factor de riesgo104–107, llegando a incrementarse entre cinco y 15,8 veces respecto a la práctica clínica habitual106,108. Igualmente, cuando la alerta es introducida en atención hospitalaria en población nacida entre 1945 y 1965, el diagnóstico se incrementó 342% en un año, así como el enlace con la atención e inicio de tratamiento (de 67 a 92%, de 32 a 18%, respectivamente), disminuyendo notablemente las pérdidas de seguimiento107. Asimismo, existe una brecha entre el diagnóstico y la vinculación con la atención de las hepatitis virales, existiendo pacientes con evaluaciones incompletas en el sistema. Estas pérdidas, en su mayoría, son causadas cuando la petición de la prueba se realiza desde atención primaria109. Existe un porcentaje variable de diagnósticos incompletos: alrededor de 64%110 y entre 14-58%109–111 de pacientes tienen una determinación de HBsAg o anti-VHC. Con un resultado positivo, nunca se completó el estudio con técnicas moleculares, o no llegaron a consulta.
El uso de alertas electrónicas es factible y una oportunidad de mejora para potenciar la detección de pacientes infectados con hepatitis virales y su vinculación con la atención y el tratamiento112 y es una estrategia coste-efectiva para el sistema sanitario113.
Recomendaciones:
- -
Informar al médico de atención primaria y/o al especialista de la existencia de una hepatitis viral, a través de una alerta electrónica.
- -
Se recomienda la creación de sistemas de citación automatizada del paciente con el especialista. De forma alternativa y, si esto no fuera posible, establecer un sistema de alerta al servicio encargado de gestionar la cita.
Las hepatitis virales crónicas son enfermedades que no suelen presentar síntomas hasta estadios avanzados. Por ello, es fundamental la formación y sensibilización de los profesionales sanitarios, especialmente en atención primaria, sobre la importancia de la detección de casos no diagnosticados en población general, así como de la presencia de factores de riesgo13. Asimismo, la descentralización del proceso de cribado y tratamiento genera también la necesidad de formar al personal no sanitario para reducir el estigma e incrementar la aceptación del cribado50. Por otra parte, la educación de las poblaciones de riesgo y colectivos vulnerables orientada a informar sobre los factores de riesgo, las consecuencias de la enfermedad hepática y las ventajas del tratamiento, mejoraría la prevención, la detección de casos y la vinculación con la atención sanitaria114. De esta forma, un estudio mostró que la educación unida a herramientas como las alertas electrónicas puede llegar a aumentar las tasas de detección aproximadamente 10 veces106. De igual forma, la sociedad civil juega un papel fundamental en la eliminación de las hepatitis virales115, siendo clave en el acercamiento a poblaciones vulnerables. Es necesario involucrarla para promover planes de actuación sobre la prevención, diagnóstico y tratamiento y hacerla partícipe de las intervenciones de salud pública en los distintos ámbitos116. Así, el diseño de campañas dirigidas a la sociedad civil ayudaría a concienciar sobre la importancia de hepatitis virales, además de reducir el estigma de la enfermedad.
Las recomendaciones en este sentido van dirigidas a:
- -
Se recomienda incrementar la formación y la concienciación de todos los profesionales sanitarios, y en especial de los profesionales de atención primaria, sobre la importancia de realizar la búsqueda activa de pacientes para conseguir los objetivos de control y eliminación de las hepatitis B, C y D.
- -
Intensificar el papel de las sociedades científicas, a través de campañas de concienciación y formación dirigidas a profesionales sanitarios y pacientes.
- -
Ampliar la información, de forma general, a la sociedad civil sobre la importancia de realizar una prueba para detectar hepatitis virales, a través de campañas de concienciación avaladas por las sociedades científicas.
El diagnóstico de la infección por los virus de las hepatitis B, C y D sigue siendo un desafío de salud pública. Todavía hay un elevado número de personas que desconocen su estado de infección. El establecimiento del diagnóstico y la vinculación al tratamiento son claves para lograr el objetivo de la OMS para 2030 a nivel mundial. El diagnóstico integral de las hepatitis virales (B, C y D) en una única extracción analítica permite un diagnóstico más rápido, disminuye el número de visitas al centro médico, evita pérdidas de seguimiento, y facilita el acceso a un tratamiento eficaz. Asimismo, la descentralización del diagnóstico en el PoC permite a los colectivos más vulnerables aumentar el acceso al diagnóstico y la derivación a la atención médica y el tratamiento. Por último, es esencial la colaboración entre los diferentes actores implicados en el proceso de búsqueda, diagnóstico y tratamiento de personas con hepatitis virales, y especial, los relacionados con las poblaciones de riesgo y los colectivos vulnerables, si queremos conseguir su eliminación en un futuro cercano.
FinanciaciónEl presente trabajo ha sido financiado por Gilead Sciences España (financiación sin conflicto de intereses y no condicionada al diseño del estudio, a la recolección, el análisis y a la interpretación de los datos, a la redacción del artículo o la decisión de enviar el artículo para su publicación).
Conflicto de interesesJavier Crespo: consultor y/o ponente y/o participó en ensayos clínicos patrocinados y/o recibió subvenciones y apoyo a la investigación de Gilead Sciences, AbbVie, MSD, Shionogi, Intercept Pharmaceuticals, Janssen Pharmaceuticals Inc, Celgene y Alexion (todos fuera del trabajo presentado).
Joaquín Cabezas: recibe subvenciones de Gilead y Abbvie; Conferencias: Gilead y Abbvie.
Antonio Aguilera: declara que no tiene conflicto de intereses.
María Buti: consultora y ponente de Gilead y Abbvie.
Federico García: declara que no tiene conflicto de intereses.
Javier García-Samaniego: conferencias y consultor: Abbvie, Gilead.
Manuel Hernández-Guerra: ha recibido becas de investigación de Abbvie y Gilead.
Francisco Jorquera: declara honorarios personales de AbbVie y Gilead Sciences, y honorarios de asesoramiento y personales de Intercept.
Elisa Martró: recibió honorarios por conferencias de Gilead Sciences, Abbvie y Cepheid, y becas de investigación de Gilead Sciences.
Juan Antonio Pineda: declara que no tiene conflicto de intereses.
Manuel Rodríguez: Gilead (asesoría y conferencias) y AbbVie (conferencias).
Miguel Ángel Serra: declara que no tiene conflicto de intereses.
Raquel Domínguez-Hernández es empleada de Pharmacoeconomics & Outcomes Research Iberia, una consultora especializada en la evaluación económica de intervenciones sanitarias que ha recibido financiación incondicional de la Fundación Española del Aparato Digestivo (FEAD).
Miguel Ángel Casado es empleado de Pharmacoeconomics & Outcomes Research Iberia, una consultora especializada en la evaluación económica de intervenciones sanitarias que ha recibido financiación incondicional de la Fundación Española del Aparato Digestivo (FEAD).
José Luis Calleja: consultor y conferenciantes: Gilead Sciences, Abbvie, Roche, Intercept, MSD.
Coordinador científico: Javier Crespo.
Comité científico: José Luis Calleja, Javier Crespo, Federico García, Francisco Jorquera y Joaquín Cabezas (secretario).
Panel de expertos: Antonio Aguilera, Marina Berenguer, María Buti, Joaquín Cabezas, José Luis Calleja, Javier Crespo, Xavier Forns, Federico García, Javier García-Samaniego, Manuel Hernández Guerra, Francisco Jorquera, Sabela Lens, Elisa Martró, Juan Antonio Pineda, Martín Prieto, Francisco Rodríguez-Frías, Manuel Rodríguez, Miguel Ángel Serra, Juan Turnes.
Colaboradores: Raquel Domínguez-Hernández y Miguel Ángel Casado.
Esta publicación ha sido avalada o patrocinada por la Asociación Española para el Estudio del Hígado (AEEH), la Alianza para la Eliminación de las Hepatitis Víricas en España (AEHVE), el Grupo de Estudio de las Hepatitis Víricas (GEHEP) de la Sociedad Española de Enfermedades Infecciones y Microbiología Clínica (SEIMC) y la Sociedad Española de Patología Digestiva (SEPD). Las opiniones expresadas por los autores no reflejan necesariamente la posición oficial de la SEIMC.