Los ensayos clínicos aleatorizados proporcionan la mejor evidencia científica de la eficacia de los fármacos biológicos en la enfermedad inflamatoria intestinal (EII). Sin embargo, los resultados pueden no ser reproducibles en la práctica clínica. Los objetivos de este estudio son analizar el porcentaje de pacientes con EII tratados con fármacos biológicos que habrían podido ser elegidos para un ensayo clínico aleatorizado y comparar la eficacia teórica de los fármacos biológicos con su efectividad en la práctica clínica.
MétodosRealizamos un estudio retrospectivo multicéntrico en 375 pacientes con EII tratados con anti-TNF con un seguimiento de un año. Los criterios de elegibilidad para la condición de ensayo clínico fueron extraídos de los estudios pivotales ACCENT, SONIC, ACT, CLASSIC y CHARM. Los pacientes elegibles fueron incluidos en un segundo análisis para comparar los resultados en la práctica clínica con los obtenidos tras realizar una estimación teórica si el paciente hubiese sido incluido en un estudio pivotal.
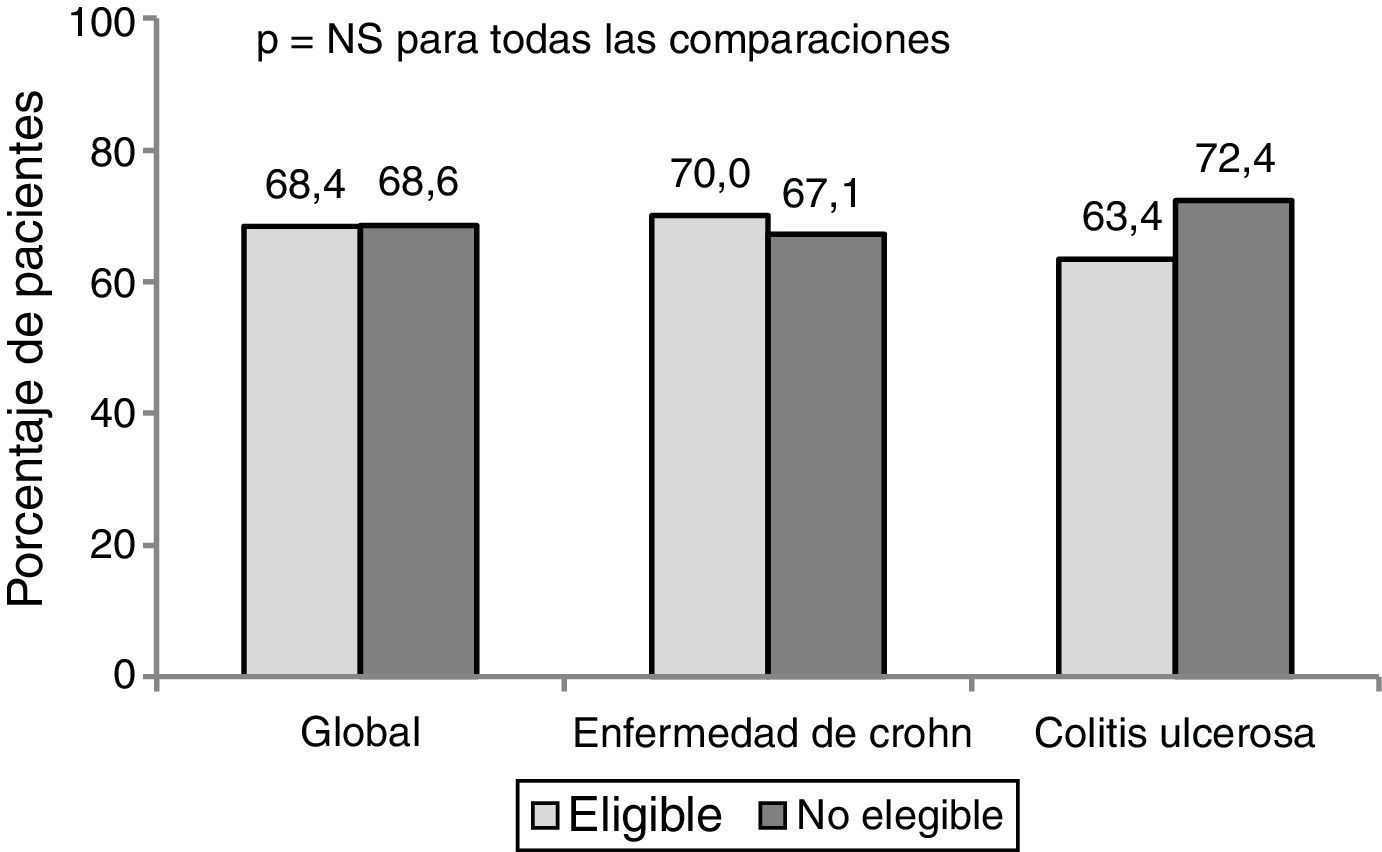
ResultadosSolo el 45,6% de los 375 pacientes cumplían los criterios de selección para un estudio pivotal. El beneficio clínico al año fue similar entre los pacientes elegibles y no elegibles (68,4% vs 68,6%). El beneficio clínico en los pacientes elegibles fue mayor en la práctica clínica que en la condición hipotética de un ensayo clínico (68,4% vs 44,4%, p<0,001).
ConclusiónMás de la mitad de los pacientes con EII tratados con fármacos biológicos no estarían representados en los ensayos pivotales. La efectividad de los fármacos anti-TNF en la práctica clínica es superior a su eficacia teórica.
Randomized controlled trials provide the best scientific evidence for the efficacy of biological drugs in inflammatory bowel disease (IBD). However, findings obtained from these trials might not be reproducible in clinical practice. This study aimed to estimate the percentage of patients with IBD treated with biologics who would have been eligible for randomized controlled trials, and to compare the theoretical efficacy of biological drugs with their effectiveness in clinical practice.
MethodsWe performed a retrospective multicenter study in 375 patients with IBD treated with anti-TNF agents and followed-up for 1 year. The eligibility criteria for the trial were taken from the ACCENT, SONIC, ACT, CLASSIC and CHARM trials. Eligible patients were included in a second analysis to compare results in clinical practice versus those hypothetically obtained if the patient had been included in a trial.
ResultsOnly 45.6% of 375 patients would have been eligible for pivotal trials. One-year clinical benefit (remission or response) was similar for eligible and non-eligible cohorts (68.4% vs. 68.6%, P=.608). The clinical benefit was greater for current clinical practice than for a hypothetical trial situation (68.4% vs. 44.4%, P<.001) in eligible patients.
ConclusionMore than half of patients with IBD treated with biologic drugs would not be represented in pivotal trials. The effectiveness of anti-TNF drugs in clinical practice exceeds their theoretical efficacy.
La enfermedad de Crohn (EC) y la colitis ulcerosa (CU) son enfermedades autoinmunes inflamatorias crónicas del tracto gastrointestinal1,2. El tratamiento convencional incluye el uso de corticoides e inmunosupresores. La incorporación en la última década de los anticuerpos anti-factor de necrosis tumoral alfa (anti-TNF) ha transformado el tratamiento y el pronóstico de estos pacientes, con un buen perfil de seguridad3. Su eficacia se apoya en varios ensayos clínicos aleatorizados y controlados con placebo4–6, lo que permitió la aprobación de estos fármacos por las agencias reguladoras.
En general, se acepta que los ensayos clínicos aleatorizados (ECA) son la mejor aproximación científica para estudiar el efecto de un fármaco o una estrategia terapéutica. Los ECA utilizan criterios de selección estrictos y un protocolo de estudio definido para maximizar la validez interna7. Además, se extraen la mayoría de las variables que podrían condicionar o interferir en el resultado, con el objetivo de evaluar el efecto atribuible al fármaco en estudio y eliminar la mayoría de sesgos potenciales. De este modo, los ECA evalúan la eficacia de un fármaco en una población seleccionada y bajo condiciones controladas. Sin embargo, la selección de los pacientes puede limitar la validez externa o la representatividad de los resultados a toda la población de pacientes subsidiarios de tratamiento, y los resultados deben ser cuidadosamente extrapolados a la práctica clínica (PC).
Por el contrario, los estudios observacionales evalúan la efectividad de un fármaco en condiciones reales de PC, pudiendo aparecer variables y sesgos durante el seguimiento que influyan en el resultado final. Las tasas de efectividad de los estudios observacionales realizados en enfermedad inflamatoria intestinal (EII) con fármacos biológicos son superiores a las de eficacia demostradas en los ECA. Por ejemplo, las tasas de respuesta mantenida al año en los respondedores primarios con infliximab y adalimumab fueron del 39% y del 43%, respectivamente, en los estudios ACCENT 14 y CHARM5. Estos resultados fueron inferiores a los obtenidos en estudios observacionales, por encima del 60%, para ambos anti-TNF8,9.
El presente trabajo (estudio EFIFECT) consiste en un ejercicio teórico para evaluar el grado de representatividad de los pacientes con EII tratados con anti-TNF en la PC en los ECA, y analizar si hay discrepancia con estos tratamientos entre la efectividad y la eficacia teórica.
Material y métodosPoblación a estudio y datos recogidosRealizamos un estudio observacional y retrospectivo de pacientes con EII tratados con fármacos anti-TNF en PC en 5 hospitales terciarios españoles. Se realizó una selección aleatorizada de las bases de datos electrónicas (un caso cada 4 pacientes adultos con EII tratados con fármacos anti-TNF) con el fin de obtener una muestra representativa a través del tiempo. Todos los pacientes seleccionados fueron seguidos durante al menos un año después de comenzar la terapia anti-TNF.
Se recogieron datos demográficos, fenotipo, localización de la enfermedad, medicación activa o pasada y antecedentes de cirugía. También se incluyó la indicación del fármaco biológico, la actividad al inicio del tratamiento y la respuesta terapéutica al año. Los datos fueron obtenidos de las historias clínicas.
El estudio fue aprobado por el comité ético de investigación de las Islas Baleares en octubre de 2012 (IB 1947/12 EPA).
ObjetivosParte 1. Analizar el porcentaje de pacientes con EII tratados con un fármaco biológico en PC que hubiesen sido elegibles para un ECA pivotal e investigar las causas de no elegibilidad.
Parte 2. Evaluar el porcentaje de pacientes elegibles que alcanzaron remisión o respuesta en PC al año de tratamiento, y compararlo con los resultados en condiciones hipotéticas de un ECA (estimación teórica). Describir los factores que explican la discrepancia entre la eficacia y la efectividad.
Definiciones y criterios de ensayo clínico aleatorizadoCriterios de ECA: seleccionamos los criterios de inclusión y exclusión de los manuscritos publicados de los estudios ACCENT 14, ACCENT 210 y SONIC11 para infliximab en EC; CLASSIC 112 y CHARM5 para adalimumab en EC y ACT 1 y ACT 26 para infliximab en CU. Los pacientes que cumplieron los criterios de inclusión y exclusión de al menos uno de los 6 ensayos pivotales se consideraron como elegibles para un ECA.
La remisión, la respuesta y el fracaso se evaluaron con el criterio del médico responsable, aunque siempre que fue posible extraer los datos de la historia clínica se apoyó en el índice de Harvey-Bradshow13 para la EC y en el índice parcial de la Clínica Mayo6 para la CU. La respuesta clínica se evaluó en la semana 52 en los pacientes que continuaron con anti-TNF o en la última visita, si se interrumpió el tratamiento.
Los pacientes elegibles fueron reevaluados en condiciones hipotéticas de ECA. Los criterios de evaluación de los ECA fueron extraídos de los diferentes estudios4–6,10–12. Cualquier violación del protocolo, como un nuevo ciclo de esteroides, la iniciación de un inmunosupresor o de terapia tópica, la intensificación de un anti-TNF, el embarazo o una infección grave fue considerado como un fracaso.
La intensificación del fármaco biológico se definió como el aumento de la dosis o de la frecuencia del fármaco biológico por indicación médica.
Análisis estadísticoSe ha realizado un análisis descriptivo de los resultados. Las variables cualitativas se han descrito en frecuencias y porcentajes con sus intervalos de confianza del 95%. Las variables continuas se describen en medias o medianas con su correspondiente desviación estándar o el intervalo intercuartílico. Se utilizó la prueba de la Chi-cuadrado y el test de Fisher para comparar las variables categóricas y la «t» de Student y el test de Mann-Whitney para las variables continuas con valores que no sigan una distribución normal. Se consideró que una diferencia era estadísticamente significativa cuando el valor de p fue inferior a 0,05. El tamaño de la muestra se calculó en 350 pacientes para poder detectar una diferencia del 15% entre el resultado clínico al año con el tratamiento anti-TNF en condiciones de PC y en la hipotética situación de ECA.
ResultadosParte 1. Eligibilidad para un ensayo clínico aleatorizadoSe incluyeron 365 pacientes con EII (276 EC y 99 CU) que habían recibido tratamiento con infliximab o adalimumab por indicación médica en PC real y que tenían un seguimiento de al menos un año.
Ciento setenta y un pacientes (45,6%) cumplían los criterios de selección de al menos uno de los 6 ECA. Los porcentajes de elegibilidad para la EC y la CU en los ECA fue de un 47,1% y un 41,4%, respectivamente.
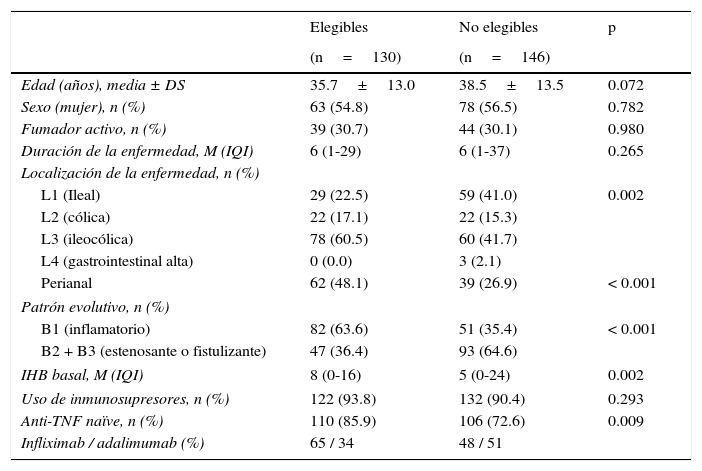
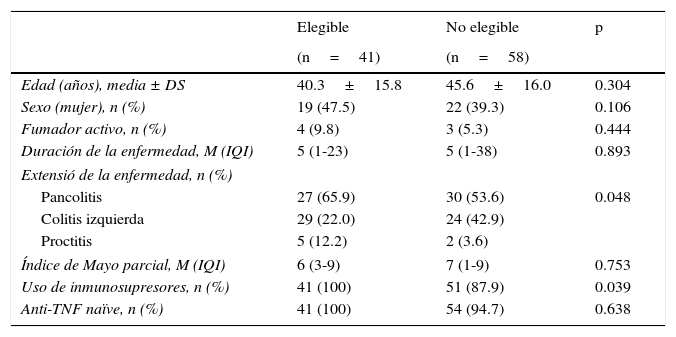
En la EC las poblaciones de pacientes elegibles y no elegibles no presentaron diferencias en la edad, el sexo, el consumo de tabaco, la duración de la enfermedad ni en el uso de inmunosupresores (tabla 1). Sin embargo, la localización ileocolónica, el patrón no obstructivo-no fistulizante, la enfermedad perianal y el porcentaje de pacientes naïve a biológicos fueron más frecuentes en el grupo de pacientes elegibles. En la CU solo hubo diferencias en la extensión de la enfermedad y en el uso de inmunosupresores (tabla 2).
Características basales de los pacientes con enfermedad de Crohn
| Elegibles | No elegibles | p | |
|---|---|---|---|
| (n=130) | (n=146) | ||
| Edad (años), media ± DS | 35.7±13.0 | 38.5±13.5 | 0.072 |
| Sexo (mujer), n (%) | 63 (54.8) | 78 (56.5) | 0.782 |
| Fumador activo, n (%) | 39 (30.7) | 44 (30.1) | 0.980 |
| Duración de la enfermedad, M (IQI) | 6 (1-29) | 6 (1-37) | 0.265 |
| Localización de la enfermedad, n (%) | |||
| L1 (Ileal) | 29 (22.5) | 59 (41.0) | 0.002 |
| L2 (cólica) | 22 (17.1) | 22 (15.3) | |
| L3 (ileocólica) | 78 (60.5) | 60 (41.7) | |
| L4 (gastrointestinal alta) | 0 (0.0) | 3 (2.1) | |
| Perianal | 62 (48.1) | 39 (26.9) | < 0.001 |
| Patrón evolutivo, n (%) | |||
| B1 (inflamatorio) | 82 (63.6) | 51 (35.4) | < 0.001 |
| B2 + B3 (estenosante o fistulizante) | 47 (36.4) | 93 (64.6) | |
| IHB basal, M (IQI) | 8 (0-16) | 5 (0-24) | 0.002 |
| Uso de inmunosupresores, n (%) | 122 (93.8) | 132 (90.4) | 0.293 |
| Anti-TNF naïve, n (%) | 110 (85.9) | 106 (72.6) | 0.009 |
| Infliximab / adalimumab (%) | 65 / 34 | 48 / 51 | |
DS: desviación estándar;IHB: índice de Harvey-Bradshaw; IQI: intervalo interquartil; M: mediana.
Características basales de los pacientes con colitis ulcerosa
| Elegible | No elegible | p | |
|---|---|---|---|
| (n=41) | (n=58) | ||
| Edad (años), media ± DS | 40.3±15.8 | 45.6±16.0 | 0.304 |
| Sexo (mujer), n (%) | 19 (47.5) | 22 (39.3) | 0.106 |
| Fumador activo, n (%) | 4 (9.8) | 3 (5.3) | 0.444 |
| Duración de la enfermedad, M (IQI) | 5 (1-23) | 5 (1-38) | 0.893 |
| Extensió de la enfermedad, n (%) | |||
| Pancolitis | 27 (65.9) | 30 (53.6) | 0.048 |
| Colitis izquierda | 29 (22.0) | 24 (42.9) | |
| Proctitis | 5 (12.2) | 2 (3.6) | |
| Índice de Mayo parcial, M (IQI) | 6 (3-9) | 7 (1-9) | 0.753 |
| Uso de inmunosupresores, n (%) | 41 (100) | 51 (87.9) | 0.039 |
| Anti-TNF naïve, n (%) | 41 (100) | 54 (94.7) | 0.638 |
DS: desviación estándar; IQI: intervalo intercuartílico; M: mediana.
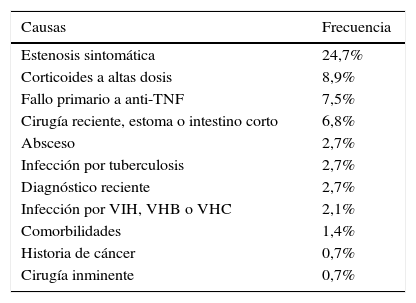
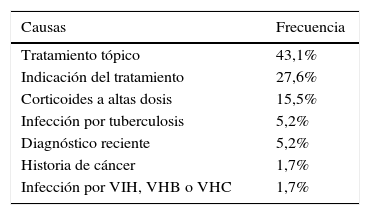
La causa más frecuente de no elegibilidad fue la indicación del fármaco por un motivo diferente a un brote moderado-grave o a una enfermedad perianal. En este grupo se incluyeron pacientes con actividad leve o sin actividad clínica, en los que la indicación de biológico fue la prevención de la recurrencia o la corticodependencia, entre otros. Las estenosis sintomáticas en la EC y el uso de fármacos tópicos en la CU fueron las siguientes causas de no elegibilidad (tablas 3 y 4).
Causas de no elegibilidad para un ECA en la enfermedad de Crohn
| Causas | Frecuencia |
|---|---|
| Estenosis sintomática | 24,7% |
| Corticoides a altas dosis | 8,9% |
| Fallo primario a anti-TNF | 7,5% |
| Cirugía reciente, estoma o intestino corto | 6,8% |
| Absceso | 2,7% |
| Infección por tuberculosis | 2,7% |
| Diagnóstico reciente | 2,7% |
| Infección por VIH, VHB o VHC | 2,1% |
| Comorbilidades | 1,4% |
| Historia de cáncer | 0,7% |
| Cirugía inminente | 0,7% |
Anti-TNF: anti-factor de necrosis tumoral; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
Causas de no elegibilidad para un ECA en la colitis ulcerosa
| Causas | Frecuencia |
|---|---|
| Tratamiento tópico | 43,1% |
| Indicación del tratamiento | 27,6% |
| Corticoides a altas dosis | 15,5% |
| Infección por tuberculosis | 5,2% |
| Diagnóstico reciente | 5,2% |
| Historia de cáncer | 1,7% |
| Infección por VIH, VHB o VHC | 1,7% |
VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
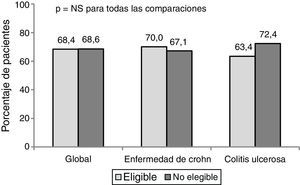
El porcentaje de respuesta al año de tratamiento en condiciones de PC fue de un 68,4%. No hubo diferencias significativas en la respuesta clínica (en global, EC y CU) entre los pacientes elegibles y no elegibles para un ECA (fig. 1).
El porcentaje de remisión global fue de un 55,3%. Los pacientes no elegibles presentaron mejores porcentajes de remisión que los elegibles (57,5% vs a 50,8% en la EC y 63,8% vs 51,2% en la CU), pero estos resultados no fueron estadísticamente significativos.
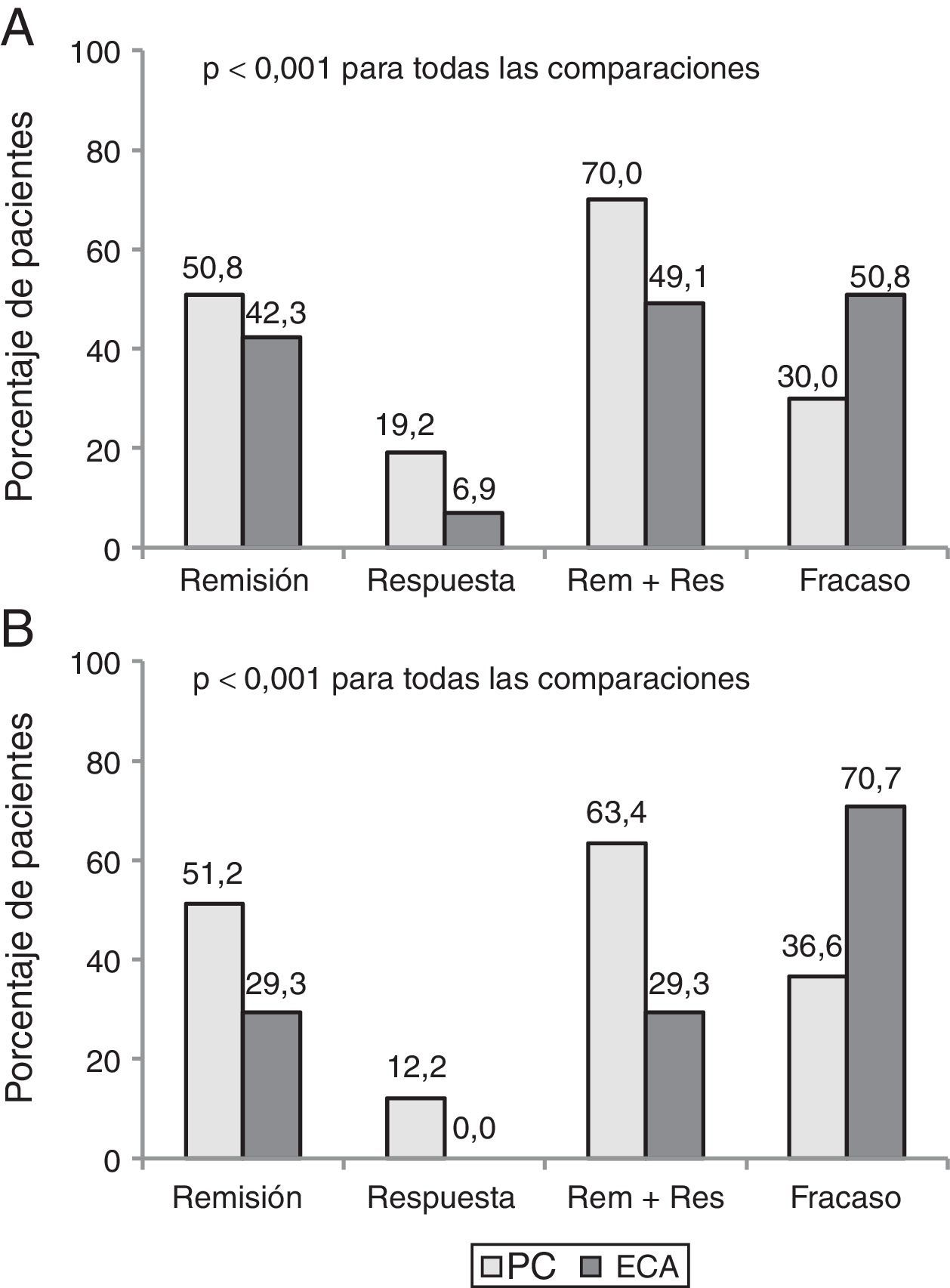
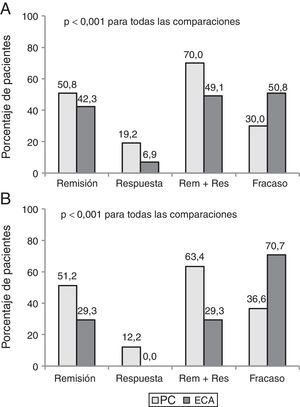
Parte 2. Discrepancia entre eficacia y efectividadCiento setenta y un pacientes que cumplían criterios de elegibilidad (130 EC y 41 CU) fueron incluidos. El beneficio clínico al año fue mayor en PC que en la evaluación teórica de un ECA (68,4% vs. 44,4%, p<0,001). Hasta el 35% de los pacientes con beneficio clínico en la PC habrían sido considerados como fracaso si hubieran sido incluidos en un ECA.
La tasa de pacientes con remisión clínica después de un año de seguimiento fue de 50,9% en PC vs 39,2%, utilizando los criterios de evaluación de un ensayo pivotal (p<0,001). La figura 2 muestra los resultados clínicos en pacientes con EC y CU con ambos criterios de evaluación.
Los motivos más frecuentes de discrepancia entre la PC y la evaluación por ECA fueron la necesidad de intensificación (75,6%) y el tratamiento con un nuevo ciclo de corticoides (12,2%). Otras causas menos frecuentes fueron el retraso en la administración del tratamiento, la cirugía y la reacción infusional.
DiscusiónEl uso de fármacos anti-TNF en pacientes con EII fue aprobado por las agencias reguladoras en función de los datos de los ECA pivotales4–6,10–12. Los ECA utilizan criterios de inclusión y exclusión estrictos para seleccionar una población homogénea14. Se excluyen sistemáticamente los pacientes con formas más graves, de mayor edad, con comorbilidades, con sospecha de mala adherencia o que reciben tratamientos con fármacos que podrían interferir con el medicamento a estudio. Estos estudios están diseñados para maximizar la validez interna a expensas de la validez externa. Por lo tanto, los resultados obtenidos a partir de un ECA pueden ser reproducidos en una población análoga y bajo condiciones similares. Sin embargo, es común (y a menudo erróneo) asumir que estos hallazgos son aplicables a la PC general, incluyendo las situaciones que fueron excluidas del estudio original.
En nuestro estudio más de la mitad de los pacientes con EII tratados con fármacos anti-TNF en la práctica habitual no cumplirían los criterios de inclusión de un ensayo pivotal. Solo el 45,6% de nuestros pacientes cumplieron con los criterios de selección de alguno de los 6 ECA. Ha et al.15 revisaron retrospectivamente 206 pacientes con EII seguidos en el Mount Sinai Medical Center con un brote de actividad moderada-grave. Solo el 34% de los pacientes con EC y el 25% de los pacientes con CU cumplían los criterios de elegibilidad para alguno de los estudios pivotales de infliximab, adalimumab, certolizumab o natalizumab. La validez externa de los ECA ha sido evaluada en otras enfermedades crónicas con resultados similares. Por ejemplo, solo el 42% y el 16% de 2 cohortes de pacientes con artritis reumatoide precoz cumplían criterios de elegibilidad para un ECA que comparó metotrexato vs etanercept, mientras que este porcentaje fue tan solo del 5% en el estudio ATTRACT (infliximab más metotrexato vs monoterapia con metotrexato). Los autores recomendaban modificar los criterios de inclusión de los ECA en la artritis reumatoide con el objetivo de mejorar la aplicabilidad de los resultados a la PC16. En otro estudio Herland et al.17 encontraron que solo el 5,4% de los pacientes con asma y el 17% de los pacientes con enfermedad pulmonar obstructiva crónica cumplían con los criterios más habituales de la ECA. Los autores cuestionaban que los resultados de los estudios pudiesen extrapolarse a la población real de pacientes. El porcentaje de representatividad fue mayor en nuestro estudio porque nos centramos solo en los pacientes con EII tratados con fármacos anti-TNF y no en toda la población de EII.
En la PC real los fármacos biológicos se administran por médicos en estructuras sanitarias diferentes (desde unidades de EII con hospital de día propio y enfermería especializada hasta profesionales con dedicación parcial a la EII). Los pacientes son heterogéneos y, como hemos visto, se realizan tratamientos en situaciones no contempladas en los estudios pivotales. Pueden presentar comorbilidades, tratamiento con otros fármacos que pueden interaccionar con los anti-TNF y situaciones de mayor gravedad o complejidad que las incluidas en los ECA. Los estudios observacionales, las series de casos, los ECA poscomercialización para situaciones específicas, y las recomendaciones de expertos aumentan y complementan la información proporcionada por los ECA pivotales. Disponemos de evidencias de tratamiento con fármacos biológicos en la prevención de la recurrencia en la EC18, en la CU grave19,20, la reservoritis21, el plastrón abdominal22, los pacientes infectados con VHB o VHC23 o durante el embarazo24, situaciones excluidas de los ECA pivotales. Además, algunas de las recomendaciones de los expertos proceden de la experiencia adquirida a partir de estudios observacionales en poblaciones no seleccionadas.
No encontramos diferencias significativas en la edad, el sexo, el hábito tabáquico o el uso de inmunosupresores entre los pacientes elegibles y no elegibles. En contraste con los estudios pivotales, más del 90% de nuestros pacientes habían recibido o estaban en tratamiento con inmunosupresores. Esto se ajusta a las recomendaciones de la European Crohn's and Colitis Organization (ECCO) para el uso de fármacos anti-TNF en PC3 y son similares a los de otro estudio9, con un 89%. Sí hubo diferencias en la localización y en el patrón de la EC, con un mayor porcentaje de formas ileales y patrones estenosante y penetrante en los no elegibles. Algunos criterios de exclusión de los ECA, como la presencia de estenosis fibróticas, abscesos o el uso de anti-TNF para la prevención de la recurrencia, que son más frecuentes en EC ileal, podrían explicar estas diferencias.
No encontramos diferencias en las tasas de respuesta entre los pacientes elegibles y no elegibles tratados con anti-TNF. Los pacientes no elegibles confieren una mayor heterogeneidad a los estudios observacionales, y podría haber grupos de pacientes con diferentes tasas de respuesta ante un mismo tratamiento. Por ejemplo, solo el 45% de los pacientes con reservoritis tratados con anti-TNF presentaron respuesta21, mientras que el éxito en la prevención de la recurrencia clínica al año fue de un 80% en el estudio de Regueiro18.
La heterogeneidad metodológica dificulta la comparación de nuestros resultados con series publicadas de otros autores. Sería interesante que las sociedades científicas establecieran unas recomendaciones que permitiesen la comparación. En algunos estudios se evalúan las tasas de remisión y respuesta utilizando índices de actividad, mientras otros evalúan el beneficio clínico en función de la opinión del médico. Hay estudios que incluyen a todos los pacientes que inician el tratamiento y otros que solo evalúan a los respondedores a la inducción. Por último, el tiempo de seguimiento es variable y los resultados se expresan en tiempo medio de seguimiento o en diferentes intervalos de tiempo. A pesar de ello, nuestros resultados, con un beneficio clínico del 68,4%, fueron similares a otros estudios observacionales. En la cohorte de Lovaina8, con 614 pacientes con EC tratados con infliximab, el beneficio clínico fue de un 56,5%, con una media de seguimiento de 4,6 años. En otra serie inglesa se evaluaron retrospectivamente 210 pacientes, el 65,9% presentaron respuesta y el 40% alcanzó la remisión clínica, con una media de seguimiento de 24 meses25. Una cohorte similar canadiense con 133 pacientes observó un porcentaje de respuesta al año de alrededor del 60%9. Existen datos similares con infliximab en la CU (80%)26 y con adalimumab en la EC (63%)27.
Sin embargo, hay una gran discrepancia entre los resultados en PC de la mayoría de series observacionales con los datos de los ECA. En el estudio ACCENT 14 se incluyeron 573 pacientes con EC en los que se realizó tratamiento con 5mg/kg de infliximab. El 58% presentó respuesta en la semana 2 y fueron aleatorizados a infliximab (5 o 10mg/kg) o placebo en las semanas 2, 6 y cada 8 semanas durante un año. Los porcentajes de remisión y respuesta para los respondedores primarios en la semana 54 fueron del 28% y del 39% en el grupo de infliximab 5mg/kg, superior al grupo placebo (17% y 22,5%; p=0,007). El estudio CHARM5 evaluó la eficacia del adalimumab en 854 pacientes con EC, con un diseño similar al anterior. Se realizó una primera fase de inducción con 80 y 40mg de adalimumab en las semanas 0 y 2 y una aleatorización en la semana 4 a adalimumab 40mg semanal, 40mg cada 2 semanas o placebo. La remisión y la respuesta se alcanzaron en el 36% y el 43% de los respondedores primarios (58%) en la semana 56 del grupo de adalimumab cada 2 semanas, con diferencias significativas respecto al grupo placebo. El estudio ACT 16 incluyó 364 pacientes con CU moderada-grave en tratamiento con infliximab (5 o 10mg/kg) o placebo. Tanto la remisión como la respuesta en la semana 54 fueron significativamente superiores en el grupo de tratamiento con 5mg/kg (34,7% y 45,5%, respectivamente) que en el grupo placebo (19,8%).
Además de los rigurosos criterios de selección, los investigadores establecen un protocolo estricto de seguimiento en los ECA, con visitas más frecuentes y controladas que en la práctica clínica. Se extraen todas las circunstancias que podrían interferir con las variables del estudio. Si se produce cualquier violación del protocolo el sujeto se retira del estudio y es considerado como fracaso. Por ejemplo, en el estudio ACCENT 1 el protocolo considera como fracaso cualquier paciente que necesitara intensificación del tratamiento, que recibiera una medicación no permitida o se interviniera, independientemente del índice de actividad4.
En la segunda parte del estudio solo hemos considerado los pacientes que serían elegibles para los ECA y comparamos la respuesta al tratamiento anti-TNF en nuestra PC con los resultados teóricos de las condiciones hipotéticas de un ECA. El beneficio clínico fue menor con los criterios de un ECA que en PC (44,4% vs. 68,4%). Un tercio de los pacientes se consideraría fracaso si hubieran sido incluidos en un ECA. Estos hallazgos confirman los resultados previos de un estudio piloto con 74 pacientes con EII presentado en el congreso de la European Crohn's and Colitis Organization en 201128.
Las principales causas de discrepancia entre los resultados de PC y los del estudio teórico de ECA fueron la necesidad de la intensificación (75,6%) y haber realizado un nuevo ciclo de corticoides (12,2%). La intensificación fue necesaria en el 23% de los pacientes de nuestra serie para mantener la respuesta durante el primer año de tratamiento. Este porcentaje es similar al 21% observado en una cohorte inglesa, a los 2 años de seguimiento25. Estas intervenciones son comunes en la práctica habitual en los pacientes con pérdida de respuesta o respuesta parcial. De hecho, la intensificación está sustentada por la evidencia científica, y se recomienda en las guías clínicas de la EII. Sin embargo, en los ECA pivotales se considera cualquier modificación de la dosis del fármaco o del intervalo de administración como una violación del protocolo, ya que interfiere con el objetivo primario que es la valoración de la eficacia del fármaco.
Hay algunas limitaciones en el estudio que pueden dar lugar a sesgos. Los datos fueron extraídos de las historias clínicas, por lo que podría haber motivos de exclusión o violaciones de protocolo para un ECA no contempladas. Por ejemplo, la consideración de estenosis sintomática como criterio de exclusión podría ser controvertida, dependiendo del componente inflamatorio o fibrótico. Pudo haber modificaciones de los tratamientos concomitantes no evaluados. Por otro lado, solo se registró una razón de no elegibilidad, y en los casos en los que había más de una el investigador seleccionó la más relevante. Los resultados al año se establecieron a criterio del médico en los casos en los que no se pudieron obtener los índices clínicos, como en otros estudios similares, y también se aplicaron los mismos criterios en la evaluación teórica del ECA.
Es importante destacar que los ECA y los estudios observacionales tienen diferentes propósitos29. Los ECA son la mejor aproximación para estudiar la eficacia de un tratamiento en condiciones muy controladas. Sin embargo, los ECA no reflejan la forma en la que el fármaco se utiliza en la práctica clínica, y sus resultados no representan a toda la población de pacientes30. Los estudios observacionales ofrecen información realista de la respuesta terapéutica en una población heterogénea y reflejan mejor la probabilidad de respuesta a un fármaco sujeto a los condicionantes de la PC. Ambos estudios son esenciales y los resultados en salud obtenidos son complementarios para la toma de decisiones médicas. David Mant31 apunta que: «La paradoja del ensayo clínico es que es la mejor forma de conocer cuándo una intervención terapéutica funciona, pero a la vez es la peor manera de conocer quién se beneficiará de ella».
En conclusión, la mitad de los pacientes con EII tratados con anti-TNF en PC real no están representados en los ensayos pivotales. Por otro lado, los ECA subestiman la probabilidad de respuesta a los fármacos anti-TNF en la EII.
FinanciaciónLuis Ibáñez-Samaniego ha recibido una beca de ISCIII (RÍO-HORTEGA CM14/00023).
AutoríaDaniel Ginard y Sam Khorrami han contribuido por igual en la realización del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.