La evidencia disponible que evalúa el impacto de la presencia de sobrecrecimiento bacteriano de intestino delgado (SIBO) después de una gastrectomía es escasa.
ObjetivosEvaluar la frecuencia de SIBO tras gastrectomía y su asociación con malnutrición. Describir las líneas antibióticas necesarias para su corrección y si mejora el estado nutricional.
Material y métodosEstudio de cohortes prospectivo en el ámbito de la Agencia Sanitaria Costa del Sol desde 2012 hasta 2015. Se realizó test del aliento en hidrógeno y en metano espirado con sobrecarga oral de glucosa. Recogida de variables demográficas y valoración nutricional, basal y al mes del tratamiento eficaz del SIBO. Se evaluaron las pautas antibióticas y el número de tratamientos.
ResultadosSe analizaron 60 pacientes gastrectomizados, 58,3%varones. Se realizó un subanálisis de la curva a los 45min para minimizar los posibles falsos positivos con una frecuencia de SIBO del 61,6%. En presencia de SIBO, se observó una tendencia no significativa a presentar un menor IMC. Tras el tratamiento con rifaximina, el SIBO permaneció positivo en el 94,6% y tras metronidazol, en el 85,7%. El multifracaso de la terapia antibiótica fue de 67,6%. No hay cambios estadísticamente significativos en parámetros nutricionales después del tratamiento.
ConclusionesEl SIBO está presente en el 61,6% de los pacientes gastrectomizados, sin que se demuestre asociación con el deterioro nutricional. Rifaximina y metronidazol son escasamente efectivos en la erradicación del SIBO. Cuando este se consigue, el efecto sobre la malnutrición es escaso, pudiendo correlacionarse con otros factores.
Available evidence assessing the impact of small intestinal bacterial overgrowth (SIBO) following gastrectomy is limited.
ObjectivesTo evaluate the prevalence of SIBO after gastrectomy and its association with malnutrition. To describe the antibiotic treatment required to correct it and if nutritional status improves.
Material and methodsA prospective cohort study was performed at the Agencia Sanitaria Costa del Sol (Costa del Sol Health Agency) from 2012 to 2015. A hydrogen-methane breath test with oral glucose overload was performed. Demographic variables and nutritional parameters were collected at baseline and one month after effective treatment of SIBO. The antibiotic regimens and the number of treatment lines used were assessed.
ResultsSixty gastrectomy patients were analysed, 58.3% of which were male. A sub-analysis of the curve was performed at 45min to minimise possible false positives, and SIBO was identified in 61.6% of cases. SIBO patients tended to have a lower BMI, although this trend was not statistically significant. After treatment with rifaximin, 94.6% of patients were still positive for SIBO, which fell to 85.7% after metronidazole. The rate of total antibiotic treatment failure was 67.6%. No statistically significant changes were found in nutritional parameters after treatment.
ConclusionsSIBO was identified in 61.6% of patients after gastrectomy. No correlation was found with any malnutrition parameter. Rifaximin and metronidazole were found to be largely ineffective in eradicating SIBO. When treatment was effective, the impact on malnutrition was negligible and may have been associated with other factors.
La gastrectomía condiciona una alteración anatómica trascendente y como consecuencia se producen cambios en la digestión y la absorción normal de los alimentos, que pueden conllevar malnutrición. Entre los pacientes sometidos a gastrectomía, la malnutrición se presenta en algunas series hasta en el 74%, con una disminución del peso y unos niveles de proteínas por debajo de lo normal1. Son múltiples los factores que influyen en la malnutrición, entre ellos, la menor ingesta por saciedad precoz, secundaria al componente restrictivo de la técnica quirúrgica, la menor absorción de nutrientes por la resección de los primeros tramos del intestino delgado y el tránsito acelerado, además de la posibilidad de desarrollar complicaciones como el síndrome de Dumping2 o el sobrecrecimiento bacteriano de intestino delgado (SIBO).
El SIBO consiste en un crecimiento excesivo y/o una alteración en el tipo de bacterias presentes en el intestino delgado. Su presencia se ha evaluado en muchas entidades. En la enfermedad celíaca se establece una prevalencia del 9-67%3, en la enfermedad de Crohn, del 25-88%4, en la pancreatitis crónica, del 34-92%5, y en el síndrome de intestino irritable, del 4-78%6; sin embargo, su asociación con el consumo de IBP no está clara, siendo los datos discordantes7–10. Datos recientes señalan una prevalencia de SIBO en series quirúrgicas de hasta un 43%, frente a un 13% en controles11. En histerectomía, el 42% de los pacientes presentan test del aliento en hidrógeno y en metano espirado (TAHMG) positivo y en pacientes con colecistectomía previa es positivo en un 41%. En el escenario de los pacientes gastrectomizados, varios estudios estiman una prevalencia del 77,5%11,12. Puede ser asintomático o presentarse con diarrea líquida, dolor abdominal, hinchazón abdominal, flatulencia, malabsorción y pérdida de peso. Se ha propuesto como un factor que podría influir en la malnutrición, al contribuir a la malabsorción de diferentes nutrientes: grasas, vitaminas liposolubles, vitamina B12 y hierro13. El diagnóstico de esta condición es complejo. El cultivo del aspirado yeyunal se considera el patrón oro, pero tiene unas considerables limitaciones, entre las que cabe destacar su coste, que es una técnica invasiva, la falta de consenso en términos cuantitativos y la falta de representatividad de las muestras respecto a los tramos distales del intestino delgado14. Los TAHMG tras sobrecarga de glucosa o lactulosa se han propuesto como herramientas diagnósticas sencillas y accesibles para detectar SIBO. La precisión de la prueba con glucosa varía de forma considerable en los estudios clínicos, con una sensibilidad del 20 al 93% y una especificidad del 30 al 86%, tomando como referencia los pacientes diagnosticados de SIBO mediante cultivo de aspirado yeyunal15–17. Las pruebas de aliento con sobrecarga de glucosa presentan mayor precisión diagnóstica que las que utilizan lactulosa como sustrato, como queda reflejado en la Conferencia de Consenso de Roma18. Algunos autores han planteado que podría aumentar la tasa de falsos positivos en los pacientes gastrectomizados, ya que pueden influir condiciones como el tránsito acelerado, que haría llegar de forma precoz el sustrato no absorbido al colon19.
A diferencia de los factores relacionados con la propia cirugía o el síndrome de Dumping, el SIBO tiene un tratamiento relativamente simple. En un reciente metaanálisis se demuestra como la administración de antibióticos, considerándolos de forma global, induce la remisión de esta condición con la normalización del test de aliento en un 51%20. La pauta antibiótica más utilizada es rifaximina, con una respuesta global del 70%21. La corrección del SIBO podría influir en la nutrición de estos pacientes. No obstante, la evidencia disponible que evalúa el impacto de la presencia de SIBO en los pacientes gastrectomizados es escasa. Iivonen et al.22 observan una correlación negativa entre la concentración máxima de hidrógeno en el TAHMG y las principales variables nutricionales evaluadas, concluyendo que existe una relación entre el SIBO y el estado nutricional de los pacientes gastrectomizados. Pero otros autores no encuentran esta relación aunque la presencia de SIBO sea elevada12.
Por ello, nos planteamos como objetivo principal determinar la frecuencia de SIBO en pacientes sometidos a una gastrectomía, valorando su asociación con la presencia de parámetros de malnutrición. De forma secundaria se busca establecer las líneas antibióticas necesarias para su corrección y evaluar el impacto de esta sobre el estado nutricional.
Pacientes y métodosPoblaciónSe realizó un estudio de cohortes prospectivo en el que se incluyeron pacientes atendidos en la Agencia Sanitaria Costa del Sol desde enero de 2012 hasta diciembre de 2015. Se incluyeron pacientes adultos mayores de 18 años sometidos a gastrectomía total o subtotal por cualquier causa, una vez trascurridos 3 meses desde la intervención. Se excluyeron aquellos pacientes con estadio tumoral avanzado (metástasis a distancia) o con recidiva neoplásica, cirrosis hepática o cualquier otra causa de maldigestión o malabsorción (pancreatitis crónica, resección pancreática, enfermedad inflamatoria intestinal, enfermedad celíaca).
A los candidatos se les propuso participar en el estudio, siendo incluidos una vez que firmaron el consentimiento informado.
Diseño del estudioTodos los pacientes incluidos en el estudio se valoraron inicialmente en consulta, donde se realizó una encuesta con variables demográficas (la edad, el sexo, el hábito tabáquico y alcohólico), la causa de gastrectomía (benigna o tumoral y tipo de tumor), el tipo de cirugía (gastrectomía total o subtotal), el tipo de reconstrucción quirúrgica y parámetros de valoración clínica mediante encuesta dirigida de presencia o ausencia (diarrea, dolor abdominal, pérdida de peso, sospecha de síndrome de Dumping, esteatorrea). Los parámetros nutricionales basales medidos fueron el índice de masa corporal (IMC), la albúmina y la prealbúmina, el colesterol, el recuento absoluto de linfocitos, la vitamina D y el magnesio. Se les realizó un TAHMG siguiendo el protocolo que se expone a continuación. Se les entregaron unas recomendaciones, de forma que el paciente debió seguir durante las 48h previas a la realización del test una dieta pobre en fibra e hidratos de carbono. Acudieron a la cita en ayuno de al menos 12h, sin fumar desde la noche anterior; se recomendó además no realizar ejercicio previamente y que por la mañana se lavaran los dientes con 20ml de solución con clorhexidina al 0,05%. Inicialmente se tomó una muestra basal que debía ser inferior a 10ppm de hidrógeno. Valores entre 10 y 20 apuntaron a un ayuno incompleto antes de la prueba o a ingesta de comida de lenta digestión el día anterior a la prueba, por lo que en estas situaciones se llevó a cabo una reeducación específica y se citaron otro día para repetir la prueba. Posteriormente, se les administró una sobrecarga oral de glucosa (60g de glucosa en 200ml de agua), y después de la toma de la dilución, se tomaron muestras alveolares con espiración forzada a intervalos de 15min durante 2h. Los resultados se leyeron en el laboratorio local con un cromatógrafo de gas (MYCROLIZER®, ISOMED) (fig. 1), y se remitieron al laboratorio central para lectura combinada de hidrógeno y metano con QuinTron MYCROLIZER en el laboratorio de referencia ISOMED.
La variable principal de resultado fue la presencia de SIBO, considerando como positivos aquellos pacientes con un pico por encima de 10ppm comparados con la determinación basal de hidrógeno y/o si la concentración de metano aumenta en más de 12ppm respecto de la basal, siendo negativo en caso contrario18. En los pacientes gastrectomizados una de las posibles causas de falso positivo en el TAHMG es la presencia de un tránsito acelerado. Para minimizar el impacto de esta circunstancia, y ante la falta de disponibilidad de la escintigrafía, siguiendo la referencia de un reciente estudio23 se realiza un subanálisis de la curva obtenida a los 45min, de tal forma que solo las curvas que elevan el pico de hidrógeno y metano en ese período de tiempo se consideran como verdaderas positivas.
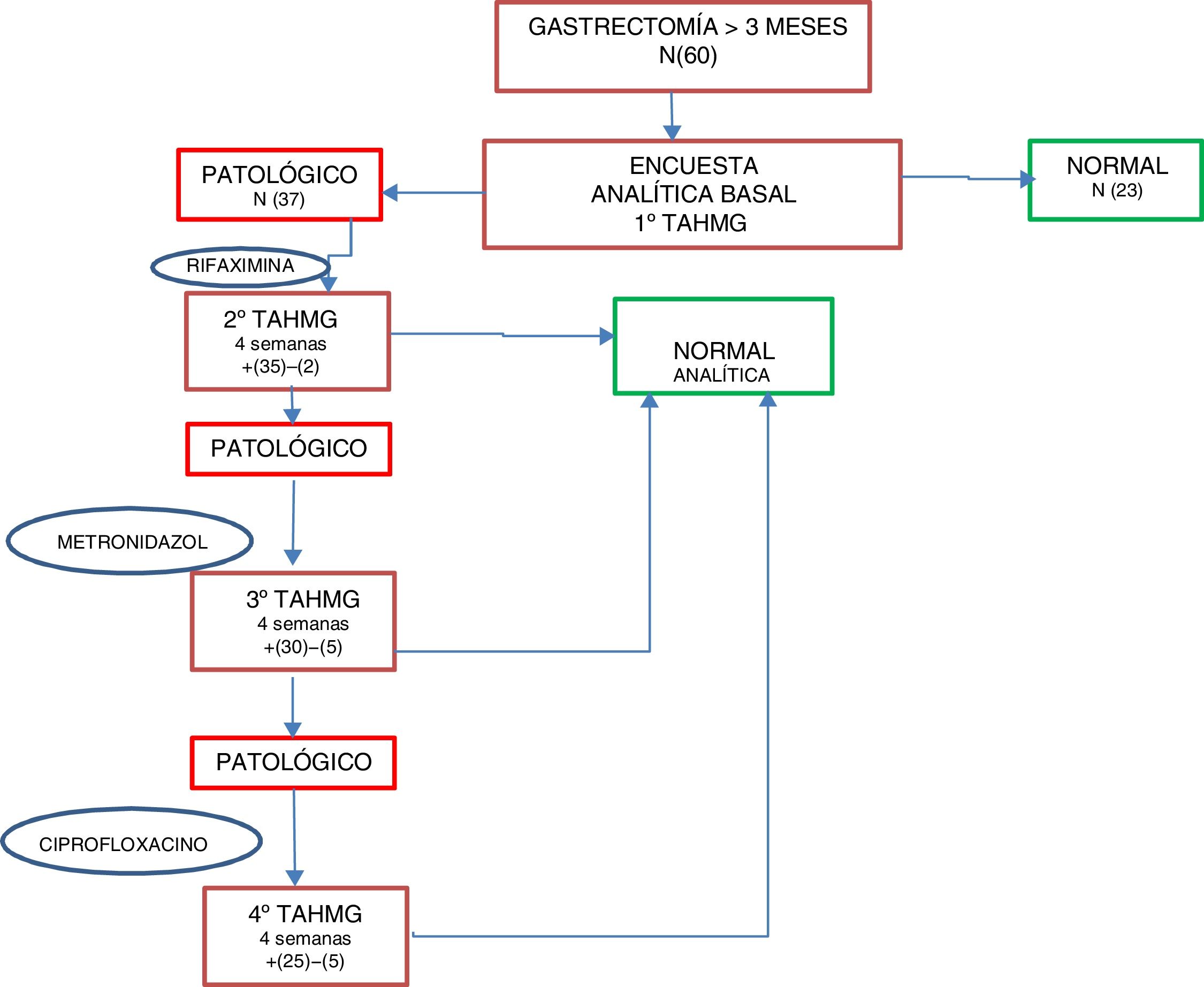
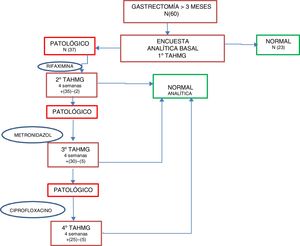
En caso de positividad para SIBO se instauró de forma estandarizada tratamiento de primera línea con rifaximina 400mg cada 8h durante 10 días; como segunda línea se instauró tratamiento con metronidazol 500mg cada 8h durante 10 días, y como tercera línea, ciprofloxacino 500mg cada 12h durante 10 días. Tras cada línea antibiótica se realizó un TAHMG a las 4 semanas para valorar la respuesta al tratamiento y/o la reaparición del SIBO, de forma que si tras 2 líneas antibióticas persistía el SIBO se consideró como multifracaso. A todos los pacientes se les realizó, tras comprobar la negativización del SIBO, una analítica al mes para evaluar el estado nutricional con todos los parámetros determinados en la valoración basal (fig. 2).
Estadística y aspectos éticosEl presente estudio se ciñó en todo momento a la declaración de Helsinki y a la ley de protección de derechos de los pacientes. No se recabó ningún dato clínico fuera de los consignados anteriormente. No obstante, todos los datos recogidos en este proyecto se registraron de forma anónima, siguiendo estrictamente las leyes y normas de protección de datos en vigor (Ley 41/2002 de 14 de noviembre; Ley 15/1999 de 15 de diciembre). El proyecto fue previamente aprobado por el Comité de Ética e Investigación de la Agencia Sanitaria Costa del Sol en julio de 2012.
Se realizó un análisis descriptivo con medidas de tendencia central y dispersión (media y desviación típica), junto con mediana y rango intercuartílico (para comparación de grupos) para las variables cuantitativas, y distribución de frecuencias para las cualitativas. Se compararon los resultados entre la curva completa a los 120min con los obtenidos con la curva a los 45min. Se calculó la frecuencia de SIBO con test a los 45min incluyendo el IC 95%. Se realizó análisis bivariado tomando como variable resultado el SIBO positivo con test a 45min, comparando con test de ji-cuadrado para variables cualitativas, el test de U de Mann-Whitney para los valores cuantitativos de malnutrición basales y el test de Wilcoxon para la valoración del cambio entre parámetros nutricionales basales y al mes en pacientes negativizados. Se estableció el nivel de significación estadística en p<0,05.
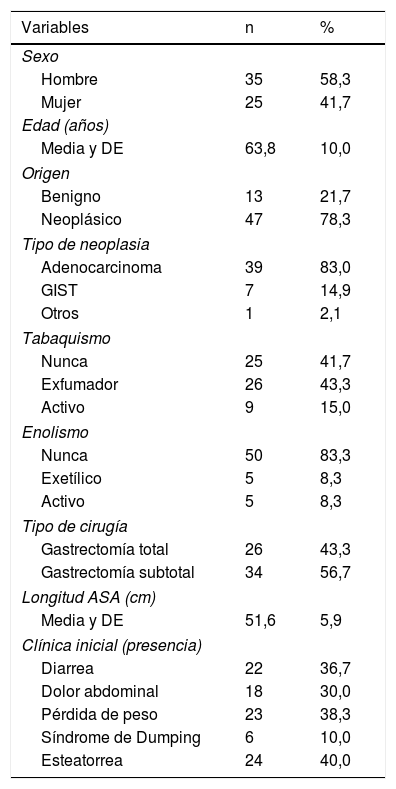
ResultadosSe evaluaron un total de 76 pacientes, excluyéndose 16 por presentar algún factor de exclusión: 4 por resección pancreática, 2 por presentar pancreatitis crónica, 2 por presentar un estadio tumoral avanzado, 5 por presentar resecciones gástricas atípicas, uno por cirrosis hepática autoinmune y 2 fueron pérdidas por retirar su consentimiento durante el estudio. Finalmente se incluyen un total de 60 pacientes gastrectomizados. De ellos el 58,3% fueron varones con una edad media de inclusión en el estudio de 63,8 (DE 10) años. Los hábitos tóxicos se recogen en la tabla 1. La gastrectomía se realizó por causa benigna en el 21,7% (13) y por causa neoplásica en el 78,3% (47), siendo el tipo de neoplasia más frecuente el adenocarcinoma gástrico, que supuso el 83% de las gastrectomías por causa neoplásica (tabla 1). De todos ellos, al 56,7% se les realizó una gastrectomía subtotal y al 43,3% una gastrectomía total, con reconstrucción Billroth tipo ii y con una media de longitud de asa en la reconstrucción de 51,6cm (DE 5,9). La manifestación clínica más frecuente fue la esteatorrea en el 40%de los pacientes; el resto de los síntomas y signos se recogen en la tabla 1.
Descriptiva de variables clínicas
| Variables | n | % |
|---|---|---|
| Sexo | ||
| Hombre | 35 | 58,3 |
| Mujer | 25 | 41,7 |
| Edad (años) | ||
| Media y DE | 63,8 | 10,0 |
| Origen | ||
| Benigno | 13 | 21,7 |
| Neoplásico | 47 | 78,3 |
| Tipo de neoplasia | ||
| Adenocarcinoma | 39 | 83,0 |
| GIST | 7 | 14,9 |
| Otros | 1 | 2,1 |
| Tabaquismo | ||
| Nunca | 25 | 41,7 |
| Exfumador | 26 | 43,3 |
| Activo | 9 | 15,0 |
| Enolismo | ||
| Nunca | 50 | 83,3 |
| Exetílico | 5 | 8,3 |
| Activo | 5 | 8,3 |
| Tipo de cirugía | ||
| Gastrectomía total | 26 | 43,3 |
| Gastrectomía subtotal | 34 | 56,7 |
| Longitud ASA (cm) | ||
| Media y DE | 51,6 | 5,9 |
| Clínica inicial (presencia) | ||
| Diarrea | 22 | 36,7 |
| Dolor abdominal | 18 | 30,0 |
| Pérdida de peso | 23 | 38,3 |
| Síndrome de Dumping | 6 | 10,0 |
| Esteatorrea | 24 | 40,0 |
ASA: American Society of Anesthesiologists; DE: desviación estándar; GIST: tumores del estroma gastrointestinal.
Al analizar la presencia de SIBO, se observó que del total de gastrectomizados, el 70,5% tuvieron un TAHMG para SIBO positivo si se analiza la curva de 120min. Al evaluar la concordancia entre la valoración «pico 45min» respecto a la curva completa (120min), en 55 (91,6%) pacientes hubo concordancia entre las 2 valoraciones, 18 valores negativos y 37 positivos, y en 5 de los pacientes la valoración a los 45min fue negativa, siendo positiva la curva completa, pudiendo considerarse como falsos positivos. La frecuencia de SIBO, excluyendo los falsos positivos, es de 61,6%. El porcentaje de acuerdo absoluto entre ambas pruebas es del 91,7%, con un valor de kappa de 0,82 (IC 95% 0,66-0,97); este último determina una fuerza de concordancia «excelente»24.
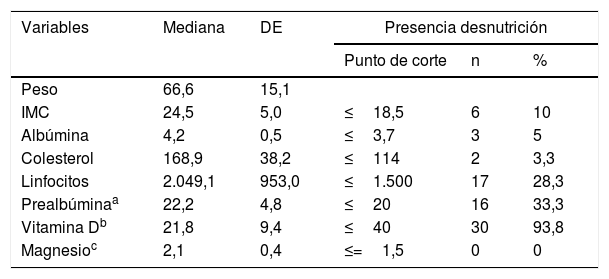
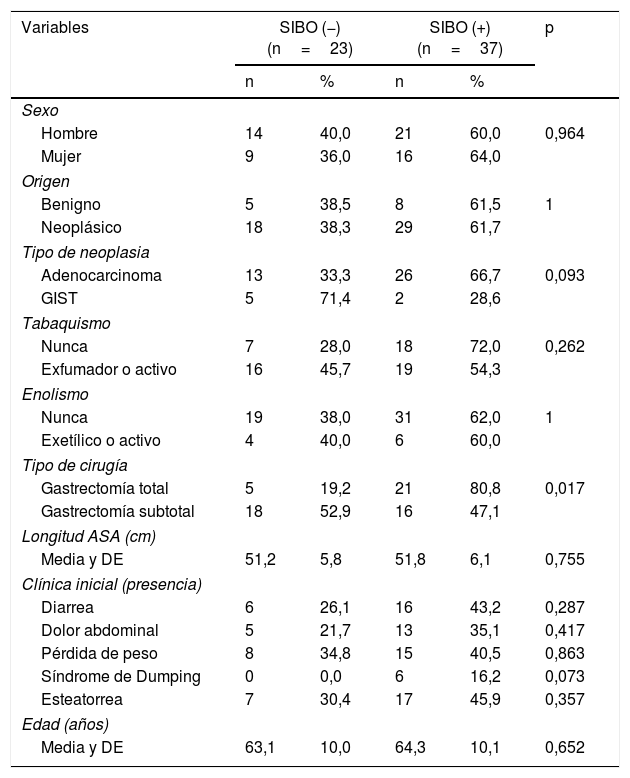
Respecto a los parámetros de malnutrición basal en esta serie de pacientes, se observó en un 28,3% un recuento de linfocitos bajo, en el 33,3% niveles bajos de prealbúmina y en el 93,8%, de vitamina D. En un 10% se observó un IMC≤18,5kg/m2 y en el 3,3%, niveles bajos de colesterol. En ninguno de los pacientes se observaron niveles bajos de magnesio (tabla 2). Las características clínicas de los pacientes en función de la presencia de SIBO se recogen en la tabla 3. En el análisis bivariado de estos datos solo se observó diferencia estadísticamente significativa en la presencia de SIBO en el grupo de los pacientes sometidos a gastrectomía total.
Descriptiva de parámetros de malnutrición
| Variables | Mediana | DE | Presencia desnutrición | ||
|---|---|---|---|---|---|
| Punto de corte | n | % | |||
| Peso | 66,6 | 15,1 | |||
| IMC | 24,5 | 5,0 | ≤18,5 | 6 | 10 |
| Albúmina | 4,2 | 0,5 | ≤3,7 | 3 | 5 |
| Colesterol | 168,9 | 38,2 | ≤114 | 2 | 3,3 |
| Linfocitos | 2.049,1 | 953,0 | ≤1.500 | 17 | 28,3 |
| Prealbúminaa | 22,2 | 4,8 | ≤20 | 16 | 33,3 |
| Vitamina Db | 21,8 | 9,4 | ≤40 | 30 | 93,8 |
| Magnesioc | 2,1 | 0,4 | ≤=1,5 | 0 | 0 |
DE: desviación estándar; IMC: índice de masa corporal.
Análisis bivariado entre variables clínicas y presencia de «pico 45 minutos»
| Variables | SIBO (−) (n=23) | SIBO (+) (n=37) | p | ||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Sexo | |||||
| Hombre | 14 | 40,0 | 21 | 60,0 | 0,964 |
| Mujer | 9 | 36,0 | 16 | 64,0 | |
| Origen | |||||
| Benigno | 5 | 38,5 | 8 | 61,5 | 1 |
| Neoplásico | 18 | 38,3 | 29 | 61,7 | |
| Tipo de neoplasia | |||||
| Adenocarcinoma | 13 | 33,3 | 26 | 66,7 | 0,093 |
| GIST | 5 | 71,4 | 2 | 28,6 | |
| Tabaquismo | |||||
| Nunca | 7 | 28,0 | 18 | 72,0 | 0,262 |
| Exfumador o activo | 16 | 45,7 | 19 | 54,3 | |
| Enolismo | |||||
| Nunca | 19 | 38,0 | 31 | 62,0 | 1 |
| Exetílico o activo | 4 | 40,0 | 6 | 60,0 | |
| Tipo de cirugía | |||||
| Gastrectomía total | 5 | 19,2 | 21 | 80,8 | 0,017 |
| Gastrectomía subtotal | 18 | 52,9 | 16 | 47,1 | |
| Longitud ASA (cm) | |||||
| Media y DE | 51,2 | 5,8 | 51,8 | 6,1 | 0,755 |
| Clínica inicial (presencia) | |||||
| Diarrea | 6 | 26,1 | 16 | 43,2 | 0,287 |
| Dolor abdominal | 5 | 21,7 | 13 | 35,1 | 0,417 |
| Pérdida de peso | 8 | 34,8 | 15 | 40,5 | 0,863 |
| Síndrome de Dumping | 0 | 0,0 | 6 | 16,2 | 0,073 |
| Esteatorrea | 7 | 30,4 | 17 | 45,9 | 0,357 |
| Edad (años) | |||||
| Media y DE | 63,1 | 10,0 | 64,3 | 10,1 | 0,652 |
ASA: American Society of Anesthesiologists; DE: desviación estándar; GIST: tumores del estroma gastrointestinal; SIBO: sobrecrecimiento bacteriano de intestino delgado.
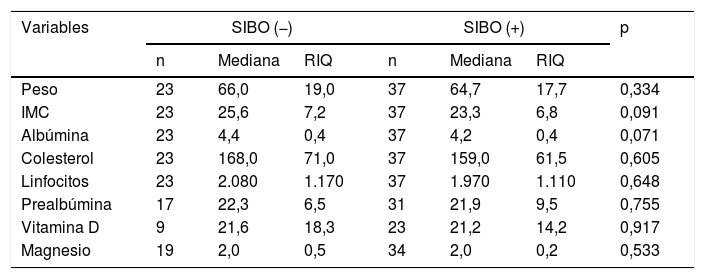
Al relacionar la presencia de SIBO y la situación nutricional basal, se observó una tendencia a tener niveles bajos de vitamina D y menor IMC en aquellos con SIBO positivo en comparación con aquellos con SIBO negativo, aunque sin llegar a la significación estadística (tabla 4). Tampoco se alcanzaron diferencias para los niveles de colesterol, albúmina, recuento absoluto de linfocitos o niveles de magnesio, probablemente por el pequeño tamaño muestral. En aquellos con SIBO positivo, el 68,8% presentaron niveles de prealbúmina≤20mg/dl, el 73,3% niveles de vitamina D≤40mg/dl y el 66,7% un IMC≤18,5kg/m2.
Análisis bivariado entre parámetros de malnutrición y SIBO
| Variables | SIBO (−) | SIBO (+) | p | ||||
|---|---|---|---|---|---|---|---|
| n | Mediana | RIQ | n | Mediana | RIQ | ||
| Peso | 23 | 66,0 | 19,0 | 37 | 64,7 | 17,7 | 0,334 |
| IMC | 23 | 25,6 | 7,2 | 37 | 23,3 | 6,8 | 0,091 |
| Albúmina | 23 | 4,4 | 0,4 | 37 | 4,2 | 0,4 | 0,071 |
| Colesterol | 23 | 168,0 | 71,0 | 37 | 159,0 | 61,5 | 0,605 |
| Linfocitos | 23 | 2.080 | 1.170 | 37 | 1.970 | 1.110 | 0,648 |
| Prealbúmina | 17 | 22,3 | 6,5 | 31 | 21,9 | 9,5 | 0,755 |
| Vitamina D | 9 | 21,6 | 18,3 | 23 | 21,2 | 14,2 | 0,917 |
| Magnesio | 19 | 2,0 | 0,5 | 34 | 2,0 | 0,2 | 0,533 |
IMC: índice de masa corporal; RIQ: rango intercuartílico; SIBO: sobrecrecimiento bacteriano de intestino delgado.
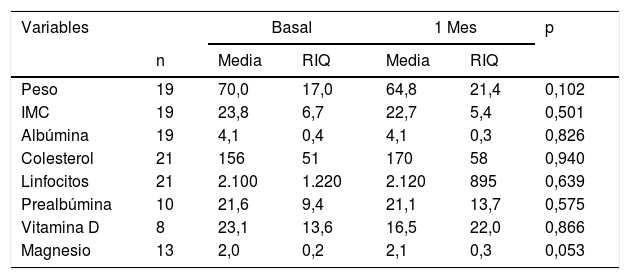
De todos los pacientes con SIBO positivo, solo negativizaron 2 (2/37) tras la primera línea de tratamiento con rifaximina, siendo nuevamente positivo en el 94,6%. Tras la segunda línea de tratamiento con metronidazol se logró negativizar en el 14,3% (5/35), y después de la tercera línea con ciprofloxacino, un 16,6% (5/25). El multifracaso de la terapia antibiótica en estos pacientes, por tanto, fue alto, presentándose en el 67,6% de los casos. Al analizar los parámetros nutricionales y antropométricos en el grupo de pacientes con multifracaso antibiótico no se observaron cambios estadísticamente significativos en ninguno de ellos con respecto a las cifras basales. En la evaluación de los cambios de los parámetros nutricionales entre las analíticas basales y al mes, se halló una mediana de reducción de 5,2kg y una tendencia al aumento de valor de magnesio en 0,1 puntos, aunque en ningún caso pudo demostrarse significación estadística para estas diferencias (tabla 5). En el grupo que negativizó el TAHMG se observó una tendencia a presentar un recuento de linfocitos absoluto y prealbúmina más altos, aunque se dispuso de datos completos postratamiento en solo 21 y 10 pacientes, respectivamente.
Análisis pareado entre parámetros de malnutrición basal y a un mes con SIBO negativizado
| Variables | Basal | 1 Mes | p | |||
|---|---|---|---|---|---|---|
| n | Media | RIQ | Media | RIQ | ||
| Peso | 19 | 70,0 | 17,0 | 64,8 | 21,4 | 0,102 |
| IMC | 19 | 23,8 | 6,7 | 22,7 | 5,4 | 0,501 |
| Albúmina | 19 | 4,1 | 0,4 | 4,1 | 0,3 | 0,826 |
| Colesterol | 21 | 156 | 51 | 170 | 58 | 0,940 |
| Linfocitos | 21 | 2.100 | 1.220 | 2.120 | 895 | 0,639 |
| Prealbúmina | 10 | 21,6 | 9,4 | 21,1 | 13,7 | 0,575 |
| Vitamina D | 8 | 23,1 | 13,6 | 16,5 | 22,0 | 0,866 |
| Magnesio | 13 | 2,0 | 0,2 | 2,1 | 0,3 | 0,053 |
IMC: índice de masa corporal; RIQ: rango intercuartílico.
Los pacientes sometidos a una gastrectomía presentan con mayor frecuencia malnutrición debido a los cambios en la digestión y la absorción de alimentos. Entre los factores propuestos se incluyen la cirugía per se, la saciedad precoz por el componente restrictivo, el tránsito acelerado, así como el desarrollo de complicaciones como el SIBO y el síndrome de Dumping1,2.
Uno de los factores modificables con un adecuado diagnóstico y tratamiento es el SIBO. Por ese motivo, se plantea como objetivo determinar la frecuencia de este en dichos pacientes y su correlación con datos de malnutrición. De forma secundaria, se busca establecer las líneas antibióticas necesarias para su corrección y evaluar el impacto de esta sobre el estado nutricional.
Respondiendo a los objetivos de nuestro estudio, la frecuencia de SIBO en nuestra serie se establece en un 70,5% en el análisis de la curva de 120min. Este dato está en concordancia con estudios previos que describen una frecuencia del 77,6%3. Tras la gastrectomía se produce una disminución de la barrera defensiva primaria, predisponiendo al desarrollo del SIBO en estos pacientes4–6. Los factores que condicionan este deterioro son, entre otros: la disminución o ausencia de secreción ácida, la alteración en la motilidad intestinal, con la disminución de las ondas anterógradas, que facilita el crecimiento intraluminal de las bacterias, y la disminución de las secreciones antibacterianas. El cultivo directo del aspirado de intestino delgado (>105cfu/ml) se ha empleado como patrón oro para el diagnóstico de SIBO, sin embargo, su carácter invasivo, la posibilidad de contaminación con la flora de tramos superiores, la localización de la muestra (falsos negativos), la falta de consenso en la definición de cultivo positivo y la falta de reproducibilidad hacen que hoy en día no sea la prueba más idónea7,8. En este contexto, el TAHMG, al ser una prueba sencilla, barata y poco invasiva, es la más utilizada, aunque tampoco hay ningún test del aliento validado para el diagnóstico del SIBO7. El test del aliento con glucosa tiene una sensibilidad del 62,5% y una especificidad del 81,8%, considerándose positivo si se produce un aumento del hidrógeno espirado superior a 10-20ppm sobre el basal8. Al interpretar la curva en los pacientes gastrectomizados, hay que tener en cuenta la existencia de resultados falsos positivos debido a un tránsito acelerado y/o a la pérdida de la superficie de absorción mucosa, de tal forma que la glucosa se escapa de la absorción del intestino delgado, siendo fermentada en el colon4,7. Para solventar esta circunstancia y ante la falta de disponibilidad de la escintigrafía, en nuestro estudio, se reconsideró SIBO positivo como aquel que se producía en los primeros 45min de la curva23, de tal forma que en los 42 pacientes con SIBO positivo, finalmente 37 cumplían este criterio, considerando que los 5 restantes podían ser falsos positivos por fermentación de la glucosa en el colon. Por lo tanto, la frecuencia de SIBO en nuestra serie se establece con esta corrección metodológica en un 61,6%. El porcentaje de acuerdo absoluto entre ambas pruebas es del 91,7%, con un valor de kappa de 0,82 (IC 95% 0,66-0,97); este último determina una fuerza de concordancia «excelente»24.
Se ha propuesto que el SIBO es uno de los factores que influyen en la malnutrición de los pacientes gastrectomizados, sin embargo, su relación y su determinación de forma estandarizada en estos pacientes no está bien establecida. Con nuestros resultados, se observa que dentro de los pacientes con TAHMG positivo (SIBO presente) hay una tendencia a mostrar unos menores niveles de prealbúmina (el 68,8% tienen niveles de prealbúmina≤20mg/dl) y de vitamina D (el 73,3% tenían niveles≤40mg/dl) e IMC (el 66,7% tenían un IMC≤18,5kg/m2), aunque no de una forma estadísticamente significativa. Los datos en la literatura son contradictorios. Algunos autores demuestran que el 74% de los pacientes gastrectomizados tienen un IMC<18,5kg/m2, hasta un 50% presenta anemia (aunque esta suele ser leve) y hasta un 58% presenta hipoproteinemia y albuminemia (<3,5mg/dl)1. En otro estudio se objetiva en pacientes gastrectomizados con reconstrucción en Y de Roux una relación inversa entre las mayores concentraciones de hidrógeno espirado en la curva del test del aliento para SIBO y los niveles de hierro, albúmina y pérdida de peso6. Sin embargo, Paik et al.12 no encuentran relación entre la presencia de SIBO y menores niveles de calcio, albúmina, hierro y hemoglobina.
La malnutrición asociada a la presencia de SIBO tiene como condicionante fisiopatológico tanto la malabsorción como la maldigestión4. La malabsorción de hidratos de carbono se produce por una metabolización en la luz intestinal por parte de las bacterias metabolizadoras de fructosa, sorbitol y lactosa de estos disacáridos, de forma que hay una parte que no llega a absorberse9. A esto se añade la secreción de citocinas inflamatorias, que pueden llevar a un daño en el borde vellositario de los enterocitos con la consiguiente disminución de la actividad de las disacaridasas y una menor absorción de hidratos de carbono10–12. Debido a la desconjugación de los ácidos biliares por las bacterias, se produce una alteración en la formación de micelas con la consiguiente malabsorción de grasas con aparición de esteatorrea y déficit de vitaminas liposolubles13,14. Dentro de estas, el déficit de vitamina D es el que se da con más frecuencia y se suele presentar con el desarrollo de osteomalacia o incluso osteoporosis15. En cuanto a las proteínas, también se puede ver alterada su absorción, ya que las bacterias desdoblan el nitrógeno de la dieta que pasa a urea, sin que esta sea utilizable para el anabolismo proteico16. Nuestros resultados no alcanzan la significación estadística en probable relación con el tamaño de la muestra y el análisis en el corto plazo que se hace de esta condición, sin tal vez dejar que la presencia de SIBO ejerza su impacto deletéreo en el estado nutricional. Otra circunstancia que hay que valorar es que el estándar de cuidados de estos pacientes en nuestro ámbito hospitalario incluye una valoración nutricional completa con recomendaciones estandarizadas en relación con la dieta y soporte nutricional si es preciso, de forma previa a la cirugía para optimizar las condiciones antes de su realización, y también una valoración posterior de forma sistematizada. Paik et al.12 identifican que un apoyo importante por parte de enfermería, que no solo aportaba soporte sintomático a sus pacientes, sino también nutricional, explicaría el adecuado estado nutricional de los pacientes en su estudio.
Para mejorar el estado nutricional de los pacientes gastrectomizados con SIBO se ha propuesto realizar un tratamiento específico del mismo. El antibiótico más usado y estudiado en monoterapia para el tratamiento del SIBO en cualquier indicación es la rifaximina, que consigue una tasa de normalización del test del aliento del 21,7-70%20,21. Al ser un antibiótico con una baja absorción sistémica, su acción principalmente se va a dar en la luz intestinal y la tasa de efectos secundarios es muy baja, por ello es una buena opción como primera línea de tratamiento. El segundo antibiótico más usado es el metronidazol, con una tasa de normalización del test del aliento del 51,2%20. Otros antibióticos menos investigados, pero que también podrían tener utilidad, son el ciprofloxacino, la doxiciclina, el norfloxacino y la amoxicilina-clavulánico, pero hay muy pocos trabajos al respecto que evalúen su efectividad. En los últimos años también se ha propuesto el uso de probióticos, aunque la evidencia al respecto aún es escasa25,26. No hay consenso en la literatura sobre cuál es la mejor pauta de tratamiento del SIBO después de una gastrectomía, y con la referencia de la efectividad de rifaximina en otras condiciones se usó (en nuestra serie) como primera línea terapéutica, aunque con una tasa de eliminación del SIBO de solo el 5,4%. La segunda línea fue el metronidazol, que eliminó el SIBO en el 14,3% de los casos, y en la tercera línea la respuesta al ciprofloxacino fue del 16,7%. Con nuestros datos, se demuestra que el fracaso reiterado de los tratamientos antibióticos en estos pacientes es alto, presentándose en el 67,6%. Estas altas tasas de fracaso terapéutico evidencian que la rifaximina y el metronidazol, a pesar de ser los tratamientos de elección para el SIBO en general, no obtienen buenos resultados en los pacientes gastrectomizados, de lo que se deriva la necesidad de indicar la antibioterapia con cautela y de testar su efectividad con el TAHMG. Los resultados de la serie que se presentan se pueden explicar por diferentes motivos. La gastrectomía es una alteración estructural permanente que favorece el SIBO, de forma que al no actuar sobre la misma este se perpetúa, y probablemente tras varias líneas de tratamiento antibiótico sin éxito, parece razonable que se beneficien de un tratamiento antibiótico cíclico, siempre valorando su impacto y los teóricos beneficios a obtener. Por otro lado, para que un antibiótico no absorbible como la rifaximina sea efectivo, se deben cumplir 2 condiciones: alcanzar la localización donde se produce el SIBO y conseguir en esa ubicación una adecuada concentración. Por lo tanto, tras la gastrectomía Billroth tipo ii con reconstrucción en Y de Roux, con la creación de asas ciegas, estas 2 condiciones pueden ser no satisfechas por antibióticos no absorbibles, explicando así la baja eficacia terapéutica.
A pesar de que el SIBO se ha postulado como un factor de riesgo de malnutrición en los pacientes gastrectomizados, no es el único que podría influir en el estado nutricional de estos pacientes. Otros factores a tener en cuenta serían el tipo de gastrectomía y de reconstrucción, la edad y el posible desarrollo de una insuficiencia pancreática exocrina por inactivación de la lipasa, originando una maldigestión grasa, hipótesis en la que nuestro grupo se encuentra trabajando.
Como limitaciones de nuestro estudio debemos considerar el tamaño muestral, que aunque similar al de otros trabajos recogidos en la literatura, ha disminuido a lo largo del proceso de seguimiento. Este hecho se ha debido a diferentes factores, entre los que se encuentra la recidiva y/o la progresión tumoral, que ha condicionado pérdidas por exitus o por deterioro del estado general. También ha influido la presencia del fracaso antibiótico reiterado del SIBO en un porcentaje elevado de los pacientes. Otra limitación podría establecerse en relación con el corto seguimiento para la valoración de los parámetros nutricionales, puesto que estos podrían precisar un tiempo superior para que se modificaran. Debemos señalar que en el diseño del estudio no se consideró realizar analítica de seguimiento en los pacientes en los que fracasó el tratamiento antibiótico. Este diseño puede ser la explicación de un sesgo si solo se compara la situación basal con la obtenida tras el tratamiento exitoso del SIBO, varias semanas o meses después.
Dentro de las fortalezas del estudio debemos considerar que aborda un problema poco estudiado. Debemos destacar su diseño prospectivo, con la evaluación sistematizada mediante TAHMG con sobrecarga de glucosa de la presencia de SIBO, la correlación con datos nutricionales y la reevaluación de la curva a los 45min para minimizar el impacto del tránsito intestinal acelerado, evitando así la presencia de falsos positivos. Los datos descritos en la literatura sobre el tratamiento de SIBO en pacientes gastrectomizados son escasos y no recogen el factor evolutivo de esta condición y de su influencia sobre el estado nutricional.
En conclusión, a la vista de los resultados obtenidos en el presente estudio, el SIBO es frecuente en pacientes gastrectomizados, observándose en el 61,6% de estos sin poder correlacionarse, en nuestra serie, de forma estadísticamente significativa con ningún parámetro de malnutrición. La rifaximina y el metronidazol no obtienen buenos resultados en el control de esta condición. El fracaso antibiótico está presente en el 83% y se debe reevaluar la respuesta tras cada línea antibiótica. Cuando esta condición se negativiza su efecto en la malnutrición es escaso y podría correlacionarse con otros factores.
AutoríaM. C. García Gavilán: adquisición de datos; análisis e interpretación de los datos; redacción del manuscrito; revisión crítica del manuscrito aportando contenido intelectual relevante.
J. Alcaide García: concepto y diseño del estudio; adquisición de datos; análisis e interpretación de los datos.
J. M. Méndez Sánchez: adquisición de datos.
R. Rivera Irigoin: concepto y diseño del estudio; adquisición de datos; análisis e interpretación de los datos.
F. Fernández Cano: adquisición de datos; análisis e interpretación de los datos.
T. Pereda Salguero: adquisición de datos; análisis e interpretación de los datos.
F. Rivas Ruiz: análisis e interpretación de los datos; redacción del manuscrito; revisión crítica del manuscrito aportando contenido intelectual relevante.
A. Pérez Aisa: concepto y diseño del estudio; adquisición de datos; análisis e interpretación de los datos; redacción del manuscrito; revisión crítica del manuscrito aportando contenido intelectual relevante; análisis estadístico; obtención de fondos; apoyo administrativo, técnico o material; supervisión del estudio.
Todos los autores han aprobado la versión final del manuscrito.
Conflicto de interesesNinguno que declarar.